 Всем тем кто интересуется химией мы посвящаем нашу статью с ответами по учебнику за за деcятый класс, авторы которого Габриелян, Остроумов, Сладков 2019. По этому учебнику будем изучать органическую химию. Всем тем, чьи экзамены и выбор профессии будет связан с химией, мы настоятельно рекомендуем не упускать любой возможности совершенствоваться в предмете. Так в частности и домашнее задание и правильное его решение является одной из степеней вашего совершенствования и познания. Поэтому не забываем про наш сайт, про ГДЗ и сверяемся с тем, что у нас есть!
Всем тем кто интересуется химией мы посвящаем нашу статью с ответами по учебнику за за деcятый класс, авторы которого Габриелян, Остроумов, Сладков 2019. По этому учебнику будем изучать органическую химию. Всем тем, чьи экзамены и выбор профессии будет связан с химией, мы настоятельно рекомендуем не упускать любой возможности совершенствоваться в предмете. Так в частности и домашнее задание и правильное его решение является одной из степеней вашего совершенствования и познания. Поэтому не забываем про наш сайт, про ГДЗ и сверяемся с тем, что у нас есть!
ГДЗ разбиты на параграфы точно так же, как и учебник, так что найти ответы не составит труда. Выбираем актуальное для вас и смотрим! Главное - все правильно списать и желательно еще проанализировать и запомнить.
Ответы к учебнику химия 10 класс Габриелян, Остроумов:
Кликайте по вкладкам с параграфами, чтобы открыть нужную страницу с ответами.
§1
-
Глава I. Предмет органической химии. Теория строения органических соединений.
§1. Предмет органической химии.
1. Какие вещества называют органическими? Приведите примеры органических веществ, знакомых вам из курса химии 9 класса.
Ответ:
Органическими веществами называют соединения углерода, за исключением оксидов углерода, угольной кислоты и её солей, карбидов и некоторых других.
Примеры органических веществ: метан, этан, пропан, этилен, ацетилен, этиловый спирт, глицерин, уксусная кислота, аминоуксусная кислота.
2. Из приведённого списка выберите формулы органических веществ: NH4HCO3, C3H7OH, C6H6, CaCO3, HCOONa, CH3NH2, CO2, H2CO3, KNO3. Рассчитайте массовую долю углерода в этих веществах.
Ответ:
Формулы органических веществ: C3H7OH, C6H6, HCOONa, CH3NH2.
Дано:
`C_3H_7OH`
`C_6H_6`
`HCOONa`
`CH_3NH_2`
------------------
`ω_(C_3H_7OH)(C) = ?`
`ω_(C_6H_6)(C) = ?`
`ω_(HCOONa)(C) = ?`
`ω_(CH_3NH_2)(C) = ?`Решение
`C_3H_7OH`
`C_6H_6`
`HCOONa`
`CH_3NH_2`
`ω_(C_3H_7OH)(C) = (100*3*A_r(C))/(M_r(C_3H_7OH)) = (100*3*12)/60 = 60%`
`ω_(C_6H_6)(C) = (100*6*A_r(C))/(M_r(C_6H_6)) = (100*6*12)/78 = 92.3%`
`ω_(HCOONa)(C) = (100*A_r(C))/(M_r(HCOONa)) = (100*12)/68 = 17.7%`
`ω_(CH_3NH_2)(C) = (100*A_r(C))/(M_r(CH_3NH_2)) = (100*12)/31 = 38.7%`
Ответ: `ω_(C_3H_7OH)(C) = 60%`, `ω_(C_6H_6)(C) = 92.3%`, `ω_(HCOONa)(C) = 17.7%`, `ω_(CH_3NH_2)(C) = 38.7%`.
3. Что изучает органическая химия? Охарактеризуйте отличительные особенности органических веществ.
Ответ:
Органическая химия изучает структуру, получение, физические и химические свойства соединений углеводородов и их производных.
Отличительные особенности органических веществ.
Большое число органических веществ построено из атомов всего двух химических элементов – углерода и водорода.
Органические соединения большей частью построены с помощью ковалентных связей.
Большинство органических соединений имеют молекулярную кристаллическую решетку, поэтому они имеют низкие температуры плавления и кипения, при н. у. представляют собой газы, жидкости или легкоплавкие твёрдые вещества.4. Приведите примеры природных, искусственных и синтетических органических веществ.
Ответ:
Природные вещества: сахароза, этиловый спирт, метан, молочная кислота, лимонная кислота, аскорбиновая кислота.
Искусственные органические вещества: ацетатное и вискозные волокна, целлулоид, целлофан.
Синтетические органические вещества: полиэтилен, полипропилен, поливинилхлорид, полистирол, полиуретан, лавсан, капрон, нейлон.
5. Массовая доля углерода в углеводороде составляет 90,0%. Относительная плотность этого газа по водороду равна 20. Найдите формулу углеводорода.
Ответ:
Дано:
`ω(C) = 90%`
`D_(H_2)(C_xH_y) = 20`
-------------------
`C_xH_y - ?`
Решение
`D_(H_2)(C_xH_y) = (M(C_xH_y))/(M(H_2))`
`M(C_xH_y) = D_(H_2)(C_xH_y)*M(H_2) = 20*2 = 40" г/моль"`
`ω(C) = (100*x*M(C))/(M(C_xH_y))`
`90 = (100*12*x)/40`
`90 = 30*x`
`x = 3`
`M(C_xH_y) = x*M(C) + y*M(H)`
`40 = 12*3 + y`
`y = 4`
Ответ: формула соединения `C_3H_4`.
7. В чём сущность витализма? Являлось ли это учение строго научным? Каким образом удалось доказать несостоятельность витализма? Согласны ли вы с аргументами противников витализма?
Ответ:
Сущность витализма была в том, что органические вещества могут образовываться только в живых организмах под действием некой "жизненной силы" и, следовательно, получить органические вещества вне организма, в пробирке или реакторе, невозможно. На ранних этапах развития химии это учение являлось строго научным.
Однако ряд открытий, сделанных в середине XIX в, показал, что сторонники витализма глубоко заблуждались. В 1828 г немецкий химик Фридрих Вёлер впервые получил органическое вещество – мочевину из неорганической соли (цианата аммония). В 1854 г. французский учёный Марселей Бертло синтезировал аналоги природных жиров, затем в 1861 г русский химик Александр Михайлович Бутлеров – аналог природного сахара. В конечном счёте под давлением экспериментальных фактов витализм потерпел крах.
Я согласен с аргументами противников витализма т. к. они подкреплены практическими экспериментами, а у сторонников витализма не имеется доказательств существования "жизненной силы".
§2
-
§2. Основные положения теории химического строения.
1. Сформулируйте первое положение теории химического строения. По молекулярным формулам метилового спирта CH3OH, этана C2H6 и метиламина CH3NH2 определите валентность каждого химического элемента и напишите полные структурные формулы этих веществ.
Ответ:
Первое положение теории химического строения. Атомы в молекулах соединены друг с другом согласно их валентности, причём углерод в органических веществах всегда четырёхвалентен, а его атомы способны соединяться в цепи линейного, разветвлённого и замкнутого строения.
Полная структурная формула метилового спирта CH3OH:
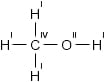
Метиловый спирт
Полная структурная формула этана C2H6: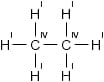
Этан
Полная структурная формула метиламина CH3NH2: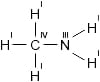
Метиламин
Валентности указаны над химическими элементами.2. Сформулируйте второе положение теории химического строения. Какие вещества называют изомерами? Напишите полные структурные формулы этиламина CH3–CH2–NH2 и диметиламина CH3–NH–CH3. Являются ли данные вещества изомерами? На примере этих веществ поясните сущность второго положения теории химического строения.
Ответ:
Второе положение теории химического строения. Свойства органических веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением.
Изомерами называют вещества, имеющие одинаковый качественный и количественный элементный состав, но различное химическое строение, а следовательно, и различные свойства.
Полная структурная формула этиламина CH3-CH2-NH2
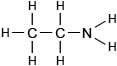
Этиламин
Полная структурная формула диметиламина CH3-NH-CH3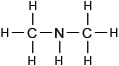
Диметиламин
Этиламин и диметиламин имеют одинаковый качественный и количественный состав (C2H7N), но имеют различное химическое строение, соответственно эти вещества являются изомерами.Этиламин имеет аммиачный запах, а диметиламин рыбный запах, это связано с тем, что данные вещества имеют различный порядок соединения атомов в молекуле, следовательно, имеют различные свойства.
3. Среди веществ, формулы которых приведены ниже, найдите пары изомеров:
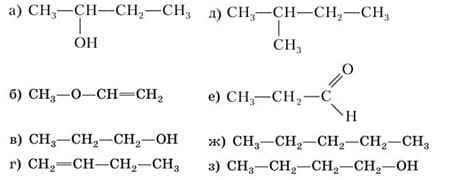
Ответ:
Ответ: а - з; б - е; д - ж.
В соответствии с ответом перепишите структурные формулы.
4. Сформулируйте третье положение теории химического строения. Среди веществ, формулы которых приведены ниже, выберите пару соединений, которые, по вашему мнению, проявляют наиболее сходные химические свойства. Объясните свой выбор.
а) CH3–CH=CH2
б) CH3–CH2–OH
в) CH3–CH2–CH2–OH
г) CH3–O–CH2–CH3Ответ:
Третье положение теории химического строения.
Атомы в молекулах органических веществ оказывают влияние друг на друга.Наиболее сходные химические свойства проявляют этиловый спирт (CH3–CH2–OH) и пропиловый спирт (CH3–CH2–CH2–OH), т. к. группа –OH соединена с одним атомом углерода, следовательно, атом кислорода влияет на соседний с ним атом водорода, облегчая его замещение атомом натрия.
В молекуле CH3–O–CH2–CH3 все атомы водорода связаны только с атомами углерода, поэтому, в отличие от этилового и пропилового спирта, данный эфир не способен реагировать с металлическим натрием.
Пропилен (CH3–CH=CH2) имеет двойную связь, а этиловый и пропиловый спирт не имеют, поэтому их химические свойства будут отличаться.
5. Найдите в Интернете и установите на свой компьютер программу построения 3D-моделей молекул органических веществ. Постройте модели молекул метана, этана, этилового спирта. Какие возможности предоставляет виртуальное моделирование для изучения химического строения веществ?
Ответ:
Соответствующие 3D-модели молекул в онлайн конструкторе: метана, этана, этилового спирта.
Виртуальное моделирование химических веществ предоставляют следующие возможности:
- визуализация пространственного строения молекул;
- построение динамических моделей с учётом электроотрицательности элементов;
- редактирование молекул;
- измерение валентных углов и длин связей;
- и т. д.
§3
-
Глава II. Углеводороды и их природные источники.
§3. Предельные углеводороды. Алканы.
1. Какие из перечисленных формул принадлежат предельным углеводородам: C4H10, C2H2, C5H12, C6H6, C4H6, C3H8.
Ответ:
Общая формула предельных углеводородов CnH2n+2, соответственно к ним относятся: C4H10, C5H12, C3H8.
2. Назовите по международной номенклатуре следующие алканы:
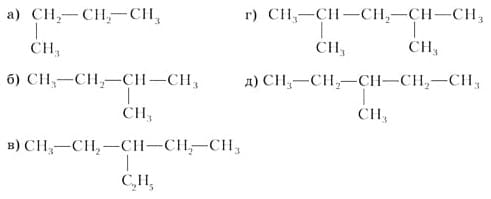
Ответ:
а) н-бутан
б) 2-метилбутан
в) 3-этилпентан
г) 2,4-диметилпентан
д) 3-метилпентан3. Напишите структурные формулы следующих углеводородов: а) 2-метилпентан; б) 2,2-диметилбутан; в) н-гексан; г) 2,3-диметилпентан; д) 3-этилгексан.
Ответ:
а)
2-метилпентанб)
2,2-диметилбутанв)
н-гексанг)
2,3-диметилпентанд)
3-этилгексан4. Напишите структурные формулы двух гомологов и двух изомеров н-гексана. Назовите эти углеводороды.
Ответ:
Структурные формулы гомологов н-гексана:
н-бутан
н-пентанСтруктурные формулы изомеров н-гексана:
2,2-диметилбутан
2-метилпентан5. Напишите уравнения реакций: а) 1 моль этана с 1 моль хлора; б) горения этана; в) дегидрирования пропана; г) 1 моль метана с 2 моль брома. Назовите образующиеся продукты.
Ответ:
а) `CH_3-CH_3 + Cl_2 overset("свет")(⟶) underset("хлорэтан")(CH_3-CH_2Cl) + underset("хлороводород")(HCl)`
б) `2C_2H_6 + 7O_2 ⟶ underset("оксид углерода (IV)")(4CO_2) + underset("вода")(6H_2O)`
в) `CH_3-CH_2-CH_3 overset(t," кат.")(⟶) underset("пропилен")(CH_3-CH=CH_2) + underset("водород")(H_2)`
г) `CH_4 + 2Br_2 overset("свет")(⟶) underset("дибромметан")(CH_2Br_2) + underset("бромоводород")(2HBr)`
6. Спичечная палочка пропитана парафином. Если внимательно понаблюдать за горящей спичкой, можно заметить, как за 1-2 мм до пламени оплавляется парафин. Какую роль выполняет это вещество? Составьте уравнение реакции горения парафина, условно считая, что его формула C36H74.
Ответ:
Парафин, находящийся под головкой, при её горении закипает, его пары воспламеняются, и этот огонь переносится на деревянную спичечную соломку.
Уравнение реакции горения парафина:
2C36H74 + 109O2 ⟶ 72CO2 + 74H2O7. Вычислите, какое количество теплоты выделится при сгорании 6.72 л метана (н. у.) в соответствии с термохимическим уравнением
CH4 + 2O2 ⟶ CO2 + 2H2O + 880 кДжОтвет:
Дано:
`V(CH_4) = 6.72 л`
-----------
`Q = ?`
Решение
`CH_4 + 2O_2 ⟶ CO_2 + 2H_2O + 880" кДж"`
`n(CH_4) = (V(CH_4))/V_m = 6.72/22.4 = 0.3" моль"`
`Q = n(CH_4)*Q_("х.р.") = 0.3*880 = 264" кДж"`
Ответ: `Q = 264" кДж"`.
8. Выскажите своё мнение о формировании бюджета Российской Федерации на основе углеводородного сырья. Какую долю бюджета в текущем году составляет экспорт природного газа?
Ответ:
За последние годы доля нефтегазовых доходов в общих доходах в среднем составляет 45%, что является очень весомым процентом из всех доходов государства.
Лабораторный эксперимент
В химический стакан объёмом 200 мл поместите плоскую свечу и зажгите её. Накройте стакан стеклом. Что происходит с внутренними стенками стакана? О чём это говорит? Почему вскоре свеча гаснет? Осторожно выньте свечу, налейте в стакан 10-15 мл свежеприготовленной известковой воды и вновь накройте стеклом. Придерживая стекло, осторожно перемешайте содержимое стакана. Что произошло с известковой водой? О чём это говорит?
Ответ:
После накрывания горящей свечи стаканом, его внутренние стенки запотевают, это говорит о том, что в процессе горения парафина образуется вода. При горении расходуется кислород воздуха, когда кислорода в стакане не остается – свеча гаснет.
Известковая вода помутнела, значит в стакане присутствует углекислый газ, который образовался в результате горения свечи.
§4
-
§4. Непредельные углеводороды. Алкены.
1. Какие углеводороды называют алкенами? Приведите молекулярные и структурные формулы, а также названия алкенов, содержащих от двух до четырёх атомов углерода в молекуле.
Ответ:
Алкенами называют углеводороды, содержащие в молекулах одну двойную связь и имеющие общую формулу CnH2n.
Молекулярная формула Название Структурная формула C2H4 Этен C3H6 Пропен C4H8 Бутен-1 Бутен-2 2. Какие виды изомерии характерны для этиленовых углеводородов? Ответ проиллюстрируйте примерами изомеров бутена.
Ответ:
Для этиленовых углеводородов характерны следующие виды изомерии:
Изомерия углеродного скелета. Примеры:
бутен-1
2-метилпропенИзомерия положения двойной связи. Примеры:
бутен-1
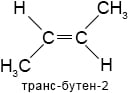
бутен-2Пространственная изомерия. Примеры:
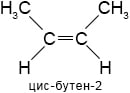
3. Охарактеризуйте промышленные и лабораторные способы получения алкенов. Напишите уравнение реакции дегидрирования алканов с использованием общих формул.
Ответ:
Главным промышленным способом получения алкенов является крекинг предельных углеводородов нефти и попутного нефтяного газа. Сущность процесса заключается в нагревании алканов без доступа воздуха в присутствии катализатора (каталитический крекинг) или при высокой температуре (термический крекинг). Цепь углеродных атомов разрывается примерно пополам, при этом образуются молекулы предельного и непредельного углеводородов:
`underset("октан")(C_8H_18) overset(t)(⟶) underset("бутен")(C_4H_8) + underset("бутан")(C_4H_10)`К лабораторным способам получения алкенов относят реакции отщепления. Для образования в молекуле двойной связи от соседних атомов углерода нужно отнять по одному связанному с ними атому или группе. Тогда освободившиеся валентности превращаются во вторую углерод-углеродную связь. В лаборатории этилен получают из этилового спирта с помощью концентрированной серной кислоты (водоотнимающего средства) при нагревании:
`C_2H_5OH overset(t," "H_2SO_(4"(конц.)"))(⟶) C_2H_4 + H_2O`
Реакции отщепления воды от молекул органических веществ называют реакциями дегидратации.Уравнение реакции дегидрирования алканов с использованием общих формул:
`C_nH_(2n+2) overset(t," кат.")(⟶) C_nH_(2n) + H_2`4. Для пропилена напишите уравнения реакций: а) горения; б) гидратации; в) присоединения бромоводорода; г) гидрирования; д) бромирования.
Ответ:
а)
2CH3–CH=CH2 + 9O2 ⟶ 6CO2 + 6H2Oб)
в)
CH3–CH=CH2 + HBr ⟶ CH3–CHBr–CH3г)
CH3–CH=CH2 + H2 t, p, кат. ⟶ CH3–CH2–CH3д)
CH3–CH=CH2 + Br2 ⟶ CH3–CHBr–CH2Br5. Сравните этан и этилен по следующим признакам: а) качественный и количественный состав; б) строение молекул; в) химические свойства.
Ответ:
Этан Этилен а) качественный и количественный состав Молекула этана состоит из 2 атомов углерода и 6 атомов водорода: C2H6. Молекула этана состоит из 2 атомов углерода и 4 атомов водорода: C2H4. б) строение молекул 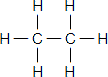
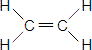
в) химические свойства Реакция горения:
2CH3–CH3 + 7O2 ⟶ 4CO2 + 6H2O
Реакция галогенирования:
CH3–CH3 + Br2 ⟶ CH3–CH2Br + HBr
Реакция дегидрирования:
CH3–CH3 t, кат. ⟶ CH2=CH2 + H2Реакция горения:
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
Реакция гидратации:
CH2=CH2 + H2O кат. ⟶ CH3–CH2–OH
Реакция гидрогалогенирования:
CH2=CH2 + HBr ⟶ CH3–CH2Br
Реакция галогенирования:
CH2=CH2 + Br2 ⟶ CH2Br–CH2Br
При пропускании этилена через водный раствор перманганата калия происходит обесцвечивание этого раствора:
CH2=CH2 + [O] + H2O ⟶ HO–CH2–CH2–OH
Реакция полимеризации:
nCH2=CH2 ⟶ (–CH2–CH2–)n6. Рассчитайте массовые доли элементов в этене и бутене. Не производя расчётов, укажите, чему равны массовые доли элементов в гексене C6H12. Поясните своё решение.
Ответ:
Дано:
`C_2H_4`
`C_4H_8`
---------------
`ω_(C_2H_4)(C) = ?`
`ω_(C_2H_4)(H) = ?`
`ω_(C_4H_8)(C) = ?`
`ω_(C_4H_8)(H) = ?`
Решение
`ω_(C_2H_4)(C) = (100*2*A_r(C))/(M_r(C_2H_4)) = (100*2*12)/28 = 85.7%`
`ω_(C_2H_4)(H) = (100*4*A_r(H))/(M_r(C_2H_4)) = (100*4*1)/28 = 14.3%`
`ω_(C_4H_8)(C) = (100*4*A_r(C))/(M_r(C_4H_8)) = (100*4*12)/56 = 85.7%`
`ω_(C_4H_8)(H) = (100*8*A_r(H))/(M_r(C_4H_8)) = (100*8*1)/56 = 14.7%`
Ответ: `ω_(C_2H_4)(C) = 85.7%`, `ω_(C_2H_4)(H) = 14.3%`, `ω_(C_4H_8)(C) = 85.7%`, `ω_(C_4H_8)(H) = 14.7%`.
Массовые доли элементов в гексене C6H12 равны массовым долям элементов в этене и бутене, и составляют `ω(C) = 85.7%`, `ω(H) = 14.7%`. Это связано с тем, что количество атомов водорода в алкенах прямо-пропорционально зависит от количества атомов углерода.
`ω_(C_nH_(2n))(C) = (n*A_r(C))/(A_r(C_nH_(2n))) = (n*A_r(C))/(n*A_r(C) + 2n*A_r(H)) = (A_r(C))/(A_r(C) + A_r(H))`
Из последнего соотношения видно, что массовая доля углерода не зависит от количества его атомов.7. Помимо полиэтилена, в качестве полимерного материала широко используют полипропилен. Из него изготавливают ковры, игрушки, химическую и бытовую посуду, канаты, изоляцию проводов, корпуса приборов. Напишите уравнение реакции получения полипропилена, укажите мономер, полимер и его элементарное звено.
Ответ:
Реакция получения полипропилена:
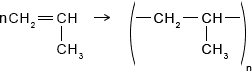
Мономер:
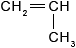
Формула полимера:
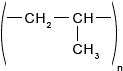
Элементарное звено:
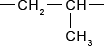
8. Рассчитайте объём этилена (н. у.), который потребуется для получения 115 л этилового спирта плотностью 0,8 г/мл.
Ответ:
Дано:
`V(C_2H_5OH) = 115 л`
`ρ(C_2H_5OH) = 0.8" г/мл" = 0.8" кг/л"`
-----------------
`V(C_2H_4) = ?`
Решение
`C_2H_4 + H_2O = C_2H_5OH`
`m(C_2H_5OH) = ρ(C_2H_5OH)*V(C_2H_5OH) = 0.8*115 = 92" кг"`
`n(C_2H_5OH) = (m(C_2H_5OH))/(M(C_2H_5OH)) = 92/45 = 2.04" кмоль"`
`n(C_2H_4) = n(C_2H_5OH) = 2.04" кмоль"`
`V(C_2H_4) = n(C_2H_4)*V_m = 2.04*22.4 = 45.7 м^3`
Ответ: `V(C_2H_4) = 45.7 м^3`.
§5
-
§5. Алкадиены. Каучуки.
1. Какие углеводороды называют алкадиенами? Напишите формулы одного гомолога и одного изомера пентадиена-1,3 с сопряжёнными двойными связями.
Ответ:
Алкадиенами называют углеводороды в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых CnH2n-2.
Гомолог пентадиена-1,3:
`underset("гексадиен-1,3")(CH_2=CH_2-CH=CH-CH_2-CH_3)`.Изомер пентадиена-1,3:
`underset("пентадиен-2,3")(CH_3-CH=C=CH-CH_3)`.2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
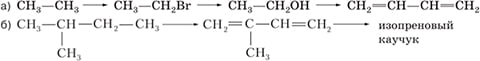
Ответ:
а)
CH3–CH3 + Br2 ⟶ CH3–CH2Br + HBr
CH3–CH2Br + NaOH ⟶ CH3–CH2–OH + NaBr
2CH3–CH2–OH t, Al₂O₃, ZnO ⟶ H2C=CH-CH=CH2 + 2H2O + H2
б)
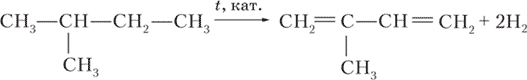
3. Сравните реакции присоединения алкенов и диеновых углеводородов. Ответ подтвердите уравнениями химических реакций.
Ответ:
Реакции галогенирования
В результате реакций галогенирования алкенов и диеновых углеводородов образуются соответствующие галогеналканы, отличие состоит в том, что алкадиены реагируют с галогенами ступенчато, с промежуточным образованием галогеналкенов.
Галогенирование бутена-1:
CH2=CH–CH2–CH3 + Br2 ⟶ CH2Br–CHBr–CH2–CH3Галогенирование бутадиена-1,3 протекает ступенчато:
CH2=CH–CH=CH2 + Br2 ⟶ CH2Br–CH=CH–CH2Br
CH2Br–CH=CH–CH2Br + Br2 ⟶ CH2Br–CHBr–CHBr–CH2BrРеакции гидрирования
Протекают аналогично реакциям галогенирования, с образованием соответствующих алканов, отличие состоит в том, что в результате гидрирования алкадиенов сначала образуют алкен, который также способен присоединять водород.
Гидрирование бутена-1:
CH2=CH–CH2–CH3 + H2 t, кат. ⟶ CH3–CH2–CH2–CH3Гидрирование бутадиена-1,3 протекает ступенчато:
CH2=CH–CH=CH2 + H2 t, кат. ⟶ CH3–CH=CH–CH3
CH3–CH=CH–CH3 + H2 t, кат. ⟶ CH3–CH2–CH2–CH3Реакции гидрогалогенирования
Реакции гидрогалогенирования алкенов и алкадиенов протекают согласно правилу Марковникова.
Гидрогалогенирование бутена-1:
CH2=CH–CH2–CH3 + HBr ⟶ CH3–CHBr–CH2–CH3Гидрогалогенирование бутадиена-1,3:
CH2=CH–CH=CH2 + 2HBr ⟶ CH3–CHBr–CHBr–CH34. Как можно доказать непредельный характер 2-метилбутадиена-1,З? Напишите уравнения реакций, подтверждающих ступенчатое протекание реакции.
Ответ:
Непредельный характер 2-метилбутадиена-1,З можно доказать с помощью бромной воды. В результате реакции произойдет обесцвечивание бромной воды:
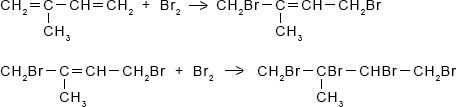
5. Найдите массу 2-метилбутадиена-1,З, который можно получить дегидрированием 72 кг 2-метилбутана, если выход продукта реакции составляет 80%.
Ответ:
Дано:
`m(C_5H_12) = 72" кг"`
`η(C_5H_8) = 80%`
--------------------
`m_("практ.")(C_5H_8) = ?
Решение
`C_5H_12 = C_5H_8 + 2H_2`
`n(C_5H_12) = (m(C_5H_12))/(M(C_5H_12)) = 72/72 = 1" кмоль"`
`n(C_5H_8) = n(C_5H_12) = 1" кмоль"`
`m_("теор.")(C_5H_8) = n(C_5H_8)*M(C_5H_8) = 1*68 = 68" кг"`
`m_("практ.")(C_5H_8) = (η(C_5H_8)*m_("теор.")(C_5H_8))/100 = (80*68)/100 = 54.4" кг"`
Ответ: `m_("практ.")(C_5H_8) = 54.4" кг"`.
6. Англичанин Чарлз Макинтош предложил пропитывать плащевую ткань раствором натурального каучука, поэтому плащи, сшитые из такого материала, не промокали под сильным дождём; их назвали макинтошами. Однако они не были лишены недостатков, присущих натуральному каучуку: размягчались на солнце и становились хрупкими в мороз. В чём заключалось открытие американца Чарлза Гудьира, позволившее устранить эти недостатки плащевого материала?
Ответ:
Чарлз Гудьир открыл процесс вулканизации, который заключался в сшивании молекул натурального каучука с помощью серы. Продуктом вулканизации является резина, она лишена недостатков, присущих натуральному каучуку.
§6
-
§6. Алкины.
1. Какие углеводороды называют алкинами? Приведите названия, молекулярные и структурные формулы первых четырёх представителей гомологического ряда алкинов.
Ответ:
Алкинами называют углеводороды с общей формулой CnH2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С.
Молекулярная формула Структурная формула Название C2H2 HC≡CH Этин C3H4 HC≡C–CH3 Пропин C4H6 HC≡C–CH2–CH3 Бутин-1 HC≡C–CH2–CH3 Бутин-2 C5H8 HC≡C–CH2–CH2–CH3 Пентин-1 3-метилбутин-1 H3C–C≡C–CH2–CH3 Пентин-2 2. Сравните общие формулы диеновых и ацетиленовых углеводородов. Можно ли однозначно сказать, к какому классу углеводородов принадлежит вещество с формулой C4H6? Напишите структурные формулы одного алкадиена и одного алкина, имеющих такой состав, и назовите их. Какой вид изомерии характерен для этих соединений?
Ответ:
Общие формулы у диеновых и ацетиленовых углеводородов одинаковые (CnH2n-2).
Нельзя однозначно сказать, к какому классу углеводородов принадлежит вещество с формулой C4H6, т. к. ей может соответствовать алкин или алкадиен.
Структурная формула алкадиена C4H6:
бутадиен-1,3
Структурная формула алкина C4H6:
бутин-2
Для алкадиенов и алкинов характерны следующие виды изомерии:
- углеродного скелета;
- положение связи (двойной или тройной);
- межклассовая изомерия;
- цис-транс-изомерия.
3. Назовите по международной номенклатуре следующие углеводороды:
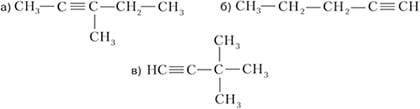
Ответ:
а) Ошибка в задании, вероятно, формула должна быть такой:
4-метилпентин-2
б)
пентин-1
в)
3,3-диметилбутин-1
4. Напишите структурные формулы следующих алкинов: а) бутин-1; б) пентин-2; в) 4,4-диметилпентин-2; г) 2,2,5-триметилгексин-3.
Ответ:
а)
HC≡C–CH2–CH3
бутин-1б)
CH3–C≡C–CH2–CH3
пентин-2в)
4,4-диметилпентин-2
г)
2,2,5-триметилгексин-3
5. Сравните химические свойства этилена и ацетилена. Какие общие черты и различия вы можете отметить? Ответ проиллюстрируйте уравнениями химических реакций.
Ответ:
Этилен и ацетилен сгорают в кислороде:
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
2HC≡CH + 5O2 ⟶ 4CO2 + 2H2OЭтилен и ацетилен вступают в реакцию гидратации, при этом в результате реакции с этиленом образуется спирт, а с ацетиленом – альдегид:
CH2=CH2 + H2O кат. ⟶ CH3–CH2–OH
HC≡CH + H2O кат. ⟶ CH3–CHOЭтилен и ацетилен вступают в реакцию гидрогалогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + HBr ⟶ CH3–CH2Br
HC≡CH + HBr ⟶ CH2=CHBr
CH2=CHBr + HBr ⟶ CH3–CHBr2Этилен и ацетилен вступают в реакцию галогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + Br2 ⟶ CH2Br–CH2Br
HC≡CH + Br2 ⟶ CHBr=CHBr
CHBr=CHBr + Br2 ⟶ CHBr2–CHBr2Этилен может вступать в реакцию полимеризации:
nCH2=CH2 ⟶ (–CH2–CH2–)n
Ацетилен не образует полимера.6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH4 ⟶ HC≡CH ⟶ CH3‒CHO
б) CaC2 ⟶ HC≡CH ⟶ CHCl=CHCl ⟶ CHCl2‒CHCl2
в) этан ⟶ этен ⟶ этинОтвет:
а)
2CH4 t ⟶ HC≡CH + 3H2
HC≡CH + H2O кат. ⟶ CH3‒CHO
б)
CaC2 + 2H2O ⟶ HC≡CH↑ + Ca(OH)2
HC≡CH + Cl2 ⟶ CHCl=CHCl
CHCl=CHCl + Cl2 ⟶ CHCl2‒CHCl2
в)
CH3‒CH3 t, кат. ⟶ CH2=CH2 + H2
CH2=CH2 t, кат. ⟶ HC≡CH + H2
7. На технический карбид кальция массой 40 г подействовали избытком воды. При этом образовалось 11,2 л газа (н. у.). Определите массовую долю примесей в карбиде кальция.
Ответ:
Дано:
`m_("тех.")(CaC_2) = 40 г`
`V(C_2H_2) = 11.2 л`
-------------------
`ω("примеси") = ?`
Решение
`CaC_2 + 2H_2O = C_2H_2"↑" + Ca(OH)_2`
`n(C_2H_2) = (V(C_2H_2))/V_m = 11.2/22.4 = 0.5" моль"`
`n(CaC_2) = n(C_2H_2) = 0.5" моль"`
`m(CaC_2) = n(CaC_2)*M(CaC_2) = 0.5*64 = 32 г`
`m("примеси") = m_("тех.")(CaC_2) - m(CaC_2) = 40 - 32 = 8 г`
`ω("примеси") = (100*m("примеси"))/(m_("тех.")(CaC_2)) = (100*8)/40 = 20%`
Ответ: `ω("примеси") = 20%`.
8.
Термохимическое уравнение реакции горения ацетилена имеет вид
2C2H2 + 5O2 ⟶ 4CO2 + 2H2O + 2600 кДжРассчитайте количество теплоты, которое выделится при сгорании 44,8 л ацетилена (н. у.).
Ответ:
Дано:
`V(C_2H_2) = 44.8 л`
---------------
`Q = ?`
Решение
`2C_2H_2 + 5O_2 ⟶ 4CO_2 + 2H_2O + 2600" кДж"`
`n(C_2H_2) = (V(C_2H_2))/V_m = 44.8/22.4 = 2" моль"`
`Q = (Q_("х.р.")*n(C_2H_2))/(n_("х.р.")(C_2H_2)) = (2600*2)/2 = 2600" кДж"`
Ответ: `Q = 2600" кДж"`.
§7
-
§7. Ароматические углеводороды, или арены.
1. Какие углеводороды называют ароматическими? Приведите формулы трёх первых представителей гомологического ряда аренов. Что общего в их строении? Чем они различаются?
Ответ:
Ароматическими называют углеводороды, в молекулах которых содержится бензольное кольцо и которые имеют общую формулу CnH2n-6.
Формулы трёх первых представителей гомологического ряда аренов:
бензол
метилбензол
этилбензол
Все они содержат в своей структуре бензольное кольцо, а различие состоит в присоединенных радикалах или их отсутствие.
2. Какие из перечисленных свойств соответствуют бензолу: а) бесцветная жидкость; б) бесцветный газ; в) кристаллическое вещество; г) без запаха; д) с характерным запахом; е) нерастворим в воде; ж) легче воды; з) тяжелее воды; и) является хорошим растворителем; к) очень ядовит?
Ответ:
Бензолу соответствуют свойства: а) бесцветная жидкость; д) с характерным запахом; е) нерастворим в воде; ж) легче воды; и) является хорошим растворителем; к) очень ядовит.
3. Выведите молекулярную формулу углеводорода, молекулы которого содержат 92,31% углерода, а плотность его паров по водороду равна 39.
Ответ:
Дано:
`ω(C) = 92.31%`
`D_(H_2)(C_xH_y) = 39`
----------------
`C_xH_y - ?`
Решение
`D_(H_2)(C_xH_y) = (M(C_xH_y))/(M(H_2))`
`M(C_xH_y) = D_(H_2)(C_xH_y)*M(H_2) = 39*2 = 78" г/моль"`
`ω(C) = (100*x*M(C))/(M(C_xH_y))`
`92.31 = (100*12*x)/78`
`x = 6`
`M(C_xH_y) = x*M(C) + y*M(H)`
`78 = 12*6 + y`
`y = 6`
Ответ: формула соединения `C_6H_6`.
4. Какие два вещества вступили в реакцию, если в результате образовались следующие продукты:
а) C6H5Cl и HCl; б) C6H5NO2 и H2O?Ответ:
а) C6H6 + Cl2 кат. ⟶ C6H5Cl + HCl
б) C6H6 + HNO3 кат. ⟶ C6H5–NO2 + H2O
5. Какой объём бензола (плотностью 0,9 г/мл) потребуется для получения 61 г нитробензола, если выход продукта реакции составляет 90%?
Ответ:
Дано:
`ρ(C_6H_6) = 0.9" г/мл"`
`m_("практ.")(C_6H_5NO_2) = 61 г`
`η(C_6H_5NO_2) = 90%`
-------------------
`V(C_6H_6) = ?`
Решение
`C_6H_6 + HNO_3 = C_6H_5NO_2 + H_2O`
`m_("теор.")(C_6H_5NO_2) = (100*m_("практ.")(C_6H_5NO_2))/(η(C_6H_5NO_2)) = (100*61)/90 = 67.8 г`
`n(C_6H_5NO_2) = (m_("теор.")(C_6H_5NO_2))/(M(C_6H_5NO_2)) = 67.8/123 = 0.551" моль"`
`n(C_6H_6) = n(C_6H_5NO_2) = 0.551" моль"`
`m(C_6H_6) = n(C_6H_6)*M(C_6H_6) = 0.551*78 = 43 г`
`V(C_6H_6) = (m(C_6H_6))/(ρ(C_6H_6)) = 43/0.9 = 47.8" мл"`
Ответ: `V(C_6H_6) = 47.8" мл"`.
6. Какую массу бромбензола можно получить при бромировании 117 г бензола бромом массой 316 г? Какое из исходных веществ прореагирует не полностью и какова масса избытка этого вещества?
Ответ:
Дано:
`m(C_6H_6) = 117 г`
`m(Br_2) = 316 г`
-------------
`m(C_6H_5Br) = ?`
`m_("изб.")("в-ва") = ?`
Решение
`C_6H_6 + Br_2 = C_6H_5Br + HBr`
`n(C_6H_6) = (m(C_6H_6))/(M(C_6H_6)) = 117/78 = 1.5" моль"`
`n(Br_2) = (m(Br_2))/(M(Br_2)) = 316/160 = 1.975" моль"`
Бром прореагирует не полностью.
`m(C_6H_5Br) = n(C_6H_6)*M(C_6H_6) = 1.5*157 = 235.5 г`
`n_("прореаг.")(Br_2) = n(C_6H_6) = 1.5" моль"`
`n_("изб.")(Br_2) = n(Br_2) - n_("прореаг.")(Br_2) = 1.975-1.5 = 0.475" моль"`
`m_("изб.")(Br_2) = n_("изб.")(Br_2)*M(Br_2) = 0.475*160 = 76 г`
Ответ: `m_("изб.")(Br_2) = 76 г`, `m(C_6H_5Br) = 235.5 г`.
7. Составьте и заполните обобщающую таблицу по теме "Углеводороды", в которой отразите следующие особенности классов этих органических соединений: состав, строение, способы получения, химические свойства, области применения.
Ответ:
Углеводороды Алканы Алкены Алкадиены Алкины Арены Состав CnH2n+2 CnH2n CnH2n-2 CnH2n-2 CnH2n-6 Строение Не содержат кратных связей Содержат одну двойную связь Содержат две двойные связи Содержат одну тройную связь Содержат хотя бы одно бензольное кольцо Способы получения написаны в соответствующих параграфах. Химические свойства Реакция горения + + + + + Реакция гидратации + Реакция гидрирования + + + Реакция дегидрирования + Реакция галогенирования + + + + + Реакция гидрогало-генирования + + + Реакция полимеризации + + Реакция изомеризации + Крекинг + Реакция нитрования + Области применения Являются сырьём для газо- и нефтехимических производств. Самым важным представителем алкенов является этилен, он используется как сырьё для производства полиэтилена, галогенпроизводных, этилового спирта, этиленгликоля и других продуктов химической промышленности. Являются сырьём для производства синтетических каучуков. Наибольшую ценность среди алкинов имеет ацетилен, он является одним из исходных веществ в производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают органические растворители. Ацетилен используют для газовой сварки и резки металлов. Бензол используется в качестве сырья для получения других органических соединений, это синтетические красители, ядохимикаты, синтетические моющие средства, лекарственные препараты, пищевые добавки, пластмассы, взрывчатые вещества и многое другое. Указаны реакции только те, о которых говорится в учебнике, в реальности их больше (например, алканы вступают в реакцию нитрования).
Лабораторный эксперимент
В пробирку налейте 2 мл воды и добавьте 5-6 капель йодной настойки. Обратите внимание на цвет раствора. Прилейте в пробирку 2 мл растворителя "Сольвент", содержащего вещества – аналоги бензола (строго соблюдайте инструкцию по применению). Встряхните пробирку. Что наблюдаете? Как изменился цвет водного и органического слоёв?
Ответ:
Водный слой заметно посветлел, а органический слой приобрёл красно-фиолетовый цвет.
Вывод: бензол является хорошим экстрактором йода из его водного раствора.
§8
-
§8. Природный газ.
1. Назовите основные продукты химической переработки природного газа и укажите процессы, с помощью которых их получают. Запишите уравнения соответствующих реакций.
Ответ:
Основные продукты химической переработки природного газа
Синтез газ. Получают его с помощью процесса конверсии:
CH4 + H2O t ⟶ CO + 3H2
Из синтез газа получают синтетический бензин и метиловый спирт:
nCO + (2n + 1)H2 кат. ⟶ CnH2n+2 + nH2O
CO + 2H2 кат. ⟶ CH3OHУглерод (сажу), водород и ацетилен. Получают их с помощью пиролиза:
CH4 t ⟶ C + 2H2
2CH4 t ⟶ C2H2 + 3H2Галогенпроизводные. Получают их с помощью галогенирования:
CH4 + Cl2 свет ⟶ CH3Cl + HCl
CH3Cl + Cl2 свет ⟶ CH2Cl2 + HCl
CH2Cl2 + Cl2 свет ⟶ CHCl3 + HCl
CHCl3 + Cl2 свет ⟶ CCl4 + HCl2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH4 ⟶ HC≡CH ⟶ CH2=CHCl ⟶ (–CH2–CHCl–)n
б) CH4 ⟶ CH3Cl ⟶ CH3OH ⟶ CO2
в) CH4 ⟶ CO ⟶ CnH2n+2Ответ:
а)
2CH4 t ⟶ HC≡CH + 3H2
HC≡CH + HCl ⟶ CH2=CHCl
nCH2=CHCl кат. ⟶ (–CH2–CHCl–)n
б)
CH4 + Cl2 свет ⟶ CH3Cl + HCl
CH3Cl + NaOH ⟶ CH3OH + NaCl
2CH3OH + 3O2 ⟶ 2CO2 + 4H2O
в)
CH4 + H2O t ⟶ CO + 3H2
CO + 2H2 кат. ⟶ CnH2n+2 + nH2O
3. Укажите важнейшие месторождения природного газа в Российской Федерации. Найдите их на карте полезных ископаемых нашей страны.
Ответ:
Важнейшие месторождения природного газа в Российской Федерации
- Уренгой
- Ямбург
- Бованенковское
- Штокмановское
- Ленинградское
- Русановское
- Заполярное
- Медвежье
- Астраханское
- Западно-Камчатский шельф
- Сахалин
- Среднеботуобинское нефтегазоконденсатное месторождение
- Оренбургское газоконденсатное месторождение
- Игримское
- Ледовое
- Ковыктинское
4. Объёмные доли алканов в природном газе некоторого месторождения равны: метан – 82%, этан – 12%, пропан – 6%. Определите их массовые доли.
Ответ:
Дано:
`φ(CH_4) = 82%`
`φ(C_2H_6) = 12%`
`φ(C_3H_8) = 6%`
---------------------
`ω(CH_4) = ?`
`ω(C_2H_6) = ?`
`ω(C_3H_8) = ?`
Решение
Допусти имеется 22.4 л природного газа, тогда:
`V(CH_4) = (φ(CH_4)*V("природного газа"))/100 = (82*22.4)/100 = 18.368 л`
`V(C_2H_6) = (φ(C_2H_6)*V("природного газа"))/100 = (12*22.4)/100 = 2.688 л`
`V(C_3H_8) = (φ(C_3H_8)*V("природного газа"))/100 = (6*22.4)/100 = 1.344 л`
`n(CH_4) = (V(CH_4))/V_m = 18.368/22.4 = 0.82" моль"`
`n(C_2H_6) = (V(C_2H_6))/V_m = 2.688/22.4 = 0.12" моль"`
`n(C_3H_8) = (V(C_3H_8))/V_m = 1.344/22.4 = 0.06" моль"`
`m(CH_4) = n(CH_4)*M(CH_4) = 0.82*16 = 13.12 г`
`m(C_2H_6) = n(C_2H_6)*M(C_2H_6) = 0.12*30 = 3.6 г`
`m(C_3H_8) = n(C_3H_8)*M(C_3H_8) = 0.06*44 = 2.64 г`
`m("природного газа") = m(CH_4) + m(C_2H_6) + m(C_3H_8) = 13.12 + 3.6 + 2.64 = 19.36 г`
`ω(CH_4) = (100*m(CH_4))/(m("природного газа")) = (100*13.12)/19.36 = 67.8%`
`ω(C_2H_6) = (100*m(C_2H_6))/(m("природного газа")) = (100*3.6)/19.36 = 18.6%`
`ω(C_3H_8) = (100*m(C_3H_8))/(m("природного газа")) = (100*2.64)/19.36 = 13.6%`
Ответ: `ω(CH_4) = 67.8%`, `ω(C_2H_6) = 18.6%`, `ω(C_3H_8) = 13.6%`.
5. Рассчитайте объём воздуха (содержащего 20% кислорода), необходимого для сжигания 100 м3 природного газа (н. у.), в котором объёмные доли метана, этана, пропана и азота равны соответственно 80%, 12%, 6% и 2%.
Ответ:
Дано:
`φ(O_2) = 20%`
`V("природного газа") = 100 м^3`
`φ(CH_4) = 80%`
`φ(C_2H_6) = 12%`
`φ(C_3H_8) = 6%`
`φ(N_2) = 2%`
-----------------
`V("воздуха") = ?`
Решение
`CH_4 + 2O_2 = CO_2 + 2H_2O`
`V(CH_4) = (φ(CH_4)*V("природного газа"))/100 = (80*100)/100 = 80 м^3`
Согласно "Закону объёмных отношений" Гей-Люссака:
`V_1(O_2) = 2*V(CH_4) = 2*80 = 160 м^3`
`2C_2H_6 + 7O_2 = 4CO_2 + 6H_2O`
`V(C_2H_6) = (φ(C_2H_6)*V("природного газа"))/100 = (12*100)/100 = 12 м^3`
`V_2(O_2) = (7*V(C_2H_6))/2 = (7*12)/2 = 42 м^3`
`C_3H_8 + 5O_2 = 3CO_2 + 4H_2O`
`V(C_3H_8) = (φ(C_3H_8)*V("природного газа"))/100 = (6*100)/100 = 6 м^3`
`V_3(O_2) = 5*V(C_3H_8) = 5*6 = 30 м^3`
`V_("общ.")(O_2) = V_1(O_2) + V_2(O_2) + V_3(O_2) = 160 + 42 + 30 = 232 м^3`
`V("воздуха") = (100*V_("общ.")(O_2))/(φ(O_2)) = (100*232)/20 = 1160 м^3`
Ответ: `V("воздуха") = 1160 м^3`.
7. Найдите в Интернете данные об объёмах добычи природного газа в России за последние 10 лет. Оформите информацию в виде таблицы. Проанализируйте динамику добычи, свяжите её с экономической ситуацией в стране и в мире.
Ответ:
Год Объём добычи природного газа в млрд. м3 2009 583 2010 657 2011 673 2012 658 2013 675 2014 647 2015 638 2016 644 2017 694 2018 741 §9
-
§9. Нефть и способы её переработки.
1. Каков состав попутного нефтяного газа? На какие фракции его разделяют при переработке, как их используют?
Ответ:
По сравнению с природным газом в попутном нефтяном газе содержится меньше метана и больше его гомологов: этана, пропана, бутана, пентана и др.
Попутный нефтяной газ разделяют на:
- фракцию, содержащую пентан, гексан и их изомеры – это газовый бензин, который используется в качестве низкосортного топлива для двигателей внутреннего сгорания;
- фракцию, содержащую пропан и бутан (пропан-бутановая), её используют в качестве топлива для двигателей, работающих на сжиженном газе;
- низкокипящую фракцию (сухой газ) – сходна по составу с природным газом и может использоваться в качестве топлива или химического сырья.
2. Что собой представляет нефть, каков её состав? Назовите основные месторождения нефти в России, укажите их на карте.
Ответ:
Нефть – это маслянистая жидкость от светло-коричневого до тёмно-бурого цвета со специфическим запахом, нерастворимая в воде. По своему составу нефть представляет собой природную смесь углеводородов, главным образом алканов линейного и разветвлённого строения, содержащих от 6 до 50 атомов углерода в молекуле. Нефть может содержать также значительное количество ароматических углеводородов.
Крупнейшие нефтяные месторождения России: Самотлорское, Приобское, Русское, Ромашкинское.
3. Что такое ректификация нефти? Укажите области применения её продуктов.
Ответ:
Ректификация нефти – разделение нефти на её составные компоненты (нефтяные фракции) с помощью перегонки.
Нефть разделяют на несколько фракций: бензин, лигроин, керосин, газойль (дизельное топливо) и др. Бензин используют в качестве топлива для двигателей внутреннего сгорания, лигроин – как горючее для сельскохозяйственной техники и сырьё для дальнейшей переработки, керосин – как топливо для современных реактивных самолетов, газойль – как топливо для дизельных двигателей. Остаток после перегонки нефти – мазут используют в качестве топлива для тепловых электростанций и котельных, а также перерабатывают с получением битума, гудрона и минеральных масел.
4. Что такое крекинг? Какая химическая реакция лежит в основе этого процесса? Запишите уравнение крекинга углеводорода состава C20H42.
Ответ:
Крекинг – процесс термического расщепления углеводородов с получением продуктов с меньшей относительной молекулярной массой.
Молекулы алканов при крекинге разрываются примерно пополам, с образованием предельного и этиленового углеводорода с меньшей длиной углеродной цепи.
Уравнение крекинга углеводорода состава C20H42:
C20H42 t ⟶ C10H22 + C10H205. Что такое риформинг? Запишите уравнения реакций изомеризации н-октана C8H18 в 2,2,4-триметилпентан. Используйте структурные формулы органических веществ.
Ответ:
Риформинг – переработка нефтепродуктов с целью повышения качества бензина и получения ароматических углеводородов.
Основу процесса риформинга составляют два типа реакций – изомеризация предельных углеводородов и их дегидрирование. В результате первой реакции образуются алканы с разветвлённой углеродной цепью, в результате второй – бензол и его гомологи.
CH3–CH2–CH2–CH2–CH2–CH2–CH2–CH3 ⟶
6. В средствах массовой информации найдите сообщения о крупных катастрофах, связанных с утечкой или возгоранием нефти. Каковы последствия этих катастроф?
Ответ:
20 апреля 2010 года - взрыв нефтяной платформы Deepwater Horizon, принадлежащей компании British Petroleum, в 80 километрах от побережья штата Луизиана в Мексиканском заливе. В результате разлива нефти было загрязнено 1770 километров побережья, был введён запрет на рыбную ловлю, для промысла были закрыты более 1/3 всей акватории Мексиканского залива. По состоянию на 2 ноября 2010 года было собрано 6814 мёртвых животных, в том числе 6104 птицы, 609 морских черепах, 100 дельфинов и других млекопитающих. В 2016 году общая сумма затрат компании BP на устранение последствий аварии превысила $56 млрд.
§10
-
§10. Каменный уголь и его переработка.
1. Расскажите о происхождении и классификации ископаемого угля. Укажите на карте важнейшие месторождения каменного угля в Российской Федерации.
Ответ:
Ископаемый уголь – горная порода, образованная окаменелыми останками доисторических растений. Различают три вида ископаемых углей: антрацит, каменный уголь и бурый уголь.
Важнейшие месторождения каменного угля в Российской Федерации: Эльгинское месторождение (Саха); Элегестское месторождение (Тува); Минусинский угольный бассейн (Республика Хакасия); Кузнецкий угольный бассейн (на юге Западной Сибири, в основном на территории Кемеровской области).
2. Какой процесс называют коксованием каменного угля? Какие основные продукты коксохимического производства и направления их вторичной переработки вы можете назвать?
Ответ:
Коксование – процесс высокотемпературного нагревания угля без доступа воздуха.
Основные продукты коксохимического производства:
- Кокс – важнейший продукт для металлургической промышленности.
- Каменноугольная смола – в состав входит около 300 различных соединений, часть из которых выделяют путём фракционной перегонки, так получают бензол и другие ароматические углеводороды.
- Аммиачная вода – на специальной колонне из неё выделяют аммиак, который идёт на производство азотных удобрений.
- Коксовый газ – из него извлекают аммиак, для этого газ пропускают через раствор серной кислоты, превращая аммиак в сульфат аммония, который используют в качестве азотного удобрения. Из коксового газа выделяют также водород, этилен, бензол и некоторые другие вещества.
- Газификация угля – продуктом этого процесса является смесь газообразных продуктов, содержащая главным образом водород и оксид углерода (II) – так называемый водяной газ. Водяной газ или разделяют на компоненты, или используют для синтеза углеводородов и кислородсодержащих органических соединений.
- Каталитическое гидрирование угля – реакция между углеродом и водородом при повышенной температуре и давлении приводит к образованию смеси углеводородов, которая используется в качестве топлива для двигателей внутреннего сгорания и является альтернативой продуктам нефтепереработки.
3. Назовите основные различия антрацита, каменного угля и бурого угля, укажите области их использования.
Ответ:
Антрацит Каменный уголь Бурый уголь Глубина залегания Залегает на больших глубинах – около 6 км. Залегает на меньших глубинах, чем антрацит. Имеет наименьшую глубину залегания. Плотность Большая плотность. Плотный, но пористый. Низкая плотность и рыхлая структура. Цвет Черный. Темно-серый. Чёрно-бурый. Блеск Имеет характерный блеск. Отсутствует. Отсутствует. Содержание углерода от 95% от 70 до 95% менее 70% Области использования Используют в качестве высокоэффективного топлива, а также для изготовления электродов и получения карбидов металлов. Используют как сырьё в коксохимическом производстве. Используют как сырьё в коксохимическом производстве. 4. Образец каменного угля массой 0,27 г сожгли в кислороде, образовавшиеся газы пропустили через избыток раствора гидроксида бария. В результате образовался осадок массой 3,94 г. Вычислите массовую долю углерода в образце каменного угля.
Ответ:
Дано:
`m("каменного угля") = 0.27 г`
`m(BaCO_3) = 3.94 г`
-----------------
`ω(C) = ?`
Решение
`C + O_2 = CO_2`
`CO_2 + Ba(OH)_2 = BaCO_3"↓"`
`n(BaCO_3) = (m(BaCO_3))/(M(BaCO_3)) = 3.94/197 = 0.02" моль"`
`n(C) = n(CO_2) = n(BaCO_3) = 0.02" моль"`
`m(C) = n(C)*M(C) = 0.02*12 = 0.24 г`
`ω(C) = (100*m(C))/(m("каменного угля")) = (100*0.24)/0.27 = 88.9%`
Ответ: `ω(C) = 88.9%`.
5. Содержание аммиака в аммиачной воде составляет 3,4%. Какую массу сульфата аммония можно получить из 2 т аммиачной воды?
Ответ:
Дано:
`ω(NH_3) = 3.4%`
`m("аммиачной воды") = 2 т = 2000" кг"`
---------------
`m((NH_4)_2SO_4) = ?`
Решение
`2NH_3 + H_2SO_4 = (NH_4)_2SO_4`
`m(NH_3) = (ω(NH_3)*m("аммиачной воды"))/100 = (3.4*2000)/100 = 68" кг"`
`n(NH_3) = (m(NH_3))/(M(NH_3)) = 68/17 = 4" кмоль"`
`n((NH_4)_2SO_4) = (n(NH_3))/2 = 4/2 = 2" кмоль"`
`m((NH_4)_2SO_4) = n((NH_4)_2SO_4)*M((NH_4)_2SO_4) = 2*132 = 264" кг"`
Ответ: `m((NH_4)_2SO_4) = 264" кг"`.
§11
-
Глава III. Кислород и азотсодержащие органические соединения.
§11. Одноатомные спирты.
1. Какие вещества относят к классу предельных одноатомных спиртов? Приведите формулы и названия трёх первых представителей этого гомологического ряда.
Ответ:
К предельным одноатомным спиртам относят вещества, содержащие в молекулах одну гидроксильную группу -ОН и имеющие общую формулу CnH2n+1OH.
Три первых представителя гомологического ряда:
`underset("метанол")(CH_3OH)`;
`underset("этанол")(C_2H_5OH)`;
`underset("пропанол-1")(CH_3-CH_2-CH_2OH)`.2. Напишите структурные формулы всех спиртов состава C4H9OH, назовите каждое вещество. Укажите типы изомерии, характерные для спиртов. Ответ проиллюстрируйте формулами изомерных бутиловых спиртов.
Ответ:
Для одноатомных спиртов характерна изомерия положения функциональной группы и углеродного скелета.
Структурные формулы всех спиртов состава C4H9OH:
CH3–CH2–CH2–CH2–OH
бутанол-1
CH3–CH–CH2–CH3
|
OH
бутанол-2
CH3–CH–CH2–OH
|
CH3
2-метилпропанол-1
CH3
|
CH3–C–CH3
|
OH
2-метилпропанол-23. Напишите структурные формулы следующих соединений: а) 2-метилпропанол-2; б) 2,3-диметилпентанол-3; в) бутанол-2; г) 3-метилбутанол-2.
Ответ:
а)
CH3
|
CH3–C–CH3
|
OH
2-метилпропанол-2
б)
CH3
|
CH3 – CH – C – CH2 – CH3
| |
CH3 OH
2,3-диметилпентанол-3
в)
CH3–CH–CH2–CH3
|
OH
бутанол-2
г)
CH3 – CH – CH – CH3
| |
OH CH3
3-метилбутанол-24. Какое действие на организм человека оказывает метиловый спирт? этиловый спирт?
Ответ:
Метиловый спирт очень ядовит: даже 5-7 мл метанола, попавшие в организм, вызывают полную потерю зрения в результате поражения сетчатки глаза, а 30 мл и более могут привести к летальному исходу.
Напитки на основе этилового спирта довольно быстро вызывают привыкание, а их токсическое действие на организм проявляется не сразу. Однозначно доказано, что любое, даже незначительное употребление алкоголя вредит здоровью человека. При попадании этилового спирта в организм происходят психические и неврологические изменения, снижаются острота мышления и чёткость восприятия, формируется неадекватное поведение. Кроме этого, под действием алкоголя происходит обезвоживание организма, кровеносные сосуды расширяются, усиливается ток крови в капиллярах, в результате чего появляется ощущение тепла и покраснение кожи. В больших количествах алкоголь приводит к тяжёлым отравлениям и гибели клеток печени.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) этан ⟶ этилен ⟶ этиловый спирт ⟶ уксусный альдегид
б) метан ⟶ хлорметан ⟶ метиловый спирт ⟶ метиловый эфир уксусной кислоты
в) этиловый спирт ⟶ этилен ⟶ бромэтан ⟶ этиловый спирт ⟶ этилат калияОтвет:
а)
H3C–CH3 t ⟶ H2C=CH2 + H2
H2C=CH2 + H2O H⁺ ⟶ CH3–CH2–OH
CH3–CH2–OH + CuO t ⟶ CH3–CHO + Cu + H2O
б)
CH4 + Cl2 ⟶ CH3Cl
CH3Cl + NaOH ⟶ CH3OH + NaCl

в)
H3C–CH2–OH t, H₂SO₄ ⟶ H2C=CH2
H2C=CH2 + HBr ⟶ H3C–CH2Br
H3C–CH2Br + NaOH ⟶ H3C–CH2–OH + NaBr
2H3C–CH2–OH + K ⟶ 2H3C–CH2–OK + H2
6. В двух пробирках без подписи находятся метиловый спирт и толуол. Предложите способ распознавания этих веществ. Напишите уравнение реакции.
Ответ:
Метиловый спирт может реагировать с карбоновыми кислотами, а толуол – нет. Для этого прильём в пробирки с веществами уксусную и концентрированную серную кислоты, нагреем пробирки, в пробирке с метиловым спиртом появится фруктовый запах, так пахнет метилацетат:

7. Какой объём водорода (н. у.) получится при действии 6,9 г натрия на 115 мл этилового спирта плотностью 0,80 г/мл?
Ответ:
Дано:
`m(Na) = 6.9 г`
`V(C_2H_5OH) = 115" мл"`
`ρ(C_2H_5OH) = 0.80" г/мл"`
--------------------
`V(H_2) = ?`
Решение
`2C_2H_5OH + 2Na = 2C_2H_5ONa + H_2"↑"`
`m(C_2H_5OH) = ρ(C_2H_5OH)*V(C_2H_5OH) = 0.8*115 = 92 г`
`n(C_2H_5OH) = (m(C_2H_5OH))/(M(C_2H_5OH)) = 92/46 = 2" моль"`
`n(Na) = (m(Na))/(M(Na)) = 6.9/23 = 0.3" моль"`
Этиловый спирт в избытке, поэтому:
`n(H_2) = (n(Na))/2 = 0.3/2 = 0.15" моль"`
`V(H_2) = n(H_2)*V_m = 0.15*22.4 = 3.36 л`
Ответ: `V(H_2) = 3.36 л`.
8. Постройте на компьютере 3D-модель молекулы этилового спирта. Рассмотрите взаимное расположение атомов в пространстве. Выскажите и аргументируйте своё мнение о том, является ли расположение атомов C–O–H линейным. Если нет, то определите примерную величину угла.
Ответ:
3D-модель молекулы этилового спирта
Этиловый спирт при н. у. является жидкостью и имеет молярную массу 46 г/моль, в тоже время, например, оксид серы (IV) имеет молекулярную массу 64 г/моль и при н. у. является газом. Эту аномалию можно связать с тем, что молекулы спирта, как и молекулы воды, связаны между собой водородными связями, а это возможно только если угол C−O−H в молекуле этилового спирта не равен 180°. Это подтверждается тем, что этанол растворяется в воде. Отсюда можно сделать вывод о том, что угол C−O−H в молекуле метанола приблизительно равен углу H−O−H в молекуле воды (104,5°).
Если вы проходили тему гибридизации, то ответ таков: "Расположение атомов C–O–H не является линейным, т. к. атом кислорода гидроксильной группы находится в состоянии sp³-гибридизации. Соответственно угол C−O−H в молекуле метанола приблизительно равен углу H−O−H в молекуле воды (104,5°)".
Лабораторный эксперимент
Фильтровальную бумагу положите на керамическую пластинку и нарисуйте на ней шариковой ручкой две точки размером с вишнёвую косточку на расстоянии 5 см друг от друга. В центр первой точки с помощью пипетки нанесите 3-4 капли воды, в центр второй точки – 3-4 капли этилового спирта. Объясните полученный результат.
Ответ:
После того, как капнули водой на точку, особых изменений не произошло.
После того, как капнули этиловым спиртом на точку, произошло её растворение, и вся смоченная поверхность окрасилась в синий цвет.
Вывод: этиловый спирт является лучшим растворителем красящих веществ, чем вода.
Лабораторный эксперимент
Накалите на пламени спиртовки свёрнутую в спираль медную проволоку до появления чёрного налёта оксида меди (II) и внесите её в пробирку с этиловым спиртом. Что наблюдаете? Объясните наблюдаемые явления.
Ответ:
При внесении в пробирку медной проволоки покрытой оксидом меди (II) наблюдается изменение цвета налёта с черного на золотисто-розовый. Это связано с тем, что происходит восстановление меди из оксида меди (II), и окисление спирта до альдегида:
CH3–CH2OH t ⟶ CH3–CHO + Cu + H2O §12
-
§12. Многоатомные спирты.
1. Какие вещества называют многоатомными спиртами? Напишите по две формулы и названия простейших представителей для двухатомных и трёхатомных спиртов.
Ответ:
Многоатомными спиртами называют вещества в молекулах которых содержится две или более гидроксильные группы.
Двухатомные спирты:
CH2 – CH2
| |
OH OH
этандиол-1,2CH2 – CH – CH3
| |
OH OH
пропандиол-1,2Трёхатомные спирты:
CH2 – CH – CH2
| | |
OH OH OH
пропантриол-1,2,3CH2 – CH – CH – CH3
| | |
OH OH OH
бутантриол-1,2,32. Какие свойства глицерина лежат в основе его применения?
Ответ:
Глицерин гигроскопичен, т. е. активно поглощает влагу воздуха. Это свойство глицерина используют при изготовлении кремов для обуви, в кожевенном производстве – для предохранения кож от высыхания, в текстильной промышленности – для придания тканям мягкости и эластичности. Глицерин широко применяют в парфюмерии и медицине для изготовления мазей и кремов.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) этанол ⟶ этен ⟶ 1,2-дихлорэтан ⟶ этандиол-1,2
б) пропанол-1 ⟶ 1-бромпропан ⟶ пропен ⟶ пропандиол-1,2Ответ:
а)
CH3–CH2OH t, H₂SO₄ ⟶ H2C=CH2 + H2O
H2C=CH2 + Cl2 ⟶ CH2Cl–CH2Cl
CH2 – CH2
| |
Cl Cl+
2NaOH
⟶
CH2 – CH2
| |
OH OH+
2NaCl
б)
CH3–CH2–CH2OH + HBr ⟶ CH3–CH2–CH2Br + H2O
CH3–CH2–CH2Br + KOH C₂H₅OH ⟶ CH3–CH=CH2 + KBr + H2O
CH3–CH=CH2 + [O] + H2O ⟶ CH2 – CH – CH3
| |
OH OH4. Какой объём водорода (н. у.) выделится при взаимодействии 1,38 г натрия с избытком этиленгликоля?
Ответ:
Дано:
`m(Na) = 1.38 г`
------------------------
`V(H_2) = ?`
Решение
`C_2H_4(OH)_2 + 2Na = C_2H_4(ONa)_2 + H_2"↑"`
`n(Na) = (m(Na))/(M(Na)) = 1.38/23 = 0.06" моль"`
`n(H_2) = n(Na) = 0.06/2 = 0.03" моль"`
`V(H_2) = n(H_2)*V(H_2) = 0.03*22.4 = 0.672 л`
Ответ: `V(H_2) = 0.672 л`.
5. В двух пробирках находятся растворы этилового спирта и глицерина. Как их различить?
Ответ:
Различить растворы этилового спирта и глицерина можно с помощью свежеосаждённого гидроксида меди (II), при его добавлении в пробирку с раствором глицерина будет наблюдаться растворение гидроксида меди (II), и окрашивание раствора в ярко-синий цвет. В пробирке с этиловым спиртом изменений наблюдаться не будет.
6. К наступлению холодов в клеточной жидкости насекомых и некоторых земноводных резко увеличивается содержание глицерина. Объясните этот природный факт.
Ответ:
К наступлению холодов в клеточной жидкости насекомых и некоторых земноводных резко увеличивается содержание глицерина, это связано с тем, что смесь глицерина и воды кристаллизуется при гораздо более низкой температуре, чем каждое из чистых веществ.
8. Температура кристаллизации этиленгликоля 13°C, температура кристаллизации воды 0°C. Попробуйте спрогнозировать температуру кристаллизации 50%-ного водного раствора этиленгликоля. Сравните ваш прогноз с истинным значением, найденным в Интернете. Проанализируйте результат, сделайте выводы.
Ответ:
Так как температура кристаллизации этиленгликоля -13°C, а температура кристаллизации воды 0°C, то можно предположить, что 50%-ного водного раствора этиленгликоля будет иметь температуру кристаллизации равную -6.5°C, однако истинное значение равно -36°C.
Отсюда можно сделать вывод: смесь многоатомного спирта (в частности, этиленгликоля) и воды кристаллизуется при гораздо более низкой температуре, чем каждое из чистых веществ.
В учебнике опечатка. На самом деле температура кристаллизации этиленгликоля -13°C, а не 13°C.
Лабораторный эксперимент
Налейте в пробирку 1 мл воды, добавьте 1 мл глицерина, встряхните смесь. Затем добавьте ещё 1 мл глицерина и ещё раз тщательно перемешайте содержимое пробирки. Какой вывод можно сделать о растворимости глицерина в воде?
Ответ:
При добавлении в 1 мл воды 1 мл глицерина, произошло его растворение. После добавления ещё 1 мл глицерина, также наблюдается его растворение.
Вывод: глицерин растворяется в воде в любых пропорциях.
Лабораторный эксперимент
Налейте в пробирку 2 мл 10%-ного раствора гидроксида натрия, добавьте несколько капель раствора сульфата меди (II). Что наблюдаете? К полученному осадку добавьте 5-6 капель глицерина и встряхните смесь. Что наблюдаете?
Ответ:
При добавлении раствора сульфата меди (II) в раствор гидроксида натрия наблюдается выпадение синего осадка:
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓При добавлении глицерина к полученному осадку наблюдается его растворение, и окрашивание раствора в ярко-синий цвет:
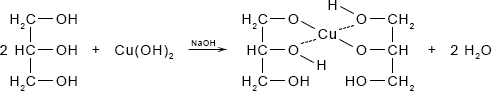
§13
-
§13. Фенол.
1. Приведите молекулярную и структурную формулы фенола. Найдите черты сходства и различия в строении молекул фенола и этанола.
Ответ:
Молекулярная формула фенола: C6H5OH.
фенолCH3–CH2–OH
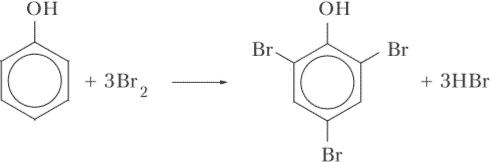
этанол2. Как взаимное влияние фенильного радикала и гидроксильной группы отражается на свойствах фенола? Ответ проиллюстрируйте уравнениями химических реакций.
Ответ:
Влияние фенильного радикала –C6H5 на гидроксильную группу выражается в значительном усилении её кислотных свойств. Это приводит к тому, что фенол, в отличие от спиртов, взаимодействует не только со щелочными металлами, но и со щелочами с образованием соли:
C6H5OH + NaOH ⟶ C6H5ONa + H2OГидроксильная группа влияет на протекание реакций по фенильному радикалу. Например, замещение атома водорода атомом галогена уже не требует присутствия катализатора. Более того, при взаимодействии фенола с бромной водой атомами брома замещаются сразу три атома водорода цикла, в строго определённые положения цикла:
3. В настоящее время вместо фенола в качестве дезинфицирующего средства используют 2,4,6-трихлорфенол. Предложите способ его получения исходя из бензола. Напишите уравнения соответствующих реакций.
Ответ:
Способ получения 2,4,6-трихлорфенола из бензола
+ Cl2 t, кат. ⟶ + HCl + NaOH ⟶ + NaCl + 3Cl2 ⟶ + 3HCl 4. В результате взаимодействия 47 г водного раствора фенола с бромной водой выпало 1,655 г осадка. Рассчитайте массовую долю фенола в исходном растворе.
Ответ:
Дано:
`m("р-ра фенола") = 47 г`
`m(C_6H_2Br_3OH) = 1.655 г`
-------------------------------------
`ω(C_6H_5OH) = ?`
Решение
`C_6H_5OH + 3Br_2 = C_6H_2Br_3OH + 3HBr`
`n(C_6H_2Br_3OH) = (m(C_6H_2Br_3OH))/(M(C_6H_2Br_3OH)) = 1.655/331 = 0.005" моль"`
`n(C_6H_5OH) = n(C_6H_2Br_3OH) = 0.005" моль"`
`m(C_6H_5OH) = n(C_6H_5OH)*M(C_6H_5OH) = 0.005*94 = 0.47 г`
`ω(C_6H_5OH) = (100*m(C_6H_5OH))/(m("р-ра фенола")) = (100*0.47)/47 = 1%`
Ответ: `ω(C_6H_5OH) = 1%`.
5. В трёх пробирках без подписи находятся водные растворы пропанола-1, глицерина и фенола. С помощью каких реагентов можно определить каждый из растворов?
Ответ:
Определить раствор глицерина можно с помощью свежеосаждённого гидроксида меди (II), при его добавлении, раствор окрасится в ярко-синий цвет.
Определить раствор фенола можно с помощью хлорида железа (III), при его добавлении, раствор окрасится в сиреневый цвет.
Определить раствор пропанола-1 можно с помощью оксида меди (II), при его добавлении, наблюдается восстановление меди из оксида, и раствор приобретает слегка раздражающий фруктовый запах.
6. Фенолят натрия взаимодействует с углекислым газом с образованием гидрокарбоната натрия и фенола согласно уравнению
C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3Какой вывод относительно кислотных свойств фенола и угольной кислоты можно сделать на основании этой реакции?
Ответ:
На основании того, что угольная кислота вытесняет фенол из её соли, можно сделать вывод о том, что фенол является проявляет более слабые кислотные свойства, чем угольная кислота.
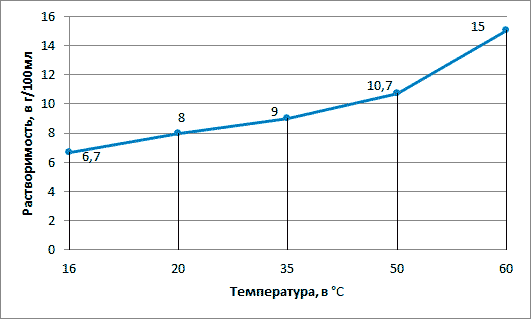
7. Опишите физические свойства фенола. Найдите в Интернете данные о растворимости фенола в воде при различных температурах. Постройте график температурной зависимости растворимости фенола в воде.
Ответ:
График температурной зависимости растворимости фенола в воде.
§14
-
§14. Альдегиды и кетоны.
1. Какие вещества называют альдегидами? Приведите формулы и названия трёх первых представителей этого гомологического ряда.
Ответ:
Альдегидами называют вещества, в молекулах которых альдегидная группа связана с углеводородным радикалом (или атомом водорода).
метаналь
этаналь
пропаналь2. Даны молекулярные формулы веществ: C2H6O, C3H6O, CH2O, C2H4O2, C3H8O, C2H4O. Какие из этих формул могут отражать состав альдегидов? Напишите соответствующие структурные формулы.
Ответ:
Общая формула представителей гомологического ряда альдегидов CnH2nO, поэтому формулы CH2O, C2H4O, C3H6O могут отражать состав альдегидов. Соответствующие формулы:
метаналь
этаналь
пропаналь3. Формальдегид объёмом 44,8 л (н. у.) растворили в 240 г воды. Рассчитайте массовую долю альдегида в растворе.
Ответ:
Дано:
`m(H_2O) = 240 г`
`V(HCHO) = 44.8 л`
----------------------------
`ω(HCHO) = ?`
Решение
`n(HCHO) = (V(HCHO))/V_m = 44.8/22.4 = 2" моль"`
`m(HCHO) = n(HCHO)*M(HCHO) = 2*30 = 60 г`
`m("р-ра") = m(H_2O) + m(HCHO) = 240 + 60 = 300 г`
`ω(HCHO) = (100*m(HCHO))/(m("р-ра")) = (100*60)/300 = 20%`
Ответ: `ω(HCHO) = 20%`.
4. При сжигании 0,22 г органического вещества, плотность паров которого по воздуху равна 1,517, образовалось 224 мл оксида углерода (IV) (н. у.) и 0,18 г воды. Определите молекулярную формулу вещества.
Ответ:
Дано:
`m("в-ва") = 0.22 г`
`D_("возд.")("в-ва") = 1.517`
`V(CO_2) = 224" мл" = 0.224 л`
`m(H_2O) = 0.18 г`
-------------------------------
`"формула в-ва" - ?`
Решение
`n(CO_2) = (V(CO_2))/V_m = 0.224/22.4 = 0.01" моль"`
`n(C) = n(CO_2) = 0.01" моль"`
`m(C) = n(C)*M(C) = 0.01*12 = 0.12 г`
`n(H_2O) = (m(H_2O))/(M(H_2O)) = 0.18/18 = 0.01" моль"`
`n(H) = 2*n(H_2O) = 2*0.01 = 0.02" моль"`
`m(H) = n(H)*M(H) = 0.02*1 = 0.02 г`
Так как масса органического соединения (`0.22 г`) больше, чем сумма масс углерода и водорода (`0.12 + 0.02 = 0.14 г`), то это соединение должно содержать кислород, тогда его формула может быть записана как `C_xH_yO_z`. Рассчитаем массу кислорода входящего в соединение:
`m(O) = m("в-ва") - m(C) - m(H) = 0.22 - 0.12 - 0.02 = 0.04 г`
`n(O) = (m(O))/(M(O)) = 0.08/16 = 0.005" моль"`
Найдём соотношение атомов углерода, водорода, кислорода:
`x" ":" "y" ":" "z = 0.01" ":" "0.02" ":" "0.005`
`x" ":" "y" ":" "z = 2" ":" "4" ":" "1`
Найдём молярную массу вещества:
`D_("возд.")("в-ва") = (M("в-ва"))/(M("возд."))`
`M("в-ва") = D_("возд.")("в-ва")*M("возд.") = 1.517*29 = 44" г/моль"`
Выполним проверку исходя из соотношения атомов углерода, водорода, кислорода:
`M("в-ва") = x*M(C) + y*M(H) + z*M(O) = 12*2 + 4 + 16*1 = 44" г/моль"`
Формула вещества: `C_2H_4O`.
Ответ: `C_2H_4O`.
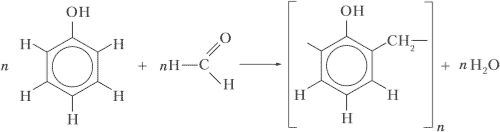
5. В чём различие реакций полимеризации и поликонденсации? Ответ проиллюстрируйте уравнениями реакций полимеризации этилена и поликонденсации фенола с формальдегидом.
Ответ:
В реакции поликонденсации, в отличие от реакции полимеризации, помимо высокомолекулярного вещества, образуется побочный низкомолекулярный продукт (чаще всего вода).
nCH2=CH2 ⟶ (–CH2–CH2–)n
6. В двух пробирках без этикеток находятся растворы этиленгликоля и уксусного альдегида. Как при помощи растворов сульфата меди (II) и гидроксида натрия распознать предложенные вещества? Укажите признаки реакций.
Ответ:
Из растворов сульфата меди (II) и гидроксида натрия получим гидроксид меди (II):
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓При добавлении свежеосаждённого гидроксида меди (II) в пробирку с раствором этиленгликоля будет наблюдаться растворение гидроксида меди (II), и окрашивание раствора в ярко-синий цвет.
При добавлении свежеосаждённого гидроксида меди (II) в пробирку с раствором уксусного альдегида (в щелочной среде) будет наблюдаться изменение цвета осадка с голубого на кирпично-красный, в результате образования оксида меди (I):
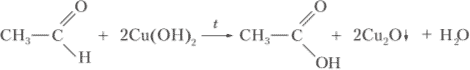
7. Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2%-ного раствора формальдегида с избытком аммиачного раствора оксида серебра?
Ответ:
Дано:
`m("р-ра") = 15 г`
`ω(HCHO) = 2%`
---------------------
`m(Ag) = ?`
Решение
`HCHO + underset("аммиачный р-р")(Ag_2O) overset(t)(=) HCOOH + 2Ag"↓"`
`m(HCHO) = (ω(HCHO)*m("р-ра"))/100 = (2*15)/100 = 0.3 г`
`n(HCHO) = (m(HCHO))/(M(HCHO)) = 0.3/30 = 0.01" моль"`
`n(Ag) = 2*n(HCHO) = 0.01*2 = 0.02" моль"`
`m(Ag) = n(Ag)*M(Ag) = 0.02*108 = 2.16 г`
Ответ: `m(Ag) = 2.16 г`.
8. В 1860 г французский химик М. Бертло провёл реакцию ацетилена с водой и был уверен, что получил непредельный спирт:
HC≡CH + H2O ⟶ CH2=CH–OHВ 1877 г аналогичную реакцию осуществил русский химик Александр Павлович Эльтеков. Учёный пришёл к выводу, что получил уксусный альдегид:
HC≡CH + H2O ⟶ CH3CHO
Кто из учёных оказался прав?Ответ:
Александр Павлович Эльтеков оказался прав. В том же 1877 г. им было сформулировано правило, в соответствии с которым спирты, содержащие гидроксильную группу у атома углерода с двойной связью, необратимо изомеризуются в альдегиды или кетоны.
Лабораторный эксперимент
В тщательно вымытую пробирку налейте 1 мл аммиачного раствора оксида серебра и добавьте по стенке 5-6 капель формалина. Поместите пробирку в стакан с горячей водой. Что наблюдаете?
Ответ:
При добавлении формалина к аммиачному раствору оксида серебра, и последующему нагреванию, наблюдается образование на стенках пробирки блестящего металлического покрытия.
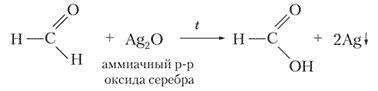
Лабораторный эксперимент
Налейте в пробирку 2 мл 5-10%-ного раствора щёлочи и добавьте 2-3 капли раствора сульфата меди (II). К образовавшемуся осадку прилейте 1 мл разбавленного водой (1:1) формалина и нагрейте содержимое пробирки. Что наблюдаете?
Ответ:
При добавлении раствора сульфата меди (II) в раствор гидроксида натрия наблюдается выпадение синего осадка:
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓При добавлении к образовавшемуся осадку раствора формалина, и последующее нагревание смеси, приводит к изменению цвета осадка с голубого на кирпично-красный:
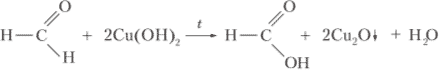
§15
-
§15. Карбоновые кислоты.
1. Какие вещества называют карбоновыми кислотами? Приведите формулы и названия пяти представителей гомологического ряда предельных одноосновных карбоновых кислот.
Ответ:
Карбоновыми кислотами называют органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом.
Первые пять представителей гомологического ряда предельных одноосновных карбоновых кислот:
метановая кислота
этановая кислота
пропановая кислота
бутановая кислота
пентановая кислота
2. Напишите формулы следующих кислот: 2-метилпропановая; 3-хлорбутановая; 2,4-диметилгексановая.
Ответ:
2-метилпропановая кислота
3-хлорбутановая кислота
2,4-диметилгексановая кислота
3. Молярная масса предельной одноосновной карбоновой кислоты равна 130 г/моль. Какова молекулярная формула этой кислоты.
Ответ:
Дано:
`M(C_nH_(2n+1)COOH) = 130" г/моль"`
---------------------------------
`C_nH_(2n+1)COOH - ?`
Решение
`M(C_nH_(2n+1)COOH) = n*M(C) + (2n+1)*M(H) + M(-COOH) = 130" г/моль"`
`12*n + (2n + 1)*1 + 45 = 130`
`14*n = 84`
`n = 6`
Ответ: `C_6H_13COOH`.
4. Какие признаки верно отражают свойства уксусной кислоты: 1) газообразное вещество; 2) без запаха; 3) с резким запахом; 4) плохо растворима в воде; 5) слабый электролит?
Ответ:
Признаки верно отражают свойства уксусной кислоты: 3) с резким запахом; 5) слабый электролит.
5. В пищевой промышленности уксусную кислоту используют как регулятор кислотности и консервант (код E260). Напишите структурные формулы предыдущего и последующего представителей данного гомологического ряда, имеющих коды E236 и E280 соответственно. Напишите уравнение реакции получения каждой кислоты.
Ответ:
метановая кислота (E236)
CH3OH + O2 ⟶ HCOOH + H2O
пропановая кислота (E280)
C3H7OH + O2 ⟶ C2H5COOH + H2O
6. В чём сходство и различие химических свойств неорганических и органических кислот? Ответ подтвердите уравнениями химических реакций.
Ответ:
Сходство химических свойств неорганических и органических кислот
Реагируют с активными металлами с образованием солей и выделением водорода:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Zn + 2CH3COOH ⟶ (CH3COO)2Zn + H2↑Реагируют с оксидами металлов с образованием солей и воды:
ZnO + 2HCl ⟶ ZnCl2 + H2O
ZnO + 2CH3COOH ⟶ (CH3COO)2Zn + H2OРеагируют с основаниями с образованием солей и воды:
Zn(OH)2 + 2HCl ⟶ ZnCl2 + 2H2O
Zn(OH)2 + 2CH3COOH ⟶ (CH3COO)2Zn + 2H2OРеагируют с солями, если в результате реакции выполняется одно из условий: образование осадка, выделение газа или образование слабого электролита:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑Различие химических свойств неорганических и органических кислот
Карбоновые кислоты сгорают в кислороде:
CH3COOH + 2O2 ⟶ 2H2O + 2CO2Карбоновые кислоты в присутствии концентрированной серной кислоты вступают во взаимодействие со спиртами, с образованием сложных эфиров:
CH3COOH + C2H5OH `overset(H_2SO_(4"(конц.)"))(⇄)` CH3COOC2H5 + H2O7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этан ⟶ хлорэтан ⟶ этиловый спирт ⟶ уксусный альдегид ⟶ уксусная кислота ⟶ ацетат калия и этиловый эфир уксусной кислоты.Ответ:
C2H6 + Cl2 ⟶ C2H5Cl + HCl
C2H5Cl + NaOH ⟶ C2H5OH + NaCl
2C2H5OH + O2 t, кат. ⟶ 2CH3CHO + 2H2O
2CH3CHO + O2 ⟶ 2CH3COOH
CH3COOH + KOH ⟶ CH3COOK + H2O
CH3COOH + C2H5OH `overset(H_2SO_(4"(конц.)"))(⇄)` CH3COOC2H5 + H2O
8. Достаточно ли 100 г 66%-ного раствора уксусной кислоты для растворения 30 г карбоната кальция? Какая масса ацетата кальция при этом получится?
Ответ:
Дано:
`m("р-ра") = 100 г`
`ω(CH_3COOH) = 66%`
`m(CaCO_3) = 30 г`
-------------------
Достаточно ли раствора уксусной кислоты для растворения карбоната кальция?
`m((CH_3COO)_2Ca) = ?`
Решение
`2CH_3COOH + CaCO_3 = (CH_3COO)_2Ca + H_2O + CO_2"↑"`
`m(CH_3COOH) = (ω(CH_3COOH)*m("р-ра"))/100 = (66*100)/100 = 66 г`
`n(CH_3COOH) = (m(CH_3COOH))/(M(CH_3COOH)) = 66/60 = 1.1" моль"`
`n(CaCO_3) = (m(CaCO_3))/(M(CaCO_3)) = 30/100 = 0.3" моль"`
Для растворения `0.3" моль"` карбоната кальция необходимо `0.6" моль"` уксусной кислоты. В растворе находится `1.1" моль"` кислоты, значит её хватит для полного растворения карбоната кальция.
`n((CH_3COO)_2Ca) = n(CaCO_3) = 0.3" моль"`
`m((CH_3COO)_2Ca) = n((CH_3COO)_2Ca)*M((CH_3COO)_2Ca) = 0.3*158 = 47.4 г`
Ответ: для растворения 30 г карбоната кальция достаточно 100 г 66%-ного раствора уксусной кислоты; `m((CH_3COO)_2Ca) = 47.4 г`.
9. Почему жжение от ужаления муравья утихает, если потереть пострадавшее место нашатырным спиртом (водным раствором аммиака)?
Ответ:
В состав муравьиного яда входит метановая кислота (муравьиная кислота), которая может вступать в реакцию с аммиаком:
HCOOH + NH3 ⟶ HCOONH4Поэтому, если потереть пострадавшее место нашатырным спиртом, то жжение от ужаления муравья утихает.
Но на самом деле в состав яда жалящих муравьёв, помимо муравьиной кислоты, входят алкалоиды и аллергенные белки, против которых раствор аммиака никак не поможет, а скорее наоборот усилит жжение, т. к. аммиак обладает местнораздражающим действием.
10. Докажите с помощью уравнений реакций, что муравьиная кислота может проявлять как свойства альдегидов, так и свойства кислот.
Ответ:
Муравьиная кислота и альдегиды реагируют с аммиачным раствором оксида серебра, при этом происходит восстановление серебра:
`HCHO + underset("аммиачный р-р")(Ag_2O) overset(t)(⟶) HCOOH + 2Ag"↓"`
`HCOOH + underset("аммиачный р-р")(Ag_2O) overset(t)(⟶) H_2O + CO_2 + 2Ag"↓"`Муравьиная кислота и альдегиды взаимодействуют с гидроксидом меди (II), при этом медь восстанавливается до одновалентной меди:
`HCHO + 2Cu(OH)_2 ⟶ Cu_2O + HCOOH + 2H_2O`
`HCOOH + 2Cu(OH)_2 ⟶ Cu_2O + CO_2 + 3H_2O`12. Есть ли у вас на кухне уксусная кислота? Какие правила техники безопасности необходимо соблюдать при её использовании? Почему?
Ответ:
С уксусной кислотой необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.
Лабораторный эксперимент
В три пробирки налейте по 2 мл раствора уксусной кислоты и добавьте по 2-3 капли индикаторов: метилового оранжевого, лакмуса и фенолфталеина. Какова окраска этих индикаторов в кислой среде?
Ответ:
Индикаторы метиловый оранжевый и лакмус окрашивают растворы уксусной кислоты в красный цвет, что говорит о том, что среда кислая.
Лабораторный эксперимент
В четыре пробирки налейте по 2 мл раствора уксусной кислоты. В первую опустите гранулу цинка. Какой газ выделяется? Во вторую пробирку добавьте несколько крупинок оксида меди (II) и слегка нагрейте на пламени спиртовки. Что наблюдаете? В третью пробирку добавьте 2-3 капли лакмуса. Отметьте окраску раствора. По каплям добавляйте в пробирку раствор гидроксида натрия. Как изменилась окраска индикатора? В четвёртую пробирку опустите небольшой кусочек мрамора. Какой газ выделяется?
Ответ:
При опускании гранулы цинка в раствор уксусной кислоты, наблюдается выделение водорода:
Zn + 2CH3COOH ⟶ (CH3COO)2Zn + H2↑При добавлении нескольких крупинок оксида меди (II) в раствор уксусной кислоты, наблюдается их растворение, и окрашивание раствора в голубой цвет:
CuO + 2CH3COOH ⟶ (CH3COO)2Cu + H2OПри добавлении нескольких капель лакмуса в раствор уксусной кислоты, наблюдается его окрашивание в красный цвет. При постепенном добавлении к окрашенному раствору раствора гидроксида натрия, наблюдается изменение цвета с красного на фиолетовый, это связано с тем, что протекает реакция нейтрализации:
CH3COOH + NaOH ⟶ CH3COONa + H2OПри опускании небольшого кусочка мрамора наблюдается выделение углекислого газа:
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑ §16
-
§16. Сложные эфиры. Жиры.
1. Какие вещества называют сложными эфирами? Как можно записать общую формулу жиров? Можно ли говорить о гомологических рядах жиров?
Ответ:
Сложными эфирами называют производные карбоновых кислот, в которых атом водорода карбоксильной группы замещён углеводородным радикалом.
Общая формула жиров:
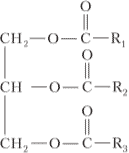
Говорить о гомологических рядах жиров нельзя потому, что в состав жиров могут входить как предельные так и непредельные производные карбоновых кислот.
2. Что такое жиры? Являются ли природные жиры индивидуальными химическими веществами?
Ответ:
Жиры – это сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.
Природные жиры представляют собой не индивидуальное вещество, а смесь различных жиров.
3. Как физические свойства жиров зависят от природы углеводородного радикала, входящего в кислотный остаток?
Ответ:
Жиры образованные остатками непредельных кислот, имеют жидкую консистенцию (исключение – твёрдое пальмовое масло). Жиры образованные остатками предельных кислот, имеют твёрдую консистенцию (исключение – рыбий жир).
4. Чему равна масса твёрдого мыла, полученного на основе 400 кг 40%-ного раствора гидроксида натрия и необходимого количества вещества тристеарата? Чему равно это количество?
Ответ:
Дано:
`m("р-ра") = 400" кг"`
`ω(NaOH) = 40%`
-------------------------
Решение
`C_3H_5(C_17H_35COO)_3 + 3NaOH = C_3H_5(OH)_3 + 3C_17H_35COONa`
`m(NaOH) = (ω(NaOH)*m("р-ра"))/100 = (40*400)/100 = 160" кг"`
`n(NaOH) = (m(NaOH))/(M(NaOH)) = 160/40 = 4" кмоль"`
`n(C_3H_5(C_17H_35COO)_3) = (n(NaOH))/3 = 4/3 = 1.33" кмоль"`
`n(C_17H_35COONa) = n(NaOH) = 4" кмоль"`
`m(C_17H_35COONa) = n(C_17H_35COONa)*M(C_17H_35COONa) = 4*306 = 1224" кг"`
Ответ: `n(C_3H_5(C_17H_35COO)_3) = 1.33" кмоль"`, `m(C_17H_35COONa) = 1224" кг"`.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: этиловый спирт ⟶ ацетальдегид ⟶ уксусная кислота ⟶ метиловый эфир уксусной кислоты ⟶ ацетат калия.
Ответ:
2C2H5OH + O2 t, кат. ⟶ 2CH3CHO + 2H2O
2CH3CHO + O2 t, кат. ⟶ 2CH3COOH
CH3COOH + CH3OH `overset(H⁺)(⇄)` CH3COOCH3 + H2O
CH3COOCH3 + KOH ⟶ CH3COOK + CH3OH
6. У какого из обитателей морей толщина подкожного жира достигает 1 м? У кого из морских млекопитающих самое жирное молоко (40% жира)? Объясните биологическую целесообразность данных явлений. В случае затруднения используйте Интернет.
Ответ:
У китов подкожный жировой слой может достигать 1 м, он выполняет несколько функций: защита от переохлаждения, удержания воды в организме, энергетического запаса, защиты от механического воздействия, обеспечение плавучести.
Самое жирное молоко из морских млекопитающих у дельфинов (40% жира). Благодаря такой большой жирности поверхностное натяжение молока в 30 раз больше, чем у воды, что особенно важно, учитывая кормление под водой (струя молока не расплывается в воде).
Лабораторный эксперимент
Налейте в пробирку 2 мл растительного масла и такой же объём бромной воды или подкисленного раствора перманганата калия. Какая из жидкостей имеет большую плотность? Встряхните содержимое пробирки. Что наблюдаете? Сделайте вывод.
Ответ:
Если использовали бромную воду.
При добавлении бромной воды в растительное масло, наблюдается всплывание масла на поверхность воды, т. к. масло имеет меньшую плотность, чем вода. После встряхивание пробирки наблюдается осветление бромной воды.
Вывод: растительное имеет в своём составе остатки непредельных карбоновых кислот.
Если использовали подкисленный раствор перманганата калия.
При добавлении подкисленного раствора перманганата калия в растительное масло, наблюдается всплывание масла на поверхность воды, т. к. масло имеет меньшую плотность, чем вода. После встряхивание пробирки наблюдается осветление бромной воды.
Вывод: растительное имеет в своём составе остатки непредельных карбоновых кислот.
Лабораторный эксперимент
В три пробирки налейте по 1 мл растительного масла. В первую добавьте 2 мл воды, во вторую – 2 мл этанола, в третью – 2 мл бензина (смесь предельных углеводородов). Встряхните содержимое пробирок. Что наблюдаете? Сделайте вывод.
Ответ:
Растительное масло всплывает на поверхность воды, в этаноле и бензине оно растворяется.
Вывод: растительное масло не растворяется в воде, но растворяется в органических растворителях.
§17
-
§17. Углеводы.
1. Какие вещества называют углеводами? Предложите признак, на основании которого этот тип веществ можно разделить на классы. Назовите эти классы и приведите примеры представителей каждого из них.
Ответ:
Углеводы – органические соединения, состоящие из одной или нескольких молекул простых сахаров (многоатомных альдегидо- или кетоноспиртов).
Углеводы, по числу сахаридов составляющих молекулу, можно разделить на три группы: моносахариды (глюкоза, фруктоза), дисахариды (сахароза, лактоза), полисахариды (крахмал, целлюлоза).
2. Почему глюкозу относят к соединениям с двойственной функцией? Ответ подтвердите уравнениями химических реакций.
Ответ:
Как многоатомный спирт, глюкоза вступает в качественную реакцию, характерную для этих соединений. Она способна реагировать с гидроксидами некоторых металлов, в частности с гидроксидом меди (II), с образованием растворимого соединения ярко-синего цвета.
Как альдегид, глюкоза вступает в качественные реакции, характерные для этого класса соединений. При нагревании глюкоза окисляется в соответствующую кислоту (её называют глюконовой) свежеприготовленным гидроксидом меди (II):
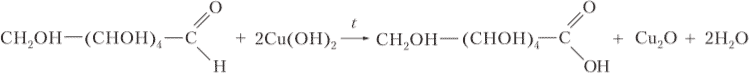
С аммиачным раствором оксида серебра при небольшом нагревании глюкоза даёт характерную для альдегидов реакцию серебряного зеркала:
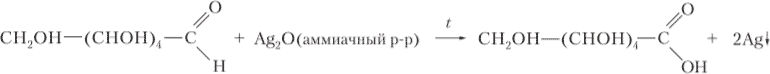
3. Какие вещества называют дисахаридами? Приведите примеры.
Ответ:
Дисахариды – углеводы, состоящие из двух остатков моносахаридов. Примеры: сахароза, лактоза, мальтоза.
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) крахмал ⟶ глюкоза ⟶ сорбит;
б) глюкоза ⟶ глюконовая кислота ⟶ глюконат кальция;
в) глюкоза ⟶ этиловый спирт ⟶ этиловый эфир уксусной кислоты.Ответ:
а)
(C6H10O5)n + nH2O фермент или кислота ⟶ nC6H12O6
б)
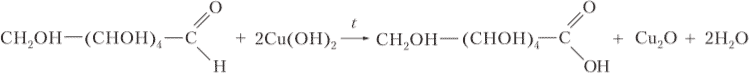
2CH2OH–(CHOH)4–COOH + Ca ⟶ (CH2OH–(CHOH)4–COO)2Ca + H2↑
в)
C6H12O6 дрожжи ⟶ 2C2H5OH + 2CO2↑
CH3COOH + C2H5OH `overset(H^+)(⇄)` CH3COOC2H5 + H2O
5. Сравните состав, строение, физические и химические свойства крахмала и целлюлозы.
Ответ:
Состав
Крахмал и целлюлоза состоят из полисахаридов, и имеют одинаковую молекулярную формулу `(C_6H_10O_5)_n`.
Строение
Степень полимеризации у крахмала меньше, чем у целлюлозы. Крахмал – полимер с разветвленными макромолекулами, а целлюлоза – полимер с линейными макромолекулами.
Физические свойства
Крахмал – порошок белого цвета, зёрна которого набухают в горячей воде с образованием крахмального клейстера.
Целлюлоза – порошок белого цвета, не растворимый в воде, не набухает даже в горячей воде.
Химические свойства
Для целлюлозы качественная реакция на крахмал отрицательная (не появляется ярко-синее окрашивание).
Крахмал и целлюлоза подвергаются гидролизу, однако целлюлоза значительно труднее подвергается гидролизу, чем крахмал.
`underset("крахмал")((C_6H_10O_5)_n) + nH_2O overset("фермент или кислота")(⟶) underset("глюкоза")(nC_6H_12O_6)`
`underset("целлюлоза")((C_6H_10O_5)_n) + nH_2O overset("фермент или кислота")(⟶) underset("глюкоза")(nC_6H_12O_6)`6. Рассчитайте объём углекислого газа (н. у.), который выделяется при спиртовом брожении 200 кг 9%-ного раствора глюкозы. Какая масса этилового спирта при этом получится?
Ответ:
Дано:
`m("р-ра") = 200" кг"`
`ω(C_6H_12O_6) = 9%`
---------------------------------
`V(CO_2) = ?`
`m(C_2H_5OH) = ?`
Решение
`C_6H_12O_6 overset("дрожжи")(⟶) 2C_2H_5OH + 2CO_2"↑"`
`m(C_6H_12O_6) = (ω(C_6H_12O_6)*m("р-ра"))/100 = (9*200)/100 = 18" кг"`
`n(C_6H_12O_6) = (m(C_6H_12O_6))/(M(C_6H_12O_6)) = 18/180 = 0.1" кмоль"`
`n(CO_2) = 2*n(C_6H_12O_6) = 2*0.1 = 0.2" кмоль"`
`V(CO_2) = n(CO_2)*V_m = 0.2*22.4 = 4.48 м^3`
`n(C_2H_5OH) = 2*n(C_6H_12O_6) = 2*0.1 = 0.2" кмоль"`
`m(C_2H_5OH) = n(C_2H_5OH)*M(C_2H_5OH) = 0.2*46 = 9.2" кг"`
Ответ: `V(CO_2) = 4.48 м^3`, `m(C_2H_5OH) = 9.2" кг"`.
7. Целлюлоза используется в пищевой промышленности как добавка, препятствующая слёживанию и комкованию порошкообразных продуктов (код E460). Под действием соляной кислоты в желудке человека примерно 5% целлюлозы гидролизуется. Какая масса глюкозы получится при гидролизе из 8,1 г полисахарида?
Ответ:
Дано:
`m("целлюлозы") = 8.1 г`
`η(C_6H_12O_6) = 5%`
-----------------------------
`m_("практ.")(C_6H_12O_6) = ?`
Решение
`(C_6H_10O_5)_n + nH_2O overset("кислота")(⟶) nC_6H_12O_6`
`n(C_6H_10O_5) = (m("целлюлозы"))/(M(C_6H_10O_5)) = 8.1/162 = 0.05" моль"`
`n_("теор.")(C_6H_12O_6) = n(C_6H_10O_5) = 0.05" моль"`
`m_("теор.")(C_6H_12O_6) = n_("теор.")(C_6H_12O_6)*M(C_6H_12O_6) = 0.05*180 = 9 г`
`m_("практ.")(C_6H_12O_6) = (η(C_6H_12O_6)*m_("теор.")(C_6H_12O_6))/100 = (5*9)/100 = 0.45 г`
Ответ: `m_("практ.")(C_6H_12O_6) = 0.45 г`.
Лабораторный эксперимент
К 2 мл аммиачного раствора оксида серебра добавьте 1-2 мл раствора глюкозы и осторожно круговыми движениями нагрейте стенки пробирки на пламени спиртовки. Что наблюдаете? Наличие какой функциональной группы позволяет обнаружить данный опыт?
Ответ:
С аммиачным раствором оксида серебра при небольшом нагревании глюкоза даёт характерную для альдегидов реакцию серебряного зеркала:
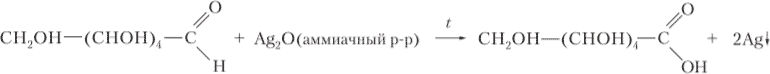
Лабораторный эксперимент
Налейте в пробирку 1 мл крахмального клейстера и добавьте 1-2 капли разбавленной водой иодной настойки. Что наблюдаете? Попробуйте обнаружить крахмал в картофеле, муке, хлебе, зёрнах бобовых, макаронных изделиях и других пищевых продуктах.
Ответ:
При добавлении иода в пробирку с крахмальным клейстером будет наблюдаться окрашивание раствора в синий цвет. Иод также окрашивает в синий цвет картофель, муку, хлеб, зёрна бобовых, макаронные изделия, это говорит о том, что в данных продуктах содержится крахмал.
§18
-
§18. Амины.
1. Какие вещества называют аминами? Как классифицируют амины по природе углеводородного радикала?
Ответ:
Аминами называют органические вещества, в молекулах которых углеводородный радикал связан с аминогруппой –NH2.
По природе углеводородного радикала амины различают на предельные и на ароматические.
2. Амины называют органическими основаниями. Почему? Напишите уравнения реакций подтверждающих эту характеристику. Сравните основные свойства аммиака, метиламина и анилина.
Ответ:
Амины называют органическими основаниями потому, что амины рассматривают как продукты замещения в молекуле аммиака атомов водорода аминогруппами. Логично предположить, что химические свойства, характерные для аммиака, будут характерны и для его органических производных. Аммиак характеризуется основными свойствами за счёт неподелённой электронной пары атома азота.
Основные свойства аминов подтверждаются тем, что они изменяют окраску индикаторов, указывающих на щелочной характер среды:
CH3NH2 + H2O ⇄ [CH3NH3]OH
[CH3NH3]OH ⇄ [CH3NH3]+ + OH-А также тем, что амины легко реагирует с кислотами:
CH3NH2 + HCl ⟶ [CH3NH3]ClАммиак является более сильным основанием, чем анилин, но более слабым, чем метиламин.
3. На примере молекулы анилина рассмотрите третье положение теории химического строения органических соединений о взаимном влиянии атомов в молекулах. Ответ подтвердите уравнениями химических реакций.
Ответ:
Третье положение теории строения органических соединений о взаимном влиянии атомов в молекулах подтверждается для анилина. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с метиламином и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин, в отличие от бензола, легко вступает в реакцию бромирования при добавлении бромной воды, при этом никакого катализатора не требуется, а бромирование протекает не по одному, а по трём атомам углерода цикла:
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: хлорметан ⟶ метанол ⟶ метиламин ⟶ бромид метиламмония.
Ответ:
CH3Cl + NaOH ⟶ CH3OH + NaCl
CH3OH + NH3 ⟶ CH3NH2 + H2O
CH3NH2 + HBr ⟶ [CH3NH3]Br
5. Смешали 10 л газообразного метиламина (н. у.) и 10 г хлороводорода. Какая масса кристаллического хлорида метиламмония при этом образовалась? Какой газ и в каком объёме остался в колбе после окончания реакции?
Ответ:
Дано:
`V(CH_3NH_2) = 10 л`
`m(HCl) = 10 г`
--------------------------
`m([CH_3NH_3]Cl) = ?`
`V_("непрореаг.")("газа") = ?`
Решение
`CH_3NH_2 + HCl = [CH_3NH_3]Cl`
`n(CH_3NH_2) = (V(CH_3NH_2))/V_m = 10/22.4 = 0.446" моль"`
`n(HCl) = (m(HCl))/(M(HCl)) = 10/36.5 = 0.274" моль"`
Метиламин находится в избытке.
`n_("прореаг.")(CH_3NH_2) = n(HCl) = 0.274" моль"`
`n_("непрореаг.")(CH_3NH_2) = n(CH_3NH_2) - n_("прореаг.")(CH_3NH_2) = 0.446 - 0.274 = 0.172" моль"`
`V_("непрореаг.")(CH_3NH_2) = n_("непрореаг.")(CH_3NH_2)*V_m = 0.172*22.4 = 3.85 л`
`n([CH_3NH_3]Cl) = n(HCl) = 0.274" моль"`
`m([CH_3NH_3]Cl) = n([CH_3NH_3]Cl)*M([CH_3NH_3]Cl) = 0.274*67.5 = 18.5 г`
Ответ: `V_("непрореаг.")(CH_3NH_2) = 3.85 л`, `m([CH_3NH_3]Cl) = 18.5 г`.
6. При сжигании органического вещества образовалось 1,26 г воды, 0,896 л оксида углерода (IV) и 0,224 л азота (н. у.). Найдите молекулярную формулу этого вещества.
Ответ:
Дано:
`m(H_2O) = 1.26 г`
`V(CO_2) = 0.896 л`
`V(N_2) = 0.224 л`
----------------------------
`"формула в-ва" - ?`
Решение
Допустим, что вещество не содержит кислород, тогда его формула `C_xH_yN_z`.
`n(H_2O) = (m(H_2O))/(M(H_2O)) = 1.26/18 = 0.07" моль"`
`n(H) = 2*n(H_2O) = 2*0.07 = 0.14" моль"`
`n(CO_2) = (V(CO_2))/V_m = 0.896/22.4 = 0.04" моль"`
`n(C) = n(CO_2) = 0.04" моль"`
`n(N_2) = (V(N_2))/V_m = 0.224/22.4 = 0.01" моль"`
`n(N) = 2*n(N_2) = 2*0.01 = 0.02" моль"`
`n(C)" ":" "n(H)" ":" "n(N) = 0.04" ":" "0.14" ":" "0.02`
`n(C)" ":" "n(H)" ":" "n(N) = 2" ":" "7" ":" "1`
Соответственно формула вещества `C_2H_7N`. Выполним проверку.
`4C_2H_7N + 15O_2 = 14H_2O + 8CO_2 + 2N_2`
Рассчитаем массу вещества, исходя из количества образовавшегося азота:
`n(C_2H_7N) = 2*n(N_2) = 2*0.01 = 0.02" моль"`
`m(C_2H_7N) = n(C_2H_7N)*M(C_2H_7N) = 0.02*45 = 0.9 г`
Рассчитаем массу вещества, исходя из количества вещества углерода, водорода и кислорода:
`m(C) = n(C)*M(C) = 0.04*12 = 0.48 г`
`m(H) = n(H)*M(H) = 0.14*1 = 0.14 г`
`m(N) = n(N)*M(N) = 0.02*14 = 0.28 г`
`m(C_2H_7N) = m(C) + m(H) + m(N) = 0.48 + 0.14 + 0.28 = 0.9 г`
Рассчитанные массы равны, соответственно вещество не содержало кислорода.
Ответ: формула вещества `C_2H_7N`.
7. Создайте компьютерные 3D-модели молекул метиламина и анилина. Рассмотрите взаимное расположение атомов и атомных групп относительно атома азота.
Ответ:
§19
-
§19. Аминокислоты. Белки.
1. Какие органические вещества называют аминокислотами? Приведите примеры формул и названий таких соединений. Почему их относят к амфотерным органическим соединениям?
Ответ:
Аминокислотами называют органические вещества, содержащие в молекуле карбоксильную группу –COOH и аминогруппу –NH2.
Примеры:
аминоуксусная кислота H2N–CH2–COOH.
аминопропионовая кислота CH3–CH(NH2)–COOH.Аминокислоты относят к амфотерным органическим соединениям потому, что они могут проявлять как кислотные свойства, обусловленные карбоксильной группой –COOH, так и основные свойства, обусловленные аминогруппой –NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
H2N–CH2–COOH + NaOH ⟶ H2N–CH2–COONa + H2O:
H2N–CH2–COOH + HCl ⟶ [H3N–CH2–COOH]Cl2. Какие природные биополимеры называют белками?
Ответ:
Белки – это природные полимеры, образованные остатками аминокислот, связанными между собой пептидными связями.
3. Опишите качественные реакции на белки.
Ответ:
Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовлениого осадка гидроксида меди (II). Эту пробу называют биуретовой реакцией.
При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым. Эту реакцию называют называют ксантопротенновой.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.
4. Что называют денатурацией белка? Какие факторы могут её вызвать?
Ответ:
Денатурация – нарушение структуры белка. Она может быть вызвана нагреванием или действием химических реагентов.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: глюкоза ⟶ этиловый спирт ⟶ уксусный альдегид ⟶ уксусная кислота ⟶ хлоруксусная кислота ⟶ аминоуксусная кислота ⟶ дипептид аминоуксусной кислоты.
Ответ:
C6H12O6 дрожжи ⟶ 2C2H5OH + 2CO2↑
2C2H5OH + O2 t, кат. ⟶ 2CH3CHO + 2H2O
2CH3CHO + O2 t, кат. ⟶ 2CH3COOH
CH3COOH + Cl2 кат. ⟶ CH2ClCOOH + HCl
CH2ClCOOH + 2NH3 ⟶ H2N–CH2–COOH + NH4Cl
H2N–CH2–COOH + H2N–CH2–COOH ⟶ H2N–CH2–CO–NH–CH2–COOH + H2O
6. В медицине для улучшения обменных процессов в центральной нервной системе применяют глицин в таблетках. Рассчитайте количество вещества глицина, содержащегося в одной таблетке массой 0,15 г, если известно, что в качестве вспомогательных веществ каждая таблетка содержит также 1% стеарата магния и 1% метилцеллюлозы.
Ответ:
Дано:
`m("таблетки") = 0.15 г`
`ω("стеарата магния") = 1%`
`ω("метилцеллюлозы") = 1%`
-----------------------------------
`n(NH_2CH_2COOH) = ?`
Решение
`ω(NH_2CH_2COOH) = 100 - ω("стеарата магния") - ω("метилцеллюлозы") = 100 - 1 - 1 = 98%`
`m(NH_2CH_2COOH) = (ω(NH_2CH_2COOH)*m("таблетки"))/100 = (98*0.15)/100 = 0.147 г`
`n(NH_2CH_2COOH) = (m(NH_2CH_2COOH))/(M(NH_2CH_2COOH)) = 0.147/75 = 0.00196" моль" = 1.96" ммоль"`
Ответ: `n(NH_2CH_2COOH) = 1.96" ммоль"`.
7. В двух пробирках находятся растворы глюкозы и белка. Как с помощью одного и того же реактива различить их?
Ответ:
Различить растворы глюкозы и белка можно с помощью свежеприготовленного осадка гидроксида меди (II). Под его действием белки (в щелочной среде) дают фиолетовое окрашивание, а глюкоза образовывает с ним растворимое соединение ярко-синего цвета.
8. Какую биологическую роль играют белки в организме? При ответе используйте не только материал параграфа, но и знания, полученные на уроках биологии.
Ответ:
Функции белков в организме:
- каталитическая;
- структурная;
- защитная;
- регуляторная;
- сигнальная;
- транспортная;
- запасная (резервная);
- рецепторная;
- двигательная.
§20
-
§20. Генетическая связь между классами органических соединений.
1. Что такое генетическая связь между классами органических соединений? В чём она проявляется?
Ответ:
Генетическая связь между классами органических соединений – это возможность получения соединений одного класса веществ из соединений другого класса.
Генетическая связь проявляется в цепочках превращений.
2. Что такое цепь превращений? Как определить число реакций в предложенной цепи превращений?
Ответ:
Цепь превращений – это последовательность химических реакций, в результате которых одни вещества превращаются в другие, которые объединяет одинаковое число атомов углерода в молекуле.
Определить число реакций в цепи можно по числу звеньев.
3. Запишите уравнения химических реакций, иллюстрирующих генетические связи между классами органических соединений:
а) пропанол-1 ⟶ пропаналь ⟶ пропановая кислота ⟶ 2-хлорпропановая кислота ⟶ 2-аминопропановая кислота (аланин) ⟶ дипептид;
б) н-бутан ⟶ бутадиен-1,3 ⟶ бутен-2 ⟶ н-бутан ⟶ этан ⟶ этилен ⟶ ацетилен ⟶ бензол;
в) метиловый спирт ⟶ формальдегид ⟶ муравьиная кислота ⟶ этиловый эфир муравьиной кислоты ⟶ этиловый спирт ⟶ этилен ⟶ хлорэтан.Ответ:
а)
2CH3–CH2–CH2OH + O2 t, кат. ⟶ 2CH3–CH2–CHO + 2H2O
2CH3–CH2–CHO + O2 кат. ⟶ 2CH3–CH2–COOH
CH3–CH2–COOH + Cl2 кат. ⟶ CH3–CHCl–COOH + HCl
CH3–CHCl–COOH + 2NH3 ⟶ H2N–CH(CH3)–COOH + NH4Cl
H2N–CH(CH3)–COOH + H2N–CH(CH3)–COOH ⟶ H2N–CH(CH3)–CO–NH–CH(CH3)–COOH + H2O
б)
CH3–CH2–CH2–CH3 t, кат. ⟶ CH2=CH–CH=CH2 + 2H2
CH2=CH–CH=CH2 + H2 t, p, кат. ⟶ CH3–CH=CH–CH3
CH3–CH=CH–CH3 + H2 t, p, кат. ⟶ CH3–CH2–CH2–CH3
CH3–CH2–CH2–CH3 t, p, кат. ⟶ CH3–CH3 + CH2=CH2
CH3–CH3 t ⟶ CH2=CH2 + H2
CH2=CH2 t ⟶ CH≡CH + H2
3CH≡CH t, кат. ⟶ C6H6
в)
2CH3OH + O2 t, кат. ⟶ HCHO + 2H2O
2HCHO + O2 кат. ⟶ 2HCOOH
HCOOH + C2H5OH `overset(H^+)(⇄)` HCOOC2H5
HCOOC2H5 `overset(H^+)(⇄)` HCOOH + C2H5OH
C2H5OH `overset(t," "H_2SO_(4"(конц.)"))(⟶)` CH2=CH2↑ + H2O
CH2=CH2 + HCl ⟶ CH3–CH2Cl
4. Запишите уравнения реакций, с помощью которых можно получить анилин из метана. Укажите условия проведения реакций. Назовите промежуточные вещества. Сколько звеньев в предложенной вами цепи превращений?
Ответ:
Метан ⟶ ацетилен ⟶ бензол ⟶ нитробензол ⟶ анилин. Цепочка превращений состоит из четырёх звеньев.
2CH4 t ⟶ HC≡CH + 3H2
3HC≡CH t, кат. ⟶ C6H6
C6H6 + HNO3 H₂SO₄(конц.) ⟶ C6H5NO2 + H2O
C6H5NO2 + 6[H] ⟶ C6H5NH2 + 2H2O
Лабораторный эксперимент
Налейте в пробирку 2 мл раствора куриного белка, добавьте 2 мл 5-10%-ного раствора щёлочи и несколько капель раствора сульфата меди (II). Что наблюдаете?
Ответ:
При добавлении раствора щёлочи и нескольких капель раствора сульфата меди (II) к раствору белка, наблюдается фиолетовое окрашивание раствора.
Лабораторный эксперимент
Налейте в пробирку 2 мл раствора куриного белка, добавьте несколько капель азотной кислоты. Что наблюдаете? Нагрейте содержимое пробирки. Какие произошли изменения? Охладите смесь и добавьте 2 мл водного раствора аммиака. Что наблюдаете?
Ответ:
При добавлении концентрированной азотной кислоты к раствору белка и последующем нагревании, наблюдается образование белого осадка.
После охлаждения смеси и добавления к ней раствора аммиака, наблюдается оранжевое окрашивание.
Лабораторный эксперимент
Подожгите 2-3 шерстяные нити. Охарактеризуйте запах горящей шерсти.
Ответ:
При поджигании шерсти чувствуется запах жжёного рога.
Вывод: шерсть имеет в своём составе серосодержащие белки.
Лабораторный эксперимент
Налейте в пробирку 2 мл раствора куриного белка и добавьте 5-6 капель этилового спирта. Что наблюдаете? Как называют этот процесс?
Ответ:
При добавлении этилового спирта к раствору куриного белка, наблюдается помутнение раствора. Этот процесс называется денатурацией.
Практическая работа №1. Идентификация органических соединений.
1 вариант
1) Проведите реакции, характерные для глюкозы, используя в качестве реактива одно химическое соединение. Опишите условия проведения и признаки реакций, составьте их уравнения. Сделайте вывод.
2) Используя один и тот же реактив, экспериментально распознайте выданные вам в пронумерованных пробирках без этикеток вещества: раствор формальдегида и глицерина. Опишите условия проведения и признаки реакций, составьте их уравнения. Сделайте вывод.
2 вариант
1) Проведите реакции, характерные для белков. Опишите условия проведения и признаки реакций. Сделайте вывод.
2) Экспериментально распознайте выданные вам в пронумерованных пробирках без этикеток вещества: крахмальный клейстер и глицерин. Опишите условия проведения и признаки реакций. Сделайте вывод.
3 вариант
1) Проведите реакции, характеризующие химические свойства уксусной кислоты. Опишите условия проведения и признаки реакций, составьте их уравнения. Сделайте вывод.
2) Экспериментально распознайте выданные вам в пронумерованных пробирках без этикеток вещества: растительное и машинное масла. Опишите условия проведения и признаки реакций. Сделайте вывод.
4 вариант
1) Предложите и экспериментально подтвердите способы распознавания степени спелости яблок. Предположите, как созревает яблоко: от центра к краю или наоборот. Докажите своё предположение экспериментально.
2) Экспериментально распознайте выданные вам в пронумерованных пробирках без этикеток вещества: растворы сахарозы и глюкозы. Опишите условия проведения и признаки реакций. Сделайте вывод.
Ответ:
1 вариант
1)
При н. у. глюкоза вступает в реакцию со свежеосаждённым гидроксидом меди (II), при этом образуется растворимое соединение ярко-синего цвета. В данной реакции глюкоза ведёт себя как многоатомный спирт.
При нагревании глюкоза окисляется в глюконовую кислоту свежеприготовленным гидроксидом меди (II). В данной реакции глюкоза ведёт себя как альдегид.
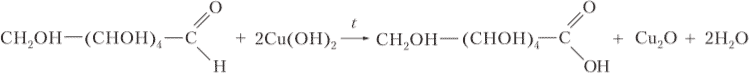
Вывод: в зависимость от условий протекания реакции глюкоза проявляет свойства присущие многоатомным спиртам или альдегидам.
2)
Формальдегид при нагревании в щелочной среде вступает во взаимодействие со свежеосаждённым гидроксидом меди (II), при этом голубой цвет осадка изменяется на кирпично-красный в результате образования оксида меди (I).
HCHO + 2Cu(OH)2 t, NaOH ⟶ HCOOH + 2Cu2O + H2O
Глицерин вступает во взаимодействие со свежеосаждённым гидроксидом меди (II) в щелочной среде, при этом образуется растворимое соединение, которое окрашивает раствор в ярко-синий цвет.

Вывод: альдегиды при нагревании и многоатомные спирты при комнатной температуре вступают во взаимодействие со свежеосаждённым гидроксидом меди (II) в щелочной среде, при этом с альдегидами наблюдается изменение окраски осадка на кирпично-красный, а с многоатомными спиртам наблюдается растворение осадка и окрашивание раствора в ярко-синий цвет.
2 вариант
1)
Раствор белков под действием свежеприготовленного осадка гидроксида меди (II) в щелочной среде даёт фиолетовое окрашивание.
При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Вывод: качественными реакциям на белки является их взаимодействие со свежеприготовленным осадком гидроксида меди (II) (фиолетовое окрашивание), и взаимодействие с концентрированной азотной кислотой (желтое окрашивание) и последующим добавлении раствора аммиака (оранжевое окрашивание).
2)
В пробирки с крахмальным клейстером и глицерином добавим по 2-3 капли раствора йода. В пробирке с крахмальным клейстером будет наблюдаться окрашивание раствора в синий цвет, а в пробирке с глицерином видимых изменений наблюдаться не будет.
Вывод: качественной реакцией на крахмал является его взаимодействие с йодом – наблюдается интенсивное синее окрашивание.
3 вариант
1) Химические свойства уксусной кислоты
Здесь у вас могут быть свои реакции!
Реагирует с активными металлами с образованием ацетатов и выделением водорода:
Zn + 2CH3COOH ⟶ (CH3COO)2Zn + H2↑Реагирует с оксидами металлов с образованием ацетатов и воды:
ZnO + 2CH3COOH ⟶ (CH3COO)2Zn + H2OРеагирует с основаниями с образованием ацетатов и воды:
Zn(OH)2 + 2CH3COOH ⟶ (CH3COO)2Zn + 2H2OРеагирует с карбонатом кальция, с образованием газа:
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑Сгорает в воздухе:
CH3COOH + 2O2 ⟶ 2H2O + 2CO2В присутствии концентрированной серной кислоты вступает во взаимодействие со спиртами, с образованием сложных эфиров:
CH3COOH + C2H5OH `overset(H_2SO_(4"(конц.)"))(⇄)` CH3COOC2H5 + H2OВывод: уксусная кислота проявляет свойства неорганических кислот, а также проявляет свойства присущие только карбоновым кислотам (реакция горения и реакция этерификации).
2)
Машинное масло состоит из предельных углеводородов, а растительное имеет в своём составе остатки непредельных карбоновых кислот. Значит различить эти два масла можно с помощью бромной воды, при её добавлении в пробирку с растительным маслом будет наблюдаться обесцвечивание бромной воды, а пробирке с мамашиным изменений не произойдёт.
Вывод: растительные масла содержат двойные связи.
4 вариант
1)
Чем больше спелось у яблока, тем больше оно содержит глюкозы. К раствору яблочного сока добавим свежеприготовленный осадок гидроксида меди (II), чем ярче будет окрашивание раствора в синий цвет, тем больше степень спелости яблока.
2)
Распознать растворы глюкозы и сахарозы можно с помощью аммиачного раствора оксида серебра. В пробирке с глюкозой будет наблюдаться восстановление серебра из оксида серебра (реакция серебряного зеркала):
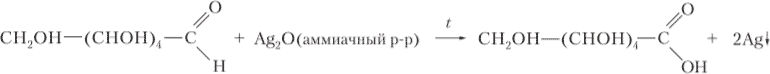
В пробирке с сахарозой видимых изменений наблюдаться не будет.
Вывод: глюкоза проявляет альдегидные свойства.
§21
-
Глава IV. Органическая химия и общество.
§21. Биотехнология.
1. Что такое биотехнология? Почему её так называют?
Ответ:
Биотехнология – наука, изучающая использование живых организмов и биологических процессов в производстве.
В 1917 г венгерский учёный Карл Эреки ввёл термин "биотехнология" для обозначения производства необходимых обществу веществ с помощью живых микроорганизмов, используемых в качестве биореакторов.
2. Какие процессы относят к традиционным биотехнологиям?
Ответ:
Процессы относящиеся к традиционным биотехнологиям: хлебопечение (использование дрожжей в качестве разрыхлителя теста), виноделие (брожение виноградного сока вызывает особый грибок, живущий на кожице винограда), получения молочных продуктов, в том числе сыроварения (молочнокислые бактерии), и д. р.
3. Чем различаются аэробная и анаэробная очистка сточных вод?
Ответ:
Аэробная очистка сточных вод протекает в присутствии растворённого в воде кислорода, а анаэробная протекает без участия кислорода. Аэробная очистка необходима для окисления органические вещества, и для осаждения загрязняющих частиц. Анаэробная биологическая очистка эффективна при больших концентрациях загрязняющих веществ.
4. Что представляет собой генная инженерия?
Ответ:
Генная инженерия – это совокупность методов и технологий выделения генов из организма, введения их в другие организмы, а также конструирования новых, не существующих в природе генов.
5. Что такое клеточная инженерия? Каких успехов она достигла?
Ответ:
Клеточная инженерия – это методы конструирования клеток нового типа.
Благодаря клеточной инженерии, в настоящее время, выращивают микрорастения, их получают путём клонирования одной-единственной растительной клетки, такой посадочный материал генетически совершенно одинаков и не заражён вирусами. Также клоны клеток применяют как своеобразные химические заводы для получения биологически активных веществ: эритропоэтина, инсулина, средств для предотвращения тромбообразования в кровеносной системе.
6. Сравните биотехнологию и химическую технологию.
Ответ:
В основе химической технологии лежит создание новых материалов или усовершенствование уже известных с помощью химических законов, а в основе биотехнологии лежит использование живых организмов и биологических процессов в производстве.
§22
-
§22. Классификация полимеров. Искусственные полимеры.
1. Что такое полимеры? Как их классифицируют по происхождению?
Ответ:
Полимеры – высокомолекулярные вещества состоящие из большого числа звеньев, имеющих одинаковое строение.
По происхождению полимеры делятся на природные, искусственные и синтетические.
2. Какие полимеры называют искусственными? Чем они отличаются от природных?
Ответ:
Искусственными полимерами называют высокомолекулярные вещества, которые получают на основе природных полимеров путём их химической модификации.
Искусственные полимеры отличаются от природных химическим составом и/или структурой.
3. В чём различие полимера и пластмассы? Какой из этих двух материалов можно назвать композиционным?
Ответ:
Полимер это высокомолекулярное чистое вещество, а пластмасса это смесь полимера с различными добавками. То есть пластмасса является композиционным материалом.
4. Что такое волокна? Приведите примеры искусственных волокон, опишите их свойства, применение и получение.
Ответ:
Волокна – это полимеры линейного строения, которые пригодны для изготовления нитей, жгутов, пряжи и текстильных материалов.
Примеры искусственных волокон.
- Ацетатный шёлк. Получают путём обработки целлюлозы уксусной кислотой, получившийся триацетат целлюлозы вытягивают в нити. Свойства: прочность, лёгкая окрашиваемость, дешевизна, экологичность и гигиеничность. Применяют для производства нитей и нетканых материалов.
- Вискоза. Свойства: впитывает влагу, мягкая на ощупь, хорошая воздухопроницаемость, высокая интенсивность цвета, не электризуется, дешевизна, ещё более экологична, чем ацетатный шёлк. Применяют для производства нитей, нетканых материалов и целлофана.
5. На упаковках с нитроцеллюлозным клеем имеется предупреждение о соблюдении мер пожарной безопасности при работе с ним. Объясните, с чем это связано.
Ответ:
На упаковках с нитроцеллюлозным клеем имеется предупреждение о соблюдении мер пожарной безопасности при работе с ним, так как в состав данного клея входят нитроцеллюлоза и растворители, которые являются легковоспламеняющимися и быстросгорающими веществами.
§23
-
§23. Синтетические полимеры.
1. Назовите известные вам пластмассы, запишите реакции их получения и охарактеризуйте области их применения. Для полноты ответа воспользуйтесь возможностями Интернета.
Ответ:
Тефлон
Получают путём полимеризации тетрафторэтилена:
nCF2=CF2 ⟶ (–CF2–CF2–)nПрименяют в химической, электротехнической и пищевой промышленности, для производства мембранной одежды, в медицине, в транспортных средствах, в военных целях, в производстве посуды с противопригарным покрытием.
Полиэтилен
Получают путём полимеризации этилена:
nCH2=CH2 ⟶ (–CH2–CH2–)nПрименяют для производства тары, плёнки, упаковки, труб, брони, утеплителей и т. д.
Поливинилхлорид
Получают путём полимеризации хлорэтилена:
nCH2=CHCl ⟶ (–CH2–CHCl–)nПрименяют для производства электроизоляции, производства листов, труб, плёнок, плёнок для натяжных потолков, искусственных кож, поливинилхлоридного волокна, пенополивинилхлорида, линолеума, грязезащитных ковриков, обувных пластикатов, мебельной кромки и т. д.
Полиэтилентерефталат
Получают полиэтилентерефталат путём полимеризации из этиленгликоля и терефталевой кислоты:
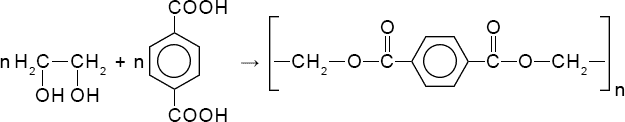
Используют главным образом для изготовления пластиковых ёмкостей.
2. Назовите синтетические волокна, запишите реакции их получения и охарактеризуйте области их применения. Для полноты ответа воспользуйтесь возможностями Интернета.
Ответ:
Капрон
Получают путём поликонденсации аминокапроновой кислоты:
nH2N–CH2–CH2–CH2–CH2–CH2–COOH ⟶ (–HN–CH2–CH2–CH2–CH2–CH2–CO–)n + nH2OИз капрона изготавливают канаты, рыболовные сети, леску, гитарные струны, фильтровальные материалы, чулки и другие бытовые товары.
3. Сравните реакции полимеризации и поликонденсации. Приведите примеры реакций обоих типов.
Ответ:
В реакции поликонденсации, в отличии от реакции полимеризации, помимо полимера образуется низкомолекулярное вещество, чаще всего вода.
Реакция полимеризации этилена:
nCH2=CH2 ⟶ (–CH2–CH2–)nРеакция поликонденсации аминокапроновой кислоты:
nH2N–CH2–CH2–CH2–CH2–CH2–COOH ⟶ (–HN–CH2–CH2–CH2–CH2–CH2–CO–)n + nH2O4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH4 ⟶ HC≡CH ⟶ CH2=CHCl ⟶ (–CH2–CHCl–)nОтвет:
CH4 t ⟶ HC≡CH + 3H2
HC≡CH + HCl ⟶ CH2=CHCl
nCH2=CHCl ⟶ (–CH2–CHCl–)n
5. Какую массу бутадиена-1,З можно получить каталитическим дегидрированием 1000 м3 бутана (н. у.)?
Ответ:
Дано:
`V(C_4H_10) = 1000 м^3`
----------------------------------
`m(C_4H_6) = ?`
Решение
`CH_3-CH_2-CH_2-CH_3 overset("t," "кат.")(⟶) CH_2=CH-CH=CH_2 + 2H_2`
`n(C_4H_10) = (V(C_4H_10))/V_m = 1000/22.4 = 44.6" кмоль"`
`n(C_4H_6) = n(C_4H_10) = 44.6" кмоль"`
`m(C_4H_6) = n(C_4H_6)*M(C_4H_6) = 44.6*54 = 2410" кг" = 2.41 т`
Ответ: `m(C_4H_6) = 2.41 т`.
6. Перед вами формулы шести органических веществ:
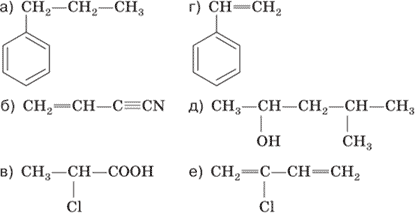
Как вы думаете, какие из них способны к реакциям полимеризации?
Ответ:
Ответ: б, г, е.






