 В этой статье нашего сайта с ответами к домашним работам будет представлена информация по учебнику химии за 7 класс авторов Габриелян, Остроумов. В самом начале нам хотелось бы сказать буквально пару слов о школьном предмете химия, а дальше и об ответах к нашему конкретному учебнику.
В этой статье нашего сайта с ответами к домашним работам будет представлена информация по учебнику химии за 7 класс авторов Габриелян, Остроумов. В самом начале нам хотелось бы сказать буквально пару слов о школьном предмете химия, а дальше и об ответах к нашему конкретному учебнику.
Итак, если немного поговорить о химии, то становится понятно, что предмет этот буквально волшебный. Ведь он объясняет и то, что порой вызывает настоящее удивление. Как при смешивании жидкостей получаются новые вещества с весьма нетривиальными свойствами, как жидкости меняют цвет и свое стабильное состояние. Он порой объясняет даже не столько наглядные примеры, а именно принцип протекания химических реакций, который скрыт от нашего взгляда. Это пожалуй куда важнее и более значимо.
Так вот, это все к тому, что у кого-то вполне возможно проснется естественное желание изучать химию, а значит возникнут и вопросы. И вот чтобы ответить на эти вопросы к домашним заданиям, то есть получить ответы на них, так называемые ГДЗ, мы как раз и создали нашу страничку.
Далее как раз можно будет ознакомиться с ответами к учебнику химии за 7 класс
Ответы к учебнику химии 7 класс Габриелян:
Кликайте по номерам параграфов, чтобы увидеть ответы на вопросы и лабораторные работы.
§1
-
ГЛАВА I. ХИМИЯ В ЦЕНТРЕ ЕСТЕСТВОЗНАНИЯ
§1. Химия как часть естествознания. Предмет химии.
Вопросы
1. Какие учебные предметы относятся к естественно−научным?
Ответ:
Биология, география, астрономия, экология, геология, химия.
2. Приведите примеры положительного воздействия человека на окружающую среду.
Ответ:
Примерами положительного воздействия человека на окружающую среду является:
1. Рациональное использование природных ресурсов.
2. Разработка и установка очистительных сооружений.
3. Раздельный сбор и переработка мусора.
4. Внедрение безотходных технологий производства.
5. Создание заповедников, заказников.
6. Воспроизводство лесов.3. Приведите примеры отрицательного воздействия человека на природу.
Ответ:
Примерами отрицательного воздействия человека на природу являются:
1. Вырубка лесов.
2. Загрязнение воды.
3. Отравление промышленными выбросами атмосферы и почвы.
4. Уничтожение растений и животных.
5. Нерациональное использование природных ресурсов.4. Что изучает химия?
Ответ:
Химия изучает вещества, их строение, свойства и превращения одних веществ в другие.
5. Из следующего перечня названий выпишите отдельно тела и вещества: снежинка, капля росы, вода, льдинка, сахар−песок, кусочек сахара, мел, школьный мелок. Сколько тел и сколько веществ названо в этом списке?
Ответ:
Тела: снежинка, капля росы, льдинка, кусочек сахара, школьный мелок.
Вещества: вода, сахар−песок, мел.
Тел в списке названо пять, веществ в списке три.6. Сравните свойства веществ (т.е. установите сходство и различие между ними):
а) углекислого газа и кислорода;
б) азота и углекислого газа;
в) сахара и соли;
г) уксусной и лимонной кислоты.Ответ:
а) Кислород и углекислый газ
Сходства: газообразные вещества, без запаха, без цвета, тяжелее воздуха
Различия: кислород поддерживает горение, поддерживает дыхание, углекислый газ не поддерживает горение и дыхание; углекислый газ тяжелее кислорода; кислород состоит из одного химического элемента, углекислый газ из двух химических элементов.
б) Азот и углекислый газ
Сходства: газообразные вещества без цвета, без запаха; не поддерживают горение и дыхание.
Различия: азот состоит из одного химического элемента, углекислый газ из двух химических элементов; азот не растворим в воде, углекислый газ растворим; углекислый газ тяжелее азота.
в) Сахар и соль
Сходства: твердые бесцветные кристаллы, хорошо растворимы в воде, без запаха, хрупкие, имеют вкус.
Различия: соль на вкус соленая, сахар − сладкий; сахар горюч, соль нет.
г) Уксусная и лимонная кислота
Сходства: на вкус кислые, бесцветные, хорошо растворимы в воде.
Различия: уксусная кислота − жидкость с резким запахом, лимонная кислота − кристаллический порошок, без запаха.7. Какие свойства алюминия лежат в основе его применения (см. рис.5)
Рис.5 - Области применения алюминия, обусловленные его свойствамиОтвет:
В основе применения алюминия лежат следующие физические свойства:
1. Агрегатное состояние (транспорт)
2. Теплопроводность (пищевая фольга, посуда)
3. Электропроводность (ЛЭП) §2
-
§2. Наблюдение и эксперимент как методы изучения естествознания и химии
Вопросы
1. Что такое наблюдение? Какие условия необходимо соблюдать, чтобы наблюдение было результативным?
Ответ:
Наблюдение — это концентрация внимания на познаваемых объектах с целью их изучения.
Для того чтобы наблюдение было результативным, необходимо выполнить ряд условий:
1) чётко определить предмет наблюдения, т.е. то, на что будет обращено внимание наблюдателя, − конкретное вещество, его свойства или превращение одних веществ в другие, условия осуществления этих превращений и т.д.;
2) сформулировать цель наблюдения − наблюдатель должен знать, за чем он проводит наблюдение;
3) составить план наблюдения, чтобы достигнуть поставленной цели.2. Чем различаются гипотеза и вывод?
Ответ:
Гипотеза − это предположение о том, как будет происходить наблюдаемое явление.
Вывод − это результаты наблюдения, которые подтверждают или опровергают гипотезу.3. Что такое эксперимент?
Ответ:
Эксперимент — научное воспроизведение какого−либо явления с целью его исследования, испытания в определённых условиях.
Например: Эксперимент "Невидимые чернила"
Подготовка и проведение: Отварить рис, слить воду в ёмкость, обмакнуть в него кисточку и написать что−нибудь на бумаге. Дать бумаге высохнуть: слова по−прежнему не видны.
Эффект: Обмакиваем ватный диск в йод и проводим им по бумаге с надписью — и видим, как крахмальные буквы синеют. Это — результат химической реакции между йодом и крахмалом.4. Какое строение имеет пламя?
Ответ:
Рассмотрим строение пламени.
Оно неоднородно по цвету, имеет три зоны (рис.7). Тёмная зона (1) находится в нижней части пламени. Она самая холодная по сравнению с другими. Тёмную зону окаймляет яркая часть пламени (2), температура которой выше, чем в тёмной зоне. Однако самая высокая температура — в верхней бесцветной части пламени (зона 3).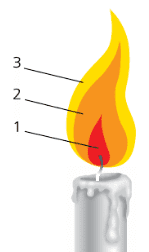
Рис. 7. Строение пламени свечи5. Как следует проводить нагревание?
Ответ:
Нагревание следует проводить в верхней, самой горячей части пламени (зона под цифрой 3).
6. Какое лабораторное оборудование вы применяли при изучении биологии и географии?
Ответ:
При изучении биологии мы использовали: микроскопы, пинцеты, лупы, покровные стёкла, готовые препараты.
При изучении географии мы использовали: компасы, карты, планшеты, барометры, термометры.7. Какое лабораторное оборудование используется при изучении химии?
Ответ:
При изучении химии используются: горелки, спиртовки, весы, лабораторная посуда (пипетки, пробирки, колбы), реактивы.
Практическая работа №21
Наблюдение за горящей свечой. Устройство и работа спиртовки
I. Опишите внешний вид свечи, вещество, из которого она изготовлена (цвет, запах, твёрдость), фитиль.
II.Зажгите свечу. Опишите внешний вид и строение пламени и ответьте на следующие вопросы:
1.Что происходит с материалом свечи при горении фитиля?
2. Как выглядит фитиль в процессе горения?
3. Нагревается ли свеча, слышен ли звук при горении, выделяется ли тепло?
4. Что происходит с пламенем, если появляется движение воздуха?
5. Как быстро сгорает свеча?
6. Изменяется ли длина фитиля в процессе горения?
7. Что представляет собой жидкость у основания фитиля? Что с ней происходит, когда она поглощается материалом фитиля, и что с ней происходит, когда её капли стекают вниз по свече?Ответ:
I. Свеча состоит из твердого парафина или воска, обычно белого цвета. Запах или отсутствует, или присутствует очень слабый. Внутри находится фитиль. Фитиль представляет собой туго сплетенную нить или толстое волокно.
II. При помощи спичек зажигаем фитиль свечи и наблюдаем за ее горением.
1) При горении свечи наблюдаем плавление парафина. Пламя свечи имеет конусовидную форму, вверху оно ярче, чем внизу, поэтому пламя имеет разные температурные участки.
2) Фитиль во время горения обугливается.
3) При горении свеча не нагревается, выделяется тепло, горение происходит без особых потрескиваний.
4) При движении воздуха, пламя отклоняется в сторону его направления движения.
5) Свеча сгорает не быстро, скорость сгорания свечи зависит от ее размеров, материалов, из которого она изготовлена.
6) Фитиль во время горения укорачивается, часть его обугливается.
7) Жидкость у основания фитиля представляет собой расплавленный парафин. Парафин не горит, часть его стекает по стержню вниз и застывает на стержне, а часть кипит возле фитиля и подтекает к нему, не давая свече быстро сгореть. §3
-
§3. Моделирование
Вопросы
1. Что такое модель; моделирование?
Ответ:
Модель − это объект−заместитель объекта оригинала, инструмент, с помощью которого исследователь изучает некоторые свойства оригинала.
Моделирование − это исследование каких‑либо реально существующих предметов, явлений и конструируемых объектов путём построения и изучения их моделей.2. Приведите примеры:
а) географических моделей;
б) физических моделей;
в) биологических моделей.Ответ:
Географические модели: географическая карта, глобус
Физические модели: материальная точка, математический маятник
Биологические модели: скелет, муляжи органов человека и животных.3. Какие модели используют в химии?
Ответ:
Условно Химические модели можно разделить на две группы: ПРЕДМЕТНЫЕ:
• Модели атома
• Модели молекул
• Модели кристаллов
• Модели химических и промышленных аппаратов и установок
ЗНАКОВЫЕ:
• Символы элементов
• Формулы веществ
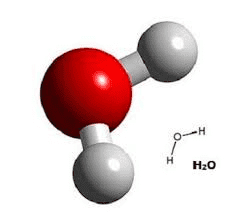
• Уравнения реакций и т.д.4. Изготовьте из пластилина шаростержневые и объёмные модели молекулы воды. Какую форму имеют эти молекулы?
Ответ:
Молекулы воды имеют форму тупоугольного треугольника.
5. Запишите формулу цветка крестоцветных, если вы изучали это семейство растений на уроках биологии. Можно ли назвать эту формулу моделью?
Ответ:
Формула цветка крестоцветных : $Ч_{4}$ $Л_{4}$ $Т_{2+4}$ $П_{1}$
Эта формула является знаковой моделью.
6. Запишите уравнение для расчёта скорости движения тела, если известны путь и время, за которое он пройден телом. Можно ли назвать это уравнение моделью?
Ответ:
Уравнение для расчета скорости имеет вид: U = $\frac{S}{t}$, где s − это путь, t − это время.
Эта формула является знаковой моделью. §4
-
§4. Химические знаки и формулы
Вопросы
1. Знаки каких химических элементов содержат заглавную латинскую букву С? Запишите их и произнесите.
Ответ:
Символ − название Произношение
C − углерод цэ
Cs − Цезий цезий
Cl − Хлор хлор
Cn − Коперниций коперниций
Ca − Кальций кальций
Cr − Хром хром
Co − Кобальт кобальт
Сu − Медь купрум
Сd − Кадмий кадмий
Ce − Церий церий
Сm − Кюрий кюрий
Cf − Калифорний калифорний2. Из таблицы 2 выпишите отдельно знаки элементов‑металлов и знаки элементов−неметаллов. Произнесите их названия.
Ответ:
Металлы
Русское Химический Произношение
название знак
Алюминий Al Алюминий
Железо Fe Ферум
Золото Au Аурум
Калий K Калий
Кальций Са Кальций
Магний Мg Магний
Медь Cu Купрум
Натрий Na Натрий
Свинец Pb Плюмбум
Ртуть Hg Гидраргирум
Серебро Ag Аргентум
Хром Cr Хром
Цинк Zn Цинк
НеметаллыРусское Химический Произношение
название знак
Азот N Эн
Водород H Аш
Кислород O О
Сера S Эс
Фосфор P Пэ
Углерод C Цэ
Хлор Cl Хлор3. Что такое химическая формула? Напишите формулы следующих веществ: а) серной кислоты, если известно, что в состав её молекулы входят два атома водорода, один атом серы и четыре атома кислорода; б) сероводорода, молекула которого состоит из двух атомов водорода и одного атома серы; в) сернистого газа, молекула которого содержит один атом серы и два атома кислорода. Что объединяет все эти вещества?
Ответ:
Химическая формула − это условная запись состава вещества посредством химических знаков и индексов.
а) $H_{2}$ $SО_{4}$ − серная кислота
б) $H_{2}$S − сероводород
в) $SO_{2}$ − сернистый газ
Эти вещества относятся к сложным веществам и состоят из двух и более химических элементов.4. Изготовьте из пластилина объёмные модели молекул следующих веществ: а) аммиака, молекула которого содержит один атом азота и три атома водорода, расположив атомы водорода по отношению к атому азота под углом 110°; б) хлороводорода, молекула которого состоит из одного атома водорода и одного атома хлора; в) хлора, молекула которого состоит из двух атомов хлора. Напишите формулы этих веществ и прочитайте их.
Ответ:
а) $NH_{3}$ − аммиак, эн аш три
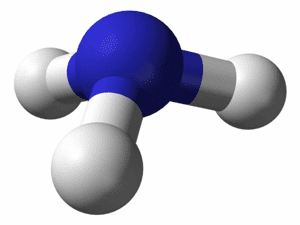
б) HCl− хлороводород, аш хлор
в) $Cl_{2}$ − хлор, хлор
5. На рисунке 40 изображены модели молекул четырёх химических веществ. Сколько химических элементов образуют эти вещества? Назовите их, запишите символы этих элементов и произнесите их.
Ответ:
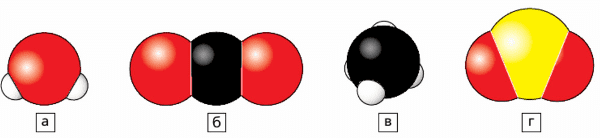
Рис. 40 Объемные модели молекул: а − воды; б − углекислого газа; в − метана; г − сернистого газа
а) вода, $H_{2}$O, аш два о
б) углекислый газ, $CO_{2}$, цэ о два
в) метан, $CH_{4}$, цэ аш четыре
г) сернистый газ, $SO_{2}$, эс о два
Эти вещества образованы четырьмя химическими элементами: водород Н (аш), углерод С (цэ), кислород О (о), сера S (эс)6. Возьмите пластилин четырёх цветов. Скатайте самые маленькие шарики белого цвета — это модели атомов водорода, красные шарики побольше − модели атомов кислорода, чёрные шарики — модели атомов углерода и, наконец, самые большие шарики жёлтого цвета — в качестве моделей атомов серы. Изготовьте объёмные модели молекул, изображённых на рисунке 40.
Ответ:

рис. 40 Объёмные модели молекул:
а — воды;
б — углекислого газа;
в — метана;
г — сернистого газа §5
-
§5. Химия и физика
Лабораторный опыт (стр.33)
На расстоянии 3 метров от вас ваш помощник распыляет вверх в течение 2 секунд освежитель воздуха или дезодорант−аэрозоль (рис.42). Определите время от начала распыления до того момента, когда вы почувствуете запах ароматизатора. Рассчитайте скорость распространения газообразного вещества.
Ответ:
Скорость распространения газообразного вещества рассчитываем по формуле:
U = $\frac{S}{t}$, где S − это путь; t − время
Дано:
S = 3м
t = 2c
Найти:
U − ?
Решение:
U = $\frac{S}{t}$=$\frac{3м}{2с}$=1,5 м/с
Ответ: U = 1,5 м/сЛабораторный опыт (стр.34)
Нанесите на предметное стекло каплю чистой воды и с помощью кисточки подкрасьте её очень небольшим количеcтвом чёрной туши, предварительно разведённой водой до светло−серого цвета. Накройте каплю покровным стеклом. Перемещая тубус микроскопа, добейтесь чёткого изображения. Вы увидите, как чёрные частицы туши совершают самопроизвольное движение. Но ведь их−то точно нельзя назвать живыми! Подобный опыт поставил выдающийся французский ученый Ж.Б.Перрен. Он зарисовал движение частиц примерно так, как показано на рисунке 43.
Ответ:
Нанесите на предметное стекло каплю чистой воды и с помощью кисточки подкрасьте её очень небольшим количеcтвом чёрной туши, предварительно разведённой водой до светло−серого цвета. Накройте каплю покровным стеклом. Перемещая тубус микроскопа, добейтесь чёткого изображения. Вы увидите, как чёрные частицы туши совершают самопроизвольное движение.
Лабораторный опыт (стр.36)
В стеклянный стакан или пол−литровую банку с водой бросьте несколько кристалликов марганцовки. Вскоре появятся малиновые разводы: вещество при растворении постепенно окрашивает воду (рис.46). Через некоторое время цвет жидкости станет совершенно однородным.
Рис. 46 - Диффузия окрашенных ионов вещества в водном растворе
На скорость диффузии веществ существенное влияние оказывает температура. Предыдущий эксперимент можно провести в двух сосудах, один из которых поместить в холодильник, второй оставить в комнате. Как вы думаете, в каком из сосудов раствор быстрее станет однородным?Ответ:
Раствор быстрее станет однородным в сосуде, который оставили в комнате. Влияние температуры на скорость реакции "прямо пропорционально": чем выше температура, тем выше скорость реакции − чем ниже температура, тем меньше и скорость реакции.
Вопросы
1. Какие частицы называют молекулами; атомами?
Ответ:
Молекула − это мельчайшая частица вещества, определяющая его химические свойства.
Атом − это мельчайшие электронейтральные частицы, из которых состоит молекула вещества.2. Что такое диффузия? Как обнаруживается диффузия пахучих веществ? Почему?
Ответ:
Диффузия − явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого.
Диффузия пахучих веществ обнаруживается по запаху, который распространяется не мгновенно, а спустя некоторое время, так как движению молекул пахучего вещества препятствуют молекулы газов, составляющих воздух. Молекулы пахучего вещества проникают в промежутки между молекулами газов. Поэтому пахучее газообразное вещество распространяется в воздухе самопроизвольно.3. Что такое ионы? Какие вещества состоят из ионов? Характер на ли диффузия для таких веществ?
Ответ:
Ионы − это положительно или отрицательно заряженные частицы, образовавшиеся из атомов.
Поваренная соль, сода, перманганат калия (в быту называют марганцовкой) — это вещества, соcтоящие из ионов.
Для таких веществ характерна диффузия. Например, диффузию можно наблюдать при постепенном растворении кристаллов соли в воде.4. Что такое броуновское движение? Как опытным путём смоделировать броуновское движение? Что доказывает это движение?
Ответ:
Броуновское движение − беспорядочное движение мельчайших частиц в жидкой или газообразной среде.
Броуновское движение можно смоделировать опытным путём. Для этого нужно нанести на предметное стекло каплю воды и подкрасить ее небольшим количеством черной туши, предварительно разведенной водой до светло−серого цвета. Накрыть каплю покровным стеклом и наблюдать под микроскопом как черные частицы туши совершают самопроизвольное движение.
Броуновское движение доказывает, что тела состоят из отдельных частиц – молекул и что молекулы находятся в непрерывном беспорядочном движении.5. Какое оборудование нужно использовать для наблюдения броуновского движения?
Ответ:
Для наблюдения броуновского движения понадобятся:
1. Микроскоп
2. Предметное стекло
3. Чёрная тушь
4. Кисточка6. Домашний эксперимент. Возьмите полстакана кипячёной воды и добавьте чайную ложку сахара. Не перемешивая содержимое стакана, попробуйте воду на вкус. Постепенно при растворении кристалликов сахара молекулы этого вещества проникают между молекулами воды. Периодически пробуйте раствор на вкус. Как он изменяется? Процессы растворения и диффузии ускоряются при перемешивании.
Ответ:
После каждого перемешивания вкус воды становится более сладким.
§6
-
§6. Агрегатные состояния веществ
Демонстрационный опыт (стр.39)
На двух чашках уравновешенных весов стоят одинаковые химические стаканы. Из наполненного углекислым газом стакана учитель «переливает» газ в один из стаканов на весах. Что происходит? Какой из газов тяжелее — воздух или углекислый газ? Придут ли весы вновь в равновесие? Объясните почему.
Ответ:
Стакан с углекислым газом перевесит стакан с воздухом, так как углекислый газ тяжелее воздуха.
Молекулярная масса воздуха составляет 29 г/моль.
Молекулярная масса углекислого газа составляет 44 г/моль. Углекислый газ тяжелее воздуха почти в 1,5 раза.
Зная, что углекислый газ тяжелее, можно предположить, что он всегда стремится вниз, на дно стакана. Поэтому весы не придут в равновесие.Вопросы
1. Назовите три агрегатных состояния веществ.
Ответ:
Вещества в зависимости от условий (например, температуры или давления) могут находиться в одном из трёх состояний:
1) Жидком
2) Твердом
3) Газообразном
Такие состояния называют агрегатными.2. Как агрегатное состояние воды связано с её круговоротом?
Ответ:
Под действием солнечного тепла жидкая вода испаряется с поверхности Земли, в газообразном состоянии она способна перемещаться на огромные расстояния. Пары воды, достигнув определенной высоты, конденсируются, и вода выпадает в виде осадков обратно на Землю. Данный процесс на Земле протекает непрерывно. Вода в твёрдом состоянии также участвует в данном процессе, например, в виде осадков (града или снега).
3. Чем отличается строение газообразного вещества от жидкого? Что общего между ними?
Ответ:
В газообразных веществах расстояние между молекулами в десятки раз превышает размер самих молекул, поэтому они очень слабо связаны друг с другом. Вследствие этого газы легко сжимаемы.
Жидкие вещества — нечто среднее между газами и твёрдыми телами. Как и твёрдые тела, они имеют собственный объём, так как силы межмолекулярного взаимодействия связывают молекулы, однако силы притяжения между ними не так велики, как в кристаллах.
Жидкие и газообразные вещества не имеют формы.4. Что характеризует твёрдое состояние вещества?
Ответ:
В твёрдых веществах частицы «выстроились» в строгом порядке. Такое упорядоченное строение имеют кристаллы. Силы взаимного притяжения частиц в кристаллах так велики, что оторвать одну от другой очень не просто. Особенно это характерно для ионных и атомных кристаллов.
5. Какие явления называются физическими?
Ответ:
Явления, при которых изменяются агрегатное состояние вещества, форма или размеры тел, построенных из этого вещества, но сохраняется его химический состав, называются физическими.
6. Приведите примеры физических явлений, известных вам из повседневной жизни или из наблюдений за природными явлениями.
Ответ:
В повседневной жизни мы можем наблюдать:
1) Засахаривание варенья
2) Круговорот воды в природе
3) Плавление парафина
4) Горение лампочки
5) Подогрев еды в микроволновке
Все это − физические явления.7. Чем отличаются твёрдые кристаллические вещества от твёрдых аморфных? Приведите примеры тех и других, известных вам из повседневной жизни.
Ответ:
Аморфные вещества настолько вязкие, что надолго сохраняют свою форму. Значит, их можно отнести к твёрдым веществам. Однако, подобно жидкостям, расположение частиц в таких веществах строго не упорядочено.
Аморфные − янтарь, воск, стекло, смолы, многие пластмассы
Твёрдые − графит, металлы, поваренная соль8. Пустую пластиковую бутылку плотно закройте пробкой и поставьте в холодильник. Буквально через минуту вы увидите, что стенки бутылки втянулись вовнутрь, будто кто−то откачал из неё часть воздуха. Почему так произошло? Примет ли бутылка прежнюю форму, если её вынуть из холодильника?
Ответ:
При помещении бутылки в холодильник скорость движения молекул в бутылке уменьшается, но снаружи находится неограниченное число молекул. Поэтому число ударов молекул о внутренние стенки бутылки становится меньше числа ударов молекул о внешние стенки. Давление газа на внешние стенки бутылки становится выше, чем давление газа на внутренние стенки. Поэтому бутылка сжимается.
Если бутылку вынуть из холодильника, давление внутри нее и снаружи постепенно выровняется, и бутылка примет прежнюю форму. §7
-
§7. Химия и физическая география
Лабораторный опыт (стр.44)
Рассмотрите при помощи увеличительного стекла или лупы кусочек гранита. Хорошо заметно его неоднородное строение. Красноватые или сероватые зёрна — это полевой шпат, полупрозрачные — кварц, блестящие чешуйчатые зёрнышки — это слюда.
Ответ:

Вопросы
1. Какое строение имеет планета Земля?
Ответ:
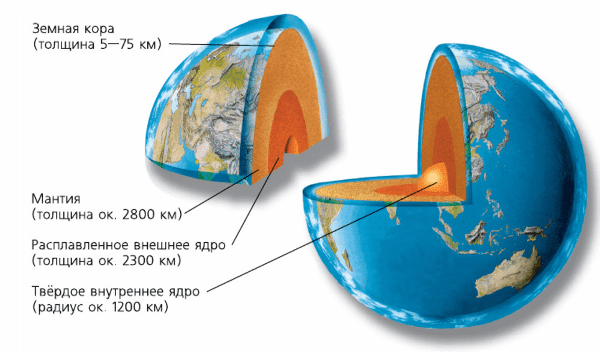
Рис. 52 Внутреннее строение Земли.
1) Твёрдое внутреннее ядро
2) Расплавленное внешнее ядро
3) Мантия
4) Земная кора2. Из чего состоит твёрдое внутреннее ядро Земли?
Ответ:
Твёрдое внутреннее ядро состоит из железа и никеля, находящихся под большим давлением, и потому, не смотря на высокую температуру, эта часть ядра твёрдая.
3. Что такое мантия Земли? Какие элементы образуют мантию?
Ответ:
Мантия − часть Земли (геосфера), расположенная непосредственно под корой и выше ядра. Она состоит в основном из минералов, богатых главным образом тремя элементами: кремнием, магнием и железом.
В мантии Земли на разных глубинах образуется магма — расплавленная вязко−жидкая, преимущественно силикатного состава масса, выходящая на поверхность при извержении вулканов в виде лавы.4. Чем отличаются минералы от горных пород?
Ответ:
Минералы (лазурит, корунд и др.) в основном состоят из одного химического вещества, а горные породы (гранит, каменный уголь) состоят из одного или нескольких минералов, или из скопления сцементированных минеральных обломков.
5. Какие горные породы вы знаете? Приведите примеры.
Ответ:
Различают несколько видов горных пород:
1) Магматические горные породы образуются при остывании и затвердевании магмы. Это, например, хорошо знакомый вам гранит — плотная зернистая горная порода с крупными кристаллами минералов.
2) Неорганические осадочные горные породы: они представляют собой обломки различных пород, которые за тысячи лет поддействием воды, ветра, солнечных лучей измельчаются, дробятся и окатываются. Так образуются валуны, щебень, галька, песок, глина.
3) Органические осадочные породы: они образованы остатками растительных и животных организмов, накопившимися за миллионы лет. Это горючие полезные ископаемые: нефть, каменный уголь, горючие сланцы, торф. К негорючим осадочным породам органического происхождения также относятся мел, известняк.6. Какую оболочку Земли образуют минералы и горные породы?
Ответ:
Минералы и горные породы образуют земную кору.
7. Какие минералы входят в состав горной породы гранит?
Ответ:

рис. 54 Гранит
Гранит состоит из:
1) полевого шпата − красноватые или сероватые зёрна
2) кварца − полупрозрачные зёрна
3) слюды − блестящие чешуйчатые зёрна §8
-
§8. Химия и биология
Демонстрационный опыт (стр.47)
Зелёный листок растения учитель помещает в пробирку, заливает его спиртом, а затем нагревает пробирку в стакане с горячей водой или на пламени спиртовки. Через некоторое время спирт окрасится в изумрудно−зелёный цвет. Хлорофилл, содержащийся в клетках растения, хорошо растворяется в спирте.
Этот опыт для вас проделал учитель. Какое явление — физическое или химическое — он вам продемонстрировал?Ответ:
Растворение хлорофилла − это физико−химический процесс.
При растворении происходит процесс равномерного распределения одного вещества в другом, при котором растворяемое вещество переходит в агрегатное состояние растворителя, т.е. происходит физическое явление − диффузия.
Изменение цвета раствора свидетельствует так же о протекании химической реакции.Домашний опыт (стр.47)
Взвесьте 100 г свежего укропа или петрушки. Высушите зелень на солнце или батарее центрального отопления. На это потребуется 5—7 дней. Таким способом вы удалите из растения большую часть содержащейся в нём воды. Сколько граммов воды вы удалили высушиванием?
Ответ:
Для определения массы воды, которую удалили высушиванием необходимо найти разность между массой зелени до высушивания (100г) и массой после ее сушки.
Высушенную зелень взвесьте на весах, полученную массу вычтите из 100г. Полученная разница и есть масса воды, содержащияся в зелени и удаленная высушиванием.
По опыту из 100г укропа получится 11 г высушенной зелени.Лабораторный опыт (стр.48)
На лист белой бумаги положите семечко подсолнечника или кусочек ядра грецкого ореха и раздавите его. На бумаге образовалось жирное пятно.
Ответ:
Полученное пятно свидетельствует о наличие жира в составе тканей растений.
Лабораторный опыт 1 (стр.49)
Резко согнув корочку апельсина, выдавите небольшое количество эфирного масла на пламя свечи или газовой горелки. Что при этом наблюдаете?
Ответ:
Мы наблюдаем вспыхивание и горение эфирных масел апельсина в виде небольшого искрения.
Эфирные масла — горючие органические вещества, они−то и вызывают небольшой «фейерверк».
Лабораторный опыт 2 (стр.49)
Из муки (её изготавливают из зёрен пшеницы) и небольшого количества воды замесите немного теста. Поместите кусочек теста в марлю и тщательно промойте его в стакане воды. К полученной мутной воде добавьте несколько капель настойки йода из аптечки. О чём свидетельствует появление сине−фиолетового окрашивания?
Ответ:
Появление сине−фиолетового окрашивания раствора свидетельствует о наличие в составе муки углевода − крахмала.
Домашний опыт (стр.50)
Таблетку аскорбиновой кислоты растворите в 1/2 стакана воды. Добавьте несколько капель йодной настойки. Что при этом наблюдаете?
Попробуйте обнаружить витамин С в свежем соке апельсина, лимона, яблока. Есть ли витамин С в известных вам газированных напитках, таких, например, как «Фанта», «Дюшес», «Спрайт» и т.д.?Ответ:
При добавлении йодной настойки к раствору аскорбиновой кислоты происходит обесцвечивание желто−коричневой настойки.
Это доказывает содержание витамина С в растворе аскорбиновой кислоты.
Так же происходит обесцвечивание раствора йода больше всего в свежем соке лимона, затем апельсина и яблока.
Значит и в этих фруктах так же есть витамин С. Больше всего витамина С в лимоне, потом в апельсине и затем в яблоке.
В газированных напитках витамин С не обнаружен, раствор не обесцветился.Вопросы
1. Какие два типа веществ входят в состав растительных и животных клеток? На какие группы они подразделяются?
Ответ:
В состав растительных и животных клеток входят:
1) органические вещества − жиры, белки, углеводы, витамины
2) неорганические вещества − вода, минеральные соли2. Как выделить хлорофилл из зелёных листьев?
Ответ:
Необходимо положить зелёный листок в пробирку и залить его спиртом. После чего пробирку нужно нагреть. Через некоторое время спирт окрасится в изумрудно−зелёный цвет. Хлорофилл, содержащийся в клетках растения, хорошо растворяется в спирте.
3. Как доказать, что в состав зелёных растений входят вода и минеральные соли? Как определить содержание каждой группы неорганических веществ с помощью химического эксперимента?
Ответ:
Для доказательства, что в состав зеленых растений входят вода и минеральные соли можно провести несложные опыты.
Опыт 1
Возьмем 100г свежего укропа или петрушки. Высушим зелень на солнце или батарее центрального отопления. На это потребуется 5—7 дней. Определим массу высушенной зелени, масса уменьшится. Для расчета массы воды необходимо найти разницу между первоначальной массой зелени и массой после высушивания растений. Таким способом мы докажем, что в состав входит вода.
Для определения содержания минеральных солей в составе зеленых растений проведем второй опыт.
Опыт 2
Возьмем сухой остаток после сушки зелени и прокалим его в муфельной печи для удаления всех органических веществ, содержащихся в растениях. Взвесим остаток, масса зелени после прокаливания еще уменьшится. В ней останутся только негорючие минеральные соли.4. Как обнаружить жир в тканях растений?
Ответ:
Для обнаружения жира в тканях растений следует семечку подсолнечника или кусочек грецкого ореха положить на лист белой бумаги и раздавить его. На бумаге образуется жирное пятно.
Это является доказательством содержания жира в тканях растений.5. Что такое эфирные масла? Какое значение они имеют в мире растений? Как можно использовать их в пищевой и парфюмерной промышленности?
Ответ:
Эфирные масла − это горючие органические вещества, особая группа растительных масел.
Эфирные масла придают цветам, ягодам, фруктам и плодам неповторимый запах, который привлекает насекомых, необходимых для опыления растений.
Эфирные масла используются в пищевой промышленности для изготовления пищевых ароматизаторов. В парфюмерной промышленности эфирные масла используют как компоненты для изготовления мыла, косметических и парфюмерных средств.6. Назовите упоминаемые в параграфе углеводы. Какую качественную реакцию на крахмал вы знаете?
Ответ:
В параграфе упоминаются следующие углеводы:
1) глюкоза (виноградный сахар),
2) фруктоза (фруктовый сахар),
3) сахароза (сахар),
4) лактоза,
5) целлюлоза,
6) крахмал.
Качественной реакций на крахмал является взаимодействие с йодом, сопровождающееся появлением сине−фиолетового окрашивания.7. Какую роль в живых организмах играют белки?
Ответ:
Белки — это особая группа веществ, которые играют исключительно важную роль в живых организмах, так как участвуют в построении клеток и тканей, являются гормонами, ферментами, выполняют защитные функции.
8. Какие витаминные препараты есть в вашей домашней аптечке? Прочитайте на упаковке их состав.
Ответ:
В моей домашней аптечке есть витамины:
1. Аевит состав: витамин A, витамин E;
2. Мульти−табс юниор состав:
− витамин A,
− витамин E,
− витамин $D_{3}$,
− витамины $B_{1}$, $B_{2}$, $B_{6}$, $B_{12}$,
− витамин C. §9
-
§9. Качественные реакции в химии
Демонстрационный опыт (стр.52)
В пробирки, наполненные кислородом и углекислым газом, учитель поочерёдно опускает тлеющую лучинку. В одной из пробирок лучинка гаснет (рис.66), а в другой — ярко вспыхивает (рис.67)
Проведённый учителем опыт позволяет отличить кислород от других газов. А как доказать, что во втором стакане находится именно углекислый газ, а, допустим, не азот, который тоже не поддерживает горение? Есть ли соответствующая углекислому газу качественная реакция?Ответ:

Рис. 66. В пробирке с углекислым газом горящая лучинка гаснет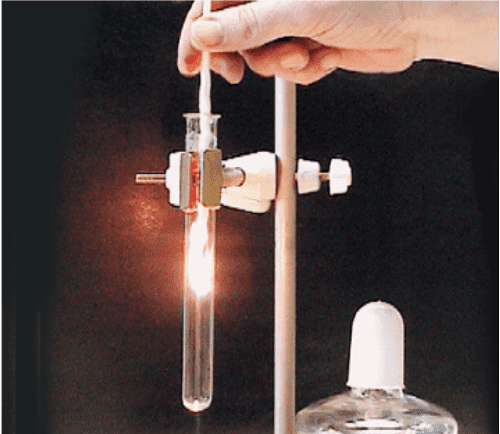
Рис. 67. В пробирке с кислородом тлеющая лучинка ярко вспыхивает
Качественная реакция на кислород − это вспыхивание тлеющей лучины в пробирке с кислородом.
Доказательством присутствия углекислого газа в пробирке служит его качественная реакция с известковой водой.
Приоткрыв крышку стакана, наполненного углекислым газом, нужно добавить в него небольшое количество известковой воды − она прозрачная. Закрыв крышку, необходимо встряхнуть жидкость в стакане. При этом она мутнеет. Это качественная реакция на углекислый газ.
Так, с помощью раствора гашёной извести в воде (гашёная известь применяется в строительстве и сельском хозяйстве) — так называемой известковой воды — можно обнаружить углекислый газ.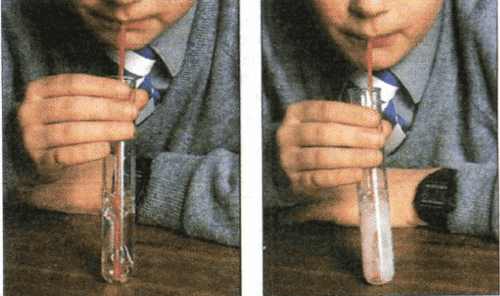
Демонстрационный опыт (стр.53)
Приоткрыв крышку стакана, наполненного углекислым газом, учитель добавляет в него небольшое количество прозрачной жидкости − известковой воды. Закрыв крышку, встряхивает жидкость в стакане. При этом она мутнеет. Это качественная реакция на углекислый газ. Так, с помощью раствора гашёной извести в воде (гашёная известь применяется в строительстве и сельском хозяйстве) − так называемой известковой воды − можно обнаружить углекислый газ.
Ответ:
Качественная реакция на углекислый газ:

Лабораторный опыт 1 (стр.53)
В выданную вам учителем пробирку с прозрачной известковой водой опустите стеклянную трубку и аккуратно продувайте через неё выдыхаемый воздух, по истечении не которого времени раствор помутнеет. Какой газ содержится в выдыхаемом воздухе?
Ответ:
Данный опыт доказывает содержание углекислого газа в выдыхаемом воздухе.
Известковая вода служит реактивом на углекислый газ.Лабораторный опыт 2 (стр.53)
В четыре одинаковых сосуда налейте равные объёмы: в 1−й − обычной воды; во 2−й − раствора поваренной соли; в 3−й − раствора сахара; в 4−й − известковой воды. Перемешайте сосуды. Определите, в каком из сосудов находилась известковая вода, с помощью качественной реакции, т.е. пропуская через жидкость выдыхаемый воздух, обогащённый углекислым газом
Ответ:
Чтобы реакцию можно было считать качественной, аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или, по крайней мере, немногими веществами. Таким образом, только в одной из четырех пробирок помутнеет раствор при пропускании через него выдыхаемого воздуха, обогащенного углекислым газом.
1−я пробирка − раствор не помутнел;
2−я пробирка − раствор не помутнел;
3−я пробирка − раствор не помутнел;
4−я пробирка − раствор помутнел.
Известковая вода служит реактивом на углекислый газ. Однако верно и обратное: с помощью углекислого газа можно провести качественную реакцию на известковую воду.
Так как в 4−й пробирке раствор помутнел, значит в ней находится раствор известковой воды.Вопросы
1. Сравните следующие вещества:
а) медь и алюминий;
б) уксусную кислоту и этиловый спирт.Ответ:
a) медь и алюминий
Свойства веществ Медь Алюминий
Агрегатное состояние твердое тело твердое тело
Цвет золотисто−розовый серебристо−белый
Запах без запаха без запаха
Пластичность пластичная пластичный
Растворимость в воде не растворима не растворим
Теплопроводность отличная тепловодность отличная теплопроводность
Электропроводность отличный проводник отличный проводник
б) уксусная кислота и этиловый спиртCвойства веществ Уксусная кислота Этиловый спирт
Агрегатное состояние жидкость жидкость
Цвет бесцветная бесцветный
Запах резкий специфический резкий специфический
Вкус кислый обжигающий
Растворимость растворима растворим2. Какие реакции называют качественными?
Ответ:
Качественными называют реакции, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Качественная реакция должна сопровождаться каким−то характерным признаком — сигналом, который можно заметить с помощью органов чувств. Это может быть изменение окраски, выпадение осадка, выделение газа, которое можно зафиксировать по появлению запаха, характерному звуку и т.д.3. Что такое реактив на определяемое вещество?
Ответ:
Реактивом на определяемое вещество называется вещество, с помощью которого проводят качественную реакцию.
Например: известковая вода служит реактивом на углекислый газ. Однако верно и обратное: с помощью углекислого газа можно провести качественную реакцию на известковую воду.4. Как с помощью тлеющей лучинки распознать кислород и углекислый газ?
Ответ:
Тлеющая лучинка в пробирке с углекислым газом гаснет, так как углекислый газ не поддерживает горение.

Тлеющая лучинка в пробирке с кислородом вспыхивает и горит, так как кислород поддерживает горение.
5. Приведите примеры, когда известковая вода является определяемым веществом, а когда — реактивом.
Ответ:
1. В четыре пробирки нальем соответственно воды, раствор поваренной соли, раствор известковой воды и раствор сахара. Пропустим через них углекислый газ. В пробирке с известковой водой произойдет помутнее. В этом случае известковая вода − определяемое вещество.
2. В пробирки с различными газами: воздух, азот, углекислый газ, кислород добавим в каждую известковой воды. В пробирке с углекислым газом произойдет помутнение. В этом случае известковая вода − реактив.6. С помощью йодной настойки из домашней аптечки проведите обнаружение крахмала в картофеле, хлебе, макаронных изделиях. Присутствует ли крахмал в майонезе, йогурте, варёном мясе, рисовой крупе?
Ответ:
Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом, поэтому при попадании йода на картофель, хлеб и макаронные изделия они посинели.
Для определения крахмала в исследуемом веществе необходимо капнуть йодную настойку на образец.
В ходе эксперимента крахмал был обнаружен в рисовой крупе.
Майонез, йогурт и варёное мясо, если на них капнуть йодом, должны принять цвет йода (тёмно−коричневый).7. Какое яблоко — незрелое или спелое — содержит больше крахмала? Как определить это опытным путём? Проведите домашний эксперимент и наблюдения запишите в тетрадь.
Ответ:
Определить содержание крахмала в яблоках можно с помощью йода, необходимо капнуть спиртовой настойкой на срез яблок. Незрелое яблоко содержит больше крахмала, так как с ним при действии йода наблюдается более интенсивная синяя окраска.
§10
-
ГЛАВА II. МАТЕМАТИКА В ХИМИИ
§10. Относительные атомная и молекулярная массы
Вопросы
1. Что такое относительная атомная масса? Почему эта величина не имеет размерности?
Ответ:
Относительная атомная масса — величина, показывающая, во сколько раз масса атома данного элемента больше массы атома водорода, принятой за единицу.
Относительная атомная масса — безразмерная величина, так как представляет собой отношение массы атома элемента к массе атома водорода.2. Что такое относительная молекулярная масса? Как она рассчитывается?
Ответ:
Относительная молекулярная масса − это отношение массы молекулы или формульной единицы к атомной единице массы.
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.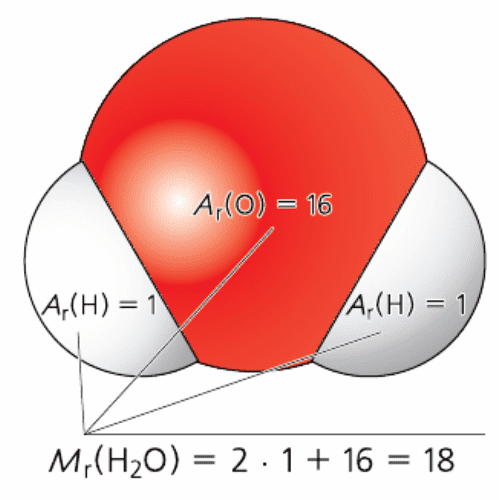
Рис. 68. Расчёт относительной молекулярной массы воды3. В состав молекулы фосфорной кислоты входят три атома водорода, один атом фосфора и четыре атома кислорода. Найдите относительную молекулярную массу этого вещества
Ответ:
$M_{r}$($H_{3}PO_{4}$) = 3 * 1+ 31+ 4 * 16 = 98
4. Рассчитайте относительные молекулярные массы веществ по их формулам: $Br_{2}$, $H_{2}O$, $CO_{2}$, $H_{2}SO_{4}$, $KOH$, $BaCl_{2}$. Значения относительных атомных масс найдите по таблице Д. И. Менделеева, округлите их до целых чисел (за исключением хлора, $A_{r}$(Cl) = 35,5).
Ответ:
1) $M_{r}$ ($Br_{2}$) = 2 * 80 = 160
2) $M_{r}$ ($H_{2}O$) =2 * 1+16 = 18
3) $M_{r}$ ($CO_{2}$) = 12+2 * 16 = 44
4) $M_{r}$ ($H_{2}SO_{4}$) = 2 * 1+32+4 * 16 = 98
5) $M_{r}$ ($KOH$) = 39+16+1 = 56
6) $M_{r}$ ($BaCl_{2}$) = 137+ 2 * 35,5 = 2085. Атом серы образует с атомами кислорода два сложных вещества (их называют оксидами) разного состава. Относительная молекулярная масса первого оксида равна 64, а второго — 80. Выведите формулы этих оксидов.
Ответ:
1) $M_{r}$ ($SO_{x}$) = 64
32+16x = 64
16x = 32
x = 2
Ответ: $SO_{2}$
2) $M_{r}$ ($SO_{x}$) = 80
32+16x =80
16x = 48
x = 3
Ответ: $SO_{3}$6. Не производя расчётов, а только на основании значений относительных атомных масс (найдите их по таблице Д. И. Менделеева) определите, у какого из веществ, формулы которых приведены ниже, наибольшая и наименьшая относительные молекулярные массы:
а) селеноводород $H_{2}Se$;
б) вода $H_{2}O$;
в) теллуроводород $H_{2}Te$;
г) сероводород $H_{2}S$.Ответ:
Наибольшая относительная молекулярная масса у $H_{2}Te$,
Наименьшая относительная молекулярная масса у $H_{2}O$,
так как $A_{r}$(Te) = 127,60 (самая большая), а $A_{r}$(O) = 15,999 (самая маленькая). §11
-
§11. Массовая доля элемента в сложном веществе
Вопросы
1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
Ответ:
Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или процентах).
Массовую долю элемента в веществе рассчитывают по формулам:
1) $w$ (элемента) = $\frac{m (элемента)}{m( вещества)}$ * 100%
2) $w$ (элемента) = $\frac{A_{r} (элемента) * n (элемента)}{M_{r} (вещества)}$ * 100%
Для расчета массовой доли элемента в формуле (2) нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.2. Рассчитайте массовые доли элементов в веществах:
а) углекислом газе $CO_{2}$;
б) сульфиде кальция $CaS$;
в) натриевой селитре $NaNO_{3}$;
г) оксиде алюминия $Al_{2}O_{3}$.Ответ:
а) $M_{r}$ ($CO_{2}$) = 12 + 2 * 16 = 44
$w$(C) = $\frac{12}{44}$ * 100% = 27%
$w$(O) = $\frac{2 * 16}{44}$ * 100% = 73%
б) $M_{r}$ (CaS) = 40 + 32 = 72
$w$(Ca) = $\frac{40}{72}$ * 100% = 55,6%
$w$(S) = 100% − 55,6% = 44,4%
в) $M_{r}$ ($NaNO_{3}$) = 23 + 14 + 3 * 16 = 85
$w$(Na) = $\frac{23}{85}$ * 100% = 27%
$w$(N) = $\frac{14}{85}$ * 100% = 17%
$w$(O) = 100% − 27% − 17% = 56%
г) $M_{r}$ ($Al_{2}O_{3}$) = 2 * 27 + 3 * 16 = 102
$w$(Al) = $\frac{2 * 27}{102}$ * 100% = 53%
$w$(O) = 100% − 53% = 47%3. В каком из азотных удобрений массовая доля питательного элемента азота наибольшая:
а) хлориде аммония $NH_{4}Cl$;
б) сульфате аммония $(NH_{4})_{2}SO_{4}$;
в) мочевине $(NH_{2})_{2}CO$?Ответ:
а) $M_{r}$ ($NH_{4}Cl$) = 14 + 4 * 1 + 35,5 = 53,5
$w$($N$) = $\frac{14}{53,5}$ * 100% = 26%
б) $M_{r}$ ($(NH_{4})_{2}$ $SO_{4}$) = 2 * 14 + 8 * 1 + 32 + 4 * 16 = 132
$w$($N$)=$\frac{28}{132}$ * 100% = 21%
в) $M_{r}$ ($(NH_{2})_{2}CO$) = 2 * 14 + 4 * 1 + 12 + 16 = 60
$w$($N$) = $\frac{28}{60}$ * 100% = 46%
Ответ: в мочевине массовая доля питательного элемента азота наибольшая.4. В минерале пирите на 7г железа приходится 8г серы. Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
Ответ:
m(вещества) = 8 + 7 = 15
$w$($Fe$) = $\frac{7}{15}$ = 0,466
$w$($S$) = $\frac{8}{15}$ = 0,534
$A_{r}$ ($Fe$) = 56
$A_{r}$ ($S$) = 32
$\frac{0,466}{56}$ : $\frac{0,534}{32}$ = 1 : 2
Ответ: массовые доли $w$($Fe$) = 0,46, $w$($S$) = 0,53; формула $FeS_{2}$5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода — 69,57%. Определите формулу оксида.
Ответ:
Относительная атомная масса азота: $A_{r}$ (N) = 14
Относительная атомная масса кислорода: $A_{r}$ (O) = 16
N : O = $\frac{30,43}{14}$ : $\frac{69,57}{16}$ = 2 : 4 = 1 : 2
Ответ: $NO_{2}$6. В Средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе соcтавляют: калий — 56,6%, углерод — 8,7%, кислород — 34,7%. Определите формулу поташа.
Ответ:
Относительная атомная масса калия: $A_{r}$ (K) = 39
Относительная атомная масса углерода: $A_{r}$ (C) = 12
Относительная атомная масса кислорода: $A_{r}$ (O) = 16
$K$ : $C$ : $O$ = $\frac{56,6}{39}$ : $\frac{8,7}{12}$ : $\frac{34,7}{16}$ = 2 : 1 : 3
Ответ: $K_{2}CO_{3}$ §12
-
§12. Чистые вещества и смеси
Вопросы
1. В чём отличие материала от химического вещества?
Ответ:
Химическое вещество — это устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определенными химическими и физическими свойствами.
Материалы состоят из химического вещества и их смесей. Одно и то же химическое вещество может служить основой для разных материалов. Так, например, химическое вещество карбонат кальция образует такие минералы как мрамор, мел, гипс.2. Может ли вода в различных агрегатных состояниях быть материалом? Приведите примеры.
Ответ:
В жидком и газообразном виде вода не является материалом, так как из неё нельзя что−либо изготовить.
В твёрдом виде вода бывает двух видов: снег и лед.
1) Снег пригоден для лепки снежков и снеговиков, снежных крепостей и домиков иглу.
2) Лед пригоден для постройки ледяных горок, крепостей, блоков из льда, скульптур.
Т.е. вода в твердом состоянии может быть материалом.3. Что такое смесь? Приведите примеры природных смесей различного агрегатного состояния. Назовите компоненты этих смесей.
Ответ:
Смесь − это сочетание двух или более химических веществ.
Газообразные природные смеси: воздух (азот, кислород, углекислый газ и др.), природные газы (метан, этан, бутан и др.).
Жидкие природные смеси: нефть (смесь жидких углеводородов).
Твёрдые природные смеси: песок (кварц, гранит, слюда), воск (твердые углеводороды).4. Приведите примеры бытовых смесей различного агрегатного состояния. Назовите компоненты этих смесей.
Ответ:
Газовые смеси: бытовой газ (метан и пахучие вещества).
Жидкие смеси: солёная вода (соль и вода), молоко (вода, жир, белки, лактоза и минеральные вещества).
Твердые смеси: адыгейская соль (соль и чеснок, с различными приправами и специями), мука (крахмал и белки).5. Какие смеси называются гетерогенными? Приведите примеры таких природных и бытовых смесей и назовите их компоненты.
Ответ:
Смеси, в которых частички составляющих их веществ видны невооружённым глазом или под микроскопом, называются неоднородными или гетерогенными.
Природные гетерогенные смеси: земля (смесь растений, песка и других веществ), лужа (смесь почвы, травы, листьев, воды).
Бытовые гетерогенные смеси: каша (смесь молока, соли, сахара, крупы), салат (смесь помидоров, огурцов, подсолнечного масла, соли).6. Какие смеси называются гомогенными? Приведите примеры таких природных и бытовых смесей и назовите их компоненты.
Ответ:
Смесь, в которой даже с помощью увеличительных приборов нельзя увидеть частицы составляющих её веществ, называется однородной или гомогенной.
Природные гомогенные смеси: воздух (азот, кислород, углекислый газ и др.), морская вода (соль, вода).
Бытовые гомогенные смеси: бытовой газ (метан, пахучие вещества), кофе (растворимый кофе и вода).7. Какой воздух может рассматриваться как гомогенная смесь, а какой — как гетерогенная?
Ответ:
Чистый воздух — это гомогенная смесь азота, кислорода, углекислого и благородных газов, водяных паров. А вот пыльный воздух — это уже гетерогенная смесь тех же газов, только содержащая ещё и частицы пыли.
§13
-
§13. Объемная доля газа в смеси
Вопросы
1. Что такое объёмная доля компонента в газовой смеси?
Ответ:
Объёмная доля компонента в газовой смеси − это особая величина для выражения состава смеси газа в цифрах, т.е. количественно.
2. Объёмная доля аргона в воздухе 0,9%. Какой объём воздуха необходим для получения 5л аргона?
Ответ:
Дано:
φ(Ar) = 0,9%
V(Ar) = 5л
Найти: V (воздуха)
Решение:
φ(Ar)= $\frac{V(Ar)}{V(воздуха)}$ * 100%
V(воздуха)= $\frac{V(Ar)}{w(Ar)}$ * 100%=$\frac{5}{0,9}$ * 100% = 555,55 л
Ответ: 555,55 л3. При разделении воздуха было получено 224 л азота. Какие объёмы кислорода и углекислого газа были получены при этом?
Ответ:
Дано:
V (N) = 224 л
φ (N) = 78%
φ (O) = 21%
φ ($CO_{2}$) = 0,03%
Найти:
V(O) =?
V($CO_{2}$) = ?
Решение:
V (воздуха) = $\frac{V(N)}{φ(N)}$ * 100 = $\frac{224}{78}$ * 100 = 287,17 л
V(O) =$\frac{φ(O) * V(воздуха)}{100}$ = $\frac{21 * 287,17}{100}$ = 60,3 л
V($CO_{2}$) = $\frac{φ(CO_{2}) * V(воздуха)}{100}$ = $\frac{0,03 * 287,17}{100}$ = 0,086 л
Ответ: V(O) = 60,3; V($CO_{2}$) = 0,086 л4. Объёмная доля метана в природном газе составляет 92%. Какой объём этой газовой смеси будет содержать 4,6 мл метана?
Ответ:
Дано:
φ ($CH_{4}$) = 92%
V ($CH_{4}$) = 4,6л
Найти:
V (природного газа) = ?
Решение:
φ ($CH_{4}$) = $\frac{V(CH_{4})}{V (пр. газа)}$ * 100
V (пр. газа) = $\frac{V ( CH_{4})}{φ(CH_{4})}$ * 100 = $\frac{4,6}{92}$ * 100 = 5 л
Ответ: V (природного газа) = 5 л5. Смешали 6 л кислорода и 2 л углекислого газа. Найдите объёмную долю каждого газа в полученной смеси.
Ответ:
Дано:
V (O) = 6 л
V ($CO_{2}$) = 2 л
Найти:
φ (O) = ?
φ ($CO_{2}$) = ?
Решение:
V (смеси) = 6 + 2 = 8 л
φ (O) = $\frac{V (O)}{V (смеси)}$* 100% = $\frac{6}{8}$ * 100% = 75%
φ ($CO_{2}$) = $\frac{V (CO_{2})}{V (смеси)}$ * 100% = $\frac{2}{8}$ * 100% = 25%
Ответ: φ (O) = 75% ; φ ($CO_{2}$) = 25% §14
-
§14. Массовая доля вещества в растворе
Вопросы
1. Что такое массовая доля растворённого вещества? Сравните понятия «объёмная» и «массовая доля» компонентов смеси.
Ответ:
Массовой долей растворённого вещества называют отношение массы растворённого вещества к массе раствора.
Объёмная и массовая доли являются относительными величинами, имеют одинаковые единицы измерения, выраженные в долях единицы или в процентах.2. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, что бы приготовить 200 г настойки?
Ответ:
Дано:
w (I) = 5%
m (настойки) = 200 г
Найти:
m (I) = ?
m (спирта) = ?
Решение:
m (I) = w * m (настойки) = $\frac{5 * 200}{100}$ = 10 г
m (спирта) = m (настойки) − m (I) = 200 − 10 = 190 г
Ответ: m (спирта) = 190 г; m (I) = 10 г3. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе.
Ответ:
Дано:
m ($H_{2}O$) = 150 г
m ($NaCl$) = 25 г
Найти:
w ($NaCl$) = ?
Решение:
m (раствора) = 150+25 = 175 г
w ($NaCl$) = $\frac{m(NaCl)}{m (раствора)}$ * 100% = $\frac{25}{175}$ * 100% = 14,28%
Ответ: w ($NaCl$) = 14,28%4. В 200 г столового уксуса содержится 6 г уксусной кислоты. Определите массовую долю кислоты в столовом уксусе.
Ответ:
Дано:
m (столового уксуса) = 200 г
m (уксусной кислоты) = 6 г
Найти:
w (уксусной кислоты) = ?
Решение:
w (уксусной кислоты) = $\frac{m(ук.кислоты)}{m(ст.уксуса)}$ * 100% = $\frac{6}{200}$ * 100% = 3%
Ответ: w (уксусной кислоты) = 3%5. Найдите массу воды и лимонной кислоты, необходимых для приготовления 50 г 5%−го раствора.
Ответ:
Дано:
m (раствора) = 50 г
w (лимонной кислоты) = 5% = 0,05
Найти:
m ($H_{2}O$) = ?
m (лимонной кислоты) = ?
Решение:
m (лимонной кислоты) = w (лимонной кислоты) * m (раствора) = 0,05 * 50 = 2,5 г
m ($H_{2}O$) = 50 − 2,5 = 47,5 г
Ответ: m (лимонной кислоты) = 2,5 г; m ($H_{2}O$) = 47,5 г6. Из 240 г 3%−го раствора питьевой соды выпарили 80 г воды. Найдите массовую долю соды в полученном растворе.
Ответ:
Дано:
m (раствора) = 240 г
m (нового раствора) = 240 − 80 = 160 г
w (соды) = 3% = 0,03
Найти:
w (соды) в новом растворе = ?
Решение:
m (соды) = w (соды) * m (раствора) = 0,03 * 240 = 7,2 г
w (соды) в новом растворе = $\frac{m(соды)}{m(нов.раствора)}$ * 100% = $\frac{7,2}{160}$ * 100% = 4,5%
Ответ: w (соды) в новом растворе = 4,5%7. К 150 г 20%−го раствора cахара добавили 30 г сахара. Найдите массовую долю вещества в полученном растворе.
Ответ:
Дано:
m (раствора) = 150 г
m (сахара) = 30 г
w (сахара) = 20% = 0,2
Найти:
w (сахара) в новом растворе = ?
Решение:
m (нового раствора) = 150 + 30 = 180г
m (сахара) в старом растворе = w (сахара) * m (раствора) = 0,2 * 150 = 30 г
m (сахара) в новом растворе = 30 + 30 = 60 г
w (сахара) в новом растворе = $\frac{m(сахара)}{m(раствора)}$ * 100% = $\frac{60}{180}$ * 100% = 33,33%
Ответ: w (сахара) в новом растворе = 33,33%8. Смешаем два раствора серной кислоты: 80 г 40%−го и 160 г 10%−го раствора. Найдите масовую долю кислоты в полученном растворе.
Ответ:
Дано:
$m_{1}$ (раствора) = 80 г
$w_{1}$ ($H_{2}SO_{4}$) = 40%
$m_{2}$ (раствора) = 160 г
$w_{2}$ ($H_{2}SO_{4}$) = 10%
Найти:
$w_{общая}$ ($H_{2}SO_{4}$) = ?
Решение:
Масса серной кислоты в первом растворе: $m_{1}$ ($H_{2}SO_{4}$) = $\frac{w_{1}(H_{2}SO_{4}) * m_{1} (раствора)}{100}$ = $\frac{40 * 80}{100}$ = 32 г
Масса серной кислоты во втором растворе: $m_{2}$ ($H_{2}SO_{4}$) = $\frac{w_{2} (H_{2}SO_{4}) * m_{2} (раствора)}{100}$ = $\frac{10 * 160}{100}$ = 16 г
$m_{общая}$ (раствора) = 80 + 160 = 240 г
$m_{общая}$ ($H_{2}SO_{4}$) = 32 + 16 = 48 г
$w_{общая}$ ($H_{2}SO_{4}$) = $\frac{m_{общая} (H_{2}SO_{4})}{m_{общая} (раствора)}$ * 100% = $\frac{48}{240}$ * 100% = 20%
Ответ: $w_{общая}$ ($H_{2}SO_{4}$) = 20%9. Пять чайных ложек поваренной соли (полных, с горкой) растворите в 450 г (450 мл) воды. Учитывая, что масса соли в каждой ложке примерно 10 г, рассчитайте массовую долю соли в растворе. Возьмите две одинаковые пластиковые бутылки объёмом 0,5 л. В 1−ю налейте полученный раствор, а во 2−ю — водопроводную воду. Поместите бутылки в морозильную камеру холодильника. Загляните в холодильник примерно через час. Какая жидкость начнёт замерзать раньше? В какой буnылке содержимое раньше превратится в лёд? Сделайте вывод.
Ответ:
Дано:
m ($NaCl$) = 50 г
m ($H_{2}O$) = 450 г
Найти:
w ($NaCl$) = ?
Решение:
m (раствора) = 450 + 50 = 500 г
w ($NaCl$) = $\frac{m (NaCl)}{m (раствора)}$ * 100% = $\frac{50}{500}$ * 100% = 10%
Ответ: w ($NaCl$) = 10%
Если в две одинаковые пластиковые бутылки объемом 0,5 л налить полученный раствор и водопроводную воду и поместить бутылки в морозильную камеру холодильника, то водопроводная вода начнет замерзать раньше и раньше превратится в лед.
Вывод: Солёная вода из−за примесей имеет более высокую плотность и более низкую температуру замерзания, чем пресная.Практическая работа №31
Цель работы состоит в приготовлении раствора с заданной массовой долей путём растворения рассчитанной массы твёрдого вещества в определённом объёме воды. Рассчитайте массу твёрдого вещества, необходимого для приготовления раствора, в соответствии с вашим вариантом задания (табл. 3). На весах отмерьте рассчитанную массу твёрдого вещества и перенесите его в химический стакан.
Рассчитайте массу воды, необходимой для приготовления раствора. Поскольку плотность воды равна 1 г/мл, рассчитанная вами масса воды численно равна её объёму. С помощью мерного цилиндра отмерьте вычисленный объём воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
Таблица 3
Варианты заданий для выполнения практической работы №3Вариант Растворенное вещество Масса раствора, г Массовая доля растворенного вещества, %
1 Поваренная соль 80 10
2 Сахар 150 5
3 Сода питьевая 50 2
4 Натриевая селитра 70 101 вариант
Дано:
m (раствора) = 80 г
w (поваренной соли) = 10% = 0,1
Найти:
m (поваренной соли) = ?
m ($H_{2}O$) = ?
Решение:
m (поваренной соли) = m (раствора) * w (поваренной соли) = 80 * 0,1 = 8 г
m ($H_{2}O$) = 80 − 8 = 72 г
Ответ: m (поваренной соли) = 8 г ; m ($H_{2}O$) = 72 г2 вариант
Дано:
m (раствора) = 150 г
w (сахара) = 5% = 0,05
Найти:
m (сахара) = ?
m ($H_{2}O$) = ?
Решение:
m (сахара) = m (раствора) * w (сахара) = 150 * 0,05 = 7,5 г
m ($H_{2}O$) = 150 − 7,5 = 142,5 г
Ответ: m (сахара) = 7,5 г ; m ($H_{2}O$) = 142,5 г3 вариант
Дано:
m (раствора) = 50 г
w (питьевой соды) = 2% = 0,02
Найти:
m (питьевой соды) = ?
m ($H_{2}O$) = ?
Решение:
m (питьевой соды) = m (раствора) * w (питьевой соды) = 50 * 0,02 = 1 г
m ($H_{2}O$) = 50 − 1 = 49 г
Ответ: m (питьевой соды) = 1 г ; m ($H_{2}O$) = 49 г4 вариант
Дано:
m (раствора) = 70 г
w (натриевой селитры) = 10% = 0,1
Найти:
m (натриевой селитры) = ?
m ($H_{2}O$) = ?
Решение:
m (натриевой селитры) = m (раствора) * w (натриевой селитры) = 70 * 0,1 = 7 г
m ($H_{2}O$) = 70 − 7 = 63 г
Ответ: m (натриевой селитры) = 7 г ; m ($H_{2}O$) = 63 г §15
-
§15. Массовая доля примесей
Вопросы
1. Что называется массовой долей примесей? Что показывает эта величина?
Ответ:
Массовая доля примесей — это отношение массы примесей к массе образца.
Массовая доля примесей показывает степень чистоты вещества.2. В промышленности используются вещества с маркировкой «ч», что означает «чистое вещество». Содержание примесей в них может соcтавлять, например, 0,01%. Найдите массу примесей в 120 г образца сажи с маркировкой «ч».
Ответ:
Дано:
w (примесей) = 0,01 % = 0,0001
m (сажи) = 120 г
Найти:
m (примесей) = ?
Решение:
m (примесей) = m (сажи) * w (примесей) = 120 * 0,0001 = 0,012 г = 12 мг
Ответ: m (примесей) = 0,012 г = 12 мг3. Массовая доля примесей в известняке составляет 5%. Рассчитайте массу основного вещества (карбоната кальция), содержащегося в 300 кг природного известняка.
Ответ:
Дано:
w (примесей) = 5% = 0,05
m (известняка) = 300 кг
Найти:
m ($CaCO_{3}$) = ?
Решение:
m (примесей) = m (известняка) * w (примесей) = 300 * 0,05 = 15 кг
m ($CaCO_{3}$) = 300 − 15 = 285 кг
Ответ: m ($CaCO_{3}$) = 285кг4. При очистке медного купороса получилось 150 мг примесей, что составило 2% от массы образца. Определите массу технического медного купороса, который подвергли очистке.
Ответ:
Дано:
m (примесей) = 150 мг
w (примесей) = 2% = 0,02
Найти:
$m_{тех.}$ (медного купороса) = ?
Решение:
$m_{тех.}$ (медного купороса) = $\frac{m (примесей)}{w (примесей)}$ = $\frac{150}{0,02}$ = 7500 мг = 7,5 г
Ответ: $m_{тех.}$ (медного купороса) = 7,5 г5. Для изготовления полупроводниковых батарей используется сверхчистый кремний. Массовая доля примесей в нём не должна превышать 0,0000000001%. Годится ли для данных целей кремний, в 30 кг которого содержится 0,03 мг примесей?
Ответ:
Дано:
m (образца) = 30 кг = 30000000 мг
m (примесей) = 0,03 мг
Найти:
w (примесей) = ?
Решение:
Рассчитаем массовую долю примесей в образце кремния:
w (примесей) = $\frac{m(примесей)}{m(образца)}$ * 100% = $\frac{0,03 }{30000000 }$ * 100% = 0,0000001%
0,0000001% > 0,0000000001%
Ответ: предоставленный кремний для изготовления полупроводниковых батарей не годится, т.к. в нашем образце кремния массовая доля примесей больше, чем должна быть в сверхчистом. §16
-
ГЛАВА III. ЯВЛЕНИЯ, ПРОИСХОДЯЩИЕ С ВЕЩЕСТВАМИ
§16. Разделение смесей
Лабораторный опыт (стр.88)
В колбу с помощью пипетки накапайте 3 − 5 капель одеколона. Встряхните сосуд, понюхайте его содержимое. Затем добавьте в колбу несколько кукурузных палочек. Закройте её пробкой, встряхните. Через 1 − 2 минуты откройте пробку и понюхайте содержимое колбы. Что можно сказать об интенсивности запаха одеколона в первом и во втором случаях? Объясните результат.
Ответ:
Во втором случае запаха мы не почувствуем, так как произошла адсорбция. Адсорбентом в данном случае выступает кукурузная палочка.
Адсорбцией называется способность некоторых твёрдых веществ поглощать своей поверхностью газообразные или растворённые вещества. Вещества, способные к адсорбции, называются адсорбентами.Вопросы
1. На каких свойствах веществ основано разделение смесей?
Ответ:
Разделение смесей основано на:
1) разности размера частиц веществ;
2) разности в магнитных свойствах веществ;
3) разности плотности веществ;
4) разности температур плавления или кипения веществ;
5) растворимости и нерастворимости веществ в различных жидкостях;
6) на смачиваемости и несмачиваемости веществ.2. Приведите примеры разделения смесей с помощью просеивания, известные вам из повседневной жизни.
Ответ:
1) Просеивание муки от лишних частиц
2) Просеивание песка для получения гальки
3) Просеивание земли для удаления мелкого мусора (для садоводства)3. Для отделения золота от пустой породы золото «моют». Какие свойства золота и частиц горной породы используют при этом?
Ответ:
Частицы золота имеют больший размер и плотность, чем частицы горной породы. При отделении золота пустая порода "вымывается", а золото остается в сите.
4. Что такое отстаивание и декантация? Приведите примеры.
Ответ:
Отстаивание − это способ разделения смеси жидкости и твердого нерастворимого вещества.
Декантация − это процесс слития жидкости с остатка.
При отстаивании частицы твердого вещества оседают на дно: чем меньше размер твердых частиц в жидкости, тем дольше будет отстаиваться смесь. В результате отстаивания получают два слоя: верхний слой − жидкость, нижний слой − твердое вещество. При декантации жидкость отделяется от твердого вещества путем ее сливания.
Пример: смесь воды и песка.5. Что такое фильтрование и фильтрат? Какие вещества и материалы могут использоваться для изготовления фильтра?
Ответ:
Фильтрование − это процесс разделения смеси, основанный на различной растворимости в воде веществ, составляющих смесь (например, смесь поваренной соли и песка). Для разделения смеси фильтрованием ее растворяют в воде и пропускают через фильтр. Частицы твердого вещества не проходят через фильтр и оседают на нем, а вода с растворенными вещества просачивается через него.
Фильтрат − это раствор, прошедший через фильтр.
Для изготовления фильтров в зависимости от их назначения, могут использоваться:
1) специальная пористая бумага
2) ткань
3) вата
4) угольный порошок
5) песок6. Приведите примеры способов фильтрования воздуха, которые используются в быту и на производстве.
Ответ:
Способы фильтрования воздуха в быту: использование ватно−марлевых повязок.
Способы фильтрования воздуха на производстве: использование респираторов.7. Что такое центрифугирование? На чём основан этот процесс? Где он применяется?
Ответ:
Цетрифугирование − это процесс разделения неоднородной смеси, содержащей частицы очень малых размеров, которые невозможно отделить отстаиванием или фильтрованием. Смесь помещают в специальный сосуд, который с огромной скоростью вращают в специальном аппарате − центрифуге. В результате более тяжелые частицы оседают на дно сосуда, а легкие оказываются сверху.
Центрифугирование основано на действии центробежной силы, которая во много раз превышает силу земного притяжения.
Этот процесс применяется, например, при сепарировании молока.8. Смешайте столовую ложку сухого молока и речного песка. Пересыпьте смесь в стакан с водой, но не перемешивайте. Для того чтобы песок полностью осел на дно, осторожно постучите по внешней стенке стакана ложкой. Какой из компонентов смеси остался на поверхности воды? Почему?
Ответ:
На поверхности воды осталось сухое молоко, так как порошок сухого молока плохо смачивается водой и удерживается на ее поверхности.
9. В стеклянный стакан насыпьте немного порошка для чистки посуды и налейте полстакана воды. Образуется мутная смесь. Жидкость станет прозрачной только на следующий день. Почему смесь отстаивается так долго?
Ответ:
Смесь порошка для чистки посуды и воды долго отстаивается, так как размеры твердых частиц в ней очень малы.
При отстаивании частицы твердого вещества оседают на дно. Если частицы твердого вещества достаточно крупные, то они быстро оседают на дно, и жидкость становится прозрачной. Чем меньше размер твердых частиц в жидкости, тем дольше будет отстаиваться смесь.10. Растолките пять таблеток активированного угля и смешайте их с четвертью стакана окрашенной газированной воды, например пепси‑колы. Интенсивно перемешайте смесь ложечкой. Что наблюдаете? Сравните окраску отстоявшегося раствора с окраской исходного напитка.
Ответ:
Наблюдается поглощение пузырьков газа активированным углем и обесцвечивание раствора. Это объясняется тем, что активированный уголь способен поглощать своей поверхностью газообразные и растворенные вещества. Эту способность называют адсорбцией, а активированный уголь адсорбентом.
§17
-
§17. Дистилляция, или перегонка
Демонстрационный опыт (стр.89)
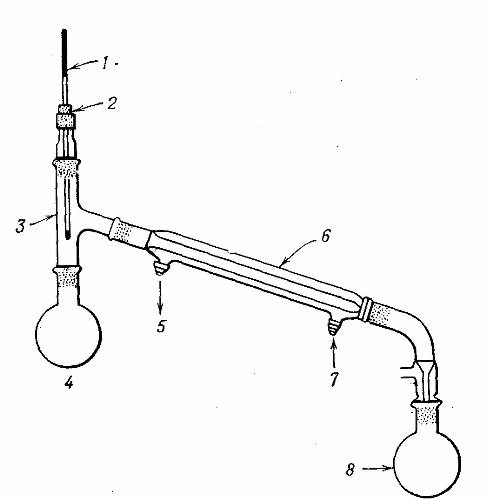
На учительском столе собрана лабораторная установка для перегонки жидкостей (рис.88).
В перегонную колбу учитель наливает воду, подкрашенную в оранжевый цвет растворимой неорганической солью (дихроматом калия).
Так вы воочию убедитесь, что в очищенной воде этого вещества не будет. Для равномерного кипения в колбу бросают 3 − 4 кусочка пористого фарфора или пемзы (кипелки).В холодильник подаётся вода, а содержимое перегонной колбы нагревается до кипения с помощью нагревательного прибора (спиртовки, газовой горелки, электронагревателя). Пары воды, попадая в холодильник, конденсируются, и дистиллированная вода стекает в приёмник.
Какую температуру показывает термометр? Как вы думаете, через какой отвод в холодильник подаётся холодная вода, а через какой она сливается?
Рис. 88 Лабораторная установка для дистилляции жидкостейОтвет:
После дистилляции вода достигает 70 − 85 градусов. В холодильник подаётся вода через отвод под номером 7, а сливается через отвод под номером 5:
Вопросы
1. Что такое дистилляция, или перегонка? На чём она основана?
Ответ:
Дистилляция − это процесс очистки жидкости от примесей. Дистилляция основана на разных температурах кипения чистой жидкости и жидкости, содержащей примеси.
Сущность дистилляции состоит в том, что жидкость, содержащую примеси, нагревают до кипения. Образующиеся пары чистой жидкости отводят и охлаждают. Получается жидкость, очищенная от примесей.2. Какая вода называется дистиллированной? Как её получают? Где она применяется?
Ответ:
Дистиллированная вода − это вода, очищенная от примесей.
Ее получают с помощью процесса, называемого дистилляцией или перегонкой. Для этого неочищенную воду нагревают до кипения, образующиеся пары чистой воды отводят и охлаждают. Получается вода, которая не содержит примесей.
Дистиллированная вода применяется для изготовления лекарств, для приготовления растворов в химических лабораториях, в аккумуляторах автомобилей.3. Какие нефтепродукты получают при перегонке нефти? Где они применяются?
Ответ:
При перегонке нефти получают нефтяной газ, петролейный эфир, бензин, лигроин, керосин, газойль, соляр, мазут.
Продукты фракционной перегонки нефти используют в качестве топлива, а также сырья для нефтехимической промышленности.4. Как разделить воздух на отдельные газы?
Ответ:
Для разделения воздуха на отдельные газы его сжижают при сильном охлаждении и сжатии, а затем подвергают фракционной перегонке. За счет разных температур кипения последовательно отгоняют азот, аргон и кислород.
5. Чем выпаривание (кристаллизация) отличается от перегонки (дистилляции)? На чем основаны оба способа разделения жидких смесей?
Ответ:
Кристаллизация (выпаривание) предназначена для выделения растворенного вещества из раствора.
Дистилляция (перегонка) предназначена для очистки жидкости от примесей.
Оба способа основаны на разнице температур кипения компонентов смеси (раствора).6. Чем отличаются процессы выпаривания и кристаллизации? На чём основаны оба способа выделения твёрдого вещества из раствора?
Ответ:
В случае выпаривания мы удаляем жидкость (растворитель) из смеси (раствора) при помощи нагревания.
В случае кристаллизации мы удаляем растворенное вещество из раствора при помощи охлаждения.
Оба способа основаны на температурном воздействии на смесь (раствор).7. Приведите примеры из повседневной жизни, в которых применяются выпаривание и дистилляция.
Ответ:
Кипячение воды в чайнике – пример выпаривания (в чайнике остается известковый налет). Образование соли на берегах соляных озер так же пример выпаривания. Фракционная перегонка нефти – пример дистилляции. Еще один пример дистилляции – получение дистиллированной воды.
8. Какую массу соли можно получить при выпаривании 250 г 5%−го её раствора? Какой объём воды можно получить из этого раствора при помощи дистилляции?
Ответ:
Дано:
m (раствора) = 250 г
w (соли) = 5% = 0,05
Найти:
m (соли) = ?
V ($H_{2}O$) = ?
Решение:
m (соли) = m (раствора) * w (соли) = 250 * 0,05 = 12,5 г
m ($H_{2}O$) = 250 − 12,5 = 237,5 г
Плотность воды равна 1 (это постоянная величина)
V ($H_{2}O$) = m ($H_{2}O$) * p ($H_{2}O$) = 237,5 * 1 = 237,5 л
Ответ: m (соли) = 12,5 г; V ($H_{2}O$) = 237,5 лПрактическая работа №41
Приготовьте горячий насыщенный раствор соли. Для этого наполовину заполните банку горячей водой (кипяток брать не нужно, чтобы не обжечься). Порциями добавляйте соль и перемешивайте. Когда соль перестанет растворяться, оставьте раствор на одну−две минуты, чтобы нерастворившиеся кристаллы успели осесть. Отфильтруйте раствор через воронку с ватой в чистый термос. Закройте термос крышкой и оставьте раствор медленно остывать два−три часа.
Раствор немного остыл. Теперь внесите в него затравку — кристаллик соли, приклеенный на кончике нитки. После того как ввели затравку, прикройте сосуд крышкой и оставьте на продолжительное время. Чтобы вырос крупный кристалл, потребуется несколько дней.
Обычно на нитке вырастает несколько кристаллов. Надо периодически удалять лишние, что бы рос один большой кристалл.
Важно записывать условия проведения эксперимента и его результат, в нашем случае это характеристики полученного кристалла. Если получилось не сколько кристаллов, то приводят описание самого большого.
Изучите свой кристалл и ответьте на вопросы.
Сколько дней вы выращивали кристалл?
Какова его форма?
Какого цвета кристалл?
Прозрачный он или нет?
Каковы размеры кристалла: высота, ширина, толщина?
Какова масса кристалла?
Зарисуйте или сфотографируйте полученный кристалл (рис. 93, 94).
Рис. 93 Кристалл поваренной соли
Рис. 94 Кристаллы медного купоросаОтвет:
Ход работы:
Я приготовил(а) горячий насыщенный раствор соли. Для этого наполовину заполнил(а) банку горячей водой. Порциями добавил(а) соль и перемешивал(а). Когда соль перестала растворяться, оставил(а) раствор на одну−две минуты, чтобы нерастворившиеся кристаллы успели осесть. Отфильтровал(а) раствор через воронку с ватой в чистый термос. Закрыл(а) термос крышкой и оставил(а) раствор медленно остывать два−три часа. После того как раствор немного остыл, я добавил(а) в него затравку — кристаллик соли, приклеенный на кончике нитки. После того как ввел(а) затравку, прикрыл(а) сосуд крышкой и оставил(а) на продолжительное время. Периодически убирал(а) лишние кристаллы, чтобы рос один большой кристалл.
Наблюдения:
1) Первые маленькие кристаллы появляются в первый−второй день. Свой кристалл я растил(а) две недели.
2) Кристалл имеет неправильную форму, в виде группировки большого числа маленьких кристаллов с острыми краями.
3) Кристалл получился такого же цвета, как и пищевая соль − прозрачный.
4) Размер необходимо измерить линейкой. Мой получился размером: длина = 5 см; ширина = 3,5 см.
5) Массу необходимо измерить на весах. Мой получился весом 12 г.
Практическая работа №51
В химический стакан поместите выданную учителем загрязнённую соль и налейте 50—70 мл дистиллированной воды. Перемешивая содержимое стеклянной палочкой, добейтесь полного растворения соли в воде.
Раствор соли от песка можно отделить фильтрованием. Для этого соберите установку, как показано на рисунке 95. С помощью стеклянной палочки осторожно перелейте содержимое стакана на фильтр. Прозрачный фильтрат будет стекать в чистый стакан, нерастворимые компоненты исходной смеси остаются на фильтре.
Жидкость в стакане — это водный раствор поваренной соли. Выделить из него чистую соль можно выпариванием. Для этого 5—7 мл фильтрата налейте в фарфоровую чашку, поместите её в кольцо штатива и осторожно нагревайте на пламени спиртовки, постоянно перемешивая содержимое стеклянной палочкой до полного выпаривания жидкости. Сравните кристаллы соли, полученные после выпаривания раствора, с исходной загрязнённой солью. Перечислите, какие приёмы и операции вы использовали для очистки загрязнённой соли.
Рис. 95 Установка для фильтрованияОтвет:
Кристаллы соли после очистки имели равномерный белый цвет и не содержали посторонних неоднородных примесей.
Для очистки загрязненной поваренной соли использовались методы фильтрования и выпаривания. §18
-
§18. Химические реакции. Условия протекания и прекращения химических реакций
Демонстрационный опыт (стр.97)
Тщательно смешивают железные опилки и порошок серы (в отношении 7 : 4 по массе). Получилась смесь двух простых веществ, в которой каждое из них сохраняет свои свойства (предложите способы разделения полученной смеси).
Ответ:
1) Железо обладает магнитными свойствами, а сера − нет. Поэтому легко можно отделить железо от серы при помощи магнита.
2) Еще один способ разделения смеси серы и железа основан на разнице в смачиваемости и плотности этих веществ. Сера тяжелее воды, но не смачивается ею, порошок серы всплывает на поверхность. Железо тяжелее воды и смачивается ею, поэтому остается на дне.Демонстрационный опыт (стр.98)
В сосуд или пробирку с небольшим кусочком мрамора приливают раствор соляной кислоты. Происходит бурное выделение газа (рис. 97).
Пробирку−реактор закрывают пробкой с газоотводной трубкой, кончик которой помещают в другую пробирку с известковой водой. О том, что химическая реакция идет, можно судить по появлению белого осадка — помутнению известковой воды (рис. 98). Какой газ выделился в первом опыте? Что является реактивом на этот газ во втором опыте?
рис. 97 Взаимодействие мрамора с соляной кислотой
рис. 98 Помутнение известковой воды при пропускании углекислого газаОтвет:
В первом опыте при взаимодействии мрамора и соляной кислоты выделился углекислый газ.
Реактивом на углекислый газ во втором опыте является известковая вода.Вопросы
1. Какие условия необходимы для протекания химических реакций?
Ответ:
Обязательное условие: соприкосновение реагирующих веществ.
Могут понадобиться дополнительные условия: наличие катализатора, нагревание или воздействие освещения.2. Приведите примеры реакций из повседневной жизни, для протекания которых не требуется первоначальное нагревание.
Ответ:
1) Окисление металлов (железо со временем ржавеет, медь окисляется, алюминий покрывается оксидной пленкой).
2) Взаимодействие уксуса и пищевой соды.
3) Если разрезать яблоко, то мякоть довольно быстро становится коричневатой – это процесс окисления железа, содержащегося в яблоке, кислородом воздуха.
4) В батарейках, аккумуляторах телефонов, планшетов и автомобилей происходят окислительно−восстановительные реакции при их использовании и зарядке.
5) Фотосинтез: процесс синтеза глюкозы из воды и углекислого газа в зелёных растениях при воздействии солнечного света.3. Что такое катализаторы? Что такое ферменты?
Ответ:
Катализаторами называются вещества, которые ускоряют химические реакции, но по их окончании остаются неизменёнными и не входят в состав продуктов.
Биологические катализаторы белковой природы называются ферментами или энзимами.4. Назовите известные вам способы тушения пожаров.
Ответ:
Способы тушения пожаров:
1) Заливание водой или различными пенами.
2) Засыпание песком.
3) Набрасывание плотной ткани.
4) Использование специальных устройств — огнетушителей.5. С помощью учителя или инструкции к применению рассмотрите устройство углекислотного огнетушителя. В чем принцип его действия?
Ответ:
Принцип действия углекислотного огнетушителя основан на вытеснении из корпуса углекислого газа, находящегося в нем под давлением.
6. Прочитайте инструкции к применению высококачественных стиральных порошков — синтетических моющих средств (СМС) с добавлением ферментов (или энзимов). В чем преимущества СМС, содержащих энзимы, перед обычными СМС?
Ответ:
СМС, содержащие энзимы, способны удалять пятна органического происхождения – белковые, жирные, крахмалосодержащие, протеиносодержащие, фруктовые.
7. Почему костер или горящие деревянные постройки тушат водой? Какую роль играет вода в этом процессе?
Ответ:
Горение − это взаимодействие веществ с кислородом воздуха.
Вода выполняет две роли в тушении огня. Во−первых, она перекрывает доступ кислорода воздуха к очагу пламени. Во−вторых, вода снижает температуру горящего объекта (для поддержания процесса горения нужна определенная температура).8. Почему нельзя потушить водой горящую нефть?
Ответ:
Нефть, как и вода, является жидкостью. Но вода и нефть не смешиваются друг с другом. При этом плотность нефти меньше, чем у воды. Таким образом, если смешать нефть и воду, то вода будет внизу, а нефть всегда будет всплывать наверх и горение продолжится. Вода просто не может ограничить доступ воздуха к нефти.
9. Почему нельзя тушить водой горящие электроприборы или электропроводку?
Ответ:
Это связано со способностью воды проводить электричество, которая создает риск удара током.
§19
-
§19. Признаки химических реакций
Демонстрационный опыт 1 (стр.103)
В химическом стакане находится бесцветный раствор щелочи. Обнаружить ее можно с помощью особых веществ — индикаторов (от лат. indication — указатель). Таким индикатором на щелочь является бесцветный спиртовой раствор фенолфталеина.
Если к содержимому стакана прилить несколько капель фенолфталеина, то появится малиновая окраска, «сигналя» о наличии в стакане раствора щелочи.
Затем к содержимому стакана приливают раствор кислоты до исчезновения малиновой окраски. Какой признак протекания химической реакции вы наблюдаете?Ответ:
В данных реакциях мы видим изменение цвета.
Демонстрационный опыт 2 (стр.103)
В двух химических стаканах находятся разноцветные растворы: фиолетово−розовый (перманганат калия в щелочной среде) и оранжевый (подкисленный раствор дихромата калия). В каждый стакан добавляют бесцветный раствор сульфита натрия. Что указывает на протекание в стаканах химических реакций (рис. 103)?

Рис. 103 Взаимодействие раствора перманганата калия (а) и раствора дихромата калия (б) с раствором сульфита натрияОтвет:
На протекание химических реакций указывает изменение цвета раствора в обоих случаях.
Демонстрационный опыт (стр.104)
Несколько кристалликов перманганата калия (буквально два−три) растворите в стакане воды (дождитесь полного растворения вещества). В полученный раствор опустите таблетку аскорбиновой кислоты. Какие изменения указывают на протекание химической реакции?
Ответ:
В реакции с аскорбиновой кислотой происходит постепенное обесцвечивание раствора и выпадение бурого осадка в виде оксида марганца (IV) − $MnO_{2}$.
Лабораторный опыт (стр.104)
В газовой зажигалке с прозрачным корпусом вы видите бесцветную жидкость. Это смесь двух газов, названия которых вы могли прочитать на автозаправочных газонаполнительных станциях или бытовых баллонах, — пропан и бутан. Какие же это газы, если имеют жидкое агрегатное состояние? Дело в том, что внутри резервуара — повышенное давление. Нажмите на клапан, не поджигая газ. Слышите шипение? Пропан и бутан вырываются наружу, принимая привычное для нормального давления газообразное состояние.
Зажгите зажигалку. Протекает химическая реакция горения пропана и бутана (рис. 104).
рис.104 Пламя газовой зажигалки — это реакция горения
Сравните окраску пламени зажигалки с пламенем газовой плиты и свечи. Какое пламя коптит? Проследите связь между свечением пламени и его коптящими свойствами.Ответ:
Пламя газовой плиты не коптящее, имеет голубоватый оттенок, который при сгорании дает углерод, угарный газ. У свечи пламя ярко−оранжевое, коптящее. Зажигалка имеет яркое пламя оранжевого цвета, не коптящее.
Цвет пламени горючих веществ, в основном, определяется присутствием в нем твердых частиц углерода и количеством кислорода.Демонстрационный опыт 1 (стр.105)
В два химических стакана, содержащих бесцветный раствор гидроксида натрия и желтоватый раствор желтой кровяной соли, добавляют раствор хлорида железа $FeCl_{3}$ (рис. 105). Что указывает на то, что мы стали свидетелями химических явлений?
Ответ:
1) В первой реакции с гидроксидом натрия выпадет бурый осадок в виде гидроксида железа (III)
3NaOH + $FeCl_{3}$ = $Fe(OH)_{3}$ (бурый осадок) + 3NaCl
2) Во второй реакции с жёлтой кровяной солью раствор изменяет свой цвет на синий.Демонстрационный опыт 2 (стр.105)
В стакан с полученным в предыдущем опыте бурым осадком добавляют соляную кислоту. Что указывает на то, что протекает химическая реакция?
Ответ:
В ходе реакции происходит растворение бурого осадка − $Fe(OH)_{3}$:
Fe$(OH)_{3}$ + 3HCl = 3 $H_{2}$O + $FeCl_{3}$Вопросы
1. Чем отличаются химические явления от физических?
Ответ:
При химических явлениях происходит превращение одних веществ в другие, а при физических― состав вещества не изменяется.
2. К каким явлениям вы отнесете горение свечи и электрической лампочки? Почему?
Ответ:
Горение свечи относится к химическому явлению, так как при горении парафина образуются новые вещества (углекислый газ и вода), а горение электрической лампочки ― к физическому явлению, так как свечение нити накаливания обусловлено пропусканием электрического тока, а не образованием новых веществ.
3. Приведите примеры известных вам реакций из повседневной жизни, которые сопровождаются изменением цвета, выделением газа или выпадением осадка.
Ответ:
1) Порча еды сопровождается изменением цвета и появлением запаха.
2) Обесцвечивание чая лимоном сопровождается изменением цвета.
3) Подгорание пищи сопровождается изменением цвета.
4) Ржавление гвоздей на двери гаража сопровождается изменением цвета.
5) Реакция гашения пищевой соды уксусом сопровождается выделением газа.
6) Появление накипи на чайнике сопровождается образованием осадка.4. Какой процесс происходит при растворении в воде таких лекарственных средств, как шипучие таблетки аспирина УПСА или витамина С.
Ответ:
При растворении в воде таких лекарственных средств, как шипучие таблетки аспирина УПСА или витамина С, протекает химическая реакция с выделением газа.
5. Какие качественные реакции используются для распознавания кислорода и углекислого газа?
Ответ:
Для распознавания кислорода используется тлеющая лучинка, которая ярко вспыхивает в кислороде.
Для распознавания углекислого газа используется тлеющая лучинка, которая гаснет в углекислом газе, а также помутнение известковой воды при пропускании через неё углекислого газа.6. Под действием так называемых кислотных дождей разрушаются мраморные скульптуры. Какое явление происходит при этом? Почему?
Ответ:
Под действием так называемых кислотных дождей происходит химическая реакция. Кислоты, выпадающие в виде кислотных дождей, реагируют с карбонатом кальция (основной компонент мрамора), превращая его в другие вещества.
7. В литровую стеклянную банку налейте полстакана воды и опустите часть таблетки аспирина УПСА размером с горошину. Что наблюдается при этом?
Чтобы определить, какой газ выделяется в результате химической реакции, опустите в банку тлеющую лучинку (не касаясь жидкости).Ответ:
Мы видим образование пузырьков газа. В результате химической реакции выделяется углекислый газ, т.к. тлеющая лучинка гаснет в его присутствии, поскольку этот газ не поддерживает горение.
8. Возьмите половину чайной ложки гашеной извести (она продается в хозяйственных магазинах) и тщательно размешайте в кипяченой воде. Весь порошок не растворится, но это не беда. Дайте смеси отстояться и перелейте прозрачный раствор в чистый стакан. С помощью трубочки от сока (осторожно, избегайте брызг!) продувайте выдыхаемый воздух через раствор. Вскоре он помутнеет: образуется осадок белого цвета. Сделайте вывод о протекании в стакане химической реакции.
Ответ:
Данная реакция является качественной реакцией на углекислый газ. Признаком протекания химической реакции является образование осадка в виде белых кристаллов (карбоната кальция − $CaCO_{3}$)
$Ca(OH)_{2}$ + $CO_{2}$ = $CaCO_{3}$ (белый осадок) + $H_{2}O$Практическая работа №61
Вам наверняка известен процесс коррозии (ржавления) железа. Под действием внешних условий на металле образуется ржавчина. В этой работе вы выясните, как влияют внешние условия на скорость коррозии железа.
Для проведения эксперимента вам понадобятся три пластиковые бутылки с крышками объемом 250—500 мл; три больших гвоздя длиной 5—10 см; мыло; наждачная бумага для зачистки гвоздей; кипяченая вода; водопроводная вода из−под крана; поваренная соль.
Гвозди нужно помыть с мылом, чтобы избавиться от слоя масла, который защищает их от ржавления. Когда гвозди высохнут, зачистите их поверхность наждачной бумагой и промойте кипяченой водой.
Первую бутылку полностью заполните холодной кипяченой водой, положите туда гвоздь и плотно закройте крышкой.
Вторую бутылку заполните наполовину холодной водой из−под крана. Положите туда гвоздь. Крышкой бутылку закрывать не надо.
В третью бутылку сначала насыпьте две столовые ложки поваренной соли. Заполните ее наполовину холодной водой из−под крана, закройте крышкой и хорошо перемешайте. Когда вся соль растворится, поместите в бутылку третий гвоздь. Крышкой бутылку закрывать не надо.
Чтобы ничего не перепутать, с помощью фломастера пронумеруйте каждую бутылку. Поставьте бутылки в укромное место. Если вода из второй и третьей бутылок будет испаряться, то просто доливайте в них воду из−под крана.
Если все сделано правильно, то через неделю на гвоздях должна образоваться ржавчина. Посмотрите, где ее больше, а где меньше.
Запишите свои наблюдения, расставив номера бутылок напротив соответствующих описаний, например:
ржавчины образовалось мало или ее практически не заметно;
ржавчина хорошо заметна, она крепко держится на гвозде;
ржавчины много, она не держится на гвозде, осыпается с него и образует на дне бутылки бурый осадок.
Сделайте выводы, как влияют на процесс коррозии состав раствора и доступ воздуха.Ответ:
Ход работы:
Гвозди помыл(а) с мылом, чтобы избавиться от слоя масла, который защищает их от ржавления. После высыхания гвоздей, зачистил(а) их поверхность наждачной бумагой и промыл(а) кипяченой водой.
Первую бутылку полностью заполнил(а) холодной кипяченой водой, положил(а) туда гвоздь и плотно закрыл(а) крышкой.
Вторую бутылку заполнил(а) наполовину холодной водой из−под крана и положил(а) туда гвоздь. Крышкой бутылку не закрывал(а)
В третью бутылку сначала насыпал(а) две столовые ложки поваренной соли, после чего заполнил(а) ее наполовину холодной водой из−под крана, закрыл(а) крышкой и хорошо перемешал(а). Когда вся соль растворилась, поместил(а) в бутылку третий гвоздь, крышкой бутылку не закрывал(а).
Чтобы ничего не перепутать, с помощью фломастера пронумеровал(а) каждую бутылку.
Сосуд с кипяченой водой, герметично закупоренный − 1
Сосуд с водопроводной водой, открытый − 2
Сосуд с водопроводной водой, открытый, немного подсоленный − 3
Поставил(а) бутылки в укромное место.
Наблюдения:
Результаты работы по истечению недели:
Ржавчины образовалось мало или ее практически не заметно − сосуд номер 1
Ржавчина хорошо заметна, она крепко держится на гвозде − сосуд номер 2
Ржавчины много, она не держится на гвозде, осыпается с него и образует на дне бутылки бурый осадок − сосуд номер 3
Вывод:
Процесс коррозии объясняется тем, что растворенный в воде кислород усиливает коррозию, а если там ещё соль, то коррозионные процессы протекают ещё более интенсивно из−за образования гальванического элемента.


