 В этой статье на момент ее издания приведен один из передовых учебников, ведь он выпущен в 2019 году. Однако несмотря на переиздания от года к году, сам принцип преподнесения материала больше похож на копирование из предыдущих версий, когда обо всем понемножку, а не то что с начала и до самого конца все по полочкам.
В этой статье на момент ее издания приведен один из передовых учебников, ведь он выпущен в 2019 году. Однако несмотря на переиздания от года к году, сам принцип преподнесения материала больше похож на копирование из предыдущих версий, когда обо всем понемножку, а не то что с начала и до самого конца все по полочкам.
Так вот здесь представим учебник по химии автора Кузнецовой изданный в 2019 году с готовыми домашними заданиями.
Все наши ответы проверены преподавателем химии в университете. Будет много теории и практики, которая потребует записи химических реакций, а сверится с верным их написанием можно как раз будет у нас.
Решебник (ГДЗ ответы) к учебнику по химии 8 класса Н. Е. Кузнецова 2019:
Кликайте по номерам параграфов, чтобы выбрать нужную страницу с ответами.
§3
-
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения.
§3. Физические и химические явления.
1. Приведите примеры физических и химических явлений. По каким признакам можно отличить физическое явление от химического?
Ответ
Физические явления
Замерзание воды
Расширение газа при его нагревании
Смачивание тряпки
Испарение спирта
Нагрев нити накаливания в лампочке
Размягчение металлов при нагревании
Химические явления
Ржавление железного гвоздя
Горение угля
Прогоркание масла
Взаимодействие пищевой соды с уксусом
Появление накипи в чайнике
Позеленение медной крыши
Физические явления состоят в изменении тел, при этом образования новых веществ не происходит. О протекании химических реакций можно судить но таким признакам: образование газообразного или нерастворимого вещества, выделение или поглощение энергии, изменение цвета вещества.2. Повторите по учебнику физики параграф о физических свойствах веществ.
Ответ
Вещества имеют следующие физические свойства: температура плавления, температура кипения, вязкость, плотность, диэлектрическая проницаемость, теплоёмкость, теплопроводность, электропроводность, цвет, твёрдость, пластичность, упругость.
3. Приведите примеры химических реакций, происходящих в природе и в организме человека.
Ответ
Примеры химических реакций:
в природе
Горение торфа
Образование кислот во влажной атмосфере из вулканических газов
Образование озона во время грозовых разрядов
Гниение растительных остатков
в организме человека
Ферментное расщепление белков
Дыхание
Синтез холестерина
Образование провитамина витамина D в коже4. Какой процесс – химический или физический – происходит: а) при образовании ржавчины на железных предметах; б) при выветривании горных пород; в) при испарении воды из водоёма (озера, моря); г) при кипячении воды в чайнике; д) при сжигании бензина в двигателе автомобиля; e) при потемнении изделий из серебра?
Ответ
Химические процессы: а) образование ржавчины на железных предметах; д) сжигание бензина в двигателе автомобиля; e) потемнение изделий из серебра.
Физические процессы: б) выветривание горных пород; в) испарение воды из водоёма; г) кипячение воды в чайнике.5. Дома проведите следующий опыт: положите в стакан одну чайную ложку питьевой соды и прилейте столовую ложку уксуса (столовый уксус – это раствор уксусной кислоты). С помощью горящей спички выясните, какой газ выделяется в результате протекающей реакции. Узнайте у родителе, в каких случаях применяется эта реакция, называемая в быту гашением соды.
Ответ
При добавлении уксуса в стакан с питьевой содой, наблюдается выделение газа. При опускании горящей спички в стакан, наблюдается потухание спички, т. е. в результате реакции выделился углекислый газ – газ не поддерживающий горение.
Данная реакция используется для приготовления пышной выпечки. §4
-
§4. Описание физических свойств веществ.
1. Заполните таблицу по образцу. Результаты работы обсудите с товарищем.
Сравнительная характеристика веществ
Сравниваемые вещества Свойства сходные различные а) Медь
б) ЖелезоТвёрдые вещества (при н. у.)
Не имеют запаха
Не растворимы в воде
Проводники электрического токаЦвет (железо - серый, медь - золотисто-розовый)
Плотность (железо - 7,87 г/см³, медь - 8,92 г/см³)
Температура плавления (железо - 1539°C, медь - 1083°C)
Температура кипения (железо - 2861°C, медь - 2567°C)
Теплопроводность (железо - 92 Вт/(м∙K), медь - 401 Вт/(м∙K))а) Сахарный песок
б) Поваренная сольТвёрдые вещества (при н. у.)
Бесцветный (кристаллы), белый (порошок)
Не имеют запаха
Растворимы в воде
Плохая теплопроводность
Не проводят электрический токаПлотность (сахарный песок - 1,59 г/см³, поваренная соль - 2,17 г/см³)
Температура плавления (сахарный песок - 186°C, поваренная соль - 801°C)
Температура кипения (сахарный песок - разлагается, поваренная соль - 1465°C)2. В кабинете химии есть две одинаковые но размерам и форме ступки: чугунная и медная. Какая из них имеет большую массу? Почему?
Ответ
Медная ступка имеет большую массу, чем чугунная ступка, так как плотность меди больше плотности чугуна.
3. Опишите физические свойства алюминия, уксусной кислоты, питьевой соды.
Ответ
Алюминий – твёрдое вещество серебристо-белого цвета, без запаха, нерастворимое в воде, ρ = 2,7 г/см3, tплав. = 660°C, tкип. = 2519°C, хороший проводник тепла и электрического тока.
Уксусная кислота – бесцветная жидкость с резким запахом, растворимое в воде, ρ = 1,05 г/см3, tплав. = 16,75°C, tкип. = 118,1°C, не проводит электрический ток.
Гидрокарбонат натрия – твёрдое вещество белого цвета (порошок), без запаха, растворимое в воде, ρ = 2,16 г/см3, разлагается при 60-200°C, не проводит электрический ток.4. На каких свойствах веществ основано применение: а) алюминия для изготовления посуды; б) графита для изготовления карандашных стержней; в) серебра для изготовления столовых приборов?
Ответ
а) Алюминий применяют для изготовления посуды потому, что алюминий обладает низкой плотностью (легкий) и высокой пластичностью (легко поддаётся формовке).
б) Графит применяют для изготовления карандашных стержней, что графит обладает низкой твердостью (при трении расслаивается на отдельные чешуйки), имеет серый цвет.
в) Серебро применяют для изготовления столовых приборов потому, что серебро обладает низкой реакционной способностью, высокой пластичностью (легко поддаётся формовке), имеет большой коэффициент отражения (близок к 100%).5. Плотность воздуха при 0°C равна 1,29 кг/м3, а плотность жидкого воздуха при -194°C равна 960 кг/м3. Как объяснить такое различие плотностей? Как получают жидкий воздух?
Ответ
Плотность воздуха при -194°C намного больше, чем при 0°C, потому что в жидком воздухе расстояние между молекулами намного меньше, чем у газообразного воздуха.
Получение жидкого воздуха. В первой камере воздух сжимают и одновременно охлаждают, затем его перенаправляют в другую камеру, где он резко расширяется, расширение вызывает понижение температуры газов, из-за этого образуются капельки жидкого воздуха.6. Пользуясь справочными таблицами, рассчитайте массу кубика льда, объём которого равен 15 см3; алюминиевой проволоки объёмом 300 см3.
Ответ
Дано:
`V("льда") = 15" см"^3`
`ρ("льда") = 0.9167" г/см"^3`
`V("алюминия") = 300" см"^3`
`ρ("алюминия") = 2.699" г/см"^3`
`m("льда") = ?`
`m("алюминия") = ?`
Решение
`m("льда") = ρ("льда")*V("льда") = 0.9167*15 = 13.75 г`
`m("алюминия") = ρ("алюминия")*V("алюминия") = 2.699*300 = 809.7 г`
Ответ: `m("льда") = 13.75 г`, `m("алюминия") = 809.7 г`.7. Каковы области применения: а) воды: б) углекислого газа; в) алюминия; г) меди; д) серебра? Какими свойствами веществ обусловлены различные способы их использования? Выберите любое из перечисленных веществ и оформите ответ в виде схемы, разместив её на одной стороне листа альбома для рисования. Часть информации можно выразить с помощью рисунков. Для составления перечня способов применения выбранного вами вещества воспользуйтесь дополнительной литературой.
Ответ
а) области применения воды:
в качестве теплоносителя и охладителя (обладает наибольшей теплоёмкостью и теплотой испарения среди жидкостей)
в качестве растворителя (вода является растворителем для многих веществ)
б) области применения углекислого газа:
в качестве консерванта (не поддерживает дыхание аэробных микроорганизмов)
в системах пожаротушения и в огнетушителях (углекислый газ не поддерживает горение)
для газирования напитков (обладает хорошей растворимостью в воде относительно других газов)
твёрдый углекислый газ используется качестве хладагента (т.к. твёрдый углекислый газ при н.у. сублимирует)
в) области применения алюминия:
силовые линии электропередач (обладает низкой плотностью и высокой электропроводностью)
сплавы для авиастроения (низкая плотность и высокая пластичность)
посуда (низкая плотность и высокая пластичность)
детали машин (хорошо подвергается механической обработке)
радиаторы (высокая теплопроводность)
г) области применения меди:
электрокабеля, электропроводка (высокая электропроводность)
радиаторы (высокая теплопроводность)
трубы (в связи с высокой механической прочностью и пригодностью для механической обработки)
сплавы
д) области применения серебра:
электрические клеммы (высокая электропроводность и коррозионная стойкость)
ювелирные изделия и посуда (пластичность, коррозионная стойкость и светоотражающая способность) §5
-
§5. Атомы. Молекулы. Химические элементы.
1. Найдите в таблице "Периодическая система химических элементов Д. И. Менделеева" элементы, символы которых начинаются с букв H, О, С, N или состоят из них, прочитайте и произнесите их названия.
Ответ
Символ элемента Русское название Произношение химического знака H Водород Аш O Кислород О C Углерод Цэ N Азот Эн 2. Расскажите друг другу, как произносятся названия следующих химических элементов: P, Hg, Al, Fe, O, H, Pb.
Ответ
P – пэ;
Hg – гидраргирум;
Al – алюминий;
Fe – феррум;
O – о;
H – аш;
Pb – плюмбум.3. Используя Интернет, выясните, какие химические элементы названы в честь стран; в честь учёных.
Ответ
Химические элементы названые в честь стран: германий (Ge), галлий (Ga), рутений (Ru), индий (In), франций (Fr), америций (Am).
Химические элементы названые в честь учёных: кюрий (Cm), эйнштейний (Es), Фермий (Fm), Менделевий (Md), Нобелий (No), Лоуренсий (Lr), Резерфордий (Rf), Сиборгий (Sg), Борий (Bh), Хассий (Hs), Мейтнерий (Mt), Оганесон (Og).4. Классификацией называют логическую операцию разделения какого-либо класса предметов на виды по определённому признаку. Составьте простейшую компьютерную схему классификации химических элементов и обсудите её с товарищем.
Ответ
Все химические элементы можно поделить на две большие группы – металлы и неметаллы.
§6
-
§6. Формы существования химических элементов. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения.
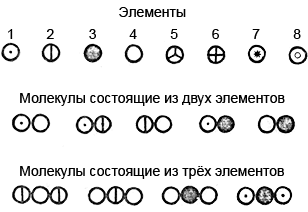
1. Рассмотрите изображения моделей молекул различных химических соединений. Какие из них относятся к простым веществам, какие – к сложным?

Ответ
Простые вещества образованы атомами одного химического элемента, поэтому к ним относится водород (H2).
Сложные вещества образованы атомами разных химических элементов, поэтому к ним относится пероксид водорода (H2O2), аммиак (NH3) и диоксид азота (NO2).2. Как строение вещества сказывается на его свойствах?
Ответ
Различают вещества молекулярного и немолекулярного строения.
Атомы в немолекулярных кристаллах связаны друг с другом разными способами, но всегда очень прочно, поэтому вещества немолекулярного плавятся и переходят в газообразное состояние только при очень сильном нагревании, когда энергии достаточно, чтобы разрушить прочные связи, с помощью которых частицы удерживаются в кристалле. Например, температура плавления поваренной соли равна 801°С.
Вещества молекулярного строения не столь прочны: молекулы в них связаны слабыми, легко разрушающимися связями, поэтому вещества такого строения (иод, лёд, кристаллический углекислый газ) легкоплавки и летучи.3. Вставьте пропущенные слова: а) в состав … хлорофилла входят … магния; б) в состав … уксусной кислоты входят … углерода, кислорода и водорода; в) кислород, водород, графит, фосфор – ….
Ответ
а) в состав молекулы хлорофилла входят атомы магния;
б) в состав молекулы уксусной кислоты входят атомы углерода, кислорода и водорода;
в) кислород, водород, графит, фосфор – простые вещества.4. Как следует классифицировать вещества по их составу? Постройте схему классификации и обсудите её с товарищем.
Ответ
По составу вещества делятся на простые и сложные.
Простые вещества делятся на: металлы, неметаллы, благородные газы.5. Белый фосфор при самом слабом нагревании на воздухе легко загорается, поэтому его хранят под слоем воды; температура плавления этого вещества составляет 44,2°С. Какие предположения о строении белого фосфора можно сделать на основании этих данных?
Ответ
Так как температура плавления белого фосфора составляет 44,2°С, то можно предположить, что белый фосфор имеет молекулярное строение.
§7
-
§7. Состав веществ. Закон постоянства состава. Химические формулы.
1. Дайте формулировку закона постоянства состава. Каково его практическое значение?
Ответ
Формулировка закона постоянства состава вещества:
"Многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав".2. Опишите качественный и количественный состав следующих веществ: H2S – сероводород; HNO3 – азотная кислота; MgSO4 – сульфат магния; Al2O3 – оксид алюминия; H3PO4 – ортофосфорная кислота.
Ответ
Вещество Качественный состав
одной молекулыКоличественный состав H2S – сероводород Состоит из атомов водорода и кислорода Содержит 2 атома водорода и 1 атом серы HNO3 – азотная кислота Состоит из атомов водорода, азота и кислорода Содержит 1 атом водорода, 1 атом азота и 3 атома кислорода MgSO4 – сульфат магния Состоит из атомов магния, серы и кислорода Содержит 1 атом магния, 1 атом серы и 4 атома кислорода Al2O3 – оксид алюминия Состоит из атомов алюминия и кислорода Содержит 2 атома алюминия и 3 атома кислорода H3PO4 – ортофосфорная кислота Состоит из атомов водорода, фосфора и кислорода Содержит 3 атома водорода, 1 атом фосфора и 4 атома кислорода §8
-
§8. Атомно-молекулярное учение в химии.
1. Когда и где возникли первые представления об атомах?
Ответ
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнегреческими философами (V-IV века до н. э.). Данная натурфилософская теория получила название атомизм.
В 1741 г. в книге "Элементы математической химии" М. В. Ломоносов фактически сформулировал основы атомно-молекулярного учения. Русский учёный-энциклопедист рассматривал строение вещества не как определённую комбинацию атомов, но как сочетание более крупных частиц – корпускул, которые, в свою очередь, состоят из более мелких частиц – элементов. Терминология Ломоносова со временем претерпела изменения: то, что он называл корпускулами, стали называть молекулами, а на смену термину элемент пришёл термин атом.2. К каким явлениям относятся диффузия и броуновское движение? С помощью какой теории и как объясняются эти явления?
Ответ
Диффузия и броуновское движение относятся к физическим явлениям.
Данные явления объясняются с помощью атомно-молекулярной теории, которая гласит о том, что атомы и молекулы находятся в непрерывном движении.3. В одной из работ М. В. Ломоносов писал: "Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел…. Корпускулы есть собрание элементов в одну небольшую массу…. Корпускулы однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом…. Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел". Перепишите заменив в цитате выделенные слова современными терминами.
Ответ
Атом есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел…. Молекулы есть собрание атомов в одну небольшую массу…. Молекулы однородны, если состоят из одинакового числа одних и тех же атомов, соединённых одинаковым образом…. Молекулы разнородны, когда атомы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел.
4. Используя Интернет, а также знания, приобретённые на уроках истории, физики и химии, составьте хронологическую таблицу, отражающую историю развития атомно-молекулярного учения, начиная с его зарождения. Обсудите результаты работы в малых группах.
Ответ
Хронологическая таблица. История развития атомно-молекулярного учения.
Дата/Период Событие V в. до н. э. В древней Греции возникло представление о том, что материя состоит из отдельных частиц – атомов. Атомизм был создан представителями древнегреческой философии Левкиппом и его учеником Демокритом. V в. н. э. С ростом влияния схоластики и упадка Римской империи атомная теория атомизма была отвергнута на многие века в пользу алхимических теорий. XVII век Исследователи вновь вернулись к атомной теории. Благодаря работам Пьерра Гассенди возникли теории "зацепленных атомов", "склеенных атомов" и "слипания посредством согласованных движений". 1661 год В трактате "The Sceptical Chymist" Роберта Бойля говорится о том, что материя состоит из скоплений частиц (кластеров), и что химические изменения являются результатом перестройки этих кластеров. Р. Бойль утверждал, что основные элементы материи состоят из частиц различного типа и размера, называемых "корпускулами", которые способны организовываться в группы. 1718 год Основываясь на концепции Бойля о комбинациях кластеров, французский химик Этьен Франсуа Жоффруа разработал теорию химического сродства для объяснения комбинаций частиц, полагая, что определенная алхимическая "сила" притягивает определенные алхимические компоненты. Эти таблицы сохраняли свою актуальность до конца столетия, пока не были вытеснены более глубокими концепциями, введенными Клодом Бертолле. 1741 год В книге "Элементы математической химии" М. В. Ломоносов фактически сформулировал основы атомно-молекулярного учения. Русский учёный-энциклопедист рассматривал строение вещества не как определённую комбинацию атомов, но как сочетание более крупных частиц – корпускул, которые, в свою очередь, состоят из более мелких частиц – элементов. 1801 год Открыт закон парциальных давлений (закон Дальтона). 1802 год Открыт закон растворимости газов в жидкостях (закон Генри-Дальтона). 1803 год Дальтоном открыт закон кратных отношений. 1808 год Дальтон изложил свою атомистическую гипотезу в труде "Новая система химической философии". 5. Один из создателей атомно-молекулярного учения Дж. Дальтон полагал, что все его рассуждения можно зарисовать или изобразить схематически. Попробуйте проиллюстрировать положения атомно-молекулярного учения так, чтобы получился целостный его конспект.
Ответ
Основные положения теории Дальтона:
Всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц – все вещества состоят из большого числа атомов (простых или сложных). Различие между веществами обусловлено различием между их частицами.
Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
Частицы (атомы) различных веществ различны – как по массе, так и по свойствам.
Атомы различных элементов способны соединяться между собой в определённых соотношениях.
Важнейшим свойством атомов является атомный вес. §9
-
§9. Масса атома. Атомная единица массы. Относительная атомная масса элемента.
1. Как вы определите понятия "макромир", "микромир"?
Ответ
Микромир – это молекулы, атомы, элементарные частицы – мир предельно малых, непосредственно не наблюдаемых микрообъектов, пространственная размерность которых исчисляется от 10-18 до 10-4 м.
Макромир – мир соразмерных человеку величин, пространственные величины выражаются в миллиметрах, сантиметрах и километрах.2. Что означают следующие записи: ma(O) = 16 а.е.м.; ma(C) = 12 а.е.м.; ma(S) = 32 а.е.м.?
Ответ
Запись ma(O) = 16 а.е.м. означат то, что масса атома кислорода равна 16 частям 1/12 массы углерода.
Запись ma(C) = 12 а.е.м. означат то, что масса атома углерода равна 12 частям 1/12 массы углерода.
Запись ma(S) = 32 а.е.м. означат то, что масса атома серы равна 32 частям 1/12 массы углерода.
Знак ma обозначает массу одного атома элемента. 1/12 массы углерода = 1,66∙10-24 г.3. Выпишите округлённые значения относительных атомных масс элементов № 5, 11, 18, 20.
Ответ
Ar(В) = 11
Ar(Na) = 23
Ar(Ar) = 40
Ar(Ca) = 404. Объясните, что означают следующие записи: Ar(H) = 1,008 ≈ 1; Ar(Ag) = 107,87 ≈ 108.
Ответ
Запись Ar(H) = 1,008 ≈ 1 означает, что отношение массы атома водорода к 12 массы атома углерода с массовым числом 12, равна 1,008 или ≈ 1. Либо атомная масса водорода равна 107,87 или ≈ 108.
Запись Ar(Ag) = 107,87 ≈ 108 означает, что отношение массы атома серебра к 12 массы атома углерода с массовым числом 12, равна 107,87 или ≈ 108. Либо атомная масса серебра равна 107,87 или ≈ 108. §10
-
§10. Относительная молекулярная масса веществ. Массовые доли элементов в соединениях.
1. Определите относительные молекулярные массы следующих веществ: CO2, CuO, H2O, CH4. Рассчитайте массовые доли элементов, входящих в состав этих соединений.
Ответ
1) Дано:
`CO_2`
`M_r(CO_2) = ?`
`ω(C) = ?`
`ω(O) = ?`
Решение
`M_r(CO_2) = A_r(C) + 2*A_r(O) = 12 + 2*16 = 44`
`ω(C) = (100*A_r(C))/(M_r(CO_2)) = (100*12)/44 = 27.27%`
`ω(O) = (100*2*A_r(O))/(M_r(CO_2)) = (100*2*16)/44 = 72.73%`
Ответ: `M_r(CO_2) = 44`, `ω(C) = 27.27%`, `ω(O) = 72.73%`.
2) Дано
`CuO`
`M_r(CuO) = ?`
`ω(Cu) = ?`
`ω(O) = ?`
Решение
`M_r(CuO) = A_r(Cu) + A_r(O) = 64 + 16 = 80`
`ω(Cu) = (100*A_r(Cu))/(M_r(CuO)) = (100*64)/80 = 80%`
`ω(O) = (100*A_r(O))/(M_r(CuO)) = (100*16)/80 = 20%`
Ответ: `M_r(CuO) = 80`, `ω(C) = 80%`, `ω(O) = 20%`.
3) Дано:
`H_2O`
`M_r(H_2O) = ?`
`ω(H) = ?`
`ω(O) = ?`
Решение
`M_r(H_2O) = 2*A_r(H) + A_r(O) = 2*1 + 16 = 18`
`ω(H) = (100*2*A_r(H))/(M_r(H_2O)) = (100*2*1)/18 = 11.11%`
`ω(O) = (100*A_r(O))/(M_r(H_2O)) = (100*16)/18 = 88.89%`
Ответ: `M_r(H_2O) = 18`, `ω(H) = 11.11%`, `ω(O) = 88.89%`.
4) Дано:
`CH_4`
`M_r(CH_4) = ?`
`ω(C) = ?`
`ω(H) = ?`
Решение
`M_r(CH_4) = A_r(C) + 4*A_r(H) = 12 + 4*1 = 16`
`ω(C) = (100*A_r(C))/(M_r(CH_4)) = (100*12)/16 = 75%`
`ω(H) = (100*4*A_r(H))/(M_r(CH_4)) = (100*4*1)/16 = 25%`
Ответ: `M_r(CH_4) = 16`, `ω(C) = 75%`, `ω(O) = 25%`.2. Рассчитайте массы молекул сероводорода, серной кислоты, кислорода. Полученные массы молекул переведите в единицы массы, используемые для описания объектов макромира.
Ответ
Дано:
`H_2S`
`H_2SO_4`
`O_2`
`m_м(H_2S) = ? г`
`m_м(H_2SO_4) = ? г`
`m_м(O_2) = ? г`
Решение
`m_м(H_2S) = 2*m_а(H) + m_а(S) = 2*1 + 32 = 34" а.е.м." = 5.64*10^-23 г`
`m_м(H_2SO_4) = 2*m_а(H) + m_а(S) + 4*m_а(O) = 2*1 + 32 + 4*16 = 1.63*10^-22 г`
`m_м(O_2) = 2*m_а(O) = 2*16 = 32" а.е.м." = 5.31*10^-23 г`
Ответ: `m_м(H_2S) = 5.64*10^-23 г`, `m_м(H_2SO_4) = 1.63*10^-22 г`, `m_м(O_2) = 5.31*10^-23 г`.3. Какую информацию о веществе сообщает химическая формула? Ответьте на этот вопрос (письменно), рассматривая формулы веществ: азотной кислоты HNO3, хлорида алюминия AlCl3, пероксида водорода H2O2.
Ответ
Химическая формула сообщает информацию о качественном и количественном составе вещества, по ней можно определить относительную и абсолютную молекулярные массы молекулы, а также массовые доли элементов входящих в состав молекулы.
HNO3 AlCl3 H2O2 Качественный состав Состоит из атомов водорода, азота и кислорода Состоит из атомов алюминия и хлора Состоит из атомов водорода и кислорода Количественный состав Состоит из 1 атома водорода, 1 атома азота и 3 атомов кислорода Состоит из 1 атома алюминия и 3 атомов хлора Состоит из 2 атомов водорода и 2 атомов кислорода Относительная молекулярная масса вещества Mr(HNO3) = 63 Mr(AlCl3) = 133.5 Mr(H2O2) = 34 Масса молекулы ma(HNO3) = 63 а.е.м. ma(AlCl3) = 133.5 а.е.м. ma(H2O2) = 34 а.е.м. Массовые доли элементов
`ω("Э") = (100*n*A_r("Э"))/(M_r("в-ва"))`ω(H) = 1.6%
ω(N) = 22.2%
ω(O) = 76.2%ω(Al) = 20.2%
ω(Cl) = 79.8%ω(H) = 5.9%
ω(O) = 94.1%4. Сравните понятия "масса молекулы" и "относительная молекулярная масса".
Ответ
Масса молекулы – абсолютная молекулярная масса, которая обычно выражается в атомных единицах массы или в граммах.
Относительная молекулярная масса – это величина, показывающая, во сколько раз масса молекулы больше 1/12 массы атома углерода-12, не имеет единицы измерения.
Если масса молекулы выражается в а.е.м., то масса молекулы численно равна относительной молекулярной массе.5. Из курса ботаники вы знаете, что для роста зелёной массы растений необходим азот. Использование какого минерального удобрения (аммиачная селитра NH4NO3, калийная селитра KNO3, мочевина (NH2)2CO) окажется наиболее эффективным и почему? Как вы полагаете, является ли содержание в веществе элемента, необходимого для растений, единственным фактором, определяющим целесообразность его использования в качестве удобрения?
Ответ
Для того, чтобы определить какое минеральное удобрение окажется наиболее эффективным для роста зелёной массы растений, необходимо рассчитать массовые доли азота в представленных удобрениях. Наиболее эффективным удобрением будет то, в котором массовая доля азота будет наибольшей.
Дано:
`"а) "NH_4NO_3`
`"б) "KNO_3`
`"в) "(NH_2)_2CO`
`ω(N) = ?`
Решение
а) `ω(N) = (100*2*A_r(N))/(M_r(NH_4NO_3)) = (100*2*14)/80 = 35%`
б) `ω(N) = (100*A_r(N))/(M_r(KNO_3)) = (100*14)/101 = 13.86%`
в) `ω(N) = (100*2*A_r(N))/(M_r((NH_2)_2CO)) = (100*2*14)/60 = 46.67%`
Ответ: а) `ω(N) = 35%`, б) `ω(N) = 13.86%`, в) `ω(N) = 46.67%`.
Наиболее эффективным удобрением является мочевина (NH2)2CO.
Наибольшее содержание элемента в веществе, необходимого для растений, не является единственным фактором, определяющим целесообразность его использования в качестве удобрения. Применение удобрений зависит от множества фактов, таких как: биодоступность удобрения, растворимость удобрения, состав почвы (содержание других питательных веществ и микроэлементов), pH почвы и т. д.6. Какая из руд наиболее богата железом: гематит Fe2O3, магнитный железняк Fe3O4, сидерит FeCO3? Ответ подтвердите расчётами, считая содержание минералов и пустой породы в рудах одинаковым.
Ответ
Дано:
`"а) "Fe_2O_3`
`"б) "Fe_3O_4`
`"в) "FeCO_3`
`ω_"наибол."(Fe) = ?`
Решение
а) `ω(Fe) = (100*2*A_r(Fe))/(M_r(Fe_2O_3)) = (100*2*56)/160 = 70%`
б) `ω(Fe) = (100*3*A_r(Fe))/(M_r(Fe_3O_4)) = (100*3*56)/232 = 72.41%`
в) `ω(Fe) = (100*A_r(Fe))/(M_r(FeCO_3)) = (100*56)/116 = 48.28%`
Ответ: наиболее богат железом магнитный железняк `Fe_3O_4`, `ω(Fe) = 72.41%`.7. Какова формула вещества, исследованного в лаборатории, если анализ показал, что оно на 50% состоит из серы и на 50% из кислорода?
Ответ
Дано:
`S_xO_y`
`ω(S) = 50%`
`ω(O) = 50%`
`S_xO_y = ?`
Решение
`ω(S) = (100*x*A_r(S))/(M_r(S_xO_y))`
`ω(O) = (100*y*A_r(O))/(M_r(S_xO_y))`
`x = (ω(S)*M_r(S_xO_y))/(100*A_r(S)) = (50*M_r(S_xO_y))/(100*32) = 0.015625*M_r(S_xO_y)`
`y = (ω(O)*M_r(S_xO_y))/(100*A_r(O)) = (50*M_r(S_xO_y))/(100*16) = 0.03125*M_r(S_xO_y)`
`x" : "y = 0.015625*M_r(S_xO_y)" : "0.03125*M_r(S_xO_y)`
`x" : "y = 1" : "2`
`SO_2`
Ответ: формула вещества `SO_2`. §11
-
§11. Что показывают химический знак и химическая формула.
1. Выпишите информацию, которую сообщают химические символы Mg, S, Na, Cl.
Ответ
Mg S Na Cl Порядковый номер 12 16 11 17 Название химического элемента Магний Сера Натрий Хлор Относительная молекулярная масса вещества Mr(Mg) = 24 Mr(S) = 32 Mr(Na) = 23 Mr(Cl) = 35,5 Масса атома ma(Mg) = 24 а.е.м. ma(S) = 32 а.е.м. ma(Na) = 23 а.е.м. ma(Cl) = 35,5 а.е.м. 2. Какую информацию несут формулы следующих соединений: а) NO2; б) H2S; в) CH4; г) H3PO4?
Ответ
Химическая формула сообщает информацию о качественном и количественном составе вещества, по ней можно определить относительную и абсолютную молекулярные массы молекулы, а также массовые доли элементов входящих в состав молекулы.
а) NO2 б) H2S в) CH4 г) H3PO4 1) Качественный состав вещества Молекула состоит из атомов двух химических элементов: N, O. Молекула состоит из атомов двух химических элементов: H, S. Молекула состоит из атомов двух химических элементов: C, H. Молекула состоит из атомов трёх химических элементов: H, P, O. 2) Количественный состав вещества В состав молекулы входят 3 атома: 1 атом азота, 2 атома кислорода. В состав молекулы входят 3 атома: 2 атома водорода, 1 атом серы. В состав молекулы входят 5 атомов: 1 атом углерода, 4 атома водорода. В состав молекулы входят 8 атомов: 3 атома водорода, 1 атом фосфора, 4 атома кислорода. 3) Относительная молекулярная масса вещества Mr(NO2) = 46 Mr(H2S) = 34 Mr(CH4) = 16 Mr(H3PO4) = 98 4) Масса молекулы ma(NO2) = 46 а.е.м. ma(H2S) = 34 а.е.м. ma(CH4) = 16 а.е.м. ma(H3PO4) = 98 а.е.м. 5) Массовые доли элементов `ω(N) = (100*A_r(N))/(NO_2) = (100*14)/46 = 30.4%`
`ω(O) = (100*2*A_r(O))/(NO_2) = (100*2*16)/46 = 69.6%``ω(H) = (100*2*A_r(H))/(H_2S) = (100*2*1)/34 = 5.9%`
`ω(S) = (100*A_r(S))/(H_2S) = (100*32)/34 = 94.1%``ω(C) = (100*A_r(C))/(CH_4) = (100*12)/16 = 75%`
`ω(H) = (100*4*A_r(H))/(CH_4) = (100*4*1)/16 = 25%``ω(H) = (100*3*A_r(H))/(H_3PO_4) = (100*3*1)/98 = 3.1%`
`ω(P) = (100*A_r(P))/(H_3PO_4) = (100*31)/98 = 31.6%`
`ω(O) = (100*4*A_r(O))/(H_3PO_4) = (100*4*16)/98 = 65.3%`3. В лаборатории установили, что некое вещество содержит 75% углерода и 25% водорода. Какова его формула?
Ответ
Дано:
`C_xH_y`
`ω(C) = 75%`
`ω(H) = 25%`
`C_xH_y = ?`
Решение
`ω(C) = (100*x*A_r(C))/(M_r(C_xH_y))`
`ω(H) = (100*y*A_r(H))/(M_r(C_xH_y))`
`x = (ω(C)*M_r(C_xH_y))/(100*A_r(C))`
`y = (ω(H)*M_r(C_xH_y))/(100*A_r(H))`
`x" : "y = (ω(C)*M_r(C_xH_y))/(100*A_r(C))" : "(ω(H)*M_r(C_xH_y))/(100*A_r(H))`
`x" : "y = 75/(100*12)" : "25/(100*1)`
`x" : "y = 0.0625" : "0.25`
`x" : "y = 1" : "4`
`CH_4`
Ответ: формула вещества `CH_4`. §12
-
§12. Система химических элементов Д. И. Менделеева.
1. Почему для дальнейшего развития химии как науки важно было систематизировать знания об элементах и их соединениях?
Ответ
Для дальнейшего развития химии как науки, требовалось ответить на вопросы: "Много ли химических элементов остаётся ещё не открытыми? В каких направлениях следует вести поиск этих элементов?" Для ответов на поставленные вопросы, необходимо было систематизировать знания об элементах и их соединениях.
2. Приведите формулировку Периодического закона.
Ответ
Формулировка Периодического закона Д. И. Менделеева: "Свойства химических элементов, а также свойства и формы их соединений находятся в периодической зависимости от их атомных весов.".
3. Доказано, что минерал галит состоит из атомов натрия и хлора. Массовая доля натрия – 39,3%. Найдите формулу галита. Примеси соединений железа придают желтую или красную окраску, частицы глины – серую. Какой цвет имеет минерал?
Ответ
Дано:
`Na_xCl_y`
`ω(Na) = 39.3%`
`Na_xCl_y= ?`
Решение
`ω(Cl) = 100 - ω(Na) = 100 - 39.3 = 60.7%`
`ω(Na) = (100*x*A_r(Na))/(M_r(Na_xCl_y))`
`ω(Cl) = (100*y*A_r(Cl))/(M_r(Na_xCl_y))`
`x = (ω(Na)*M_r(Na_xCl_y))/(100*A_r(Na))`
`y = (ω(Cl)*M_r(Na_xCl_y))/(100*A_r(Cl))`
`x" : "y = (ω(Na)*M_r(Na_xCl_y))/(100*A_r(Na))" : "(ω(Cl)*M_r(Na_xCl_y))/(100*A_r(Cl))`
`x" : "y = 39.3/(100*23)" : "60.7/(100*35.5)`
`x" : "y = 0.017" : "0.017`
`x" : "y = 1" : "1`
`NaCl`
Ответ: формула минерала галит `NaCl`.
Галит может иметь цвет от желтого, красного или желто-красного до серого. §13
-
§13. Валентность химических элементов. Определение валентности в бинарных соединениях.
1. Рассмотрите таблицу 7. Какие металлы обладают постоянной валентностью? Какие элементы первой группы обладают переменной валентностью? Какую подгруппу они образуют?
Ответ
Постоянной валентностью обладают металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа).
В I группе медь (Cu), серебро (Ag) и золото (Au) обладают переменной валентностью, они образуют побочную подгруппу.2. Используя таблицу 7, составьте формулы кислородсодержащих соединений известных вам элементов.
Ответ
H2O, Li2O, Na2O, K2O, Rb2O, Cs2O.
BeO, MgO, CaO.
B2O3, Al2O3.
CO2, SiO2, SnO2, PbO2.
N2O5, P2O5, As2O5.
SO3, SeO3, TeO3.
Cl2O7, Br2O7, I2O7.3. Определите валентность химических элементов по формулам их соединений: HgO, HBr, ZnS, MgF2, CuO, AlCl3.
Ответ
`overset(II)(Hg)overset(II)(O)`, `overset(I)(H)overset(I)(Br)`, `overset(II)(Zn)overset(II)(S)`, `overset(II)(Mg)overset(I)(F_2)`, `overset(II)(Cu)overset(II)(O)`, `overset(III)(Al)overset(I)(Cl_3)`.
4. Определите валентность химических элементов в соединениях: Cl2O, NO, NO2, N2O3, SO2, SO3, Cl2O5.
Ответ
`overset(I)(Cl)_2overset(II)(O)`, `overset(II)(N)overset(" "II)(O)`, `overset(IV)(N)overset(II)(O_2)`, `overset(III)(N)_2overset(II)(O_3)`, `overset(IV)(S)overset(II)(O_2)`, `overset(VI)(S)overset(II)(O_3)`, `overset(V)(Cl)_2overset(II)(O_5)`.
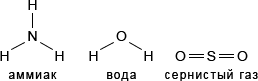
5. Начертите графические формулы для молекул: аммиака NH3, воды H2O, сернистого газа SO2.
Ответ
Графические формулы молекул: аммиака NH3, воды H2O, сернистого газа SO2.
§14
-
§14. Составление формул по валентности.
1. Какие валентности могут проявлять атомы элементов № 3, 12, 14, 19 (в периодической таблице)?
Ответ
№3 – литий (Li) – находится в I группе главной подгруппе – в соединениях проявляет валентность I.
№12 – магний (Mg) – находится во II группе главной подгруппе – в соединениях проявляет валентность II.
№14 – кремний (Si) – находится во IV группе главной подгруппе – в соединениях проявляет валентность II и IV.
№19 – калий (K) – находится в I группе главной подгруппе – в соединениях проявляет валентность I.2. Составьте молекулярные формулы возможных бинарных кислородных соединений для серы (II и IV) и фосфора (III и V). Начертите графические формулы молекул этих соединений.
Ответ
Бинарные кислородные соединения серы: `overset(II)(S)O`, `overset(IV)(S)O_2`.
S=O O=S=O
Бинарные кислородные соединения серы (II и IV).
Бинарные кислородные соединения фосфора: `overset(III)(P)_2O_3`, `overset(V)(P)_2O_5`.
3. Составьте формулы соединений натрия, алюминия, кремния, цинка и олова с кислородом и хлором.
Ответ
Составьте формулы соединений натрия, алюминия, кремния, цинка и олова с кислородом и хлором.
Na2O, NaCl.
Al2O3, AlCl3.
SiO2, SiCl4.
ZnO, ZnCl2.
SnO2, SnCl4.4. Расставьте индексы вместо точек в формулах следующих соединений:
`K…N…`, `overset(IV)(Sn)…O…`, `overset(VII)(Mn)…O…`, `overset(III)(Fe)…S…`, `overset(III)(Cr)…Cl…`.Ответ
`K_3N`, `SnO_2`, `Mn_2O_7`, `Fe_2S_3`, `CrCl_3`.
5. Составьте формулы соединений, состоящих из пар элементов: калий и сера, натрий и фосфор, кальций и хлор, азот и магний, углерод и кремний.
Ответ
K2S, Na3P, CaCl2, Mg3N2, SiC.
§15
-
§15. Количество вещества. Моль – единица количества вещества.
1. Определите число молекул углекислого газа и воды, содержащихся в следующих порциях веществ: а) 4 моль; б) 0,2 моль; в) 125 моль.
Ответ
Дано:
а) `n(CO_2) = n(H_2O) = 4" моль"`
б) `n(CO_2) = n(H_2O) = 0.2" моль"`
в) `n(CO_2) = n(H_2O) = 125" моль"`
`N(CO_2) = ?`
`N(H_2O) = ?`
Решение
а) `N(CO_2) = N(H_2O) = n(H_2O)*N_А = 4*6*10^23 = 2.4*10^24" молекул"`
б) `N(CO_2) = N(H_2O) = n(H_2O)*N_А = 0.2*6*10^23 = 1.8*10^23" молекул"`
в) `N(CO_2) = N(H_2O) = n(H_2O)*N_А = 125*6*10^23 = 7.5*10^25" молекул"`
Ответ:
а) `N(CO_2) = N(H_2O) = 2.4*10^24" молекул"`
б) `N(CO_2) = N(H_2O) = 1.8*10^23" молекул"`
в) `N(CO_2) = N(H_2O) = 7.5*10^25" молекул"`.2. Население земного шара составляет примерно 7,5∙109 человек. Сколько планет, подобных Земле, потребовалось бы для расселения 6∙1023 людей (числа, равного числу Авогадро)?
Ответ
Дано:
`N_"Земли"("человек") = 7.5*10^9`
`N("человек") = 6*10^23`
`k("планет") = ?`
Решение
`k("планет") = (N("человек"))/(N_"Земли"("человек")) = (6*10^23)/(7.5*10^9) = 8*10^13`
Ответ: `k("планет") = 8*10^13`.3. Какому количеству вещества соответствует: а) 3∙1023 молекул воды; б) 36∙1023 молекул кислорода?
Ответ
Дано:
`N(H_2O) = 3*10^23" молекул"`
`N(O_2) = 36*10^23" молекул"`
`n(H_2O) = ?`
`n(O_2) = ?`
Решение
`n(H_2O) = (N(H_2O))/N_А = (3*10^23)/(6*10^23) = 0.5" моль"`
`n(O_2) = (N(O_2))/N_А = (36*10^23)/(6*10^23) = 6" моль"`
Ответ: `n(H_2O) = 0.5" моль"`, `n(O_2) = 6" моль"`.4. Масса 10 моль воды равна:
1) 1,8 г; 2) 3,6 г; 3) 90 г; 4) 180 г.Ответ
Дано:
`n(H_2O) = 10" моль"`
`m(H_2O) = ?`
Решение
`m(H_2O) = n(H_2O)*M(H_2O) = 10*18 = 180 г`
Ответ: `m(H_2O) = 180 г`.5. Какое количество вещества составляет 88 г оксида меди (II)?
1) 0.5 моль; 2) 1,1 моль; 3) 1,5 моль; 4) 2 моль.Ответ
Дано:
`m(CuO) = 88 г`
`n(CuO) = ?`
Решение
`n(CuO) = (m(CuO))/(M(CuO)) = 88/80 = 1.1" моль"`
Ответ: `n(CuO) = 1.1" моль"`.6. В лаборатории изучают образцы различных металлов одинакового объема. Расположите эти образцы по возрастанию числа атомов, содержащихся в образце. Металлы: железо, медь, цинк, алюминий. Их плотность (г/см3) соответственно: 7,87; 8,96; 7,13; 2,70.
Ответ
Дано:
`V(Fe) = V(Cu) = V(Zn) = V(Al)`
`ρ(Fe) = 7.87" г/см"^3`
`ρ(Cu) = 8.96" г/см"^3`
`ρ(Zn) = 7.13" г/см"^3`
`ρ(Al) = 2.70" г/см"^3`
Расположить образцы по возрастанию числа атомов.
Решение
Допустим у нас имеется по `1" см"^3` данных металлов, тогда:
`m(Fe) = 7.87 г`, `m(Cu) = 8.96 г`, `m(Zn) = 7.13 г`, `m(Al) = 2.7 г`.
`n(Fe) = (m(Fe))/(M(Fe)) = 7.87/56 = 0.141" моль"`
`n(Cu) = (m(Cu))/(M(Cu)) = 8.96/64 = 0.14" моль"`
`n(Zn) = (m(Zn))/(M(Zn)) = 7.13/65 = 0.11" моль"`
`n(Al) = (m(Al))/(M(Al)) = 2.7/27 = 0.1" моль"`
Ответ: Al, Zn, Cu, Fe.7. Определите, какое количество вещества хлороводорода содержит столько же молекул, сколько их заключено в 360 г воды.
Ответ
Дано:
`m(H_2O) = 360 г`
`N(HCl) = N(H_2O)`
`n(HCl) = ?`
Решение
`n(H_2O) = (m(H_2O))/(M(H_2O)) = 360/18 = 20" моль"`
`N(H_2O) = n(H_2O)*N_А`
`N(HCl) = n(HCl)*N_А`
`n(HCl)*N_А = n(H_2O)*N_А`
`n(HCl) = n(H_2O) = 20" моль"`
Ответ: `n(HCl) = 20" моль"`.8. Масса порции сульфата меди (II), в которой содержится 1,204∙1023 атомов кислорода, равна:
1) 8 г; 2) 32 г; 3) 64 г; 4) 128 г.Ответ
Дано:
`N(CuSO_4) = 1.204*10^23" молекул"`
`m(CuSO_4) = ?`
Решение
`n(CuSO_4) = (N(CuSO_4))/N_А = (1.204*10^23)/(6*10^23) = 0.2" моль"`
`m(CuSO_4) = n(CuSO_4)*M(CuSO_4) = 0.2*160 = 32 г`
Ответ: `m(CuSO_4) = 32 г`. §16
-
§16. Молярная масса.
1. Вставьте пропущенные слова: а) вода … 10 моль; б) ацетон … 5 г; в) сера … 6 кг; г) олово … 7,3 г/см3; д) … серной кислоты 98 г/моль; e) железо … 1 моль.
Ответ
а) вода количеством 10 моль;
б) ацетон массой 5 г;
в) сера массой 6 кг;
г) олово плотностью 7,3 г/см3;
д) молярная масса серной кислоты 98 г/моль;
e) железо количеством 1 моль.2. Сколько атомов серебра содержится в бруске массой 32,4 г?
Ответ
Дано:
`m(Ag) = 32.4 г`
`N(Ag) = ?`
Решение
`n(Ag) = (m(Ag))/(M(Ag)) = 32.4/108 = 0.3" моль"`
`N(Ag) = n(Ag)*N_А = 0.3*6*10^23 = 1.8*10^23" атомов"`
Ответ: `N(Ag) = 1.8*10^23" атомов"`.3. Какое количество вещества магния взято, если оно содержит: а) 24∙1023 атомов; б) 1.8∙1023 атомов?
Ответ
Дано:
`"а) "N(Mg) = 24*10^23" атомов"`
`"б) "N(Mg) = 1.8*10^23" атомов"`
`n(Mg) = ?`
Решение
а) `n(Mg) = (N(Mg))/(N_А) = (24*10^23)/(6*10^23) = 4" моль"`
б) `n(Mg) = (N(Mg))/(N_А) = (1.8*10^23)/(6*10^23) = 0.3" моль"`
Ответ: а) `n(Mg) = 4" моль"`, б) `n(Mg) = 0.3" моль"`.4. Где содержится больше атомов: а) в 1 г алюминия или в 1 г углерода; б) в 1 моль алюминия или в 1 моль углерода?
Ответ
Дано:
а) `m(Al) = 1 г`
`m(C) = 1 г`
б) `n(Al) = 1" моль"`
`n(C) = 1" моль"`
Сравнить
`N(Al)" "?" "N(C)`
Решение
а) `n(Al) = (m(Al))/(M(Al)) = 1/27 = 0.037" моль"`
`n(C) = (m(Al))/(M(Al)) = 1/12 = 0.083" моль"`
`N(Al) = n(Al)*N_А = 0.037*6*10^23 = 2.22*10^22" атомов"`
`N(C) = n(C)*N_А = 0.083*6*10^23 = 4.98*10^22" атомов"`
`N(C) > N(Al)`
б) `N(Al) = n(Al)*N_А = 1*6*10^23 = 6*10^22" атомов"`
`N(C) = n(C)*N_А = 1*6*10^23 = 6*10^22" атомов"`
`N(C) = N(Al)`
Ответ: а) `N(C) > N(Al)`, б) `N(C) = N(Al)`.5. Какое количество вещества содержится: а) в 90 г воды H2O; б) в 4,9 г серной кислоты H2SO4; в) в 22 г углекислого газа CO2?
Ответ
Дано:
`"а) "m(H_2O) = 90 г`
`"б) "m(H_2SO_4) = 4.9 г`
`"в) "m(CO_2) = 22 г`
`"а) "n(H_2O) = ?`
`"б) "n(H_2SO_4) = ?`
`"в) "n(CO_2) = ?`
Решение
а) `n(H_2O) = (n(H_2O))/(M(H_2O)) = 90/18 = 5" моль"`
б) `n(H_2SO_4) = (n(H_2SO_4))/(M(H_2SO_4)) = 4.9/98 = 0.05" моль"`
в) `n(CO_2) = (n(CO_2))/(M(CO_2)) = 22/44 = 0.5" моль"`
Ответ: а) `n(H_2O) = 5" моль"`, б) `n(H_2SO_4) = 0.05" моль"`, в) `n(CO_2) = 0.5" моль"`.6. Одинаковое ли число молекул составляют 32 г метана CH4 и 32 г оксида серы (IV) SO2?
Ответ
Дано:
`m(CH_4) = 32 г`
`m(SO_2) = 32 г`
Сравнить
`N(CH_4)" "?" "N(SO_2)`
Решение
`n(CH_4) = (m(CH_4))/(M(CH_4)) = 32/16 = 2" моль"`
`n(SO_2) = (m(SO_2))/(M(SO_2)) = 32/64 = 0.5" моль"`
`N(CH_4) = n(CH_4)*N_А = 2*6*10^23 = 12*10^23" молекул"`
`N(SO_2) = n(SO_2)*N_А = 0.5*6*10^23 = 3*10^23" молекул"`
`N(CH_4) > N(SO_2)`
Ответ: `N(CH_4) > N(SO_2)`.7. Одинаковое ли количество вещества соответствует 160 г оксида железа (III) Fe2O3 и 160 г сульфата меди (II) CuSO4?
Ответ
Дано:
`m(Fe_2O_3) = 160 г`
`m(CuSO_4) = 160 г`
Сравнить
`n(Fe_2O_3)" "?" "n(CuSO_4)`
Решение
`n(Fe_2O_3) = (m(Fe_2O_3))/(M(Fe_2O_3)) = 160/160 = 1" моль"`
`n(CuSO_4) = (m(CuSO_4))/(M(CuSO_4)) = 160/160 = 1" моль"`
`n(Fe_2O_3) = n(CuSO_4)`
Ответ: `n(Fe_2O_3) = n(CuSO_4)`.8. Масса 0,5 моль серной кислоты H2SO4, равна:
1) 98 г; 2) 9,8 г; 3) 49 г; 4) 4,9 г.Ответ
Дано:
`n(H_2SO_4) = 0.5" моль"`
`m(H_2SO_4) = ?`
Решение
`m(H_2SO_4) = n(H_2SO_4)*M(H_2SO_4) = 0.5*98 = 49 г`
Ответ: `m(H_2SO_4) = 49 г`. §17
-
Глава 2. Химические реакции. Законы сохранения массы и энергии.
§17. Сущность, признаки и условия протекания химических реакций. Тепловой эффект химической реакции.
1. Что называется химической реакцией?
Ответ
Химической реакцией называют превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением и свойствами.
2. На какие типы (по тепловому эффекту) можно разделить химические реакции?
Ответ
По тепловому эффекту химические реакции делятся на экзотермические (реакции, протекающие с выделением теплоты) и эндотермические (реакции, протекающие с поглощением теплоты).
3. Какие признаки говорят о том, что перечисленные ниже процессы являются химическими реакциями: а) гниение листьев; б) пригорание пищи; в) ржавление железа; г) окисление меди; д) взаимодействие известковой воды и углекислого газа; е) скисание молока?
Ответ
а) Изменение цвета, появление запаха.
б) Изменение цвета, появление запаха.
в) Изменение цвета.
г) Изменение цвета.
д) Появление осадка.
е) Изменение цвета, появление запаха и осадка.4. Приведите примеры протекания химических реакций, для которых характерны признаки: выделение газа, появление осадка, изменение окраски.
Ответ
Примеры химических реакций с выделением газа: брожение глюкозы; взаимодействие пищевой соды с уксусной кислотой; взаимодействие лимонной кислоты с накипью; разложение пероксида водорода в присутствии крови.
Примеры химических реакций с появлением осадка: взаимодействие раствора едкого натра с раствором медного купороса, взаимодействие раствора гашеной извести с углекислым газом.
Примеры химических реакций с изменением окраски: ржавление железа, чернение серебра, взаимодействие иода с раствором крахмала.5. Изобразите схему реакции образования сероводорода из серы и водорода:
H2 + S = H2S.
Объясните её с точки зрения атомно-молекулярного учения.Ответ
Схема реакции образования сероводорода из серы и водорода:

Согласно атомно-молекулярному учению все вещества состоят из атомов, соединённых друг с другом в молекулы или другие частицы. В процессе данной реакции происходит разрушение молекулы водорода, и образуются 2 атома водорода, которые соединяются с атомом серы, в результате образуется молекула сероводорода.6. К какому типу – экзо- или эндотермическому – относятся следующие реакции: образование воды из водорода и кислорода, самовозгорание и взрыв метана (газ который часто выделяется породой и скапливается в шахтах).
Ответ
Данные процессы относятся к экзотермическим реакциям.
Лабораторные опыты №1
1. Зачищенный кусок медной проволоки или пластинки зажмите тигельными щипцами и нагревайте в пламени спиртовки.
2. Прилейте 1-2 мл раствора уксусной кислоты к порошку пищевой соды или к карбонату кальция (известняку).
3. Прилейте 3-4 мл раствора хлорида меди к раствору едкого натра.
4. К 2 мл раствора крахмала добавьте 1-2 капли раствора йода.Ответ
1 При нагревании куска медной проволоки в пламени спиртовки наблюдается почернение поверхности проволоки.
2 При добавлении раствора уксусной кислоты к порошку пищевой соды или к карбонату кальция (известняку) наблюдается выделение газа.
3 При добавлении раствора хлорида меди к раствору едкого натра наблюдается выпадение синего осадка.
4 При добавлении йода к раствору крахмала наблюдается синее окрашивание раствора.Лабораторные опыты №2
1. Откроем колпачок спиртовки, по при соприкосновении исходных веществ (спирта и кислорода) реакции не происходит. Поднесём зажжённую спичку. Спирт па фитиле спиртовки нагревается и загорается, начинается реакция горения. Какое условие необходимо для возникновения реакции?
2. В пробирку наливаем 3%-й раствор перекиси водорода. Добавим немного чёрного порошка оксида марганца (IV). Наблюдаем бурное выделение газа. Это кислород, который образовался при реакции разложения перекиси водорода. Какое условие было необходимо для начала этой реакции?Ответ
1 Для того чтобы началась реакция горения спирта, необходимо его нагревание и соприкосновение его с кислородом.
2 Для того чтобы началась реакция разложения пероксида водорода, необходимо было добавить катализатор (оксид марганца (IV)). §18
-
§18. Законы сохранения массы и энергии.
1. Сформулируйте закон сохранения массы веществ при химических реакциях и проиллюстрируйте его примерами.
Ответ
Формулировка закона сохранения массы веществ при химических реакциях: "Общая масса веществ, вступивших в химическую реакцию, равна общей массе веществ – продуктов химической реакции".
Примеры
Если взвесить негашеную известь и воду до начала реакции, то их масса будет равна массе раствора гашенной извести после протекания реакции.
Если взвесить цинк и серу до начала реакции, то их масса будет равна массе образовавшегося сульфида цинка.2. Объясните причину сохранения массы веществ при химических реакциях.
Ответ
Причина сохранения массы веществ при химических реакциях состоит в том, что в процессе химической реакции число атомов исходных веществ сохраняется, происходит лишь их перегруппировка, ведущая к образованию новых веществ (продуктов реакции). То есть сумма атомов веществ, вступивших в химическую реакцию, равна сумме атомов, получившихся в результате реакции.
3. Почему выделение или поглощение теплоты относится к общим признакам химических реакций?
Ответ
Характерной особенностью химических реакций является то, что они всегда сопровождаются поглощением или выделением энергии. Д. И. Менделеев указывал: важнейшим признаком всех химических реакций является изменение энергии в процессе их протекания. Выделение или поглощение теплоты в процессе химических реакций обусловлено тем, что энергия затрачивается на процесс разрушения одних веществ (разрушение связей между атомами и молекулами) и выделяется при образовании других веществ (образование связей между атомами и молекулами).
4. При горении дров, на первый взгляд, закон сохранения массы не действует. Опровергните это утверждение.
Ответ
При горении дров, на первый взгляд, закон сохранения массы не действует, однако если произвести поглощение продуктов реакции горения и взвесить их вместе с остатками горения дров, то масса веществ получится такой же, как и до начала реакции.
5. Какие виды превращения энергии в химических реакциях вам известны? Приведите примеры, когда энергетические изменения являются для практики более важными, чем превращения, происходящие с веществами в ходе реакции.
Ответ
Энергия химических реакций может превращаться в следующие виды энергии: тепловую, световую, механическую и электрическую.
Примеры, когда энергетические изменения являются для практики более важными, чем превращения, происходящие с веществами в ходе реакции:
Горение бензина в двигателе внутреннего сгорания.
Горение угля в печи.
Сгорание природного газа в турбине ТЭЦ.
Горение свечи для освещения помещения.
Детонация взрывчатых веществ для производства различных взрывных работ.
Электролиз воды для получения водорода §19
-
§19. Составление уравнений химических реакций. Расчёты по химическим уравнениям.
1. Какие расчёты называются стехиометрическими? Для чего они применяются?
Ответ
Расчёты количеств веществ, участвующих в химических реакциях, называются стехиометрическими.
Стехиометрические расчёты применяются для нахождение значений количества, массы и объемов веществ (реагентов и продуктов) химической реакции.2. Как связаны между собой масса, количество вещества и молярная масса?
Ответ
Масса, количество вещества и молярная масса связаны между собой уравнением:
`M = m/n`,
где `M` – молярная масса (г/моль), `m` – масса (г), `n` – количество вещества (моль).3. Что такое уравнение химической реакции?
Ответ
Уравнение химической реакции представляет собой условную запись химической реакции с помощью химических формул. В левой части уравнения пишут формулы исходных веществ, а в правой – формулы продуктов реакции.
4. Какими законами необходимо руководствоваться при составлении уравнений?
Ответ
Уравнения химических реакций составляют на основе законов сохранения массы и постоянства состава веществ.
5. Какое количество вещества кислорода необходимо для получения 72 г воды из кислорода и водорода?
Ответ
Дано:
`m(H_2O) = 72 г`
`n(O_2) = ?`
Решение
`2H_2 + O_2 = 2H_2O`
`n(H_2O) = (m(H_2O))/(n(H_2O)) = 72/18 = 4" моль"`
`n(O_2) = (n(H_2O))/2 = 4/2 = 2" моль"`
Ответ: `n(O_2) = 2" моль"`.6. Прочтите уравнения химических реакций и объясните их:
1) 2Ca + O2 = 2CaO;
2) Fe + S = FeS.Ответ
1) 2Ca + O2 = 2CaO
При взаимодействии 2 моль кальция с 1 моль кислорода, образуется 2 моль оксида кальция.
1) Fe + S = FeS
При взаимодействии 1 моль железа с 1 моль серы, образуется 1 моль сульфида железа (II).7. Составьте уравнения реакций:
1) Zn + S ⟶ ZnS;
2) Fe + O2 ⟶ Fe2O3;
3) HgO ⟶ Hg + O2.Ответ
1) Zn + S = ZnS
2) 4Fe + 3O2 = 2Fe2O3
3) 2HgO = 2Hg + O28. Используя химическое уравнение из задания 6 (1), рассчитайте массу образовавшегося оксида кальция CaO, если в реакцию вступил кислород количеством вещества 0,1 моль.
Ответ
Дано:
`n(O_2) = 0.1" моль"`
`m(CaO) = ?`
Решение
`2Ca + O_2 = 2CaO`
`n(CaO) = 2*n(O_2) = 2*0.1 = 0.2" моль"`
`m(CaO) = n(CaO)*M(CaO) = 0.2*56 = 11.2 г`
Ответ: `m(CaO) = 11.2 г`. §20
-
§20. Типы химических реакций.
1. Приведите примеры и дайте определение реакциям замещения, разложения, присоединения, обмена.
Ответ
Реакции соединения – это такие реакции, при которых из двух или более простых или сложных веществ образуется одно новое сложное вещество. Примеры:
2H2 + O2 ⟶ 2H2O
CaO + CO2 ⟶ CaCO3
Реакции разложения – это такие реакции, при которых из одного сложного вещества получаются два или более простых или сложных веществ. Примеры:
2H2O эл. ток⟶ 2H2↑ + O2↑
Cu(OH)2 t⟶ CuO + H2O
Реакции замещения – это реакции между простым и сложным веществами, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества. Примеры:
CuCl2 + Fe ⟶ Cu + FeCl2
Fe2O3 + 2Al ⟶ 2Fe + Al2O3.
Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями. Пример:
CuO + H2SO4 ⟶ CuSO4 + H2O.2. Приведите примеры и укажите сходство и различия в реакциях замещения и обмена.
Ответ
Реакция замещения:
CuCl2 + Fe ⟶ Cu + FeCl2.
Реакции обмена:
CuO + H2SO4 ⟶ CuSO4 + H2O.
Сходство в реакциях замещения и обмена состоит в количеств исходных и образовавшихся веществ (2 исходных и 2 продукта).
Различие состоит в том, что в реакции замещения из сложного и простого вещества образуются новые сложное и простое вещества, а в реакции обмена из двух сложных веществ образуются два новых сложных вещества.3. Расставьте коэффициенты в уравнениях реакций (там, где это необходимо), укажите, к какому типу относятся следующие химические реакции:
1) C + O2 ⟶ CO2;
2) CaCO3 ⟶ CaO + CO2;
3) Zn + HCl ⟶ ZnCl2 + H2;
4) NaOH + H2SO4 ⟶ Na2SO4 + H2O.Ответ
1) C + O2 ⟶ CO2
Реакция соединения.
2) CaCO3 ⟶ CaO + CO2
Реакция разложения.
3) Zn + 2HCl ⟶ ZnCl2 + H2
Реакция замещения.
4) 2NaOH + H2SO4 ⟶ Na2SO4 + H2O
Реакция обмена.4. Объясните сущность химических реакций разных типов с позиций атомно-молекулярного учения.
Ответ
С позиций атомно-молекулярного учения все химические реакции сводятся к образованию новых веществ из атомов, входящих в состав исходных веществ. Следовательно, сущность химических реакций состоит в перегруппировке атомов, в результате которой из молекул или атомов образуются новые молекулы или атомы.
5. Рассчитайте массу (г) продукта реакции, образовавшегося при горении 1,5 моль фосфора в кислороде.
Ответ
Дано:
`n(P) = 1.5" моль"`
`m(P_2O_5) = ?`
Решение
`4P + 5O_2 = 2P_2O_5`
`n(P_2O_5) = (2*n(P))/4 = (2*1.5)/4 = 0.75" моль"`
`m(P_2O_5) = n(P_2O_5)*M(P_2O_5) = 0.75*142 = 106.5 г`
Ответ: `m(P_2O_5) = 106.5 г`.6. Вычислите количество вещества (моль) углерода, вступившего в реакцию с кислородом, если в результате выделилось 4,4 г углекислого газа.
Ответ
Дано:
`m(CO_2) = 4.4 г`
`n(C) = ?`
Решение
`C + O_2 = CO_2`
`n(CO_2) = (m(CO_2))/(M(CO_2)) = 4.4/44 = 0.1" моль"`
`n(C) = n(CO_2) = 0.1" моль"`
Ответ: `n(C) = 0.1" моль"`.7. При взаимодействии 0,5 моль алюминия и серы можно получить сульфид алюминия Al2S3, масса которого:
1) 3,75 г; 2) 37,5 г; 3) 30,5 г; 4) 4 моль.Ответ
Дано:
`n(Al) = 0.5" моль"`
`m(Al_2S_3) = ?`
Решение
`2Al + 3S = Al_2S_3`
`n(Al_2S_3) = (n(Al))/2 = 0.5/2 = 0.25" моль"`
`m(Al_2S_3) = n(Al_2S_3)*M(Al_2S_3) = 0.25*150 = 37.5 г`
Ответ: `m(Al_2S_3) = 37.5 г`.8. Запишите уравнения реакций соединения, в результате которых образуются следующие вещества: 1) SO2; 2) CuO; 3) P2O5; 4) Fe2O3.
Ответ
1) S + O2 ⟶ SO2
2) Cu + O2 t⟶ 2CuO
3) 4P + 5O2 ⟶ 2P2O5
4) 4Fe + 3O2 t⟶ 2Fe2O39. Составьте и решите задачу, используя следующие единицы: относительная молекулярная масса, масса, молярная масса, количество вещества.
Ответ
Вычислите массу оксида кальция, которую можно получить из 450 г карбоната кальция.
Дано:
`m(CaCO_3) = 450 г`
`m(CaO) = ?`
Решение
`CaCO_3 overset(t)(=) CaO + CO_2"↑"`
`n(CaCO_3) = (m(CaCO_3))/(M(CaCO_3)) = 450/100 = 4.5" моль"`
`n(CaO) = n(CaCO_3) = 4.5" моль"`
`m(CaO) = n(CaO)*M(CaO) = 4.5*56 = 252 г`
Ответ: `m(CaO) = 252 г`.Лабораторные опыты
1. Заполните пробирку на 1/5 часть свежеприготовленным гидроксидом меди (II) Cu(OH)2 (гидроксид меди (II) приготовьте по указаниям учителя). Возьмите пробирку с гидроксидом меди (II) держателем и нагревайте в пламени спиртовки. Определите, прошла ли химическая реакция. Составьте уравнение реакции. Назовите продукты реакции, ответ обоснуйте.
2. Налейте в пробирку (примерно на 1/4 объёма) раствор хлорида меди (II) CuCl2, опустите в пробирку очищенный железный гвоздь. Затем выньте гвоздь и насыпьте в пробирку немного железных опилок. Внимательно наблюдайте за изменениями, происходящими в ходе реакции. Назовите: а) признаки протекающей химической реакции (опишите продукты реакции); б) отличие этой реакции от предыдущих.
3. В пробирку, на дно которой насыпан порошок оксида меди (II) CuO, прилейте 5 мл раствора соляной кислоты HCl. Назовите признаки химической реакции.
Ответ
1. При нагревании гидроксида меди (II) наблюдается изменение окраски осадка с синего на черный:
`Cu(OH)_2 overset(t)(=) underset("оксид меди (II)")(CuO) + underset("вода")(H_2O)`
2. `CuCl_2 + Fe = Cu + FeCl_2`
а) Признаки реакции: изменение цвета поверхности железа, изменение цвета раствора с синего на зелёный.
б) Данная реакция относится к реакции замещения, предыдущая к реакции разложения.
3. `CuO + 2HCl = CuCl_2 + H_2O`
Признаки реакции: растворение осадка, изменение цвета раствора с бесцветного на синий. §21
-
Глава 3. Методы химии.
§21. Методы науки химии.
1. Какое значение в химии имеют методы научного исследования веществ?
Ответ
С помощью методов научного исследования можно установить состав веществ, их свойства и способы получения.
2. Что такое анализ и синтез веществ? Какие виды анализа вам известны?
Ответ
Анализ и синтез веществ – экспериментальные методы в химии.
Слово "анализ" означает "разложение". С помощью анализа определяют химический состав веществ. Анализ может быть качественным и количественным.
Синтез – получение сложных веществ из более простых путём химических реакций.3. Укажите, какие из приведённых реакций можно отнести к реакциям синтеза.
1) Fe + CuCl2 = FeCl2 + Cu
2) H2 + Cl2 = 2HCl
3) N2 + 3H2 = 2NH3
4) Zn + 2HCl = ZnCl2 + H2Ответ
Синтез – получение сложных веществ из более простых путём химических реакций, поэтому к реакциям синтеза можно отнести реакции соединения:
2) H2 + Cl2 = 2HCl
3) N2 + 3H2 = 2NH34. Какие приёмы качественного анализа вы используете в повседневной жизни? Как вы думаете, в каких случаях используют такой аналитический приём, как окрашивание пламени?
Ответ
Приёмы качественного анализа вы используете в повседневной жизни:
- проверка еды на свежесть по запаху;
- проба еды на солёность, кислотность или сладость.
Окрашивание пламени используется для качественного обнаружения некоторых химических элементов, например, в минералах. §22
-
§22. Химический язык как средство и метод познания химии.
1. Что входит в содержание химического языка?
Ответ
В содержание химического языка входит:
- символика (химические знаки, формулы, уравнения);
- терминология (специальные слова и термины);
- номенклатура (названия веществ, элементов, частиц).2. Какую информацию несут следующие знаки, формулы, уравнения химических реакций?
a) N2
б) P2O5
в) N2 + 3H2 ⟶ 2NH3 + Q
г) 2H2O эл. ток⟶ 2H2 + O2
д) 2HgO t⟶ 2Hg + O2 - QОтвет
Информация
Качественная Количественная
N2 Простое вещество, состоит из азота 1 молекула азота, состоящая из 2 атомов азота
Mr = 28
P2O5 Сложное вещество, состоит из фосфора и кислорода 1 молекула оксида фосфора, состоящая из 2 атомов азота и 5 атомов кислорода
Mr = 142
N2 + 3H2 ⟶ 2NH3 + Q Реакция соединения, экзотермическая Из 1 моль азота и 3 моль водорода образуется 2 моль аммиака
2H2O эл. ток⟶ 2H2 + O2 Реакция разложения, при действии электрического тока Из 2 моль воды образуется 2 моль воды и 1 моль кислорода
2HgO t⟶ 2Hg + O2 - Q Реакция разложения, при нагревании, эндотермическая Из 2 моль оксида ртути (II) образуется 2 моль ртути и 1 моль кислорода3. Как составляются и что показывают химическая формула и химическое уравнение?
Ответ
Алгоритм составления химической формулы:
Записать символы элементов.
Обозначить валентность элементов.
Найти наименьшее общее кратное.
Разделить наименьшее общее кратное на валентность элементов.
Расставьте индексы.
Химическая формула показывает качественный и количественный состав вещества.
Алгоритм составления уравнений химических реакций:
Записать формулы исходных веществ и продуктов реакции.
Определить число атомов каждого элемента в левой и правой частях уравнения. Если число атомов различное, то необходимо:
а) найти для каждого элемента наименьшее кратное;
б) разделить наименьшее кратное на число соответствующих атомов, т. е. найти и расставить коэффициенты;
в) уравнять числа атомов остальных элементов.
Проверить правильность уравнивания числа атомов в левой и правой частях уравнения химической реакции.
Информация, которую несёт химическое уравнение
Качественная Количественная
состав исходных веществ и продуктов реакции;
протекает реакция с поглощением или выделением энергии;
особые условия проведения реакции.
число молей исходных веществ и продуктов реакции;
массы реагирующих и образующихся веществ;
количество реагирующих частиц;
тепловой эффект реакции.4. Объясните, какую информацию о качественном и количественном составе вещества даёт молекулярная формула CH4O.
Ответ
Качественный состав CH4O: молекула состоит из атомов трёх химических элементов: C, H, O.
Количественный состав CH4O: в состав молекулы входят 6 атомов: 1 атом углерода, 4 атома водорода, 1 атом кислорода.5. Какая запись обозначает четыре атома кислорода?
1) 2O2; 2) 4O; 3) 4O2; 4) 2O.Ответ
Четыре атома кислорода обозначает запись 4O.
6. Молекулы каких веществ состоят из одинакового числа атомов?
1) H2O; 2) O2; 3) CO2; 4) HNO3.Ответ
Из одинакового числа атомов (из трёх) состоят молекулы H2O и CO2.
7. Состав вещества выражен формулой K2SO4. Определите: а) суммарное число атомов в молекуле; б) число химических элементов, входящих в состав вещества; в) число атомов каждого химического элемента в веществе.
Ответ
K2SO4
а) 7;
б) 3;
в) калия – 2, серы – 1, кислорода – 4.8. Даны формулы веществ: а) H2O – вода; б) O2 – кислород; в) CO2 – оксид углерода (IV); г) HNO3 – азотная кислота. Молекула какого вещества содержит наименьшее число атомов? Сколько атомов разных химических элементов входит в состав молекулы каждого вещества?
Ответ
Наименьшее число атомов содержит O2 – кислород.
а) H2O – 2 атома водорода, 1 атом кислорода.
б) O2 – 2 атома кислорода.
в) CO2 – 1 атом углерода, 2 атома кислорода.
г) HNO3 – 1 атом водорода, 1 атом азота, 3 атома кислорода. §23
-
Глава 4. Вещества в окружающей нас природе и в технике.
§23. Чистые вещества и смеси.
1. Охарактеризуйте чистые вещества и примеси. Как определяется чистота веществ?
Ответ
Чистые вещества обладают строго постоянными физическими свойствами.
Чистоту вещества можно определить:
1) по содержанию примесей, загрязняющих основное вещество;
2) по "чистоте" геометрии кристалла, т. е. по идеальному порядку в расположении атомов (для кристаллических веществ).
Количество примесей в веществе может быть различным, например от 10-5—10-10 (сверхчистые вещества) до 40% в рудах, содержащих железо, и до 99,5% в золотоносных породах. Даже незначительное количество примесей может существенно влиять на свойства вещества (изменять температуру плавления, кипения, способность вступать в химические реакции) и определять область использования вещества.2. Какие виды смесей вам известны? Приведите примеры.
Ответ
Различают два вида смеси – гомогенные (однородные) и гетерогенные (неоднородные).
Примеры гомогенных смесей: раствор сахара в воде, смесь спирта с водой, жидкий воздух.
Примеры гетерогенных смесей: латунь (сплав цинка с медью), молоко, туман.3. Как разделить следующие смеси: а) растительное масло (жидкость) и воду; б) алюминиевые стружки и бензин; в) уголь и сахар; г) песок и порошок серы; д) смесь красителей (жидкость)?
Ответ
а) Разделить растительное масло и воду можно с помощью отстаивания.
б) Алюминиевые стружки и бензин можно разделить с помощью фильтрования или декантации.
в) Уголь и сахар можно разделить с помощью фильтрования.
г) Песок и порошок серы можно разделить с помощью флотации.
д) Смесь красителей (жидкость) можно разделить с помощью перегонки.4. Фильтрованием можно разделить смесь:
1) воды и сахара;
2) воды и подсолнечного масла;
3) воды и поваренной соли;
4) воды и речного песка.Ответ
Фильтрованием можно разделить смесь воды и речного песка.
5. Очистить железные опилки от порошка серы можно:
1) фильтрованием;
2) выпариванием;
3) с помощью магнита;
4) растиранием смеси в ступке.Ответ
Очистить железные опилки от порошка серы можно с помощью магнита.
6. Для очистки было взято 10,5 г кристаллического йода, после возгонки и охлаждения было получено 8,75 г чистого вещества. Сколько примесей в процентах содержалось в исходном кристаллическом йоде?
Ответ
Дано:
`m("смеси") = 10.5 г`
`m(I_2) = 8.75 г`
`ω("примеси") = ?`
Решение
`m("примеси") = m("смеси") - m(I_2) = 10.5 - 8.75 = 1.75 г`
`ω("примеси") = (100*m("примеси"))/(m("смеси")) = (100*1.75)/10.5 = 16.67%`
Ответ: `ω("примеси") = 16.67%`.7. Как самопроизвольно осуществляется очистка веществ в природе?
Ответ
Вода , например, очищается благодаря испарению и конденсации в виде осадков, либо фильтруется сквозь слои песка, попадая в подземные воды.
§24
-
§24. Растворы. Растворимость веществ.
1. На какие группы делятся вещества по их растворимости?Ответ
По степени растворимости вещества можно разделить на практически нерастворимые, малорастворимые и хорошо растворимые.
2. Что показывает коэффициент растворимости веществ?
Ответ
Коэффициент растворимости показывает отношение массы вещества, образующего насыщенный при данной температуре раствор, к объёму растворителя.
Например, коэффициент растворимости поваренной соли при 20°C равен 0,36. Это значит, что 36 г вещества растворяются в 100 г воды, образуя насыщенный раствор при 20°C.3. Какие факторы оказывают влияние на растворимость различных веществ?
Ответ
Растворимость твёрдых веществ зависит от температуры.
Растворимость газов зависит от температуры и давления.
Растворимость большинства твёрдых веществ (за исключением немногих, например гипса, извести) с повышением температуры возрастает.
Растворимость газов возрастает при понижении температуры и повышении давления.4. Какие растворы называются ненасыщенными и насыщенными? Приведите примеры.
Ответ
Раствор, в котором данное вещество при данной температуре и постоянном давлении больше не растворяется, называется насыщенным. Например, насыщенный раствор поваренной соли при комнатной температуре образуется при растворении в 100 г воды 32 г соли. Если мы добавим ещё некоторое количество соли, то она выпадет в осадок.
Раствор, в котором ещё может раствориться добавочное количество данного вещества, называется ненасыщенным. Например, ненасыщенным раствором будет являться раствор, в котором 16 г поваренной соли растворено в 100 г воды при комнатной температуре. Если мы добавим в такой раствор ещё 16 г соли, то она растворится.5. Пользуясь кривыми растворимости, укажите, в каких случаях раствор будет ненасыщенным, насыщенным, пересыщенным:
а) в 100 г воды растворено 120 г медного купороса CuSO4 при температуре 78°C;
б) в 100 г воды растворено 160 г калийной селитры при температуре 60°C;
в) в 1000 г воды растворено 800 г медного купороса при температуре 70°C.Ответ
а) перенасыщенный
б) перенасыщенный
в) перенасыщенный §25
-
§25. Массовая доля растворённого вещества.
1. Что такое массовая доля растворённого вещества?
Ответ
Массовой долей растворённого вещества называют отношение массы растворённого вещества к общей массе раствора.
2. Чем различаются насыщенный раствор и концентрированный раствор?
Ответ
Насыщенный раствор – раствор, в котором данное вещество при данной температуре и постоянном давлении больше не растворяется.
Концентрированный раствор – раствор с высоким содержанием растворённого вещества.
Концентрированный раствор не всегда является насыщенным, например, если в 100 г воды растворено 100 г AgNO3 при н. у., то такой раствор будет концентрированным, но не насыщенным, так как в нём ещё может растворяться нитрат серебра.
Насыщенный раствор не всегда является концентрированным, например, если в 100 г воды растворено 7.3 г KClO3 при н. у., то такой раствор будет насыщенным, но не концентрированным, так как количество растворённого вещества в нём невелико.3. Сколько потребуется бромида калия KBr (г) и воды (мл) для приготовления: а) 200 г 15%-го раствора; б) 1,5 кг 5%-го раствора; в) 15 г 0,1%-го раствора?
Ответ
Дано:
а) `m("р-ра") = 200 г`
`ω(KBr) = 15%`
б) `m("р-ра") = 1.5" кг" = 1500 г`
`ω(KBr) = 5%`
в) `m("р-ра") = 15 г`
`ω(KBr) = 0.1%`
`m(KBr) = ?`
`V(H_2O) = ?`
Решение
`m(KBr) = (ω(KBr)*m("р-ра"))/100`
`m(H_2O) = m("р-ра") - m(KBr)`
`V(H_2O) = (m(H_2O))/(ρ(H_2O))`
а) `m(KBr) = (15*200)/100 = 30 г`
`m(H_2O) = 200 - 30 = 170 г`
`V(H_2O) = 170/1 = 170" мл"`
б) `m(KBr) = (5*1500)/100 = 75 г`
`m(H_2O) = 1500 - 75 = 1425 г`
`V(H_2O) = 1425/1 = 1425" мл"`
в) `m(KBr) = (0.1*15)/100 = 0.015 г`
`m(H_2O) = 15 - 0.015 = 14.985 г`
`V(H_2O) = 14.985/1 = 14.985" мл"`
Ответ:
а) `m(KBr) = 30 г`, `V(H_2O) = 170" мл"`;
б) `m(KBr) = 75 г`, `V(H_2O) = 1425" мл"`;
в) `m(KBr) = 0.015 г`, `V(H_2O) = 14.985" мл"`.4. В 500 г раствора, насыщенного при 20°C, содержится 120 г нитрата калия KNO3. Найдите растворимость этой соли и массовую долю соли в растворе.
Ответ
Дано:
`m("р-ра") = 500 г`
`m(KNO_3) = 120 г`
`ω(KNO_3) = ?`
`s(KNO_3) = ?`
Решение
`ω(KNO_3) = (100*m(KNO_3))/(m("р-ра")) = (100*120)/500 = 24%`
`m(H_2O) = m("р-ра") - m(KNO_3) = 500 - 120 = 380 г`
`s(KNO_3) = (100*m(KNO_3))/(m(H_2O)) = (100*120)/380 = 31.6 г/(100 г H_2O)`
Ответ: `ω(KNO_3) = 24%`, `s(KNO_3) = 31.6 г/(100 г H_2O)`.5. Столовый уксус представляет собой 6%-й раствор уксусной кислоты в воде. Для приготовления 200 г столового уксуса потребуется этой кислоты:
1) 0,2 г; 2) 10 г; 3) 12 г; 4) 14 г.Ответ
Дано:
`ω(CH_3COOH) = 6%`
`m("р-ра") = 200 г`
`m(CH_3COOH) = ?`
Решение
`m(CH_3COOH) = (ω(CH_3COOH)*m("р-ра"))/100 = (6*200)/100 = 12 г`
Ответ: `m(CH_3COOH) = 12 г`.6. Для приготовления 400 г раствора использовали 34 г соли. Массовая доля растворённого вещества в растворе составляет:
1) 3,4%; 2) 6,8%; 3) 8,5%; 4) 12,2%.Ответ
Дано:
`m("соли") = 34 г`
`m("р-ра") = 400 г`
`ω("соли") = ?`
Решение
`ω("соли") = (100*m("соли"))/(m("р-ра")) = (100*34)/400 = 8.5%`
Ответ: `ω("соли") = 8.5%`. §26
-
Глава 5. Понятие о газах. Воздух. Кислород. Горение.
§26. Законы Гей-Люссака и Авогадро.
1. Баллон вмещает 30 моль сжатого кислорода. Какой объём займёт этот газ (при н. у.)?
Ответ
Дано:
`n(O_2) = 30" моль"`
`V(O_2) = ?`
Решение
`V(O_2) = n(O_2)*V_m = 30*22.4 = 672 л`
Ответ: `V(O_2) = 672 л`.2. Какой объём займёт (при н. у.) водород количеством вещества: а) 3 моль; б) 0,4 моль; в) 2 моль; г) 400 моль?
Ответ
Дано:
`"а) "n(H_2) = 3" моль"`
`"б) "n(H_2) = 0.4" моль"`
`"в) "n(H_2) = 2" моль"`
`"г) "n(H_2) = 400" моль"`
`V(H_2) = ?`
Решение
`"а) "V(H_2) = n(H_2)*V_m = 3*22.4 = 67.2 л`
`"б) "V(H_2) = n(H_2)*V_m = 0.4*22.4 = 8.96 л`
`"в) "V(H_2) = n(H_2)*V_m = 2*22.4 = 44.8 л`
`"г) "V(H_2) = n(H_2)*V_m = 400*22.4 = 8960 л`
Ответ:
`"а) "V(H_2) = 67.2 л`
`"б) "V(H_2) = 8.96 л`
`"в) "V(H_2) = 44.8 л`
`"г) "V(H_2) = 8960 л`.3. Колба объёмом 500 мл заполнена хлором (при н. у.). Определите количество вещества и число молекул.
Ответ
Дано:
`V(Cl_2) = 500" мл" = 0.5 л`
`n(Cl_2) = ?`
`N(Cl_2) = ?`
Решение
`n(Cl_2) = (V(Cl_2))/V_m = 0.5/22.4 = 0.0223" моль"`
`N(Cl_2) = n(Cl_2)*N_А = 0.0223*6*10^23 = 1.34*10^22" молекул"`
Ответ: `n(Cl_2) = 0.0223" моль"`, `N(Cl_2) = 1.34*10^22" молекул"`.4. Какой объём кислорода (н. у.) потребуется для сгорания угля массой 24 г?
C + O2 = CO2Ответ
Дано:
`m(C) = 24 г`
`V(O_2) = ?`
Решение
`C + O_2 = CO_2`
`n(C) = (m(C))/(M(C)) = 24/12 = 2" моль"`
`n(O_2) = n(C) = 2" моль"`
`V(O_2) = n(O_2)*V_m = 2*22.4 = 44.8 л`
Ответ: `V(O_2) = 44.8 л`.5. Каковы объём (н. у.) и масса водорода, выделившегося при взаимодействии 6,9 г металла натрия с водой?
2Na + 2H2O = 2NaOH + H2↑Ответ
Дано:
`m(Na) = 6.9 г`
`V(H_2) = ?`
`m(H_2) = ?`
Решение
`2Na + 2H_2O = 2NaOH + H_2"↑"`
`n(Na) = (m(Na))/(M(Na)) = 6.9/23 = 0.3" моль"`
`n(H_2) = (n(Na))/2 = 0.3/2 = 0.15" моль"`
`V(H_2) = n(H_2)*V_m = 0.15*22.4 = 3.36 л`
`m(H_2) = n(H_2)*M(H_2= 0.15*2 = 0.3 г`
Ответ: `V(H_2) = 3.36 л`, `m(H_2) = 0.3 г`.6. Рассчитайте объём (н. у.) сернистого газа SO2, образующегося:
а) при сгорании 3 г серы S + O2 = SO2;
б) при затрате на сгорание серы 44,8 л кислорода; 2,24 л кислорода; 11,2 л кислорода.Ответ
Дано:
а) `m(S) = 3 г`
б) `V_1(O_2) = 44.8 л`
`V_2(O_2) = 2.24 л`
`V_3(O_2) = 11.2 л`
`V(SO_2) = ?`
Решение
`S + O_2 = SO_2`
а) `n(S) = (m(S))/(M(S)) = 3/32 = 0.09375" моль"`
`n(SO_2) = n(S) = 0.09375" моль"`
`V(SO_2) = n(SO_2)*V_m = 0.09375*22.4 = 2.1 л`
б) `V(SO_2) = n(O_2)`
`V_1(SO_2) = 44.8 л`
`V_2(SO_2) = 2.24 л`
`V_3(SO_2) = 11.2 л`
Ответ:
а) `V(SO_2) = 2.1 л`
б) `V_1(SO_2) = 44.8 л`, `V_2(SO_2) = 2.24 л`, `V_3(SO_2) = 11.2 л`. §27
-
§27. Воздух – смесь газов. Относительная плотность газов.
1. Определите относительную плотность углекислого газа по водороду, воздуху и кислороду.
Ответ
Дано:
`CO_2`
`D_(H_2)(CO_2) = ?`
`D_"возд."(CO_2) = ?`
`D_(O_2)(CO_2) = ?`
Решение
`D_(H_2)(CO_2) = (M_r(CO_2))/(M_r(H_2)) = 44/2 = 22`
`D_"возд."(CO_2) = (M_r(CO_2))/(M_r("возд.")) = 44/29 = 1.517`
`D_(O_2)(CO_2) = (M_r(CO_2))/(M_r(O_2)) = 44/32 = 1.375`
Ответ: `D_(H_2)(CO_2) = 22`, `D_"возд."(CO_2) = 1.517`, `D_(O_2)(CO_2) = 1.375`.2. Сравните величины: плотность и относительная плотность газов.
Ответ
Плотность газа – абсолютная величина численно равная массе газа в единицы объёма газа.
Относительная плотность газа – относительная величина, которая показывает во сколько раз один газ легче или тяжелее другого газа.3. Определите относительную молекулярную массу хлороводорода, если его относительная плотность по водороду равна 18,25.
Ответ
Дано:
`D_(H_2)(HCl) = 18.25`
`M_r(HCl) = ?`
Решение
`D_(H_2)(HCl) = (M_r(HCl))/(M_r(H_2))`
`M_r(HCl) = D_(H_2)(HCl)*M_r(H_2) = 18.25*2 = 36.5" г/моль"`
Ответ: `M_r(HCl) = 36.5" г/моль"`.4. Как экспериментально доказать, что воздух не является индивидуальным простым веществом?
Ответ
Доказать, что воздух не является индивидуальным простым веществом, можно при сжигании фосфора в воздухе под стеклянным колоколом, опушенным в воду. При этом вода в колоколе поднимается примерно на 1/5, так как при горении фосфора расходуется только кислород.
5. При сгорании топлива, дыхании растений и животных потребляется огромное количество кислорода. Почему его массовая доля в воздухе не изменяется?
Ответ
Массовая доля в воздухе не изменяется, так как его расход компенсируется его образованием в процессе фотосинтеза.
6. В 1 м3 воздуха при комнатной температуре содержится 18 мл воды в виде паров. Рассчитайте, сколько воды содержится в воздухе кабинета химии (размеры кабинета: 8×6×3,5 м).
Ответ
`V("кабинета") = 8*6*3.5 = 168 м^3`
`V(H_2O) = (18*168)/1 = 3024" мл" = 3.024 л`7. -
8. Какие вещества получают из воздуха? Где и как их используют?
Ответ
Из воздуха получают: азот, кислород и инертные газы (в основном аргон).
Азот используется в качестве сырья для синтеза аммиака. Жидкий азот применяется как хладагент.
Кислород используется для газопламенной резки и сварки металлов, в химической промышленности кислород используют как реактив-окислитель. Жидкий кислород применяется в качестве окислителя для ракетного топлива.
Аргон используется: в лазерах, при заполнении внутреннего пространства стеклопакетов и ламп накаливания, в качестве защитной среды при сварке металлов. §28
-
§28. Кислород – химический элемент и простое вещество. Получение кислорода в лаборатории.
1. Рассчитайте массовые доли кислорода в соединениях, использующихся для его получения: H2O2, HgO, KMnO4, KClO3. Если бы стоимость всех перечисленных веществ была одинаковой, применение какого из них оказалось бы наиболее выгодным?
Ответ
Дано:
`H_2O_2`
`HgO`
`KMnO_4`
`KClO_3`
`ω_"наибол."(O) = ?`
Решение
`ω_(H_2O_2)(O) = (100*2*A_r(O))/(M_r(H_2O_2)) = (100*2*16)/34 = 94.1%`
`ω_(HgO)(O) = (100*A_r(O))/(M_r(HgO)) = (100*16)/217 = 7.4%`
`ω_(KMnO_4)(O) = (100*4*A_r(O))/(M_r(KMnO_4)) = (100*4*16)/158 = 40.5%`
`ω_(KClO_3)(O) = (100*3*A_r(O))/(M_r(KClO_3)) = (100*3*16)/122.5 = 39.2%`
Ответ: наиболее выгодным веществом для получения кислорода является пероксид водорода `ω_(H_2O_2)(O) = 94.1%`.2. Определите массу каждого вещества, которое следует подвергнуть разложению, чтобы получить 64 г O2: a) KClO3; б) HgO; в) KMnO4.
Ответ
Дано:
`m(O_2) = 64 г`
`"а) "KClO_3`
`"б) "HgO`
`"в) "KMnO_4`
`m(KClO_3) = ?`
`m(HgO) = ?`
`m(KMnO_4) = ?`
Решение
`n(O_2) = (m(O_2))/(M(O_2)) = 64/32 = 2" моль"`
`"а) "2KClO_3 = 2KCl + 3O_2`
`n(KClO_3) = (2*n(O_2))/3 = (2*2)/3 = 1.33" моль"`
`m(KClO_3) = n(KClO_3)*M(KClO_3) = 1.33*122.5 = 163 г`
`"б) "2HgO = 2Hg + O_2`
`n(HgO) = 2*n(O_2) = 2*2 = 4" моль"`
`m(HgO) = n(HgO)*M(HgO) = 4*217 = 868 г`
`"в) "2KMnO_4 = K_2MnO_4 + MnO_2 + O_2`
`n(KMnO_4) = 2*n(O_2) = 2*2 = 4" моль"`
`m(KMnO_4) = n(KMnO_4)*M(KMnO_4) = 4*158 = 632 г`
Ответ: `m(KClO_3) = 163 г`, `m(HgO) = 868 г`, `m(KMnO_4) = 632 г`.3. Многие минералы в своём составе имеют атомы кислорода. Рассчитайте массовую долю кислорода: а) в малахите (CuOH)2CO3; б) в кальците CaCO3; в) в горном хрустале SiO2; г) в корунде Al2O3.
Ответ
Дано:
`"а) "(CuOH)_2CO_3`
`"б) "CaCO_3`
`"в) "SiO_2`
`"г) "Al_2O_3`
`ω(O) = ?`
Решение
`"а) "ω(O) = (100*5*A_r(O))/(M_r((CuOH)_2CO_3)) = (100*5*16)/222 = 36.04%`
`"б) "ω(O) = (100*3*A_r(O))/(M_r(CaCO_3)) = (100*3*16)/100 = 48%`
`"в) "ω(O) = (100*2*A_r(O))/(M_r(SiO_2)) = (100*2*16)/60 = 53.33%`
`"г) "ω(O) = (100*3*A_r(O))/(M_r(Al_2O_3)) = (100*3*16)/102 = 47.06%`
Ответ: `"а) "ω(O) = 36.04%`, `"б) "ω(O) = 48%`, `"в) "ω(O) = 53.33%`, `"г) "ω(O) = 47.06%`.4. Как известно, рыбы дышат кислородом, растворённым в воде. Что можно сказать о требовательности к содержанию кислорода в воде таких известных видов рыб, как карась и форель, если первый предпочитает стоячую воду небольших прудов, а вторая водится только в быстрых горных речках?
Ответ
В горных реках температура воды ниже, чем в небольших прудах, а растворимость газов в жидкостях растёт с понижением температуры. Также в быстрых горных речках потоки воды активно перемешиваются, поэтому количество растворенного кислорода больше, чем в стоячей воде.
Карась живет в прудах и озерах, а в форель в реках, поэтому можно сделать вывод, что форель более требовательна к высокому содержанию кислорода в воде, чем карась.5. В каких условиях можно хранить жидкий кислород? Где он применяется?
Ответ
Жидкий кислород хранят и транспортируют в металлических сосудах Дьюара (термосах) или в специальных цистернах – танках.
Жидкий кислород является окислительным компонентом ракетных топлив. §29
-
§29. Химические свойства и применение кислорода.
1. Формулы только оксидов приведены в ряду:
1) HCl, FeO, CuCl2;
2) Na2SO4, SO3, BaO;
3) P2O5, CaO, N2O3;
4) NaOH, Na2O, H2SO4.Ответ
Формулы только оксидов приведены в ряду: 3) P2O5, CaO, N2O3.
2. Соедините стрелками формулы оксидов с их названиями.
1) Na2O; 2) SO3; 3) Fe2O3; 4) MnO2.
А. Оксид железа (III); Б. Оксид натрия; В. Оксид марганца (IV); Г. Оксид серы (VI).Ответ
1) Б; 2) Г; 3) А; 4) В.
3. Составьте уравнения реакций окисления этилена C2H4, этана C2H6.
Ответ
C2H4 + 3O2 ⟶ 2CO2 + 2H2O
2C2H6 + 7O2 ⟶ 4CO2 + 6H2O4. Используя компьютер, составьте схему применения кислорода. Постарайтесь отразить в ней обусловленность применения свойствами вещества. Обсудите её с товарищем.
Ответ
Применение кислорода:
- для газопламенной резки и сварки металлов – обусловлено сильной окислительной способностью;
- в качестве окислителя для ракетного топлива – обусловлено сильной окислительной способностью;
- в медицине – поддерживает дыхание;
- в химической промышленности – обусловлено сильной окислительной способностью. §30
-
Глава 6. Основные классы неорганических соединений.
§30. Оксиды.
1. Формулы только основных оксидов приведены в ряду:
1) SO2, BaO, Cl2O7;
2) CaO, Na2O, Rb2O;
3) SO2, CO2, P2O5;
4) P2O3, MgO, HgO.Ответ
Формулы только основных оксидов приведены в ряду: 2) CaO, Na2O, Rb2O.
2. Формулы только кислотных оксидов приведены в ряду:
1) Na2O, K2O, MgO;
2) CO2, Fe2O3, N2O5;
3) CO2, P2O5, Mn2O7;
4) Li2O, CO2, MnO.Ответ
Формулы только кислотных оксидов приведены в ряду: 3) CO2, P2O5, Mn2O7.
3. Что вы знаете о применении оксидов CO2, H2O, SiO2 и др.? Составьте формулы оксидов: S(IV), Cu(II), Fe(III), Hg(II), N(V), P(V), Se(VI), Cl(VII). Какие из них вступают в реакцию с водой? Составьте уравнения этих реакций.
Ответ
Углекислый газ CO2 применяется в пищевой промышленности как консервант, в системах пожаротушения и в огнетушителях, используется для газирования напитков, для создания инертной среды при сварке металлов.
Вода H2O используется в качестве растворителя, теплоносителя, для питья и приготовления пищи, для пожаротушения.
Оксид кремния (IV) SiO2 применяют в производстве стекла, керамики, абразивов, бетонных изделий.
Формулы оксидов: SO2, CuO, Fe2O3, HgO, N2O5, P2O5, SeO3, Cl2O7.
SO2 + H2O = H2SO3
N2O5 + H2O = 2HNO3
P2O5 + 3H2O = 2H3PO4
SeO3 + H2O = H2SeO4
Cl2O7 + H2O = 2HClO4Лабораторный опыт
2. Поместите в пробирки с водой небольшие (размером меньше спичечной головки) порции оксида фосфора (V), оксида кремния (IV), оксида кальция и оксида железа (III). Размешайте стеклянными палочками. Что наблюдаете? Во все пробирки добавьте по 2-3 капли лакмуса.
Ответ
При добавлении воды к оксиду фосфора (V) наблюдается его растворение:
P2O5 + 3H2O = 2H3PO4
Лакмус окрашивает раствор в красный цвет.
При добавлении воды к оксиду кремния (IV) изменений не наблюдается. Лакмус не меняет окраску раствора.
При добавлении воды к оксиду кальция (V) наблюдается его растворение:
CaO + H2O = Ca(OH)2
Лакмус окрашивает раствор в синий цвет.
При добавлении воды к оксиду железа (III) изменений не наблюдается. Лакмус не меняет окраску раствора. §31
-
§31. Основания – гидроксиды основных оксидов.
1. Формулы только оснований приведены в ряду:
1) KOH, K2SO4, K2O;
2) NaOH, Cu(OH)2, Ca(OH)2;
3) H2SO4, LiOH, Li2CO3;
4) CuSO4, Cu(OH)2, Mg(OH)2.
В выбранном ряду подчеркните щёлочи.Ответ
Формулы только оснований приведены в ряду: 2) NaOH, Cu(OH)2, Ca(OH)2.
2. Назовите вещества, состав которых выражается следующими формулами: CuO, Zn(OH)2, Al(OH)3, Fe2O3, Na2SO4, Mg(OH)2, HgO, Pb(OH)2, Cr(OH)3.
Ответ
CuO – оксид меди (II)
Zn(OH)2 – оксид цинка (II)
Al(OH)3 – оксид алюминия
Fe2O3 – оксид железа (III)
Na2SO4 – сульфат натрия
Mg(OH)2 – гидроксид магния (II)
HgO – оксид ртути (II)
Pb(OH)2 – гидроксид свинца (II)
Cr(OH)3 – гидроксид хрома (III)3. По предложенной схеме составьте соответствующие уравнения реакций:
a) Li ⟶ Li2O ⟶ LiOH;
б) Ca ⟶ CaO ⟶ Ca(OH)2.Ответ
a) 4Li + O2 ⟶ 2Li2O
Li2O + H2O ⟶ 2LiOH
б) 2Ca + O2 ⟶ 2CaO
CaO + H2O ⟶ Ca(OH)24. Предложите объяснение следующему факту. Название гидроксида натрия восходит к названию знаменитого в древности египетского озера Вади Натрум. Какая связь может быть прослежена между ними?
Ответ
Название долины Вади-Натрун связано с наличием в ней небольших озёр богатых содой (карбонатом натрия). Из соды получают гидроксида натрия, поэтому данная щёлочь имеет такое название.
Лабораторный опыт
В четыре пробирки поместите очень маленькие порции (столько, сколько уместилось бы на кончике ножа) оксидов алюминия, бария, кальция и меди (II) и прилейте к ним по 2-3 мл воды. Взболтайте вещества в пробирках. Что произошло? Во все пробирки добавьте по нескольку капель фенолфталеина.
Ответ
При добавлении воды к оксиду алюминия изменений не наблюдается. Фенолфталеин не меняет окраску раствора.
При добавлении воды к оксиду бария наблюдается его растворение:
BaO + H2O = Ba(OH)2
Фенолфталеин окрашивает раствор в малиновый цвет.
При добавлении воды к оксиду меди (II) изменений не наблюдается. Фенолфталеин не меняет окраску раствора. §32
-
§32. Кислоты.
1. Формулы только кислородсодержащих кислот приведены в ряду:
1) HCl, H2SO4, H3PO4;
2) H2SiO3, H2S, H2SO3;
3) H2SO4, HNO3, H3PO4;
4) HNO3, HF, H2S.Ответ
Формулы только кислородсодержащих кислот приведены в ряду: 3) H2SO4, HNO3, H3PO4.
2. Валентность кислотного остатка сернистой кислоты равна:
1) I; 2) II; 3) III; 4) IV.Ответ
Валентность кислотного остатка сернистой кислоты равна: 2) II.
3. Соедините стрелками названия кислот с их характерными свойствами.
1) уксусная кислота; 2) соляная кислота; 3) серная кислота; 4) сероводородная кислота.
А. Концентрированная, летучая, с запахом хлороводорода; Б. Летучая, с запахом тухлых яиц; В. Летучая, с резким характерным запахом; Г. Тяжёлая, маслянистая жидкость, без запаха.Ответ
1) В; 2) А; 3) Г; 4) Б.
4. По предложенной схеме составьте уравнения химических реакций:
1) C ⟶ CO2 ⟶ H2CO3;
2) S ⟶ SO2 ⟶ SO3 ⟶ H2SO4;
3) B ⟶ B2O3 ⟶ H3BO3;
4) Ba ⟶ BaO ⟶ Ba(OH)2.Ответ
1) C + O2 = CO2
CO2 + H2O = H2CO3
2) S + O2 = SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
3) 4B + 3O2 = 2B2O3
B2O3 + 3H2O = 2H3BO3
4) 2Ba + O2 = 2BaO
BaO + H2O = Ba(OH)2 §33
-
§33. Соли: состав и номенклатура.
1. Формулы только солей приведены в ряду:
1) Zn(NO3)2, HNO3, MgSO4;
2) Cu(OH)2, CuSO4, H2SO4;
3) AlCl3, Ba(NO3)2, Na3PO4;
4) Al2(SO4)3, H2S, MgCO3.Ответ
Формулы только солей приведены в ряду: 3) AlCl3, Ba(NO3)2, Na3PO4.
2. Расставьте индексы и дайте названия веществам: Zn…Cl…, Mg…NO3…, Ca…PO4…, Al…S…, Fe(III)…SO4…, Na…SiO3…, Na…NO3….
Ответ
ZnCl2 – хлорид цинка (II)
Mg(NO3)2 – нитрат магния
Ca3(PO4)2 – фосфат кальция
Al2S3 – сульфид алюминия
Fe2(SO4)3 – сульфат железа (III)
Na2SiO3 – силикат натрия
NaNO3 – нитрат натрия3. Составьте формулы следующих солей: нитрат меди (II), хлорид меди (II), хлорид ртути (II), силикат магния, фосфат калия, сульфат кальция.
Ответ
Нитрат меди (II) – Cu(NO3)2
Хлорид меди (II) – CuCl2
Хлорид ртути (II) – HgCl2
Силикат магния – MgSiO3
Фосфат калия – K3PO4
Сульфат кальция – CaSO44. Работая с одним из вариантов малого химического тренажёра (табл. 20), выполните следующее:
а) определите принадлежность каждого соединения к одному из классов неорганических соединений;
б) назовите каждое вещество;
в) определите валентность кислотных остатков в формулах солей и кислот;
г) определите растворимость солей по таблице растворимости;
д) проверьте себя: сколько веществ из перечисленных в данном варианте вам хорошо знакомы (т. е. вы можете описать их физические свойства).Ответ
Вариант I
Формула вещества Класс соединения Название вещества Валентность кислотного остатка Растворимость соли Физические свойства вещества CaO Основный оксид Оксид кальция Твёрдое вещество белого цвета без запаха H2S Кислота Сероводород II Бесцветный газ с запахом тухлых яиц NaCl Соль Хлорид натрия I Растворимая Бесцветное твёрдое вещество без запаха Ca3(PO4)2 Соль Фосфат кальция III Нерастворимая Бесцветное твёрдое вещество без запаха N2O5 Кислотный оксид Оксид азота (V) Бесцветный газ с резким запахом AgNO3 Соль Нитрат серебра (I) I Растворимая Бесцветное твёрдое вещество без запаха Mg Металл Магний Твёрдое вещество серебристого цвета без запаха FeSO4 Соль Сульфат железа II Растворимая Твёрдое вещество светло-жёлтого цвета без запаха HNO3 Кислота Азотная кислота I Бесцветная, дымящая на воздухе жидкость с резким запахом Вариант II
Формула вещества Класс соединения Название вещества Валентность кислотного остатка Растворимость соли Физические свойства вещества K2SiO3 Соль Силикат калия II Растворимая Бесцветное твёрдое вещество без запаха Na2O Основный оксид Оксид натрия Бесцветное твёрдое вещество без запаха H2SO4 Кислота Серная кислота II Маслянистая жидкость без цвета и запаха K3PO4 Соль Фосфат калия III Растворимая Бесцветное твёрдое вещество без запаха PbS Соль Сульфид свинца (II) II Нерастворимая Твёрдое вещество серого цвета без запаха P2O5 Кислотный оксид Оксид фосфора (V) Бесцветный газ с резким запахом H2CO3 Кислота Угольная кислота II Угольная кислота существует в водных растворах ZnSO4 Соль Сульфат цинка II Растворимая Бесцветное твёрдое вещество без запаха Cu Металл Медь Твёрдое вещество золотисто-розового цвета без запаха Вариант III
Формула вещества Класс соединения Название вещества Валентность кислотного остатка Растворимость соли Физические свойства вещества H2SO3 Кислота Сернистая кислота II Существует лишь в разбавленных водных растворах ZnCl2 Соль Хлорид цинка I Растворимая Твёрдое вещество белого цвета без запаха BaO Основный оксид Оксид бария Бесцветное твёрдое вещество без запаха Ba Металл Барий Твёрдое вещество серебристого цвета без запаха SO3 Кислотный оксид Оксид серы (VI) Бесцветный газ с резким запахом K3PO4 Соль Фосфат калия III Растворимая Бесцветное твёрдое вещество без запаха HNO3 Кислота Азотная кислота I Бесцветная, дымящая на воздухе жидкость с резким запахом CaS Соль Сульфид кальция II Разлагается Твёрдое вещество белого цвета без запаха Hg(NO3)2 Соль Нитрат ртути (II) I Растворимая Бесцветное твёрдое вещество без запаха Вариант IV
Формула вещества Класс соединения Название вещества Валентность кислотного остатка Растворимость соли Физические свойства вещества HgCl2 Соль Хлорид ртути (II) I Растворимая Бесцветное твёрдое вещество без запаха HNO3 Кислота Азотная кислота I Бесцветная, дымящая на воздухе жидкость с резким запахом BaSO4 Соль Сульфат бария II Нерастворимая Твёрдое вещество белого цвета без запаха MgO Основный оксид Оксид магния Твёрдое вещество белого цвета без запаха Na2SO4 Соль Сульфат натрия II Растворимая Бесцветное твёрдое вещество без запаха CO2 Кислотный оксид Оксид углерода (IV) Бесцветный газ без запаха CaSiO3 Соль Силикат кальция II Нерастворимая Бесцветное твёрдое вещество без запаха H3PO4 Кислота Фосфорная кислота III Твёрдое вещество белого цвета без запаха Ca Металл Кальций Твёрдое вещество серебристого цвета без запаха Вариант V
Формула вещества Класс соединения Название вещества Валентность кислотного остатка Растворимость соли Физические свойства вещества SO2 Кислотный оксид Оксид серы (IV) Бесцветный газ с резким запахом Mg3(PO4)2 Соль Фосфат магния III Нерастворимая Бесцветное твёрдое вещество без запаха H2SiO3 Кислота Кремниевая кислота II Бесцветное твёрдое вещество без запаха ZnCl2 Соль Хлорид цинка I Растворимая Твёрдое вещество белого цвета без запаха CaO Основный оксид Оксид кальция Твёрдое вещество белого цвета без запаха Fe Металл Железо Твёрдое вещество серебристого цвета без запаха H2SO4 Кислота Серная кислота II Маслянистая жидкость без цвета и запаха Pb(NO3)2 Соль Нитрат свинца (II) I Растворимая Бесцветное твёрдое вещество без запаха K2CO3 Соль Карбонат кальция II Растворимая Бесцветное твёрдое вещество без запаха §34
-
§34. Химические свойства оксидов.
1. Из приведённых уравнений химических реакций выберите то, которое характеризует общее свойство всех кислотных оксидов.
1) SO3 + H2O = H2SO4;
2) SO3 + Na2O = Na2SO4;
3) H2SO4 = SO3 + H2O;
4) SO3 + 2NaOH = Na2SO4 + H2O.Ответ
Все кислотные оксиды взаимодействуют со щелочами:
4) SO3 + 2NaOH = Na2SO4 + H2O.2. Из приведённых уравнений химических реакций выберите то, которое характеризует общее свойство всех основных оксидов.
1) K2O + H2O = 2KOH;
2) K2O + CO2 = K2CO3;
3) CuO + H2SO4 = CuSO4 + H2O;
4) Cu(OH)2 = CuO + H2O.Ответ
Все основные оксиды взаимодействуют с кислотами:
3) CuO + H2SO4 = CuSO4 + H2O.3. Из перечня приведённых формул: NaOH, H2O, PH3, MgCl2, H2SO4, CO2, Ba(OH)2, CH4 – выберите формулы веществ, вступающих во взаимодействие: а) с оксидом серы (IV); б) с оксидом кальция. Составьте соответствующие уравнения реакций.
Ответ
а) 2NaOH + SO2 = Na2SO3 + H2O
H2O + SO2 = H2SO3
Ba(OH)2 + SO2 = BaSO3 + H2O
б) CaO + H2O = Ca(OH)2
CaO + H2SO4 = CaSO4 + H2O
CaO + CO2 = CaCO34. Составьте уравнения реакций, раскрывающие следующие превращения:
? ⟵ S ⟶ ? ⟶ BaSO3
? ⟵ Ba ⟶ ? ⟶ BaSO3Ответ
S + O2 ⟶ SO2
SO2 + Ba(OH)2 ⟶ BaSO3↓ + H2O
2Ba + O2 ⟶ 2BaO
BaO + SO2 ⟶ BaSO3
Ba + S ⟶ BaSЛабораторные опыты
1. Поместите в две пробирки небольшие количества оксида меди (II) и оксида цинка. Прилейте в каждую по 1,5-2 мл раствора серной кислоты и немного нагрейте. Что наблюдаете? Составьте соответствующие уравнения реакций.
2. Руководствуясь схемой опыта (рис. 65), получите углекислый газ и пропустите его через известковую воду (раствор гидроксида кальция). Вы уже знаете, что в результате этой реакции образуется нерастворимое вещество белого цвета (известковая вода мутнеет). Вспомните, в каких целях вы использовали эту реакцию на уроках биологии.
Ответ
1. При добавлении раствора серной кислоты к оксиду меди (II) наблюдается растворение оксида, и окрашивание раствора в синий цвет:
CuO + H2SO4 = CuSO4 + H2O
При добавлении раствора серной кислоты к оксиду цинка наблюдается растворение оксида:
ZnO + H2SO4 = ZnSO4 + H2O
2. Получим углекислый газ с помощью взаимодействия соляной кислоты с карбонатом кальция (мрамором, мелом):
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
При пропускании углекислого газа через известковую воду, наблюдается помутнение раствора:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
С помощью данной реакции на уроке биологии было доказано, что в выдыхаемом воздухе содержится углекислый газ. §35
-
§35. Химические свойства кислот.
1. Дополните схемы и составьте соответствующие им уравнения реакций.
а) Ba ⟶ ? ⟶ ?
б) C ⟶ ? ⟶ ?
в) Li ⟶ ? ⟶ ?Ответ
а) Ba + 2H2O = Ba(OH)2 + H2↑
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
б) C + O2 = CO2
CO2 + 2NaOH = Na2CO3 + H2O
в) 4Li + O2 = 2Li2O
Li2O + 2HCl = 2LiCl + H2O2. С какими из перечисленных веществ вступит в реакцию соляная кислота: SO2, CuO, HNO3, CO2, Fe(OH)3, KOH, P2O5, CaO, Mg(OH)2? Составьте уравнения реакций.
Ответ
CuO + 2HCl = CuCl2 + H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
KOH + HCl = KCl + H2O
CaO + 2HCl = CaCl2 + H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O3. Составьте уравнения реакций, отражающих химические свойства фосфорной кислоты.
Ответ
Уравнения реакций, отражающих химические свойства фосфорной кислоты.
Реагирует с металлами:
3Mg + 2H3PO4 = Mg3(PO4)2 + 3H2↑
Реагирует с основными оксидами:
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
Реагирует с основаниями:
3KOH + H3PO4 = K3PO4 + 3H2O
Реагирует с солями:
3Na2CO3 + 2H3PO4 = 2Na3PO4 + 3H2O + 3CO2↑ §36
-
§36. Щёлочи, их свойства и способы получения.
1. С помощью уравнений реакций проиллюстрируйте химические свойства едкого кали KOH, известковой воды, баритовой воды – Ba(OH)2.
Ответ
Химические свойства едкого кали KOH, известковой воды, баритовой воды – Ba(OH)2.
Взаимодействуют с кислотами:
KOH + HCl = KCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Взаимодействуют с кислотными оксидами:
2KOH + CO2 = K2CO3 + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
Ba(OH)2 + CO2 = BaCO3 + H2O
Взаимодействуют с солями:
2KOH + CuSO4 = K2SO4 + Cu(OH)2↓
Ca(OH)2 + FeCl2 = CaCl2 + Fe(OH)2↓
Ba(OH)2 + FeCl2 = BaCl2 + Fe(OH)2↓2. Подумайте, какие правила предосторожности следует соблюдать при приготовлении растворов щелочей.
Ответ
При приготовлении растворов щелочей необходимо надеть: маску-экран или защитные очки, респиратор, резиновые перчатки.
Следует добавлять щелочь в воду, а не наоборот. Следует разбить добавление щелочи в воду на несколько частей.3. Из варианта I малого химического тренажёра (см. табл. 20, с. 144) выберите вещества, способные вступать во взаимодействие с соляной кислотой. Составьте уравнения соответствующих реакций.
Ответ
CaO + 2HCl = CaCl2 + H2O
AgNO3 + HCl = HNO3 + AgCl↓
Mg + 2HCl = MgCl2 + H2↑4. Как вы думаете, целесообразно ли в промышленности получать щёлочи способами, рассмотренными в данном параграфе? Ответ обоснуйте.
Ответ
В параграфе приведены два способа получения щелочей – из металлов и их оксидов.
Получать щелочи из соответствующих металлов нецелесообразно, т. к. на получение чистых металлов тратится много ресурсов.
Получать щелочи из оксидов соответствующих металлов гораздо выгоднее, т. к. оксиды металлов дешевле получить термическим разложением соответствующих карбонатов, таким образом получают, например, гашеную известь.5. В трёх пробирках находятся образцы твёрдых веществ: гидроксида натрия, гидроксида кальция и оксида цинка. Как различить эти вещества?
Ответ
1) Добавить воды во все три пробирки, в пробирке, где не произошло растворение твёрдого вещества, находится оксид цинка.
2) Пропустить выдыхаемый воздух через оставшиеся две пробирки, в той, где будет наблюдаться помутнение раствора, находится гидроксид кальция:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В пробирке, где изменений не наблюдается, находится гидроксид натрия.6. В трёх пробирках находятся растворы соляной кислоты, едкого натра и известковой воды. Предложите самый короткий способ их определения.
Ответ
1) Добавить в пробирки раствор фенолфталеина, в пробирке с соляной кислотой цвет не изменится, в пробирках с едким натром и известковой водой произойдет окрашивание растворов в малиновый цвет.
2) Пропустить выдыхаемый воздух через окрашенные пробирки, в той, где будет наблюдаться помутнение раствора, – находится известковая вода:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В пробирке, где изменений не наблюдается, находится едкий натр.7. Составьте уравнения реакций, раскрывающие схему превращений:
а) Ca ⟶ CaO ⟶ Ca(OH)2 ⟶ Ca3(PO4)2;
б) BaO ⟶ Ba(OH)2 ⟶ Ba(NO3)2.Ответ
а) 2Ca + O2 ⟶ 2CaO
CaO + H2O ⟶ Ca(OH)2
3Ca(OH)2 + 2H3PO4 ⟶ Ca3(PO4)2 + 6H2O
б) BaO + H2O ⟶ Ba(OH)2
Ba(OH)2 + 2HNO3 ⟶ Ba(NO3)2 + 2H2O8. Вычислите объём (л) оксида углерода (IV) (н. у.), который можно получить из 500 г карбоната кальция.
Ответ
Дано:
`m(CaCO_3) = 500 г`
`V(CO_2) = ?`
Решение
`CaCO_3 overset(t)(=) CaO + CO_2"↑"`
`n(CaCO_3) = (m(CaCO_3))/(M(CaCO_3)) = 500/100 = 5" моль"`
`n(CO_2) = n(CaCO_3) = 5" моль"`
`V(CO_2) = n(CO_2)*V_m = 5*22.4 = 112 л`
Ответ: `V(CO_2) = 112 л`. §37
-
§37. Нерастворимые основания, их получение и свойства. Амфотерность.
1. Из перечня формул малого химического тренажёра (см. табл. 20, с. 144) выберите формулы тех веществ, которые вступают в реакцию: а) с KOH; б) с Fe(OH)3; в) с Ca(OH)2. Составьте соответствующие уравнения реакций.
Ответ
а) KOH
2KOH + H2S = K2S + 2H2O
2KOH + N2O5 = 2KNO3 + H2O
KOH + AgNO3 = KNO3 + AgOH↓
2KOH + FeSO4 = K2SO4 + Fe(OH)2↓
KOH + HNO3 = KNO3 + H2O
2KOH + H2SO4 = K2SO4 + 2H2O
6KOH + P2O5 = 2K3PO4 + 3H2O
2KOH + H2CO3 = K2CO3 + 2H2O
2KOH + ZnSO4 = K2SO4 + Zn(OH)2↓
2KOH + H2SO3 = K2SO3 + 2H2O
2KOH + ZnCl2 = 2KCl + Zn(OH)2↓
2KOH + SO3 = K2SO4 + H2O
2KOH + Hg(NO3)2 = 2KNO3 + Hg(OH)2↓
2KOH + HgCl2 = 2KCl + Hg(OH)2↓
2KOH + CO2 = K2CO3 + H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + SO2 = K2SO3 + H2O
2KOH + H2SiO3 = K2SiO3 + 2H2O
2KOH + Pb(NO3)2 = 2KNO3 + Pb(OH)2↓
б) Fe(OH)3
2Fe(OH)3 + 3H2S = Fe2S3 + 6H2O
Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
2Fe(OH)3 + 3H2CO3 = Fe2(CO3)3 + 6H2O
2Fe(OH)3 + 3H2SO3 = Fe2(SO3)3 + 6H2O
Fe(OH)3 + H3PO4 = FePO4 + 6H2O
в) Ca(OH)2
Ca(OH)2 + H2S = CaS↓ + 2H2O
Ca(OH)2 + N2O5 = Ca(NO3)2 + H2O
Ca(OH)2 + 2AgNO3 = Ca(NO3)2 + 2AgOH↓
Ca(OH)2 + FeSO4 = CaSO4↓ + Fe(OH)2↓
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4↓ + 2H2O
3Ca(OH)2 + 2K3PO4 = 6KOH + Ca3(PO4)2↓
3Ca(OH)2 + P2O5 = Ca3(PO4)2↓ + 3H2O
Ca(OH)2 + H2CO3 = CaCO3↓ + 2H2O
Ca(OH)2 + ZnSO4 = CaSO4↓ + Zn(OH)2↓
Ca(OH)2 + H2SO3 = CaSO3↓ + 2H2O
Ca(OH)2 + ZnCl2 = CaCl2 + Zn(OH)2↓
Ca(OH)2 + SO3 = CaSO4↓ + H2O
Ca(OH)2 + Hg(NO3)2 = Ca(NO3)2 + Hg(OH)2↓
Ca(OH)2 + HgCl2 = CaCl2 + Hg(OH)2↓
Ca(OH)2 + Na2SO4 = 2NaOH + CaSO4↓
Ca(OH)2 + CO2 = CaCO3↓ + H2O
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2↓ + 6H2O
Ca(OH)2 + SO2 = CaSiO3 + H2O
Ca(OH)2 + H2SiO3 = CaSiO3 + 2H2O
Ca(OH)2 + Pb(NO3)2 = Ca(NO3)2 + Pb(OH)2↓
Ca(OH)2 + K2CO3 = 2KOH + CaCO3↓2. Пользуясь таблицей растворимости, составьте уравнения реакций получения в лаборатории следующих нерастворимых оснований: Pb(OH)2, Al(OH)3, Mg(OH)2, Fe(OH)2.
Ответ
PbCl2 + 2NaOH = 2NaCl + Pb(OH)2↓
AlCl3 + 3NaOH = 3NaCl + Al(OH)3↓
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2↓
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓3. Составьте уравнения реакций, отражающие химические свойства гидроксида меди (II).
Ответ
Реагирует с кислотами:
Cu(OH)2 + H2SO4 ⟶ CuSO4 + 2H2O
Разлагается при нагревании:
Cu(OH)2 t⟶ CuO + H2O4. Объясните причины образования двух слов от одного корня: "амфотерность" и "амфибия".
Ответ
Слово "амфотерность" происходит от греческого amphoteros, что значит "и тот и другой", и отражает способность веществ в зависимости от условий проявлять либо основные, либо кислотные свойства.
Амфибия (происходит от греческого amfi – двоякий, bio – жизнь) – способность жить как на суше, так и в воде.
5. -
6. Сравните химические свойства оснований: KOH, Mg(OH)2, Al(OH)3.
Ответ
`KOH` `Mg(OH)_2` `Al(OH)_3` Взаимодействие
с кислотными оксидами`2KOH + CO_2 = K_2CO_3 + H_2O` `Mg(OH)_2 + CO_2 = MgCO_3 + H_2O` — Взаимодействие
с кислотами`KOH + HCl = KCl + H_2O` `Mg(OH)_2 + 2HCl = MgCl_2 + 2H_2O` `Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O` Взаимодействие
с солями`2KOH + CuSO_4 = K_2SO_4 + Cu(OH)_2"↓"` — — Взаимодействие
с щелочами— — `Al(OH)_3 + KOH = K[Al(OH)_4]` Термическое
разложение— `Mg(OH)_2 overset(t)(=) MgO + H_2O` `2Al(OH)_3 overset(t)(=) Al_2O_3 + 3H_2O` 7. Вычислите массу (г) гидроксида меди (II), образовавшуюся при реакции хлорида меди (II) с 160 г раствора гидроксида натрия с массовой долей NaOH 5%.
Ответ
Дано:
`ω(NaOH) = 5%`
`m("р-ра") = 160 г`
`m(Cu(OH)_2) = ?`
Решение
`2NaOH + CuSO_4 = Na_2SO_4 + Cu(OH)_2"↓"`
`m(NaOH) = (ω(NaOH)*m("р-ра"))/100 = (5*160)/100 = 8 г`
`n(NaOH) = (m(NaOH))/(M(NaOH)) = 8/40 = 0.2" моль"`
`n(Cu(OH)_2) = (n(NaOH))/2 = 0.2/2 = 0.1" моль"`
`m(Cu(OH)_2) = n(Cu(OH)_2)*M(Cu(OH)_2) = 0.1*98 = 9.8 г`
Ответ: `m(Cu(OH)_2) = 9.8 г`. §38
-
§38. Химические свойства солей. Генетическая связь неорганических соединений.
1. Составьте уравнения реакций, раскрывающие следующие превращения: Cu ⟶ CuO ⟶ Cu(NO3)2 ⟶ Cu(OH)2 ⟶ CuO ⟶ CuSO4.
Ответ
Cu + O2 t⟶ 2CuO
CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O
Cu(NO3)2 + 2NaOH ⟶ 2NaNO3 + Cu(OH)2↓
Cu(OH)2 t⟶ CuO + H2O
CuO + H2SO4 ⟶ CuSO4 + H2O2. С какими из перечисленных веществ вступит в реакции раствор гидроксида кальция (известковая вода): хлорид цинка, железо, оксид серы (IV), сульфат меди (II), нитрат свинца (II), оксид железа (II), бромоводородная кислота?
Ответ
Ca(OH)2 + ZnCl2 = CaCl2 + Zn(OH)2↓
Ca(OH)2 + SO2 = CaSO3↓ + H2O
Ca(OH)2 + CuSO4 = CaSO4↓ + Cu(OH)2↓
Ca(OH)2 + Pb(NO3)2 = Ca(NO3)2 + Pb(OH)2↓
Ca(OH)2 + 2HBr = CaBr2 + 2H2O3. Из веществ, формулы которых даны в варианте II малого химического тренажёра (см. табл. 20, с. 144), выберите те, что будут вступать в реакцию со следующими химическими соединениями: а) оксид кальция; б) гидроксид железа (II); в) баритовая вода; г) нитрат свинца (II).
Ответ
а) оксид кальция
CaO + H2SO4 = CaSO4 + H2O
3CaO + P2O5 = Ca3(PO4)2
CaO + H2CO3 = CaCO3 + H2O
б) гидроксид железа (II)
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Fe(OH)2 + H2CO3 = FeCO3 + 2H2O
в) баритовая вода
Ba(OH)2 + K2SiO3 = BaSiO3↓ + 2KOH
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
3Ba(OH)2 + 2K3PO4 = 6KOH + Ba3(PO4)2↓
3Ba(OH)2 + P2O5 = Ba3(PO4)2↓ + 3H2O
Ba(OH)2 + H2CO3 = BaCO3↓ + 2H2O
Ba(OH)2 + ZnSO4 = BaSO4↓ + Zn(OH)2↓
г) нитрат свинца (II)
Pb(NO3)2 + K2SiO3 = PbSiO3↓ + 2KNO3
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3
3Pb(NO3)2 + 2K3PO4 = Pb3(PO4)2↓ + 6HNO3
Pb(NO3)2 + ZnSO4 = PbSO4↓ + Zn(NO3)24. Пользуясь составленными схемами, напишите уравнения реакций, возможных между веществами, представленными на рисунке 71.
Ответ
3Ca + 2P = Ca3P2
2Ca + O2 = 2CaO
4P + 5O2 = P2O5
3CaO + P2O5 = Ca3(PO4)2
CaO + H2O = Ca(OH)2
P2O5 + 3H2O = 2H3PO4
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2↓ + 6H2O
3Ca(OH)2 + P2O5 = Ca3(PO4)2↓ + 3H2O
3CaCO3 + 2H3PO4 = Ca3(PO4)2 + 3H2O + CO2↑
3Ca + 2H3PO4 = Ca3(PO4)2 + 3H2↑
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O5. -
6. Составьте схемы генетической связи соединений, образованных атомами элементов № 5, 13, 14, 17, 33, 34 в периодической таблице.
Ответ
№5 B ⟶ B2O3 ⟶ H3BO3 ⟶ Na3BO3
№13 Al ⟶ Al2O3 ⟶ AlCl3 ⟶ Al(OH)3
№14 Si ⟶ SiO2 ⟶ Na2SiO3 ⟶ H2SiO3
№17 Cl2 ⟶ Cl2O7 ⟶ HClO4 ⟶ NaClO4
№33 As ⟶ Al2O3 ⟶ AlCl3 ⟶ Al(OH)37. Для проведения химической реакции с 0,2 моль карбоната натрия использовали раствор, массовая доля хлороводорода в котором 5%. Определите массу взятого раствора.
Ответ
Дано: Решение
`n(Na_2CO_3) = 0.2" моль"`
`ω(HCl) = 5%`
`m("р-ра") = ?`
Решение
`Na_2CO_3 + 2HCl = 2NaCl + H_2O + CO_2"↑"`
`n(HCl) = 2*n(Na_2CO_3) = 2*0.2 = 0.4" моль"`
`m(HCl) = n(HCl)*M(HCl) = 0.4*36.5 = 14.6 г`
`m("р-ра") = (100*m(HCl))/(ω(HCl)) = (100*14.6)/5 = 292 г`
Ответ: `m("р-ра") = 292 г`. §39
-
Глава 7. Строение атома.
§39. Состав и важнейшие характеристики атома. Изотопы. Химические элементы.
1. Дайте характеристику основных видов внутриатомных частиц.
Ответ
Характеристика частицы Название частицы
Протон Нейтрон Электрон
Символ `""_1^1p` `""_0^1n` `ē`
Масса (m, а.е.м.) 1 1 Ничтожно мала
Заряд +1 0 -1
Входят в состав ядра атома. Образуют электронную оболочку атома.2. Какие частицы обусловливают массу атома? Определите массовое число элемента №15 в периодической таблице.
Ответ
Массу атома обусловливают протоны и нейтроны.
Массовое число элемента №15 равно 31.3. Дайте определение изотопов, приведите примеры.
Ответ
Изотопы – разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную атомную массу.
Например, природный кислород состоит из трёх изотопов: `""_8^16O` (изотопное содержание 99,76%), `""_8^17O` (0,04%) и `""_8^18O` (0,20%).4. Почему заряд ядра атома является главной характеристикой элемента?
Ответ
Химические свойства химического элемента определяются зарядом ядра атома, который численно равен порядковому номеру элемента в Периодической системе Д. И. Менделеева. Следовательно, заряд ядра атома является главной характеристикой химического элемента.
5. Выразите графически соотношение изотопов аргона. В чём их сходство и различия?
Ответ
Изотопы аргона: `""_18^36Ar` (0,337%), `""_18^38Ar` (0,063%), `""_18^40Ar` (99,6%).
Изотопы аргона имеют одинаковый заряд ядра +18, но разные массовые числа.6. Поясните взаимосвязи между понятиями "химический элемент", "изотопы", "массовое число".
Ответ
Массовое число — это сумма числа протонов и нейтронов в ядре атома.
Изотопы – разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную атомную массу.
Химический элемент — совокупность природных изотопов. Относительная атомная масса химического элемента равна среднему значению масс всех его природных изотопов с учётом их распространённости в природе. §40
-
§40. Строение электронной оболочки атомов.
1. Почему правильно говорить о вероятности пребывания электрона в той или иной части атомного пространства?
Ответ
Быстро движущийся электрон может находиться в любой точке пространства, окружающего ядро атома, и на разном удалении от него, образуя электронную оболочку. Поэтому принято говорить о вероятности пребывания электрона в той или иной части внутриатомного пространства.
2. Изобразите схемы строения электронной оболочки атомов: а) магния; б) фосфора; в) хлора.
Ответ
Схемы строения электронной оболочки атомов магния
Схемы строения электронной оболочки атомов фосфора
Схемы строения электронной оболочки атомов хлора
3. Схема распределения электронов по электронным слоям 2, 8, 6 соответствует атому:
1) хлора; 2) кислорода; 3) серы; 4) азота.Ответ
Схема распределения электронов по электронным слоям 2, 8, 6 соответствует атому: 3) серы.
4. Соедините стрелками распределение электронов по электронным слоям и названия соответствующих элементов.
1) 2, 4; 2) 2, 8, 2; 3) 2, 1; 4) 2, 8, 7.
A. Литий; Б. Хлор; В. Углерод; Г. Магний.Ответ
1) В; 2) Г; 3) А; 4) Б.
§41
-
Глава 8. Периодический закон и Периодическая система Д. И. Менделеева.
§41. Периодические изменения свойств химических элементов. Современная трактовка Периодического закона.
1. Опишите важнейшие характеристики атомов элементов.
Ответ
К важнейшим характеристикам атомов элементов относятся: порядковый номер, заряд ядра атома, массовое число, число электронов на внешнем электронном слое.
2. Дайте обобщённую характеристику одного из элементов: № 8, 12 и 16 в периодической таблице в виде графической схемы.
Ответ
Элемент №8
Элемент кислород
Электронные оболочки атома кислорода
Простое вещество – газообразный неметалл кислород O2.
Сложные вещества
Водородные соединения: H2O вода (жидкость).
Кислород – элемент-неметалл.
Элемент №12
Элемент магний
Электронные оболочки атома магния
Простое вещество – металл магний O2.
Водородные соединения: MgH2 гидрид магния (твёрдое тело).
Высшие кислородные соединения: MgO оксид магния (основный оксид).
Магний – элемент-металл.
Элемент №16
Элемент сера
Электронные оболочки атома серы
Простое вещество – твёрдый неметалл сера S.
Водородные соединения: H2S сероводород (газ).
Высшие кислородные соединения: SO2 оксид серы (IV) и SO3 оксид серы (VI) (кислотные оксиды).
Сера – элемент-неметалл.3. В чём причина периодического изменения свойств элементов и их соединений? Ответ подтвердите примерами.
Ответ
Периодическое изменение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и электронных структур атомов.
Например, натрий и калий имеют по 1 электрону на внешнем энергетическом уровне.
Электронные оболочки атома натрия
Электронные оболочки атома калия
Оба металла образуют основные оксиды и основания с одинаковой формулой и свойствами: Na2O и K2O, NaOH и KOH.
Например, азот и фосфор имеют по 5 электронов на внешнем энергетическом уровне.
Электронные оболочки атома азота
Электронные оболочки атома фосфора
Оба образуют летучие водородные соединения со схожими свойствами и схожими химическими формулами: NH3, PH3.4. Дайте современную трактовку Периодического закона. Почему свойства элементов находятся в зависимости от заряда ядра атома элемента?
Ответ
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома (порядкового номера элемента).
Величина заряда ядра – главная характеристика элемента, мера его индивидуальности. От этой характеристики элемента зависят все остальные его свойства, она определяет число электронов и их состояние в атоме. Возрастание Z атомов от первого до последнего элемента приводит к периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне. В этом физический смысл Периодического закона и причина периодичности изменения свойств элементов.5. Установите зависимость между изменением внешнего электронного слоя атомов элементов и характером этих элементов. Подтвердите её примерами.
Ответ
С увеличением количества электронов на внешнем электронном слое, усиливаются неметаллические свойства и ослабевают металлические свойства. Например, у натрия на внешнем электронном слое 1 электрон, а у хлора – 7 электронов. Натрия – типичный металл, а хлор – типичный неметалл.
С увеличением количества электронов на внешнем электронном слое, усиливаются кислотные свойства соответствующих высших оксидов и высших гидроксидов. Например, гидроксид натрия – щелочь, гидроксид магния – слабое основание, гидроксид алюминия – амфотерное основание, а гидроксид серы (VI) – кислота.6. Почему заряд ядра атомов элемента считают главной характеристикой? Дайте развёрнутую аргументацию.
Ответ
Возрастание заряда ядра атомов от первого до последнего элемента приводит к периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне, в этом состоит причина периодичности изменения свойств элементов. Поэтому заряд ядра атома является главной характеристикой химического элемента.
7. В чём сущность закона Мозли и какое значение он имеет для объяснения явления периодичности?
Ответ
Сущность закона Мозли заключается в том, что частоты спектральных линий рентгеновского излучения находятся в линейной зависимости от заряда заряда атома.
Закон Мозли явился неопровержимым доказательством правильности размещения элементов в периодической системе элементов Д. И. Менделеева и содействовал выяснению физического смысла заряда заряда атома. §42
-
§42. Периодическая система в свете теории строения атома.
1. Что такое период? Какие периоды вы знаете?
Ответ
Периодом в таблице Д. И. Менделеева называют горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов. Они имеют одинаковое число электронных слоёв, но разное число валентных электронов. Периоды (кроме 1-го) начинаются щелочным металлом и заканчиваются инертным газом.
Периоды по количеству элементов в них делятся на малые и большие.2. Что такое группа? На основе каких признаков элементы объединяются в единую группу?
Ответ
Группой в таблице Д. И. Менделеева называют вертикальный ряд элементов, расположенных в порядке увеличения зарядов ядер их атомов. Атомы этих элементов содержат одинаковое число валентных электронов, но различаются числом электронных слоёв.
3. Дайте определение подгруппы элементов и укажите признаки, по которым элементы попадают в подгруппу.
Ответ
Подгруппа – вертикальный ряд элементов (внутри группы), расположенных в порядке увеличения зарядов ядер их атомов.
В одну подгруппу попадают элементы, атомы которых имеют сходные электронные структуры, а отсюда и сходство их основных химических свойств.4. В ряду Na ⟶ Mg ⟶ Al ⟶ Si металлические свойства:
1) усиливаются; 2) ослабевают; 3) не изменяются; 4) изменяются периодически.Ответ
В ряду Na ⟶ Mg ⟶ Al ⟶ Si металлические свойства: 2) ослабевают.
В периодах слева направо металлические свойства ослабевают.5. В ряду F ⟶ Cl ⟶ Br ⟶ I неметаллические свойства:
1) усиливаются; 2) ослабевают; 3) не изменяются; 4) изменяются периодически.Ответ
В ряду F ⟶ Cl ⟶ Br ⟶ I неметаллические свойства: 2) ослабевают.
В группах сверху вниз неметаллические свойства ослабевают.6. Наиболее ярко выражены металлические свойства у простого вещества, образованного атомами, которые имеют следующее электронное строение:
1) 2, 1; 2) 2, 8, 1; 3) 2, 8, 8, 1; 4) 2, 8, 2.Ответ
3) 2, 8, 8, 1.
7. Наиболее ярко выражены неметаллические свойства у простого вещества, образованного атомами, которые имеют следующее электронное строение:
1) 2, 8, 4; 2) 2, 8, 5; 3) 2, 8, 6; 4) 2, 8, 7.Ответ
4) 2, 8, 7.
8. Установите сходство и различие малых и больших периодов. Большие периоды делятся на два ряда: чётный и нечётный. В нечётном сосредоточены металлические элементы. Каковы особенности изменения их свойств? Укажите причины.
Ответ
Сходства малых и больших периодов
Слева направо растёт заряд ядра атома.
Начинаются со щелочных металлов и заканчиваются благородными газами (кроме 1-го периода).
Различия малых и больших периодов
Содержат разное количество элементов.
У элементов малых периодов электронами заполняется внешний энергетический уровень, а у элементов больших – внешний и предвнешний уровень.
Число электронов на внешнем слое у атомов элементов-металлов больших периодов остаётся неизменным. §43
-
§43. Характеристика химического элемента и его свойств на основе положения в Периодической системе Д. И. Менделеева и теории строения атома.
1. Что такое энергия ионизации, что она выражает и как изменяется?
Ответ
Энергия ионизации – это энергия, необходимая для отрыва от атома наиболее слабо связанного с ним электрона.
Энергия ионизации выражается в килоджоулях на моль (кДж/моль).
Наименьшей энергией ионизации обладают щелочные металлы (498 кДж/моль для Na), наибольшее значение её имеют металлы VIII группы (1519 кДж/моль для Ar). В главных подгруппах значение энергии ионизации уменьшается сверху вниз, в периодах – увеличивается слева направо. Чем больше радиус атома и меньше электронов на внешнем слое, тем слабее удерживается электрон и тем меньше энергия ионизации.2. Что такое сродство к электрону? Как оно изменяется у атомов элементов в подгруппах и периодах?
Ответ
Сродство к электрону – энергия, которая выделяется при присоединении одного электрона к атому.
В главных подгруппах значение сродства к электрону уменьшается сверху вниз, в периодах – увеличивается слева направо.3. Что такое электроотрицательность элементов? Как она выражается и какое имеет значение для изучения химии?
Ответ
Электроотрицательность – способность атомов данного элемента притягивать к себе электроны от атомов элемента партнёра.
Электроотрицательность измеряется полусуммой численных значений энергии ионизации и сродства к электрону атома данного элемента. Для удобства расчётов вместо абсолютных значений электроотрицательности обычно используют относительную электроотрицательность. Для этого электроотрицательность щелочного металла лития принимают за единицу и сравнивают с ней электроотрицательность других элементов.
Зная относительную электроотрицательность элементов, можно прогнозировать возможность их атомов соединяться друг с другом.4. В ряду элементов O ⟶ S ⟶ Se с увеличением порядкового номера химического элемента электроотрицательность:
1) увеличивается; 2) уменьшается; 3) не изменяется; 4) изменяется периодически.Ответ
В ряду элементов O ⟶ S ⟶ Se с увеличением порядкового номера химического элемента электроотрицательность: 2) уменьшается.
5. В ряду элементов C ⟶ N ⟶ O ⟶ F с увеличением порядкового номера химического элемента электроотрицательность:
1) увеличивается; 2) уменьшается; 3) не изменяется; 4) изменяется периодически.Ответ
В ряду элементов C ⟶ N ⟶ O ⟶ F с увеличением порядкового номера химического элемента электроотрицательность: 1) увеличивается.
6. Какими свойствами должен обладать элемент, у которого Z = 34? Дайте его описание.
Ответ
1) Селен (Se) располагается в 4 периоде в 5 ряду, в VI группе, главной подгруппе, имеет порядковый номер 34.
2) Заряд ядра атома = +34; относительная атомная масса = 79; число протонов = 34; число электронов = 34; число нейтронов = 45.
3) Электронные оболочки атома селена Se
Валентные электроны:
34Se 4s ↑↓ 4p ↑↓ ↑ ↑
4) Высший оксид: SeO3 – оксид селена (VI) – проявляет кислотные свойства.
Высший гидроксид: H2SeO4 – селеновая кислота – проявляет кислотные свойства.
Водородные соединения: H2Se.
5) Селен – элемент-неметалл.
6) Неметаллические свойства в периоде у Se выражены больше, чем у As, но меньше, чем у Br; в подгруппе меньше, чем у S, но больше, чем у Te.7. Элемент 6-го периода образует с кислородом оксид ЭО, который гидратируется водой с образованием щёлочи. Газообразных водородных соединений не имеет. Что это за элемент и в какой группе и подгруппе Периодической системы он находится?
Ответ
Этот элемент – барий (Ba), он располагается в во второй группе, в главной подгруппе.
Элемент 6-го периода образует с кислородом оксид ЭО: BaO или HgO.
Гидратируется водой с образованием щёлочи:
BaO + H2O ⟶ Ba(OH)2
HgO + H2O ⇸
Оксид бария гидратируется и образуется щёлочь – гидроксид бария.
Барий газообразных водородных соединений не имеет.8. Вычислите массу 20%-й соляной кислоты, которая потребуется для очистки железной пластины от ржавчины массой 21,4 г. (Следует учесть, что ржавчина состоит только из гидроксида железа(III)).
Ответ
Дано:
`ω(HCl) = 20%`
`m(Fe(OH)_3) = 21.4 г`
`m("р-ра "HCl) = ?`
Решение
`Fe(OH)_3 + 3HCl = FeCl_3 + 3H_2O`
`n(Fe(OH)_3) = (m(Fe(OH)_3))/(M(Fe(OH)_3)) = 21.4/107 = 0.2" моль"`
`n(HCl) = 3*n(Fe(OH)_3) = 3*0.2 = 0.6" моль"`
`m(HCl) = n(HCl)*M(HCl) = 0.6*36.5 = 21.9 г`
`m("р-ра "HCl) = (100*m(HCl))/(ω(HCl)) = (100*21.9)/20 = 109.5 г`
Ответ: `m("р-ра "HCl) = 109.5 г`.9. Для полной нейтрализации 150 г раствора с массовой долей хлороводорода 7,3% потребовалось 200 г раствора гидроксида натрия. Вычислите массовую долю (%) щёлочи в этом растворе.
Ответ
Дано:
`m_1("р-ра") = 150 г`
`ω_1(HCl) = 7.3%`
`m_2("р-ра") = 200 г`
`ω_2(NaOH) = ?`
Решение
`HCl + NaOH = NaCl + H_2O`
`m(HCl) = (ω_1(HCl)*m_1("р-ра"))/100 = (7.3*150)/100 = 10.95 г`
`n(HCl) = (m(HCl))/(M(HCl)) = 10.95/36.5 = 0.3" моль"`
`n(NaOH) = n(HCl) = 0.3" моль"`
`m(NaOH) = n(NaOH)*M(NaOH) = 0.3*40 = 12 г`
`ω_2(NaOH) = (100*m(NaOH))/(m_2("р-ра")) = (100*12)/200 = 6%`
Ответ: `ω_2(NaOH) = 6%`. §44
-
Глава 9. Строение вещества.
§44. Ковалентная связь атомов при образовании молекул простых веществ.
1. Какая химическая связь называется ковалентной? Почему она так названа?
Ответ
Химическая связь между атомами, осуществляемая общими электронными парами, называется ковалентной.
Приставка "ко-" означает "совместное участие". В данном случае – участие двух атомов в реализации своей валентности.2. Изобразите схему образования молекулы водорода и кислорода, объясните механизм образования химической связи.
Ответ
Атом водорода имеет один неспаренный электрон. При образовании молекулы H2 каждый из атомов водорода отдаёт на образование связи по одному своему электрону, т. е. образуется одинарная ковалентная связь. Схема образования молекулы водорода:
Схема образования молекулы водорода
Атом кислорода имеет два неспаренных электрона. При образовании молекулы O2 каждый из атомов кислорода отдаёт на образование связи по два электрона, т. е. образуются двойная ковалентная связь. Схема образования молекулы кислорода:
Схема образования молекулы кислорода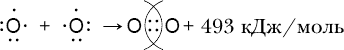
3. При каких условиях атомы одного элемента могут соединяться друг с другом, образуя молекулы простых веществ, и в чём особенность этой ковалентной связи?
Ответ
Атомы одного элемента могут соединяться друг с другом, если у них имеются неспаренные электроны.
Особенность этой ковалентной связи состоит в обобществлении неспаренных электронов.4. Сравните химические связи между атомами в молекулах фтора, кислорода и азота. В чём сходство и различия в образовании молекул этих веществ?
Ответ
Схема образования молекулы фтора
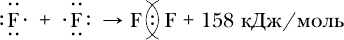
Схема образования молекулы кислорода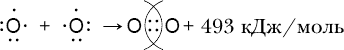
Схема образования молекулы азота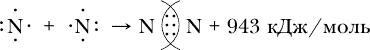
Сходство в образовании молекул этих веществ состоит в том, что связи в молекулах образуется за счет перекрывания электронных облаков неспаренных электронов, то есть все молекулы образованы с помощью ковалентной связи.
Различие состоит в том, что связи в молекулах образованы разными количествами общих электронных пар. В молекуле фтора F2 связь между атомами одинарная, в молекуле кислорода O2 – двойная, в молекуле азота N2 – тройная. §45
-
§45. Виды ковалентной связи и её свойства.
1. Дайте определение ковалентной связи и опишите её свойства.
Ответ
Ковалентная связь – химическая связь между атомами, осуществляемая общими электронными парами.
К свойствам ковалентной связи относятся: прочность (энергия), длина, направленность, полярность, насыщаемость.
Прочность определяется энергией связи. Прочность молекул увеличивается с увеличением кратности связи между её атомами.
Длина связи зависит от радиуса взаимодействующих атомов, от кратности связи между ними. Прочность молекул увеличивается с уменьшением длины между их атомами и повышением её энергии.
Направленность химических связей в молекуле определяет её пространственную форму. Молекулы разных веществ могут иметь линейное, угловое, пирамидальное и другое строение, плоскостную и неплоскостную формы.
Насыщаемостью связи называют способность атомов образовывать строго определённое число ковалентных связей.2. Как образуется ковалентная связь? Поясните на примере схем её образования между атомами в молекулах водорода и бромоводорода.
Ответ
Ковалентная связь образуется за счёт перекрытия (обобществления) пары валентных электронных облаков.
У каждого атома водорода имеется один неспаренный электрон. При взаимодействии этих электронов образуется общая электронная пара, связывающая атомы водорода, т. е. образуется одинарная ковалентная связь. Схема образования ковалентной связи между атомами в молекуле водорода:
Схема образования молекулы водорода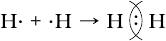
У атома водорода и у атома брома имеется по одному неспаренному электрону. При взаимодействии этих электронов образуется общая электронная пара, связывающая атомы водорода и брома, т. е. образуется одинарная ковалентная связь. Схема образования ковалентной связи между атомами в молекуле бромоводорода:
Схема образования молекулы бромоводорода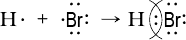
3. Дайте определение ковалентной полярной связи. Укажите и объясните направленность смещения электронных пар в молекулах: HBr, H2S, NH3, CH4.
Ответ
Ковалентная химическая связь между атомами разных элементов, при которой общая электронная пара (пары) смещена в сторону наиболее электроотрицательного элемента, называется ковалентной полярной.
В молекулах общие электронные пары смещаются в сторону более электроотрицательного элемента, значит электронные пары в HBr смещены к брому, в H2S – к сере, в NH3 – к азоту, в CH4 – к углероду.4. Какое из указанных веществ имеет ковалентную неполярную связь?
1) CaCl2; 2) N2; 3) HI; 4) CH4.Ответ
2) N2.
5. Какой вид химической связи в молекуле сероводорода?
1) ковалентная полярная; 2) ковалентная неполярная.Ответ
1) ковалентная полярная.
6. Одинаковый вид химической связи имеют фтороводород и
1) фтор; 2) фторид калия; 3) кислород; 4) вода.Ответ
4) вода.
§46
-
§46. Ионная связь и её свойства.
1. Какая химическая связь называется ионной и для каких элементов она характерна?
Ответ
Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью.
Вещества с ионной связью образуют типичные металлы и неметаллы, резко отличающиеся по своей электроотрицательности.2. На примере фторида лития объясните механизм его образования и запишите схему этого процесса.
Ответ
На внешнем электронном слое у атома литий находится один неспаренный s-электрон, у атома фтора из семи внешних электронов один p-электрон неспаренный. За счёт неспаренных электронов между атомами лития и фтора образуется химическая связь. Из-за большой разницы электроотрицательности способ её образования будет иной. Схема этого процесса:
Механизм образования ионной связи во фториде лития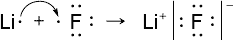
3. На основе строения атомов и места в Периодической системе элементов калия и хлора дайте аргументированный прогноз относительно возможности образования между ними химической связи и её типа.
Ответ
Калий находится в 4 периоде, а хлор в 3 периоде.
Калий находится в I группе в главной подгруппе, т. е. располагается в начале периода, и имеет на внешнем энергетическом уровне 1 неспаренный электрон.
Хлор находится в VII группе в главной подгруппе, т. е. располагается в конце периода, и имеет на внешнем энергетическом уровне 6 спаренных и 1 неспаренный электрон.
Так как и калий, и хлор имеют по одному неспаренному электрону, то можно предположить, что между ними может возникнуть химическая связь.
В соответствии с тем, что периодах электроотрицательность растёт слева на право, а в группах сверху вниз, то можно сделать предположение, что между атомами калия и хлора образуется ионная связь.4. В чём сходство и различия химической связи у соединений HF и NaF? Результаты сравнения изложите в форме таблицы.
Ответ
HF NaF Элементы образующие связь Химическая связь образована разными элементами Фтор (F) образует связь с другим элементном. Связь между элементами неметаллами. Связь между металлом и неметаллом. Кратность связи Одинарная связь H–F, Na–F Тип связи Ковалентная полярная Ионная 5. Какое значение имеют электронное строение атомов и их ОЭО для определения характера связи между взаимодействующими атомами? Ответ аргументируйте.
Ответ
Чем меньше энергетических уровней в атоме, и чем больше электронов на внешнем уровне, тем меньше радиус атома, и тем больше электроотрицательность, и наоборот. Характер связи между атомами определяется разницей в их электроотрицательности. Если она большая, то образуется ионная связь, если небольшая, то ковалентная полярная. А если электроотрицательность соединяющихся атомов одинаковая, то ковалентная неполярная.
6. Учитывая место элемента в Периодической системе и численное значение ОЭО, определите тип связи в следующих соединениях: молекулярный бром, бромид водорода, бромид калия (см. форзац учебника).
Ответ
Молекулярный бром (Br2) – ковалентная неполярная.
Бромид водорода (HBr) – ковалентная полярная.
Бромид калия (KBr) – ионная. §47
-
§47. Степень окисления.
1. Сформулируйте определение степени окисления. Для чего и кем введена в науку эта характеристика элемента?
Ответ
Степень окисления – это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений.2. Определите степень окисления элементов по формулам их соединений: K2CrO4, HVO3, H3PO4, Na2SO3.
Ответ
`overset(+1)(K)_2overset(+7)(Cr)overset(" "-2)(O)_4`, `overset(+1)(H)overset(+5)(V)overset(" "-2)(O)_3`, `overset(+1)(H)_3overset(+5)(P)overset(" "-2)(O)_4`, `overset(+1)(Na)_2overset(+4)(S)overset(" "-2)(O)_3`.
3. Значения высшей и низшей степени окисления серы соответственно равны:
1) +2 и –6; 2) +4 и –2; 3) +6 и –2; 4) +6 и –4.Ответ
Значения высшей и низшей степени окисления серы соответственно равны: 3) +6 и –2.
4. В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
1) NO2 и P2O5; 2) NO2 и Ca3P2; 3) Li3N и AlN; 4) NH3 и P2O3.Ответ
3) Li3N и AlP.
Вероятно, в задании ошибка, не AlN, а AlP.
1) `overset(+4)(N)O_2` и `overset(" "+5)(P)_2O_5`; 2) `overset(" "+4)(N)O_2` и `Ca_3overset(-3)(P)_2`; 3) `Li_3overset(-3)(N)` и `Aloverset(-3)(P)`; 4) `overset(-3)(N)H_3` и `overset(+3)(P)_2O_3`.
5. Каковы значения степени окисления и валентности элементов в веществах, формулы которых: H2O2, Na2O2, FeS2? Объясните их смысл.
Ответ
`underset(I)(overset(+1)(H)_2)underset(II)(overset(-2)(O_2))`, `underset(I)(overset(+1)(Na)_2)underset(II)(overset(-2)(O_2))`, `underset(II)(overset(+2)(Fe))underset(II)(overset(-1)(S_2))`
Валентность определяется числом образованных ковалентных связей. Степень окисления определяется числом смещенных электронов. §48
-
§48. Кристаллическое состояние веществ.
1. Что такое кристалл и кристаллическая решётка? Каковы её основные характеристики?
Ответ
Кристаллами называют твёрдые тела с закономерным расположением в них частиц – атомов, молекул, ионов.
Кристаллическая решётка – это модель кристалла, его внутренний каркас. Основными её характеристиками являются узлы и элементарные ячейки.2. Опишите элементарные ячейки кристаллов фторида кальция, оксида кремния (IV) и льда.
Ответ
Элементарная ячейка кристалла фторида кальция – куб.
Элементарная ячейка кристалла оксида кремния (IV) и льда – шестигранная призма.3. Назовите основные типы кристаллических решёток и дайте их краткую характеристику.
Ответ
Молекулярная кристаллическая решётка
Молекулярные кристаллические решётки — это решётки, в узлах которых расположены молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия.
Атомы в их молекулах связаны прочными ковалентными связями. Молекулы же в кристаллах стянуты слабыми межмолекулярными силами, которые легко разорвать. Поэтому кристаллы с молекулярной решёткой обладают малой твёрдостью, легкоплавки, летучи. Молекулярные вещества легко переходят из одного агрегатного состояния в другое.
Примером веществ с молекулярной кристаллической решёткой может служить кристаллический оксид углерода (IV) CO2 – "сухой лёд".
Атомная кристаллическая решётка
Атомные кристаллические решётки – решётки, в которых расположены атомы, стянутые в кристалле прочными ковалентными связями.
Атомы в такой решётке прочно связанны с помощью электронных пар, эти связи одинаковы, как и углы, образующиеся между атомами. Благодаря высокой прочности ковалентной связи атомные кристаллы имеют высокую прочность, они тугоплавки.
Примерами таких твёрдых веществ служат простые вещества – алмаз, кремний; сложные вещества – карбид кальция, сульфид цинка, диоксид кремния и др.
Ионная кристаллическая решётка
Ионные кристаллические решётки – это решётки, в узлах которых расположены ионы с противоположными зарядами.
Связь между ионами осуществляется за счёт электростатического притяжения. Энергия кристаллических решёток ионных соединений высокая. Ионные кристаллы отличаются высокой твёрдостью и температурой плавления, малой летучестью. По свойствам они сходны с атомными кристаллами.
Типичный представитель веществ с такой решёткой – поваренная соль.4. Какая кристаллическая решётка у веществ, образованных атомами металлов и галогенами?
1) атомная; 2) ионная; 3) молекулярная; 4) металлическая.Ответ
3) молекулярная.
5. У каких веществ при обычных условиях структурными единицами кристаллических решёток являются ионы?
1) у хлороводорода; 2) у поваренной соли; 3) у воды; 4) у водорода.Ответ
2) у поваренной соли.
6. Вычислите массу 2%-го раствора серной кислоты, необходимую для проведения химической реакции с цинком для получения 1,12 л водорода (н. у.).
Ответ
Дано:
`ω(H_2SO_4) = 2%`
`V(H_2) = 1.12 л`
`m("р-ра") = ?`
Решение
`H_2SO_4 + Zn = ZnSO_4 + H_2"↑"`
`n(H_2) = (V(H_2))/V_m = 1.12/22.4 = 0.05" моль"`
`n(H_2SO_4) = n(H_2) = 0.05" моль"`
`m(H_2SO_4) = n(H_2SO_4)*M(H_2SO_4) = 0.05*98 = 4.9 г`
`m("р-ра") = (100*m(H_2SO_4))/(ω(H_2SO_4)) = (100*4.9)/2 = 245 г`
Ответ: `m("р-ра") = 245 г`.7. На примере твёрдых оксидов углерода (IV) и кремния (IV) установите зависимость их некоторых свойств от кристаллической структуры.
Ответ
Оксид углерода (IV) имеет молекулярную кристаллическую решётку, поэтому он легкоплавок и летуч (при н. у. газ), сухой лёд обладает малой твёрдость, легко переходит из твёрдого состояния в газообразное.
Оксид кремния (IV) имеет атомную кристаллическую решётку, поэтому он тугоплавок и обладает высокой твёрдостью. §49
-
Глава 10. Химические реакции в свете электронной теории.
§49. Окислительно-восстановительные реакции.
1. Какова сущность процессов окисления и восстановления в свете электронных представлений?
Ответ
Окисление – процесс отдачи электронов атомом, молекулой или ионом.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом.2. Что показывает степень окисления? Как она изменяется при окислении и восстановлении элементов?
Ответ
Степень окисления показывает условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
При окислении степень окисления растёт, а при восстановлении – снижается.3. Определите, окисляется или восстанавливается сера при переходах:
а) H2S ⟶ SO2 ⟶ SO3;
б) SO2 ⟶ H2SO3 ⟶ K2SO3.
Обсудите с товарищем, какой вывод можно сделать на основе выполнения задания.Ответ
а) `H_2overset(-2)(S) ⟶ overset(+4)(S)O_2` – сера отдала 6 электронов, значит сера окисляется.
`overset(+4)(S)O_2 ⟶ overset(+6)(S)O_3` – сера отдала 2 электрона, значит сера окисляется.
б) `overset(+4)(S)O_2 ⟶ H_2overset(x)(+4)O_3` – степень окисления не изменяется.
`H_2overset(+4)(S)O_3 ⟶ K_2overset(+4)(S)O_3` – степень окисления не изменяется.4. Определите, какие из перечисленных реакций относятся к окислительно-восстановительным:
1) Mg + HCl ⟶ MgCl2 + H2;
2) MgO + НСl ⟶ MgCl2 + H2O;
3) CaO + CO2 ⟶ CaCO3;
4) FeCl3 + KI ⟶ I2 + FeCl2 + KCl.
Составьте схему реакции 4, указав окислитель и восстановитель, окислительный и восстановительный процессы.Ответ
К окислительно-восстановительным относятся реакции 1 и 4.
2FeCl3 + 2KI ⟶ I2 + 2FeCl2 + 2KCl
2I- - 2ē ⟶ I02 |2| 2 |1 восстановитель (окисление)
Fe+3 + 1ē ⟶ Fe+2 |1| |2 окислитель (восстановление)5. Выберите схемы превращений, в которых азот является окислителем.
1) N+5 ⟶ N+2;
2) N+3 ⟶ N+5;
3) N0 ⟶ N+2;
4) N0 ⟶ N-3;
5) N-3 ⟶ N0.Ответ
1) N+5 + 3ē ⟶ N+2;
4) N0 + 3ē ⟶ N-3. §50
-
§50. Составление уравнений окислительно-восстановительных реакций.
1. Сформулируйте правило сохранения числа электронов в ОВР и укажите его значение для составления уравнений этих реакций.
Ответ
Число электронов, оттянутых восстановителем, должно быть равно числу электронов, притянутых окислителем.
Данное правило помогает упростить расстановку коэффициентов в уравнениях реакций с помощью метода электронного баланса2. Расставьте коэффициенты в приведённом уравнении реакции методом электронного баланса, используя два приёма их составления:
NH3 + O2 ⟶ N2 + H2O.Ответ
4NH3 + 3O2 ⟶ 2N2 + 6H2O
2N-3 - 6ē ⟶ N20 |6| 12 |2
O20 + 4ē ⟶ 2O-2 |4| |3
Расставим коэффициенты в приведённом уравнении реакции методом электронного баланса, используя два приёма их составления:
3. Вычислите массу (г) сульфата бария, который может быть получен при добавлении к 50 г 20,8%-го раствора хлорида бария серной кислоты.
Ответ
Дано:
`m("р-ра") = 50 г`
`ω(BaCl_2) = 20.8%`
`m(BaSO_4) = ?`
Решение
`BaCl_2 + H_2SO_4 = BaSO_4"↓" + 2HCl`
`m(BaCl_2) = (ω(BaCl_2)*m("р-ра"))/100 = (20.8*50)/100 = 10.4 г`
`n(BaCl_2) = (m(BaCl_2))/(M(BaCl_2)) = 10.4/208 = 0.05" моль"`
`n(BaSO_4) = n(BaCl_2) = 0.05" моль"`
`m(BaSO_4) = n(BaSO_4)*M(BaSO_4) = 0.05*233 = 11.65 г`
Ответ: `m(BaSO_4) = 11.65 г`.4. Используя алгоритмическое предписание, расставьте коэффициенты в следующем уравнении:
H2S + Cl2 + H2O ⟶ H2SO4 + HCl.Ответ
H2S + 4Cl2 + 4H2O ⟶ H2SO4 + 8HCl
S-2 - 8ē ⟶ S+6 |8| 8 |1 восстановитель (окисление)
Cl20 + 2ē ⟶ 2Cl- |2| |4 окислитель (восстановление)5. Над стрелками укажите количество электронов, отданных или принятых атомами или ионами химических элементов.
1) Cl0 ⟶ Cl-;
2) Cl- ⟶ Cl0;
3) Cl+ ⟶ Cl-;
4) Cl+5 ⟶ Cl-.Ответ
1) Cl0 +1ē ⟶ Cl-
2) Cl- -1ē ⟶ Cl0
3) Cl+ +2ē ⟶ Cl-
4) Cl+5 +6ē ⟶ Cl-6. Вычислите количество вещества (моль) гидроксида железа (III), полученного в химической реакции хлорида железа (III) с 200 г раствора гидроксида натрия с массовой долей щёлочи 0,30.
Ответ
Дано:
`m("р-ра") = 200 г`
`ω(NaOH) = 0.3`
`n(Fe(OH)_3) = ?`
Решение
`FeCl_3 + 3NaOH = 3NaCl + Fe(OH)_3"↓"`
`m(NaOH) = ω(NaOH)*m("р-ра") = 0.3*200 = 60 г`
`n(NaOH) = (m(NaOH))/(M(NaOH)) = 60/40 = 1.5" моль"`
`n(FeCl_3) = (n(NaOH))/3 = 1.5/3 = 0.5" моль"`
Ответ: `n(FeCl_3) = 0.5" моль"`. §51
-
§51. Сущность и классификация химических реакций в свете электронной теории.
1. В чём сущность химических реакций с позиций электронных представлений? В каком направлении обычно протекают реакции?
Ответ
Химические реакции – это превращение одних веществ в другие. Превращения веществ связаны с перестройкой электронных структур атомов, ионов, молекул – частиц, из которых состоят участвующие в реакции вещества.
Реакции обычно протекают в сторону образования более прочных связей.2. Какие классификации химических реакций вам известны, какие признаки лежат в их основе? Приведите примеры реакций выделенных типов и их уравнения.
Ответ
По числу и составу реагентов и продуктов реакции
Реакции соединения. Примеры:
2H2 + O2 ⟶ 2H2O
CaO + CO2 ⟶ CaCO3
Реакции разложения. Примеры:
2H2O эл. ток⟶ 2H2↑ + O2↑
Cu(OH)2 t⟶ CuO + H2O
Реакции замещения. Примеры:
CuCl2 + Fe ⟶ Cu + FeCl2
Fe2O3 + 2Al ⟶ 2Fe + Al2O3
Реакции обмена. Примеры:
CuO + H2SO4 ⟶ CuSO4 + H2O
По тепловому эффекту
Эндотермические. Примеры:
Zn(OH)2 t ⟶ ZnO + H2O - Q
CaCO3 t ⟶ CaO + CO2↑ - Q
Экзотермические. Примеры:
C + O2 ⟶ CO2 + Q
CaO + H2O ⟶ Ca(OH)2 + Q
По изменению степени окисления
Окислительно-восстановительные. Примеры:
H2S + 4Cl2 + 4H2O ⟶ H2SO4 + 8HCl
4NH3 + 3O2 ⟶ 2N2 + 6H2O
Не окислительно-восстановительные. Примеры:
CaO + CO2 ⟶ CaCO3
CuO + H2SO4 ⟶ CuSO4 + H2O3. Определите типы реакций по их схемам и расставьте коэффициенты:
1) Mg + I2 ⟶ MgI2;
2) MgO + HBr ⟶ MgBr2 + H2O;
3) NH3 + O2 ⟶ N2 + H2O;
4) FeCl3 + NaOH ⟶ Fe(OH)3↓ + NaCl;
5) KI + CuCl2 ⟶ I2 + CuI + KCl.Ответ
1) Mg + I2 ⟶ MgI2
Реакция соединения, ОВР.
2) MgO + 2HBr ⟶ MgBr2 + H2O
Реакция обмена, не ОВР.
3) 4NH3 + 3O2 ⟶ 2N2 + 6H2O
Реакция замещения, ОВР.
4) FeCl3 + 3NaOH ⟶ Fe(OH)3↓ + 3NaCl
Реакция обмена, не ОВР.
5) 4KI + 2CuCl2 ⟶ I2 + 2CuI + 4KCl
Сложная ОВР.4. Какие из перечисленных выше реакций относятся к окислительно-восстановительным? Объясните сущность и названия этих реакций в свете электронной теории.
Ответ
К окислительно-восстановительным относятся реакции:
1) Mg + I2 ⟶ MgI2
3) 4NH3 + 3O2 ⟶ 2N2 + 6H2O
5) 4KI + 2CuCl2 ⟶ I2 + 2CuI + 4KCl5. К раствору хлорида натрия прилили раствор нитрата серебра. В результате их взаимодействия образовался осадок, масса которого составила 0,287 г. Вычислите количество вещества (моль) нитрата серебра, вступившего в реакцию.
Ответ
Дано:
`m(AgCl) = 0.287 г`
`n(AgNO_3) = ?`
Решение
`NaCl + AgNO_3 = NaNO_3 + AgCl"↓"`
`n(AgCl) = (m(AgCl))/(M(AgCl)) = 0.287/143.5 = 0.002" моль"`
`n(AgNO_3) = n(AgCl) = 0.002" моль"`
Ответ: `n(AgNO_3) = 0.002" моль"`.6. Определите количество вещества (моль) фосфорной кислоты, которое можно получить при нагревании 28,4 г оксида фосфора (V) с водой.
Ответ
Дано:
`m(P_2O_5) = 28.4 г`
`n(H_3PO_4) = ?`
Решение
`P_2O_5 + 3H_2O = 2H_3PO_4`
`n(P_2O_5) = (m(P_2O_5))/(M(P_2O_5)) = 28.4/142 = 0.2" моль"`
`n(H_3PO_4) = 2*n(P_2O_5) = 2*0.2 = 0.4" моль"`
Ответ: `n(H_3PO_4) = 0.4" моль"`.7. Составьте уравнения реакций между сероводородом, бромом и объясните функции веществ в этих реакциях с позиций электронной теории.
Ответ
H2S + Br2 ⟶ 2HBr + S
S-2 - 2ē ⟶ S0 |2| 2 |1 восстановитель (окисление) Br20 + 2ē ⟶ 2Br- |2| |1 окислитель (восстановление)


