 Химия один из практичных предметов и одна из наиболее востребованных отраслей в нашей жизни. Можно утверждать, что нас везде и всюду окружают химические процессы, которые мы видим или о которых догадываемся, но все они влияют и на качество нашей жизни ни на комфорт. Только из-за одного это уже можно понять насколько все таки важна химия как в школьной программе, так и в нашем мире. Однако несмотря на столь явное ее распространение, часто выходит так, что школьники не в курсе самых простых реакций, возможности их протекания и тем более особенностей. При этом в большинстве случаев нам кажется стоит винить не самих школьников, а построение процесса обучения, будь то школьные пособия, преподавание, особенности программы. Но что насчет уникальности системы образования, когда школьники годами изучаю предмет, при этом не знаю ничего, - мы помолчим... А вот насчет ответов вполне можем помочь. Ведь в этой статье речь пойдет об учебнике по химии для 8 класса авторов Рудзитис, Фельдман.
Химия один из практичных предметов и одна из наиболее востребованных отраслей в нашей жизни. Можно утверждать, что нас везде и всюду окружают химические процессы, которые мы видим или о которых догадываемся, но все они влияют и на качество нашей жизни ни на комфорт. Только из-за одного это уже можно понять насколько все таки важна химия как в школьной программе, так и в нашем мире. Однако несмотря на столь явное ее распространение, часто выходит так, что школьники не в курсе самых простых реакций, возможности их протекания и тем более особенностей. При этом в большинстве случаев нам кажется стоит винить не самих школьников, а построение процесса обучения, будь то школьные пособия, преподавание, особенности программы. Но что насчет уникальности системы образования, когда школьники годами изучаю предмет, при этом не знаю ничего, - мы помолчим... А вот насчет ответов вполне можем помочь. Ведь в этой статье речь пойдет об учебнике по химии для 8 класса авторов Рудзитис, Фельдман.
Обложка учебника преимущественно в синем цвете. Сверху вниз идет надпись химия, чуть правее цифра 8...
Что по содержимому, то как нам кажется здесь программа не затронула некоторых важным моментов, как то, строение элементов с описанием ядра и вращения электронов по их орбитам, то есть тех самых электронов, которые и участвуют в формировании связей, в реакциях...
Так вот, если об ответах, то это как раз то, о чем будет наш основной материал.
Ответы по домашним заданиям к учебнику химии за 8 класс, автор Рудзитис:
Выбирайте параграф, кликните и смотрите ответы к нему.
§1
-
§1. Предмет химии. Вещества и их свойства
1. Что изучает химия? Каковы её важнейшие задачи? Составьте схему, иллюстрирующую значение химии, и обсудите её с соседом но парте.
Химия - это наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Задачи химии :
• изучение веществ, их свойств и прогнозирование использования веществ в промышленности, сельском хозяйстве, медицине и быту.
• получение различных веществ, например, пластмасс, минеральных удобрений, лекарств и т.д. Эти вещества получают путем химических превращений.2. Чем различаются понятия «вещество» и «тело»? Приведите примеры.
Тело - предмет, который состоит из определенного вещества или нескольких веществ. Например, ложка - тело. Металл, из которого она состоит - вещество.
3. Из следующего перечня выпишите отдельно названия веществ и предметов (физических тел) : железо, термометр, медь, капрон, ртуть, напильник, нож, сахар.
Вещества: железо, медь, капрон, ртуть, сахар.
Предметы: термометр, напильник, нож.4. Какими сходными и отличительными свойствами обладают следующие вещества: а) поваренная соль и сахар; б) уксус и вода?
а) Поваренная соль и сахар имеют одинаковый внешний вид: белый цвет, кристаллики, хорошо растворимы в воде.
Но у них разный вкус, разное внутреннее строение и разные химические свойства
б) Уксус и вода имеют одинаковое агрегатное состояние и консистенцию: это прозрачные жидкости. Они могут быть хорошими растворителями.
Но у них разный запах, вкус, строение вещества и химические свойства.5. На основе жизненного опыта и используя дополнительную литературу, сравните физические свойства меди и серы. Ответ оформите в виде таблицы.
Свойство
Агрегатное состояние
Цвет
Запах
Плотность
Растворимость в воде
Теплопроводность
Электропроводность
Температура плавления
Температура кипенияМедь
СераСвойство Медь Сера
Агрегатное
состояние твердое твердое
Цвет золотисто-розовый желтый
Запах без запаха специфический запах
Плотность 8.96 г/см³ 2.07 г/см³
Растворимость
в воде нерастворима нерастворима
Тепло-
проводность хорошая плохая
Электро-
проводность проводник диэлектрик
Температура
плавления 1083°C 113°C
Температура
кипения 2567°C 445°C
Тест
1. В каком ряду находятся названия только веществ 1) медь, медная проволока, стекло, колба
2) железо, сахар, соль, уксус
3) вилка, ножницы, фарфоровая ваза, стакан
В ответе 1 проволока и колба - тела, в ответе 3 все предметы - тела.
Правильный ответ 2.2. В каком ряду находятся названия только тел?
1) крахмал, белок, соль, песок
2) подсолнечное масло, железо, очки, ложка
3) колба, стакан, фужер, стеклянная банка
В ответе 1 все указанное - вещества, в ответе 2 - масло и железо - вещества.
Правильный ответ 3. §2
-
§2. Методы познания в химии
1. Какие основные методы познания, используемые в химии, вам известны? Кратко опишите их.
Основные методы познания в химии — это наблюдение, описание, химический эксперимент и измерение.
Научное наблюдение всегда целенаправленное: сначала формулируется цель, а результате находится ответ на поставленный вопрос. Важны условия, при которых проводится наблюдение, точное описание увиденного. От грамотного описания зависит правильное объяснение и понимание увиденного. Это же относится и к эксперименту. Тщательное планирование, внимательное отношение к наблюдаемым явлениям и их организованное описание лежат в основе успешного эксперимента.
Химия – точная наука, поэтому в большинстве экспериментов не обойтись без измерений (измеряются масса, объём, температура кипения, температура плавления, плотность и т.д.).2. Опишите физические свойства : а) меди; б) воды; в) соли.
а) Медь: твердое вещество желто-оранжевого цвета, с металлическим блеском, хорошо проводит тепло и электрический ток.
б) Вода: прозрачная жидкость без цвета, запаха или вкуса, плохо проводит тепло, диэлектрик (не проводит ток).
в) Соль (поваренная): белое твердое кристаллическое вещество без запаха, хорошо растворимо в воде, плохо проводит тепло, не проводит электрический ток.
Тест
1. Установите соответствие между веществами и их свойствами.
1) порошок железа
A. хорошо проводит электричество
B. имеет тёмно-серый цвет
Д. имеет металлический блеск2) порошок серы
Б. имеет жёлтый цвет
Г. не смачивается водой
Е. не проводит электрический ток2. Чтобы избежать разбрызгивания смеси при разбавлении концентрированной серной кислоты водой, нужно
1) воду в кислоту добавлять по каплям
2) воду в кислоту добавлять струйкой
3) кислоту добавлять в воду небольшими порциями
4) одновременно вливать воду и кислоту в один сосуд
При контакте серной кислоты и воды выделяется много тепла, что приводит к разбрызгиванию. Поэтому кислоту небольшими порциями добавляют в воду.
Правильный ответ 33. Верны ли следующие суждения?
А. При работе со спиртовкой нельзя зажигать одну спиртовку от другой.
Б. Без указания учителя нельзя смешивать неизвестные вещества.
1) верно только А
2) верно только Б
З) оба суждения верны
4) оба суждения неверны
Если зажигать одну спиртовку от другой, то на пламя может вылиться спирт, а это пожароопасно. Утверждение А верно.
Смешивание неизвестных веществ может привести к возникновению опасной ситуации. Утверждение Б верно.
Правильный ответ 3. §3
-
§3. Практическая работа 1. Приемы безопасной работы с оборудованием и веществами. Строение пламени.
Зарисуйте в тетради строение пламени спиртовки. На рисунке обозначьте различные зоны пламени.
Зарисовываем рисунок 6 с.13 учебника.
§4
-
§4. Чистые вещества и смеси
1. При чтении текста о разделении смесей в тетради составьте схему «Основные способы разделения неоднородных и однородных смесей». Для каждого способа приведите примеры.
Неоднор. смесей :
- отстаивание (разделение песка и воды),
- фильтрование (нерастворимых и растворимых веществ),
- действие магнитом (порошки железа и серы),
- продувка (разделение зерна от шелухи)Однор. смесей :
- выпаривание, кристаллизация (разделение соли и воды),
- дистилляция (разделение воды и спирта),
- хроматография (разделение красителей).2. Даны смеси: а) спирта и воды; б) речного песка и сахара; в) медных и железных опилок; г) воды и бензина. Как разделить эти смеси? Поясните, на каких свойствах компонентов смеси основано их разделение.
а) спирт и вода
Разделяют дистилляцией. Разделение основано на разности температур кипения спирта и воды - у спирта она меньше (78 C), его отгоняют первым.
б) речной песок и сахар
Разделение основано на различии в растворимости в воде. Добавляют воду - сахар растворяется, песок - нет. Песок отфильтровывают, сахар получают упариванием.
в) медные и железные опилки
Разделение основано на различной растворимости в соляной кислоте. Добавляют к смеси кислоту : железо растворяется, медь оседает.
г) бензин и вода
Разделение основано на разной плотности. Отстаивают смесь, она расслаивается - бензин с меньшей плотностью (0,71 г/мл) занимает верхний слой, вода (1 г/мл) - нижний. Слои разделяют на делительной воронке.3. Можно ли фильтрованием выделить из раствора поваренную соль? Почему?
Поваренная соль полностью растворяется в воде, образуя однородный (гомогенный) раствор. Однородные смеси невозможно разделить фильтрованием, т.к. нет различия в размерах частиц компонентов. Разделить такую смесь можно, например, упариванием.
4. Предложите способ выделения глины из её смеси с водой.
Глина нерастворима в воде, ее можно отделить отстаиванием с последующим фильтрованием; выпариванием.
5. Как, не используя каких-либо приспособлений, можно отделить сливки от молока? Найдите в Интернете определение термина «центрифугирование».
Метод разделения смеси компонентов с различными плотностями (таких как молоко и сливки), не требующий специальных приспособлений – это отстаивание: с течением времени, молоко, обладающее большей средней плотностью, под действием силы притяжения оседает, а менее плотные сливки всплывают.
Центрифугирование основано на том же принципе – т.е. разделение веществ с различной плотностью под действием силы. Только здесь в качестве разделяющей силы выступает не сила притяжения, а центробежная сила.
Тест
1. Выберите схемы, изображающие состав чистых веществ.
Все молекулы чистого вещества имеют одинаковый состав и строение.
Правильный ответ 1, 3.2. Фильтрованием можно разделить смесь
1) воды и сахара
2) воды и поваренной соли
3) воды и угольной пыли
4) воды и столового уксуса
Уголь не растворяется в воде, поэтому его можно отфильтровать.
Правильный ответ 3.3. Смесь порошков железа и серы является
1) гомогенной
2) гетерогенной
Частицы железа и серы имеют различную структуру и размер, поэтому их смесь неоднородна (гетерогенна).
Правильный ответ 2.4. Очистить воду от примеси подсолнечного масла можно
1) выпариванием
2) фильтрованием
3) перегонкой
4) отстаиванием
Вода и масло имеют различные плотности, поэтому с течением времени их смесь расслаивается – разделение проводят методом отстаивания.
Правильный ответ 4.5. Установите соответствие между смесью и способом её разделения.
1) раствор поваренной соли в воде.
2) раствор мела в воде
3) смесь железа и серы
4) смесь воды и бензина
А. действие магнитом
Б. с помощью делительной воронки
В. выпаривание
Г. фильтрование
Соль из воды выделяют, выпаривая воду.
Мел не растворяется в воде – его отфильтровывают.
Железо притягивается магнитом, сера - нет : разделяют действием магнита.
Вода и бензин имеют различные плотности - при отстаивании они расслаиваются и могут быть разделены на делительной воронке.
Правильный ответ 1-В, 2-Г, 3-А, 4-Б. §5
-
§5. Практическая работа 2. Очистка загрязнённой поваренной соли
Как можно очистить от примесей поваренную соль?
Где используют фильтры?
Какие компьютерные программы вам известны?1. Растворение загрязнённой поваренной соли (смесь соли с песком). В стакан с загрязненной солью налейте примерно 20 мл полы.
Чтобы ускорить растворение, содержимое стакана перемешайте стеклянной палочкой (осторожно, не касаясь стенок стакана). Если соль не растворилась, добавляйте понемногу волу до тех пор, пока соль не растворится.
2. Очистка полученного раствора при помощи фильтрования. Для изготовления фильтра листок фильтровальной бумаги шириной в два раза больше диаметра воронки дважды сложите пополам, примерьте к воронке и отрежьте по луге так. чтобы крап бумаги был на 0,5 см ниже края воронки (рис. 13). Раскрытый фильтр поместите а воронку и смочите водой. расправьте его. чтобы он плотно примыкал к воронке. Воронку вставьте в кольцо штатива.
Конец сё должен касаться внутренней стенки стакана, в котором собирается отфильтрованный раствор. Мутный раствор налейте на фильтр по стеклянной палочке (см. рис 10). В стакан стечёт прозрачный фильтрат.
3. Выпаривание раствора. Полученный фильтрат вылейте в фарфоровую чашку и поставьте ее на кольцо штатива (см. рис. 11). Нагревайте чашку з пламени спиртовки, периодически перемешивая фильтр до полного испарения волы. На дне чашки остаются кристаллики соли. Полученную соль сравните с исходной.
4. Отчёт о работе оформите в виде таблицы.
Что делали (названия опытов, рисунки приборов с обозначениями)
Что наблюдали
Выводы
5. Осуществите домашний эксперимент — вырастите кристаллы поваренной соли или медного купороса, соблюдая правила техники безопасности. Консультацию о деталях постановки опыта получите у учителя.
6. Подготовьте презентацию своего домашнего эксперимента.
ПРЕЗЕНТАЦИЯ — это демонстрационные материалы для публичного выступления (сообщения, доклада, лекция и г д.).
Прежде чем делать презентацию, подготовьте текст своего сообщения и определите, какие иллюстрации (фотографии, рисунки, графики, таблицы) вам понадобятся для того, чтобы рассказать о ходе вашего эксперимента и заинтересовать слушателей.
Презентацию можно выполнить на компьютере или разместить на стенде. Компьютерная презентация — это файл, в который вы собираете материалы для выступления перед аудиторией. Файл презентации состоит из последовательности кадров, или слайдов. Слайды можно выводить на экран компьютера или специального проектора по ходу выступления или же напечатать на бумаге или прозрачной плёнке. Для создания компьютерных презентаций существуют специальные программы. Одна из них — PowerPoint из пакета Microsoft Office.
Если презентацию нашего выступления вы разметаете на стенде, то название работы и другие заголовки сделайте четкими и достаточно большими, чтобы их можно било прочитать с расстояния примерно I м. Вы можете приклеить вырезанные из бумаги буквы или написать все заголовки по графирсту. Под названием работы можно расположить короткое резюме примерно из 100 слов, объясняющее суть выступленияЧто делали
В стакан с загрязненной солью добавили 20 мл воды, перемешали.
Изготовили фильтр, пропустили через него смесь.
Фильтрат перелили в фарфоровую чашку до полного испарения воды
Что наблюдали
Соль растворилась в воде, песок - нет.
Песок остался на фильтре.
После упаривания на дне фарфоровой чашки остались кристаллики соли, которые выглядели белыми, без признаков загрязнения
Выводы
Смесь поваренной соли и песка является неоднородной (гетерогенной). Разделить компоненты можно, используя их различную растворимость в воде : нерастворимый песок можно отфильтровать, а однородную смесь соли и воды - упарить. §6
-
§6. Физические и химические явления. Химические реакции
1. Сравните физические и химические явления. Ответ проиллюстрируйте конкретными примерами.
Физические явления - явления, при которых обычно изменяется только агрегатное состояние веществ.
Примеры : плавление стекла, плавление и замерзание воды.
Химические явления - явления, при которых из данных веществ образуются другие вещества.
Примеры : сгорание топлива, ржавление железа.2. Заполните таблицу, используя ваш жизненный опыт. Результат обсудите с соседом по парте.
Примеры явлений
1. Физические явления
1) ...
2) ... и т. д.
2. Химические явления
1) ...
2) ... и т. д.Значение этих явлений в жизни и деятельности человека
Физические явления
1) испарение воды, конденсация паров, выпадение дождя - Круговорот воды в природе
2) изменение агрегатного состояния и формы под воздействием температуры и давления - Штамповка, прокат, формование в металлургии, химической промышленности, производстве полимеров
Химические явления
1) получение металлов из руд - Металлургия
2) получение полимеров - Производство пластмассовых изделий
3) сгорание топлива - Транспортная, военная и энергетическая промышленность
4) окисление белков, жиров, углеводов - Обмен веществ в организме3. Каковы условия возникновения и течения химических реакций? Пользуясь знаниями из курсов физики и географии и на основе своего жизненного опыта приведите 3—4 примера химических явлений и опишите признаки их протекания.
Признаки химических явлений :
• выделение теплоты (света) - например, горение спирта
• изменение окраски - например, возникновение бурого или зеленоватого оттенка на ржавеющих металлических изделиях
• появление запаха - например, возникновение запаха у испорченной пищи, что связано с окислением входящих в ее состав веществ
• образование осадка - например, выпадение хлопьев при кипячении жесткой воды
• выделение газа - например, при гашении питьевой соды уксусом выделяется углекислый газ
Условия протекания химических реакций :
• контакт реагирующих веществ (достигается измельчением, растворением, перемешиванием),
• достижение определенной температуры (достигается нагреванием).
Тест
1. К физическим явлениям не относится
1) замерзание воды 3) горение бензина
2) плавление алюминия 4) испарение воды
При испарении или замерзании воды и плавлении алюминия просто происходит смена агрегатного состояния веществ, поэтому ответы 1,2,4 неверны
Правильный ответ 3.2. К химическим явлениям не относится
1) ржавление железа 3) горение бензина
2) подгорание пищи 4) испарение воды
При испарении воды происходит смена агрегатного состояния вещества, без химических превращений.
Правильный ответ 3. §7
-
§7. Атомы, молекулы и ионы
1. Подготовьте компьютерную презентацию (см. §5) по теме «Роль М. В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения».
Несмотря на то, что идея о некоторых неделимых частицах, из которых состоит все вокруг, не являлась новой (например, понятие «атом» в этом контексте впервые ввел Демокрит 2500 лет назад), научное обоснование этой концепции возникло значительно позже.
Атомно-молекулярное учение было разработано в 18-19 вв. ключевую роль в этом сыграли М.В. Ломоносов и Дж. Дальтон.Великий русский ученый М.В.Ломоносов утверждал, что тела в природе состоят из «корпускул» (молекул), в состав которых входят «элементы» (атомы).
Многообразие веществ ученый объяснял соединением разных атомов в молекулах и различным расположением атомов в них.
Удивительно верной и смелой для того времени оказалась мысль Ломоносова о том, что некоторые «корпускулы» (молекулы) могут состоять из одинаковых «элементов» (атомов).
Основоположником атомно-молекулярного учения принято считать известного английского ученого Джона Дальтона.
Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона оказались более достоверными, научными.
Например, Дальтон отрицал возможность существования молекул, образованных одинаковыми атомами.Атомно-молекулярное учение в начале было принято довольно скептически, однако по мере развития химии как науки, накопления практического материала, постепенно становилась очевидна справедливость данной концепции.
Наконец, в 1860 году на Всемирном съезде химиков в Карлсруэ, атомно-молекулярное учение было окончательно признано научным сообществом.2. Какие опыты, известные вам из курсов физики и химии, подтверждают следующие положения : а) вещества состоят из молекул; б) молекулы образованы атомами?
а) подтверждением того, что вещества состоят из молекул, можно считать открытый Дальтоном закон кратных отношений; проницаемость, растворимость и сжимаемость веществ; фотографии, полученные с помощью электронного микроскопа.
б) экспериментальным доказательством того, что молекулы состоят из атомов, служит, например, устройство аппарата для разложения воды, в котором на одной трубке выделяется водород, а на другой - кислород, которые изначально входят в состав молекулы воды.3. Чем различаются понятия «атом» и «молекула»?
Молекулы - мельчайшие частицы многих веществ, их состав и химические свойства такие же, как у данного вещества. Молекулы при химических реакциях распадаются, т.е. они являются химически делимыми частицами. Молекулы состоят из атомов.
Атомы - мельчайшие химически неделимые частицы вещества.4. Объясните физические явления исходя из представлений об атомно-молекулярном строении вещества. Приведите примеры.
На основании атомно-молекулярного учения можно объяснить физические явления. Например, испарение.
При испарении происходит нагревание, при нагревании молекулы начинают колебаться и двигаться быстрей, при усиленном движении молекул расстояние между ними возрастает, а агрегатное состояние, при котором расстояние между частицами больше их размера, соответствует газообразному. Таким образом, происходит переход жидкости в газ.5. Объясните с позиций атомно-молекулярного учения : а) испарение воды; б) разложение воды под действием постоянного электрического тока.
а) испарение воды происходит при нагревании. Из-за высокой температуры молекулы воды, которые в жидком состоянии находятся близко друг к другу, начинают колебаться и двигаться быстрей, что увеличивает расстояние между ними (они как бы «расталкивают» друг друга). Когда расстояние становится достаточно большим, вода уже ведет себя не как жидкость, а как газ - ведь в газе молекулы расположены далеко друг от друга. Таким образом, происходит переход воды из жидкости в газ.
б) молекула воды образована одним атомом кислорода и двумя атомами водорода. При пропускании постоянного электрического тока через воду молекулы воды распадаются. Из двух молекул воды образуется одна двухатомная молекула кислорода и 2 двухатомных молекулы водорода6. Какие элементарные частицы входят в состав ядра атома?
В состав ядра атома входят два типа элементарных частиц : нейтроны и протоны. Также их называют нуклонами (от лат. nucleus — ядро). Они обладают одинаковой массой, но различно заряжены : нейтроны не имеют заряда, протоны – положительны.
7. В каком случае атом электронейтрален?
Атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Заряд ядра обусловлен протонами. Если число протонов (и, соответственно, заряд ядра) равен числу электронов, то атом целиком не имеет заряда : он электронейтрален.
8. Как образуются положительно и отрицательно заряженные ионы?
Если электронейтральный атом (т.е. частица, в которой число протонов в ядре равно числу электронов вокруг ядра) теряет электрон (или несколько электронов), то протонов становится больше, чем электронов. Следовательно, атом становится заряжен положительно – такую частицу называют положительно заряженным ионом или катионом.
Наоборот, если электронейтральный атом приобретает один или несколько электронов, то в этом случае уже электронов становится больше, чем протонов. Соответственно, атом становится отрицательным – такую частицу называют отрицательно заряженным ионом или анионом.
Тест
1. Верны ли следующие суждения о молекулах?
А. Молекулы являются химически делимыми частицами.
Б. Молекулы состоят из атомов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Молекулы состоят из атомов, поэтому их можно разделить на атомы. Утверждения А и Б верны.
Правильный ответ 3.2. Установите соответствие между названием элементарной частицы её зарядом.
1) протон — Б. + 1
2) нейтрон — В. 0
3) электрон — А. —1 §8
-
§8. Вещества молекулярного и немолекулярного строения
1. Приведите примеры веществ с молекулярным и немолекулярным строением. Как эти вещества различаются по свойствам?
Примеры веществ с молекулярным строением : кислород, водород, азот, вода, спирт, эфир, кристаллическая сера, белый фосфор.
Примеры веществ с немолекулярным строением : алмаз, графит, поваренная соль.
В кристаллической решетке связи между молекулами гораздо слабее, чем между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры кипения и плавления, часто летучи и имеют запах. Вещества с немолекулярным строением, наоборот, характеризуются высокими температурами кипения и плавления, обычно они твердые, нелетучие, без запаха.2. Обсудите с соседом по парте вопрос, можно ли по физическим свойствам вещества определить, какое строение оно имеет — молекулярное или немолекулярное.
Именно строение вещества и обуславливает его свойства, поэтому, зная физические свойства, можно предположить, молекулярное или немолекулярное строение имеет вещество. Газы, жидкости и легкоплавкие вещества, а так же вещества со специфичным запахом имеют молекулярное строение. Немолекулярные вещества твердые, нелетучие, тугоплавкие.
3. Какие типы кристаллических решёток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решётки. Составьте схему «Типы кристаллических решёток».
Атомная (алмаз), молекулярная (йод), ионная (поваренная соль).
4. Углекислый газ при нормальном давлении переходит в твёрдое состояние при температуре около -70 °С, а речной песок (кремнезём) плавится при температуре около 1700 °С. Какие выводы о строении этих веществ в твёрдом состоянии можно сделать?
Т.к. связи между частицами веществ с молекулярным строением обычно намного слабее, чем связи в немолекулярных веществах, что отражается в низких температурах плавления молекулярных веществ, то можно предположить, что углекислый газ имеет молекулярное строение, а кремнезем - немолекулярное.
Тест
1. Для углекислого газа характерна кристаллическая решётка
1) молекулярная
2) атомная
3) ионная
Углекислый газ - вещество с низкими температурами кипения и плавления, в обычных условиях газообразное. Это характеризует его как вещество с молекулярной структурой.
Правильный ответ 1.2. Установите соответствие между типом кристаллической решётки вещества и его свойствами.
1) молекулярная — Б. хрупкое, легкоплавкое, не проводит электрический ток
2) ионная — B. твёрдое, тугоплавкое, хорошо растворяется в воде
3) атомная — A. твёрдое, тугоплавкое, не растворяется в воде
Правильный ответ 1-Б, 2-В, 3-А §9
-
§9. Простые и сложные вещества
1. Как можно доказать, что кислород, железо и водород — простые вещества, а вода и сульфид железа — сложные вещества? Каковы условия возникновения и течения реакции образования сульфида железа?
Кислород, серу или железо нельзя получить из более простых веществ или разложить.
Наоборот, воду можно разложить с образованием кислорода и водорода или получить ее из них. Аналогично, сульфид железа можно получить, если смешать серу и железо при нагревании.2. Чем отличаются по составу и свойствам смеси от химических соединений? Приведите примеры.
В смесях вещества можно смешать в любых пропорциях (т.е. состав смесей переменный), при этом все компоненты смеси сохраняют свои индивидуальные свойства.
В веществах состав химического соединения постоянен, а само вещество не сохраняет свойства тех веществ, из которых оно получено.
Так, например, состав молекулы воды постоянный (массовое соотношение водорода к кислороду 1 : 8), а сама вода проявляет свои уникальные свойства, не имеющие ничего общего ни со свойствами кислорода, ни со свойствами водорода.3. При помощи каких способов из смесей можно выделить вещества, входящие в их состав? Приведите примеры.
Неоднор. смесей :
отстаивание (разделение песка и воды),
фильтрование (нерастворимых и растворимых веществ),
действие магнитом (порошки железа и серы),
продувка (разделение зерна от шелухи)Однор. смесей :
выпариване, кристаллизация (разделение соли и воды),
дистилляция (разделение воды и спирта),
хроматография (разделение красителей).Тест
1. На рисунках условно изображены простые и сложные вещества. Простое вещество изображено на рисунке.
Простое вещество состоит из атомов одного и того же элемента.
Правильный ответ 4.2. На рисунках условно изображены простые и сложные вещества. Сложное вещество изображено на рисунке.
Сложное вещество состоит из одинаковых молекул, состоящих из разных атомов.
Правильный ответ 2.3. На рисунках условно изображены химические соединения и смеси. Смеси показаны на рисунках.
Смесь состоит из молекул разных веществ.
Правильный ответ 3,4. §10
-
§10. Химические элементы
1. Что называют химическим элементом?
Химический элемент - это определенный вид атомов.
Атомы одного вида отличаются от атомов другого вида массой и свойствами. Например, атом кислорода в 16 раз тяжелее атома водорода и отличается от него по свойствам.2. Как вы думаете, можно ли говорить о физических свойствах химического элемента? А о физических свойствах простого вещества?
Неправильно говорить о физических свойствах химического элемента, т.к. химический элемент - это не физический реальный объект, а понятие, которое характеризует определенный вид атомов.
Наоборот, вещество - реальный объект, и для определенных веществ, характерны определенные свойства. Поэтому можно говорить о физических свойствах простого вещества.3. Составьте и напишите два предложения, в одном из которых речь шла бы о кислороде как о простом веществе, а в другом — как о химическом элементе.
Кислород в качестве простого вещества, газа : Кислорода в водолазном баллоне должно было хватить на 2 часа.
Кислород в качестве химического элемента : Кислород входит в состав любых оксидов.
Тест
1. О водороде как о простом веществе речь идёт в утверждении
1) водород входит в состав воды
2) водород легче воздуха
В первом утверждении говорится о водороде как о химическом элементе, а во втором - как о простом веществе.
Правильный ответ 2.2. Установите соответствие между понятием и его определением.
1) химический элемент Б. определённый вид атомов
2) простое вещество A. вещество, состоящее из атомов одного химического элемента
3) сложное вещество B. вещество, состоящее из атомов разных химических элементов
Правильный ответ 1-Б, 2-А, 3-В §11
-
§11. Относительная атомная масса химических элементов
1. Определите, во сколько раз масса атома серы больше массы атома водорода и массы атома кислорода.
Ar(S) = 32
Ar(H) = 1
Ar(O) = 16
32/1 = 32
32/16 = 2
Таким образом, масса атома серы в 32 раза больше массы атома водорода и в 2 раза больше массы атома кислорода.2. Дайте определение понятия «относительная атомная масса». Какой смысл имеет слово «относительная»?
Относительная атомная масса показывает не абсолютное, а относительное значение массы элемента, во сколько раз масс элемента больше 1/12 массы атома углерода. Т.е. во сколько раз элемент тяжелее по отношению к углероду (точнее, к 1/12 части углерода).
3. Используя периодическую таблицу Д. И. Менделеева, найдите значения относительных атомных масс элементов натрия, бария, серы, хлора, брома и аргона.
Ar(Na) = 23
Ar(Ba) = 137
Ar(S) = 32
Ar(Cl) = 35,5
Ar(Br) = 80
Ar(Ar) = 40
Тест
1. Установите соответствие между химическим элементом и его относительной атомной массой.
1) водород — В. 1
2) сера — А. 32
3) кислород — Б. 16
4) углерод — Г. 12
Д. 14 лишнее2. В состав молекулы какого-либо вещества может входить элемент кислород массой
а) 8 а. е. м.
б) 16 а. е. м.
в) 6 а. е. м.
г) 24 а. е. м.
Относительная масса атома кислорода всегда составляет 16 а.е.м.
Правильный ответ б. §12
-
§12. Знаки химических элементов
1.Что обозначает химический знак, или символ?
Сокращенные буквенные обозначения химических элементов - знаки (символы) химических элементов.
Химический символ (химический знак) обозначает один атом данного химического элемента.2. Запишите химические знаки следующих элементов : натрий, цинк, барий, серебро, сера, фтор, бром, фосфор.
Na, Zn, Ba, Ag, S, F, Br, P
3. Запишите русские названия элементов, обозначенных следующими символами : Na, Cl, Ва, Р, Сu, Zn, S, Аl.
Натрий, хлор, барий, фосфор, медь, цинк, сера, алюминий
4. Найдите в Интернете или словаре иностранных слов латинские названия серы, сурьмы и мышьяка. Запишите химические знаки этих элементов.
сера — сульфур S, сурьма — стибиум Sb, мышьяк — арсеникум As
Тест
1. Химический знак элемента кальция — это
1) К
2) Са √
3) Sc
4) Сr2. Установите соответствие между символом химического элемента и его названием.
1) Аl — Г. алюминий
2) Сu — А. медь
3) Сl — Д. хлор
4) Ag — Б. сереброВ. кальций лишний
3. Установите соответствие между символом химического элемента и его латинским названием.
1) Си — Б. купрум
2) Ag — Г. аргентум
3) Fe — А. феррум
4) Hg — В. гидраргирум §13
-
§13. Закон постоянства состава веществ
1. Кем и когда был открыт закон постоянства состава? Дайте определение и поясните сущность этого закона с точки зрения представлений об атомах и молекулах.
Закон постоянства состава веществ был открыт французским ученым Ж.Прустом в 1799-1806 гг.
Закон сформулирован так :
каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.
Закон постоянства состава не является всеобщим - он справедлив только для веществ, имеющих молекулярное строение. Состав веществ немолекулярного строения часто зависит от способа их получения.2. Известно вещество, в котором на 2 атома меди приходится 1 атом серы. В каких массовых отношениях нужно взять медь и серу, чтобы оба вещества полностью вступили в реакцию?
Cu2S
m(Cu) : m(S) = 2Ar(Cu) : Ar(S) = 2·64 : 32 = 4 : 13. Какое практическое значение имеет закон постоянства состава веществ?
На основании закона постоянства состава можно производить расчеты, связанные с массовыми соотношениями веществ, вступающих в химическую реакцию. Так, можно рассчитать, сколько нужно взять исходных веществ, чтобы получить из них определенное количество продукта реакции.
§14
-
§14. Химические формулы. Относительная молекулярная масса
1. Что показывает химическая формула? Приведите примеры.
Химическая формула - условная запись состава вещества посредством химических знаков и индексов. Она показывает, из атомов каких элементов состоит вещество (качественный состав), и каково соотношение атомов этих элементов (количественный состав вещества).
Например, химическая формула сероводорода H2S показывает, что вещество состоит из атомов водорода и серы (качественный состав), которые соотносятся между собой как 2 : 1 (количественный состав).2. Можно ли выразить массу сульфида железа следующими числами : а) 44 а. е. м.; б) 176 а. е. м.; в) 150 а. е. м.; г) 264 а. е. м.? Почему?
Относительную массу сульфида железа FeS можно узнать, сложив относительные массы атомов :
M(FeS) = Ar(Fe) + Ar(S) = 56 + 32 = 88 (а.е.м.)
Соответственно, масса сульфида, выраженная через а.е.м. будет кратна 88 (будет делиться на 88), но не меньше 88.
88 * 2 = 176
88 * 3 = 264
Правильные ответы Б и Г.3. Напишите химическую формулу вещества, если известно, что в его состав входят : а) атом железа и три атома хлора; б) два атома алюминия и три атома кислорода; в) атом кальция, атом углерода и три атома кислорода. Вычислите относительные формульные массы данных веществ.
а) атом железа и 3 атома хлора FeCl3
56 + 3·35,5 = 162,5
б) 2 атома алюминия и 3 атома кислорода Al2O3
27·2 + 16·3 = 102
в) атом кальция, атом углерода и 3 атома кислорода CaCO3
40 + 12 + 16·3 = 1004. Что означают записи : 4Н, 2H2, HgO, 5FeS, 3H2SO4?
4H — 4 атома водорода
2H2 — 2 молекулы водорода, каждая из которых состоит из 2 атомов водорода
HgO — химическая формула оксида ртути, состоящего из одного атома ртути и 1 атома кислорода
5FeS — химическая формула сульфида железа с коэффициентом 5, состоящего из 1 атома железа и 1 атома серы (это немолекулярное соединение, поэтому о пяти молекулах тут не может быть речи!).
3H2SO4 — 3 молекулы серной кислоты, каждая из которых состоит из 2 атомов водорода, 1 атома серы и 4 атомов кислорода5. Заполните таблицу.
Вещество
Качественный состав
Количественный составKMnO4
В состав перманганата калия входят химические элементы калий K, марганец Mn и кислород O.
Молекула перманганата калия образована одним атомом калия K, одним атомом марганца Mn и четырьмя атомами кислорода O.
m(K) : m(Mn) : 4m(O) = 39 : 55 : 64H2SO4
В состав серной кислоты входят химические элементы водород H, сера S и кислород O.
Молекула серной кислоты образована двумя атомами водорода H, одним атомом серы S и четырьмя атомами кислорода O.
2m(H) : m(S) : 4m(O) = 2 : 32 : 64 = 1 : 16 : 326. Сравните качественный и количественный состав : а) сернистого газа SO2 и серного ангидрида SO3; б) угарного газа СO и углекислого газа СO2.
а) Вещество
Качественный состав
Количественный состав
SO2
В состав сернистого газа входят химические элементы сера S и кислород O. Молекула сернистого газа образована одним атомом серы S и двумя атомами кислорода O.
m(S) : 2m(O) = 32 : 32 = 1 : 1
SO3 В состав серного ангидрида входят химические элементы сера S и кислород O. Молекула серного ангидрида образована одним атомом серы S и тремя атомами кислорода O.
m(S) : 3m(O) = 32 : 48 = 2 : 3б) Вещество
Качественный состав
Количественный состав
CO
В состав угарного газа входят химические элементы углерод C и кислород O. Молекула угарного газа образована одним атомом углерода C и одним атомом кислорода O.
m(C) : m(O) = 12 : 16 = 3 : 4
CO2 В состав углекислого газа входят химические элементы углерод C и кислород O. Молекула углекислого газа образована одним атомом углерода C и двумя атомами кислорода O.
m(C) : 2m(O) = 12 : 32 = 3 : 87. Состав вещества отражает формула K2S04. Определите : а) суммарное число атомов в молекуле; б) число химических элементов, входящих в состав вещества; в) число атомов каждого химического элемента в веществе.
Вещество
K2SO4
Суммарное число атомов в молекуле
2(K) + 1(S) + 4(O) = 7
Качественный состав
В состав сульфата калия входят химические элементы калий K, сера S и кислород O.
Количественный состав
Молекула сульфата калия образована двумя атомами калия K, одним атомом серы S и четырьмя атомами кислорода O.
2m(K) : m(S) : 4m(O) = 78 : 32 : 64 = 39 : 16 : 328. В каких массовых отношениях следует взять алюминий и серу, чтобы получить соединение, в котором на каждые два атома Аl приходится три атома S?
Соединение, в котором на каждые 2 атома алюминия приходится по 3 атома серы – сульфид алюминия Al2S3.
2m(Al) : 3m(S) = 54 : 96 = 9 : 16
Тест
1. Относительная молекулярная масса оксида железа Fe2O3 равна
1) 320
2) 160
3) 480
4) 62
M(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2·56 + 3·16 = 160
Правильный ответ 2.2. Тот факт, что молекула азота состоит из двух атомов азота, отражает запись
1) 2N
2) N2
3) N2O
4) N2O3
Символ атома азота N; на то, что их в молекуле 2 указывает индекс 2 : N2
Правильный ответ 2.3. Запись 2O2 обозначает
1) четыре атома кислорода
2) два атома кислорода
3) две молекулы кислорода
4) четыре молекулы кислорода
2O2 - 2 молекулы, каждая из которых состоит из 2 атомов кислорода.
Правильный ответ 3.4. Верны ли следующие суждения?
А. Для веществ немолекулярного строения подсчитывают не относительную молекулярную массу, а относительную формульную массу.
Б. Для веществ молекулярного строения подсчитывают относительную молекулярную массу
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверны
Для молекулярных веществ считают относительную молекулярную массу, для немолекулярных - относительную формульную массу. Оба утверждения верны.
Правильный ответ 3. §15
-
§15. Вычисления по химическим формулам. Массовая доля элемента в соединении
1. Вычислите относительную молекулярную массу сульфата меди CuSO4.
M(CuSO4) = Ar(Cu) + Ar(S) + 4Ar(O) = 64 + 32 + 4·16 = 160
2. Вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2СO3.
Угольная кислота :
H2CO3
2m(H) : m(C) : 3m(O) = 2 : 12 : 48 = 1 : 6 : 24
1 + 6 + 24 = 31
Т.е. в 31 массовых частях угольной кислоты содержится 1 массовая часть водорода, 6 массовых частей углерода и 24 массовых части кислорода.3. Вычислите массовые доли элементов в процентах по формулам соединений : a) CuSO4 — сульфат меди; б) Fe2O3 — оксид железа; в) HNO3 — азотная кислота.
Сульфат меди CuSO4 :
M(CuSO4) = Ar(Cu) + Ar(S) + 4Ar(O) = 64 + 32 + 4·16 = 160
ω(Cu) = Ar(Cu)/M(CuSO_4) •100% = 64/160•100% = 40%
ω(S) = Ar(S)/M(CuSO_4) •100% = 32/160•100% = 20%
ω(O) = 4Ar(O)/M(CuSO_4) •100% = 64/160•100% = 40%Оксид железа Fe2O3 :
M(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2·56 + 3·16 = 160
ω(Fe) = 2Ar(Fe)/M(Fe_2 O_3) •100% = 112/160•100% = 70%
ω(O) = 3Ar(O)/M(Fe_2 O_3) •100% = 48/160•100% = 30%Азотная кислота HNO3 :
M(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1 + 14 + 3·16 = 63
ω(H) = Ar(H)/M(HNO_3) •100% = 1/63•100% = 1,6%
ω(N) = Ar(N)/M(HNO_3) •100% = 14/63•100% = 22,2%
ω(O) = 3Ar(O)/M(HNO_3) •100% = 48/63•100% = 76,2%4. Во сколько раз массовая доля химического элемента серы в оксиде серы SO3 меньше, чем в оксиде серы SO2?
Дано :
Аr(S) = 32а.е.м
Аr(O) = 16а.е.м
ω (S)SO2/ω (S)SO3 - ?
M(SO2) = A(S) + 2 A(O) = 32 + 2·16 = 64(а.е.м)
ω (S)SO2 = A(S)/M(SO2)·100% = 32/64·100% = 50%
M(SO3) = A(S) + 3 A(O) = 32 + 3·16 = 80 (а.е.м)
ω (S)SO2 = A(S)/M(SO2)·100% = 32/80·100% = 40%
ω (S)SO2/ ω (S)SO3 = 50/40 = 1,25
Ответ: в 1,25 раза.5. Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Аr(Н) = 1а.е.м
Аr(S) = 32а.е.м
m(H) : m(S) = 1 : 16 = (1*2) : (16*2) = 2 : 32
32 - один атом серы, а 2 - два атома водорода, значит, химическая формула вещества H2S6 Применяя сведения об относительных атомных массах химических элементов, составьте химическую формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2 : 1 : 2.
Аr(Cu) = 64 а.е.м
Аr(S) = 32 а.е.м
Аr(O) = 16 а.е.мm(Cu) : m(S) : m(O) = 2 : 1 : 2 = 64 : 32 : (16*4)
Значит, меди и серы по одному атому, а кислорода 4.
CuSO47 Выведите простейшую формулу соединения, в котором массовая доля натрия равна 32,4%, серы — 22,5%, кислорода — 45,1%.
Ar(Na) = 23 а.е.м
Ar(S) = 32 а.е.м
Ar(O) = 16 а.е.мИз условия задачи следует, что в 100 единицах массы вещества 32,4 единицы натрия, 22,5 единиц серы, 45,1 единиц кислорода.
Найдем число атомов каждого элемента в 100 единицах вещества :
32,4 : 23 = 1,41 атома Na
22,5 : 32 = 0,70 атома S
45,1 : 16 = 2,82 атома O
Следовательно, можно определить соотношение чисел атомов в формуле вещества
NaхSуOz
x : y : z = 1,41 : 0,70 : 2,82
Чтобы получить соотношение целых чисел, разделим все числа атомов на наименьшее из них :
x : y : z = 1,41/0,70 : 0,70/0,70 : 2,82/0,70 = 2 : 1 : 4
Таким образом, NaхSуOz :
Na2SO4
Ответ. Na2SO4.8. Смешали 14 г порошкообразного железа с 14 г порошкообразной серы. Смесь нагрели. Найдите массу сульфида железа, если известно, что Fe и S в данном случае соединяются в массовых отношениях 7 : 4.
Известно, что смешали 14 г железа и 14 г серы. Но не всё количество вступило в реакцию. Железа 7 частей, а серы 4, значит железа потрачено по массе больше. Будем считать, что все 14 г железа вступили в реакцию.
значит 14 г - это 7 частей, а 14 : 7 = 2 г - 1 часть
А серы по массе 4 таких же части, значит 2*4 = 8 г
14 + 8 = 22 г
Ответ. 22 г.Другой вариант решения :
Вычислим относительную молекулярную массу сульфида железа :
Mr(FeS) = Ar(Fe) + Ar(S) = 56 + 32 = 88
Fe + S = FeS
ω (Fe)FeS = 56/88 = 0,64 или 64%
ω (S)FeS = 32/88 = 0,36 или 36%
Известно, что смешали 14 г железа и 14 г серы. Но не всё количество вступило в реакцию! Железа 7 частей, а серы 4, значит железа потрачено больше.
Всего вещества 14 + 14 = 28 г
Будем считать, что все 14 г железа вступили в реакцию, а они составляют 64% от всего вещества. Тогда 100% вещества :
14 г - 64%
х г - 100%
х = 14*100 : 64 = примерно 22 г.
Ответ. 22 г.Еще решение :
Дано :
m(S) = 14 г
m(Fe) = 14 г
m(Fe) : m(S) = 7 : 4
m(FeS) = ?Решение
Из массового соотношения видно, что для реакции соединения масса железа должна быть больше, чем серы, поэтому расчет проводим по ней (по массе железа), т. к. она полностью вступила в реакцию.
m(S) = 4*m(Fe)/7 = 4*14/7 = 8 г
m(FeS) = m(Fe) + m(S) = 14 + 8 = 22 г
Ответ: m(FeS) = 22 г.
Тест
1. Установите соответствие между химической формулой и массовым соотношением химических элементов, входящих в состав этой формулы.
1) MgO А. 3 : 2
2) H2SO4 Г. 1 : 16 : 32
3) Fe2O3 Б. 7 : 3
4) CuSO4 В. 2 : 1 : 2MgO
Ar(Mg) : Ar(O) = 24/16 = 3/2
1)-А.
H2SO4
2Ar(H) : Ar(S) : 4Ar(O) = 2/32/64 = 1/16/32
2)-Г.
Fe2O3
2Ar(Fe) : 3Ar(O) = 112/48 = 7/3
3)-Б.
CuSO4
Ar(Cu) : Ar(S) : 4Ar(O) = 65/32/64 = 2/1/2
4)-В.
Правильный ответ 1-А, 2-Г, 3-Б, 4-В.2. Массовая доля химического элемента углерода в молекуле этанола C2H60 составляет
1) 10%
2) 23,6%
3) 41,0%
4) 52,2%C2H6O
M(C2H6O) = 2Ar(C) + 6Ar(H) + Ar(O) = 2·12 + 6 + 16 = 46
ω(C) = (2Ar(C))/M(C_2 H_6 O) •100% = 24/46•100% = 52,2%
Правильный ответ 4. §16
-
§16. Валентность химических элементов. Определение валентности элементов по формулам их соединений
1. Что такое валентность химических элементов? Поясните, почему валентность водорода принята за единицу.
Валентность - свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность водорода принята за единицу, т.к. водород - самый легкий химический элемент. Он служит «точкой отсчета», относительно которой можно оценить валентности остальных элементов.2. При взаимодействии магния с водой один атом магния замещает два атома водорода в молекуле воды. Какова валентность магния?
Валентность водорода равна I, валентность кислорода равна II, таким образом, чтобы после вытеснения обоих атомов водорода из одной молекулы воды, кислород смог реализовать валентность, 1 атом магния также должен иметь валентность, равную II.
Mg + 2H2O = Mg(OH)2 + H2↑3. Выпишите элементы, имеющие постоянную валентность, равную I : Na, Сu, S, К, Н, Сl..
Постоянной валентностью, равной I, характеризуются металлы главной подгруппы I группы (щелочные металлы), по причине наличия одного электрона на внешнем энергетическом уровне. Из перечисленных элементов к ним относятся натрий Na и калий K. Кроме того, всего один электрон в своей электронной структуре имеет водород, благодаря чему, он также проявляет постоянную валентность I.4. Выпишите элементы, имеющие постоянную валентность, равную II : Са, Na, О, S, Ва, Fe.
Постоянной валентностью, равной II, характеризуются металлы главной подгруппы II группы (например, кальций Ca или Ba)), из-за двух электронов на внешнем энергетическом уровне; кислород также имеет постоянную валентность II (из-за наличия двух неспаренных электронов на внешнем энергетическом уровне).
5.Определите валентность металлов в следующих оксидах : СuО, Cu2O, Na2O, Аl2O3, FeO, Fe2O3.
Медь Cu расположена в побочной подгруппе первой группы и может проявлять как валентность II, так и I :
CuII OII
CuI2OII
Натрий – щелочной металл, расположен в главной подгруппе первой группы, из-за единственного электрона на внешнем энергетическом уровне проявляет постоянную валентность I :
Na2IOII
Алюминий – активный металл, расположен в главной подгруппе третьей группы, из-за наличия трех электронов на внешнем энергетическом уровне проявляет постоянную валентность III :
Al2IIIO3II
Железо расположено в побочной подгруппе, проявляет несколько валентностей в различных соединениях, например, II или III :
FeII OII, Fe2IIIO3II
Тест
1. Формула одного из оксидов фосфора P205. Валентность фосфора в этом соединении равна
1) 2
2) 3
3) 4
4) 5
Валентность кислорода всегда II.
P2xO5II
x = 5·II/2 = V
Правильный ответ 4.2. Установите соответствие между химической формулой соединения и валентностью серы в этом соединении.
1) S03
2) H2S
3) SO2
А. II
Б. IV
В. VISO3
Валентность кислорода всегда II.
SxO3II
x = 3·II/1 = VI
1)-В.
H2S
Валентность водорода всегда I.
H2ISx
x = 2·I/1 = II
2)-А.
SO2
Валентность кислорода всегда II.
SxO2II
x = 2·II/1 = IV
3)-Б.
Правильный ответ 1-В, 2-А, 3-Б. §17
-
§17. Составление химических формул по валентности
1. Определите валентность элементов по формулам : HgO, K2S, В2O3, ZnO, MnO2, NiO, Cu2O, SnO2, Ni2O3, SO3, As2O5, Cl2O7.
HgII OII, K2I SII, В2III O3II, ZnII OII, MnIV O2II, NiII OII, Cu2I OII, SnIV O2II, NiIII 2O3II, SVI O3II, As2V O5II, ClVII 2O7II
2. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы :
LiO, BaO, PO, SnO, КО, PH, MnO, FeO, HS, NO, CrClLi2O, BaO, P2O5, SnO2, K2О, PH3, Mn2O7, FeO, H2S, NO2, CrCl3
3. Пользуясь данными таблицы 3, составьте химические формулы соединений с кислородом (оксидов) следующих химических элементов : Zn, В, Be, Со, Pb, Ni. Назовите эти соединения.
ZnO оксид цинка, В2O3 оксид бора, BeO оксид бериллия, СоO оксид кобальта (II), Со2O3 оксид кобальта (III), PbO оксид свинца (II), PbO2 оксид свинца (IV), NiO оксид никеля (II), Ni2O3 оксид никеля (III).
4. Определите валентность азота в следующих соединениях : NO, N2O3, NO2, N2O5.
Азот находится в пятой группе главной подгруппы таблицы Менделеева, следовательно, номер группы показывает его максимальную валентность, которая равна V. В своих оксидах азот проявляет валентности от одного до пяти :
N2IOII, NIIOII, N2IIIO3II, NIVO4II, N2VO5II5. Составьте формулы оксидов (соединений с кислородом) : меди(I), железа(III), вольфрама(IV), железа(II), углерода(IV), серы(VI), олова(IV). марганца(VII).
Cu2O, Fe2O3, WO3, FeO, CO2, SO3, SnO2, Mn2O7
6 Составьте формулы соединений с хлором следующих элементов : K, Са, Аl, Ва.
Благодаря семи электронам на внешнем энергетическом уровне (3 электронным парам и одному неспаренному электрону), хлор образует с менее электроотрицательными элементами бинарные соединения хлориды, в которых проявляет валентность I.
Среди указанных элементов калий – щелочной металл, расположен в главной подгруппе первой группы, из-за единственного электрона на внешнем энергетическом уровне проявляет постоянную валентность I, следовательно, в хлоридах состоит с хлором в соотношении 1 : 1
KIClI
Аналогично с кальцием и барием, расположенными в главной подгруппе 2 группы, проявляющими валентность II. Поэтому на один двухвалентный металл приходится 2 атома I валентного хлора :
CaIICl2I, BaIICl2I
Алюминий – активный металл, расположен в главной подгруппе третьей группы, из-за наличия трех электронов на внешнем энергетическом уровне проявляет постоянную валентность III :
AlIIICl3I7 Составьте формулы водородных соединений следующих элементов : S(II), Р(III), F(I), C(IV).
Атом водорода имеет в своей электронной структуре всего один электрон, поэтому может проявлять лишь одну валентность : I. Соответственно, при образовании водородных соединений, число атомов водорода соответствует валентности элемента, с атомом которого происходит связывание :
H2ISII, PIIIH3I, HIFI, CIVH4I
Тест
1. В одном из оксидов марганец проявляет валентность, равную четырём. Его химическая формула
1) МnО
2) МnO2
3) Мn2O7
MnIIOII
MnIVO2II
Mn2VIIO7II
Правильный ответ 2.2. Установите соответствие между химической формулой вещества и его названием.
1) СrО
2) СrO3
3) Сr2O3
4) МnCl2
А. оксид хрома(VI)
Б. оксид хрома(II)
В. хлорид марганца(II)
Г. оксид хрома(III)CrIIOII
CrVIO3II
Cr2IIIO3II
MnIICl2I
Правильный ответ 1-Б, 2-А, 3-Г, 4-В. §18
-
§18. Атомно-молекулярное учение
1. Составьте конспект данного параграфа. Все тезисы атомно-молекулярного учения проиллюстрируйте конкретными примерами. Выполненную работу обсудите с соседом по парте.
1) Существуют вещества с молекулярным и немолекулярным строением. Пример : вода H2O имеет молекулярное строение, алмаз C, сульфид серы FeS - немолекулярное.
2) Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния и температуры. Пример : промежутки возрастают с ростом температуры в ряду «твердое вещество-жидкость-газ».
3) Молекулы находятся в непрерывном движении. Пример : с ростом температуры это движение ускоряется, происходит теплопередача.
4) Между молекулами существуют силы взаимного притяжения и отталкивания. Пример : эти силы наиболее выражены в твердых телах, наименее - в газах.
5) Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении. Пример : молекула воды H2O состоит из атомов водорода и кислорода.
6) Атомы одного вида отличаются от атомов другого вида массой и свойствами. Пример : атом кислорода в 16 раз тяжелее атома водорода и отличается от него по свойствам.
7) При физических явлениях молекулы сохраняются, при химических - разрушаются. Пример : при кипении воды увеличивается расстояние между молекулами - она переходит в пар. При химическом разложении воды происходит разрушение молекулы воды с образованием газов - водорода и кислорода.
8) Связи в узлах молекулярной решетки слабы, поэтому вещества с молекулярной структурой имеют низкие температуры кипения/плавления. Пример : вода имеет относительно низкие температуры кипения (100C) и плавления (0C).
9) Связи в ионных и атомных решетках прочные, поэтому вещества с немолекулярной структурой имеют высокие температуры кипения/плавления. Пример : алмаз имеет очень высокую температуру плавления (4000C).
Физические явления в большей степени связаны с механическим движением молекул, а химические сопровождаются перегруппировкой атомов.2. Какие явления подтверждают : а) движение молекул; б) наличие между молекулами определённых расстояний? Ответ подтвердите примерами.
А) теплопередача между веществами обусловлена тем, что с ростом температуры постоянные колебания молекул и атомов возрастают.
Б) смена агрегатного состояния, которая сопровождается изменением расстояния между молекулами (атомами) подтверждает существование промежутков между частицами.3. Вычислите относительные молекулярные массы : а) оксида железа(III); б) оксида фосфора(V); в) оксида марганца(VII).
а) Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2·56 + 3·16 = 160
б) Mr(P2O5) = 2Ar(P) + 5Ar(O) = 2·31 + 5·16 = 142
в) Mr(Mn2O7) = 2Ar(Mn) + 7Ar(O) = 2·55 + 7·16 = 222 §19
-
§19. Закон сохранения массы веществ
1. Сформулируйте закон сохранения массы веществ и объясните его с точки зрения атомно-молекулярного учения. Проиллюстрируйте его примерами.
Закон сохранения массы :
масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения закон объясняется так : в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Пример : Fe + S = FeS
m(Fe) + m(S) = m(FeS)2. В реторту насыпали порошок цинка, закрыли газоотводную трубку зажимом, реторту взвесили и содержимое прокалили. Когда реторта остыла, её вновь взвесили. Изменилась ли её масса и почему? Затем открыли зажим. Остались ли чашки весов в равновесии и почему?
Когда зажим закрыт, содержимое реторты полностью изолировано от окружающей среды, поэтому масса реторты не изменится согласно закону сохранения массы.
Если зажим открыть, то станет возможет контакт содержимого реторты с окружающей средой, взаимный переход газов, взаимодействие с компонентами воздуха и т.д., поэтому масса реторты может измениться.3. Почему при горении спиртовки масса спирта постоянно уменьшается? Не нарушается ли при этом закон сохранения массы веществ?
Спирт сгорает с образованием углекислого газа, и в этой реакции закон сохранения массы сохраняется :
C2H5OH + 3O2 = 2CO2 + 3H2O
Т.к. углекислый газ уносится из области реакции в окружающую среду, то масса спирта в спиртовке уменьшается.4. Какое теоретическое и практическое значение имеет закон сохранения массы веществ? Приведите примеры.
Открытие закона сохранения массы способствовало дальнейшему развитию науки. Например, без него никогда не был бы открыт периодический закон.
Также закон сохранения массы позволяет производить расчеты массы исходных веществ, если нужно получить определенную массу продукта реакции. Например, зная массовое соотношение железа к сере в сульфиде железа, можно рассчитать массы исходных реагентов.
На основании закона сохранения массы становится возможным составлять уравнения химических реакций. Например, Fe + S = FeS
Тест
1. Медь соединяется с серой в массовом отношении 2 : 1. Для приготовления 21 г сульфида меди(Н) потребуется
1) Cu - 14 г, S - 7 г
2) Cu - 12 г, S - 9 г
3) Cu - 7 г, S - 14 г
4) Cu - 16 г, S - 5 г
2 : 1 = 2x : x
2x + x = 21
3x = 21
x = 7
2x = 14
Правильный ответ 1.2. При разложении 4,34 г окCuда ртути(Н) образовалось 4,02 г ртути. Масса выделившегося при этом кислорода равна
1) 0,16 г
2) 0,32 г
3) 3,2 г
4) 1,6 г
HgO
m(HgO) = m(Hg) + m(O)
m(O) = m(HgO)-m(Hg)
m(O) = 4,34-4,02 = 0,32
Правильный ответ 2. §20
-
§20. Химические уравнения
1. Что называют уравнением химической реакции? Что показывает химическое уравнение?
Уравнением химической реакции называют условную запись химической реакции посредством знаков и формул. на показывает, какие вещества вступили в реакцию и какие образовались.
2. Какой последовательности действий следует придерживаться при оставлении уравнений химической реакции?
При составлении химического уравнения, начинают с написания схемы химической реакции. Т.е. слева пишут формулы исходных веществ, которые вступили в реакцию, справа – формулы продуктов реакции, т.е. тех веществ, которые образовались в итоге; а между ними ставят стрелочку – от исходных веществ к продуктам.
Схема химической реакции наглядно демонстрирует, какие вещества прореагировали между собой, и какие получились в результате. После составления схемы необходимо расставить коэффициенты, основываясь на законе сохранения масс : сколько атомов вступило в химическую реакцию – столько же и образовалось после ее протекания. Т.е число атомов каждого химического элемента слева и справа должно быть одинаково.
Уравнивание числа атомов производят расчетом наименьшего общего кратного до и после реакции, начиная с того химического элемента, атомов которого больше всего в данной реакции. После уравнивания снова пересчитывают число атомов до и после реакции, и если закон сохранения массы выполняется, то стрелочку «→» меняют на знак равенства « = » : получено химическое уравнение.3. Расставьте коэффициенты в следующих схемах реакций :
Fe + Cl2 — → FeCl3
Аl + S — → Al2S3
W03 + H2 - → W + H2O
Li + O2 — → Li2O2Fe + 3Cl2 = 2FeCl3
2Аl + 3S = Al2S3
WO3 + 3H2 = W + 3H2O
4Li + O2 — → 2Li2O4. Запишите правую часть уравнения химической реакции и расставьте коэффициенты :
2Си + O2 = 2CuO
5. Составьте формулу продукта реакции по известным валентностям элементов и расставьте коэффициенты в схеме реакции :
Fe + Cl2 — → FeCl
Fe + Cl2 → FeIIIClI
FeIIIClI : трехвалентное железо образует три связи – по одной связи на каждый одновалентный хлор, следовательно, на один атом железа приходится три атома хлора :
FeIIICl3I
Уравнивают по хлору :
Cl2 → FeCl3
3Cl2 → 2 FeCl3
Теперь по железу :
2 Fe → 2 FeCl3
Итого : 2Fe + 3Cl2 = 2FeCl36 В живых организмах при окислении (взаимодействием с кислородом O2) глюкозы С6Н12O6 выделяется необходимая для жизнедеятельности энергия. Напишите уравнение этой реакции, если известно, что в итоге образуются углекислый газ СO2 и вода H2O.
С6Н12O6 + 6O2 = СO2 + H2O
Тест
1. В схеме реакции между оксидом железа(III) и соляной кислотой :
Fe2O3 + HCl — → FeCl3 + H20O перед формулой образующейся соли нужно поставить коэффициент
1) 1
2) 2
3) 3
4) 6
Правильный ответ 4) 62. Сумма коэффициентов в уравнении реакции между оксидом фосфора(V) и водой равна
1) 5
2) 6
3) 4
4) 3
Правильный ответ 2) 6 §21
-
§21. Типы химических реакций
1. Напишите по два уравнения каждого из известных вам типов химических реакций и объясните их с точки зрения атомно-молекулярного учения.
Реакция соединения :
Zn + Cl2 = ZnCl2
2H2 + O2 = 2H2O
из двух или нескольких простых или сложных веществ образуется одно более сложное вещество.
Реакция разложения :
H2O2 = H2O + H2
CaCO3 = CaO + CO2
из одного сложного вещества образуются два или несколько простых или сложных веществ.
Реакция замещения
Zn + 2HCl = ZnCl2 + H2
Fe2O3 + Al = Al2O3 + Fe
протекает между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов сложном веществе.
Реакция обмена
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
NaOH + HCl = NaCl + H2O
протекает между двумя сложными веществами, в ходе которых они обмениваются составными частями.2. Сравните реакции соединения и разложения (разложения и замещения, замещения и соединения) : а) по числу взятых и полученных веществ; б) по тому, являются ли исходные и полученные вещества простыми или сложными.
а) по числу взятых и полученных веществ
Число исходных веществ всегда больше, чем продуктов реакции (продукт реакции один)
Пример :
2Zn + O2 = 2ZnO
Число исходных веществ всегда меньше, чем продуктов реакции : одно сложное вещество разлагается на несколько простых
Пример :
CaCO3 = CaO + CO2↑
Число исходных веществ равно числу продуктов реакции, т.к. атомы одного (простого) вещества, замещают собой атомы элемента во втором (сложном) веществе, и этот элемент, в свою очередь, выделяется в виде продукта реакции (простого вещества)
Пример :
Zn + H2SO4 = ZnSO4 + H2↑
б) по тому, являются ли исходные и полученные вещества простыми или сложными Исходные вещества могут быть как простыми, так и сложными – главное, чтобы они реагировали друг с другом с образованием одного продукта, который всегда является сложным веществом
Примеры :
2Cu + O2 = 2CuO
простое простое сложное
вещество вещество веществоNa2O + H2O → 2NaOH
сложное вещество сложное вещество сложное вещество4NO2 + 2H2O + O2 → 4HNO3
сложное вещество сложное вещество простое вещество сложное вещество
Исходное вещество – всегда сложное вещество, которое в процессе реакции распадается на несколько продуктов, которые могут быть и простыми, и сложными
Примеры :
Cu(OH)2 → CuO + H2O
сложное вещество сложное вещество сложное вещество2H2O2 → 2H2O + O2↑
сложное вещество сложное вещество простое вещество2HgO → 2Hg + O2↑
сложное вещество простое вещество простое вещество
Исходные веществ : одно – простое, другое –сложное; продукты реакции : одно – простое, другое –сложное
Пример :
Fe + 2HCl → FeCl2 + H2↑
простое вещество сложное вещество сложное вещество простое вещество3. Перепишите приведённые ниже схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ, расставьте коэффициенты и поясните, к какому типу относится каждая из указанных реакций :
Zn + ? → ZnO
Mg + HCl → MgCl2 + ?
Au2O3 → Au + ?
Al + CuCl2 → Cu + ?2Zn + O2 → 2ZnO р-я соединения
Mg + 2HCl → MgCl2 + H2↑ р-я замещения
2Au2O3 → 4Au + 3O2↑ р-я разложения
2Al + 3CuCl2 → 3Cu + 3Cu + 2AlCl3 р-я замещения §22
-
§22. Кислород, его общая характеристика, нахождение в природе и получение
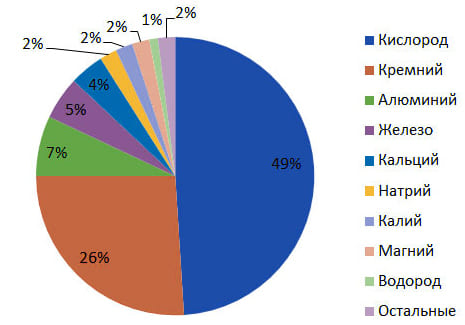
1. Предложите свой вариант диаграммы «Распространение химических элементов в природе (по массе)». Выполните его на компьютере.
2. Как получают кислород в лаборатории и в промышленности? Напишите уравнения соответствующих реакций. Обсудите с соседом по парте, чем различаются эти способы.
Получение кислорода в лаборатории
В школьной лаборатории чаще всего кислород получают из перманганата калия :
KMnO4 t⟶ K2MnO4 + MnO2 + O2↑Разложение пероксида водорода в присутствии оксида марганца (IV) :
2H2O2 _MnO₂⟶ 2H2O + O2↑Разложение бертолетовой соли при нагревании в присутствии оксида марганца (IV) :
2KClO3 MnO₂, t⟶ 2KCl + 3O2↑Получение кислорода в промышленности
В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных газов : основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196°С) ниже температуры кипения жидкого кислорода (-183°С), то азот испаряется, а жидкий кислород остается. Газообразный кислород хранят в стальных баллонах под давлением 15 МПа.
Отличие способов получения кислорода в лаборатории и в промышленности заключается в том, что в лаборатории его получают благодаря химическим процессам, а в промышленности благодаря физическим процессам.
В промышленности : реакции не происходит; 2 основных компонента воздуха (азот и кислород) разделяют, используя разности их температур кипения (воздух сжижают и последовательно выпаривают азот, затем кислород). Процесс чисто физический, позволяет получить кислород высокой чистоты; но затратный - требует высокой температуры и давления, а также дорогостоящего оборудования.
3. Какие вещества называют катализаторами? Какой катализатор используют в известных вам реакциях получения кислорода?
Катализаторы - вещества, которые ускоряют химические реакции, но сами при этом не расходуются и не входят в состав продуктов реакции.
В реакциях получения кислорода из перекиси водорода и хлората калия, используют оксид марганца (IV) в качестве катализатора.4. Допишите уравнение реакции разложения оксида ртути(Н) и расставьте необходимые коэффициенты :
HgO = ... + ...HgO → Hg + O2↑
Начинают уравнивать с кислорода :
O → O2
2O = O2
Теперь по ртути :
2HgO → Hg
2HgO → 2Hg
2HgO = 2Hg + O2↑5. Допишите уравнение реакции разложения пероксида водорода расставьте необходимые коэффициенты :
H2O2 = ... + ...
H2O2 → H2O + O2↑
Начинают уравнивать с кислорода :
H2O2 → O2- + O2
2H2O2 = 2O2- + O2
И по водороду сходится :
2H2O2 = 2H2O
2H2O2 = 2H2O + O2↑6 Вычислите массовые доли элементов (в процентах) : а) в оксиде серы(IV); б) в бертолетовой соли КСlO3.
а) В оксиде серы (IV)
Дано :
SO2
ω(S) = ?
ω(O) = ?Решение
Mr(SO2) = Ar(S) + 2*Ar(O) = 32 + 2*16 = 64 а.е.м
ω(S) = Ar(S)/Mr(SO2) = 32/64 * 100 = 50%
ω(O) = 100 - ω(S) = 100 - 50 = 50%
Ответ: ω(S) = 50%, ω(O) = 50%б) В бертолетовой соли KClO3
Дано :
KClO3
ω(K) = ?
ω(Cl) = ?
ω(O) = ?Решение
Mr(KClO3) = Ar(K) + Ar(Cl) + 3*Ar(O) = 39 + 35.5 + 3*16 = 122.5 а.е.м
ω(K) = Ar(K)/Mr(KClO3) * 100 = 39/122.5 * 100 = 31.8%
ω(Cl) = Ar(Cl)/Mr(KClO3) * 100 = 35.5/122.5 * 100 = 29%
ω(O) = 3*Ar(O)/Mr(KClO3) * 100 = 3*16/122.5 * 100 = 39.2%
Ответ: ω(K) = 31.8%, ω(Cl) = 29%, ω(O) = 39.2%7. На основании закона сохранения массы веществ рассчитайте массу кислорода, вступившего в реакцию с 3,2 г меди, если в результате реакции образовалось 4 г оксида меди(Н).
Дано :
m(Cu) = 3.2 г
m(CuO) = 4 г
m(O2) = ?
Решение:
2Cu + O2 = 2CuO
m(Cu) + m(O2) = m(CuO)
3.2 + m(O2) = 4
m(O2) = 0.8 г
Ответ: m(O2) = 0.8 гЕще вариант решения через количество вещества, которое будете проходить в параграфе 36:
Дано :
m(Cu) = 3,2 г
M(Cu) = 64 г/моль
m(CuO) = 4 г
M(CuO) = 80 г/моль
M (O2) = 32 г/моль
m(O2) = ?
Решение:
2Cu + O2 = 2CuO
n(Cu) = m/M = 3,2/64 = 0,05 (моль)
n(CuO) = m/M = 4/80 = 0,05 (моль)
Cu O2 CuO
0,05 моль x моль 0,05 моль
2 молекулы 1 молекула 2 молекулы
x = n(O2) = 0,05·1/2 = 0,025 (моль)
m(O2) = n·M = 0,025 ·32 = 0,8 (г)
Ответ. 0,8 г.
Тест
1. Самый распространённый химический элемент в земной коре — это
1) водород
2) кислород
3) железо
4) кремний
Правильный ответ 2) кислород2. В предложении «Кислород входит в состав воздуха» речь идёт о кислороде
1) как о химическом элементе
2) как о простом веществе
Воздух - смесь газов, один из которых кислород. Элемент не может быть газом, вещество может. Кислород газ - простое вещество.
Правильный ответ 2.3. Укажите правую часть уравнения химической реакции разложения пероксида водорода H202.
1) 2H2 + 2O2
2) 2H2O + O2
3) H2O + H2
4) H2O + O2
Правильный ответ 2) 2H2O + O24. Для получения кислорода в лаборатории не используют вещество
1) КМnO4
2) КСlO3
3) H2O2
4) СаО
Кислород получают в лаборатории разложением перманганата калия, перекиси или хлората калия, поэтому ответы 1,2,3 неверны.
Правильный ответ 4. §23
-
§23. Свойства кислорода
1. Охарактеризуйте физические и химические свойства кислорода. Составьте уравнения соответствующих химических реакций. Под формулами веществ напишите их названия, а над формулами проставьте валентность элементов в соединениях.
Физические свойства кислорода : бесцветный газ, без вкуса и запаха, немного тяжелее воздуха, слабо растворим в воде, температура кипения -183°C, температура плавления -218°C.
Химические свойства кислорода.
Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называют реакциями горения. Например, если опустить в сосуд с кислородом тлеющий уголек, то он раскаляется добела и сгорает :
$\underset{углерод}C + \underset{кислород}{O_2} = \underset{оксид\;углерода(IV)}{\overset{IV\;II}{CO_2}}$Сера горит в кислороде ярким синим пламенем с образованием газа с резким запахом :
$\underset{сера}S + \underset{кислород}{O_2} = \underset{оксид\;серы\;(IV)}{\overset{IV\;II}{SO_2}}$Фосфор сгорает в кислороде ярким пламенем с образованием белого дыма :
$\underset{фосфор}{4P} + \underset{кислород}{5O_2} = \overset{V\;\;\;II}{\underset{оксид\;фосфора\;(V)}{P_2O_5}}$В кислороде горят и такие вещества, которые обычно считают негорючими, например железо :
$\underset{железо}{3Fe} + \underset{кислород}{2O_2} = \underset{оксид\;железа\;(II,III)}{\overset{II,III\;\;\;II}{Fe_3O_4}}$2. Как может протекать взаимодействие веществ с кислородом?
При нагревании кислород энергично реагирует со многими веществами, при этом выделяется теплота и свет (реакции горения).
Реакции с участием кислорода могут протекать быстро (как горение) или медленно, незаметно для наблюдателя. Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно.
Горение может сопровождаться цветным пламенем и запахом (горение серы), с образованием дыма (горение фосфора), с треском и образованием искр (горение железа).
Кроме того, реакция может протекать быстро (реакции горения), а может медленно, как, например, при ржавлении металлов :
2Cu + O2 = 2CuO3. Приведите примеры медленного взаимодействия веществ с кислородом.
Гниение органических веществ, ржавление железа, окисление сливочного масла.
Пример медленного окисления вещества кислородом - образование ржавчины :
2Cu + O2 = 2CuO
2Fe + O2 = 2FeO
4Fe + 3O2 = 2Fe2O34. Какие вещества называют оксидами? Напишите уравнения химических реакций, в результате которых образуются оксиды следующих химических элементов : а) кремния; б) цинка; в) бария; г) водорода; д) алюминия. Дайте названия этим оксидам.
Оксиды – бинарные сложные вещества, т.е. вещества, в состав которых входят атомы двух разных химических элементов : один из них всегда кислород O, другой может быть металлом (в таком случае оксид называют основным) или неметаллом (такой оксид называют кислотным).
Реакциями образования оксида элемента, к примеру, являются реакции соединения, представляющие собой окисление кислородом атомов этого элемента :
а) оксид кремния (кремнезём) : Si + O2 = SiO2
б) оксид цинка (окись цинка) : 2Zn + O2 = 2ZnO
в) оксид бария (окись бария) : 2Ba + O2 = 2BaO
г) оксид водорода (вода) : 2H2 + O2 = 2H2O
д) оксид алюминия (корунд) : 4Al + 3O2 = 2Al2O35. При разложении основного карбоната меди (минерала малахита) СuСO3 • Сu(ОН)2 образуются три оксида. Напишите уравнение этой реакции.
В состав малахита входят 2 соединения двухвалентной меди : карбонат CuCO3 и гидроксид Cu(OH)2.
CuCO3 – соединение, разлагающееся под действием температуры на углекислый газ и оксид меди :
CuCO3 → CuO + CO2↑
Cu(OH)2 – не растворимое основание, такие соединения распадаются при нагревании на воду и оксид металла (в данном случае, оксид меди) :
Cu(OH)2 → CuO + H2O
Таким образом, суммарное уравнение реакции будет выглядеть следующим образом :
CuCO3· Cu(OH)2 = 2 CuO + CO2↑ + H2O
Т.е. минерал малахит разлагается с образованием оксидов водорода , меди (II) и углерода (IV).6. Составьте уравнения реакций, протекающих при горении : а) фосфора; б) алюминия.
Горение – взаимодействие с кислородом O2; горение простых веществ – реакция соединения, приводящая к образованию оксида :
а) 4P + 5O2 = 2P2VO5II
б) 4Al + 3O2 = 2Al2IIIO3II7 Определите, какое из соединений железа — Fe2O3 или богаче железом.
Fe2O3 :
M(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2·56 + 3·16 = 160
ω(Fe) = (2Ar(Fe))/M(Fe_2 O_3) •100% = 112/160•100% = 70%
Fe3O4 :
M(Fe3O4) = 3Ar(Fe) + 4Ar(O) = 3·56 + 4·16 = 232
ω(Fe) = (3Ar(Fe))/M(Fe_3 O_4) •100% = 168/232•100% = 72,4%Таким образом, в Fe3O4 содержание железа выше.
Тест
1. Определите вещество по описанию : бесцветный газ, без вкуса и запаха, малорастворим в воде. При давлении 760 мм рт. ст. и температуре -218,8 °С затвердевает.
1) кислород
2) водород
3) углекислый газ
4) сероводород
Указанные физические свойства соответствуют кислороду.
Правильный ответ 1.2. Реакция горения фосфора в кислороде относится к реакциям
1) соединения
2) разложения
3) замещения
4) окисления
из 2-х простых веществ образуется одно сложное - реакция соединения.
Правильный ответ 1. §24
-
§24. Применение кислорода. Круговорот кислорода в природе
1. Используя рисунок 29, создайте свой вариант компьютерной презентации из 6—7 слайдов по теме «Применение кислорода». Обсудите cвою презентацию с соседом по парте.
Презентация
(Медицина Авиация Резка металла Металлургия Взрывные работы Сварка металла - на каждую отрасль по слайду)2. Что делается в вашей местности для поддержания определённого уровня кислорода в воздухе? В чём может заключаться ваше участие в этой деятельности?
Самые распространенные мероприятия - посадка зеленых насаждений, строительство парков, уход за городскими деревьями.
Внести свой вклад в поддержание уровня кислорода можно, поучаствовав в подобных мероприятиях.В нашей местности для поддержания содержания кислорода в воздухе высаживаются деревья. Моё участие может заключается в том, что я могу принимать участие в высадке растений.
3. Поясните на примерах, как происходит круговорот кислорода в природе.
Зеленые растения и цианобактерии в процессе фотосинтеза выделяют кислород, который растворяется в воде водоемов и поступает в атмосферу. Далее он расходуется на процессы гниения, дыхания аэробных организмов и горения (пожары, сжигании различных видов топлива). В результате этих процессов выделяется углекислый газ, который поглощается растениями, и в процессе фотосинтеза в атмосферу снова выделяется кислород.
4. Обобщите знания о кислороде по плану, который представлен в таблице. Данную таблицу подготовьте с помощью компьютера и заполните её. Проверьте заполненную таблицу у соседа по парте.
Общая характеристика
Химический знак элемента – O
Латинское название – оксигениум
Относительная масса элемента Ar(O2) = 16
Химическая формула простого вещества - O2
Относительная молекулярная масса простого вещества Mr(O2 = 32)
В соединениях кислород двухвалентенНахождение в природе
Самый распространенный элемент на Земле : входит в состав земной коры, атмосферы и биологически активных веществ
Получение :
а) в лаборатории
б) в промышленности
б) 2 основных компонента воздуха (азот и кислород) разделяют, используя разности их температур кипения (воздух сжижают и последовательно выпаривают азот, затем кислород).Физические свойства
Бесцветный газ без вкуса и запаха, относительно малорастворим в водеПрименение
• Медицина
• Авиация
• Сварка металлов
• Резка металлов
• Взрывные работы
• МеталлургияОбщая характеристика Химический элемент главной подгруппы VI группы, второго периода периодической системы, с атомным номером 8. Кислород – химически активный неметалл. Нахождение в природе В атмосфере Земли, в составе оксидов (воды, силиката кремния (IV) и т. д.), в составе многих минералов. Получение :
а) в лаборатории
б) в промышленностиПолучение кислорода в лаборатории
В школьной лаборатории чаще всего кислород получают из перманганата калия :
KMnO4 _t⟶ K2MnO4 + MnO2 + O2↑Разложение пероксида водорода в присутствии оксида марганца (IV) :
2H2O2 _MnO₂⟶ 2H2O + O2↑Разложение бертолетовой соли при нагревании в присутствии оксида марганца (IV) :
2KClO3 _MnO₂, t⟶ 2KCl + 3O2↑Получение кислорода в промышленности
В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных газов : основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196°С) ниже температуры кипения жидкого кислорода (-183°С), то азот испаряется, а жидкий кислород остается. Газообразный кислород хранят в стальных баллонах под давлением 15 МПа.
Физические свойства Бесцветный газ, без вкуса и запаха, немного тяжелее воздуха, слабо растворим в воде, температура кипения -183°C, температура плавления -218°C.
Химические свойства Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называют реакциями горения. Например, если опустить в сосуд с кислородом тлеющий уголек, то он раскаляется добела и сгорает :
C + O2 = CO2Сера горит в кислороде ярким синим пламенем с образованием газа с резким запахом :
S + O2 = SO2Фосфор сгорает в кислороде ярким пламенем с образованием белого дыма :
4P + 5O2 = P2O5В кислороде горят и такие вещества, которые обычно считают негорючими, например железо :
3Fe + 2O2 = Fe3O4Применение Применение кислорода : в медицине; на взрывных работах; для сварки металлов; для резки металлов; в авиации для дыхания; в авиации для двигателей; в металлургии. 5. Известно, что в организме человека содержится 65% кислорода по массе. Вычислите массу кислорода в вашем организме.
В массу тела поставьте ваш "вес".
Дано :
m(тела) = 46 кг
ω(O) = 65%
m(O) = ?Решение
m(O) = (ω(O)*m(тела))/100 = (65*46)/100 = 29.9 кг
Ответ: m(O) = 29.9 кг.
Тест
1. Горение магния относится к реакциям
1) разложения
2) замещения
3) соединения
2Mg + O2 = 2MgO
из двух простых веществ образовалось одно сложное - реакция соединения.
Правильный ответ 3.2. Массовая доля химического элемента фосфора в оксиде фосфора(У) составляет
1) 19,2%
2) 36,4%
3) 43,7%
4) 100%
Mr(P2O5) = 2Ar(P) + 5Ar(O) = 3·31 + 5·16 = 142
ω(P) = (2Ar(P))/Mr(P2O5)•100% = 62/142•100% = 43,7%
Правильный ответ №3. §25
-
§25. Практическая работа 3. Получение и свойства кислорода
1. Получение и собирание кислорода
а) Соберите прибор, как показано на рисунке 25 (с. 73). и проверьте его на герметичность. В пробирку насыпьте перманганат калия примерно на 1/4 её объёма и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Закрепите пробирку на лапке штатива гак, чтобы конец газоотводной трубки почти доходил до дна стакана или цилиндра, и которой будет собираться кислород.
В пламени спиртовки сначала обогрейте всю пробирку, а затем нагревайте ее дно.
Полноту заполнения стакана (цилиндра) кислородом проверяйте тлеющей лучинкой. Как только сосуд наполнится кислородом, закройте его картоном или стеклянной пластинкой.
б) Соберите прибор, как показано на рисунке 26 (с. 74), и проверьте его на герметичность. В сосуд с водой опрокиньте пробирку с водой (или цилиндр, закрытый стеклянной пластинкой). Затем пробирку (цилиндр) с водой наденьте на конец газоотводной трубки и шире войте пробирку с перманганатом калия. Когда сосуд заполнится кислородом, закройте его под водой стеклянной пластинкой.
2. Горение в кислороде угля и серы
а) Положите в железную ложечку кусочек древесного угля и раскалите его в пламени спиртовки. Затем ложечку с тлеющим углем внесите в сосуд с кислородом и наблюдайте за происходящим. Когда горение прекратится, налейте в сосуд немного известковой воды и взболтайте. Почему известковая вода мутнеет’ Запишите уравнение реакции горения угля.
б) В железную ложечку положите кусочек серы и подожгите ее в пламени спиртовки. (Опыт провозится в вытяжном шкафу!) Понаблюдайте, как сера горит на воздухе. Затем поместите горящую серу в сосуд с кислородом. Как изменилось пламя? Почему? Запишите уравнение реакции горения серы.
3. Отчёт о работе оформите в виде таблицы (см. § 5).Что делали
Собрали установку как на рисунке, полноту заполнения стакана кислородом проверяли, вводя в него тлеющую лучинку.
Собрали установку как на рисунке, методом вытеснения воды наполнили пробирку кислородом.
Раскалили в пламени спиртовки древесный уголь, внесли его в пробирку с кислородом. Затем наполнили пробирку известковой водой и взболтали.
Подожгли кусочек серы в пламени спиртовки. Затем внесли серу в пробирку с кислородом.Что наблюдали
Через некоторое время после начала реакции тлеющая лучина, введенная в стакан, загоралась.
По мере образования кислорода уровень воды в пробирке опускался.
Уголь горит в кислороде. Известковая вода помутнела.
Сера горит на воздухе медленно, в кислороде – интенсивно, синим пламенем. При этом появляется резкий запах.Выводы
Получить кислород в лаборатории можно разложением перманганата калия :
О выделении кислорода можно судить по воспламеняющейся лучине (кислород поддерживает горение).
Кислород – газ, поэтому с увеличением его концентрации в пробирке возрастает давление, в результате чего, кислород вытесняет воду, наполняя пробирку.
Уголь горит в кислороде с образованием углекислого газа.
Помутнение известковой воды – качественная реакция на углекислый газ, что подтверждает, что горение угля происходит согласно этому уравнению реакции.
В воздухе концентрация кислорода небольшая – всего 21%. Поэтому сера горит в чистом кислороде гораздо интенсивнее.
Появление резкого запаха свидетельствует об образовании оксида серы (IV) в процессе горения серы в кислороде. §26
-
§26. Озон. Аллотропия кислорода
1. Какое значение имеет озон для жизни на Земле? Используя дополнительные источники информации, узнайте, над какими участками Земли озоновый слой наиболее тонкий.
Озоновый слой, находящийся на высоте 20-25 км защищает всё живое на Земле от губительного воздействия космического излучения. Наиболее тонкий озоновый слой располагается над Антарктикой.
2. Сравните свойства кислорода и озона. На основе этих примеров поясните сущность аллотропии.
Кислород Озон Физические свойства Бесцветный газ, без вкуса и запаха. Малорастворим в воде. Голубой газ с характерным запахом. Плотность в 1,5 раза больше, чем у кислорода. Намного лучше растворяется в воде, чем кислород. Химические свойства Взаимодействует с многими веществами при нагревании с выделением тепла и света. Значительно более активен, чем кислород. Это связано с тем, что молекула озона распадается на 1 атом и 1 молекулу кислорода : O3 = O2 + O. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются. Каучук становится хрупким, а красители обесцвечиваются. Сущность аллотропии заключается в способности химического элемента образовывать несколько простых веществ, которые различаются между собой физическими и химическими свойствами.
3. Расскажите соседу по парте об озоне по следующему плану : 1) нахождение в природе; 2) получение; 3) свойства;4) применение.
Оцените работу друг друга.Нахождение в природе
В природе озон образуется во время грозы под действием электрических разрядов – молний. В лесах озон образуется в результате окисления смолы хвойных деревьев. Озон постоянно образуется также в верхних слоях атмосферы на высоте 20-25 км.Получение
Озон получают в специальных приборах – озонаторах. В озонаторе кислород превращается в озон под действием электрического разряда
3O2 _постоянный ток⟶ 2O3Свойства
Плотность озона в 1,5 раза больше плотности кислорода. Он намного лучше, чем кислород, растворяется в воде. Кроме того, его химическая активность значительно превышает активность кислорода. Так, в атмосфере озона некоторые вещества (например, фосфор и спирт) воспламеняются, каучук становится хрупким, а многие красители обесцвечиваются. Из-за высокой химической активности озон ядовит.Высокая химическая активность озона объясняется тем, что его молекулы неустойчивы и легко распадаются с образованием атомов кислорода :
O3 = O2 + O.
Атомарный кислород намного активнее молекулярного.Применение
Высокую химическую активность озона используют, в частности, при обеззараживании питьевой воды, воды в бассейнах, сточных вод. В воде, через которую пропускают озон, гибнут болезнетворные микроорганизмы.
Тест
1. Аллотропными модификациями являются
1) кислород и водород
2) кислород и озон
3) натрий и калий
4) алюминий и медь
Кислород и озон являются разными простыми веществами, образованными одним химическим элементом – кислородом. Кислород (O2) и озон (O3) Поэтому они являются аллотропными модификациями.
Правильный ответ 2.2. Озон получают
1) в аппарате Киппа
2) в озонаторе
3) в кристаллизаторе
4) в газометре
Озон получают из кислорода в специальном аппарате – озонаторе :
Правильный ответ 2.3. Определите вещество по описанию : газ с характерным запахом свежести, голубого цвета, в 1,5 раза тяжелее кислорода.
1) озон
2) аммиак
3) углекислый газ
4) сероводород
Аммиак, углекислый газ и сероводород бесцветны, поэтому ответы 2,3,4 неверны.
Правильный ответ 1. §27
-
§27. Воздух и его состав
1. С помощью каких опытов можно определить содержание кислорода и азота в воздухе?
Сжигание фосфора в колоколе позволяет определить, что в воздухе есть кислород (обуславливающий горение фосфора), а также, что кислорода в 4 раза меньше, чем азота (который не поддерживает горение).
2. Какие вы знаете благородные газы? Перечислите области их применения.
Благородные газы : гелий, неон, аргон, криптон, ксенон.
Гелий используют при наполнении воздушных шаров и дирижаблей.
В атмосфере аргона производят электросварку легкоокисляющихся металлов.
Неон аргон и криптон используются при производстве ламп.3. Чем отличается горение веществ в кислороде от их горения на воздухе?
Горение на воздухе происходит гораздо менее интенсивно, чем в кислороде, т.к. в воздухе содержание кислорода невелико – 21%. А именно кислород – окислитель, обуславливающий горение.
4. В чём сходство и различия горения простых и сложных веществ? Поясните на примерах.
При горении простого вещества образуется оксид элемента, образующего это простое вещество.
При горении сложного вещества образуются оксиды всех элементов, атомы которых входили в состав сложного вещества.5. Руководствуясь правилами, приведёнными в параграфе, составьте уравнения реакций горения следующих веществ : а) бария; б) алюминия; в) лития; г) фосфора; д) водорода; е) сероводорода H2S; ж) этана C2Нб; з) ацетилена C2H2.
А) 2Ba + O2 = 2BaO
Б) 4Al + 3O2 = 2Al2O3
В) 4Li + O2 = 2L2O
Г) 4P + 5O2 = 2P2O5
Д) 2H2 + O2 = 2H2O
Е) 2H2S + 3O2 = 2H2O + 2SO2
Ж) 2C2H6 + 7O2 = 4CO2 + 6H2O
З) 2C2H2 + 5O2 = 4CO2 + 2H2O6 Обсудите с соседом по парте условия возникновения и прекращения горения. Какие средства тушения пожара нужно использовать в следующих случаях : а) загорелась одежда на человеке; б) воспламенился бензин; в) возник пожар на складе лесоматериалов; г) загорелась нефть на поверхности воды?
Для возникновения и поддержания горения необходимы температура воспламенения и доступ окислителя (кислорода).
А) вода
Б) огнетушитель, песок
В) вода, специальные пены
Г) специальные пены7. Рассчитайте массу кислорода, необходимого для сжигания 2,4 г углерода.
Дано:
m(C) = 2.4 г
m(O2) = ?Решение
C + O2 = CO2↑
n(C) = (m(C))/(M(C)) = 2.4/12 = 0.2 моль
n(O2) = n(C) = 0.2 моль
m(O2) = n(O2)*M(O2) = 0.2 * 32 = 6.4 г
Ответ: m(O2) = 6.4 гВариант решения через количество вещества в молях (будете учить в параграфе 36):
Дано :
m(C) = 2,4 г
M(C) = A(C) = 12 г/моль
M (O2) = 32 г/моль
m(O2) = ?C + O2 → CO2↑
n(C) = m/M = 2,4/12 = 0,2 (моль)
C O2
0,2 моль x моль
1 молекула 1 молекула
x = n(O2) = 0,2 (моль)
m(O2) = n·M = 0,2 ·32 = 6,4 (г)
Ответ. 6,4 г.8 Допишите уравнение реакции горения этана (C2H6) в кислороде расставьте коэффициенты.
с2н6 + O2 = ... + ...C2H6 + O2 → CO2 + H2O
Уравнивают по углероду :
C2H6 → CO2
C2H6 = 2CO2
Теперь по водороду :
C2H6 → H2O
C2H6 = 3H2O
Теперь по кислороду :
O2 → 2CO2 + 3H2O
7O2 → 4CO2 + 6H2O
Теперь, чтобы снова уравнялись углерод и водород, удваивают и предыдущие равенства :
2C2H6 = 6H2O
2C2H6 = 4CO2
Итого : 2C2H6 + 7O2 = 4CO2 + 6H2O
Тест
1. Состав воздуха экспериментально определил
1) М. В. Ломоносов
2) А. Лавуазье
3) Дж. Дальтон
4) Дж. Пристли
В 1774 году состав воздуха определил французский химик А. Лавуазье.
Правильный ответ 2.2. Составной частью воздуха не является
1) кислород
2) азот
3) водород
4) углекислый газ
Водород – самый распространенный элемент в космосе, но не в земной атмосфере.
Правильный ответ 3.3. К благородным газам не относят
1) гелий
2) кислород
3) неон
4) аргон
Кислород чрезвычайно активен, поэтому не относится к благородным газам, которые инертны.
Правильный ответ 2.4. При тушении пожара используют
1) речной песок
2) углекислый газ
3) бензин
4) кислород
Углекислый газ не поддерживает горение, поэтому его применяют в составе огнетушителей. Песок также не горит, поэтому его используют при тушении пожаров.
Правильный ответ 1,2.5. К реакциям горения относится реакция
1) СаСO3 = СаО + СO2
2) 2Mg + O2 = 2MgO
3) 2HgO = 2Hg + 02
Горение – реакция с кислородом.
Правильный ответ 2. §28
-
§28. Водород, его общая характеристика, нахождение в природе и получение
1. Дайте общую характеристику элемента водорода. Приведите примеры соединений, содержащих водород, и напишите их формулы.
Общая характеристика элемента водород :
Химический знак элемента – H
Латинское название – гидрогениум
Относительная атомная масса элемента Ar(H) = 1,008
Химическая формула простого вещества – H2
Относительная молекулярная масса простого вещества Mr(H2) = 2,016
В соединениях водород одновалентен
Примеры соединений, содержащих водород : водород H2, аммиак NH3, хлороводород HCl, сероводород H2S.2. Поясните, что означают записи : 5Н, 2H2, 6Н, ЗH2.
5H – 5 атомов водорода
2H2 – 2 молекулы водорода, каждая из которой состоит из 2-х атомов водорода
6H – 6 атомов водорода
3H2 – 3 молекулы водорода, каждая из которой состоит из 2-х атомов водорода3. В каком виде водород встречается в природе? Сравните массовые доли водорода в воде H2O и в метане СН4.
Водород – самый распространенный химический элемент во Вселенной, он является составной частью Солнца и других звезд. На Земле представлен в составе воды, метана, органических веществ, а также в виде простого вещества.
В воде :
ω(H) = (2Ar(H))/M(H_2 O) •100% = 2/18•100% = 11,1%
В метане :
ω(H) = (4Ar(H))/M(CH_4) •100% = 4/16•100% = 25%
Т.е. в воде массовая доля водорода меньше, чем в метане.4. Составьте уравнения реакций, в результате которых можно получить водород. Укажите, к какому типу относятся эти реакции.
Разложение воды при действии постоянного электрического тока :
2H2O _постоянный ток⟶ 2H2↑ + O2↑ – реакция разложения.При взаимодействии некоторых металлов с кислотами, например при взаимодействии цинка с раствором соляной кислоты :
Zn + 2HCl ⟶ ZnCl2 + H2↑ – реакция замещения.При взаимодействии активных металлов (например, Na) с водой :
2Na + 2HOH ⟶ 2NaOH + H2↑ – реакция замещения.5. Водород можно получить при взаимодействии алюминия с растворами соляной и серной кислот. Составьте уравнения этих реакций.
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Тест
1. Самый распространённый элемент во Вселенной — это
1) Не
2) Аr
3) Н
4) О
Водород – самый распространенный химический элемент во Вселенной, он является составной частью Солнца и других звезд.
Правильный ответ 3.2. О водороде как о простом веществе говорится в утверждении
1) водород входит в состав соляной кислоты
2) водород — это практически нерастворимый в воде газ
3) водород входит в состав метана СН4
4) из водорода и кислорода состоит вода
В ответах 1,3,4 говорится, что водород входит в состав веществ – это характеризует его как элемент. Поэтому ответы 1,3,4 неверны.
В ответе 2 говорится о водороде, как о газе. Газ – вещество.
Правильный ответ 2.3. Две молекулы водорода обозначает запись
1) 4Н
2) 2H2
3) 4H2
4) 2Н
Молекула водорода состоит из 2-хатомов водорода, что показывает индекс «2» после символа H : H2
То, что молекулы 2, показывает коэффициент «2» перед обозначением молекулы H2 : 2H2
Правильный ответ 2.4. Реакция Mg + ЗНСl = MgCl2 + H2 относится к реакциям
1) соединения
2) разложения
3) замещения
4) обмена
Простое вещество магний вытесняет из сложной молекулы соляной кислоты водород в форме простого вещества – реакция замещения.
Правильный ответ 3.5. Массовая доля водорода в серной кислоте H2SO4 составляет
1) 32,65%
2) 65,31%
3) 2,04%
4) 0,20%
ω(H) = (2Ar(H))/M(H_2 SO_4)•100% = 2/98•100% = 2,04%
Правильный ответ 3. §29
-
§29. Свойства и применение водорода
1. Один цилиндр заполнен водородом, а другой — кислородом. Как определить, в каком цилиндре находится каждый из газов?
И водород, и кислород поддерживают горение. При этом :
• Введенная в цилиндр с водородом горящая лучина гаснет с характерным хлопком.
• Введенная в цилиндр с кислородом тлеющая лучина загорается.2. Как перелить из одного сосуда в другой, а) водород; б) кислород?
Водород легче воздуха :
Mr(H2) = 1 + 1 = 2
2<29
Поэтому водород переливается в перевернутую пробирку.
Кислород тяжелее воздуха :
Mr(O2) = 16 + 16 = 32
32 → 29
Поэтому кислород переливается в пробирку в положении «дно снизу».3. Составьте уравнения химических реакций водорода со следующими оксидами : а) оксидом ртути(II); б) железной окалиной Fe,O4; в) оксидом вольфрама(VI). Объясните, какова роль водорода в этих реакциях. Что происходит с металлом в результате реакции?
А) H2 + HgO = H2O + Hg
4H2 + Fe3O4 = 4H2O + 3Fe
3H2 + WO3 = 3H2O + W
H20 → H2 + O – водород – восстановитель, он окисляется в процессе реакции
Hg2 + → Hg0
Fe2 + + Fe3 + → Fe0
W + 6 → W0
Металл – окислитель, в результате реакции его оксида с водородом, металл восстанавливает до чистого вещества.4. Используя рисунок 39, создайте свой вариант презентации из 7—8 слайдов по теме «Применение водорода». Обсудите свою презентацию с соседом по парте.
Презентация
Свойства
Водород – бесцветный, самый легкий газ.
Он в 14,5 раз легче воздуха.
Плотность водорода равна 0,09 г/л
Растворимость водорода в воде очень низкая
Температура сжижения -252,8˚C
Применение
Металлургия
Неорганический синтез
Энергетическая промышленность
Органический синтез
Металлургия
Водород используют как восстановитель при получении металлов из руд: CuO + H2 t= Cu + H2O
Неорганический синтез
Водород используется при получении многих ценных неорганических веществ: соляной кислоты, воды и т.д.
Cl2 + H2 t= 2HCl
Органический синтез
С участием водорода проводят превращение растительных масел в твердые жиры.
Энергетика
Водород – эффективное топливо. Его применение основано на способности гореть с выделением
большого количества теплоты.
Это свойство используется не только в транспортной промышленности, но и металлургических областях, например, при сварке и резке металлов.
Перспективы использования
Большое значение может иметь применение водорода в качестве экологически чистого топлива, т.к. при его сгорании образуются водяные пары, не загрязняющие атмосферу.
Для осуществления этой идеи потребуется разработать экономически выгодные условия проведения реакции разложения воды:
2H2O эл.ток→ 2H2↑ + O2↑
Выводы
Таким образом, водород не только используется в широком диапазоне отраслей промышленности, но и имеет перспективы при разработке экологически чистого топлива.5. Руководствуясь планом, приведённым в задании 3 после § 26, подготовьте компьютерную презентацию по теме «Водород».
Презентация
ХАРАКТЕРИСТИКА ВОДОРОДА
Нахождение в природе
Получение
Свойства
ПрименениеНАХОЖДЕНИЕ В ПРИРОДЕ
• Водород – самый распространенный химический элемент
во Вселенной, он является составной частью Солнца и
других звезд. На Земле представлен в составе воды,
метана, органических веществ, а также в виде простого
вещества.ПОЛУЧЕНИЕ
• В лаборатории – в аппарате Киппа:
Zn + 2HCl = ZnCl2 + H2↑
• В промышленности – из природного газа или из воды:
2H2O → 2H2↑ + O2↑ФИЗИЧЕСКИЕ СВОЙСТВА
• Водород – бесцветный, самый легкий газ.
• Он в 14,5 раз легче воздуха.
• Плотность водорода равна 0,09 г/л
• Растворимость водорода в воде очень низкая
• Температура сжижения -252,8˚CХИМИЧЕСКИЕ СВОЙСТВА
1. Взаимодействие с галогенами
2. Взаимодействие с кислородом
3. Взаимодействие с серой
4. Взаимодействие с азотом
5. Взаимодействие со сложными веществами (оксидами металлов и неметаллов)
6. Взаимодействие с активными металламиПРИМЕНЕНИЕ
Металлургия
Неорганический синтез
Органический синтез
Энергетическая промышленность
Тест
1. В соединении NH3 водород проявляет валентность
1) III
2) II
3) I
4) IV
Правильный ответ 3) I2. В уравнении реакции PbO2 + 2H2 = РЬ + 2H20 восстановителем является
1) свинец
2) водород
3) оксид свинца(IV)
4) вода
Правильный ответ 2) водород3. Левая часть уравнения реакции : ... + ... = Hg + H2O — это
1) HgO + С =
2) HgO + H2 =
3) HgO + Аl =
4) HgO + CO =
Правильный ответ 2) HgO + H2 = §30
-
§30. Практическая работа 4. Получение водорода и исследование его свойств.
В чём особенности техники безопасности при работе с водородом?
1. Получение водорода и его собирание методом вытеснения воды. Соберите прибор, как показано на рисунке 35, и проверьте его на герметичность. В пробирку поместите несколько гранул цинка и добавьте 2—3 мл разбавленной соляной кислоты.
В течение минуты выделяющемуся из прибора газу дайте свободно выходить из пробирки (вначале выделяющийся водород содержит примесь воздуха, который находился в приборе до начала реакции). Затем конец газоотводной трубки подведите к горлышку пробирки, предварительно заполненной водой и помещённой в перевёрнутом виде в чашку с водой. Когда газ заполнит пробирку, закройте её под водой пробкой, выньте из чашки и поставьте в штатив горлышком вниз." Почему водород можно собрать методом вытеснения воды?
2. Получение водорода и его собирание методом вытеснения воздуха. Повторите опыт, взяв вместо соляной кислоты серную. Водород соберите в пробирку, перевёрнутую вверх дном (см. рис. 35)." Напишите уравнения реакций цинка: а) с соляной кислотой; б) с серной кислотой.
3. Горение водорода. Проверьте собранный вами водород на чистоту. Для этого пробирку, наполненную водородом, держа отверстием вниз, поднесите к пламени горелки. Горелка должна быть размещена на расстоянии не менее 0,5 м от прибора, в котором получали водород!
В каком случае полученный газ сгорает спокойно, а в каком случае — со взрывом? "
Если вы собрали чистый водород, он сгорает спокойно, с характерным звуком «ппах». Если водород содержит примесь воздуха, слышен характерный свистящий хлопок."
Что образуется в результате сгорания водорода?
Вода.
4. Отчёт о работе оформите в виде таблицы (см. § 5).
§31
-
§31. Вода
1. Поясните, как при помощи анализа и синтеза можно установить качественный и количественный состав воды и вывести её химическую формулу.
Анализ – метод определение состава вещества путем его разложения на более простые вещества.
Синтез – получение сложных веществ из более простых.Таким образом, разложив воду и определив, что в результате образуются водород и кислород (в соотношении 2 : 1), можно определить ее состав с помощью анализа.
Наоборот, взяв кислород и водород (в соотношении 2 : 1) и получив из них воду, можно определить состав воды путем синтеза.2. В эвдиометре взорвали смесь, состоящую из 1 мл водорода и 6 мл кислорода. Какой газ и в каком количестве остался после взрыва?
Таким образом, 1 мл водорода реагирует с 0,5 мл кислорода с образованием 1 мл воды.
В итоге остается 6-0,5 = 5,5 (мл) кислорода и образуется 1 мл паров воды.3. В чём заключается очистка питьевой воды?
Питьевую воду отстаивают и фильтруют (для удаления механических примесей), обрабатывают хлором, озоном или ультрафиолетом (для удаления микробов).
Также питьевую воду могут подвергать дистилляции (для очистки от растворенных нелетучих компонентов) и аэрации (для очистки от ионов металлов и от газов).4. Как получают дистиллированную воду и где её применяют? Можно ли дождевую воду назвать дистиллированной? Ответ поясните.
Дистиллированную воду получают в дистилляторах : грязную воду выпаривают, при этом испаряется только вода, без примесей; ее конденсируют, получая дистиллят. Дистиллированную воду используют в аптеках, химических лабораториях, охладительных системах.
Несмотря на то, что дождевая вода тоже образуется в результате конденсации паров, ее нельзя считать дистиллятом, т.к. в процессе конденсации она снова вступает в контакт с многочисленными веществами из окружающей среды, растворяя их в себе.5. Выполните проект на тему «Исследование питьевой воды местности, где я живу».
Презентация проекта
§32
-
§32. Химические свойства и применение воды
1. Составьте краткую схему-конспект параграфа. Проверьте выполнение этого задания у соседа по парте и оцените его работу.
Общая характеристика
Молекула воды состоит из 2 атомов водорода и 1 атома кислорода.
Химическая формула – H2O
Относительная молекулярная масса Mr(H2O) = 18 а.е.м.Нахождение в природе
Вода – самое распространенное на Земле вещество. Ею заполнены океаны, моря, озера и реки; пары воды входят в состав воздуха. Вода содержится в организмах животных и растений. Так, например, в организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%.Физические свойства
Бесцветная жидкость, без вкуса и запаха, кипит при 100°C (при давлении 101,3 кПа), замерзает при 0°C, ее максимальная плотность (при 4°C) равна 1 г/см3. Лед имеет меньшую плотность, чем жидкая вода, и всплывает на её поверхность, что очень важно для обитателей водоемов зимой. Вода обладает исключительно большой теплоемкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.Химические свойства
Вода вступает в реакции замещения с активными металлами:
Ca + 2H2O ⟶ Ca(OH)2 + H2↑Вода вступает в реакции с менее активными металлами при нагревании:
Zn + 2H2O t⟶ Zn(OH)2 + H2↑Под действием постоянноro электрического тока или высокой температуры (2000°C) вода разлагается на водород и кислород:
2H2O постоянный ток⟶ 2H2↑ + O2↑Вода вступает в реакции соединения со многими сложными веществами, например с оксидами:
CaO + H2O ⟶ Ca(OH)2
SO3 + H2O ⟶ H2SO4Применение
Роль воды в промышленности, в сельском хозяйстве и в быту очень велика и многообразна. Вода является важным сырьем для химической промышленности, например для получения водорода. Способность воды реагировать с некоторыми оксидами используется для получения оснований и кислот. Вода широко применяется как растворитель.
Тест
1. К реакциям замещения относятся реакции
1) Li2O + H2O = 2LiOH
2) Mg + H2O = MgO + H2
3) 2К + 2H2O = 2КОН + H2
4) SO3 + H2O = H2SO4
В результате реакции замещения между простым и сложным веществом образуются новые простое и сложное вещества.
Правильный ответ 2,3.2. Вода не взаимодействует
1) с кальцием
2) с медью
3) с оксидом натрия
4) с серой
Ответы 2) с медью и 4) с серой §33
-
§33. Вода — растворитель. Растворы
1. Что такое растворы и чем они отличаются от взвесей?
Растворы – однородные смеси, состоящие из растворителя, растворенного в нем вещества и продуктов их взаимодействия.
В отличие от взвесей, которые являются неоднородными мутными смесями, растворы однородны.2. Какие смеси называют суспензиями и эмульсиями? Приведите примеры эмульсий и суспензий.
Суспензии – взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды.
Например, смесь глины с водой.
Эмульсии – взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами воды.
Например, смесь воды с керосином, бензином или растительным маслом.3. Что такое растворимость? Какая существует зависимость между изменением температуры и растворимостью твёрдых и газообразных веществ?
Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.
С повышением температуры, растворимость большинства твердых веществ возрастает, а большинства газов – уменьшается.4. При открывании бутылки с лимонадом наблюдается бурное выделение газа. Чем это можно объяснить?
Бутылка с лимонадом в закрытом виде находится под высоким давлением, а растворимость газов возрастает при повышении давления. При открытии бутылки наблюдается бурное выделение газа потому, что растворимость газа снижается, т. к. давление в бутылки снижается до атмосферного уровня.
5. Используя дополнительные источники информации, составьте схему круговорота воды в природе.
Тест
1. Укажите верное утверждение.
1) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным.
2) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют ненасыщенным.
Раствор, в котором данное вещество при данной температуре больше не растворяется, называется насыщенным.
Правильный ответ 1.2. Морская вода это
1) раствор
2) суспензия
3) эмульсия
Морская вода – однородна, поэтому это раствор.
Правильный ответ 1.3. Смесь растительного масла с водой называют
«эмульсией»
(т.к. капли масла распределены равномерно между молекулами воды) §34
-
§34. Массовая доля растворённого вещества
1. Что показывает массовая доля вещества в растворе?
Массовая доля вещества выражает отношение его массы к общей массе раствора; т.о. эта величина наглядно показывает, какая масса в растворе приходится на данное вещество, в процентах :По массовой доле можно понять, много или мало вещества в растворе, т.е. является раствор концентрированным или разбавленным.
2. Как можно приготовить раствор с заданной массовой долей растворённого вещества? Приведите пример.
Приготовить раствор можно рассчитав количество вещества и воды.
Например, нужно приготовить 50 г 8% раствора нитрата калия.
Способ 1 :
m(KNO3) = 0,08·50 г = 4 (г)
m(воды) = m(раствора)-m(KNO3) = 50-4 = 46 (г)
Способ 2 :
Раствор Нитрат калия
50 г x г
100 г 8 г
m(KNO3) = x = 50·8/100 = 4 (г)
m(воды) = m(раствора)-m(KNO3) = 50-4 = 46 (г)Итог : взвесить 4 г нитрата калия и растворить в 46 мл воды, предварительно отмеренной цилиндром.
3. Чем отличаются понятия «насыщенный раствор» и «концентрированный раствор»?
Концентрация вещества в концентрированном растворе высока.
Концентрация вещества в насыщенном растворе максимальна.
Т.е. насыщенный раствор – частный случай концентрированного.4. В 513 г дистиллированной воды растворили 27 г соли. Вычислите массовую долю (в процентах) растворённого вещества в полученном растворе.
ω(соли) = (m(соли))/m(раствора) •100% = 27/(513 + 27)•100% = 5%
5.При выпаривании 25 г раствора получили 0,25 г соли. Определите массовую долю растворённого вещества и выразите её в процентах.
ω(соли) = (m(соли))/m(раствора)•100% = 0,25/25•100% = 1%
6 Дано 500 г раствора с массовой долей гидроксида натрия 0,2. Вычислите массу вещества, которое получается при выпаривании этого раствора.
ω(NaOH) = m(NaOH)/m(раствора)
m(NaOH) = ω(NaOH)*m(раствора) = 0,2*500 = 100 (г)
Ответ: m(NaOH) = 100 г.7 К 200 г раствора, массовая доля вещества в котором 0,3, добавили 100 г воды. Вычислите массовую долю растворённого вещества в полученном растворе.
m(вещества) = 0,3·200 = 60 (г)
m(нового раствора) = 200 + 100 = 300 (г)
ω(вещества в новом растворе) = m(вещества)/m(нового раствора)•100% = 60/300•100% = 20%8 Рассчитайте массу 5,5 л раствора серной кислоты, если плотность такого раствора при 20 °С равна 1,06 г/мл.
Дано :
V(раствора H2SO4) = 5,5 л = 5500 мл
р20°C = 1,06г/мл
m(раствора H2SO4) = ?
m = V·р = 5500·1,06 = 5830 (г) = 5,83 (кг)
Ответ. 5,83 кг.9 Рассчитайте плотность раствора соляной кислоты, если 560 г такого раствора занимают объём 500 мл.
Дано :
m(раствора HCl) = 560 г
V(раствора HCl) = 500 мл
р(раствора HCl) = ?
р = m/V = 560/500 = 1,12 (г/мл)
Ответ. 1,12 г/мл.
Тест
1. Укажите верное утверждение.
1) Раствор, в котором содержится много растворённого вещества, называют концентрированным.
2) Раствор, в котором содержится много растворённого вещества, называют разбавленным.
Правильный ответ 12. В 325 г воды растворили 25 г соли. Массовая доля соли в полученном растворе равна
1) 0,71%
2) 7,1%
3) 14,2%
4) 1,42%
ω(соли) = (m(соли))/m(раствора) •100% = 25/(325 + 25)•100% = 7,14%
Правильный ответ 2.3. Установите соответствие между физической величиной и формулой для её расчёта.
1) массовая доля элемента в соединении
2) массовая доля вещества в растворе
3) плотность
Ответ: 1-Б, 2-В, 3-А §35
-
§35. Практическая работа 5. Приготовление раствора с определенной массовой долей растворенного вещества (соли)
Вспомните формулу, с помощью которой можно вычислить массовую долю растворённого вещества.
ω (р.в.) = m(р.в)/m(р-ра) *100%
1. Проведение расчётов
Получите задание у учителя и вычислите, какая масса соли и какой объём воды необходимы, чтобы приготовить раствор с определённой массовой долей растворённого вещества.
2. Взвешивание
Перед взвешиванием проверьте техническое состояние весов.
На чаши весов положите одинаковые кусочки фильтровальной бумаги (на неё будет насыпаться вещество при взвешивании и размещаться разновес) и уравновесьте весы при помощи маленьких кусочков бумаги.
Отвесьте на весах рассчитанную вами навеску соли. На правую чашку весов при помощи пинцета поместите разновес (в соответствии с тем, какую массу должна иметь навеска соли), а на фильтровальную бумагу, лежащую на левой чашке, насыпьте соль. Снова уравновесьте весы, добавляя или убирая небольшие порции соли.
3. Приготовление раствора
Навеску соли перенесите в колбу. При помощи мерного цилиндра отмерьте объём воды, необходимый для приготовления раствора. При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости, а черта деления — напротив нижнего мениска уровня жидкости.
Примерно половину отмеренного объёма воды вылейте в колбу с веществом. Энергичным взбалтыванием добейтесь полного растворения соли. Затем в полученный раствор вылейте остальную воду, после чего раствор взболтайте вновь.
4. Отчёт о работе составьте в произвольной форме.
§36
-
§36. Количество вещества. Моль. Молярная масса
1. В каком случае применяют физическую величину "количество вещества" и в каких единицах её измеряют? Ответ поясните примерами.
Физическую величину "количество вещества" применяют потому, что она является более удобной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам. Единицей количества вещества является моль.
Неудобство использования массовых соотношений состоит в том, что каждый раз приходилось вычислять относительные молекулярные или атомные массы веществ, и находить их соотношение, например в реакции:
2Al + 3S = Al2S3
27 а.е.м + 32 а.е.м. = 150 а.е.м.
тогда массовые соотношения m(Al) : m(S) : m(Al2S3) = 9 : 16 : 25, а использование "количество вещества" даёт возможность использовать соотношение частиц (атомов, молекул), которое выражается в коэффициентах реакции, в данном случае это
n(Al) : n(S) : n(Al2S3) = 2 : 3 : 12. Что означает физическая величина "молярная масса" и чем она отличается от физических величин "относительная молекулярная масса" и "относительная атомная масса"?
Молярная масса вещества – это масса одного моля вещества (измеряется в г/моль).
Относительная молекулярная масса – это величина, показывающая, во сколько раз масса молекулы больше 1/12 массы атома углерода-12.
Относительная атомная масса – это величина, показывающая, во сколько раз масса атома больше 1/12 массы атома углерода-12.3. Рассчитайте молярные массы воды H2O, углекислого газа СO2, серной кислоты H2SO4, сероводорода H2S.
M(H2O) = 2∙M(H) + M(O) = 2∙1 + 16 = 18 г/моль
M(CO2) = M(C) + 2∙M(O) = 12 + 2∙16 = 44 г/моль
M(H2SO4) = 2∙M(H) + M(S) + 4∙M(O) = 2∙1 + 32 + 4∙16 = 98 г/моль
M(H2S) = 2∙M(H) + M(S) = 2∙1 + 32 = 34 г/моль4. Дано уравнение реакции 2Mg + O2 = 2MgO. Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом атомов и количеством вещества.
2Mg + O2 = 2MgO
Масса Число атомов Количество вещества Mg O Mg O Mg O2 48 г 32 г 12.04∙1023 12.04∙1023 2 моль 1 моль 24 г 16 г 6.02∙1023 6.02∙1023 1 моль 0.5 моль 12 г 8 г 3.01∙1023 3.01∙1023 0.5 моль 0.25 моль 5.Составьте 2—3 уравнения известных вам химических реакций и поясните, в каких массовых и количественных соотношениях реагируют вещества.
2Zn + O2 = 2ZnO
Массовые соотношения: m(Zn) : m(O2) = 2∙Ar(Zn) : 2∙Ar(O) = 130 : 32 = 65 : 16
Количественные соотношения: 2 : 12Al + 3CuCl2 = 3Cu + 2AlCl3
Массовые соотношения: m(Al) : m(CuCl2) = 2∙Ar(Al) : 3∙Mr(CuCl2) = 54 : 402 = 9 : 67
Количественные соотношения: 2 : 3Fe + S = FeS
Массовые соотношения: m(Fe) : m(S) = Ar(Fe) : Ar(S) = 56 : 32 = 7 : 4
Количественные соотношения: 1 : 1
Тест
1. Медь, взятая количеством вещества 6 моль, имеет массу
1) 60 г
2) 192 г
3) 384 г
4) 400 г
m(Cu) = nM = 6·64 = 384 (г)
Правильный ответ 3.2. Масса 0,1 моль алюминия равна
1) 0,1 г
2) 2,7 г
3) 260 г
4) 540 г
m(Al) = nM = 0,1·27 = 2,7 (г)
Правильный ответ 2.3. Количество вещества, соответствующее 32 кг оксида железа(III), — это
1) 10 моль
2) 20 моль
3) 100 моль
4) 200 моль
n (Fe2O3) = m/M = 32000/160 = 200 (моль)
Правильный ответ 4.4. Количество вещества, соответствующее 560 г карбоната кальция СаСO3, — это
1) 0,56 моль
2) 5,6 моль
3) 6,5 моль
4) 10 моль
n(CaCO3) = m/M = 560/100 = 5,6 (моль)
Правильный ответ 2. §37
-
§37. Вычисления с использованием понятий «количество вещества» и «молярная масса»
1. По уравнению реакции 2Аl + 3S = Al2S3 найдите массу и количество сульфида алюминия Al2S3, если в реакцию вступает 4,5 г алюминия.
Дано :
m(Al) = 4,5 г
M(Al) = 27 г/моль
M (Al2S3) = 150 г/моль
n(Al2S3) = ?
m(Al2S3) = ?2Al + 3S → Al2S3
n(Al) = m/M = 4,5/27 = 0,17 (моль)Al Al2S3
0,17 моль x моль
2 молекулы 1 молекула
x = n(Al2S3) = 0,17·1/2 = 0,085 (моль)
m(Al2S3) = n·M = 0,085 ·150 = 12,75 (г)
Ответ. 0,085 моль; 12,75 г.2. Вычислите массу и количество кислорода, прореагировавшего с медью, если образовалось 4 г оксида меди(II).
Дано :
m(CuO) = 4 г
M(CuO) = 27 г/моль
M (O2) = 32 г/моль
n(O2) = ?
m(O2) = ?2Cu + O2 → 2CuO
n(CuO) = m/M = 4/80 = 0,05 (моль)O2 CuO
x моль 0,05 моль
1 молекула 2 молекулы
x = n(O2) = 0,05·1/2 = 0,025 (моль)
m(O2) = n·M = 0,025 ·32 = 0,8 (г)
Ответ. 0,025 моль; 0,8 г.3. Составьте и решите задачу, используя понятия «количество вещества» и «молярная масса».
Найдите молярную массу, количество вещества и массу продукта реакции, образовавшегося при горении 6,2 г фосфора.
Дано :
m(P) = 6,2 г
M(P) = 31 г/моль
n(P2O5) = ?
M (P2O5) = ?
m(P2O5) = ?4P + 5O2 → 2P2O5
n(P) = m/M = 6,2/31 = 0,2 (моль)
P P2O5
0,2 моль x моль
4 молекулы 2 молекулы
x = n(P2O5) = 0,2·2/4 = 0,1 (моль)
M (P2O5) = 2Ar(P) + 5Ar(O) = 2·31 + 5·16 = 142 (г/моль)
m(P2O5) = n·M = 0,1 ·142 = 14,2 (г)
Ответ. 0,1 моль; 142 г/моль; 14,2 г. §38
-
§38. Закон Авогадро. Молярный объём газов
1. Какие физические явления и факты подтверждают правильность закона Авогадро? Сформулируйте этот закон.
Закон Авогадро : в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Закон Авогадро подтверждается тем, что все газы одинаково сжимаются (закон Бойля-Мариотта), обладают одинаковым термическим коэффициентом расширения (закон Гей-Люссака) и имеют некоторые другие общие свойства.2. Поясните, почему можно вывести понятие «молярный объём газа» на основе следствия закона Авогадро.
Из закона Авогадро следует, что массы различных газов, в которых содержится одинаковое число молекул, должны занимать одинаковые объемы. Экспериментально установлено, что 1 моль любого газа при н.у. занимает 22,4 л.
Эту величину, т.е. объем 1 моль данного газа, называют молярным объемом.3. Определите относительную плотность оксида азота(II) по воздуху.
D(NO)возд. = M(NO)/29 = 1,03
4. Сгорело 6 кг угля С. Вычислите объём образовавшегося оксида углерода(IV) (н. у.).
C + O2 - → CO2↑
n(C) = m/M = 6000/12 = 500 (моль)
n(C) = n(CO2) = 500 моль
V(CO2) = n·Vm = 500·22,4 = 11200 (л)
Ответ 11200 л. §39
-
§39. Объёмные отношения газов при химических реакциях
1. Каким закономерностям подчиняется поведение газообразных веществ в химических реакциях? Поясните на конкретных примерах.
Отношение коэффициентов в уравнениях реакций показывает отношение объёмов реагирующих и образовавшихся газообразных веществ.
1 моль 1 моль 2 моль
H2 + Cl2 = 2HCl
22.4 л 22.4 л 44.8 л
V(H2) : V(O2) : V(HCl) = 22.4 : 22.4 : 44.8 = 1 : 1 : 2Отношения объёмов реагирующих газов позволяют производить ряд расчётов, не прибегая к вычислению относительных молекулярных масс. Например, необходимо узнать сколько литров хлороводорода может образоваться, из 67.2 л водорода:
22.4 л H2 — 44.8 л HCl
67.2 л H2 — ? л HCl
V(HCl) = 44.8*67.2/22.4 = 134.4 л
Или из соотношения объёмов, которое численно равно соотношению коэффициентов реакции, видно что, из 1 литра водорода образуется 2 литра хлороводорода, поэтому ответ 134.4 л (67.2*2).2. При взаимодействии хлора с водородом образовалось 0,25 моль хлороводорода. Вычислите объем хлора, вступившего в реакцию (н. у.).
H2 + Cl2 = 2HCl
По уравнению реакции :
Cl2 HCl
x моль 0,25 моль
1 молекула 2 молекулы
x = n(Cl2) = 0,25·1/2 = 0,125 (моль)
V(Cl2) = n· Vm = 0,125 ·22,4 = 2,8 (л)
Ответ. 2,8 л.3. Вычислите, какой объем кислорода потребуется для сжигания 10 м3 этана C2H6 (н. у.).
2C2H6 + 7O2 = 4CO2 + 6H2O
V(C2H6) = 10 м3 = 10000 л
n(C2H6) = V(C2H6)/Vm = 10000/22,4 = 446,43 (моль)По уравнению реакции :
C2H6 O2
446,43 моль x моль
2 молекулы 7 молекул
x = n(O2) = 446,43·7/2 = 1562,5 (моль)V(O2) = n· Vm = 1562,5·22,4 = 35000 (л) = 35 (м3)
Ответ. 35 м3.
Тест
1. При взаимодействии хлора и 500 л водорода получили хлороводород, объем которого (н.у.) составил
1) 100 л
2) 200 л
3) 500 л
4) 1000 л
H2 + Cl2 = 2HCl
По уравнению реакции :
H2 HCl
500 л x л
1 молекула 2 молекулы
x = 500·2/1 = 1000 (л)
Правильный ответ 4.2. Для синтеза воды из кислорода и водорода использовали 22,4 л кислорода (н.у.). Количество вступившего в реакцию водорода составило
1) 2 моль
2) 4 моль
3) 6 моль
4) 8 моль
2H2 + O2 = 2H2O
22,4 л = 1 моль
По уравнению реакции :
H2 O2
x моль 1 моль
2 молекулы 1 молекула
x = n(H2) = 2 (моль)
Правильный ответ 1.3. Объем хлора С12 (н. у.), который требуется для синтеза 40 м3 хлороводорода НCl, равен
1) 10 м3
2) 20 м3
3) 30 м3
4) 40 м3
H2 + Cl2 = 2HCl
По уравнению реакции :
Cl2 HCl
x м3 40 м3
1 молекула 2 молекулы
x = 40/2 = 20 (м3)
Правильный ответ 2. §40
-
§40. Оксиды
1. Какие вещества называют оксидами и как их классифицируют? Начертите в тетрадях таблицу и в соответствующих графах запишите перечисленные ниже формулы оксидов : Na2O, N2O5, SiO2, CaO, CrO, CrO3, CuO, Mn2O7, FeO, SO2. Дайте оксидам названия.
Кислотные оксиды
Основные оксидыОксиды – бинарные неорганические соединения, в состав которых входит кислород.
Оксиды подразделяют на основные и кислотные.
Оксиды, которым соответствуют основания, называют основными.
Оксиды, которым соответствуют кислоты, называют кислотными.2. Составьте уравнения реакций, схемы которых даны ниже :
а) Li + ...- → Li2O
б) Са + ..- → CaO
в) С + ...- → CO2
г) Аl + ... - → Al2O3
Д) РH3 + ... - → P2O5 + H2O
е) LiaO + .. - → LiNO3 + H2o
ж) CuO + ... - → СuCl2 + H2O
з) Li2O + ... - → LiOH
и) P2O5 + ... - → H3PO4
к) S03 + ... - → Na2SO4 + ...а) 4Li + O2 ⟶ 2Li2O
б) 2Ca + O2 ⟶ 2CaO
в) C + O2 ⟶ CO2
г) 4Al + 3O2 ⟶ 2Al2O3
д) 2PH3 + 4O2 ⟶ P2O5 + 3H2O
е) Li2O + 2HNO3 ⟶ 2LiNO3 + H2O
и) P2O5 + 3H2O ⟶ 2H3PO4
к) SO3 + 2NaOH ⟶ Na2SO4 + H2O3. Напишите формулы оксидов, которым соответствуют следующие кислоты : H2SO4, H2SO3, H2CO3, H2SiO3, HMnO4, H3BO3.
SO3, SO2, CO2, SiO2, Mn2O7, B2O3
4. Напишите уравнения химических реакций, соответствующие следующим превращениям :
а) Са → СаО → Са(ОН)2
б) Си → СиО → CuSO4
в) Р → P2O5 → H3РO4
г) SO3 + ... → K2SO4 + ...
д) N2O5 + LiOH → ...
е) P2O5 + ... → Ca3(РO4)2 + ...а) 2Ca + O2 ⟶ 2CaO
CaO + H2O ⟶ Ca(OH)2
б) 2Cu + O2 t⟶ CuO
CuO + H2SO4 ⟶ CuSO4 + H2O
в) 4P + 5O2 ⟶ 2P2O5
P2O5 + 3H2O ⟶ 2H3PO4
г) SO3 + 2KOH ⟶ K2SO4 + H2O
д) N2O5 + 2LiOH ⟶ 2LiNO3 + H2O
е) P2O5 + 3Ca(OH)2 t⟶ Ca3(PO4)2 + 3H2O5. Перечислите некоторые отрасли экономики, в которых применяют оксиды. Приведите примеры.
Электроэнергетика – вода в паровых турбинах на электростанциях.
Топливная промышленность – оксид магния используется в качестве добавки к топливам, эффективно снижающей коррозию промышленного и котельного оборудования.
Чёрная металлургия – Fe2O3 и Fe3O4 входят в состав руд, из которых получают чугун и сталь.
Цветная металлургия – из оксида алюминия, входящего в состав глинозёма, получают чистый алюминий.
Оружестроение – термитная смесь (смесь алюминия с оксидом железа (III)) используется в зажигательных снарядах.
Промышленность строительных материалов – оксид кальция используется для получения гашеной извести Ca(OH)2, которая применяется для производства строительных смесей.
Стекольная промышленность – оксид кремния (IV) используется для производства стёкол.
Пищевая промышленность – оксид магния используется как добавка, препятствующая слеживанию и комкованию.
6 Выведите химическую формулу оксида, если известно, что натрий с кислородом соединяется в массовом отношении 2,3 : 0,8.
Дано:
m(Na) : m(O) = 2.3 : 0.8
NaxOy = ?Решение
m(Na) : m(O) = x*Ar(Na) : y*Ar(O) = 2.3 : 0.8
(23*x)/(16*y) = 2.3/0.8
(1.4375*x)/y = 2.875/1
x : y = 2 : 1Соответственно формула: Na2O
Ответ: Na2O7 Напишите уравнение реакции оксида фосфора(V) с избытком воды и вычислите соотношение масс элементов в реагирующих веществах.
P2O5 + 3H2O = 2H3PO4
P2O5 m(P) : m(O) = (2·30) : (5·16) = 60 : 80 = 3 : 4
H2O m(H) : m(O) = (2·1) : (16) = 2 : 16 = 1 : 8
H3PO4 m(H) : m(P) : m(O) = (3·1) : (30) : (4·16) = 3 : 30 : 64
Тест
1. Формулы только оксидов приведены в ряду
1) H2SO4, CaO, CuCl2
2) Na2CO3, Na2O, Cl2O7
3) CO2, Li2O, Al2O3
4) KOH, K2O, BaO
H2SO4 – кислота, CuCl2 – соль, поэтому ответ 1 неверен.
Na2CO3 – соль, поэтому ответ 2 неверен.
KOH – основание, поэтому ответ 4 неверен.
Правильный ответ 3.2. Формулы только основных оксидов приведены в ряду
1) СO2, А12O3, K2O
2) CaO, BaO, Na2O
3) NO2, MgO, SO2
4) P2O5, Fe2O3, ZnO
CO2 – кислотный оксид, поэтому ответ 1 неверен.
NO2 и SO2 – кислотные оксиды, поэтому ответ 3 неверен.
P2O5 – кислотный оксид, поэтому ответ 4 неверен.
Правильный ответ 2.3. Два кислотных оксида указаны в пункте
1) МnO2 и ZnO
2) Fe2O3 и СO2
3) SO3 и СrO3
4) P2O5 и Na2O
ZnO, Fe2O3, Na2O – основные оксиды, поэтому ответы 1, 2, 4 неверны.
Правильный ответ 3.4. Из приведённых уравнений химических реакций выберите eравнение, которое не характеризует свойство кислотных оксидов.
1) SO3 + H2O = H2SO4
2) SO3 + Na2O = Na2SO4
3) SO3 + 2NaOH = Na2SO4 + H2O
4) H2SO4 = SO3 + H2O
Кислотные оксиды реагируют с водой, основными оксидами и основаниями, поэтому ответы 1,2,3 неверны.
Правильный ответ 4.5. Установите соответствие между формулой оксида и формулой cоответствуюшего ему основания или кислоты.
Правильный ответ 1-В, 2-А, 3-Г, 4-Б. §41
-
§41. Гидроксиды. Основания
1. Как классифицируют гидроксиды? Напишите три формулы гидроксидов и назовите их.
Основаниями называют сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими группами атомов OH. Гидроксиды разделяются на амфотерные и основания.
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Cu(OH)2 – гидроксид меди (II)
Zn(OH)2 – гидроксид цинка2. Напишите уравнения реакций, при помощи которых можно получить : а) растворимое основание; б) практически нерастворимое основание. Укажите тип каждой реакции.
а)
2Na + 2H2O = 2NaOH + H2↑ – замещения
CaO + H2O = Ca(OH)2 – соединения
K2O + H2O = 2KOH – соединенияб)
MgO + H2O = Mg(OH)2 – соединения
FeSO4 + 2KOH = K2SO4 + Fe(OH)2↓ – обмена
CuCl2 + 2NaOH = 2NaCl + Cu(OH)2↓ – обмена3. В 1000 г воды при 20°С растворяется : а) 1,56 г гидроксида кальция; б) 38 г гидроксида бария. Определите массовые доли веществ в этих растворах и выразите их в процентах.
А) ω(Ca(OH)2 ) = m(Ca(OH)2)/m(раствора)•100% = 1,56/(1000 + 1,56)•100% = 0,16%
Б) ω(Ba(OH)2 ) = m(Ba(OH)2)/m(раствора)•100% = 38/(1000 + 38)•100% = 3,67% §42
-
§42. Химические свойства оснований
1. Приведите пример реакции нейтрализации. Составьте соответствующее уравнение реакции.
К реакции нейтрализация относится взаимодействие гидроксида меди (II) с соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O2. Напишите уравнения реакций, при помощи которых можно осуществить превращения :
Са → СаО → Са(ОН)2 → СаCl2
Сu → СuО → СuCl2 → Сu
Сu <- СuО → CuSO42Ca + O2 ⟶ 2CaO
CaO + H2O ⟶ Ca(OH)2
Ca(OH)2 + 2HCl ⟶ CaCl2 + 2H2O
2Cu + O2 t⟶ 2CuO
CuO + 2HCl ⟶ CuCl2 + H2O
CuCl2 + Fe ⟶ Cu + FeCl2
CuO + H2 t⟶ Cu + H2O
CuO + H2SO4 ⟶ CuSO4 + H2O3. Объясните, какое свойство гашёной извести позволяет использовать её в строительстве как связующий материал. Ответ подтвердите уравнением реакции.
Смесь гашёной извести с кварцевым песком используется в некоторых строительных растворах потому, что происходит химическая реакция с образованием нерастворимого силиката кальция:
Ca(OH)2 + SiO2 = CaSiO3 + H2OТакже гашеную известь используют для самовосстанавливающегося бетона, при возникновении небольшой трещины в неё попадает углекислый газ который вступает в реакцию с гашеной известью, трещина затягивается благодаря образованию кристаллов карбоната кальция:
Ca(OH)2 + CO2 = CaCO3 + H2O.4. Вычислите массу серной кислоты, необходимой для нейтрализации раствора, содержащего 10 г гидроксида натрия.
H2SO4 + 2NaOH = Na2SO4 + 2H2O
n(NaOH) = m/M = 10/40 = 0,25 (моль)
По уравнению реакции :
H2SO4 NaOH
x моль 0,25 моль
1 молекула 2 молекулы
x = n(H2SO4) = 0,25/2 = 0,125 (моль)
m(H2SO4) = n·M = 0,125·98 = 12,25 (г)
Ответ. 12,25 г.5.Расположите соединения, формулы которых даны ниже, в порядке возрастания содержания в них железа : a) Fe3O4; б) Fe(OH)3; в) FeSO4; г) FeO; д) Fe2O3.
А) Fe3O4
ω(Fe) = (3Ar(Fe))/M(Fe3O4)•100% = 168/232•100% = 72,41%Б) Fe(OH)3
ω(Fe) = (Ar(Fe))/M(Fe(OH)3)•100% = 56/107•100% = 52,34%В) FeSO4
ω(Fe) = (Ar(Fe))/M(FeSO4)•100% = 56/152•100% = 36,84%Г) FeO
ω(Fe) = (Ar(Fe))/M(FeO)•100% = 56/152•100% = 77,78%Д) Fe2O3
ω(Fe) = (2Ar(Fe))/M(Fe2O3)•100% = 112/160•100% = 70%Таким образом, вещества в порядке увеличения содержания железа :
FeSO4 → Fe(OH)3 → Fe2O3 → Fe3O4 → FeO
Тест
1. Формулы только оснований приведены в ряду
1) Na2CO3, NaOH, NaCl
2) KNO3, HNO3, КОН
3) КОН, Mg(OH)2, Cu(OH)2
4) НСl, ВаCl2, Ва(ОН)2
KOH – гидроксид калия
Mg(OH)2 – гидроксид магния
Cu(OH)2 – гидроксид меди
Правильный ответ 3.2. Индикатор лакмус изменяет свой цвет в щелочной среде
1) на фиолетовый
2) на красный
3) на синий
4) на бесцветный
В щелочной среде лакмус становится синим (в кислой – красным, в нейтральной – фиолетовым).
Правильный ответ 3.3. Вставьте в схемы реакций нейтрализации недостающие формулы веществ.
1) ... + ... — → Mg(NO3)2 + H2O
2) ... + ... — → MgCl2 + H2O
3) ... + ... — → К3РO4 + H2O
4) ... + ... — → Na2S + H2O1) Mg(ОН)2 + НNO3 → Mg(NO3)2 + H2O
2) Mg(ОН)2 + НCl → MgCl2 + H2O
3) КОН + H3РO4 → К3РO4 + H2O
4) NaON + H2S → Na2S + H2O NaON + H2S4. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
1) NaOH + СO2
2) NaOH + H2SO4
3) Fe(OH)2 + HCl
4) Fe(OH)2
А. FeO + H2O
Б. Na2CO3 + H2O
B. Na2SO4 + H2O
Г. FeCl2 + H2O
Правильный ответ 1-Б, 2-В, 3-Г, 4-А. §43
-
§43. Амфотерные оксиды и гидроксиды
1. Что означает слово «амфотерный»?
Понятие «амфотерность» применяется к веществу (например, оксиду, гидроксиду), если оно проявляет как основные, так и кислотные свойства. В данном случае амфотерность обозначает двойственность свойств, из-за которой вещество нельзя отнести ни к основному, ни к кислотному типу.2. В чём особенность химических свойств амфотерных оксидов?
Так, оксид алюминия (III) проявляет основные свойства, т.е. реагирует с кислотными оксидами и кислотами :
Al2O3 + 3SO3 → Al2(SO4)3
Al2O3 + 6HCl → 2 AlCl3 + 3H2O
Но, в то же время, Al2O3 проявляет и кислотные свойства, т.е. реагирует с основными оксидами и щелочами :
Al2O3 + Na2O → 2Na3AlO3
Al2O3 + 2NaOH + 3H2O → 2Na(Al(OH)4)
Значит, оксид алюминия – амфотерный оксид.3. Напишите уравнение реакции, протекающей : а) между оксидом алюминия и оксидом серы(VI); б) между оксидом алюминия и оксидом кальция.
Оксид алюминия является амфотерным, поэтому реагирует как с кислотными, так и основными оксидами с образованием солей :
а) Al2O3 + 3SO3 = Al2(SO4)3
б) Al2O3 + CaO = 2Ca(AlO2)24. Допишите уравнения химических реакций.
1) Ве(ОН)2 + NaOH - → сплавление ... + ...
2) Ве(ОН)2 + НСl — → ... + ...1) Be(OH)2 + 2NaOH сплавление⟶ Na2BeO2 + 2H2O
2) Be(OH)2 + 2HCl ⟶ BeCl2 + 2H2O5. Раствору, содержащему избыток хлорида железа(III), прилили раствор, содержащий 240 г гидроксида натрия. Определите массу и количество образовавшегося гидроксида железа(III).
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
n(NaOH) = m/M = 240/40 = 6 (моль)По уравнению реакции :
NaOH Fe(OH)3
6 моль x моль
3 молекулы 1 молекула
x = n(Fe(OH)3) = 6·1/3 = 2 (моль)
m(Fe(OH)3) = n· M = 2· 107 = 214 (г)Ответ. 2 моль, 214 г.
Тест
1. Формулы только амфотерных оксидов приведены в ряду
1) СO2, Na2O, Fe2O3
2) ВеО, Аl2O3, ZnO
3) P2O5, MgO, SO2
4) K2O, CuO, SiO2
Бериллий, алюминий и цинк – амфотерные элементы, поэтому их оксиды тоже амфотерны.
Правильный ответ 2.2. Амфотерные оксиды
1) взаимодействуют только со щелочами
2) взаимодействуют только с кислотами
3) взаимодействуют и с кислотами, и со щелочами
4) не взаимодействуют ни с кислотами, ни со щелочами
Амфотерные оксиды сочетают в себе и основные свойства (реагируют с кислотами), и кислотные свойства (реагируют со щелочами).
Правильный ответ 3.3. Из приведенных уравнений химических реакций выберите те, которые характеризуют амфотерный характер гидроксида.
1) K2O + H2SO4 = K2SO4 + H2O
2) Ве(ОН)2 + 2НСl = ВeCl2 + 2H2O
3) КОН + HCl = КСl + H2O
4) Ве(ОН)2(тв.) + 2КОН(тв.) = K2ВеO2 + H2O
Амфотерный характер гидроксида характеризуют его реакции с кислотами и щелочами.
Правильный ответ 2,4. §44
-
§44. Кислоты
1. Какие вещества называют кислотами?
Кислотами называют сложные вещества, состоящие из атомов водорода (которые могут замещаться на атомы металлов) и кислотных остатков.
2. Составьте структурные формулы следующих кислот: а) угольной; б) бромоводородной НВr; в) сернистой H2SO3; г) хлорной НСlO4. Проверьте выполнение этого задания у соседа по парте.
а) H-O-C-O-H
||
O
б) H-Br
в) HO-S-OH
||
O
O-H
|
г) O=Cl=O
||
O3. Определите валентность кислотных остатков следующих кислот : H2S, HBr, HNo3, H2СO3, НМnO4, H3РO4, H2SO4.
Водород H в кислотах проявляет валентность I. Это означает, что 1 атом водорода может образовать только одну связь с кислотным остатком. Следовательно, валентность кислотного остатка будет соответствовать числу атомов водорода в кислоте :
Кислота Число атомов водорода (в одной молекуле кислоты) Валентность кислотного остатка
H2S 2 II
HBr 1 I
HNO3 1 I
H2CO3 2 II
HMnO4 1 I
H3PO4 3 III
H2SO4 2 II4. Выведите химическую формулу соединения, в состав которого входят 3,95 массовой части химического элемента селена (Ar(SE)) = 79) и 0,1 массовой части водорода.
HxSey
x/79y = 0,1/3,95
x/y = (0,1·79)/(3,95) = 2/1
H2Se
Тест
1. Формулы ТОЛЬКО кислот приведены в ряду
1) HCI, NaCl, HNO3
2) H2SO3, H2SO4, H2S
3) Ca(OH), H3PO4, Ca3(PO4)2
4) Na2O, NaNO3, HNO3
H2SO3 – сернистая кислота
H2SO4 – серная кислота
H2S – сероводородная кислота
Правильный ответ 2.2. Валентность кислотного остатка серной кислоты равна
1) I
2) II
3) III
4) IV
Ответ 2) II3. Установите соответствие между формулой кислоты и ее на званием.
1) НNO
2) НСl
3) H2SO4
4) H2SO3
А. хлороводородная
Б. сернистая
В. азотная
Г. серная
Д. азотистая
Правильный ответ 1-В, 2-А, 3-Г, 4-Б. §45
-
§45. Химические свойства кислот
1. В трёх сосудах без этикеток находятся белые кристаллы лимонной кислоты, сахара и поваренной соли. Как установить в домашних условиях, где какое вещество?
Лимонная кислота, сахар и хлорид натрия – не только химические реактивы, но и ингредиенты, используемые при приготовлении пищи. Поэтому в домашних условиях их допустимо пробовать на вкус и легко различить. Кроме того, лимонную кислоту можно распознать с помощью еще одного бытового ингредиента – пищевой соды : выделение газа указывает на то, что сода прореагировала именно с кислотой :
H + + NaHCO3 → Na + + H2O + CO2↑2. Начертите в тетради приведённую ниже таблицу. В соответствующих графах запишите по три уравнения реакций, в которых участвуют или образуются кислоты.
Реакции
разложения
соединения
замещения
обмена3. Какие из веществ, формулы которых приведены, реагируют с соляной кислотой : а) СuО; б) Сu в) Сu(ОН)2; г) Ag; д) Аl(ОН)3?
а) СuО + 2HCl
б) Сu + HCl
в) Сu(ОН)2 + 2HCl
г) Ag + HCl
д) Аl(ОН)3 + 3HClа) CuO + 2HCl ⟶ CuCl2 + H2O
б) Cu + HCl ⇸ реакция не идет, т. к. медь в ряду напряжений металлов стоит после водорода.
в) Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2O
г) Ag + HCl ⇸ реакция не идет, т. к. серебро в ряду напряжений металлов стоит после водорода.
д) Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O4. Впишите в схемы химических реакций недостающие формулы веществ.
1) ... + ... — → Mg(NO3)2 + H2O
2) ... + ... — → MgCl2 + H2
3) ... + ... — → К3РO4 + H2O
4) ... + ... — → Na2S + H2O1) MgO + 2HNO3 ⟶ Mg(NO3)2 + H2O
2) Mg + 2HCl ⟶ MgCl2 + H2↑
3) 3KOH + H3PO4 ⟶ K3PO4 + 3H2O
4) 2NaOH + H2S ⟶ Na2S + 2H2O5. В реакции алюминия с серной кислотой образовалось 3,42 г сульфата алюминия. Определите массу и количество (моль) алюминия, вступившего в реакцию.
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
n(Al2(SO4)3) = m/M = 3,42/342 = 0,01 (моль)По уравнению реакции :
Al Al2(SO4)3
x моль 0,01 моль
2 молекулы 1 молекула
x = n(Al) = 0,02 (моль)
m(Al) = n· M = 0,02 · 27 = 0,54 (г)Ответ. 0,02 моль, 0,54 г.
§46
-
§46. Соли
1. Напишите формулы карбоната магния, гидрокарбоната железа(II), сульфата железа(III), гидрофосфата кальция, основного хлорида магния.
Карбонат магния : MgCO3
Гидрокарбонат железа (II) : Fe(HCO3)2
Сульфат железа (III) : Fe2(SO4)3
Гидрофосфат кальция : Ca(HCO3)2
Основный хлорид магния : MgOHCl2. Даны химические формулы веществ : HBr, NaHSO4, Cu2O, Fe(OH)3, Fe(NO3)3, Ca(HCO3)2, N2O5, H3BO3, Li2O, SO2, Ba(OH)2, Ca3(P04)2, Cu(OH)2. Начертите в тетради таблицу (см. с. 160) и поместите формулы в соответствующие графы.
Оксиды
основные
кислотныеОснования
растворимые
нерастворимыеКислоты
Соли
средние
кислые3. Назовите следующие соли : NaCl, Al(NO3)3, K3PO4, Na2SO4, Na2S, Na2SO3, FeSO4, AgNO3, Fe2(SO4)3, Na2CO3, NaHCO3.
NaCl хлорид натрия,
Al(NO3)3 нитрат алюминия,
K3PO4 фосфат калия,
Na2SO4 сульфат натрия,
Na2S сульфид натрия,
Na2SO3 сульфит натрия,
FeSO4 сульфат железа II,
AgNO3 нитрат серебра,
Fe2(SO4)3 сульфат железа III,
Na2CO3 карбонат натрия,
NaHCO3 гидрокарбонат натрия4. Составьте схему «Получение солей» и проиллюстрируйте её уравнениями химических реакций. Обсудите итог работы с соседом по парте.
Взаимодействие металла с неметаллом:
Mg + S ⟶ MgS
3Ca + 2P ⟶ Ca3P2Взаимодействие металла с кислотой:
Zn + H2SO4 ⟶ ZnSO4 + H2↑
Fe + 2HCl ⟶ FeCl2 + H2↑Взаимодействие металла с солью:
CuSO4 + Fe ⟶ FeSO4 + Cu
Cu + 2AgNO3 ⟶ Cu(NO3)2 + 2AgВзаимодействие щелочей с неметаллами:
2NaOH + Cl2 ⟶ NaClO + KCl + H2O
6KOH + 3I2 t ⟶ KIO3 + 5KI + 3H2OВзаимодействие основного оксида с кислотным оксидом:
3K2O + P2O5 ⟶ 2K3PO4
CaO + SiO2 ⟶ CaSiO3Взаимодействие основного оксида с кислотой:
CuO + H2SO4 ⟶ CuSO4 + H2O
Na2O + H2S ⟶ Na2S + H2OВзаимодействие щелочи с кислотным оксидом:
2NaOH + CO2 ⟶ Na2CO3 + H2O
2KOH + SO3 ⟶ K2SO4 + H2OВзаимодействие основания с кислотой:
NaOH + HCl ⟶ NaCl + H2O
Fe(OH)2 + H2SO4 ⟶ FeSO4 + 2H2OВзаимодействие соли и щелочи:
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓
FeCl3 + 3KOH ⟶ 3KCl + Fe(OH)3↓Взаимодействие соли c кислотой:
Na2CO3 + 2HCl ⟶ NaCl + H2O + CO2↑
K2S + 2HNO3 ⟶ 2KNO3 + H2S↑Взаимодействие двух солей (если образуется осадок или газ):
BaCl2 + Na2SO4 ⟶ 2NaCl + BaSO4↓
AgNO3 + KCl ⟶ KNO3 + AgCl↓Разложение кислых солей при нагревании:
Ca(HCO3)2 t ⟶ CaCO3 + CO2↑ + H2O
2KHSO3 t ⟶ K2SO3 + SO2↑ + H25.Напишите уравнения реакций нейтрализации, в результате которых образуются следующие соли : а) АlСl3; б) BaSO4; в) Ba(NO3)2; г) Na3PO4; д) NaNO3; е) NaHSO4; ж) КH2РO4; з) K2НРO4.
а) Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
б) Ba(OH)2 + H2SO4 ⟶ BaSO4↓ + 2H2O
в) Ba(OH)2 + 2HNO3 ⟶ Ba(NO3)2 + 2H2O
г) 3NaOH + H3PO4 ⟶ Na3PO4 + 3H2O
д) NaOH + HNO3 ⟶ NaNO3 + H2O
е) NaOH + H2SO4 ⟶ NaHSO4 + H2O
ж) KOH + H3PO4 ⟶ KH2PO4 + H2O
з) 2KOH + H3PO4 ⟶ K2HPO4 + 2H2O
Тест
1. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3
2) Cu(NO3)2
3) Al2(SO4)3
4) K2СO3
А. нитрат меди(II)
Б. карбонат калия
В. хлорид железа(III)
Г. сульфат алюминия
Правильный ответ 1-В, 2-А, 3-Г, 4-Б.2. Установите соответствие между химической формулой соли и классом, к которому она относится.
1) NaHCO3
2) Сu(ОН)Cl
3) Na2CO3
4) Na2|Zn(OH)4|
А. средние соли
Б. кислые соли
В. основные соли
Г. комплексные соли
Правильный ответ 1-Б, 2-В, 3-А, 4-Г. §47
-
§47. Химические свойства солей
1. Составьте уравнения химических реакций, схемы которых даны ниже :
1) Са + ... — → CaSO4 + H2
2) SO3 + ... — → CaSO4
3) N2O5 + ... — → Ca(NO3)2
4) СаО + ... — → СаСO3
5) Са(OН)2 + ... — → CaSO4 + H2O
6) P2O5 + ... — → Ca3(РO4)2 + H2OCa + H2SO4 ⟶ CaSO4 + H2↑
SO3 + CaO ⟶ CaSO4
N2O5 + CaO ⟶ Ca(NO3)2
CaO + SO2 ⟶ CaSO3
Ca(OH)2 + SO3 ⟶ CaSO4 + H2O
P2O5 + 3Ca(OH)2 ⟶ Ca3(PO4)2 + 3H2O2. С какими веществами реагирует хлорид кальция, если получается : а) сульфат кальция; б) карбонат кальция; в) фосфат кальция; г) гидроксид кальция; д) хлороводород? Напишите уравнения реакций и поясните, почему они идут до конца.
Реакции идут до конца, т.к. выделяется газ или образуется осадок.
а) CaCl2 + Na2SO4 ⟶ 2NaCl + CaSO4↓
б) CaCl2 + K2CO3 ⟶ 2KCl + CaCO3↓
в) 3CaCl2 + 2H3PO4 ⟶ 6HCl + Ca3(PO4)2↓
г) CaCl2 + 2KOH ⟶ 2KCl + Ca(OH)2↓
д) CaCl2 + 2NaOH ⟶ 2NaCl + Ca(OH)2↓3. Составьте уравнения реакций, соответствующие следующим превращениям :
а) Са → СаО → Са(OН)2 → Ca(NO3)2 → CaSO4
б) С → СO2 → Na2CO3 → СO2 → СаСO3
в) Fe2(SO4)3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3
г) P → P2O5 → H3PO4 → Ca3(PO4)2 → H3PO4 → Ca(H2PO4)2а)
2Ca + O2 ⟶ 2CaO
CaO + H2O ⟶ Ca(OH)2
Ca(OH)2 + 2HNO3 ⟶ Ca(NO3)2 + 2H2O
Ca(NO3)2 + K2SO4 ⟶ 2KNO3 + CaSO4↓б)
C + O2 ⟶ CO2↑
CO2 + 2NaOH ⟶ Na2CO3 + H2O
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑
CO2 + Ca(OH)2 ⟶ CaCO3 + H2Oв)
Fe2(SO4)3 + 6NaOH ⟶ 3Na2SO4 + 2Fe(OH)3↓
2Fe(OH)3 t⟶ Fe2O3 + 3H2O
Fe2O3 + 3H2SO4 ⟶ Fe2(SO4)3 + 3H2Oг)
4P + 5O2 ⟶ 2P2O5
P2O5 + 3H2O ⟶ 2H3PO4
2H3PO4 + 3Ca(OH)2 ⟶ Ca3(PO4)2 + 3H2O
Ca3(PO4)2 + 6HNO3 ⟶ 3Ca(NO3)2 + 2H3PO4
2H3PO4 + Ca(OH)2 ⟶ Ca(H2PO4)2 + 2H2O4. По уравнению реакции определите, в каких мольных отношениях следует смешать гидроксид кальция с фосфорной кислотой, чтобы произошла реакция нейтрализации.
2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2 + 6H2O
H3PO4 Ca(OH)2
x моль y моль
2 молекулы 3 молекулы
x : y = 2 : 35. Заполните таблицу, вписав в неё по 2—3 формулы веществ, относящихся к каждому классу. Обсудите это задание с соседом по парте.
Простые вещества
Металлы НеметаллыСложные вещества
Оксиды
Гидроксиды
Кислоты
СолиПростые вещества Сложные вещества Металлы Неметаллы Оксиды Гидроксиды Кислоты Соли Na S CaO KOH HCl NaCl Al P ZnO Fe(OH)3 H2SO4 FeCl2 Fe O2 P2O5 Cu(OH)2 H3PO4 K2CO3 §48
-
§48. Практическая работа 6. Решение экспериментальных задач по теме "Важнейшие классы неорганических соединений"
Решаем логические задачи экспериментально по плану в учебнике.
§49
-
§49. Классификация химических элементов
1. Что такое классификация?
Классификация химических веществ – разделение их по определенным группам (классам) на основании каких-либо общих свойств и признаков.
Так, например, классификация неорганических веществ (химических соединений) – разделение их на классы, такие как окиды, гидроксиды, кислоты, соли. Классы делят на группы (например оксиды могут быть основными, кислотными или амфотерными).2. На основании каких признаков вещество можно отнести к металлам?
Металлы имеют ряд объединяющих признаков : не считая общих физических свойств (металлический блеск, ковкость, пластичность, электропроводность, теплопроводность и т.д.) металлы проявляют сильные восстановительные свойства; имеют от одного до трех электронов на внешнем энергетическом уровне; образуют основные соединения : основные оксиды, соответствующие им гидроксиды, способные реагировать с кислотными оксидами и кислотами.
3. Вспомните, какими химическими свойствами обладают оксиды и гидроксиды элементов цинка и алюминия. Напишите соответствующие уравнения химических реакций.
При сплавлении : Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4]
При сплавлении : Al(OH)3 + NaOH = NaAlO2 + 2H2O4. Приведите примеры, подтверждающие, что химические элементы можно распределить по отдельным группам.
Химические элементы можно распределить по определенным группам по схожести их химических свойств.
Например, по характеру взаимодействия металла с водой можно выделить семейство щелочных металлов :Элементы семейства щелочноземельных элементов образуют оксиды, которые взаимодействуют с водой с образованием щелочной среды :
RO + H2O = R(OH)2
Где R – щелочноземельный металл
Галогены образуют бинарные соли при взаимодействии с металлами, поэтому они тоже выделяются как отдельная группа :
2Na + Cl2 = 2NaCl
2K + Br2 = 2KBr5. Химический элемент галлий Ga сходен с элементом алюминием Аl, а селен Se — с серой S. Напишите формулы оксидов, гидроксидов солей, в состав которых входят эти элементы. Составьте уравнения реакций, характеризующих химические свойства соответствующих соединений.
Ga2O3 – оксид галлия (III).
Реагирует с оксидами щелочных металлов:
Ga2O3 + Na2O t ⟶ 2NaGaO2Реагирует с кислотными оксидами:
Ga2O3 + 3SO3 ⟶ Ga2(SO4)3Реагирует с щелочами:
Ga2O3 + 2NaOH + 3H2O ⟶ 2Na[Ga(OH)4]Реагирует с кислотами:
Ga2O3 + 6HCl ⟶ 2GaCl3 + 3H2OGa(OH)3 – гидроксид галлия (III).
Реагирует с щелочами:
Ga(OH)3 + NaOH ⟶ NaGaO2 + H2O
Ga(OH)3 + NaOH t (сплавл.) ⟶ Na[Ga(OH)4]Реагирует с кислотами:
Ga(OH)3 + 3HCl ⟶ GaCl3 + 3H2OSeO2 – оксид селена (IV).
Реагирует с водой:
SeO2 + H2O ⟶ H2SeO3Реагирует с основными оксидами:
SeO2 + Na2O ⟶ Na2SeO3Реагирует с основаниями:
SeO2 + 2NaOH ⟶ Na2SeO3 + H2OH2SeO3 – селенистая кислота.
Реагирует с основными оксидами:
H2SeO3 + Na2O ⟶ Na2SeO3 + H2OРеагирует с щелочами:
H2SeO3 + 2NaOH ⟶ Na2SeO3 + 2H2OSeO3 – оксид селена (VI).
Реагирует с водой:
SeO3 + H2O ⟶ H2SeO4Реагирует с основными оксидами:
SeO3 + Na2O ⟶ Na2SeO4Реагирует с основаниями:
SeO3 + 2NaOH ⟶ Na2SeO4 + H2OH2SeO4 – селеновая кислота.
Реагирует с основными оксидами:
H2SeO4 + Na2O ⟶ Na2SeO4 + H2OРеагирует с щелочами:
H2SeO4 + 2NaOH ⟶ Na2SeO4 + 2H2O6. В некоторых ядерных реакторах жидкий натрий используют в качестве теплоносителя – вещества, переносящего тепло, вырабатываемое реактором. В чём опасность для окружающей среды такого использования натрия? Для ответа на этот вопрос воспользуйтесь Интернетом или дополнительной литературой.
Использование натрия в качестве теплоносителя в ядерных реакторах, является опасным для окружающей среды, т. к. данный металл обладают большой химической активностью, так при контакте с водой реакция может протекать со взрывом, что может перевести к разрушению реактора, и выбросу радиоактивных изотопов в атмосферу и окружающее пространство.
Тест
1. К металлическим свойствам не относят
1) твёрдость
2) ковкость
3) металлический блеск
4) газообразное состояние при нормальных условиях
При нормальных условиях большинство металлов – твердые блестящие ковкие вещества.
Правильный ответ 4.2. Только щелочные металлы указаны в ряду
1) Li, Ва, Na, К
2) Li, Na, К, Rb
3) К, Са, Ва, Rb
4) Li, Na, Sr, Ca
Щелочные металлы – металлы I группы главной подгруппы таблицы Менделеева.
Правильный ответ 2.3. Установите соответствие между общей формулой высших оксидов и молекулярной формулой вещества.
1) R2O А.SO3
2) RO Б.K2O
3) RO2 В.СаО
4) RO3 Г.SiO,
Правильный ответ 1-Б, 2-В, 3-Г, 4-А. §50
-
§50. Периодический закон Д. И. Менделеева
1. Какая характеристика атома была положена Д. И. Менделеевым в основу его системы элементов? Как Менделеев формулировал периодический закон? Какие трудности возникали у него при обосновании этого закона?
В основу системы элементов Д.И.Менделеевым была положена атомная масса элементов.
В 1869 году он сформулировал периодический закон : свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Однако при обосновании этого закона возникли следующие вопросы :
• Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически?
• Почему в некоторых случаях (аргон и калий, кобальт и никель, теллур и иод) нужно было отступить от общего принципа и расположить эти элементы не в порядке возрастания их относительных атомных масс?
Менделеев предвидел, что эти вопросы будут решены при выявлении сложной структуры атомов.2. Почему Д. И. Менделеев назвал открытый им закон периодическим? Ответ подтвердите анализом свойств химических элементов.
Менделеев назвал закон периодическим, т.к. располагая элементы в порядке возрастания относительных атомных масс, он наблюдал периодическое изменение их свойств :
• В ряду литий-фтор усиливаются неметаллические свойства, ослабевают металлические, в ряду литий-углерод возрастает валентность
• Начиная с натрия, эти тенденции в изменении свойств и валентности повторяются аналогично
• Начиная с калия, свойства снова начинают повторяться по аналогии с предыдущими рядами, что уже позволяет сделать вывод о периодичности изменений.3. Проведено сплавление 4,05 г оксида цинка ZnO с гидроксидом натрия, взятым в избытке. Определите массу и количество вещества образовавшейся соли.
ZnO + 2NaOH = Na2ZnO2 + H2↑
n(ZnO) = m/M = 4,05/16 = 0,05 (моль)
По уравнению реакции n(ZnO) = n(Na2ZnO2) = 0,05 (моль)m(Na2ZnO2) = n· M = 0,05· 143 = 7,15 (г)
Ответ. 0,05 моль, 7,15 г.
Тест
1. В ряду Na—Mg—Al—Si металлические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
С увеличением номера группы металлические свойства ослабевают, а неметаллические – усиливаются.
Правильный ответ 2.2. В ряду Si—Р—S—Сl неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
С увеличением номера группы металлические свойства ослабевают, а неметаллические – усиливаются.
Правильный ответ 1.3. Подчеркните в каждом ряду элемент, который в большей степени проявляет неметаллические свойства.
1) углерод, фтор
2) кальций, бром
3) кремний, фосфор
4) кислород, фтор
Сильнее неметаллические свойства у элемента, у которого больший номер группы и меньший номер периода. §51
-
§51. Периодическая таблица химических элементов
1. Охарактеризуйте строение периодической таблицы элементов.
Классификацию элементов, предложенную Д.И.Менделеевым, называют периодической системой.
Периодическая таблица, составленная на основе периодического закона, является его графическим изображением.
Периодическая таблица состоит из периодов (горизонтальные ряды) и групп (вертикальные ряды).
В 1-м периоде 2 элемента : водород и гелий.
Во 2-м и 3-м периодах по 8 элементов. Это малые периоды.
В 4-м и 5-м периодах по 18 элементов, в 6-м – 32, 7-й – незавершен. Это большие периоды.
Все периоды начинаются щелочным металлом и заканчиваются благородным газом.
Каждая группа состоит из 2-подгрупп : главной и побочной. В коротком варианте таблицы их 8, в полудлинном – 18, в длинном – 32.2. Что называют периодом? Что общего между малыми и большими периодами? В чём состоит отличие?
Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, называются периодами.
Малые и большие периоды отличаются количеством элементов, входящих в их состав.
В 1-м периоде 2 элемента : водород и гелий.
Во 2-м и 3-м периодах по 8 элементов. Это малые периоды.
В 4-м и 5-м периодах по 18 элементов, в 6-м – 32, 7-й – незавершен. Это большие периоды.
И большие, и малые периоды начинаются щелочным металлом и заканчиваются благородным газом.3. Как изменяются свойства химических элементов : а) в периодах; б) в А-группах?
А) в периодах слева направо ослабевают металлические свойства и усиливаются неметаллические (например, 3-й период : натрий – типичный металл, хлор – типичный неметалл)
Б) в A-группах сверху вниз ослабевают неметаллические свойства и усиливаются металлические (например, I A-подгруппа : металлические свойства у цезия выражены сильнее, чем у лития).4. Чем полудлинный вариант периодической таблицы отличается от классического (короткого) варианта?
В классическом варианте 8 групп, которые разделены на две подгруппы (главную и побочную), а в полудлинном варианте таблицы показаны все 18 групп (в ней между элементами IIА- и IIIА-групп размещаются 10 элементов Б-групп).
Тест
1. Формула летучего водородного соединения химического элемента H3R. В периодической таблице этот элемент находится
1) в III группе
2) в V группе
3) в VII группе
4) в IV группе
Правильный ответ 2.2. Установите соответствие между номером периода и числом элементов в периоде.
1) 1-й период
2) 2-й и 3-й периоды,
3) 4-й и 5-й периоды,
4) 6-й период
Правильный ответ 1-В, 2-Г, 3-А, 4-Б. §52
-
§52. Строение атома
1. Какие сведения о строении атома химического элемента можно получить на основании его положения в периодической таблице Д. И. Менделеева?
На основании положения элемента в периодической таблице Д.И.Менделеева, можно узнать :
1) Число протонов (равно порядковому номеру элемента)
2) Число электронов (равно порядковому номеру элемента)
3) Заряд ядра (равно порядковому номеру элемента)
4) Число нейтронов (равно разнице между молярной массой и порядковым номером элемента)
5) Атомную массу
6) Число энергетических уровней (равно номеру периода)
7) Число электронов на внешнем энергетическом уровне (равно номеру группы главной подгруппы)
8) Увеличивается или уменьшается радиус атома элемента по сравнению с соседними элементами (сверху вниз по подгруппе – увеличивается за счет увеличения числа электронных уровней; слева направо по периоду – уменьшается за счет роста заряда ядра при одинаковом количестве энергетических уровней)2. Число каких частиц в ядре атома химического элемента можно узнать по его порядковому номеру?
Порядковый номер элемента в периодической таблице № = e Число электронов = Z Заряд ядра = p Число протонов в ядре
Кроме того, зная порядковый номер элемента и атомную массу, можно найти число нейтронов в ядре :
n = Ar (атомная масса) - p (число протонов в ядре, № в таблице)
Таким образом, номер указывает на число протонов и позволяет посчитать число нейтронов.3. Какое из чисел, приведённых в периодической таблице, указывает на число электронов в электронной оболочке атома данного элемента?
Порядковый номер элемента в периодической таблице Д.И.Менделеева указывает на число электронов в электронной оболочке атомов данного элемента.
Тест
1. Изотопы одного и того же химического элемента различаются
1) числом электронов
2) числом протонов
3) числом нейтронов
4) зарядом ядра
У изотопов одинаковый заряд ядра и одинаковое количество протонов и электронов, они отличаются количеством нейтронов.
Правильный ответ 3.2. Ядро атома Аl содержит
1) 27 протонов и 13 нейтронов
2) 13 протонов и 14 нейтронов
3) 14 протонов и 13 нейтронов
4) 13 протонов и 27 нейтронов
p = 13
p + n = 27
n = 27-p = 27-13 = 14
Правильный ответ 2. §53
-
§53. Распределение электронов по энергетическим уровням
1. Поясните, что называется энергетическим уровнем, и изобразите схемы строения атомов натрия Na, азота N, кальция Са и фосфора Р.
Энергетический уровень (энергетический слой) – совокупность электронов, обладающих одинаковым запасом энергии, которую они поглощают или испускают определенными порциями.
2. Объясните сущность явления периодичности в изменении химических свойств элементов.
Сущность явления периодичности состоит в том, что с возрастанием заряда ядра атомов элементов периодически появляются элементы с одинаковым числом валентных электронов. Этим объясняется периодическая повторяемость свойств химических элементов и их соединений.
Например, свойства лития, натрия и калия объясняются тем, что на наружном энергетическом уровне их атомов имеется по одному валентному электрону.
Тест
1. Сходство в строении атомов химических элементов одной A-группы обусловлено
1) одинаковыми радиусами атомов
2) одинаковыми зарядами ядер атомов
3) одинаковым числом электронов на внешнем электронном слое
4) одинаковым числом электронных слоев
Номер группы главной подгруппы соответствует количеству валентных электронов на внешнем энергетическом уровне атома данного элемента.
Правильный ответ 3.2. Распределение электронов по электронным слоям в атоме элемента 2, 8, 4. Такое распределение электронов соответствует атому
1) углерода
2) алюминия
3) магния
4) кремния
Сумма электронов равна номеру элемента в периодической системе.
2 + 8 + 4 = 14
№14 – это кремний.
Правильный ответ 4.3. Установите соответствие между химическим элементом и числом электронов на внешнем электронном уровне его атома.
1) Na
2) Al
3) S
4) F
А. 6е
Б. 1е
В. 7е
Г. Зе
Номер группы главной подгруппы соответствует количеству валентных электронов на внешнем энергетическом уровне атома данного элемента.
Правильный ответ 1-Б, 2-Г, 3-А, 4-В. §54
-
§54. Значение периодического закона
1. Охарактеризуйте научное и практическое значение периодического закона.
Научное значение периодического закона :
• Были предсказаны элементы, которые были открыты в будущем
• Были рассчитаны и исправлены некоторые неверные значения атомных масс элементов
• Были созданы предпосылки для создания современной теории строения атомов.
Практическое значение периодического закона :
• Знание строения атома и периодичности изменения свойств соединений элементов сделали возможным создание практических методик по синтезу и анализу химических соединений, прогнозирование свойств веществ, которые могут быть использованы в промышленности и в быту, способствовали возникновению и развитию ядерной энергетики.2. На основе теории строения атомов объясните сущность явления периодичности в изменении свойств элементов.
Сущность явления периодичности состоит в том, что с возрастанием заряда ядра атомов элементов периодически появляются элементы с одинаковым числом валентных электронов. Этим объясняется периодическая повторяемость свойств химических элементов и их соединений.
Например, свойства лития, натрия и калия объясняются тем, что на наружном энергетическом уровне их атомов имеется по одному валентному электрону. §55
-
§55. Электроотрицательность химических элементов
1. Что такое электроотрицательность? Используя таблицу 18 и периодическую таблицу, расположите химические знаки перечисленных ниже элементов в порядке возрастания значений электроотрицательности : фосфор, магний, бор, цезий, кислород, кремний, калий, углерод, водород, литий, фтор, сера, алюминий, кальций.
Электроотрицательность – свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях.
Тест
1. В ряду F — Cl — Вг — I с увеличением порядкового номера химического элемента электроотрицательность
1) увеличивается
2) уменьшается
3) не изменяется
4) изменяется периодически
От фтора к иоду электроотрицательность уменьшается.
Правильный ответ 2.2. В ряду C-N-O-F c увеличением порядкового номера химического элемента электроотрицательность
1) увеличивается
2) уменьшается
3) не изменяется
4) изменяется периодически
От углерода к фтору электроотрицательность возрастает.
Правильный ответ 1. §56
-
§56. Основные виды химической связи
1. Объясните, почему численные значения электроотрицательности атомов элементов позволяют судить о виде химической связи, возникающей между ними. Приведите примеры.
Электроотрицательность – свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях.
Т.е. чем выше электроотрицательность одного из участников связи по отношению к другому, тем больше он оттягивает на себя общие электроны, тем более полярна связь.По разности значений электроотрицательности элементов можно судить о том, на сколько она полярна, т. е. можно определить вид химической связи. Рассмотрим несколько примеров:
1) Ковалентная неполярная связь образована атомами одного и того же химического элемента, поэтому разность электроотрицательности будет равна 0.
2) Ковалентная полярная связь образована атомами разных неметаллов, поэтому разность электроотрицательности будет больше 0, но меньше 1,7, например в оксиде углерода (II) она равна 1 (3,5 - 2,5).
3) Ионная связь образована атомами разных неметаллов, поэтому разность электроотрицательности будет больше 1,7, например у хлорида натрия она равна 2,1 (3,0 - 0,9).
2. В тетрадях напишите по три формулы соединений : а) с ионной; б) с ковалентной полярной; в) с ковалентной неполярной связью. Изобразите их электронные формулы.
а) соединения с ионной связью
..
Na+[ : Cl : ]-
..
Хлорид натрия NaCl
..
Ca+2[ : S : ]-2
..
Сульфид кальция CaS
..
K+[ : O : ]-K+
..
Оксид калия K2O
б) соединения с ковалентной полярной связью
..
H : Cl :
..
Хлороводород
..
:C:: O
..
Оксид углерода (II)
..
H : S : H
..
H2S Сероводород
в) соединения с ковалентной неполярной связью
H : H
H2 Водород
.. ..
O : O
.. ..
O2 Кислород
: N ::: N :
N2 Азот3. Изобразите структурные формулы молекул воды и хлороводорода.
H-O-H
H-Cl4. Учитывая значения электроотрицательностей элементов (см. табл. 18), составьте химические формулы и укажите сдвиг общих электронных пар в соединениях : а) лития с азотом; б) кислорода с фтором;
в) углерода с серой; г) углерода с алюминием.а) лития с азотом
Liδ+ → Nδ- ← Liδ+
↑
Liδ+б) кислорода с фтором
Fδ- ← Oδ+ → Fδ-
в) углерода с серой
Sδ- ← Cδ+ → Sδ-
г) углерода с алюминием
Alδ+ → Cδ- ← Alδ+ → Cδ- ← Alδ+ → Cδ- ← Alδ+
§57
-
§57. Степень окисления
1. Что такое степень окисления?
Степень окисления – это условный заряд атома в соединении, рассчитанный исходя из условия, что все связи в соединении ионные.
2. Составьте уравнения окислительно-восстановительных реакций : а) алюминия с кислородом; б) железа с хлором; в) натрия с серой. Укажите окислитель и восстановитель.
3. При взаимодействии водорода с оксидом меди(Н) образовалось 0,1 моль меди. Вычислите : а) массу образовавшейся меди; б) массу и количество вещества оксида меди(II), вступившего в реакцию.
CuO + H2 = H2O + Cu
А) m(Cu) = n· M = 0,1· 64 = 6,4 (г)
Б) n(Cu) = n(CuO) = 0,1 (моль)
m(CuO) = n· M = 0,1· 80 = 8 (г)4. В реакции образовалось 4 г оксида меди(II). Вычислите : а) массу и количество меди, вступившей в реакцию; б) массу и количество израсходованного кислорода.
2Cu + O2 = 2CuO
n(CuO) = m/M = 4/80 = 0,05 (моль)По уравнению реакции :
Cu O2 CuO
x моль y моль 0,05 моль
2 молекулы 1 молекула 2 молекулы
а) x = n(Cu) = 0,05·2/2 = 0,05 (моль)
m(Cu) = n· M = 0,05· 64 = 3,2 (г)
б) y = n(O2) = 0,05·1/2 = 0,025 (моль)
m(O2) = n· M = 0,025· 16 = 0,4 (г)


