 Один из естественных школьных предметом, это предмет химии. Это наука о возможном протекании реакции между химическими элементами. Обычно это процессы окисления или выщелачивания, где при образовании связей получается новое вещество, образующее стабильное состояние для данных условий.
Один из естественных школьных предметом, это предмет химии. Это наука о возможном протекании реакции между химическими элементами. Обычно это процессы окисления или выщелачивания, где при образовании связей получается новое вещество, образующее стабильное состояние для данных условий.
В нашем конкретном случае речь пойдет о ГДЗ ответах для учебника по химии за 9 класс, авторы Г. Е. Рудзитис и Ф. Г. Фельдман, 2019 год издания. Если у вас именно такой учебник, то милости просим к нам на сверку ваших домашних заданий.
Выбираем вкладку по параграфу и сверяемся, а наши ГДЗ точно помогут вам ваших проблемах связанных с домашними работами.
Ответы к учебнику химия 9 класс, Рудзитис:
Кликайте по вкладкам с параграфами, чтобы открыть нужную страницу с ответами.
§1
-
Глава I. Классификация химических реакций.
§1. Окислительно-восстановительные реакции.Задание 1. Определите степени окисления элементов в следующих соединениях: Li2O, Na2O2, H2S, LiH, P2O5, K2Cr2O7.
Ответ:
`overset(+1)(Li)_2overset(-2)(O)`, `overset(+1)(Na)_2overset(-1)(O)_2`, `overset(+1)(H)_2overset(-2)(S)`, `overset(+1)(Li)overset(-1)(H)`, `overset(+5)(P)_2overset(-2)(O)_5`, `overset(+1)(K)_2overset(+6)(Cr)_2overset(-2)(O)_7`.
Задание 2. Докажите, что реакция 2Fe + 3Cl2 = 2FeCl3 является окислительно-восстановительной. Укажите окислитель и восстановитель.
Ответ:
2Fe + 3Cl2 = 2FeCl3 Cl20 + 2ē ⟶ 2Cl- |3 окислитель (восстановление) Fe0 - 3ē ⟶ Fe+3 |2 восстановитель (окисление) Задание 3. Заполните таблицу, приведя по два примера реакций соединения и разложения, которые не являются окислительно-восстановительными. Обсудите таблицу с соседом по парте. Проверьте друг у друга заполненную таблицу.
Ответ:
Тип реакций Примеры реакций, протекающих без изменения степени окисления элементов Реакции соединения P2O5 + 3H2O ⟶ 2H3PO5
NH3 + HCl ⟶ NH4ClРеакции разложения CaCO3 t ⟶ CaO + CO2↑
Cu(OH)2 t ⟶ CuO + H2OЗадание 4. Даны схемы реакций:
а) Zn + Cl2 ⟶ ZnCl2
б) Zn + HCl ⟶ ZnCl2 + H2↑Проставьте над знаками соответствующих химических элементов степени окисления, покажите переход электронов и расставьте коэффициенты.
Ответ:
а) `overset(0)(Zn) + overset(0)(Cl)_2 ⟶ overset(+2)(Zn)overset(-1)(Cl)_2`
Cl20 + 2ē ⟶ 2Cl- 1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 1 восстановитель (окисление)
б) `overset(0)(Zn) + overset(+1)(H)Cl ⟶ overset(+2)(Zn)Cl_2 + overset(0)(H)_2"↑"`H20 + 2ē ⟶ 2H+ 1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 1 восстановитель (окисление) Задание 5. Даны схемы окислительно-восстановительных реакций:
а) CuS + HNO3(разб.) ⟶ Cu(NO3)2 + S + NO + H2O
б) K2SO3 + H2SO4 + KMnO4 ⟶ K2SO4 + MnSO4 + …Составьте уравнения этих реакций, пользуясь алгоритмом, приведённым в параграфе.
Ответ:
3CuS + 8HNO3(разб.) ⟶ 3Cu(NO3)2 + 3S + 2NO + 4H2O
N+5 + 3ē ⟶ N+2 2 окислитель (восстановление) S-2 - 2ē ⟶ S0 3 восстановитель (окисление)
5K2SO3 + 3H2SO4 + 2KMnO4 ⟶ 6K2SO4 + 2MnSO4 + 3H2OMn+7 + 5ē ⟶ Mn+2 2 окислитель (восстановление) S-4 - 2ē ⟶ S+6 5 восстановитель (окисление) Задание 6. В схеме реакции
HNO3 ⟶ H2O + NO2 + O2
расставьте коэффициенты методом электронного баланса.Ответ:
4HNO3 ⟶ 2H2O + 4NO2 + O2
N+5 + 1ē ⟶ N+4 4 окислитель (восстановление) 2O-2 - 4ē ⟶ O20 1 восстановитель (окисление) Тестовые задания
Тест 1. К окислительно-восстановительным реакциям не относится реакция
1) Cu + HNO3 ⟶ Cu(NO3)2 + H2O + NO2
2) CuO + P2O5 ⟶ Cu3(PO4)2
3) CuO + H2 ⟶ Cu + H2O
4) Cu + H2SO4 ⟶ CuSO4 + H2O + SO2
Ответ:2)
`overset(+2)(Cu)overset(-2)(O) + overset(+5)(P)_2overset(-2)(O)_5 ⟶ overset(+2)(Cu)_3(overset(+5)(P)overset(-2)(O)_4)_2`Тест 2. Установите соответствие между окислительно-восстановительным процессом, обозначенным схемой передачи электронов, и схемой химической реакции.
1) S-2 ⟶ S0
2) S+6 ⟶ S+4
3) N+5 ⟶ N+4
4) N-3 ⟶ N0А. HNO3 ⟶ H2O + NO2 + O2
Б. H2S + SO2 ⟶ H2O + S
В. NH3 + O2 ⟶ H2O + NO
Г. NH3 + O2 ⟶ H2O + N2
Д. C + H2SO4 ⟶ CO2 + SO2 + H2Ответ:
1) Б; 2) Д; 3) А; 4) Г.
А. `Hoverset(+5)(N)O_3 ⟶ H_2O + overset(+4)(N)O_2 + O_2`
Б. `H_2overset(-2)(S) + overset(+4)(S)O_2 ⟶ H_2O + overset(0)(S)`
В. `overset(-3)(N)H_3 + O_2 ⟶ H_2O + overset(+2)(N)O`
Г. `overset(-3)(N)H_3 + O_2 ⟶ H_2O + overset(0)(N)_2`
Д. `C + H_2overset(+6)(S)O_4 ⟶ CO_2 + overset(+4)(S)O_2 + H_2` §2
-
§2. Тепловые эффекты химических реакций.
Задание 1. -
Задание 2. Какие данные нужно обязательно указывать при составлении термохимических уравнений? Поясните на конкретных примерах.
Ответ:
В термохимических уравнениях обязательно указывают агрегатное состояние вещества.
2HgO(тв.) = 2Hg(ж.)O + O2(г.) - 180 кДж
2H2(г.) + O2(г.) = 2H2O(г.) + 484 кДжЗадание 3. Какое количество теплоты выделится при сжигании 100 л водорода, взятого при нормальных условиях, в избытке кислорода? Термохимическое уравнение реакции:
2H2(г.) + O2(г.) = 2H2O(г.) + 484 кДжОтвет:
Дано:
`V(H_2) = 100 л`
`Q = ?`
Решение
`2H_(2"(г.)") + O_(2"(г.)") = 2H_2O_("(г.)") + 484" кДж"`
`n(H_2) = (V(H_2))/V_m = 100/22.4 = 4.46" моль"`
`2" моль "H_(2"(г.)")" "—" "484" кДж"`
`4.46" моль "H_(2"(г.)")" "—" "Q`
`Q = (4.46*484)/2 = 1079" кДж"`
Ответ: `Q = 1079" кДж"`.Задание 4. Вычислите, сколько сгорело угля, если при этом выделилось 33520 кДж теплоты.
Ответ:
Дано:
`Q = 33520" кДж"`
`m(C) = ?`
Решение
`C_("(тв.)") + O_(2"(г.)") = CO_(2"(г.)") + 402.24" кДж"`
`1" моль "C_("(тв.)")" "—" "402.24" кДж"`
`n(C)" "—" "33520" кДж"`
`n(C) = (1*33520)/402.24 = 83.3" моль"`
`m(C) = n(C)*M(C) = 12*83.3 = 1000 г = 1" кг"`
Ответ: `m(C) = 1" кг"`. §3
-
§3. Скорость химических реакций.
Задание 1. Что такое скорость химической реакции и как её определяют?
Ответ:
Скорость реакции – изменение концентрации прореагировавшего или образующегося вещества в единицу времени.
`υ = (Δc)/(Δt)`, или `υ = (c_1 - c_2)/(t_2 - t_1)`Задание 2. Приведите примеры реакций, замедление или ускорение которых имеет положительное или отрицательное значение для производства либо в быту.
Ответ:
Замедление коррозии металлов имеет положительное значение.
Замедление брожения в хлебобулочном производстве имеет отрицательное значение.
Ускорение разложения пластика имеет положительное значение.
Ускорение порчи продуктов питания имеет отрицательное значение.Задание 3. В таблице 1 указаны условия, влияющие на скорость химических реакций, и даны примеры. Назовите для каждого условия один-два дополнительных примера, составьте уравнения реакций и дайте обоснование их осуществления.
Ответ:
Условия влияющие на скорость химических реакций Примеры 1. Природа реагирующих веществ. Выделение водорода протекает более интенсивно во время реакции цинка с соляной кислотой, чем с уксусной кислотой:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Zn + 2CH3COOH ⟶ Zn(CH3COO)2 + H2↑2. Концентрации реагирующих веществ. Выделение водорода протекает более интенсивно во время реакции цинка с 30% соляной кислотой, чем с 5% соляной кислотой. 3. Площади поверхности реагирующих веществ. Выделение водорода протекает более интенсивно во время реакции соляной кислоты c порошком цинка, чем с гранулами цинка. 4. Температура. При нагревании выделение водорода протекает более интенсивно во время реакции цинка с соляной кислотой, чем при нормальных условиях. 5. Наличие катализаторов или ингибиторов. Пероксид водорода в присутствии оксида марганца (IV) бурно разлагается, а без катализатора видимых изменений не наблюдается:
2H2O2 MnO₂ ⟶ 2H2O + O2↑Задание 4. В сосуде ёмкостью 2 л газы A и B реагируют в соответствии с уравнением
A + B = 2C.В начале реакции газа A было 0,4 моль, а через 2 с было обнаружено 0,2 моль продукта. Определите скорость реакции.
Ответ:
Дано:
`V = 2 л`
`n_1(A) = 0.4" моль"`
`Δt = 2 с`
`n_2(C) = 0.2" моль"`
`υ = ?`
Решение
`A + B = 2C`
`n_2(A) = n_1(A) - (n_2(C))/2 = 0.4 - 0.2/2 = 0.3" моль"`
`C_1(A) = (n_1(A))/V = 0.4/2 = 0.2" моль/л"`
`C_2(A) = (n_2(A))/V = 0.3/2 = 0.15" моль/л"`
`υ = (C_1 - C_2)/(Δt) = (0.2 - 0.15)/2 = 0.025" "("моль")/("л"*"с")`
Ответ: `υ = 0.025" "("моль")/("л"*"с")`.Тестовые задания
Тест 1. С большей скоростью идёт взаимодействие соляной кислоты
1) с Hg 2) с Zn 3) с Mg 4) с FeОтвет:
3) с Mg
Т. к. среди представленных металлов магний является самым активным металлом, располагается левее остальных в ряду напряжений металлов.Тест 2. Скорость реакции железа с соляной кислотой увеличится, если
1) добавить индикатор
2) повысить давление
3) измельчить кусок металла
4) понизить температуру раствораОтвет:
3) измельчить кусок металла
§5
-
§5. Обратимые реакций. Понятие о химическом равновесии.
Задание 1. -
Задание 2. Определите, в каком направлении сместится равновесие: а) при увеличении концентрации одного из исходных веществ; б) при повышении температуры; в) при повышении давления в следующих реакциях:
2SO2 + O2 ⇄ 2SO3 + Q
N2 + 3H2 ⇄ 2NH3 + Q
N2 + O2 ⇄ 2NO - QОтвет:
2SO2 + O2 ⇄ 2SO3 + Q
а) Вправо, т. к. при повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции.
б) Влево, т. к. при повышении температуры химическое равновесие смещается в направлении эндотермической реакции.
в) Вправо, т. к. при повышении давления равновесие сдвигается в направлении, в котором уменьшается объём газов.N2 + 3H2 ⇄ 2NH3 + Q
а) Вправо, т. к. при повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции.
б) Влево, т. к. при повышении температуры химическое равновесие смещается в направлении эндотермической реакции.
в) Вправо, т. к. при повышении давления равновесие сдвигается в направлении, в котором уменьшается объём газов.N2 + O2 ⇄ 2NO - Q
а) Вправо, т. к. при повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции.
б) Вправо, т. к. при понижении температуры химическое равновесие смещается в направлении экзотермической реакции.
в) Не влияет, т. к. объём газов в результате реакции не изменяется.Задание 3. Для какой химической реакции понижение температуры повлияет на смешение химического равновесия в сторону образования продуктов реакции?
3O2 ⇄ 2O3 - Q
2H2O ⇄ 2H2 + O2 - Q
C3H6 + H2 ⇄ C3H8 + QОтвет:
При понижении температуры химическое равновесие смещается в направлении экзотермической реакции, т. е. ответ: C3H6 + H2 ⇄ C3H8 + Q.
Тестовые задания
Тест 1. Обратимые химические реакции возможны между растворами
1) ZnCl2 и Na2SO4
2) KOH и HNO3
3) KNO3 и Na3PO4
4) AgNO3 и NaClОтвет:
1 и 3.
Т. к. не образуется газ, осадок или малодиссоциирующее вещества:
1) ZnCl2 + Na2SO4 ⇄ 2NaCl + ZnSO4
3) 3KNO3 + Na3PO4 ⇄ 3NaNO3 + K3PO4Тест 2. Для смешения химического равновесия реакции
2NO + O2 ⇄ 2NO2 + Q
в сторону образования оксида азота (IV) необходимо
1) повысить температуру
2) понизить температуру
3) уменьшить давление
4) увеличить давление
5) увеличить концентрацию оксида азота (II)Ответ:
2, 4, 5.
Тест 3. На смешение химического равновесия реакции
2SO2 + O2 ⇄ 2SO3 + Q
в сторону образования оксида серы (IV) не оказывает влияния
1) понижение температуры
2) увеличение давления
3) катализатор
4) увеличение концентрации оксида серы (IV)Ответ:
3)
§6
-
Глава II. Химические реакции в водных растворах.
§6. Сущность процесса электролитической диссоциации.
Задание 1. Поясните, почему раствор сахара не проводит электрический ток, а раствор хлорида натрия проводит.
Ответ:
Раствор сахара не проводит электрический ток потому, что сахар не является электролитом, т. е. при растворении не распадается на ионы.
Раствор хлорида натрия проводит электрический ток потому, что хлорид натрия является электролитом, т. е. при растворении распадается на ионы.Задание 2. Перечислите основные причины, вызывающие распад некоторых веществ на ионы при растворении их в воде или расплавлении.
Ответ:
Причина распада веществ с ионной связью на ионы в воде состоит в том, что молекула воды полярна (диполь), вследствие этого, при растворении вещества с ионной связью молекулы воды притягиваются своими отрицательными полюсами к катионам вещества, а положительными полюсами – к анионам. В результате связь между ионами ослабляется и кристаллическая решётка разрушается. Этому процессу способствует также большая диэлектрической проницаемостью воды.
При растворении в воде веществ с ковалентной сильнополярной связью, происходит изменение характера химической связи, т. е. под влиянием полярных молекул воды ковалентная полярная связь в растворяемом веществе превращается в ионную и далее процесс отщепления частиц протекает аналогично веществам с ионной связью.
При расплавлении усиливаются колебательные движения частиц, что приводит к ослаблению связи между ними. В результате также разрушается кристаллическая решётка.Задание 3. Укажите различия в строении и свойствах ионов и атомов, например, для кальция и фтора.
Ответ:
20Ca 2ē 8ē 8ē 2ē
20Ca2+ 2ē 8ē 8ē
На внешнем уровне у атома кальция 2 электрона, а у иона их нет, поэтому атом кальция может окисляться, а ион - нет.9F 2ē 7ē
9F- 2ē 8ē
На внешнем уровне у атома фтора 7 электронов, а у иона их 8 (т. е. энергетический уровень завершен), поэтому атом фтора может восстанавливаться, а ион - нет.Задание 4. Определите массу сульфида меди (II), образовавшегося в результате взаимодействия 5 моль сульфата меди (II) с сероводородной кислотой, взятой в избытке.
Ответ:
Дано:
`n(CuSO_4) = 5" моль"`
`m(CuS) = ?`
Решение
`CuSO_4 + H_2S = H_2SO_4 + CuS"↓"`
`n(CuS) = n(CuSO_4) = 5" моль"`
`m(CuS) = n(CuS)*M(CuS) = 5*96 = 480 г`
Ответ: `m(CuS) = 480 г`. §7
-
§7. Диссоциация кислот, оснований и солей.
Задание 1. Что такое ион гидроксония и как он образуется? Какой вид связи в этом ионе?
Ответ:
Гидроксоний – ион, который образуется в результате соединение катиона водорода с молекулой воды.
H+ + H2O ⟶ H3O+
Гидроксоний образован ковалентной связью между ионом водорода кислоты и атомом кислорода в молекуле воды, при этом механизм образования этой связи – донорно-акцепторный.Задание 2. Напишите уравнения процессов диссоциации фосфорной кислоты, гидроксида калия и сульфата алюминия.
Ответ:
Диссоциация фосфорной кислоты
H3PO4 ⇄ H+ + H2PO4-
H2PO4- ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
Диссоциация гидроксида калия
KOH ⇄ K+ + OH-
Диссоциация сульфата алюминия
Al2(SO4)3 ⇄ 2Al3+ + 3SO42-Задание 3. Вычислите количество гидроксида калия (в молях), вступившего в реакцию с серной кислотой, если в результате образовалось 174 г соли.
Ответ:
Дано:
`m(K_2SO_4) = 174 г`
`n(KOH) = ?`
Решение
`2KOH + H_2SO_4 = K_2SO_4 + H_2O`
`n(K_2SO_4) = (m(K_2SO_4))/(M(K_2SO_4)) = 174/174 = 1" моль"`
`n(KOH) = 2*n(K_2SO_4) = 2*1 = 2" моль"`
Ответ: `n(KOH) = 2" моль"`.Тестовые задания
Тест 1. При растворении в воде гидроксид-ионы образует вещество, формула которого
1) Cu(OH)2 2) CH3OH 3) LiOH 4) H2SO4Ответ:
3)
LiOH ⇄ Li+ + OH-Тест 2. Вещества, которые относятся к разным классам неорганических соединений, но образуют при диссоциации в водных растворах одинаковые катионы, — это
1) KOH и LiOH
2) Ba(OH)2 и BaSO4
3) Ba(OH)2 и BaCl2
4) CaCO3 и Ca(OH)2Ответ:
3)
Ba(OH)2 ⇄ Ba2+ + 2OH-
BaCl2 ⇄ Ba2+ + 2Cl-Тест 3. Вещества, которые относятся к разным классам неорганических соединений, но образуют при диссоциации в водных растворах одинаковые анионы, – это
1) Ba(OH)2 и Ba(NO3)2
2) LiOH и Cu(OH)2
3) BaSO4 и Na2SO4
4) HNO3 и Zn(NO3)2Ответ:
4)
Кислота
HNO3 ⇄ H+ + NO3-
Соль
Zn(NO3)2 ⇄ Zn2+ + 2NO3- §8
-
§8. Слабые и сильные электролиты. Степень диссоциации.
Задание 1. Что означает выражение: "Степень диссоциации уксусной кислоты в данном растворе равна 0,3"?
Ответ:
"Степень диссоциации уксусной кислоты в данном растворе равна 0,3" – это выражение означает, что в данном растворе 30% молекул уксусной кислоты CH3COOH распалось на ионы CH3COO- и H+.
Задание 2. Используя понятие "степень диссоциации", объясните смысл понятий "сильная кислота" и "слабая кислота".
Ответ:
Сильная кислота – это электролит, который при растворении в воде полностью диссоциирует на катионы водорода и анионы кислотного остатка.
Слабая кислота – это электролит, который при растворении в воде незначительно диссоциирует на катионы водорода и анионы кислотного остатка.Задание 3. Приведите примеры сильных и слабых электролитов. Где на практике необходимо учитывать силу электролитов?
Ответ:
Сильные электролиты: гидроксид натрия, серная кислота, нитрат аммония.
Слабые электролиты: гидроксид меди, гидроксид аммония, угольная кислота.
Учитывать силу электролитов необходимо учитывать при производстве и эксплуатации аккумуляторов, при процессах электролиза.Задание 4. Дан раствор слабого электролита. Как увеличить степень его диссоциации?
Ответ:
Увеличить степень диссоциации слабого электролита можно с помощью разбавления раствора.
Тестовые задания
Тест 1. Среди перечисленных электролитов сильным электролитом является
1) сульфат меди (II)
2) сероводородная кислота
3) фосфорная кислота
4) гидроксид цинкаОтвет:
1) сульфат меди (II)
Тест 2. При полной диссоциации 1 моль нитрата меди (II) в растворе образуется
1) 3 моль катионов меди и 1 моль нитрат-ионов
2) 2 моль катионов меди и 3 моль нитрат-ионов
3) 1 моль катионов меди и 2 моль нитрат-ионов
4) 1 моль катионов меди и 3 моль нитрат-ионовОтвет:
3)
Cu(NO3)2 ⇄ Cu2+ + 2NO3-Тест 3. Выберите верную запись правой части уравнения диссоциации карбоната натрия.
1) = Na+ + CO32-
2) = Na+ + 2CO32-
3) = 2Na+ + CO32-
4) = 2Na+ + HCO3-Ответ:
3)
§9
-
§9. Реакции ионного обмена.
Задание 1. Какие реакции называют качественными?
Ответ:
Качественная реакция – реакция, с помощью которой определяют наличие того или иного иона.
Задание 2. Даны растворы, содержащие ионы Ag+, SO42-, H+, I-. Используя Приложение 1 (с. 202-203), определите, с помощью каких реактивов можно определить эти растворы. Напишите уравнения соответствующих реакций.
Ответ:
Ag+ можно определить с помощью хлорида натрия, выпадет белый осадок:
Ag+ + Cl- ⟶ AgCl↓
SO42- можно определить с помощью хлорида бария, выпадет белый осадок:
Ba2+ + SO42- ⟶ BaSO4↓
H+ можно определить с помощью лакмуса, он окрасит раствор в красный цвет.
I- можно определить с помощью нитрата серебра, выпадет желтый осадок:
Ag+ + I- ⟶ AgI↓Задание 3. Даны растворы: а) сульфата цинка и нитрата бария; б) сульфата меди (II) и гидроксида калия; в) сульфата цинка, хлорида магния и фосфата натрия; г) хлорида железа (III) и сульфата магния. При сливании каких растворов реакции обмена пойдут до конца и почему? Составьте уравнения этих реакций в молекулярном, полном и сокращённом ионном виде.
Ответ:
а) Реакция идёт до конца, т. к. в результате реакции выпал осадок:
ZnSO4 + Ba(NO3)2 ⟶ Zn(NO3)2 + BaSO4↓
Zn2+ + SO42- + Ba2+ + 2NO3- ⟶ Zn2+ + 2NO3- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
б) Реакция идёт до конца, т. к. в результате реакции выпал осадок:
CuSO4 + 2KOH ⟶ K2SO4 + Cu(OH)2↓
Cu2+ + SO42- + 2K+ + 2OH- ⟶ 2K+ + SO42- + Cu(OH)2↓
Cu2+ + 2OH- ⟶ Cu(OH)2↓
в) Реакция идёт до конца, т. к. в результате реакции выпал осадок:
3ZnSO4 + 2Na3PO4 ⟶ 3Na2SO4 + Zn3(PO4)2↓
3Zn2+ + 3SO42- + 6Na+ + 2PO43- ⟶ 6Na+ + 3SO42- + Zn3(PO4)2↓
3Zn2+ + 3SO42- + 6Na+ + 2PO43- ⟶ 6Na+ + 3SO42- + Zn3(PO4)2↓
Реакция идёт до конца, т. к. в результате реакции выпал осадок:
3MgCl2 + 2Na3PO4 ⟶ 6NaCl + Mg3(PO4)2↓
3Mg2+ + 6Cl- + 6Na+ + 2PO43- ⟶ 6Na+ + 6Cl- + Mg3(PO4)2↓
3Mg2+ + 2PO43- ⟶ Mg3(PO4)2↓
г) Реакция является обратимой, т. к. в результате реакции не образуется осадок, газ или малодиссоциирующего вещества:
2FeCl3 + 3MgSO4 ⇄ 3MgCl2 + Fe2(SO4)3
2Fe3+ + 6Cl- + 3Mg2+ + 3SO42- ⇄ 3Mg2+ + 6Cl- + 2Fe3+ + 3SO42-Задание 4. Даны схемы реакций:
а) 2H+ + CO32- ⟶
б) 2H+ + S2- ⟶
в) 2H+ + SO32- ⟶
Составьте уравнения соответствующих реакций в молекулярном виде.Ответ:
а) 2HCl + Na2CO3 ⟶ 2NaCl + H2O + CO2↑
б) 2HCl + Na2S ⟶ 2NaCl + H2S↑
в) 2HCl + Na2SO3 ⟶ 2NaCl + H2O + SO2↑Задание 5. В раствор, содержащий 40 г сульфата меди (II), поместили железные опилки. Какие вещества образуются в результате реакции и какова их масса?
Ответ:
Дано:
`m(CuSO_4) = 40 г`
`m(Cu) = ?`
`m(FeSO_4) = ?`
Решение
`CuSO_4 + Fe = Cu + FeSO_4`
`n(CuSO_4) = (m(CuSO_4))/(M(CuSO_4)) = 40/160 = 0.25" моль"`
`n(Cu) = n(FeSO_4) = n(CuSO_4) = 0.25" моль"`
`m(Cu) = n(Cu)*M(Cu) = 0.25*64 = 16 г`
`m(FeSO_4) = n(FeSO_4)*M(FeSO_4) = 0.25*152 = 38 г`
Ответ: `m(Cu) = 16 г`, `m(FeSO_4) = 38 г`.Задание 6. К 20 г раствора, содержащего 5% сульфата меди (II), добавили гидроксид натрия. Вычислите массу образовавшегося осадка.
Ответ:
Дано:
`m("р-ра") = 20 г`
`ω(CuSO_4) = 5%`
`m(Cu(OH)_2) = ?`
Решение
`CuSO_4 + 2NaOH = Na_2SO_4 + Cu(OH)_2"↓"`
`m(CuSO_4) = (ω(CuSO_4)*m("р-ра"))/100 = (5*20)/100 = 1 г`
`n(CuSO_4) = (m(CuSO_4))/(M(CuSO_4)) = 1/160 = 0.00625" моль"`
`n(Cu(OH)_2) = n(CuSO_4) = 0.00625" моль"`
`m(Cu(OH)_2) = n(Cu(OH)_2)*M(Cu(OH)_2) = 0.00625*98 = 0.6125 г`
Ответ: `m(Cu(OH)_2) = 0.6125 г`.Тестовые задания
Тест 1.
Реакция ионного обмена возможна между растворами веществ
1) Na2CO3 и HNO3
2) CuCl2 и NaNO3
3) KCl и NaNO3
4) Ca(OH)2 и KNO3Ответ:
1)
Na2CO3 + 2HNO3 ⟶ 2NaNO3 + H2O + CO2↑Тест 2. При добавлении раствора хлорида калия к раствору нитрата серебра
1) выпадает осадок
2) выделяется газ
3) выпадает осадок и выделяется газ
4) видимых изменений не происходитОтвет:
1)
KCl + AgNO3 ⟶ KNO3 + AgCl↓Тест 3. Реакции, схема которой
K2CO3 + HNO3 ⟶ KNO3 + H2O + CO2↑,
соответствует сокращённое ионное уравнение
1) H+ + OH- = H2O
2) CO32- + 2H+ = H2O + CO2↑
3) H2O + CO2 = 2H+ + CO32-
4) K2CO3 = 2K+ + CO32-Ответ:
2)
K2CO3 + 2HNO3 ⟶ 2KNO3 + H2O + CO2↑
2K+ + CO32- + 2H+ + 2NO3- ⟶ 2K+ + 2NO3- + H2O + CO2↑
CO32- + 2H+ ⟶ H2O + CO2↑ §10
-
§10. Гидролиз солей.
Задание 1. Какие соли подвергаются гидролизу и почему? Объясните это на примерах нитрата цинка, сульфата калия и сульфида натрия.
Ответ:
Гидролизу подвергаются соли образованные или слабым основанием и сильной кислотой, или сильным основанием и слабой кислотой.
Нитрат цинка образован слабым основанием (Zn(OH)2) и сильной кислотой (HNO3), поэтому он подвергается гидролизу:
Zn(NO3)2 + HOH ⇄ ZnOHNO3 + HNO3
Zn2+ + 2NO3- + HOH ⇄ ZnOH+ + NO3- + H+ + NO3-
Zn2+ + HOH ⇄ ZnOH+ + H+
Сульфат калия образован сильным основанием (KOH) и сильной кислотой (H2SO4), поэтому он не подвергается гидролизу:
K2SO4 + HOH ⇄ KOH + KHSO4
2K+ + SO42- + HOH ⇄ K+ + OH- + K+ + H+ + SO42-
HOH ⇄ H+ + OH-
Сульфид натрия образован сильным основанием (NaOH) и слабой кислотой (H2S), поэтому он подвергается гидролизу:
Na2S + HOH ⇄ NaOH + NaHS
2Na+ + S2- + HOH ⇄ Na+ + OH- + Na+ + HS-
S2- + HOH ⇄ OH- + HS-Задание 2. Напишите уравнения гидролиза солей: карбоната калия, хлорида меди (II), нитрата свинца (II), фосфата натрия.
Ответ:
Гидролиз карбоната калия
K2CO3 + HOH ⇄ KHCO3 + KOH
2K+ + CO32- + HOH ⇄ K+ + HCO3- + K+ + OH-
CO32- + HOH ⇄ HCO3- + OH-
Гидролиз хлорида меди (II)
CuCl2 + HOH ⇄ CuOHCl + HCl
Cu2+ + 2Cl- + HOH ⇄ CuOH+ + Cl- + H+ + Cl-
Cu2+ + HOH ⇄ CuOH+ + H+
Гидролиз нитрата свинца (II)
Pb(NO3)2 + HOH ⇄ PbOHNO3 + HNO3
Pb2+ + 2NO3- + HOH ⇄ PbOH+ + NO3- + H+ + NO3-
Pb2+ + HOH ⇄ PbOH+ + H+
Гидролиз фосфата натрия
Na3PO4 + HOH ⇄ Na2HPO4 + NaOH
3Na+ + PO43- + HOH ⇄ 2Na+ + HPO42- + Na+ + OH-
PO43- + HOH ⇄ HPO42- + OH-Задание 3. Техническую соду, массовая доля примесей в которой составляет 10%, обработали соляной кислотой. При этом выделилось 4 моль оксида углерода (IV). Вычислите массу технической соды, вступившей в реакцию с кислотой.
Ответ:
Дано:
`n(CO_2) = 4" моль"`
`ω("примеси") = 10%`
`m_("тех.")(Na_2CO_3) = ?`
Решение
`Na_2CO_3 + 2HCl = 2NaCl + H_2O + CO_2"↑"`
`n(Na_2CO_3) = n(CO_2) = 4" моль"`
`m(Na_2CO_3) = n(Na_2CO_3)*M(Na_2CO_3) = 4*106 = 424 г`
`ω(Na_2CO_3) = 100 - ω("примеси") = 100 - 10 = 90%`
`m_("тех.")(Na_2CO_3) = (100*m(Na_2CO_3))/(ω(Na_2CO_3)) = (100*424)/90 = 471 г`
Ответ: `m_("тех.")(Na_2CO_3) = 471 г`.Тестовые задания
Тест 1. Фиолетовый лакмус окрасится в красный цвет в водном растворе
1) сульфида калия
2) нитрата меди (II)
3) сульфата натрия
4) сульфата литияОтвет:
2) нитрата меди (II)
Cu(NO3)2 + HOH ⇄ CuOHNO3 + HNO3
Cu2+ + 2NO3- + HOH ⇄ CuOH+ + NO3- + H+ + NO3-
Cu2+ + HOH ⇄ CuOH+ + H+Тест 2. Щелочную среду имеет раствор
1) сульфита калия
2) нитрата натрия
3) сульфата алюминия
4) хлорида магнияОтвет:
1) сульфита калия
K2SO3 + HOH ⇄ KHSO3 + KOH
2K+ + SO32- + HOH ⇄ K+ + HSO3- + K+ + OH-
SO32- + HOH ⇄ HSO3- + OH- §12
-
Глава III. Галогены.
§12. Характеристика галогенов.
Задание 1. Начертите схемы распределения электронов по энергетическим уровням в атомах галогенов. Поясните, какой из галогенов и почему должен быть самым сильным окислителем.
Ответ:
Самым сильным окислителем среди галогенов является фтор, т. к. у его меньше всех электронных слоёв, поэтому у него самый малый радиус атома, соответственно ему легче присоединить электроны, чем отдать их, по сравнению с другими галогенами.Задание 2. Изобразите строение молекул фтора и фтороводорода с помощью структурных и электронных формул. Укажите вид химической связи в молекулах этих веществ.
Ответ:
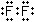 Электронная формула строения молекулы фтора
Электронная формула строения молекулы фтора
Ковалентная неполярная связь.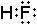 Электронная формула строения молекулы фтороводорода
Электронная формула строения молекулы фтороводорода
Ковалентная полярная связь.Задание 3. Чем различаются вещества фтор, фтороводород, фторид натрия: а) по виду химической связи; б) по строению кристаллической решётки; в) по химическим свойствам?
Ответ:
Фтор Фтороводород Фторид натрия а) вид химической связи Ковалентная неполярная Ковалентная полярная Ионная б) строение кристаллической решётки Молекулярная Молекулярная Ионная в) химические свойства Сильный окислитель Обладает свойствами кислот, является слабой кислотой Обладает свойствами солей Задание 4. Охарактеризуйте способы получения галогенов. Какие из галогенов труднее, а какие легче выделить в свободном состоянии?
Ответ:
Галогены в природных соединениях проявляют степень окисления -1, поэтому для получения в свободном состоянии надо окислить их ионы: Г - 1ē ⟶ Г.
В промышленности галогены получают с помощью электролиза растворов или расплавов электролитов:
2NaCl(расплав) электролиз ⟶ 2Na + Cl2↑
В лабораториях для получения галогенов применяют различные окислители. Так, для получения хлора можно использовать соединения марганца, в которых он находится в степени окисления +4 или +7:
4HCl(конц.) + MnO2 t ⟶ MnCl2 + Cl2 + 2H2O
Труднее всего в свободном состоянии выделить фтор, а легче всего – иод, это связано с тем, что слабее всего удерживают избыточные электроны те ионы, радиус которых больше, т. е. иодид-ионы, и наоборот сильнее всего удерживают избыточные электроны те ионы, радиус которых меньше, т. е. фторид-ионы.
Так фторид-ионы можно окислить только в процессе электролиза. Хлорид-ионы можно окислить не только в процессе электролиза, но и соединениями марганца, в которых он находится в степени окисления +4 или +7. Бромид-ионы и иодид-ионы можно окислить не только упомянутыми выше соединениями марганца, но и свободным хлором, а иодид-ионы также и бромом:
2KBr + Cl2 ⟶ 2KCl + Br2
2KI + Br2 ⟶ 2KBr + I2Задание 5. К водному раствору иодида калия добавили раствор крахмального клейстера. Затем через этот раствор пропустили хлор. Как изменился цвет раствора и почему?
Ответ:
При добавлении раствора крахмального клейстера к раствору иодиду калия цвет раствора не изменился.
После пропускания хлора через данный раствор, хлор вытеснил иод из иодида калия:
2KI + Cl2 ⟶ 2KCl + I2
Т. к. в результате реакции выделится иод, то он при взаимодействии с крахмалом образовал соединение синего цвета, поэтому раствор приобрёл синий цвет.Тестовые задания
Тест 1. Наиболее сильным окислителем является галоген
1) фтор 2) хлор 3) бром 4) иодОтвет:
1) фтор
Тест 2. Нельзя практически осуществить химическую реакцию
1) KI + Br2 ⟶
2) KI + Cl2 ⟶
3) KCl + Br2 ⟶
4) F2 + H2O ⟶Ответ:
3) KCl + Br2 ⇸
§13
-
§13. Хлор.
Задание 1. В виде каких соединений хлор встречается в природе? Назовите наиболее важные из них и покажите их месторождения на карте. Почему хлор в природе не встречается в свободном состоянии? Оцените выполнение этого задания у соседа по парте.
Ответ:
В земной коре хлор самый распространённый галоген. Хлор очень активен – он непосредственно соединяется почти со всеми элементами периодической системы, поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl·NaCl и т. д.
Крупнейшими месторождениями поваренной соли (NaCl) являются – Мертвое море, Жаксыкылыш (озеро в Казахстане), залив Кара-Богаз-Гол (Туркмения), Соледар (Донецкая область, Украина), Белбажское соляное месторождение (Россия, Нижегородская область), озеро Баскунчак (Астраханская область, Россия), Соль-Илецк (Оренбургской область, Россия), Соликамск и Березники (Пермский край, Россия), Яван (Таджикистан).Задание 2. Охарактеризуйте основные химические свойства хлора. Составьте уравнения химических реакций: а) лития с хлором; б) сгорания порошка железа в хлоре; в) горения водорода в хлоре; г) взаимодействия хлора с водой. Над знаками химических элементов проставьте степени окисления. Укажите окислитель и восстановитель.
Ответ:
Основные химические свойства хлора
Взаимодействие с простыми веществами
Реагирует с металлами:
`overset(0)(Cu) + overset(0)(Cl_2) ⟶ overset(+2)(Cu)overset(-1)(Cl)_2`
Реагирует с некоторыми неметаллами:
`2overset(0)(Sb) + 3overset(0)(Cl_2) ⟶ 2overset(+3)(Sb)overset(-1)(Cl)_3`
Реагирует с водородом:
`overset(0)(H_2) + overset(0)(Cl_2) ⟶ 2overset(+1)(H)overset(-1)(Cl)`
Взаимодействие со сложными веществами
Реагирует с водой:
`H_2O + overset(0)(Cl_2) ⟶ Hoverset(-1)(Cl) + Hoverset(+1)(Cl)O`
Вытесняет из солей бром и иод:
`2Naoverset(-1)(Br) + overset(0)(Cl_2) ⟶ 2Naoverset(-1)(Cl) + overset(0)(Br)_2`
`2Naoverset(-1)(I) + overset(0)(Cl_2) ⟶ 2Naoverset(-1)(Cl) + overset(0)(I)_2`
а)
`2overset(0)(Li) + overset(0)(Cl_2) ⟶ 2overset(+1)(Li)overset(-1)(Cl)`
`Li^(0) - 1ē ⟶ Li^(+1)` – окисляется
`Cl_2^(0) + 2ē ⟶ 2Cl^(-1)` – восстанавливается
б)
`2overset(0)(Fe) + 3overset(0)(Cl_2) ⟶ 2overset(+3)(Fe)overset(-1)(Cl_3)`
`Fe^(0) - 3ē ⟶ Fe^(+3)` – окисляется
`Cl_2^(0) + 2ē ⟶ 2Cl^(-1)` – восстанавливается
в)
`overset(0)(H_2) + overset(0)(Cl_2) ⟶ 2overset(+1)(H)overset(-1)(Cl)`
`H_2^(0) - 2ē ⟶ 2H^(+1)` – окисляется
`Cl_2^(0) + 2ē ⟶ 2Cl^(-1)` – восстанавливается
г)
`H_2O + overset(0)(Cl_2) ⟶ Hoverset(-1)(Cl) + Hoverset(+1)(Cl)O`
`Cl^(0) - 1ē ⟶ Cl^(+1)` – окисляется
`Cl^(0) + 1ē ⟶ Cl^(-1)` – восстанавливаетсяЗадание 3. Почему синяя лакмусовая бумага в свежеприготовленной хлорной воде обесцвечивается, а в хлорной воде, которая длительное время находилась на свету, краснеет?
Ответ:
Хлор со временем он реагирует с водой:
Cl2 + H2O = HCl + HClO
В результате реакции образуется соляная кислота и хлорноватистая кислота. Хлорноватистая кислота распадается на свету:
HClO = HCl + O
в результате образуется атомарный кислород O, который является сильным окислителем и обесцвечивает лакмус.
Со временем весь атомарный кислород улетучивается, в итоге в растворе остается только соляная кислота (HCl), которая окрашивает лакмус в красный цвет.Задание 4. На каких химических свойствах хлора основано его использование на практике? Напишите уравнения соответствующих реакций.
Ответ:
Благодаря тому что при взаимодействии хлора с водой образуется сильный окислитель – хлорноватистая кислота, хлор применяют для обеззараживания питьевой волы, для отбеливания ткани и бумаги. Процесс отбеливания объясняется тем, что большинство красящих веществ при взаимодействии с хлорноватистой кислотой разрушаются и превращаются в бесцветные соединения. Также хлорная вода используется как сильный окислитель в химических лабораториях.
Cl2 + H2O = HCl + HClO
Способность хлора реагировать со сложными веществами используют для получения пластмасс, красителей, медикаментов и других продуктов путём присоединения атомов хлора к органическим соединениям – хлорирования.
Хлор применяют для синтеза соляной кислоты.
H2 + Cl2 = 2HClЗадание 5. В закрытом прочном сосуде смешали 8 л хлора с 12 л водорода (н. у.) и смесь взорвали. Какой объём хлороводорода получился? Какой газ и в каком объёме остался в избытке?
Ответ:
Дано:
`V(Cl_2) = 8 л`
`V(H_2) = 12 л`
`V_("изб.")("газа") = ?`
`V(HCl) = ?`
Решение
`H_2 + Cl_2 = 2HCl`
`V(H_2)" ":" "V(Cl_2)" ":" "V(HCl) = 1:1:2`
Из соотношения объемов газов видно, что водорода в избытке, поэтому:
`V_("изб.")(H_2) = 12 - 8 = 4 л`
Найдём объем образовавшегося хлороводорода:
`V(Cl_2)" ":" "V(HCl) = 1:2`
`V(HCl) = 2*V(Cl_2) = 2*8 = 16 л`Ответ: `V_("изб.")(H_2) = 4 л`, `V(HCl) = 16 л`.
Задание 6. Рассчитайте объём (н. у.), массу и количество вещества хлора, выделившегося при взаимодействии оксида марганца (IV) MnO2 массой 17,4 г с соляной кислотой, взятой в избытке.
Ответ:
Дано:
`m(MnO_2) = 17.4 г`
`n(Cl_2) = ?`
`m(Cl_2) = ?`
`V(Cl_2) = ?`
Решение
`MnO_2 + 4HCl = MnCl_2 + Cl_2 + 2H_2O`
`n(MnO_2) = (m(MnO_2))/(M(MnO_2)) = (17.4)/87 = 0.2" моль"`
`n(Cl_2) = n(MnO_2) = 0.2" моль"`
`m(Cl_2) = n(Cl_2)*M(Cl_2) = 0.2*71 = 14.2 г`
`V(Cl_2) = n(Cl_2)*V_m = 0.2*22.4 = 4.48 л`
Ответ: `n(Cl_2) = 0.2" моль"`, `m(Cl_2) = 14.2 г`, `V(Cl_2) = 4.48 л`.Задание 7. Рассмотрите рисунок 11. Используя Интернет или дополнительную литературу, узнайте, какое применение находят хлориды свинца и титана.
Ответ:
Хлорид свинца (II) используется:
- в производстве керамики;
- в производстве стекла пропускающего инфракрасное излучение;
- в качестве пигмента белой краски.
Хлорид титана (IV) используется:
- для получения губчатого титана;
- для получения катализаторов и в качестве катализатора в химической промышленности;
- для производства пигмента – титановых белил;
- как дымообразователь.
Тестовые задания
Тест 1. Реакция окисления железа хлором относится к реакциям
1) замещения 2) разложения 3) соединения 4) обменаОтвет:
3)
2Fe + 3Cl2 = 2FeCl3Тест 2. Степень окисления хлора в хлорной кислоте HClO4 равна
1) 0 2) -1 3) +7 4) +1Ответ:
3)
`overset(+1)(H)overset(+7)(Cl)overset(-2)(O)_4`Тест 3. Определите вещество по описанию: газ жёлто-зелёного цвета с резким удушливым запахом, почти в 2,5 раза тяжелее воздуха.
1) кислород 2) хлор 3) водород 4) аргонОтвет:
2) хлор
`M("воздуха") = 29" г/моль"`; `M(O_2) = 32" г/моль"`; `M(Cl_2) = 71" г/моль"`; `M(H_2) = 2" г/моль"`; `M(Ar) = 40" г/моль"`
`M("газа") = 2.5*29 = 72.5" г/моль"`, что приблизительно соответствует хлору. §14
-
§14. Хлороводород: получение и свойства.
Задание 1. Какими двумя способами можно получить хлороводород? Составьте уравнения соответствующих химических реакций.
Ответ:
Хлороводород можно получить при взаимодействии водорода с хлором:
H2 + Cl2 ⟶ 2HCl
Также хлороводород можно получить при действии на хлорид натрия концентрированной серной кислотой:
2NaCl + H2SO4(конц.) ⟶ Na2SO4 + 2HCl↑Задание 2. Охарактеризуйте физические и химические свойства хлороводорода и поясните, для каких целей этот газ используется.
Ответ:
Физические свойства хлороводорода
Бесцветный газ с резким запахом, немного тяжелее воздуха, дымящий во влажном воздухе. Обладает большой растворимостью в воде, при 0°C в 1 объёме воды растворяется около 500 объёмов газа.
Химические свойства хлороводорода
В отличие от соляной кислоты хлороводород при обычных условиях не реагирует ни с металлами, ни с их оксидами.
Применение хлороводорода
Основная масса хлороводорода используется для производства соляной кислоты, а также в производстве пластмасс и каучука.Задание 3. Через раствор иодида калия пропустили 100 мл газовой смеси (н. у.), предназначенной для синтеза хлороводорода. В результате выделилось 0,508 г йода. Каков был состав газовой смеси в процентах (по объёму)?
Ответ:
Дано:
`V("смеси") = 100" мл" = 0.1 л`
`m(I_2) = 0.508 г`
`ϕ(H_2) = ?`
`ϕ(Cl_2) = ?`
Решение
`2KI + Cl_2 = 2KCl + I_2`
`n(I_2) = (m(I_2))/(M(I_2)) = 0.508/254 = 0.002" моль"`
`n(Cl_2) = n(I_2) = 0.002" моль"`
`V(Cl_2) = n(Cl_2)*V_m = 0.002*22.4 = 0.0448 л`
`ϕ(Cl_2) = (100*V(Cl_2))/(V("смеси")) = (100*0.0448)/0.1 = 44.8%`
`ϕ(H_2) = 100 - ϕ(Cl_2) = 100 - 44.8 = 55.2%`
Ответ: `ϕ(H_2) = 55.2%`, `ϕ(Cl_2) = 44.8%`. §15
-
§15. Соляная кислота и её соли.
Задание 1. Как в лабораторных условиях и в промышленности получают соляную кислоту? Составьте уравнения соответствующих реакций.
Ответ:
В лабораторных условиях соляную кислоту получают растворением в воде хлороводорода, который образуется при взаимодействии концентрированной серной кислоты с хлоридом натрия:
2NaCl + H2SO4(конц.) ⟶ Na2SO4 + 2HCl
В промышленности соляную кислоту получают сжиганием водорода в хлоре и растворением продукта реакции в воде:
H2 + Cl2 ⟶ 2HClЗадание 2. Даны следующие вещества: Zn, Cu, Al, CaO, SiO2, Fe2O3, NaOH, Al(OH)3, Fe2(SO4)3, CaCO3, Fe(NO3)3. Какие из этих веществ реагируют с соляной кислотой? Составьте уравнения соответствующих реакций.
Ответ:
Zn + 2HCl ⟶ ZnCl2 + H2↑
2Al + 6HCl ⟶ 2AlCl3 + 3H2↑
CaO + 2HCl ⟶ CaCl2 + H2O
Fe2O3 + 6HCl ⟶ 2FeCl3 + 3H2O
NaOH + HCl ⟶ NaCl + H2O
Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑Задание 3. Хлороводород, который получили при взаимодействии избытка концентрированной серной кислоты с 58,5 г хлорида натрия, растворили в 146 г воды. Определите массовую долю хлороводорода (в процентах) в полученном растворе.
Ответ:
Дано:
`m(NaCl) = 58.5 г`
`m(H_2O) = 146 г`
`ω(HCl) = ?`
Решение
`2NaCl + H_2SO_4 = Na_2SO_4 + 2HCl"↑"`
`n(NaCl) = (m(NaCl))/(M(NaCl)) = (58.5)/58.5 = 1" моль"`
`n(HCl) = n(NaCl) = 1" моль"`
`m(HCl) = n(HCl)*M(HCl) = 1*36.5 = 36.5 г`
`m("р-ра") = m(H_2O) + m(HCl) = 146 + 36.5 = 182.5 г`
`ω(HCl) = (100*m(HCl))/(m("р-ра")) = (100*36.5)/182.5 = 20%`
Ответ: `ω(HCl) = 20%`.Задание 4. В одном объёме воды при комнатной температуре растворяется примерно 500 объемов хлороводорода. Вычислите массовую долю хлороводорода (в процентах) в полученном растворе.
Ответ:
Дано:
`V(H_2O_"(ж.)")" ":" "V(HCl_"(г.)") = 1:500`
`ω(HCl) = ?`
Решение
Допустим у нас имеется 1 л воды, массой 1000 г, тогда:
`V(HCl) = 500*1 = 500 л`
`n(HCl) = (V(HCl))/V_m = 500/22.4 = 22.3" моль"`
`m(HCl) = n(HCl)*M(HCl) = 22.3*36.5 = 814 г`
`m("р-ра") = m(H_2O) + m(HCl) = 1000 + 814 = 1814 г`
`ω(HCl) = (100*m(HCl))/(m("р-ра")) = (100*814)/1814 = 44.9%`
Ответ: `ω(HCl) = 44.9%`.Тестовые задания
Тест 1. Установите соответствие между исходными и полученными веществами в уравнениях химических реакций, характеризующих свойства соляной кислоты.
1) HCl + Zn ⟶
2) HCl + MgO ⟶
3) HCl + Ca(OH)2 ⟶
4) HCl + AgNO3 ⟶
А. Mg(OH)2 + Cl2
Б. H2O + CaCl2
В. H2 + ZnCl2
Г. H2O + MgCl2
Д. AgCl + HNO3Ответ:
1) В; 2) Г; 3) Б; 4) Д.
Тест 2. Различить галогеноводородные кислоты и их соли можно с помощью одного реактива. Этот реактив —
1) хлорная вода
2) нитрат серебра
3) крахмальный клейстер
4) медьОтвет:
2) нитрат серебра
§17
-
Глава IV. Кислород и сера.
§17. Характеристика кислорода и серы.
Задание 1. Нарисуйте схемы строения атомов химических элементов VIА-группы и объясните, как изменяются окислительные свойства в ряду O, S, Se, Te.
Ответ:
Окислительные свойства в ряду O, S, Se, Te ослабевают, т. к. увеличивается количество электронных слоёв, соответственно элементам становится легче отдавать электроны, чем принимать их.Задание 2. Сравните свойства кислорода и озона, кристаллической и пластической серы. На этих примерах поясните сущность явления аллотропии.
Ответ:
Сущность аллотропии заключается в способности химического элемента образовывать несколько простых веществ, которые различаются между собой физическими и химическими свойствами. Например, элемент кислород имеет две аллотропные модификации – кислород и озон, элемент сера также имеет две аллотропные модификации – кристаллическая и пластическая серы.
Кислород Озон Физические свойства Бесцветный газ, без вкуса и запаха, малорастворим в воде. Голубой газ с характерным запахом, в 1,5 раза тяжелее кислорода, намного лучше растворим в воде, чем кислород. Химические свойства Взаимодействует с многими веществами при нагревании с выделением тепла и света. Значительно более активен, чем кислород. Это связано с тем, что молекула озона распадается на 1 атом и 1 молекулу кислорода: O3 = O2 + O. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются. Каучук становится хрупким, а красители обесцвечиваются. Кристаллическая сера Пластическая сера Физические свойства Твёрдое вещество жёлтого цвета, которое имеет молекулярную кристаллическую решётку. Вещество темно-желтого цвета, которое растягивается подобно резине, имеет аморфное строение. Задание 3. Перечислите природные соединения серы, напишите их химические формулы и определите в них степени окисления серы.
Ответ:
Сульфиды
Свинцовый блеск – `Pboverset(-2)(S)`
Медный блеск – `Cu_2overset(-2)(S)`
Цинковая обманка – `Znoverset(-2)(S)`
Пирит – `Feoverset(-1)(S)_2`
Сероводород – `H_2overset(-2)(S)`
Сульфаты
Гипс – `Caoverset(+6)(S)O_4*2H_2O`
Горькая соль – `Mgoverset(+6)(S)O_4*7H_2O`
Мирабилит (глауберова соль) – `Na_2overset(+6)(S)O_4*10H_2O`Задание 4. Известно соединение, содержащее 0,27928 массовых долей, или 27,928%, фосфора и 0,72072 массовых долей, или 72,072%, серы. Найдите его простейшую формулу.
Ответ:
Дано:
`ω(P) = 0.27928`
`ω(S) = 0.72072`
`P_xS_y - ?`
Решение
`ω(P)" ":" "ω(S) = x*A_r(P)" ":" "y*A_r(S)`
`0.27928" ":" "0.72072 = 31*x" ":" "32*y`
`x" ":" "y = 0.009009" ":" "0.022523`
`x" ":" "y = 1" ":" "2.5`
`x" ":" "y = 2" ":" "5`, соответственно формула `P_2S_5`
Ответ: `P_2S_5`.Тестовые задания
Тест 1.
Среди перечисленных химических элементов наибольшую электроотрицательность имеет
1) кислород
2) селен
3) теллур
4) сераОтвет:
1) кислород
Тест 2. Кислород проявляет положительную степень окисления в соединении
1) SO3 2) CaO 3) OF2 4) H2OОтвет:
3)
`overset(+2)(O)overset(-1)(F)_2`Тест 3. Степень окисления кислорода равна -1 в соединении
1) Na2O 2) Na2O2 3) NaOH 4) Na2CO3Ответ:
2)
`overset(+1)(Na)_2overset(-1)(O)_2` §18
-
§18. Свойства и применение серы.
Задание 1. Объясните, в каких случаях сера может проявлять свойства окислителя, а в каких – восстановителя. Приведите примеры.
Ответ:
Cера проявляет свойства окислителя с менее электроотрицательными элементами, например, при взаимодействии с цинком и водородом.
Zn + S ⟶ ZnSS0 + 2ē ⟶ S-2 |1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 |1 восстановитель (окисление) H2 + S ⟶ H2S
S0 + 2ē ⟶ S-2 |1 окислитель (восстановление) H20 - 2ē ⟶ 2H+ |1 восстановитель (окисление) Cера проявляет свойства восстановителя с более электроотрицательными элементами, например, при взаимодействии с кислородом и фтором.
S + O2 ⟶ SO2
O20 + 4ē ⟶ 2O-2 |1 окислитель (восстановление) S0 - 4ē ⟶ S+4 |1 восстановитель (окисление) S + 3F2 ⟶ SF6
F20 + 2ē ⟶ 2F- |3 окислитель (восстановление) S0 - 6ē ⟶ S+6 |1 восстановитель (окисление) Задание 2. Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества: Li2S, ZnS, SO2, SF6. Поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях.
Ответ:
Li + S ⟶ Li2S
S0 + 2ē ⟶ S-2 |1 окислитель (восстановление) Li0 - 1ē ⟶ Li+ |2 восстановитель (окисление) Zn + S ⟶ ZnS
S0 + 2ē ⟶ S-2 |1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 |1 восстановитель (окисление) S + O2 ⟶ SO2
O20 + 4ē ⟶ 2O-2 |1 окислитель (восстановление) S0 - 4ē ⟶ S+4 |1 восстановитель (окисление) S + 3F2 ⟶ SF6
F20 + 2ē ⟶ 2F- |3 окислитель (восстановление) S0 - 6ē ⟶ S+6 |1 восстановитель (окисление) Задание 3. При образовании из простых веществ 1 моль оксида серы (IV) выделяется теплота в количестве 332,8 кДж. Сколько выделится теплоты при сгорании 1 г серы?
Ответ:
Дано:
`n_1(SO_2) = 1" моль"`
`Q_1 = 332.8" кДж"`
`m_2(S) = 1 г`
`Q_2 = ?`
Решение
`S + O_2 = SO_2`
`n_1(S) = n_1(SO_2) = 1" моль"`
`n_2(S) = (m_2(S))/(M(S)) = 1/32 = 0.03125" моль"`
`Q_2 = (Q_1*n_2(S))/(n_1(S)) = (332.8*0.03125)/1 = 10.4" кДж"`
Ответ: `Q_2 = 10.4" кДж"`.Тестовые задания
Тест 1. Установите соответствие между приведённой схемой химической реакции и примером, иллюстрирующим её.
1) S0 ⟶ S-2
2) S+4 ⟶ S+6
3) S0 ⟶ S+4
А. 2H2S + 3O2 = 2SO2 + 2H2O
Б. H2 + S = H2S
В. 2SO2 + O2 = 2SO3
Г. S + O2 = SO2
Д. 2H2S + SO2 = 3S + 2H2OОтвет:
1) Б; 2) В; 3) Г.
Тест 2. Бинарные соединения серы с металлами называют
1) сульфатами
2) сульфитами
3) сульфидами
4) сернистыми металламиОтвет:
3) сульфидами
§19
-
§19. Сероводород. Сульфиды.
Задание 1. Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Укажите окислитель и восстановитель.
Ответ:
Неполное сгорание сероводорода
2H2S + O2 ⟶ 2H2O + 2SO20 + 4ē ⟶ 2O-2 |1 окислитель (восстановление) S-2 - 2ē ⟶ S0 |2 восстановитель (окисление) Полное сгорание сероводорода
2H2S + 3O2 ⟶ 2H2O + 2SO2O20 + 4ē ⟶ 2O-2 |3 окислитель (восстановление) S-2 - 6ē ⟶ S+4 |2 восстановитель (окисление) Задание 2. Запишите уравнение химической реакции сероводорода с раствором нитрата свинца (II) в молекулярном, полном и сокращённом ионном виде. Отметьте признаки этой реакции.
Ответ:
При взаимодействии сероводорода с раствором нитрата свинца (II) выпадет черный осадок сульфида свинца:
H2S + Pb(NO3)2 ⟶ 2HNO3 + PbS↓
H2S + Pb2+ + 2NO3- ⟶ 2H+ + 2NO3- + PbS↓
Pb2+ + H2S ⟶ 2H+ + PbS↓Задание 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CuS ⟶ H2S ⟶ SO2 ⟶ SO3Ответ:
CuS + 2HCl ⟶ CuCl2 + H2S↑
2H2S + 3O2 ⟶ 2H2O + 2SO2
2SO2 + O2 t, кат.⟶ 2SO3Задание 4. Сероводород пропустили через 200 г раствора сульфата меди (II) (массовая доля CuSO4 равна 18%). Вычислите массу осадка, выпавшего в результате этой реакции.
Ответ:
Дано:
`m("р-ра") = 200 г`
`ω(CuSO_4) = 18%`
`m(CuS) = ?`
Решение
`CuSO_4 + H_2S = H_2SO_4 + CuS"↓"`
`m(CuSO_4) = (ω(CuSO_4)*m("р-ра"))/100 = (18*200)/100 = 36 г`
`n(CuSO_4) = (m(CuSO_4))/(M(CuSO_4)) = 36/160 = 0.225" моль"`
`n(CuS) = n(CuSO_4) = 0.225" моль"`
`m(CuS) = n(CuS)*M(CuS) = 0.225*96 = 21.6 г`
Ответ: `m(CuS) = 21.6 г`.Тестовые задания
Тест 1. Летучие водородные соединения элементов VIА-группы имеют кристаллическую решётку
1) ионную
2) атомную
3) молекулярную
4) металлическуюОтвет:
3) молекулярную
Тест 2. Сероводород проявляет свойства восстановителя в химических реакциях
1) H2S + O2 ⟶ S + H2O
2) H2S + NaOH ⟶ Na2S + H2O
3) H2S + SO2 ⟶ S + H2O
4) H2S + Pb(NO3)2 ⟶ PbS + HNO3
5) H2S + O2 ⟶ SO2 + H2OОтвет:
1, 3, 5.
§20
-
§20. Оксид серы (IV). Сернистая кислота.
Задание 1. Составьте схему применения сернистого газа. Обсудите её с соседом по парте.
Ответ:
Большая часть оксида серы (IV) используется для производства сернистой кислоты и оксида серы (VI), который идёт на производство серной кислоты. Также используется в качестве консерванта (пищевая добавка E220), и для отбеливания соломы, шёлка и шерсти.
Задание 2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
S ⟶ H2S ⟶ SO2 ⟶ Na2SO3 ⟶ BaSO3 ⟶ SO2.Уравнения реакций ионного обмена напишите в полном и сокращённом ионном виде.
Ответ:
S + H2 t ⟶ H2S
2H2S + 3O2 ⟶ 2H2O + 2SO2
SO2 + 2NaOH ⟶ Na2SO3 + H2O
SO2 + 2Na+ + 2OH- ⟶ 2Na+ + SO32- + H2O
SO2 + 2OH- ⟶ SO32- + H2O
Na2SO3 + BaCl2 ⟶ 2NaCl + BaSO3↓
2Na+ + SO32- + Ba2+ + 2Cl- ⟶ 2Na+ + 2Cl- + BaSO3↓
Ba2+ + SO32- ⟶ BaSO3↓
BaSO3 + 2HCl t ⟶ BaCl2 + H2O + SO2↑
BaSO3 + 2H+ + 2Cl- t ⟶ Ba2+ + 2Cl- + H2O + SO2↑
BaSO3 + 2H+ t ⟶ Ba2+ + H2O + SO2↑Задание 3. -
Задание 4. Определите объём сероводорода (н. у.), образовавшегося при реакции соляной кислоты с 2 кг сульфида железа (II), содержащего 10% примесей.
Ответ:
Дано:
`m_("тех.")(FeS) = 2" кг" = 2000 г`
`ω("примеси") = 10%`
`V(H_2S) = ?`
Решение
`FeS + 2HCl = FeCl_2 + H_2S"↑"`
`ω(FeS) = 100 - ω("примеси") = 100 - 10 = 90%`
`m(FeS) = (ω(FeS)*m_("тех.")(FeS))/100 = (90*2000)/100 = 1800 г`
`n(FeS) = (m(FeS))/(M(FeS)) = 1800/88 = 20.45" моль"`
`n(H_2S) = n(FeS) = 20.45" моль"`
`V(H_2S) = n(FeS)*V_m = 20.45*22.4 = 458.1 л`
Ответ: `V(H_2S) = 458.1 л`.Тестовые задания
Тест 1. Для получения оксида серы (IV) невозможно использовать химическую реакцию
1) S + O2 ⟶
2) H2S + O2 ⟶
3) BaCO3 t ⟶
4) Na2SO3 + HCl ⟶Ответ:
3) BaCO3 t ⇸
Тест 2. В техническом хлориде натрия содержится примесь сульфита натрия. Обнаружить эту примесь можно с помощью раствора
1) гидроксила калия
2) сульфида калия
3) серной кислоты
4) карбоната калияОтвет:
3)
Обнаружить сульфит натрия можно с помощью серной кислоты, при её добавлении и подогревании раствора будет образовываться оксид серы (IV), который имеет специфический запах:
Na2SO3 + H2SO4 t ⟶ Na2SO4 + H2O + SO2↑ §21
-
§21. Оксид серы (VI). Серная кислота.
Задание 1. Концентрированная серная кислота при нагревании реагирует с ртутью и серебром, подобно тому как она реагирует с медью. Составьте уравнения этих реакций и укажите окислитель и восстановитель.
Ответ:
Hg + 2H2SO4(конц.) ⟶ HgSO4 + SO2↑ + 2H2O
S+6 + 2ē ⟶ S+4 |1 окислитель (восстановление) Hg0 - 2ē ⟶ Hg+2 |1 восстановитель (окисление) 2Ag + 2H2SO4(конц.) ⟶ Ag2SO4 + SO2↑ + 2H2O
S+6 + 2ē ⟶ S+4 |1 окислитель (восстановление) Ag0 - 1ē ⟶ Ag+ |2 восстановитель (окисление) Задание 2. Составьте уравнения практически осуществимых реакций.
CuSO4 + HCl ⟶
Ba(NO3)2 + H2SO4 ⟶
Cu + HCl ⟶
NaNO3 + HCl ⟶
MgCl2 + H2SO4(конц.) ⟶
Na2SO3 + H2SO4 ⟶
NaOH + H2SO4 ⟶
Al(OH)3 + H2SO4 ⟶Укажите условия осуществления реакций. В тех случаях, где это возможно, составьте полные и сокращённые ионные уравнения.
Ответ:
Ba(NO3)2 + H2SO4 ⟶ 2HNO3 + BaSO4↓
Ba2+ + 2NO3- + 2H+ + SO42- ⟶ 2H+ + 2NO3- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
Na2SO3 + H2SO4 ⟶ Na2SO4 + H2O + SO2↑
2Na+ + SO32- + 2H+ + SO42- ⟶ 2Na+ + SO42- + H2O + SO2↑
2H+ + SO32- ⟶ H2O + SO2↑
2NaOH + H2SO4 ⟶ Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ + SO42- ⟶ 2Na+ + SO42- + 2H2O
H+ + OH- ⟶ H2O
2Al(OH)3 + 3H2SO4 ⟶ Al2(SO4)3 + 6H2O
2Al(OH)3 + 6H+ + 3SO42- ⟶ 2Al3+ + 3SO42- + 6H2O
Al(OH)3 + 3H+ ⟶ Al3+ + 3H2OЗадание 3. Назовите окислитель в реакциях: а) разбавленной серной кислоты с металлами; б) концентрированной серной кислоты с металлами.
Ответ:
а) В реакциях разбавленной серной кислоты с металлами окислителем являются протоны водорода. Например:
Zn + H2SO4(разб.) ⟶ ZnSO4 + H2↑2H+ + 2ē ⟶ H20 |1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 |1 восстановитель (окисление) б) В реакциях концентрированной серной кислоты с металлами окислителем является сера S+6. Например:
Cu + 2H2SO4(конц.) ⟶ CuSO4 + SO2↑ + 2H2OS+6 + 2ē ⟶ S+4 |1 окислитель (восстановление) Cu0 - 2ē ⟶ Cu+2 |1 восстановитель (окисление) Задание 4. Составьте уравнения реакций согласно схеме 6. Результаты работы обсудите с соседом по парте.
Ответ:
`H_2 + underset("сера")(S) overset(t)(⟶) underset("сероводород")(H_2S)`
`Zn + underset("сера")(S) ⟶ underset("сульфид цинка")(ZnS)`
`O_2 + underset("сера")(S) ⟶ underset("оксид серы (IV)")(SO_2)`
`O_2 + underset("сероводород")(2H_2S) ⟶ 2H_2O + underset("сера")(2S)`
`2Na + underset("сероводород")(H_2S) ⟶ underset("сульфид натрия")(Na_2S)`
`underset("сульфат цинка")(ZnSO_4) + underset("сероводород")(H_2S) ⟶ underset("серная кислота")(H_2SO_4) + underset("сульфид цинка")(ZnS"↓")`
`underset("серная кислота")(H_2SO_4) + underset("сульфид цинка")(ZnS) ⟶ underset("сульфат цинка")(ZnSO_4) + underset("сероводород")(H_2S"↑")`
`3O_2 + underset("сульфид цинка")(2ZnS) overset(t)(⟶) 2ZnO + underset("оксид серы (IV)")(2SO_2)`
`O_2 + underset("оксид серы (IV)")(2SO_2) overset(t,"кат.")(⟶) underset("оксид серы (VI)")(2SO_3)`
`H_2O + underset("оксид серы (IV)")(SO_2) ⟶ underset("сернистая кислота")(H_2SO_3)`
`underset("сернистая кислота")(H_2SO_3) overset(t)(⟶) H_2O + underset("оксид серы (IV)")(SO_2"↑")`
`underset("сульфат цинка")(ZnSO_4) + underset("сернистая кислота")(H_2SO_3) ⟶ underset("сульфит цинка")(ZnSO_3"↓") + underset("серная кислота")(H_2SO_4)`
`underset("сульфит магния")(MgSO_3) overset(t)(⟶) MgO + underset("оксид серы (IV)")(SO_2"↑")`
`H_2O + underset("оксид серы (VI)")(SO_3) ⟶ underset("серная кислота")(H_2SO_4)`
`Zn(OH)_2 + underset("серная кислота")(H_2SO_4) ⟶ underset("сульфат цинка")(ZnSO_4) + 2H_2O`
``Задание 5. Рассчитайте массу раствора, содержащего 0,2 массовой доли серной кислоты, который израсходуется на реакцию с 4,5 г алюминия.
Ответ:
Дано:
`ω(H_2SO_4) = 0.2`
`m(Al) = 4.5 г`
`m("р-ра") = ?`
Решение
`2Al + 3H_2SO_4 = Al_2(SO_4)_3 + 3H_2"↑"`
`n(Al) = (m(Al))/(M(Al)) = 4.5/27 = 0.167" моль"`
`n(H_2SO_4) = (3*n(Al))/2 = (3*0.167)/2 = 0.25" моль"`
`m(H_2SO_4) = n(H_2SO_4)*M(H_2SO_4) = 0.25*98 = 24.5 г`
`m("р-ра") = (m(H_2SO_4))/(ω(H_2SO_4)) = 24.5/0.2 = 122.5 г`
Ответ: `m("р-ра") = 122.5 г`.Тестовые задания
Тест 1. Концентрированная серная кислота является окислителем в химических реакциях
1) Cu + H2SO4 ⟶ CuSO4 + H2O + SO2
2) CuO + H2SO4 ⟶ CuSO4 + H2O
3) NaCl + H2SO4 ⟶ Na2SO4 + HCl
4) C + H2SO4 ⟶ CO2 + SO2 + H2OОтвет:
1, 4.
Cu + 2H2SO4(конц.) ⟶ CuSO4 + SO2↑ + 2H2OS+6 + 2ē ⟶ S+4 |1 окислитель (восстановление) Cu0 - 2ē ⟶ Cu+2 |1 восстановитель (окисление) C + 2H2SO4 ⟶ CO2 + 2SO2 + 2H2O
S+6 + 2ē ⟶ S+4 |2 окислитель (восстановление) C0 - 4ē ⟶ C+4 |1 восстановитель (окисление) Тест 2. В качестве сырья для получения серной кислоты промышленным способом не используют
1) серу 2) сероводород 3) сульфат кальция 4) пиритОтвет:
3) сульфат кальция
§23
-
Глава V. Азот и фосфор.
§23. Характеристика азота и фосфора. Физические и химические свойства азота.
Задание 1. На основе представлений о строении атомов поясните: а) в чём проявляется сходство элементов азота и фосфора; б) чем эти элементы отличаются один от другого.
Ответ:
а) Сходство элементов азота и фосфора
Располагаются в VА группе; имеют по 5 электронов на внешнем энергетическом уровне; минимальная степень окисления -3; максимальная степень окисления +5; образуют оксиды N2O5, P2O5; образуют летучие водородные соединения NH3, PH3.
б) Отличие элементов азота и фосфора
Азот имеет 2 энергетических уровня, а фосфор – 3, соответственно радиус атома фосфора больше, чем у азота, поэтому у азота сильнее выражены неметаллические свойства, чему у фосфора. Азот образует молекулу N2 с тройной связью, поэтому он более инертен, чем фосфор.Задание 2. В одном цилиндре накопится азот, в другом – кислород, а в третьем – углекислый газ. Как различить эти газы?
Ответ:
В цилиндре с кислородом тлеющая лучинка вспыхнет.
В цилиндре с оксидом углерода (IV) известковая вода помутнеет:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
В оставшемся цилиндре находится азот.Задание 3. К 300 г раствора, содержащего 0,1 массовой доли гидроксида калия, прилили азотную кислоту. Сколько граммов сопи образовалось?
Ответ:
Дано:
`m("р-ра") = 300 г`
`ω(KOH) = 0.1`
`m(KNO_3) = ?`
Решение
`KOH + HNO_3 = KNO_3 + H_2O`
`m(KOH) = ω(KOH)*m("р-ра") = 0.1*300 = 30 г`
`n(KOH) = (m(KOH))/(M(KOH)) = 30/56 = 0.536" моль"`
`n(KNO_3) = n(KOH) = 0.536" моль"`
`m(KNO_3) = n(KNO_3)*M(KNO_3) = 0.536*101 = 54.1 г`
Ответ: `m(KNO_3) = 54.1 г`. §24
-
§24. Аммиак.
Задание 1. Напишите уравнения четырёх химических реакций, в результате которых образуется аммиак.
Ответ:
3H2 + N2 `overset("t, кат.")(⇄)` 2NH3
2NH4Cl + Ca(OH)2 t ⟶ CaCl2 + 2NH3↑ + 2H2O
Mg3N2 + H2O ⟶ MgO + NH3↑
NH4Cl t ⟶ HCl + NH3↑Задание 2. При пропускании аммиака через трубку с накалённым оксидом меди (II) образуется медь. Напишите уравнение этой реакции, укажите окислитель и восстановитель. Покажите переход электронов.
Ответ:
3CuO + 2NH3 ⟶ 3Cu + N2 + 3H2O
Cu+2 + 2ē ⟶ Cu0 |3 окислитель (восстановление) 2N-3 - 6ē ⟶ N20 |1 восстановитель (окисление) Задание 3. Поясните, какие химические свойства аммиака используют при получении продуктов, указанных на рисунке 21.
Ответ:
Аммиак используют для производства нитрата аммония, который применяется для производства взрывчатых веществ, т. к. содержит в себе азот в минимальной и максимальной степенях окисления `overset(-3)(N)H_4overset(+5)(N)O_3`, поэтому проявляет одновременно сильные окислительные и восстановительные свойства.
Аммиак используют для производства нитрата аммония, который применяется как азотное удобрение, имеющее большую массовую долю азота.
В медицине используют раствор аммиака – нашатырный спирт, который применяется для возбуждения дыхания и выведения из обморочного состояния.
Аммиак используют для пайки цветных металлов потому, что он не позволяет окисляться металлам кислородом воздуха, т. к. он проявляет сильные восстановительные свойства.
В бытовой химии аммиак применяется потому, что обладает низкой температурой кипения, испаряясь он не оставляет разводов.
Аммиак используют для производства азотной кислоты потому, что он обладает хорошей транспортабельностью, т. к. он легко сжижается при комнатной температуре.Тестовые задания
Тест 1. Аммиак не вступает в химическую реакцию
1) с кислородом 2) с водородом 3) с соляной кислотой 4) с водойОтвет:
2) с водородом
Тест 2. Схеме превращения N-3 ⟶ N0 соответствует уравнение реакции
1) 2NH3 + H2SO4 = (NH4)2SO4
2) 4NH3 + 5O2 = 4NO + 6H2O
3) 4NH3 + 3O2 = 2N2 + 6H2O
4) NH3 + HCl = NH4ClОтвет:
3) 4NH3 + 3O2 = 2N2 + 6H2O
§26
-
§26. Соли аммония.
Задание 1. Составьте уравнения реакций, при которых образуются: а) дигидрофосфат аммония; б) гидрофосфат аммония; в) фосфат аммония.
Ответ:
а) NH3 + H3PO4 ⟶ NH4H2PO4
б) 2NH3 + H3PO4 ⟶ (NH4)2HPO4
в) 3NH3 + H3PO4 ⟶ (NH4)3PO4Задание 2. Какие свойства гидрокарбоната аммония используют при выпечке кондитерских изделий? Напишите уравнение реакции.
Ответ:
Гидрокарбонат аммония используют при выпечке кондитерских изделий потому, что при нагревании он разлагает с образованием газов, которые разрыхляют тесто.
(NH4)2CO3 t ⟶ NH3↑ + H2O + CO2↑Задание 3. Начертите в тетради таблицу. В соответствующих графах запишите молекулярные и ионные уравнения реакций, поясняющих химические свойства указанных солей. Проверьте выполнение задания у соседа по парте.
Ответ:
Соль Химические свойства, общие с другими солями Специфические свойства NH4Cl Диссоциирует на ионы:
NH4Cl ⇄ NH4+ + Cl-Реагирует с кислотами:
2NH4Cl + H2SO4(конц.) t ⟶ (NH4)2SO4 + 2HCl↑
2NH4+ + 2Cl- + 2H+ + SO42- t ⟶ 2NH4+ + SO42- + 2HCl↑
H+ + Cl- t ⟶ HCl↑Реагирует с другими солями:
AgNO3 + NH4Cl ⟶ NH4NO3 + AgCl↓
Ag+ + NO3- + NH4+ + Cl- ⟶ NH4+ + NO3- + AgCl↓
Ag+ + Cl- ⟶ AgCl↓Подвергается гидролизу:
NH4Cl + HOH ⇄ NH4OH + HCl
NH4+ + Cl- + HOH ⇄ NH4OH + H+ + Cl-
NH4+ + HOH ⇄ NH4OH + H+При высокой температуре разлагается:
NH4Cl t ⟶ NH3↑ + HCl↑Реагирует со щелочами:
NH4Cl + NaOH ⟶ NaCl + NH3↑ + H2O
NH4+ + Cl- + Na+ + OH- ⟶ Na+ + Cl- + NH3↑ + H2O
NH4+ + OH- ⟶ NH3↑ + H2O(NH4)2CO3 Реагирует с кислотами:
(NH4)2CO3 + 2HCl ⟶ 2NH4Cl + H2O + CO2↑
(NH4)2CO3 + 2H+ + 2Cl- ⟶ 2NH4+ + 2Cl- + H2O + CO2↑
(NH4)2CO3 + 2H+ ⟶ 2NH4+ + H2O + CO2↑Подвергается гидролизу:
(NH4)2CO3 + HOH ⇄ NH4OH + NH4HCO3При высокой температуре разлагается:
(NH4)2CO3 t ⟶ 2NH3↑ + H2O + CO2↑Реагирует со щелочами:
(NH4)2CO3 + 2NaOH ⟶ Na2CO3 + 2NH3↑ + 2H2O
(NH4)2CO3 + 2Na+ + 2OH- ⟶ 2Na+ + CO32- + 2NH3↑ + 2H2O
(NH4)2CO3 + 2OH- ⟶ CO32- + 2NH3↑ + 2H2O(NH4)2S Реагирует с кислотами:
(NH4)2S + 2HCl ⟶ 2NH4Cl + H2S↑
(NH4)2S + 2H+ + 2Cl- ⟶ 2NH4+ + 2Cl- + H2S↑
(NH4)2S + 2H+ ⟶ 2NH4+ + H2S↑Подвергается гидролизу:
(NH4)2S + 2HOH ⟶ 2NH4OH + H2S↑При высокой температуре разлагается:
(NH4)2S t ⟶ 2NH3↑ + H2S↑Реагирует со щелочами:
(NH4)2S + 2NaOH ⟶ Na2S + 2NH3↑ + 2H2O
(NH4)2S + 2Na+ + 2OH- ⟶ 2Na+ + S2- + 2NH3↑ + 2H2O
(NH4)2S + 2OH- ⟶ S2- + 2NH3↑ + 2H2O(NH4)2SO4 Диссоциирует на ионы:
(NH4)2SO4 ⇄ 2NH4+ + SO42-Реагирует с другими солями:
(NH4)2SO4 + BaCl2 ⟶ 2NH4Cl + BaSO4↓
2NH4+ + SO42- + Ba2+ + 2Cl- ⟶ 2NH4+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓Подвергается гидролизу:
(NH4)2SO4 + HOH ⇄ NH4OH + NH4HSO4
2NH4+ + SO42- + HOH ⇄ NH4OH + NH4+ + H+ + SO42-
NH4+ + HOH ⇄ NH4OH + H+При высокой температуре разлагается:
(NH4)2SO4 t ⟶ 2NH3 + SO3 + H2OРеагирует со щелочами:
(NH4)2SO4 + 2NaOH ⟶ Na2SO4 + 2NH3↑ + 2H2O
2NH4+ + SO42- + 2Na+ + 2OH- ⟶ 2Na+ + SO42- + 2NH3↑ + 2H2O
NH4+ + OH- ⟶ NH3↑ + H2OЗадание 4. 10,7 г хлорида аммония смешали с гидроксидом кальция и смесь нагрели. Какой газ выделился? Рассчитайте его массу и объем (н. у.).
Ответ:
Дано:
`m(NH_4Cl) = 10.7 г`
`m(NH_3) = ?`
Решение
`2NH_4Cl + Ca(OH)_2 overset(t)(=) CaCl_2 + 2NH_3"↑" + 2H_2O`
`n(NH_4Cl) = (m(NH_4Cl))/(M(NH_4Cl)) = 10.7/53.5 = 0.2" моль"`
`n(NH_3) = n(NH_4Cl) = 0.2" моль"`
`V(NH_3) = n(NH_3)*V_m = 0.2*22.4 = 4.48 л`
Ответ: `V(NH_3) = 4.48 л`.Задание 5. Рассчитайте объём (н. у.) и массу аммиака, требующегося для получения 5 т нитрата аммония.
Ответ:
Дано:
`m(NH_4NO_3) = 5 т = 5000" кг"`
`V(NH_3) = ?`
`m(NH_3) = ?`
Решение
`NH_3 + HNO_3 = NH_4NO_3`
`n(NH_4NO_3) = (m(NH_4NO_3))/(M(NH_4NO_3)) = 5000/80 = 62.5" кмоль"`
`n(NH_3) = n(NH_4NO_3) = 62.5" кмоль"`
`V(NH_3) = n(NH_3)*V_m = 62.5*22.4 = 1400 м^3`
`m(NH_3) = n(NH_3)*M(NH_3) = 62.5*17 = 1062.5" кг"`
Ответ: `V(NH_3) = 1400 м^3`, `m(NH_3) = 1062.5" кг"`.Тестовые задания
Тест 1. Установите соответствие между исходными и полученными веществами.
1) (NH4)2CO3 ⟶
2) NH4Cl + H2SO4 ⟶
3) (NH4)2SO4 + KOH ⟶
4) (NH4)2SO4 + Ba(NO3)2 ⟶
А. NH3 + H2O + K2SO4
Б. NH4NO3 + BaSO4
В (NH4)2SO4 + HCl
Г. NH3 + CO2
Д. NH3 + CO2 + H2OОтвет:
1) Д; 2) В; 3) А; 4) Б.
Тест 2. Отрицательную степень окисления азот проявляет в соединении
1) NO 2) N2O3 3) HNO3 4) NH3Ответ:
4)
`overset(-3)(N)overset(+1)(H)_3` §27
-
§27. Азотная кислота.
Задание 1. Объясните, почему азотную кислоту относят к кислотам-окислителям. Какие ещё кислоты-окислители вам известны? Можно ли отнести к подобным кислотам соляную кислоту? Обсудите этот вопрос с соседом по парте.
Ответ:
Азотную кислоту относят к кислотам-окислителям потому, что атом азота в её молекуле находится в максимальной степени окисления +5. Серная кислота, как и азотная кислота – сильный окислитель. Соляную кислоту нельзя отнести к кислотам-окислителям потому, что хлор в её молекуле находится в минимальной степени окисления -1.
Задание 2. При взаимодействии разбавленной азотной кислоты с некоторыми металлами (Mg, Zn) может выделиться оксид азота (I) или азот. Напишите соответствующие уравнения окислительно-восстановительных реакций.
Ответ:
4Mg + 10HNO3(разб.) ⟶ 4Mg(NO3)2 + N2O + 5H2O
2N+5 + 8ē ⟶ 2N+ |1 окислитель (восстановление) Mg0 - 2ē ⟶ Mg+2 |4 восстановитель (окисление) 5Zn + 12HNO3(разб.) ⟶ 5Zn(NO3)2 + N2↑ + 6H2O
2N+5 + 10ē ⟶ N20 |1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 |5 восстановитель (окисление) Задание 3. Напишите молекулярные, полные ионные и сокращённые ионные уравнения реакций, с помощью которых можно различить соляную, серную и азотную кислоты.
Ответ:
Распознать соляную кислоту можно с помощью нитрата серебра, в результате реакции образуется творожистый осадок белого цвета:
AgNO3 + HCl ⟶ HNO3 + AgCl↓
Ag+ + NO3- + H+ + Cl- ⟶ H+ + NO3- + AgCl↓
Ag+ + Cl- ⟶ AgCl↓
Распознать серную кислоту можно с помощью хлорида бария, в результате реакции образуется осадок белого цвета:
BaCl2 + H2SO4 ⟶ 2HCl + BaSO4↓
Ba2+ + 2Cl- + 2H+ + SO42- ⟶ 2H+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
Распознать азотную кислоту можно с помощью нагревания на свету, в результате реакции образуется бурый газ (NO2):
4HNO3 t, свет ⟶ 2H2O + 4NO2↑ + O2↑Задание 4. Приведите уравнения реакций: а) характерных только для азотной кислоты; б) общих для азотной и других кислот.
Ответ:
Уравнения реакций, характерные только для азотной кислоты
При нагревании и под действием света концентрированная азотная кислота разлагается:
4HNO3 t, свет ⟶ 2H2O + 4NO2↑ + O2↑
Азотная кислота по-разному реагирует с металлами. В этих реакциях в зависимости от концентрации кислоты и восстановительной способности металла выделяются различные оксиды азота, иногда азот и даже аммиак:
Cu + 4HNO3(конц.) ⟶ Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб.) ⟶ 3Cu(NO3)2 + 2NO↑ + 4H2O
Уравнения реакций, общих для азотной и других кислот
Азотная кислота является сильной кислотой, поэтому она диссоциирует полностью:
HNO3 ⟶ H+ + NO3-
Реагирует с основными оксидами:
CuO + 2HNO3 ⟶ Cu(NO3)2 + H2O
Реагирует с основаниями:
NaOH + HNO3 ⟶ NaNO3 + H2O
Реагирует с солями более слабых и более летучих кислот:
Na2CO3 + 2HNO3 ⟶ 2NaNO3 + H2O + CO2↑Задание 5. Напишите уравнения реакций, протекающих между серебром и разбавленной, а также концентрированной азотной кислотой. Покажите переход электронов и подчеркните окислитель одной чертой, а восстановитель двумя.
Ответ:
3Ag + 4HNO3(разб.) ⟶ 3AgNO3 + NO↑ + 2H2O
N+5 + 3ē ⟶ N+2 |1 окислитель (восстановление) Ag0 - 1ē ⟶ Ag+ |3 восстановитель (окисление) Ag + 2HNO3(конц.) ⟶ AgNO3 + NO2↑ + H2O
N+5 + 1ē ⟶ N+4 |1 окислитель (восстановление) Ag0 - 1ē ⟶ Ag+ |1 восстановитель (окисление) Задание 6. -
Задание 7. Какой объем аммиака (н. у.) потребуется для получения 50 т раствора с массовой долей азотной кислоты 0,5?
Ответ:
Дано:
`m("р-ра") = 50 т`
`ω(HNO_3) = 0.5`
`V(NH_3) = ?`
Решение
`NH_3 ⟶ HNO_3`
`m(HNO_3) = ω(HNO_3)*m("р-ра") = 0.5*50 = 25 т = 25000" кг"`
`n(HNO_3) = (m(HNO_3))/(M(HNO_3)) = 25000/63 = 396.8" кмоль"`
`n(NH_3) = n(HNO_3) = 396.8" кмоль"`
`V(NH_3) = n(NH_3)*V_m = 396.8*22.4 = 8888 м^3`
Ответ: `V(NH_3) = 8888 м^3`.Тестовые задания
Тест 1. Установите соответствие между исходными веществами и продуктами реакции.
1) HNO3 ⟶
2) NH4NO3 + KOH ⟶
3) Cu(NO3)2 + KOH ⟶
4) Zn(NO3)2(тв.) + H2SO4(конц.) ⟶
A. NH3↑ + KNO3 + H2O
Б. HNO3 + ZnSO4
B. ZnSO4 + H2↑
Г. NO2↑ + O2↑ + H2O
Д. Cu(OH)2↓ + KNO3Ответ:
1) Г; 2) А; 3) Д; 4) Б.
Тест 2. Азотная кислота не взаимодействует
1) с оксидом углерода (IV)
2) с оксидом меди (II)
3) с карбонатом натрия
4) с гидроксидом алюминияОтвет:
1) с оксидом углерода (IV)
§28
-
§28. Соли азотной кислоты.
Задание 1. При грозовых разрядах в почве иногда может образовываться нитрат кальция. Напишите уравнения соответствующих реакций.
Ответ:
N2 + 2O2 ⚡ ⟶ 2NO2
2NO2 + H2O ⟶ HNO2 + HNO3
2HNO3 + CaCO3 ⟶ Ca(NO3)2 + H2O + CO2↑Задание 2. Составьте уравнения реакций согласно схеме 7. Обсудите выполнение задания с соседом по парте.
Ответ:
`O_2 + underset("азот")(N_2) overset(t)(⟶) underset("оксид азота (II)")(2NO)`
`3Mg + underset("азот")(N_2) overset(t)(⟶) underset("нитрид магния")(Mg_3N_2)`
`3O_2 + underset("нитрид магния")(2Mg_3N_2) overset(t)(⟶) 6MgO + underset("азот")(2N_2)`
`6H_2O + underset("нитрид магния")(Mg_3N_2) overset(t)(⟶) 6Mg(OH)_2 + underset("аммиак")(2NH_3"↑")`
`H_2O + underset("аммиак")(NH_3) ⇄ underset("гидроксид аммония")(NH_4OH)`
`5O_2 + underset("аммиак")(4NH_3) overset("t, кат.")(⟶) underset("оксид азота (II)")(4NO) + 6H_2O`
`HCl + underset("аммиак")(NH_3) ⟶ underset("хлорид аммония")(NH_4Cl)`
`NaOH + underset("хлорид аммония")(NH_4Cl) overset(t)(⟶) NaCl + underset("аммиак")(NH_3"↑") + H_2O`
`NaOH + underset("хлорид аммония")(NH_4Cl) ⟶ NaCl + underset("гидроксид аммония")(NH_4OH)`
`O_2 + underset("оксид азота (II)")(2NO) ⟶ underset("оксид азота (IV)")(2NO_2)`
`H_2O + underset("оксид азота (IV)")(2NO_2) ⟶ HNO_2 + underset("азотная кислота")(HNO_3)`
`2KOH + underset("оксид азота (IV)")(2NO_2) ⟶ KNO_2 + underset("нитрат калия")(KNO_3) + H_2O`
`underset("нитрат серебра (I)")(2AgNO_3) overset(t)(⟶) 2Ag + underset("оксид азота (IV)")(2NO_2"↑") + O_2"↑"`
`KOH + underset("азотная кислота")(HNO_3) ⟶ underset("нитрат калия")(KNO_3) + H_2O`
`NH_3 + underset("азотная кислота")(HNO_3) ⟶ underset("нитрат аммония")(NH_4NO_3)`
`underset("азотная кислота")(4HNO_3) overset(t)(⟶) underset("оксид азота (IV)")(4NO_2"↑") + O_2"↑" + 2H_2O`
`3Cu + underset("азотная кислота")(8HNO_(3"(разб.)")) ⟶ 3Cu(NO_3)_2 + underset("оксид азота (II)")(2NO"↑") + 4H_2O`
`2NaOH + underset("оксид азота (V)")(N_2O_5) ⟶ underset("нитрат натрия")(2NaNO_3) + H_2O`Задание 3. Вычислите массовую долю (в процентах) азотной кислоты, если в результате проведения химической реакции между 200 г раствора этой кислоты и карбонатом магния было получено 11,2 л (н. у) оксида углерода (IV).
Ответ:
Дано:
`m("р-ра") = 200 г`
`V(CO_2) = 11.2 л`
`ω(HNO_3) = ?`
Решение
`2HNO_3 + MgCO_3 = Mg(NO_3)_2 + H_2O + CO_2"↑"`
`n(CO_2) = (V(CO_2))/V_m = 11.2/22.4 = 0.5" моль"`
`n(HNO_3) = 2*n(CO_2) = 0.5*2 = 1" моль"`
`m(HNO_3) = n(HNO_3)*M(HNO_3) = 1*63 = 63 г`
`ω(HNO_3) = (100*m(HNO_3))/(m("р-ра")) = (100*63)/200 = 31.5%`
Ответ: `ω(HNO_3) = 31.5%`. §29
-
§29. Фосфор.
Задание 1. Азот встречается в природе в соединениях и в свободном состоянии, а фосфор — только в соединениях. Чем это объясняется?
Ответ:
Азот встречается в природе в соединениях и в свободном состоянии, а фосфор – только в соединениях потому, что фосфор более химически активен, чем азот. Это связано с тем, что в молекуле азота N2 атомы азота попарно связаны тремя ковалентными связями, а атомы фосфора попарно связаны всего одной ковалентной связью.
Задание 2. Охарактеризуйте свойства белого и красного фосфора. Какими опытами можно доказать, что белый и красный фосфор – видоизменения одного и того же элемента?
Ответ:
Белый фосфор Красный фосфор Физическое состояние Кристаллическое вещество Аморфное или кристаллическое вещество Твёрдость Небольшая – можно резать ножом. Цвет Бесцветный/желтоватый Темно-красный Плотность 1,8 г/см3 2,3 г/см3 Растворимость Не растворяется Не растворяется Температура плавления 44°C При сильном нагревании превращается в пары белого фосфора. Температура воспламенения 40°C. В измельченном состоянии воспламеняется при обычной температуре. Примерно 260°C. Свечение В темноте светится. Не светится. Действие на организм Сильный яд. Неядовит. Доказать, что белый и красный фосфор — видоизменения одного и того же элемента можно с помощью опытов.
- При длительном нагревании белого фосфора без доступа воздуха он желтеет и постепенно превращается в красный фосфор.
- При нагревании красного фосфора в тех же условиях он превращается в пар, при конденсации которого образуется белый фосфор.
Задание 3. Вычислите массовую долю (в процентах) азотной кислоты в растворе, если известно, что 200 г этого раствора полностью прореагировали с 4 г гидроксида натрия.
Ответ:
Дано:
`m("р-ра") = 200 г`
`m(NaOH) = 4 г`
`ω(HNO_3) = ?`
Решение
`NaOH + HNO_3 = NaNO_3 + H_2O`
`n(NaOH) = (m(NaOH))/(M(NaOH)) = 4/40 = 0.1" моль"`
`n(HNO_3) = n(NaOH) = 0.1" моль"`
`m(HNO_3) = n(HNO_3)*M(HNO_3) = 0.1*63 = 6.3 г`
`ω(HNO_3) = (100*m(HNO_3))/(m("р-ра")) = (100*6.3)/200 = 3.15%`
Ответ: `ω(HNO_3) = 3.15%`.Задание 4. Рассчитайте массу раствора азотной кислоты (массовая доля HNO3, в нём равна 14%), требующегося на реакцию с 2 моль карбоната натрия.
Ответ:
Дано:
`ω(HNO_3) = 14%`
`n(Na_2CO_3) = 2" моль"`
`m("р-ра") = ?`
Решение
`Na_2CO_3 + 2HNO_3 = 2NaNO_3 + H_2O + CO_2"↑"`
`n(HNO_3) = 2*n(Na_2CO_3) = 2*2 = 4" моль"`
`m(HNO_3) = n(HNO_3)*M(HNO_3) = 4*63 = 252 г`
`m("р-ра") = (100*m(HNO_3))/(ω(HNO_3)) = (100*252)/14 = 1800 г = 1.8" кг"`
Ответ: `m("р-ра") = 1.8" кг"`.Тестовые задания
Тест 1. Положительную степень окисления фосфор не проявляет в соединении
1) P2O5 2) PCl5 3) PH3 4) P2O5Ответ:
3)
`overset(-3)(P)overset(+1)(H)_3`Тест 2. Фосфор не вступает в реакцию
1) с кислородом
2) с водородом
3) с водой
4) с кальциемОтвет:
3) с водой
§30
-
§30. Оксид фосфора (V). Фосфорная кислота и её соли.
Задание 1. Составьте молекулярные и ионные уравнения реакций фосфорной кислоты: а) с кальцием; б) с оксидом кальция; в) с гидроксидом кальция, взятым в избытке; в недостатке. Под формулами запишите названия соответствующих веществ.
Ответ:
а) `underset("кальций")(3Ca) + underset("фосфорная кислота")(2H_3PO_4) ⟶ underset("фосфат кальция")(Ca_3(PO_4)_2) + underset("водород")(3H_2"↑")`
б) `underset("оксид кальция")(3CaO) + underset("фосфорная кислота")(2H_3PO_4) ⟶ underset("фосфат кальция")(Ca_3(PO_4)_2) + underset("вода")(3H_2O)`
в) `underset("гидроксид кальция")(3Ca(OH)_(2"(изб.)")) + underset("фосфорная кислота")(2H_3PO_4) ⟶ underset("фосфат кальция")(Ca_3(PO_4)_2"↓") + underset("вода")(6H_2O)`
`3Ca^(2+) + 6OH^(-) + 6H^(+) + 2PO_4^(3-) ⟶ Ca_3(PO_4)_2 + 6H_2O`
`underset("гидроксид кальция")(Ca(OH)_2) + underset("фосфорная кислота")(2H_3PO_(4"(изб.)")) ⟶ underset("дигидрофосфат кальция")(Ca(H_2PO_4)_2) + underset("вода")(2H_2O)`
`Ca^(2+) + 2OH^(-) + 2H^(+) + 2H_2PO_4^(-) ⟶ Ca^(2+) + 2H_2PO_4^(-) + 2H_2O`
`H^(+) + OH^(-) ⟶ H_2O`Задание 2. Составьте уравнения реакций согласно схеме 8. Обсудите выполнение задания с соседом по парте.
Ответ:
`3H_2 + underset("фосфор")(2P) overset("t, p")(⟶) underset("фосфин")(2PH_3)`
`5O_2 + underset("фосфор")(4P) ⟶ underset("оксид фосфора (V)")(2P_2O_5)`
`3Ca + underset("фосфор")(2P) overset("t")(⟶) underset("фосфид кальция")(Ca_3P_2)`
`5HNO_(3"(конц.)") + underset("фосфор")(P) ⟶ underset("фосфорная кислота")(H_3PO_4) + 5NO_2"↑" + H_2O`
`6HCl + underset("фосфид кальция")(Ca_3P_2) ⟶ 3CaCl_2 + underset("фосфин")(2PH_3"↑")`
`3H_2O + underset("оксид фосфора (V)")(P_2O_5) ⟶ underset("фосфорная кислота")(2H_3PO_4)`
`6NaOH + underset("оксид фосфора (V)")(P_2O_5) ⟶ underset("фосфат натрия")(2Na_3PO_4) + 3H_2O`
`3NaOH + underset("фосфорная кислота")(H_3PO_4) ⟶ underset("фосфат натрия")(Na_3PO_4) + 3H_2O`
`3H_2SO_4 + 2underset("фосфат натрия")(Na_3PO_4) ⟶ 3Na_2SO_4 + underset("фосфорная кислота")(2H_3PO_4)`
`3SiO_2 + 5C + underset("фосфат кальция")(Ca_3(PO_4)_2) ⟶ 3CaSiO_3 + 5CO"↑" + underset("фосфор")(2P)`Задание 3. Сколько фосфорной кислоты можно получить из 31 т фосфата кальция, содержащего 20% примесей?
Ответ:
Дано:
`m_("тех.")(Ca_3(PO_4)_2) = 31 т`
`ω("примеси") = 20%`
`m(H_3PO_4) = ?`
Решение
`Ca_3(PO_4)_2 + 6HCl = 3CaCl_2 + 2H_3PO_4`
`ω(Ca_3(PO_4)_2) = 100 - ω("примеси") = 100 - 20 = 80%`
`m(Ca_3(PO_4)_2) = (ω(Ca_3(PO_4)_2)*m_("тех.")(Ca_3(PO_4)_2))/100 = (80*31)/100 = 24.8 т = 24800" кг"`
`n(Ca_3(PO_4)_2) = (m(Ca_3(PO_4)_2))/(M(Ca_3(PO_4)_2)) = 24800/310 = 80" кмоль"`
`n(H_3PO_4) = 2*n(Ca_3(PO_4)_2) = 2*80 = 160" кмоль"`
`m(H_3PO_4) = n(H_3PO_4)*M(H_3PO_4) = 160*98 = 15680" кг" = 15.68 т`
Ответ: `m(H_3PO_4) = 15.68 т`.Задание 4. Раствор фосфорной кислоты массой 49 кг с массовой долей H3PO4 50% нейтрализовали гидроксидом кальция. Определите массу образовавшегося фосфата кальция.
Ответ:
Дано:
`m("р-ра") = 49" кг"`
`ω(H_3PO_4) = 50%`
`m(Ca_3(PO_4)_2) = ?`
Решение
`3Ca(OH)_2 + 2H_3PO_4 = Ca_3(PO_4)_2 + 6H_2O`
`m(H_3PO_4) = (ω(H_3PO_4)*m("р-ра"))/100 = (50*49)/100 = 24.5" кг"`
`n(H_3PO_4) = (m(H_3PO_4))/(M(H_3PO_4)) = 24.5/98 = 0.25" кмоль"`
`n(Ca_3(PO_4)_2) = (n(H_3PO_4))/2 = 0.25/2 = 0.125" кмоль"`
`m(Ca_3(PO_4)_2) = n(Ca_3(PO_4)_2)*M(Ca_3(PO_4)_2) = 0.125*310 = 38.75" кг"`
Ответ: `m(Ca_3(PO_4)_2) = 38.75" кг"`. §31
-
Глава VI. Углерод и кремний.
§31. Характеристика углерода и кремния. Аллотропия углерода.
Задание 1. Перечислите химические элементы IVА-группы периодической системы Д. И. Менделеева. Найдите общие и отличительные черты в строении атомов этих элементов.
Ответ:
Все элементы IVА-группы имеют по 4 электрона на внешнем энергетическом уровне, различие заключает в количестве электронных слоёв.Задание 2. Как доказать, что графит и алмаз являются аллотропными видоизменениями одного и того же химического элемента? Почему их свойства столь различны?
Ответ:
Графит и алмаз являются аллотропными модификациями углерода, доказать это можно с помощью сжигания их, в результате сгорания образуется только оксид углерода (IV):
C + O2 ⟶ CO2
Особая твёрдость алмаза обусловлена его строением: в его кристаллической решётке каждый атом углерода связан ковалентными связями с четырьмя другими атомами, находящимися на одинаковых расстояниях от него. Эти связи по всем направлениям одинаково прочные. В графите же атомы располагаются как бы слоями и расстояние между атомами, расположенными в разных слоях, гораздо больше, чем между атомами в одном слое. Соответственно и связи между атомами, находящимися в разных слоях, непрочные. Этим и объясняется резкое отличие физических свойств графита от физических свойств алмаза.Задание 3. Для каких целей применяют алмаз и графит?
Ответ:
Ограненный алмаз применяется в ювелирном деле в качестве драгоценного камня. Алмаз, из-за исключительной твёрдости, находит своё применение в промышленности: его используют для изготовления ножей, свёрл, резцов и тому подобных изделий.
Графит используют для изготовления: плавильных тиглей, электродов, смазочных материалов, стержней для карандашей, синтетических алмазов, контактных щёток и токосъёмников. §32
-
§32. Химические свойства углерода. Адсорбция.
Задание 1. При каких процессах образуется древесный уголь? Каково его строение, свойства и применение?
Ответ:
Древесный уголь образуется при нагревании древесины без доступа воздуха. Древесный уголь имеет тонкопористое строение, благодаря этому он обладает свойством адсорбировать газообразные и растворенные вещества. Его применяют дря производства активированного угля, который используется в качестве фильтрующего материала в противогазах, в фильтрах для воды и т. д.
Задание 2. С помощью каких явлений, которые вы наблюдаете в жизни, можно доказать, что хлеб, молоко, мясо содержат углерод?
Ответ:
При сильном нагревании хлеб, молоко, мясо пригорают – обугливаются, что является доказательством наличия в них углерода.
Задание 3. Переведите таблицу 24 в текст.
Ответ:
Углерод проявляет восстановительные свойства при взаимодействии с кислородом. Углерод восстанавливает металлы из их оксидов. Углерод при взаимодействии с углекислым газом проявляет восстановительные свойства, при этом образуется угарный газ. При нагревании углерод восстанавливает водород из воды.
Углерод взаимодействует с водородом с образованием метана, при этом углерод проявляет окислительные свойства. Углерод проявляет окислительные свойства в реакциях с металлами, при этом образуются карбиды соответствующих металлов.Задание 4. Составьте уравнения реакций, протекающих при нагревании угля: 1) с оксидом железа (III); 2) с оксидом олова (IV). Покажите переход электронов и подчеркните одной чертой окислитель, а двумя – восстановитель.
Ответ:
2Fe2O3 + 3C t ⟶ 4Fe + 3CO2↑
2Fe+3 + 6ē ⟶ 2Fe0 |2 окислитель (восстановление) C0 - 4ē ⟶ C+4 |3 восстановитель (окисление) SnO2 + C t ⟶ Sn + CO2↑
Sn+4 + 4ē ⟶ Sn0 |1 окислитель (восстановление) C0 - 4ē ⟶ C+4 |1 восстановитель (окисление) Задание 5. Основываясь на свойствах углерода и пользуясь рисунком 32, поясните, для каких целей применяют углерод.
Ответ:
Свойства углерода Применение Черный цвет (сажа) Производство резины, крема для обуви, красящих пигментов. Твердость алмаза Для изготовления ножей, свёрл, резцов. Редкость и большой коэффициент преломления света. В качестве драгоценного камня в ювелирных изделиях. Адсорбция Для производства адсорбентов, медицинских препаратов. Возможность взаимодействия с водородом Применяется для производства синтетического бензина и метилового спирта Возможность взаимодействия с металлами Производство карбидов Задание 6. Обсудите с соседом по парте, где в повседневной жизни вы можете встретиться с веществами, в состав которых входят атомы элементов IVА-группы.
Ответ:
Углерод: графит, школьный мел (CaCO3), пищевая сода (NaHCO3), сахароза (C12H22O11), уксусная кислота (CH3COOH).
Кремний: кристалл процессора (Si), кварцевый песок (SiO2), силикатный клей (Na2SiO3).
Олово и свинец можно встретить в припое, свинец можно встретить в автомобильных аккумуляторах.Задание 7. Сколько потребуется раствора, содержащего 0,05 массовой доли, или 5%, хлороводорода, для реакции с 11,2 г карбоната натрия?
Ответ:
Дано:
`ω(HCl) = 0.05`
`m(Na_2CO_3) = 11.2 г`
`m("р-ра") = ?`
Решение
`Na_2CO_3 + 2HCl = 2NaCl + H_2O + CO_2"↑"`
`n(Na_2CO_3) = (m(Na_2CO_3))/(M(Na_2CO_3)) = 11.2/106 = 0.106" моль"`
`n(HCl) = 2*n(Na_2CO_3) = 2*0.106 = 0.212" моль"`
`m(HCl) = n(HCl)*M(HCl) = 0.212*36.5 = 7.74 г`
`m("р-ра") = (m(HCl))/(ω(HCl)) = 7.74/0.05 = 155 г`
Ответ: `m("р-ра") = 155 г`.Тестовые задания
Тест 1. Верны ли следующие суждения об углероде?
А. Адсорбция тем сильнее, чем больше поверхность твёрдого вещества на которой она происходит.
Б. Хороший адсорбент — это графит.
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверныОтвет:
1) верно только А
Тест 2. В результате полного сгорания метана образуются
1) углекислый газ и водород
2) углекислый газ и вода
3) оксид углерода (II) и вода
4) углерод и водаОтвет:
2)
CH4 + 2O2 ⟶ 2H2O + CO2 §33
-
§33. Оксид углерода (II) — угарный газ.
Задание 1. Охарактеризуйте процесс образования молекул оксида углерода (II) и ионов аммония и гидроксония. Что в этих процессах общего?
Ответ:
В молекуле оксида углерода (II) между атомами углерода и кислорода образуется тройная связь C≡O, две связи образуются за счет обобществления электронов, а третья связь образуется по донорно-акцепторному механизму: атом кислорода предоставляет одну из своих свободных электронных пар атому углерода (кислород является донором, а углерод – акцептором).
Образование ионов гидроксония можно объяснить возникновением дополнительной ковалентной связи между ионом водорода кислоты и атомом кислорода в молекуле воды. В этом случае электроны для общей электронной пары предоставляет атом кислорода, т. е. является её донором, а ион водорода – её акцептором.
Образование иона аммония происходит аналогично образованию иона гидроксония. При взаимодействии аммиака с ионом водорода атом азота является донором своей неподелённой электронной пары, а ион водорода — её акцептором; так по донорно-акцепторному механизму образуется четвёртая ковалентная связь между азотом и водородом.
Объединяет процессы образования данных молекул – донорно-акцепторный механизм образования одной ковалентной связи.Задание 2. Как получают оксид углерода (II) в лаборатории и в промышленности? Напишите уравнения соответствующих реакций.
Ответ:
В лаборатории оксид углерода (II) получают, действуя на муравьиную кислоту концентрированной серной кислотой, которая связывает воду:
HCOOH H₂SO₄, t ⟶ H2O + CO↑
В промышленности оксид углерода (II) получают при сгорании угля в особых печах – газогенераторах в результате двух последовательно протекающих реакций. В начале в одной части печи происходит полное сгорание угля и образуется оксид углерода (IV):
C + O2 ⟶ CO2
Далее в другой части печи оксид углерода (IV) реагирует с раскалённым углем:
С + CO2 t ⟶ 2COЗадание 3. На конкретных примерах охарактеризуйте химические свойства CO.
Ответ:
Оксид углерода (II) проявляет сильные восстановительные свойства, является несолеобразующим оксидом.
Восстанавливает большинство металлов из их оксидов:CuO + CO t ⟶ Cu + CO2
Cu+2 + 2ē ⟶ Cu0 |1 окислитель (восстановление) C+2 - 2ē ⟶ C+4 |1 восстановитель (окисление) В кислороде и на воздухе горит:
2CO + O2 ⟶ 2CO2
O20 + 4ē ⟶ 2O-2 |1 окислитель (восстановление) C+2 - 2ē ⟶ C+4 |2 восстановитель (окисление) Тестовые задания
Тест 1. Степень окисления +2 углерод имеет в соединении
1) CH4 2) CO 3) CO2 4) K2CO3Ответ:
2) CO
Тест 2.
Аппарат для получения CO в промышленности называют
1) конвертером
2) газогенератором
3) аппаратом Киппа
4) электролизёромОтвет:
2) газогенератором
§34
-
§34. Оксид углерода (IV) — углекислый газ.
Задание 1. Составьте уравнения реакций, протекающих с образованием оксида углерода (IV) в природе, в быту, в лаборатории и в промышленности.
Ответ:
Образование оксида углерода (IV)
В природеГорение древесного угля:
C + O2 ⟶ CO2
Дыхание:
C6H12O6 + 6O2 ⟶ 6CO2 + 6H2O
В быту
Горение природного газа:
CH4 + 2O2 ⟶ CO2 + 2H2O
Гашение пищевой соды уксусом:
CH3COOH + NaHCO3 ⟶ CH3COONa + H2O + CO2↑
В лаборатории
Взаимодействие карбоната кальция с соляной кислотой:
CaCO3 + 2HCl ⟶ CaCl2 + CO2↑ + H2O
В промышленности
Разложение карбоната кальция при нагревании:
CaCO3 t ⟶ CaO + CO2↑
Восстановление металлов угарным газом:
CuO + CO t ⟶ Cu + CO2Задание 2. Работая в парах, расскажите друг другу об оксидах углерода, характеризуя их по плану: состав ⟶ строение ⟶ получение ⟶ свойства ⟶ применение.
Ответ:
Оксид углерода (II) Оксид углерода (IV) Состав CO CO2 Строение C≡O O=C=O Получение CO2 + C t ⟶ CO C + O2 ⟶ CO2 Свойства §34. Задание 3. Общие с другими кислотными оксидами
Реагирует с водой:
CO2 + H2O ⇄ H2CO3Реагирует с основаниями:
CO2 + 2NaOH ⟶ Na2CO3 + H2OРеагирует с основными оксидами:
CO2 + CaO ⟶ CaCO3Специфические
Известковая вода мутнеет при пропускании углекислого газа:
CO2 + Ca(OH) ⟶ H2O + CaCO3↓При повышенной температуре обладает окислительными свойствами:
CO2 + 2Mg ⟶ 2MgO + CПрименение Для восстановления металлов. Как консервант, в системах пожаротушения и в огнетушителях, для газирования напитков, для производства сухого льда. Задание 3. Какой объём углекислого газа (н. у.) выделится при обжиге 500 т известняка, содержащего 0,1 массовой доли примесей?
Ответ:
Дано:
`m_("тех.")(CaCO_3) = 500 т`
`ω("примеси") = 0.1`
`V(CO_2) = ?`
Решение
`CaCO_3 overset(t)(=) CaO + CO_2"↑"`
`m("примеси") = ω("примеси")*m_("тех.")(CaCO_3) = 0.1*500 = 50 т`
`m(CaCO_3) = m_("тех.")(CaCO_3) - m("примеси") = 500 - 50 = 450 т = 450000" кг"`
`n(CaCO_3) = (m(CaCO_3))/(M(CaCO_3)) = 450000/100 = 4500" кмоль"`
`n(CO_2) = n(CaCO_3) = 4500" кмоль"`
`V(CO_2) = n(CO_2)*V_m = 4500*22.4 = 100800 м^3`
Ответ: `V(CO_2) = 100800 м^3`.Задание 4. В 365 г воды растворили 135 г кристаллической соды. Определите массовую долю (в долях единицы и в процентах) безводной соли (Na2CO3) в полученном растворе.
Ответ:
Дано:
`m(H_2O) = 365 г`
`m(Na_2CO_3*10H_2O) = 135 г`
`ω(Na_2CO_3) = ?`
Решение
`m("р-ра") = m(H_2O) + m(Na_2CO_3*10H_2O) = 365 + 135 = 500 г`
`n(Na_2CO_3*10H_2O) = (m(Na_2CO_3*10H_2O))/(M(Na_2CO_3*10H_2O)) = 135/286 = 0.472" моль"`
`n(Na_2CO_3) = n(Na_2CO_3*10H_2O) = 0.472" моль"`
`m(Na_2CO_3) = n(Na_2CO_3)*M(Na_2CO_3) = 0.472*106 = 50 г`
`ω(Na_2CO_3) = (100*m(Na_2CO_3))/(m("р-ра")) = (100*50)/500 = 10%`
Ответ: `ω(Na_2CO_3) = 10%`. §35
-
§35. Угольная кислота и её соли. Круговорот углерода в природе.
Задание 1. Для изучения химических свойств угольной кислоты в один раствор, насыщенный оксидом углерода (IV), опустили олово, в другой — магний. В каком случае удалось доказать, что угольная кислота хотя и неактивно, но всё же реагирует с металлами? Почему?
Ответ:
В случае с магнием удалось доказать, что угольная кислота хотя и неактивно, но всё же реагирует с металлами:
Mg + H2CO3 ⟶ MgCO3 + H2↑
Угольная кислота реагирует с магнием, т. к. этот металл более активный, чем олово.Задание 2. Составьте уравнения реакций, соответствующих следующей схеме:
Na2CO3 ⇄ Na2CO3∙10H2O
Na2CO3 ⟶ NaHCO3
NaHCO3 ⟶ Na2CO3Ответ:
Na2CO3 + 10H2O ⇄ Na2CO3∙10H2O
Na2CO3∙10H2O t ⟶ Na2CO3 + 10H2O
Na2CO3 + H2O + CO2 ⟶ 2NaHCO3
NaHCO3 + NaOH ⟶ Na2CO3 + H2OЗадание 3. Используя рисунок 35, составьте уравнения химических реакций, которые происходят при круговороте углерода в природе.
Ответ:
Горение угля:
C + O2 ⟶ CO2
Дыхание, брожение:
C6H12O6 + 6O2 ⟶ 6CO2 + 6H2O
Горение природного газа:
CH4 + 2O2 ⟶ CO2 + 2H2O
Разложение карбоната кальция при нагревании:
CaCO3 t ⟶ CaO + CO2↑
Фотосинтез:
6CO2 + 6H2O ⟶ C6H12O6 + 6O2
Растворение оксида углерода (IV) в Мировом океане:
H2O + CO2 ⇄ H2СO3
Взаимодействие угольной кислоты с ионами кальция:
Ca2+ + H2СO3 ⟶ CaСO3↓ + 2H+Задание 4. Чем объяснить моющие свойства кальцинированной соды? Как вы думаете, можно ли в домашних условиях хранить соду в алюминиевом сосуде?
Ответ:
Моющие свойства кальцинированной соды объясняются тем, что её раствор имеет щелочную реакцию среды (из-за гидролиза соли), что способствует омылению жиров:
Na2CO3 + HOH ⇄ NaOH + NaHCO3
2Na+ + CO32- + HOH ⇄ Na+ + OH- + Na+ + HCO3-
CO32- + HOH ⇄ OH- + HCO3-
Кальцинированную соду нельзя хранить в алюминиевом сосуде т. к., в результате гидролиза образовывается щелочь, которая вступает в реакцию с алюминием:
2Al + 6H2O + 2NaOH ⟶ 2Na[Al(OH)4] + 3H2↑Задание 5. Составьте уравнения реакций согласно схеме 10. Проверьте выполнение этого задания у соседа по парте и оцените его работу.
Ответ:
`underset("углерод")(C) + 2H_2 overset(t," "p," кат.")(⟶) underset("метан")(CH_4)`
`underset("углерод")(C) + O_2 ⟶ underset("оксид углерода (IV)")(CO_2)`
`underset("метан")(CH_4) overset(t)(⟶) underset("углерод")(C) + 2H_2`
`H_2O + underset("оксид углерода (IV)")(CO_2) ⇄ underset("угольная кислота")(H_2CO_3)`
`underset("карбонат кальция")(CaCO_3) + H_2O + underset("оксид углерода (IV)")(CO_2) ⟶ underset("гидрокарбонат кальция")(Ca(HCO_3)_2)`
`CaO + underset("оксид углерода (IV)")(CO_2) ⟶ underset("карбонат кальция")(CaCO_3)`
`C + underset("оксид углерода (IV)")(CO_2) overset(t)(⟶) underset("оксид углерода (II)")(2CO)`
`underset("муравьиная кислота")(HCOOH) overset(H_2SO_4," "t)(⟶) H_2O + underset("оксид углерода (II)")(2CO"↑")`
`underset("оксид углерода (II)")(2CO"↑") + O_2 ⟶ underset("оксид углерода (IV)")(2CO_2)`
`underset("гидрокарбонат натрия")(NaHCO_3) + NaOH ⟶ underset("карбонат натрия")(Na_2CO_3) + H_2O`
`underset("гидрокарбонат кальция")(Ca(HCO_3)_2) overset(t)(⟶) CaO + H_2O"↑" + underset("оксид углерода (IV)")(2CO_2"↑")`
`underset("карбонат кальция")(CaCO_3) overset(t)(⟶) CaO + underset("оксид углерода (IV)")(CO_2"↑")`Задание 6. 146 г смеси, состоящей из карбоната и гидрокарбоната натрия, сильно прокалили. Остаток после прокаливания весил 137 г. Выразите состав смеси в массовых долях.
Ответ:
Дано:
`m("смеси") = 146 г`
`m_2("смеси") = 137 г`
`ω(NaHCO_3) = ?`
`ω(Na_2CO_3) = ?`
Решение
`2NaHCO_3 overset(t)(=) Na_2CO_3 + H_2O"↑" + CO_2"↑"`
`m("смеси") - m_2("смеси") = 146 - 137 = 9 г`
`m(H_2O) + m(CO_2) = m("смеси") - m_2("смеси")`
`m(H_2O) + m(CO_2) = 9 г`
`m("смеси") - m_2("смеси") = m(NaHCO_3) - m_("обр.")(Na_2CO_3)`
`m(NaHCO_3) - m_("обр.")(Na_2CO_3) = n(NaHCO_3)*M(NaHCO_3) - n_("обр.")(Na_2CO_3)*M(Na_2CO_3)`
`84*n(NaHCO_3) - 106*n_("обр.")(Na_2CO_3) = 9 г`
`n_("обр.")(Na_2CO_3) = (n(NaHCO_3))/2`
`84*n(NaHCO_3) - (106*n(NaHCO_3))/2 = 9`
`31*n(NaHCO_3) = 9`
`n(NaHCO_3) = 0.29" моль"`
`m(NaHCO_3) = n(NaHCO_3)*M(NaHCO_3) = 0.29*84 = 24.4 г`
`ω(NaHCO_3) = (100*m(NaHCO_3))/(m("смеси")) = (100*24.4)/146 = 16.7%`
`ω(Na_2CO_3) = 100 - ω(NaHCO_3) = 100 - 16.7 = 83.3%`
Ответ: `ω(NaHCO_3) = 16.7%`, `ω(Na_2CO_3) = 83.3%`.Задание 7. Допишите уравнения практически осуществимых реакций.
1) CO2 + Ba(OH)2 ⟶
2) K2CO3 + HNO3 ⟶
3) KOH + CaCO3 ⟶
4) Ca(HCO3)2 ⟶Ответ:
1) CO2 + Ba(OH)2 ⟶ BaCO3↓ + H2O
2) K2CO3 + 2HNO3 ⟶ 2KNO3 + H2O + CO2↑
4) Ca(HCO3)2 t ⟶ CaCO3 + H2O↑ + CO2↑Тестовые задания
Тест 1. В двух закрытых цилиндрах без этикеток находятся углекислый газ и водород. Газы можно различить
1) по цвету
2) по запаху
3) с помощью горящей лучины
4) с помощью фильтровальной бумаги, смоченной спиртовым раствором фенолфталеинаОтвет:
3) с помощью горящей лучины
Тест 2. Сокращённому ионному уравнению CO2 + 2OH- = H2O + CO32- соответствует химическая реакция между
1) соляной кислотой и карбонатом кальция
2) гидроксидом натрия и оксидом углерода (IV)
3) кремниевой кислотой и карбонатом калия
4) карбонатом калия и оксидом кремния (IV)Ответ:
2) гидроксидом натрия и оксидом углерода (IV)
§37
-
§37. Кремний. Оксид кремния (IV).
Задание 1. Работая в парах, составьте характеристику кремния по плану: нахождение в природе ⟶ получение ⟶ состав ⟶ строение ⟶ свойства ⟶ применение.
Ответ:
Кремний
Нахождение в природе
По распространённости в земной коре кремний занимает второе место после кислорода (примерно 26%). В природе встречается в виде соединений: оксида кремния (IV) SiO2 (кремнезём) и каолинита Al2O3∙2SiO2∙2H2O. Оксид кремния (IV) – это основная часть песка, а каолинит – основная составная часть глины. Весьма распространён в природе ортоклаз (полевой шпат) K2O∙Al2O3∙6SiO2.
Получение
В промышленности получают при нагревании смести песка и угля:
2C + SiO2 t ⟶ Si + 2CO↑В лаборатории получают при взаимодействии смеси чистого песка с порошком магния:
2Mg + SiO2 t ⟶ 2MgO + SiСтроение
Известен аморфный и кристаллический кремний, обладающий атомной кристаллической решеткой.
Свойства
Физические свойства. Кристаллический кремний обладает металлическим блеском, он тугоплавкий, очень твёрдый, с незначительной электрической проводимостью.
Химические свойства. В соединениях кремний проявляет степени окисления +4 и -4.
Из простых веществ при обычных условиях аморфный кремний реагирует лишь с фтором:
Si + F2 ⟶ SiF4При повышенной температуре кремний становится активным и реагирует с кислородом, хлором, бромом, углеродом и серой. В соединениях с этими элементами для кремния характерна степень окисления +4:
Si + O2 t ⟶ SiO2Существуют соединения, где кремний проявляет степень окисления -4. Так, с металлами кремний образует силициды:
2Mg + Si t ⟶ Mg2Si.
При действии на силициды сильных кислот образуется силан SiH4:
Mg2Si + 4HCl ⟶ SH4↑ + 2MgCl2Применение
Большие количества кремния расходуются для получения кремнистых сталей, обладающих высокой жаропрочностью и кислотоупорностью. Кремний, подобно германию, является полупроводником, и поэтому его успешно применяют в различных устройствах, в том числе в электронной технике. Кристаллы кремния используют в фотоэлементах, при помощи которых энергия солнечного излучения превращается в электрическую.
Задание 2. В чём сходство и различия высших оксидов углерода и кремния?
Ответ:
Сходство высших оксидов углерода и кремния состоит в том, что углерод и кремний имеют степень окисления +4 – `overset(+4)(C)O_2`, `overset(+4)(Si)O_2`. Различие состоит в том, что оксид углерода имеет молекулярную кристаллическую решетку, а оксид кремния – атомную кристаллическую решетку.
Задание 3. Напишите уравнения реакций, соответствующих следующим превращениям:
SiO2 ⟶ Si ⟶ Mg2Si ⟶ SiH4 ⟶ SiO2Ответ:
SiO2 + 2Mg t ⟶ 2MgO + Si
Si + 2Mg t ⟶ Mg2Si
Mg2Si + 4HCl ⟶ 2MgCl2 + SiH4↑
SiH4 + 2O2 ⟶ 2H2O + SiO2Тестовые задания
Тест 1. Для оксида кремния (IV) характерны следующие физические свойства:
1) газ, без запаха
2) твёрдое вещество жёлтого цвета
3) жидкость, легче воды
4) кристаллическое вещество, не растворяющееся в водеОтвет:
4) кристаллическое вещество, не растворяющееся в воде
Тест 2. Оксид кремния (IV) вступает в реакцию
1) с кислородом
2) с водой
3) с щёлочью
4) с кислотойОтвет:
3) с щёлочью
§38
-
§38. Кремниевая кислота и её соли. Стекло. Цемент.
Задание 1. Как можно получить кремниевую кислоту из оксида кремния (IV)? Напишите уравнения реакций.
Ответ:
SiO2 + 2NaOH t ⟶ Na2SiO3 + H2O
Na2SiO3 + 2HCl ⟶ 2NaCl + H2SiO3↓Задание 2. Работая в парах, составьте рассказ о силикатах по плану: состав ⟶ строение ⟶ свойства ⟶ применение.
Ответ:
Силикаты
Состав
Силикаты это соли кремниевой кислоты. Как и для кремниевой кислоты, формулы, принятые для её солей (Na2SiO3, CaSiO3), условны. Существует много различных силикатов, которые образуются при полном или частичном замещении атомов водорода атомами металлов в молекулах кислот состава nSiO2m∙H2O.
Свойства
Физические свойства. Многие силикаты тугоплавки и в воде практически нерастворимы, растворимы лишь силикаты натрия и калия.
Химические свойства.
Реагируют почти со всеми кислотами, в том числе и с угольной кислотой:
Na2SiO3 + H2O + CO2 ⟶ Na2CO3 + H2SiO3↓
В результате образуется белый студенистый осадок кремниевой кислоты. Эту реакцию используют для обнаружения силикатов.Растворимые силикаты могут участвовать в реакциях обмена с другими солями:
Na2SiO3 + CaCl2 ⟶ CaSiO3↓ + 2NaClВ водных растворах силикаты подвергаются гидролизу. Водные растворы силикатов имеют щелочную среду:
Na2SiO3 + HOH ⇄ NaOH + NaHSiO3Применение
Используются для производства стекла, цемента. Некоторые силикаты применяют для пропитки древесины, чтобы придать ей огнеупорность. Водный раствор силиката натрия используется в качестве силикатного клея. Силикаты используются в качестве поделочных камней.
Задание 3. В двух пробирках находятся растворы силиката калия и карбоната калия. Как различить эти соли? Напишите молекулярные, ионные и сокращённые ионные уравнения реакций.
Ответ:
Различить силикат калия и карбонат калия можно с помощью раствора сильной кислоты, например, соляной кислоты.
В результате реакции силиката калия с соляной кислотой образуется белый студенистый осадок:
Na2SiO3 + 2HCl ⟶ 2NaCl + H2SiO3↓
2Na+ + SiO32- + 2H+ + 2Cl- ⟶ 2Na+ + 2Cl- + H2SiO3↓
2H+ + SiO32- ⟶ H2SiO3↓
В результате реакции карбоната калия с соляной кислотой образуется газ:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑
2Na+ + CO32- + 2H+ + 2Cl- ⟶ 2Na+ + 2Cl- + H2O + CO2↑
2H+ + CO32- ⟶ H2O + CO2↑Задание 4. Сколько потребуется оксида кремния (IV), содержащего 0,2 массовой доли примесей, чтобы получить 6,1 кг силиката натрия?
Ответ:
Дано:
`ω("примеси") = 0.2`
`m(Na_2SiO_3) = 6.1" кг"`
`m_("тех.")(SiO_2) = ?`
Решение
`SiO_2 + 2NaOH overset(t)(=) Na_2SiO_3 + H_2O`
`n(Na_2SiO_3) = (m(Na_2SiO_3))/(M(Na_2SiO_3)) = 6.1/122 = 0.05" кмоль"`
`n(SiO_2) =n(Na_2SiO_3) = 0.05" кмоль"`
`m(SiO_2) = n(SiO_2)*M(SiO_2) = 0.05*60 = 3" кг"`
`ω(SiO_2) = 1 - ω("примеси") = 0.8`
`m_("тех.")(SiO_2) = (m(SiO_2))/(ω(SiO_2)) = 3/0.8 = 3.75" кг"`
Ответ: `m_("тех.")(SiO_2) = 3.75" кг"`. §39
-
Глава VII. Металлы.
§39. Характеристика металлов.
Задание 1. Как расположены металлы в периодической таблице Д. И. Менделеева? Чем отличается строение атомов металлов от строения атомов неметаллов?
Ответ:
Металлы располагаются преимущественно в левой и нижней части периодической таблицы, т. е. в основном в I, II и III группах. Атомы металлов, в отличие от атомов неметаллов, обладают большим радиусом, поэтому легко отдают наружные электроны.
Задание 2. Чем по строению и свойствам кристаллические решётки металлов отличаются от ионных и атомных кристаллических решёток?
Ответ:
В узлах ионной кристаллической решетки находятся положительно и отрицательно заряженные ионы. В узлах атомной кристаллической решетки находятся нейтральные атомы. В узлах металлической кристаллической решетки попеременно находятся положительно заряженные ионы и нейтральные атомы, а пространстве между ними находятся свободные электроны, отсюда – хорошая электропроводность.
Задание 3. Каковы общие физические свойства металлов? Объясните эти свойства, основываясь на представлениях о металлической связи.
Ответ:
Все компактные металлы обладают характерным металлическим блеском. Это свойство объясняется тем, что поверхность металла хорошо отражает световые лучи. Металлы отражают также радиоволны.
Металлы — хорошие проводники электричества и теплоты. Это обусловлено наличием в их металлических решётках свободных электронов, которые в электрическом поле приобретают направленное движение.
Многие металлы пластичны и обладают хорошей ковкостью, что также объясняется особенностью металлической связи. Так как ионы в металлической решётке друг с другом непосредственно не связаны, отдельные слои их могут свободно перемешаться один относительно другого.
Некоторые металлы (хром, марганец, сурьма) очень хрупкие. Самые хрупкие металлы находятся в V, VI и VII группах периодической таблицы Д. И. Менделеева. У атомов этих элементов имеется от пяти до семи свободных электронов. Большое количество свободных электронов обеспечивает прочность отдельных слоёв ионов, препятствует их свободному скольжению, и пластичность таких металлов уменьшается.Задание 4. Почему некоторые металлы пластичные (например, медь), а другие — хрупкие (например, сурьма)?
Ответ:
Свободные электроны обеспечивают прочность отдельных слоёв ионов, препятствует их свободному скольжению, и чем больше количество свободных электронов, тем меньше пластичность металла. Поэтому медь обладает хорошей ковкостью, т. к. её атомы имеют всего по 2 валентных электронов, а сурьма является хрупким металлом потому, что её атомы имеют по 5 валентных электронов.
Задание 5. При "растворении" в соляной кислоте 12,9 г сплава, состоящего из меди и цинка, получили 2,24 л водорода (н. у.). Вычислите массовые доли (в процентах) цинка и меди в этом сплаве.
Ответ:
Дано:
`m("латуни") = 12.9 г`
`V(H_2) = 2.24 л`
`ω(Zn) = ?`
`ω(Cu) = ?`
Решение
`Zn + 2HCl = ZnCl_2 + H_2"↑"`
`n(H_2) = (V(H_2))/V_m = 2.24/22.4 = 0.1" моль"`
`n(Zn) = n(H_2) = 0.1" моль"`
`m(Zn) = n(Zn)*M(Zn) = 0.1*65 = 6.5 г`
`ω(Zn) = (100*m(Zn))/(m("латуни")) = (100*6.5)/12.9 = 50.4%`
`ω(Cu) = 100 - ω(Zn) = 100 - 50.4 = 49.6%`
Ответ: `ω(Zn) = 50.4%`, `ω(Cu) = 49.6%`.Задание 6. Медно-алюминиевый сплав обработали 60 г соляной кислоты (массовая доля HCl — 10%). Вычислите массу и объём выделившегося газа (н. у.).
Ответ:
Дано:
`m("р-ра") = 60 г`
`ω(HCl) = 10%`
`m(H_2) = ?`
`V(H_2) = ?`
Решение
`2Al + 6HCl = 2AlCl_3 + 3H_2"↑"`
`m(HCl) = (ω(HCl)*m("р-ра"))/100 = (10*60)/100 = 6 г`
`n(HCl) = (m(HCl))/(M(HCl)) = 6/36.5 = 0.164" моль"`
`n(H_2) = (n(HCl))/2 = 0.164/2 = 0.082" моль"`
`m(H_2) = n(H_2)*M(H_2) = 0.082*2 = 0.164 г`
`V(H_2) = n(H_2)*V_m = 0.082*22.4 = 1.84 л`
Ответ: `m(H_2) = 0.164 г`, `V(H_2) = 1.84 л`.Тестовые задания
Тест 1. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
1) 2ē, 1ē 2) 2ē, 2ē 3) 2ē, 3ē 4) 2ē, 4ēОтвет:
1) 2ē
Тест 2. Наиболее ярко металлические свойства проявляет простое вещество, атомы которого имеют строение электронной оболочки
1) 2ē, 2ē
2) 2ē, 8ē, 2ē
3) 2ē, 8ē, 8ē, 2ē
4) 2ē, 8ē, 18ē, 8ē, 2ēОтвет:
4) 2ē, 8ē, 18ē, 8ē, 2ē
Тест 3. Хорошо проводит электрический ток твёрдое вещество, имеющее кристаллическую решётку
1) молекулярную
2) атомную
3) металлическую
4) ионнуюОтвет:
3) металлическую
§40
-
§40. Нахождение металлов в природе и общие способы их получения.
Задание 1. В виде каких соединений встречаются в природе металлы калий, магний, хром и цинк? Напишите химические формулы этих соединений.
Ответ:
Хлорид калия KCl, нитрат калия KNO3.
Хлорид магния MgCl2, сульфат магния MgSO4.
Оксид хрома (III) Cr2O3
Сульфид цинка ZnSЗадание 2. Предложите три способа получения железа из железной руды Fe2O3 с использованием различных восстановителей. Запишите уравнения реакций.
Ответ:
Fe2O3 + 3H2 t ⟶ 2Fe + 3H2O
Fe2O3 + 3CO t ⟶ 2Fe + 3CO2
Fe2O3 + 2Al ⟶ 2Fe + Al2O3Задание 3. Восстановите левую часть схемы реакции:
… + … ⟶ Pb + CO2Ответ:
PbO2 + C t ⟶ Pb + CO2
§41
-
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов.
Задание 1. На основе представлений о строении атомов поясните, чем металлы по химическим свойствам отличаются от неметаллов.
Ответ:
Атомы металлов обладают, как правило, большим радиусом, поэтому в отличие от атомов неметаллов легко отдают наружные электроны, т. е. являются сильными восстановителями.
Задание 2. Начертите в тетради предлагаемую таблицу. В соответствующих графах напишите уравнения практически осуществимых реакций; укажите условия их протекания (см. табл. 28). Результаты работы обсудите с соседом по парте.
Ответ:
Реагирующие вещества Уравнения практически осуществимых реакций с металлами Na Ca Zn Cu Ag O2 4Na + O2 ⟶ 2Na2O 2Ca + O2 ⟶ 2CaO Zn + O2 t ⟶ 2ZnO Cu + O2 t ⟶ 2CuO H2O 2Na + 2H2O ⟶ 2NaOH + H2↑ Ca + 2H2O ⟶ Ca(OH)2 + H2↑ Pb(NO3)2 (в растворе) Pb(NO3)2 + Zn ⟶ Pb + Zn(NO3)2 HCl 2Na + 2HCl ⟶ 2NaCl + H2↑ Ca + 2HCl ⟶ CaCl2 + H2↑ Zn + 2HCl ⟶ ZnCl2 + H2↑ H2SO4 2Na + H2SO4 ⟶ Na2SO4 + H2↑ Ca + H2SO4 ⟶ CaSO4 + H2↑ Zn + H2SO4 ⟶ ZnSO4 + H2↑ Cu + 2H2SO4 ⟶ CuSO4 + 2H2O + SO2↑ 2Ag + 2H2SO4 ⟶ Ag2SO4 + 2H2O + SO2↑ Задание 3. 6 г смеси, состоящей из порошков алюминия и меди, обработали избытком соляной кислоты, при этом выделилось 3,7 л водорода (н. у.). Вычислите массовую долю (в процентах) каждого металла в смеси.
Ответ:
Дано:
`m("смеси") = 6 г`
`V(H_2) = 3.7 л`
`ω(Al) = ?`
`ω(Cu) = ?`
Решение
`2Al + 6HCl = 2AlCl_3 + 3H_2"↑"`
`n(H_2) = (V(H_2))/V_m = 3.7/22.4 = 0.165" моль"`
`n(Al) = (2*n(H_2))/3 = (2*0.165)/3 = 0.11" моль"`
`m(Al) = n(Al)*M(Al) = 0.11*27 = 2.97 г`
`ω(Al) = (100*m(Al))/(m("смеси")) = (100*2.97)/6 = 49.5%`
`ω(Cu) = 100 - ω(Al) = 100 - 49.5 = 50.5%`
Ответ: `ω(Al) = 49.5%`, `ω(Cu) = 50.5%`. §42
-
§42. Сплавы.
Задание 1. Изложите сущность процесса образования сплавов. Почему сплавы обычно твёрже исходных металлов?
Ответ:
В расплавленном состоянии металлы легко смешиваются между собой, а при охлаждении такая смесь застывает и приобретает свойства, которых не было у образующих её металлов, в этом и заключается сущность процесса образования сплавов.
Способность металлов в расплавленном состоянии не только механически смешиваться, но и образовывать друг с другом (и с атомами неметаллов) различные соединения – одна из причин, объясняющая, почему сплавы по физическим свойствам так резко отличаются от составляющих их металлов.Задание 2. Почему в технике широко используют сплавы железа, а не чистое железо? Какие сплавы железа применяют на производстве и в быту?
Ответ:
Чистое железо менее твердое и легко корродирует, поэтому на производстве и в быту применяют сплавы железа. Важнейшие из них – чугун (содержит 2,1-4% углерода, а также кремний, марганец, небольшие количества серы и фосфора) и сталь (содержит 0,3-2,1 % углерода и небольшие количества кремния, марганца, фосфора и серы). Твердость этих сплавов обусловлена тем, что атомы железа реагируют с атомами углерода, и образуется карбид железа Fe3C.
Задание 3. Рассчитайте массы оксида свинца и оксида олова, необходимых для получения 500 г припоя, состоящего из 34% олова и 66% свинца.
Ответ:
Дано:
`m("припой") = 500 г`
`ω(Sn) = 34%`
`ω(Pb) = 66%`
`m(SnO_2) = ?`
`m(PbO_2) = ?`
Решение
`SnO_2 ⟶ Sn`
`m(Sn) = (ω(Sn)*m("припой"))/100 = (34*500)/100 = 170 г`
`n(Sn) = (m(Sn))/(M(Sn)) = 170/119 = 1.43" моль"`
`n(SnO_2) = n(Sn) = 1.43" моль"`
`m(SnO_2) = n(SnO_2)*M(SnO_2) = 1.43*151 = 216 г`
`PbO_2 ⟶ Pb`
`m(Pb) = (ω(Pb)*m("припой"))/100 = (66*500)/100 = 330 г`
`n(Pb) = (m(Pb))/(M(Pb)) = 330/207 = 1.59" моль"`
`n(PbO_2) = n(Pb) = 1.59" моль"`
`m(PbO_2) = n(PbO_2)*M(PbO_2) = 1.59*239 = 380 г`
Ответ: `m(SnO_2) = 216 г`, `m(PbO_2) = 380 г`. §43
-
§43. Щелочные металлы.
Задание 1. Начертите схему строения атома рубидия Rb. Сравните её со схемами строения атомов натрия и цезия.
Ответ:
Атомы рубидия, натрия и цезия имеют по одному валентному электрону, различие состоит в том, что они имеют разное количество электронных слоёв.Задание 2. Почему все щелочные металлы – сильные восстановители?
Ответ:
Все щелочные металлы обладают относительно большими радиусами и содержат всего по 1 электрону на внешнем энергетическом уровне, поэтому они легко отдают единственный валентный электрон более электроотрицательным элементам, т. е. проявляют сильные восстановительные свойства.
Задание 3. Сравните реакции щелочных металлов с водой и с кислотами. Составьте уравнения соответствующих реакций и покажите переход электронов.
Ответ:
В реакциях с водой и кислотами щелочные металлы проявляют восстановительные свойства, в результате реакций происходит восстановление водорода и окисление щелочных металлов, также в результате реакции с водой образуется соответствующая щёлочь, а с кислотами – соответствующая соль.
2Na + 2H2O ⟶ 2Na(OH)2 + H2↑
2H+ + 2ē ⟶ H20 |1 окислитель (восстановление) Na0 - 1ē ⟶ Na+ |2 восстановитель (окисление) 2Na + 2HCl ⟶ 2NaCl + H2↑
2H+ + 2ē ⟶ H20 |1 окислитель (восстановление) Na0 - 1ē ⟶ Na+ |2 восстановитель (окисление) Задание 4. Сколько граммов раствора, содержащего 0,1 массовой доли, или 10%, гидроксида натрия, потребуется для нейтрализации 196 г раствора, содержащего 0,1 массовой доли, или 10%, серной кислоты?
Ответ:
Дано:
`ω_1(NaOH) = 0.1`
`m_2("р-ра") = 196 г`
`ω_2(H_2SO_4) = 0.1`
`m_1("р-ра") = ?`
Решение
`H_2SO_4 + 2NaOH = Na_2SO_4 + 2H_2O`
`m(H_2SO_4) = ω_2(H_2SO_4)*m_2("р-ра") = 196*0.1 = 19.6 г`
`n(H_2SO_4) = (m(H_2SO_4))/(M(H_2SO_4)) = 19.6/98 = 0.2" моль"`
`n(NaOH) = 2*n(H_2SO_4) = 2*0.2 = 0.4" моль"`
`m(NaOH) = n(NaOH)*M(NaOH) = 0.4*40 = 16 г`
`m_1("р-ра") = (m(NaOH))/(ω_1(NaOH)) = 16/0.1 = 160 г`
Ответ: `m("р-ра "NaOH) = 160 г`.Задание 5. При обработке 15 г технической поваренной соли концентрированной серной кислотой выделилось 5,6 л газа (н. у.). Рассчитайте массовую долю (в процентах) примесей в поваренной соли.
Ответ:
Дано:
`m_("тех.")(NaCl) = 15 г`
`V(HCl) = 5.6 л`
`ω("примеси") = ?`
Решение
`2NaCl + H_2SO_(4"(конц.)") = Na_2SO_4 + 2HCl"↑"`
`n(HCl) = (V(HCl))/V_m = 5.6/22.4 = 0.25" моль"`
`n(NaCl) = n(HCl) = 0.25" моль"`
`m(NaCl) = n(NaCl)*M(NaCl) = 0.25*58.5 = 14.625 г`
`m("примеси") = m_("тех.")(NaCl) - m(NaCl) = 15 - 14.625 = 0.375 г`
`ω("примеси") = (100*m("примеси"))/(m_("тех.")(NaCl)) = (100*0.375)/15 = 2.5%`
Ответ: `ω("примеси") = 2.5%`.Задание 6. Определите, какая соль получится, и рассчитайте её массу, если через 100 мл раствора, содержащего 0,32 массовой доли, или 32%, гидроксида калия (ρ = 1,32 г/см3), пропустили весь оксид углерода (IV), который образуется при сжигании 18 л метана (н. у.).
Ответ:
Дано:
`V_1("р-ра") = 100" мл"`
`ρ_1("р-ра") = 1.32" г/мл"`
`ω_1(KOH) = 0.32`
`V(CH_4) = 18 л`
`m("соли") = ?`
Решение
`CH_4 + 2O_2 = CO_2 + 2H_2O`
`n(CH_4) = (V(CH_4))/V_m = 18/22.4 = 0.8036" моль"`
`n(CO_2) = n(CH_4) = 0.8036" моль"`
`m_1("р-ра") = ρ_1("р-ра")*V_1("р-ра") = 1.32*100 = 132 г`
`m(KOH) = ω_1(KOH)*m_1("р-ра") = 0.32*132 = 42.24 г`
`n(KOH) = (m(KOH))/(M(KOH)) = 42.24/56 = 0.7543" моль"`
Углекислого газа в избытке, поэтому реакция пойдет по схеме:
`CO_2 + KOH = KHCO_3`
`n(KHCO_3) = n(KOH) = 0.7543" моль"`
`m(KHCO_3) = n(KHCO_3)*M(KHCO_3) = 0.7543*100 = 75.43 г`
Ответ: `m(KHCO_3) = 75.43 г`.Тестовые задания
Тест 1.
Химический элемент, атомная масса которого 23, а число нейронов в ядре равно 12, в периодической системе находится
1) в 3-м периоде, IБ-группе
2) в 4-м периоде, IIIА-группе
3) в 4-м периоде, VIIБ-группе
4) в 3-м периоде, IА-группеОтвет:
4)
Номер элемента = атомная масса - число нейронов = 23 - 12 = 11.Тест 2. При взаимодействии калия с водой наряду с водородом образуется
1) оксид 2) гидроксид 3) пероксид 4) гидридОтвет:
2)
2K + H2O = 2KOH + H2"↑"Тест 3. Необходимо строго соблюдать правила безопасности, работая с веществом
1) KCl 2) KOH 3) Cu 4) NaClОтвет:
2) KOH
§44
-
§44. Магний. Щелочноземельные металлы.
Задание 1. На основе положения в периодической таблице и представлений о строении атомов поясните, какие свойства магния и кальция являются общими. Составьте уравнения соответствующих реакций.
Ответ:
Магний и кальций располагаются во IIА-группе, поэтому у них на внешнем энергетическом уровне находится два электрона, имеют относительно большие радиусы атомов, проявляют типично металлические свойства, т. е. в реакциях проявляют восстановительные свойства.
Реагируют с неметаллами, например, с хлором и с серой:
Mg + S ⟶ MgS
Ca + S ⟶ CaS
Mg + Cl2 ⟶ MgCl2
Ca + Cl2 ⟶ CaCl2
Реагируют с водой:
Mg + 2H2O t ⟶ Mg(OH)2 + H2↑
Ca + 2H2O ⟶ Ca(OH)2 + H2↑
Реагируют с кислотами:
Mg + 2HCl ⟶ MgCl2 + H2↑
Ca + 2HCl ⟶ CaCl2 + H2↑
Реагируют с водородом при нагревании:
Mg + H2 ⟶ MgH2
Ca + H2 ⟶ CaH2
Реагируют с кислородом:
2Mg + O2 ⟶ 2MgO
2Ca + O2 ⟶ 2CaOЗадание 2. В периодической таблице кальций находится рядом с калием, однако его химические свойства более близки к свойствам натрия, который находится в другом периоде. Обсудите этот вопрос с соседом по парте.
Ответ:
Калий и кальций находятся в одном периоде, но на внешнем энергетическом уровне у калия 1 электрон, а у кальция – 2, соответственно калий легче отдаёт электроны, чем кальция, т. е. у кальция электроотрицательность больше, чем у калия.
Натрий и калий находятся IА-группе, но разных периодах, поэтому имеют разное количество электронных слоёв у калия их 4, а у натрия – 3, поэтому у натрия радиус атома меньше, чем у калия, соответственно калий легче отдаёт электроны, чем натрий, т. е. у натрия электроотрицательность больше, чем у калия.
Так как у натрия и кальция электроотрицательности больше, чем у калия, то можно предположить, что их электроотрицательности приблизительно равны, соответственно их химические свойства схожи.Задание 3. Под воздействием окружающей среды кальций превращается в карбонат кальция. Составьте уравнения соответствующих реакций.
Ответ:
Кальций реагирует с кислородом или с влагой воздуха:
Ca + O2 ⟶ 2CaO
Ca + 2H2O ⟶ Ca(OH)2 + H2↑
Образовавшийся оксид кальция может также прореагировать с влагой воздуха:
CaO + H2O ⟶ Ca(OH)2
Оксид и гидроксид кальция реагируют с углекислым газом:
CaO + CO2 ⟶ CaCO3
Ca(OH)2 + CO2 ⟶ CaCO3 + H2OЗадание 4. При прокаливании 50 кг чистого карбоната кальция его масса уменьшилась на 4,4 кг. Сколько процентов карбоната кальция разложилось?
Ответ:
Дано:
`m(CaCO_3) = 50" кг"`
`m(CO_2) = 4.4" кг"`
`ω_("разл.")(CaCO_3) = ?`
Решение
`CaCO_3 overset(t)(=) CaO + CO_2"↑"`
`n(CO_2) = (m(CO_2))/(M(CO_2)) = 4.4/44 = 0.1" кмоль"`
`n_("разл.")(CaCO_3) = n(CO_2) = 0.1" кмоль"`
`m_("разл.")(CaCO_3) = n_("разл.")(CaCO_3)*M(CaCO_3) = 0.1*100 = 10" кг"`
`ω_("разл.")(CaCO_3) = (100*m_("разл.")(CaCO_3))/(m(CaCO_3)) = (100*10)/50 = 20%`
Ответ: `ω_("разл.")(CaCO_3) = 20%`.Задание 5. 8 г металла со степенью окисления +2 прореагировало с водой и выделилось 4,48 л водорода (н. у.). Определите относительную атомную массу металла и назовите его.
Ответ:
Дано:
`m(Me) = 8 г`
`V(H_2) = 4.48 л`
`M(Me) = ?`
Решение
`Me + 2H_2O = Me(OH)_2 + H_2"↑"`
`n(H_2) = (V(H_2))/V_m = 4.48/22.4 = 0.2" моль"`
`n(Me) = n(H_2) = 0.2" моль"`
`M(Me) = (m(Me))/(n(Me)) = 8/0.2 = 40" г/моль"`
Данная молярная масса соответствует кальцию Ca.
Ответ: `M(Ca) = 40" г/моль"`.Тестовые задания
Тест 1. Распределение электронов по слоям в атоме химического элемента, заряд которого +12, следующее
1) 2, 8, 8, 1
2) 2, 8, 2
3) 2, 8, 8, 2
4) 2, 8, 8Ответ:
2) 2, 8, 2
Тест 2. В ряду Mg — Ca — Sr — Ba способность металлов отдавать электроны
1) усиливается
2) ослабевает
3) не изменяется
4) изменяется периодическиОтвет:
1) усиливается
Тест 3. Реакцию между магнием и соляной кислотой относят к реакциям
1) соединения
2) обмена
3) разложения
4) замещенияОтвет:
4) замещения
§45
-
§45. Важнейшие соединения кальция. Жёсткость воды.
Задание 1. Какие превращения происходят с гашёной известью при использовании её в строительстве? Напишите уравнения соответствующих реакций.
Ответ:
Гашёная известь постепенно затвердевает, т. к. она реагирует с углекислым газом воздуха, в результате реакции образуется нерастворимый карбонат кальция:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2OЗадание 2. Почему жёсткую воду нельзя использовать для охлаждения двигателей машин? Ответ подтвердите уравнением реакции.
Ответ:
Жёсткую воду нельзя использовать для охлаждения двигателей машин потому, что под действием температуры гидрокарбонат кальция разлагается с образованием нерастворимого карбоната кальция (накипи), который отлагается на внутренние стенки теплообменника. Теплопроводность накипи в десятки и сотни раз меньше теплопроводности металла, из которого изготавливают теплообменники. Поэтому даже тончайший слой накипи создаёт большое термическое сопротивление, что может привести к перегреву двигателя автомобиля.
Ca(HCO3)2 t ⟶ CaCO3↓ + H2O + CO2↑Задание 3. Каковы основные способы устранения жёсткости воды? Напишите уравнения соответствующих реакций.
Ответ:
Временная жёсткость воды обусловлена присутствием гидрокарбонатов кальция и магния. Её можно устранить следующими способами:
Кипячением:
Mg(HCO3)2 t ⟶ MgCO3↓ + H2O + CO2↑
Ca(HCO3)2 t ⟶ CaCO3↓ + H2O + CO2↑
Действием известкового молока или соды:
Ca(OH)2 + Ca(HCO3)2 ⟶ 2CaCO3↓ + 2H2O
Na2CO3 + Ca(HCO3)2 ⟶ CaCO3↓ + 2NaHCO3
Постоянная жёсткость воды обусловлена присутствием сульфатов и хлоридов кальция и магния. Её устраняют действием соды:
MgSO4 + Na2CO3 ⟶ MgCO3↓ + Na2SO4
CaSO4 + Na2CO3 ⟶ CaCO3↓ + Na2SO4Задание 4. Составьте уравнения реакций к схеме 14.
Ответ:
`underset("кальций")(Ca) + H_2 overset(t)(⟶) underset("гидрид кальция")(CaH_2)`
`underset("кальций")(Ca) + 2HCl ⟶ underset("хлорид кальция")(CaCl_2) + H_2"↑"`
`underset("кальций")(2Ca) + O_2 ⟶ underset("оксид кальция")(2CaO)`
`underset("оксид кальция")(Ca) + 2C overset(t)(⟶) underset("карбид кальция")(CaC_2)`
`underset("оксид кальция")(CaO) + 2HCl ⟶ underset("хлорид кальция")(CaCl_2) + H_2O`
`underset("оксид кальция")(CaO) + 3C overset(t)(⟶) underset("карбид кальция")(CaC_2) + CO`
`underset("оксид кальция")(CaO) + H_2O ⟶ underset("гидроксид кальция")(Ca(OH)_2)`
`underset("карбид кальция")(CaC_2) + 2H_2O ⟶ underset("гидроксид кальция")(Ca(OH)_2) + C_2H_2"↑"`
`underset("гидроксид кальция")(Ca(OH)_2) + 2HCl ⟶ underset("хлорид кальция")(CaCl_2) + 2H_2O`
`underset("гидроксид кальция")(Ca(OH)_2) + underset("оксид углерода (IV)")(CO_2) ⟶ underset("карбонат кальция")(CaCO_3"↓") + 2H_2O`
`underset("карбонат кальция")(CaCO_3) overset(t)(⟶) CaO + underset("оксид углерода (IV)")(CO_2)`
`underset("карбонат кальция")(CaCO_3) + H_2O + CO_2 ⟶ underset("гидрокарбонат кальция")(Ca(HCO_3)_2)`
`underset("карбонат кальция")(CaCO_3) + H_2O ⇄ underset("гидроксид кальция")(Ca(OH)_2) + H_2CO_3`
`underset("гидрокарбонат кальция")(Ca(HCO_3)_2) overset(t)(⟶) underset("карбонат кальция")(CaCO_3"↓") + H_2O + CO_2"↑"`Задание 5. Поташ K2CO3 массой 2,76 г обработали раствором гашёной извести массой 2000 г. Вычислите массу гашёной извести, израсходованной на обработку поташа, и массовую долю (в процентах) Ca(OH)2 в растворе.
Ответ:
Дано:
`m(K_2CO_3) = 2.76 г`
`m("р-ра "Ca(OH)_2) = 2000 г`
`m(Ca(OH)_2) = ?`
`ω(Ca(OH)_2) = ?`
Решение
`K_2CO_3 + Ca(OH)_2 = 2KOH + CaCO_3"↓"`
`n(K_2CO_3) = (m(K_2CO_3))/(M(K_2CO_3)) = 2.76/138 = 0.02" моль"`
`n(Ca(OH)_2) = n(K_2CO_3) = 0.02" моль"`
`m(Ca(OH)_2) = n(Ca(OH)_2)*M(Ca(OH)_2) = 0.02*74 = 1.48 г`
`ω(Ca(OH)_2) = (100*m(Ca(OH)_2))/(m("р-ра "Ca(OH)_2)) = (100*1.48)/2000 = 0.074%`
Ответ: `m(Ca(OH)_2) = 1.48 г`, `ω(Ca(OH)_2) = 0.074%`.Тестовые задания
Тест 1. Расположите формулы оксидов в порядке усиления основных свойств
1) MgO 2) BaO 3) SrO 4) CaOОтвет:
1, 4, 3, 2.
Тест 2. Постоянная жёсткость воды обусловлена наличием:
1) гидрокарбонатов кальция и магния
2) сульфатов и хлоридов кальция и магния
3) гипохлорита кальция
4) нитратов кальция и магнияОтвет:
2) сульфатов и хлоридов кальция и магния
Тест 3. Для умягчения жёсткой воды нужно
1) добавить карбонат натрия и отфильтровать получившийся осадок
2) добавить растворимую соль кальция или магния
3) озонировать водуОтвет:
1) добавить карбонат натрия и отфильтровать получившийся осадок
§46. Алюминий.
§46
-
Задание 1. Пользуясь периодической таблицей и на основе представлений о строении атомов, поясните, как изменяются свойства элементов в ряду Na — Mg — Al.
Ответ:
В ряду элементов Na — Mg — Al увеличивается количество электронов на внешнем энергетическом уровне, соответственно увеличивается сила притяжения электронов, как следствие уменьшается радиус атомов, атомам становится сложнее отдавать свои валентные электроны, поэтому металлические ослабевают, а неметаллические свойства усиливаются.
Задание 2. Почему алюминий в природе встречается только в соединениях?
Ответ:
Алюминий в ряду напряжений металлов помещается сразу за самыми активными металлами, поэтому в природе он встречается только в виде соединений.
Задание 3. Охарактеризуйте важнейшие природные соединения алюминия.
Ответ:
Важнейшие природные соединения алюминия:
- Каолинит (важнейшая составная часть глины) – Al2O3∙2SiO2∙2H2O
- Корунд – Al2O3
- Полевой шпат или ортоклаз – K2O Al2O3∙6SiO2
- Боксит (алюминиевая руда) – Al2O3∙nH2O
- Нефелин – Na2O∙Al2O3∙2SiO2
Задание 4. Для получения алюминия из AlCl3 в качестве восстановителя можно использовать кальций. Охарактеризуйте этот процесс и составьте уравнение реакции, покажите переход электронов. Почему эту реакцию нельзя проводить в водном растворе.
Ответ:
2AlCl3 + 3Ca ⟶ 2Al + 3CaCl2
Al+3 + 3ē ⟶ Al0 |2 окислитель (восстановление) Ca0 - 2ē ⟶ Ca+2 |3 восстановитель (окисление) Эту реакцию нельзя проводить в водном растворе потому, что кальций реагирует с водой с образованием щелочи.
Задание 5. Составьте уравнения реакций, в которых алюминий восстанавливает: а) галогены; б) железо; в) ионы водорода; г) серу; д) кислород. Покажите переход электронов.
Ответ:
а) 2Al + 3Cl2 ⟶ 2AlCl3 Cl20 + 2ē ⟶ 2Cl- |3 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |2 восстановитель (окисление) б) 2Al + Fe2O3 ⟶ Al2O3 + 2Fe Fe+3 + 3ē ⟶ Fe0 |1 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |1 восстановитель (окисление) в) 2Al + 2NaOH + 6H2O ⟶ 2Na[Al(OH)4] + 3H2↑ 2H+ + 2ē ⟶ H20 |3 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |2 восстановитель (окисление) г) 2Al + 3S ⟶ Al2S3 S0 + 2ē ⟶ S-2 |3 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |2 восстановитель (окисление) д) 4Al + 3O2 ⟶ 2Al2O3 O20 + 4ē ⟶ O-2 |3 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |4 восстановитель (окисление) Задание 6. Могут ли быть окислителями: а) атомы алюминия; б) ионы алюминия? Ответ подтвердите уравнениями реакций.
Ответ:
а) Алюминий это типичный металл имеет минимальную степень окисления 0, поэтому он может проявлять только восстановительные свойства.
2Al + 3S ⟶ Al2S3 S0 + 2ē ⟶ S-2 |3 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |2 восстановитель (окисление) б) Ионы алюминия имеют максимальную степень окисления +3, поэтому они могут проявлять только окислительные свойства.
2AlCl3 + 3Ca ⟶ 2Al + 3CaCl2 Al+3 + 3ē ⟶ Al0 |2 окислитель (восстановление) Ca0 - 2ē ⟶ Ca+2 |3 восстановитель (окисление) Задание 7. Сколько потребуется алюминия, чтобы при реакции с соляной кислотой получить столько водорода, сколько его выделяется при взаимодействии 1 моль натрия с водой?
Ответ:
Дано:
`n(Na) = 1" моль"`
`m(Al) = ?`
Решение
`2Na + 2H_2O = 2NaOH + H_2"↑"`
`n(H_2) = (n(Na))/2 = 1/2 = 0.5" моль"`
`2Al + 6HCl = 2AlCl_3 + 3H_2"↑"`
`n(Al) = (2*n(H_2))/3 = (2*0.5)/3 = 0.333" моль"`
`m(Al) = n(Al)*M(Al) = 0.333*27 = 9 г`
Ответ: `m(Al) = 9 г`.Задание 8. На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л некоторого газа (н. у.). Вычислите процентный состав сплава, если его общая масса была 10 г.
Ответ:
Дано:
`V(H_2) = 2.24 л`
`m("сплава") = 10 г`
`ω(Al) = ?`
`ω(Cu) = ?`
Решение
`2Al + 2NaOH + 6H_2O = 2Na[Al(OH)_4] + 3H_2"↑"`
`n(H_2) = (V(H_2))/V_m = 2.24/22.4 = 0.1" моль"`
`n(Al) = (2*n(H_2))/3 = (2*0.1)/3 = 0.0667" моль"`
`m(Al) = n(Al)*M(Al) = 0.0667*27 = 1.8 г`
`ω(Al) = (100*m(Al))/(m("сплава")) = (100*1.8)/10 = 18%`
`ω(Cu) = 100 - ω(Al) = 100 - 18 = 82%`
Ответ: `ω(Al) = 18%`, `ω(Cu) = 82%`.Тестовые задания
Тест 1. Схема строения иона Al3+ – это
1) (+13) 2, 8
2) (+13) 2, 8, 3
3) (+8) 2, 8
4) (+12) 2, 8Ответ:
1) (+13) 2, 8
Тест 2. Один из способов получения металлов, например, по уравнению реакции
Fe2O3 + 2Al = Al2O3 + 2Fe
называют ____.Ответ:
алюминотермия.
Тест 3. Химическую реакцию, уравнение которой
2Al + 6HCl = 2AlCl3 + 3H2↑,
относят к реакциям 1) соединения 2) разложения 3) обмена 4) замещенияОтвет:
4) замещения
Тест 4. Установите соответствие между названием минерала и его формулой.
1) боксит 2) корунд 3) каолинит 4) полевой шпат
А. Al2O3
Б. K2O∙Al2O3∙6SiO2
В. Al2O3∙2SiO2∙2H2O
Г. Al2O3∙nH2OОтвет:
1) Г; 2) А; 3) В; 4) Б.
§47
-
§47. Важнейшие соединения алюминия.
Задание 1. К раствору сульфата алюминия понемногу приливали раствор щёлочи (до избытка). Что наблюдали? Составьте уравнения соответствующих реакций.
Ответ:
При добавлении раствора щёлочи к раствору сульфата алюминия наблюдается выпадение белого осадка:
Al2(SO4)3 + 6NaOH ⟶ 3Na2SO4 + 2Al(OH)3
При дальнейшем добавлении раствора щёлочи наблюдается растворение осадка:
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]Задание 2. В водные растворы хлорида натрия и хлорида алюминия опустили синюю лакмусовую бумагу. Как изменился её цвет и почему?
Ответ:
В растворе хлорида натрия цвет лакмусовой бумаги не изменился потому, что NaCl — соль образованная сильным основанием и сильной кислотой, поэтому гидролиз не протекает, соответственно раствор имеет нейтральную среду.
В растворе хлорида алюминия цвет лакмусовой бумаги изменился на красный потому, что AlCl3 — соль образованная слабым основанием и сильной кислотой, поэтому протекает гидролиз в результате которого образуются катионы водорода (H+):
AlCl3 + HOH ⇄ AlOHCl2 + HCl
Al3+ + 3Cl- + HOH ⇄ AlOH2+ + 2Cl- + H+ + Cl-
Al3+ + HOH ⇄ AlOH2+ + H+Задание 3. Составьте уравнения реакций согласно схеме 16. Обсудите выполнение задания с соседом по парте.
Ответ:
`underset("алюминий")(4Al) + 3O_2 ⟶ underset("оксид алюминия")(2Al_2O_3)`
`underset("алюминий")(2Al) + 6H_2O ⟶ underset("гидроксид алюминия")(2Al(OH)_3) + 3H_2"↑"`
`underset("алюминий")(2Al) + 6HCl ⟶ underset("хлорид алюминия (соль)")(2AlCl_3) + 3H_2"↑"`
`underset("оксид алюминия")(Al_2O_3) + 6HCl ⟶ underset("хлорид алюминия (соль)")(2AlCl_3) + 3H_2O`
`underset("оксид алюминия")(Al_2O_3) + 2NaOH overset(t)(⟶) underset("алюминат натрия")(2NaAlO_2) + H_2O`
`underset("оксид алюминия")(Al_2O_3) + 3Ca overset(t)(⟶) underset("алюминий")(2Al) + 3CaO`
`underset("гидроксид алюминия")(Al(OH)_3) + 3HCl ⟶ underset("хлорид алюминия (соль)")(AlCl_3) + 3H_2O`
`underset("гидроксид алюминия")(Al(OH)_3) + NaOH overset(t)(⟶) underset("алюминат натрия")(NaAlO_2) + 2H_2O`
`underset("хлорид алюминия (соль)")(AlCl_3) + 3NaOH ⟶ underset("гидроксид алюминия")(Al(OH)_3"↓") + 3NaCl`Задание 4. Напишите уравнения химических реакций, соответствующих превращениям
Al0 ⟶ Al+3 ⟶ Al0Ответ:
2Al + 3Cl2 ⟶ 2AlCl3 Cl20 + 2ē ⟶ 2Cl- |3 окислитель (восстановление) Al0 - 3ē ⟶ Al+3 |2 восстановитель (окисление) 2AlCl3 + 3Ca ⟶ 2Al + 3CaCl2 Al+3 + 3ē ⟶ Al0 |2 окислитель (восстановление) Ca0 - 2ē ⟶ Ca+2 |3 восстановитель (окисление) Задание 5. Дано 40 г раствора, содержащего 5% хлорида алюминия. Сколько потребуется миллилитров раствора (ρ = 1,2 г/см3), содержащего 0,2 массовой доли, или 20%, гидроксида натрия, чтобы хлорид алюминия полностью превратить в тетрагидроксоалюминат натрия?
Ответ:
Дано:
`m_1("р-ра") = 40 г`
`ω_1(AlCl_3) = 5%`
`ρ_2("р-ра") = 1.2" г/мл"`
`ω_2(NaOH) = 20%`
`V_2("р-ра") = ?`
Решение
`AlCl_3 + 4NaOH = 3NaCl + Na[Al(OH)_4]`
`m(AlCl_3) = (ω_1(AlCl_3)*m_1("р-ра"))/100 = (5*40)/100 = 2 г`
`n(AlCl_3) = (m(AlCl_3))/(M(AlCl_3)) = 2/133.5 = 0.015" моль"`
`n(NaOH) = 4*n(AlCl_3) = 0.015*4 = 0.06" моль"`
`m(NaOH) = n(NaOH)*M(NaOH) = 0.06*40 = 2.4 г`
`m_2("р-ра") = (100*m(NaOH))/(ω_2(NaOH)) = (100*2.4)/20 = 12 г`
`V_2("р-ра") = (m_2("р-ра"))/(ρ_2("р-ра")) = 12/1.2 = 10" мл"`
Ответ: `V("р-ра "NaOH) = 10" мл"` §48
-
§48. Железо.
Задание 1. В каком виде железо встречается в природе? Напишите формулы соединений и дайте им названия.
Ответ:
Железо в природе встречается в виде соединений. Основные минералы содержащие соединения железа:
- Магнетит (магнитный железняк) – Fe3O4 (FeO∙Fe2O3) – оксиды железа (II,III).
- Гематит (красный железняк) – Fe2O3 – оксид железа (III).
- Лимонит (бурый железняк) – Fe2O3∙nH2O – смесь гидратов оксида железа (III)
- Пирит – FeS2 – дисульфид железа (II).
- Сидерит – FeCO3 – карбонат железа (II).
- Метеоритное железо – Fe – почти чистое железо.
Задание 2. Составьте уравнения реакций, в которых железо реагирует: а) с кислотами; б) с солями; в) с водой при повышенной температуре. Покажите переход электронов и укажите окислитель и восстановитель.
Ответ:
а) Fe + 2HCl ⟶ FeCl2 + H2↑ 2H+ + 2ē ⟶ H20 |1 окислитель (восстановление) Fe0 - 2ē ⟶ Fe+2 |1 восстановитель (окисление) б) Fe + CuSO4 ⟶ FeSO4 + Cu Cu+2 + 2ē ⟶ Cu0 |1 окислитель (восстановление) Fe0 - 2ē ⟶ Fe+2 |1 восстановитель (окисление) в) 3Fe + 4H2O t ⟶ FeO∙Fe2O3 + 4H2↑ 2H+ + 2ē ⟶ H20 |4 окислитель (восстановление) Fe0 - 2ē ⟶ Fe+2 |1 восстановитель (окисление) 2Fe0 - 6ē ⟶ 2Fe+3 Задание 3. Используя знания по биологии, Интернет и дополнительную литературу, охарактеризуйте роль элемента железа в организме человека.
Ответ:
Железо в организме человека входит в состав железосодержащих белков, таких как: гемоглобин (68%), ферритин (27%), миоглобин (4%), трансферрин (0,1%).
Главные функции гемоглобина: перенос кислорода от легких к органам и тканям организма, а также буферная функция, заключающаяся в том, что человек может прожить некоторое время без дыхания. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Главные функции ферритина: связывание ионов железа и создание в организме человека запасов железа.
Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Трансферрины принимают участие в обеспечении врождённого иммунитета. Трансферрины присутствуют в слизистых оболочках, где связывают ионы железа. В результате снижения концентрации свободных ионов железа, лишь незначительная часть бактерий способна размножаться в таких условиях.Задание 4. Минеральная вода некоторых источников содержит гидрокарбонат железа (II). При каких условиях и в каких химических процессах эта растворимая соль железа может образоваться из природного минерала сидерита FeCO3?
Ответ:
Гидрокарбонат железа (II) может образоваться из природного минерала сидерита FeCO3, если в минеральной воде имеется растворенный углекислый газ:
FeCO3 + H2O + CO2 ⟶ Fe(HCO3)2
Также гидрокарбонат железа (II) может образоваться из сидерита, если в минеральной воде присутствуют гидрокарбонаты щелочных металлов, например, натрия или калия:
FeCO3 + 2NaHCO3 ⟶ Fe(HCO3)2 + Na2CO3Тестовые задания
Тест 1. Схема строения иона Fe3+ — это
1) (+26) 2 8 14 2
2) (+26) 2 8 14
3) (+26) 2 8 13
4) (+27) 2 8 15 2Ответ:
3) (+26) 2 8 13
Тест 2. Степень окисления железа в Fe2(SO4)3 равна
1) +2 2) +3 3) +4 4) +8 Ответ:
2) +3
Тест 3. Металл, который при нагревании реагирует с водой, — это
1) медь 2) железо 3) олово 4) свинецОтвет:
2) железо
§49
-
§49. Соединения железа.
Задание 1. Составьте уравнения реакций, при помощи которых можно получить: а) соли железа (II) и соли железа (III); б) гидроксид железа (II) и гидроксид железа (III); в) оксиды железа.
Ответ:
а)
Fe + 2HCl ⟶ FeCl2 + H2↑
2Fe + 3Cl2 ⟶ 2FeCl3
б)
FeCl2 + 2NaOH ⟶ 2NaCl + Fe(OH)2↓
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
в)
Fe(OH)2 t ⟶ FeO + H2O
2Fe(OH)3 t ⟶ Fe2O3 + 3H2OЗадание 2. Какими общими и специфическими свойствами обладают оксиды и гидроксиды железа? Составьте уравнения соответствующих реакций.
Ответ:
Общие свойства оксидов и гидроксидов железа – реагируют с кислотами:
FeO + 2HCl ⟶ FeCl2 + H2O
Fe2O3 + 6HCl ⟶ 2FeCl3 + 3H2O
Fe(OH)2 + 2HCl ⟶ FeCl2 + 2H2O
Fe(OH)3 + 3HCl ⟶ FeCl3 + 3H2O
Специфические свойства
Гидроксид железа (II) окисляется на воздухе или в присутствии окислителей:
4Fe(OH)2 + O2 + 2H2O ⟶ 4Fe(OH)3
2Fe(OH)2 + H2O2 ⟶ 2Fe(OH)3
Оксид и гидроксид железа (III) реагирует со щелочами (проявляет слабые амфотерные свойства):
Fe2O3 + 2NaOH t ⟶ 2NaFeO2 + H2O
Fe(OH)3 + NaOH t ⟶ NaFeO2 + 2H2OЗадание 3. Определите, какое количество сероводорода (моль) образуется при взаимодействии сульфида железа (II) с соляной кислотой массой 130 г (массовая доля HCl равна 20%).
Ответ:
Дано:
`m("р-ра") = 130 г`
`ω(HCl) = 20%`
`n(H_2S) = ?`
Решение
`FeS + 2HCl = FeCl_2 + H_2S"↑"`
`m(HCl) = (ω(HCl)*m("р-ра"))/100 = (20*130)/100 = 26 г`
`n(HCl) = (m(HCl))/(M(HCl)) = 26/36.5 = 0.712" моль"`
`n(H_2S) = (n(HCl))/2 = 0.712/2 = 0.356" моль"`
Ответ: `n(H_2S) = 0.356" моль"`.Задание 4. Образец сидерита, основная часть которого FeCO3, содержит 40% железа. Вычислите, сколько процентов FeCO3 в этом образце.
Ответ:
Дано:
Сидерит
`ω(Fe) = 40%`
`ω(FeCO_3) = ?`
Решение
Допустим имеется 100 г сидерита, тогда:
`m(Fe) = (ω(Fe)*m("сидерита"))/100 = (40*100)/100 = 40 г`
`n(Fe) = (m(Fe))/(M(Fe)) = 40/56 = 0.714" моль"`
`n(FeCO_3) = n(Fe) = 0.714" моль"`
`m(FeCO_3) = n(FeCO_3)*M(FeCO_3) = 0.714*116 = 82.8 г`
`ω(FeCO_3) = (100*m(FeCO_3))/(m("сидерита")) = (100*82.8)/100 = 82.8%`
Ответ: `ω(FeCO_3) = 82.8%`.Тестовые задания
Тест 1. Расположите формулы оксидов в порядке усиления их основных свойств
1) FeO 2) CaO 3) Na2O 4) Fe2O3Ответ:
4, 1, 2, 3.
Тест 2. В схеме реакции Fe3O4 + … ⟶ Fe + H2O вместо многоточия следует поставить формулу
1) углерода 2) соли 3) водорода 4) оксида углерода (II)Ответ:
3) водорода
Тест 3. Качественной реакцией на ионы Fe2+ и Fe3+ является их взаимодействие
1) с сульфат-ионами
2) с известковой водой
3) с кислотами
4) с гидроксид-ионамиОтвет:
4) с гидроксид-ионами
§51
-
Глава VIII. Первоначальные представления об органических веществах.
§51. Органическая химия.
Задание 1. Что изучает органическая химия?
Ответ:
Органическая химия изучает соединения углерода, а также законы их превращений.
Задание 2. Какие вещества относят к органическим? Приведите примеры.
Ответ:
Вещества, в состав которых входит углерод, относят к органическим. Примеры органических веществ: сахароза, уксусная кислота, этиловый спирт, молочная кислота, ацетон.
Задание 3. Какие особенности строения атома углерода позволили ему стать родоначальником огромного количества соединений?
Ответ:
Углерод в органических соединения проявляет валентность равную четырем (образует 4 ковалентные связи), благодаря этому углерод способен соединяться друг с другом, образуя длинные цепи и замкнутые кольца, также между атомами углерода в молекулах углеводородов могут возникать двойные и тройные связи, все это позволяет углероду стать родоначальником огромного количества органических соединений.
Задание 4. Атомы каких элементов могут входить в состав органических веществ?
Ответ:
В состав органических веществ могут входить не только углерод, но и водород, кислород, азот, а также фосфор, сера и галогены.
Задание 5. Чем различаются органические и неорганические соединения?
Ответ:
Большинство неорганических веществ имеет немолекулярное строение, и поэтому они обладают высокими температурами плавления и кипения. Большинство же органических соединений имеет молекулярное строение, и поэтому температуры их плавления и кипения невысоки. Почти все органические вещества могут гореть и легко разлагаются при прокаливании.
Задание 6. Приведите примеры углеводородов, с которыми вы встречаетесь в быту. За дополнительной информацией обратитесь к родителям.
Ответ:
Примеры углеводородов с которыми встречаемся в быту: метан, пропан, бутан, нафталин, изопреновый каучук.
Тестовые задания
Тест 1. Соединения углерода и водорода называют
1) углеводами
2) карбидами
3) карбоновыми кислотами
4) углеводородамиОтвет:
4) углеводородами
Тест 2. Среди перечисленных соединений углерода укажите органические вещества
1) угольная кислота
2) бензин
3) метан
4) угарный газОтвет:
2, 3.
§52
-
§52. Предельные (насыщенные) углеводороды.
Задание 1. Какие углеводороды называют алканами? Приведите примеры алканов.
Ответ:
Углеводороды, в молекулах которых атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода, называют алканами. Примеры алканов: метан, этан, пропан, бутан.
Задание 2. Составьте структурные формулы пентана C5H12 и гексана C6H14.
Ответ:
Пентан C5H12
Гексан C6H14Задание 3. Охарактеризуйте физические и химические свойства метана.
Ответ:
Метан – это почти нерастворимый в воде бесцветный горючий газ без запаха.
При поджигании метан сгорает бледно-голубым, еле заметным пламенем с образованием углекислого газа и воды:
CH4 + 2O2 ⟶ CO2 + 2H2O
Если метан нагреть до температуры выше 1200°C, он разлагается на сажу и водород:
CH4 t ⟶ C + 2H2
Для предельных углеводородов характерны реакции замещения. Например, метан на свету реагирует с хлором, при этом атомы хлора постепенно замещают атомы водорода в молекуле метана:
CH4 + Cl2 свет ⟶ HCl + CH3Cl
CH3Cl + Cl2 свет ⟶ HCl + CH2Cl2Задание 4. Вычислите объёмы кислорода и воздуха, которые потребуются для полного сжигания 150 дм3 природного газа, содержащего 94% метана (н. у.). Содержание кислорода (по объёму) в воздухе примерно равно 20%.
Ответ:
Дано:
`V("природного газа") = 150 л`
`φ(CH_4) = 94%`
`φ(O_2) = 20%`
`V(O_2) = ?`
`V("воздуха") = ?`
Решение
`CH_4 + 2O_2 = CO_2 + 2H_2O`
`V(CH_4) = (φ(CH_4)*V("природного газа"))/100 = (94*150)/100 = 141 л`
`n(CH_4) = (V(CH_4))/V_m = 141/22.4 = 6.3" моль"`
`n(O_2) = 2*n(CH_4) = 6.3*2 = 12.6" моль"`
`V(O_2) = n(O_2)*V_m = 12.6*22.4 = 282 л`
`V("воздуха") = (100*V(O_2))/(φ(O_2)) = (100*282)/20 = 1410 л`
Ответ: `V(O_2) = 282 л`, `V("воздуха") = 1410 л`.Тестовые задания
Тест 1. Формулы только алканов записаны в ряду
1) C2H4, C3H6, C4H8
2) C2H6, C3H8, C4H10
3) C2H2, C3H4, C4H6
4) C2H2, C2H4, C2H6Ответ:
2) C2H6, C3H8, C4H10
Тест 2. Гомологом метана является углеводород
1) C2H2 2) C3H8 3) C3H6 4) C2H4Ответ:
2) C3H8
§53
-
§53. Непредельные (ненасыщенные) углеводороды.
Задание 1. Этилен начинает гомологический ряд алкенов. Приведите формулы (молекулярные и структурные) двух гомологов этилена.
Ответ:
Гомологи этилена: пропилен C3H6 (H2C=CH-CH3), бутен-1 C4H8 (H2C=CH-CH2-CH3).
Задание 2. Охарактеризуйте свойства этилена и его применение. Где используют полиэтилен и полипропилен?
Ответ:
Этилен – это газ, почти без запаха, плохо растворимый в воде.
На воздухе горит светящимся пламенем:
C2H4 + 3O2 ⟶ 2CO2 + 2H2O
Благодаря наличию двойной связи этилен легко вступает в реакции присоединения, например:
H2C=CH2 + Br2 t ⟶ BrH2C–CH2Br
Благодаря двойной связи молекулы этилена могут соединяться друг с другом, т. е. вступать в реакцию полимеризации:
nH2C=CH2 TiCl₂, Al(C₂H₅)₃ ⟶ n(–H2C–CH2–)Задание 3. Ацетилен начинает гомологический ряд ацетиленовых углеводородов (алкинов). Приведите формулы (молекулярные и структурные) двух гомологов ацетилена.
Ответ:
Гомологи ацетилена: пропин C3H4 (HC≡C-CH3), бутин-1 C4H6 (HC≡C-CH2-CH3).
Задание 4. Вычислите массу 3%-ной бромной воды, необходимой для получения 80 г дибромэтана.
Ответ:
Дано:
`m(C_2H_4Br_2) = 80 г`
`ω(Br_2) = 3%`
`m("бромной воды") = ?`
Решение
`C_2H_4 + Br_2 = C_2H_4Br_2`
`n(C_2H_4Br_2) = (m(C_2H_4Br_2))/(M(C_2H_4Br_2)) = 80/188 = 0.4255" моль"`
`n(Br_2) = n(C_2H_4Br_2) = 0.4255" моль"`
`m(Br_2) = n(Br_2)*M(Br_2) = 0.4255*160 = 68.08 г`
`m("бромной воды") = (100*m(Br_2))/(ω(Br_2)) = (100*68.08)/3 = 2269 г`
Ответ: `m("бромной воды") = 2269 г`.Задание 5. Вычислите объём ацетилена (н. у.), полученного по реакции CaC2 + 2H2O ⟶ Ca(OH)2↓ + C2H2↑, если в реакцию вступило 160 г технического карбида кальция (массовая доля CaC2 равна 80%).
Ответ:
Дано:
`m_("тех.")(CaC_2) = 160 г`
`ω(CaC_2) = 80%`
`V(C_2H_2) = ?`
Решение
`CaC_2 + 2H_2O = Ca(OH)_2"↓" + C_2H_2"↑"`
`m(CaC_2) = (ω(CaC_2)*m_("тех.")(CaC_2))/100 = (80*160)/100 = 128 г`
`n(CaC_2) = (m(CaC_2))/(M(CaC_2)) = 128/64 = 2" моль"`
`n(C_2H_2) = n(CaC_2) = 2" моль"`
`V(C_2H_2) = n(C_2H_2)*V_m = 2*22.4 = 44.8 л`
Ответ: `V(C_2H_2) = 44.8 л`. §54
-
§54. Полимеры.
Задание 1. Дайте краткую характеристику полиэтилена, полипропилена, поливинилхлорида. Где они применяются?
Ответ:
Полиэтилен представляет собой массу белого цвета, химически стоек, диэлектрик, не чувствителен к удару, при нагревании размягчается (80-120°C). Элементарное звено в молекуле полиэтилена (-CH2-CH2-). Полиэтилен применяют для производства: плёнки, различной тары, труб, электроизоляции, термоклея, брони.
В отличие от полиэтилена, полипропилен менее плотный, более твёрдый (стоек к истиранию), более термостойкий (начинает размягчаться при 140°С, температура плавления 175°С), почти не подвергается коррозионному растрескиванию. Обладает высокой чувствительностью к свету и кислороду. Элементарное звено в молекуле полипропилена (-CH2-CH(CH3)-). Полипропилен применяют для производства: мешков, тары, труб, деталей технической аппаратуры, пластиковых стаканчиков, предметов домашнего обихода, нетканых материалов, электроизоляционный материал, в строительстве для вибро- и шумоизоляции.
Поливинилхлорид отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям, в чистом виде не поддерживает горение на воздухе, обладает малой морозостойкостью (-15°C) и нагревостойкостью (66°C). Элементарное звено в молекуле поливинилхлорида (-CH2-CHCl-). Поливинилхлорид применяют для производства: электроизоляции, листов, труб, плёнок, искусственных кож, линолеума, грязезащитных ковриков, обувных пластикатов, мебельной кромки.Задание 2. Назовите два предмета, которые изготовлены из полиэтилена и которыми вам приходилось пользоваться в быту. Отметьте два положительных свойства, на которых основано применение полиэтиленовых изделий в быту, и два нежелательных свойства.
Ответ:
Изделия из полиэтилена используемые в быту: пакеты, упаковочная плёнка, бутылки, банки, ящики, канистры, садовые лейки, горшки для рассады.
Положительных свойства: не чувствителен к удару, прозрачность тонких листов, не пропускает воду. Нежелательные свойства: не очень высокая температура размягчения (80-120°C), плохая биоразлагаемость. §55
-
§55. Производные углеводородов. Спирты.
Задание 1. Кратко охарактеризуйте метанол, этанол, этиленгликоль и глицерин. Где их используют?
Ответ:
Метанол (CH3OH) – бесцветная жидкость (tкип. = 65 °С). Очень ядовит. Один его глоток уже может вызвать слепоту, а несколько большее количество – смерть. Метанол применяют в качестве растворителя, добавки к автомобильному топливу, для производства уксусной кислоты, пластмасс и других веществ.
Этанол (C2H5OH) – бесцветная жидкость со своеобразным запахом, легче воды (его плотность 0,8 г/см3), кипит при температуре 78,3°C, хорошо растворяется в воде и сам является растворителем. Этиловый спирт производят главным образом из этилена и широко используют при производстве синтетических каучуков, а также в качестве растворителя и исходного материала для производства лаков, медикаментов, алкогольных напитков, в пищевой и парфюмерной промышленности. Спирт смешивается с бензином во всех отношениях, поэтому его иногда применяют в качестве добавки к топливу.
Этанол образуется при брожении сахаросодержащих веществ по схеме:
C6H12O6 ферменты ⟶ 2C2H5OH + 2CO2↑Также получают с помощи гидратации этилена:
C2H4 + H2O ⟶ C2H5OHЭтанол горит в кислороде и на воздухе:
2C2H5OH + 6O2 ⟶ 6H2O + 4CO2Этанол вступает в реакцию с активными металлами:
2C2H5OH + 2Na ⟶ 2C2H5ONa + H2↑Если нагреть этанол в присутствии серной кислоты, то образуется газ этилен:
C2H5OH t, H₂SO₄ ⟶ C2H4↑ + H2OЭтиленгликоль – простейший представитель многоатомных спиртов. Его структурная формула:
CH2-CH2
| |
OH OHЭтиленгликоль – сладкая сиропообразная жидкость, кипящая при 197,6°C, очень ядовита. Используется для производства антифризов.
Глицерин бесцветная сиропообразная жидкость, сладкая на вкус. Его структурная формула:
CH2-CH-CH2
| | |
OH OH OHГлицерин используют для приготовления антифризов, средств смягчения кожи, в производстве ряда медикаментов. Из него производят также нитроглицерин – взрывчатое вещество.
Задание 2. Метанол начинает гомологический ряд предельных одноатомных спиртов. Запишите молекулярные формулы двух последующих спиртов. Выведите общую формулу предельных одноатомных спиртов.
Ответ:
C2H5OH, C3H7OH.
Общая формула предельных одноатомных спиртов: CnH2n+1OH.Задание 3. Вычислите объем этилена (н. у.), полученного из 80 г этилового спирта (массовая доля этилового спирта равна 96%).
Ответ:
Дано:
`m_("тех.")(C_2H_5OH) = 80 г`
`ω(C_2H_5OH) = 96%`
`V(C_2H_4) = ?`
Решение
`C_2H_5OH overset(t," "H_2SO_4)(⟶) C_2H_4"↑" + H_2O`
`m(C_2H_5OH) = (ω(C_2H_5OH)*m_("тех.")(C_2H_5OH))/100 = (96*80)/100 = 76.8 г`
`n(C_2H_5OH) = (m(C_2H_5OH))/(M(C_2H_5OH)) = 76.8/46 = 1.67" моль"`
`n(C_2H_4) = n(C_2H_5OH) = 1.67" моль"`
`V(C_2H_4) = n(C_2H_4)*V_m = 1.67*22.4 = 37.4 л`
Ответ: `V(C_2H_4) = 37.4 л`.Тестовые задания
Тест 1. Гомологом этанола является соединение
1) CH4 2) CH3OH 3) C6H5OH 4) C2H4(OH)2Ответ:
2) CH3OH
Тест 2. В результате горения этанола в кислороде образуются
1) C и H2O 2) CO и H2O 3) CO2 и H2O 4) C2H2 и H2OОтвет:
3) CO2 и H2O
§56
-
§56. Карбоновые кислоты. Сложные эфиры. Жиры.
Задание 1. Какие вещества называют карбоновыми кислотами? Какие природные карбоновые кислоты вам известны? Где они встречаются в природе и как их используют?
Ответ:
Карбоновыми кислотами называют производные углеводородов, в молекулах которых имеется группа атомов -COOH. (карбоксильная группа).
Муравьиная кислота HCOOH содержится в ядовитых железах муравьев, в крапиве, в еловой хвое. Используется в качестве протравы шерсти и кожи перед крашением, в промышленности в качестве сильного восстановителя, как лекарство от ревматизма (1.25%-ный спиртовой раствор под названием "муравьиный спирт"), используется также для получения сложных эфиров, которые применяют в качестве растворителей.
Уксусная кислота CH3COOH в природе образуется в результате уксуснокислого брожения, применяется как столовый уксус (5-9%-ный водный раствор).
Лимонная кислота содержится в лимонах, малине, смородине, крыжовнике, в ягодах рябины, в винограде. Её широко используют в пищевой промышленности для производства прохладительных напитков и кондитерских изделий и в медицине.
Молочная кислота в значительных количествах образуется при скисании молока, квашении капусты, силосовании кормов. Применяется в качестве консерванта.
Щавелевая кислота содержится в щавеле и некоторых других растениях. Щавелевую кислоту используют при производстве красителей, а также для удаления ржавчины.Задание 2. Рассмотрите химические свойства карбоновых кислот на примере пропионовой кислоты C2H5COOH. Запишите уравнения соответствующих химических реакций.
Ответ:
Химические свойства карбоновых кислот на примере пропионовой кислоты
Диссоциирует с образованием иона водорода:
C2H5COOH ⇄ C2H5COO- + H+
Взаимодействует с активными металлами:
2C2H5COOH + Mg ⟶ (C2H5COO)2Mg + H2↑
Взаимодействует с основными оксидами:
2C2H5COOH + CaO ⟶ (C2H5COO)2Ca + H2O
Взаимодействует с основаниями:
C2H5COOH + 2NaOH ⟶ C2H5COONa + H2O
Взаимодействует с основаниями:
2C2H5COOH + K2CO3 ⟶ 2C2H5COOK + H2O + CO2↑Задание 3. Взаимодействие каких веществ приводит к образованию сложных эфиров? Какие сложные эфиры обладают приятным ароматом?
Ответ:
Сложные эфиры образуются при взаимодействии карбоновых кислот со спиртами. Метилацетат (метиловый эфир уксусной кислоты) имеет фруктовый запах.
Задание 4. К какому классу органических веществ относятся жиры? Какую роль жиры играют в организме?
Ответ:
Жиры относятся к сложным эфирам (глицерина и высших карбоновых кислот). В организме жиры служат одним из источников энергии: при окислении 1 г жира выделяется 39 кДж.
Задание 5. Для нейтрализации столового уксуса понадобилось 200 г 30%-ного раствора гидроксида натрия. Вычислите массу и количество (в молях) уксусной кислоты, вступившей в реакцию.
Ответ:
Дано:
`m("р-ра") = 200 г`
`ω(NaOH) = 30%`
`n(CH_3COOH) = ?`
`m(CH_3COOH) = ?`
Решение
`CH_3COOH + NaOH = CH_3COONa + H_2O`
`m(NaOH) = (ω(NaOH)*m("р-ра"))/100 = (30*200)/100 = 60 г`
`n(NaOH) = (m(NaOH))/(M(NaOH)) = 60/40 = 1.5" моль"`
`n(CH_3COOH) = n(NaOH) = 1.5" моль"`
`m(CH_3COOH) = n(CH_3COOH)*M(CH_3COOH) = 1.5*60 = 90 г`
Ответ: `n(CH_3COOH) = 1.5" моль"`, `m(CH_3COOH) = 90 г`.Задание 6. 5 г 90%-ного раствора этилового спирта смешали с уксусной кислотой и нагрели в присутствии концентрированной серной кислоты. Вычислите массу образовавшегося эфира.
Ответ:
Дано:
`m("р-ра") = 5 г`
`ω(C_2H_5OH) = 90%`
`m(CH_3COO-C_2H_5) = ?`
Решение
`C_2H_5OH + CH_3COOH overset(t," "H₂SO₄)(⟶) CH_3COO-C_2H_5 + H_2O`
`m(C_2H_5OH) = (ω(C_2H_5OH)*m("р-ра"))/100 = (90*5)/100 = 4.5 г`
`n(C_2H_5OH) = (m(C_2H_5OH))/(M(C_2H_5OH)) = 4.5/46 = 0.0978" моль"`
`n(CH_3COO-C_2H_5) = n(C_2H_5OH) = 0.0978" моль"`
`m(CH_3COO-C_2H_5) = n(CH_3COO-C_2H_5)*M(CH_3COO-C_2H_5) = 0.0978*88 = 8.61 г`
Ответ: `m(CH_3COO-C_2H_5) = 8.61 г`.Тестовые задания
Тест 1. Уксусная кислота — это
1) бесцветная, нерастворимая в воде жидкость
2) бесцветная, растворимая в воле жидкость, без запаха
3) голубая, растворимая в воде жидкость, с характерным запахом
4) бесцветная, растворимая в воде жидкость, с характерным запахом, в которой лакмус изменяет свой цвет на красныйОтвет:
4) бесцветная, растворимая в воде жидкость, с характерным запахом, в которой лакмус изменяет свой цвет на красный
Тест 2. Жиры — это сложные эфиры
1) глицерина и минеральных кислот
2) глицерина и высших карбоновых кислот
3) метанола и минеральных кислот
4) метанола и высших карбоновых кислотОтвет:
2) глицерина и высших карбоновых кислот
§57
-
§57. Углеводы.
Задание 1. Как глюкоза образуется в природе?
Ответ:
Глюкоза образуется в процессе фотосинтеза:
6CO2 + 6H2O Свет, хлорофилл ⟶ C6H12O6 + 6O2↑Задание 2. В каких растениях содержится сахароза?
Ответ:
Сахароза содержится в сахарной свекле (16-22%), сахарном тростнике (14-26%) и в соке клёна, берёзы, пальмы, плодов ряда растений.
Задание 3. Охарактеризуйте строение молекул крахмала и глюкозы. Где используют эти вещества?
Ответ:
Характеристика глюкозы
Молекулярная формула глюкозы C6H12O6. Глюкозу широко используют в кондитерской и текстильной промышленности, в производстве зеркал и аскорбиновой кислоты. Спиртовое брожение используют в производстве вина и при получении этилового спирта, который играет существенную роль во многих химических производствах.
Характеристика крахмала
Молекулярная формула крахмала (C6H10O5)n, где число n достигает нескольких тысяч. Если к каждому элементарному звену молекулы крахмала C6H10O5 мысленно прибавить по молекуле воды, то получится множество молекул глюкозы.
Крахмал используют в пищевой, текстильной, бумажной и фармацевтической промышленности. Из него получают сиропы, техническую глюкозу, этанол, декстрин, применяемый при ситцепечатании и для производства клея. §58
-
§58. Аминокислоты. Белки.
Задание 1. Охарактеризуйте строение молекул аминокислот и белков.
Ответ:
Молекулы аминокислот содержат карбоксильную группу (-COOH) и аминогруппу (-NH2).
Например, аминоуксусная кислота имеет следующие строение:
O
||
H2N-CH2-C-OHЗадание 2. Охарактеризуйте роль белков в организме.
Ответ:
Белки входят в состав всех клеток организма человека. Функции белков разнообразны: из одних белков образуются мышечные ткани, из других – покровные, из третьих – опорные и т. д. Сложный белок гемоглобин снабжает клетки кислородом. Специальные белки – интерфероны – защищают организм от инфекций.
К белкам относятся также ферменты и некоторые гормоны. Ферменты можно рассматривать как катализаторы биохимических процессов. Гормоны влияют на деятельность определённых органов или систем органов и регулируют процессы обмена веществ.Задание 3. Что называют ферментами и что – гормонами?
Ответ:
Ферменты – вещества, которые ускоряют протекание биохимических процессов (биологические катализаторы).
Гормоны – вещества, которые влияют на деятельность определённых органов или систем органов и регулируют процессы обмена веществ.Задание 4. На основании всего известного вам материала по органической химии составьте таблицу по следующему образцу:
Ответ:
Класс соединений Типичный представитель Область применения Алканы CH4 Метан используют в качестве топлива, для производства водорода. Алкены C2H4 Этилен применяется для получения: полиэтилена, уксусной кислоты, этиленгликоля Алкины C2H2 Ацетилен используют: для газовой сварки и резки металлов, в производстве взрывчатых веществ, для получения уксусной кислоты, этилового спирта, растворителей, пластмасс. Одноатомные спирты C3OH Метанол применяют в качестве растворителя, добавки к автомобильному топливу, для производства уксусной кислоты, пластмасс и других веществ. Многоатомные спирты HO-CH2-CH2-OH Этиленгликоль используется для производства антифризов. Карбоновые кислоты HCOOH Используется в качестве протравы шерсти и кожи перед крашением, в промышленности в качестве сильного восстановителя, как лекарство от ревматизма, используется также для получения сложных эфиров, которые применяют в качестве растворителей. Сложные эфиры CH3COOCH3 Метилацетат применяют в качестве растворителя. Жиры Сложный эфир глицерина и олеиновой кислоты. Применяют для жарки еды. Углеводы C6H12O6 Глюкозу широко используют в кондитерской и текстильной промышленности, в производстве зеркал и аскорбиновой кислоты, для получения этилового спирта. Аминокислоты NH2-CH2-COOH Аминоуксусная кислота используется в качестве лекарственного средства и пищевой добавки. Задание 5. Почему можно утверждать, что углерод – основа жизни на Земле?
Ответ:
Углерод – основа всех органических веществ, а живые организмы состоят из органических веществ, потому углерод – основа жизни на Земле.
Лабораторные работы
-
Лабораторные и практические работы
Лабораторные опыты
Лабораторный опыт. Реакции между растворами электролитов.
1) В пробирку с раствором хлорида натрия прилейте раствор нитрата серебра (I) или нитрата свинца (II). Выпадает осадок.
2) В пробирку с раствором карбоната натрия прилейте соляной кислоты. В результате реакции выделяется газ.
3) В пробирку с раствором азотной кислоты прилейте раствор гидроксида калия. В результате реакции выделяется теплота.
4) К раствору хлорида магния прилейте раствор сульфата натрия. Признаков химической реакции не наблюдается. Запишите уравнения проведенных реакций.
Ответ:
1) При добавлении раствора нитрата серебра (I) к раствору хлорида натрия, выпадает белый творожистый осадок:
AgNO3 + NaCl ⟶ NaNO3 + AgCl2) При добавлении соляной кислоты к раствору карбоната натрия, выделяется газ:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑3) При добавлении раствора гидроксида калия к раствору азотной кислоты, выделяется теплота:
HNO3 + KOH ⟶ KNO3 + H2O + Q4) При добавлении раствора сульфата натрия к раствору хлорида магния, признаков химической реакции не наблюдается:
MgCl2 + Na2SO4 ⇸Лабораторный опыт. Вытеснение галогенами друг друга из растворов их соединений.
1) В первую пробирку налейте 3-4 мл водного раствора бромида калия или бромида натрия, а во вторую и третью — столько же иодида калия или иодида натрия.
2) В первую и вторую пробирки добавьте 1-2 мл хлорной воды, а в третью — столько же бромной воды.
О чём свидетельствует изменение цвета раствора в пробирках?
Напишите уравнения соответствующих химических реакций и поясните, в какой последовательности галогены вытесняют друг друга из соединений.
Ответ:
При добавлении хлорной воды к раствору бромида калия наблюдается окрашивание раствора в желтый цвет, т. к. в результате реакции выделился бром:
2KBr + Cl2 ⟶ 2KCl + Br2При добавлении хлорной воды к раствору иодида калия наблюдается окрашивание раствора в буро-коричневый цвет, т. к. в результате реакции выделился иод:
2KI + Cl2 ⟶ 2KCl + I2При добавлении бромной воды к раствору иодида калия наблюдается окрашивание раствора в буро-коричневый цвет, т. к. в результате реакции выделился иод:
2KI + Br2 ⟶ 2KBr + I2Бром вытеснят иод из его соединений, хлор вытеснят бром из его соединений, фтор вытесняет хлор из его соединений.
Лабораторный опыт. Ознакомление с образцами серы и её природных соединений.
Рассмотрите выданные вам образцы серы и её природных соединений.
Охарактеризуйте выданные образцы по плану:
1. Название
2. Химическая формула
3. Агрегатное состояние
4. Цвет
5. ТвёрдостьОтвет:
Название Химическая формула Агрегатное состояние Цвет Твёрдость Сера S Твердое тело Желтый Низкая Пирит FeS2 Твердое тело Желто-серый с металлическим блеском Высокая Цинковая обманка ZnS Твердое тело Серый с металлическим блеском Средняя Свинцовый блеск PbS Твердое тело Серый с металлическим блеском Низкая Киноварь HgS Твердое тело Красный Низкая Гипс CaSO4∙2H2O Твердое тело Белый Низкая Глауберова соль NaSO4∙10H2O Твердое Бесцветный Низкая Лабораторный опыт. Качественная реакция на сульфид-ионы.
В пробирку с раствором сульфида натрия добавьте несколько капель нитрата меди (II) или нитрата свинца (II).
Отметьте признаки проведённой химической реакции.
Составьте молекулярное, ионное и сокращённое ионное уравнения реакции.
Ответ:
При добавлении нитрата меди (II) к раствору сульфида натрия, наблюдается выпадение черного осадка:
Cu(NO3)2 + Na2S ⟶ 2NaNO3 + CuS↓
Cu2+ + 2NO3- + 2Na+ + S2- ⟶ 2Na+ + 2NO3- + CuS↓
Cu2+ + S2- ⟶ CuS↓Лабораторный опыт. Качественная реакция на сульфит-ионы.
В пробирку с раствором сульфита натрия добавьте 1 мл раствора серной кислоты.
Отметьте признаки проведённой вами химической реакции.
Составьте молекулярное, ионное и сокращённое ионное уравнения реакции.
Ответ:
При добавлении раствора серной кислоты к раствору сульфита натрия, ощущается резкий запах:
Na2SO3 + H2SO4 ⟶ Na2SO4 + H2O + SO2↑
2Na+ + SO32- + 2H+ + SO42- ⟶ 2Na+ + SO42- + H2O + SO2↑
2H+ + SO32- ⟶ H2O + SO2↑Лабораторный опыт. Распознавание сульфат-ионов в растворе.
В одну пробирку налейте 1-2 мл раствора сульфата натрия, в другую – столько же раствора сульфата цинка, а в третью – столько же разбавленного раствора серной кислоты. Во все пробирки поместите по грануле цинка, а затем добавьте несколько капель раствора хлорида бария или нитрата бария.
Как отличить сульфаты от других солей?
Составьте молекулярные, ионные и сокращённые ионные уравнения осуществлённых реакций.
Ответ:
При добавлении гранул цинка в растворы сульфата натрия и сульфата цинка, изменений не наблюдается:
Na2SO4 + Zn ⇸
ZnSO4 + Zn ⇸При добавлении гранулы цинка в раствор серной кислоты, наблюдается выделение газа:
H2SO4 + Zn ⟶ ZnSO4 + H2↑
2H+ + SO42- + Zn ⟶ Zn2+ + SO42- + H2↑
2H+ + Zn ⟶ Zn2+ + H2↑При добавлении раствора хлорида бария в раствор сульфата натрия, наблюдается выпадение осадка белого цвета:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- ⟶ 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓При добавлении раствора хлорида бария в раствор сульфата цинка (пробирка 2 и 3), также наблюдается выпадение осадка белого цвета:
ZnSO4 + BaCl2 ⟶ ZnCl2 + BaSO4↓
Zn2+ + SO42- + Ba2+ + 2Cl- ⟶ Zn2+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓Отличить сульфаты от других солей можно с помощью растворимой соли бария, в результате реакции должен выпасть осадок белого цвета.
Лабораторный опыт. Распознавание солей аммония.
1) В одну пробирку поместите немного кристаллического сульфата аммония (NH4)2SO4, в другую – нитрата аммония NH4NO3. В обе пробирки прилейте по 1-2 мл раствора гидроксида натрия и слегка нагрейте.
2) В струю выделяющегося газа поместите красную лакмусовую бумагу, смоченную дистиллированной водой.
Какой газ выделяется в данном опыте? Напишите уравнения соответствующих реакций.
Как можно отличить соли аммония от других солей?
Ответ:
При нагревании сульфата аммония и нитрата аммония, выделяющийся газ окрашивает лакмусовую бумагу, смоченную дистиллированной водой, в синий цвет.
(NH4)2SO4 + 2NaOH t ⟶ Na2SO4 + 2NH3↑ + 2H2O
NH4NO3 + NaOH t ⟶ NaNO3 + NH3↑ + H2OАммиак окрашивает смоченную водой лакмусовую бумагу в синий цвет потому, что аммиак растворяется в воде и диссоциирует с образованием гидроксид-анионов:
NH3 + H2O ⇄ NH4OH
NH4OH ⇄ NH4+ + OH-С помощью нагревания соли аммония можно отличить от других солей, при этом образуется аммиак, который имеет характерный запах, а раствор имеет щелочную среду.
Лабораторный опыт. Проведение качественной реакции на углекислый газ.
Через 2-3 мл свежеприготовленного раствора гидроксида кальция (известковой воды) пропустите углекислый газ.
Почему известковая вода мутнеет, если через нее пропускают углекислый газ?
Напишите уравнение протекающей реакции в молекулярном, ионном и сокращенном ионном виде.
Ответ:
При пропускании углекислого газа через раствор гидроксида кальция, наблюдается помутнение раствора, это связано с тем, что в результате реакции образуется нерастворимый карбонат кальция:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
Ca2+ + 2OH- + CO2 ⟶ CaCO3↓ + H2OЛабораторный опыт. Качественная реакция на карбонат-ионы.
В одну пробирку положите немного мела, а в другую — немного карбоната магния. В первую пробирку налейте 1-2 мл разбавленной соляной кислоты, а во вторую — столько же разбавленной серной кислоты. Обе пробирки закройте пробками с газоотводными трубками, концы которых поместите в пробирки с известковой водой.
На основе выполненных опытов сделайте вывод, какая реакция является качественной реакцией на карбонат-ионы.
Напишите уравнения соответствующих реакций в молекулярном ионном и сокращённом ионном виде.
Ответ:
При добавлении соляной кислоты к мелу, а разбавленной серной кислоты к карбонату магния, в обоих случаях наблюдается выделение газа.
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑MgCO3 + H2SO4 ⟶ MgSO4 + H2O + CO2↑
MgCO3 + 2H+ + SO42- ⟶ Mg2+ + SO42- + H2O + CO2↑
MgCO3 + 2H+ ⟶ Mg2+ + H2O + CO2↑При пропускании выделяющегося газа через известковую воду, наблюдается её помутнение, это говорит о том, что этим газом является оксид углерода (IV).
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2OВывод: качественной реакцией на карбонат ионы является реакция с кислотой, в результате взаимодействия выделяется газ – оксид углерода (IV).
Лабораторный опыт. Взаимодействие металлов с растворами солей.
В первую пробирку налейте 2-3 мл раствора нитрата серебра (I), во вторую – 2-3 мл раствора сульфата меди (II), а в третью – столько же раствора нитрата алюминия. В первую пробирку положите тонкую медную проволоку, во вторую – стружки железа, а в третью – медные стружки.
Какие вещества образуются в каждой пробирке?
Какая закономерность проявляется в этих процессах?
Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращённом ионном виде.
Ответ:
Медная проволока в растворе нитрата серебра (I) покрылась серебром:
2AgNO3 + Cu ⟶ Cu(NO3)2 + 2Ag
2Ag+ + 2NO3- + Cu ⟶ Cu2+ + 2NO3- + 2Ag
2Ag+ + Cu ⟶ Cu2+ + 2AgЖелезная стружка в растворе сульфата меди (II) покрылась медью:
CuSO4 + Fe ⟶ FeSO4 + Cu
Cu2+ + SO42- + Fe ⟶ Fe2+ + SO42- + Cu
Cu2+ + Fe ⟶ Fe2+ + CuПри добавлении медной стружки в раствор нитрата алюминия изменений не наблюдается:
Al(NO3)3 + Cu ⇸Вывод: более активные металлы вытесняют менее активные металлы из их солей.
Лабораторный опыт. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов.
1) Через 2-3 мл свежеприготовленного раствора гидроксида кальция (известковой воды) пропустите оксид углерода (IV).
2) Продолжайте пропускать оксид углерода (IV) через раствор.
3) Пробирку с прозрачным раствором прокипятите.
Почему известковая вода мутнеет, если через неё пропускать оксид углерода (IV)?
Почему раствор опять становится прозрачным, если продолжать пропускать оксид углерода (IV)?
Объясните, почему при нагревании этого прозрачного раствора образуется осадок.
Ответ:
При пропускании оксида углерода (IV) через известковую воду, наблюдается помутнение раствора, из-за образования нерастворимого карбоната кальция:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2OПри дальнейшем пропускании оксида углерода (IV), наблюдается растворение осадка, из-за образования растворимого гидрокарбоната кальция:
CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2При кипячении раствора гидрокарбоната кальция, наблюдается помутнение раствора, из-за образования нерастворимого карбоната кальция:
Ca(HCO3)2 t, кат. ⟶ CaCO3↓ + H2O + CO2↑Лабораторный опыт. Получение гидроксида алюминия и взаимодействие его с кислотами и щелочами.
1) Получите гидроксид алюминия. Для этого в две пробирки налейте по 1 мл раствора с массовой долей гидроксида натрия 5% и затем добавьте раствор хлорида алюминия до выпадения белого осадка гидроксида алюминия.
2) В одну пробирку с осадком гидроксида алюминия прилейте соляную кислоту. В другую пробирку добавьте избыток гидроксида натрия и встряхните.
Что происходит в каждой из пробирок? Сделайте вывод о характере гидроксида алюминия.
Ответ:
При добавлении раствора гидроксида натрия к раствору хлорида алюминия, наблюдается выпадение белого осадка гидроксида алюминия:
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓При добавлении соляной кислоты к гидроксиду алюминия, наблюдается его растворение:
Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2OПри добавлении гидроксида натрия к гидроксиду алюминия, также наблюдается его растворение:Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
Вывод: гидроксид алюминия проявляет амфотерные свойства.
Практические работы
-
Практические работы
Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость.
Влияние природы реагирующих веществ
1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее?
2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
Влияние концентрации реагирующих веществ
В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30 %-ной соляной кислоты, в другую — 1 мл 10 %-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
Влияние катализатора
В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца (IV) MnO2 и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет MnO2?
Ответ:
Влияние природы реагирующих веществ
1) При добавлении кусочка магния в соляную кислоту, выделяется газ:
Mg + 2HCl ⟶ MgCl2 + H2↑При добавлении кусочка цинка в соляную кислоту, выделяется газ:
Zn + 2HCl ⟶ ZnCl2 + H2↑При добавлении кусочка меди в соляную кислоту, изменений не наблюдается:
Cu + HCl ⇸Быстрее протекает реакция с магнием, чем с цинком, т. к. магний в ряду напряжений металлов располагается левее цинка.
2) В пробирке с соляной кислотой наблюдается более интенсивное выделение газа, чем в пробирке с уксусной кислотой, значит реакция цинка с соляной кислотой протекает быстрее, чем реакция цинка с уксусной кислотой.
Zn + 2HCl ⟶ ZnCl2 + H2↑
Zn + 2CH3COOH ⟶ (CH3COO)2Zn + H2↑Влияние концентрации реагирующих веществ
Цинк быстрее реагирует с 30%-ной соляной кислотой, чем с 10%-ной кислотой потому, что чем больше концентрация кислоты, тем больше число столкновений молекул хлороводорода с атомами цинка.
Zn + 2HCl ⟶ ZnCl2 + H2↑Влияние поверхности соприкосновения реагентов
Быстрее выделения газа протекает при реакции соляной кислоты с порошком мела, чем с цельным кусочком мела.
2HCl + CaCO3 ⟶ CaCl2 + H2O + CO2↑Влияние температуры
Реакция цинка с соляной кислотой сопровождается выделением водорода, в нагретой пробирке процесс выделения газа протекает более интенсивно, чем не в нагретой.
Zn + 2HCl ⟶ ZnCl2 + H2↑
Вывод: при повышении температуры скорость химической реакции возрастает.
Влияние катализатора
При внесении тлеющей лучинки в пробирку с перекисью водорода видимых изменений не наблюдается. После добавления оксида марганца (IV) в пероксид водорода наблюдается бурное выделение газа:
2H2O2 MnO₂ ⟶ 2H2O + O2При повторном внесении тлеющей лучины, наблюдается её воспламенение.
Так как по окончании реакции чёрный порошок оксид марганца (IV) не израсходовался, то значит оксид марганца (IV) в данной реакции является катализатором.
Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов».
Задание 1
Вариант 1. Налейте в пробирку 1-2 мл разбавленной 1:4 серной кислоты и опустите в неё кусочек цинка. Составьте уравнение реакции в молекулярном, ионном и сокращённом ионном виде, покажите переход электронов и объясните, что в этой реакции является окислителем.
Вариант 2. Налейте и пробирку 1-2 мл соляной кислоты и опустите в неё несколько стружек магния. Составьте уравнение реакции в молекулярном, ионном и сокращённом ионном виде, покажите переход электронов и объясните, что в этой реакции является окислителем.
Задание 2
Вариант 1. В трёх пробирках дан раствор хлорида магния. В первую пробирку прилейте раствор гидроксида натрия, во вторую — карбоната натрия, в третью — нитрата цинка. Составьте уравнения реакций, идущих до конца, в молекулярном, ионном и сокращённом ионном виде.
Вариант 2. В трёх пробирках дан раствор хлорида магния. В первую пробирку прилейте раствор фосфата калия, во вторую — сульфида натрия, в третью — нитрата калия. Составьте уравнения реакций, идущих до конца, в молекулярном, ионном и сокращённом ионном виде.
Задание 3
Вариант 1. Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты. Слейте попарно эти растворы, осторожно понюхайте и определите, в каких случаях реакции идут до конца и почему. Составьте уравнения соответствующих реакций в молекулярном, ионном и сокращённом ионном виде.
Вариант 2. Даны растворы: а) сульфита натрия и соляной кислоты; б) сульфата меди (II) и азотной кислоты; в) карбоната натрия и серной кислоты. Слейте попарно эти растворы, осторожно понюхайте и определите, в каких случаях реакции идут до конца и почему. Составьте уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
Задание 4
Вариант 1. Осуществите реакции, соответствующие сокращённым ионным уравнениям:
а) Ca2+ + CO32- = CaCO3↓
б) SO32- + 2H+ = SO2↑ + H2O
в) OH- + H+ = H2OВариант 2. Осуществите реакции, соответствующие сокращённым ионным уравнениям:
а) Fe3+ + 3OH- = Fe(OH)3↓
б) CO32- + 2H+ = CO2↑ + H2O
в) Ag+ + Cl- = AgCl↓Задание 5
Вариант 1. Пользуясь растворами, находящимися на столе, получите: а) гидроксид железа (III); б) сульфид меди (II). Составьте молекулярные ионные и сокращённые ионные уравнения соответствующих реакций.
Вариант 2. Пользуясь растворами, находящимися на столе, получите: а) оксид серы (IV); б) карбонат кальция. Составьте молекулярные, ионные и сокращённые ионные уравнения соответствующих реакций. Отчёт о работе выполните в произвольной форме.
Ответ:
Задание 1
Вариант 1
Zn + H2SO4 ⟶ ZnSO4 + H2↑
Zn + 2H+ + SO42- ⟶ Zn2+ + SO42- + H2↑
Zn + 2H+ ⟶ Zn2+ + H2↑2H+ + 2ē ⟶ H20 |1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 |2 восстановитель (окисление) Вариант 2
Mg + 2HCl2 ⟶ MgCl2 + H2↑
Mg + 2H+ + 2Cl- ⟶ Mg2+ + 2Cl- + H2↑
Mg + 2H+ ⟶ Mg2+ + H2↑2H+ + 2ē ⟶ H20 |1 окислитель (восстановление) Mg0 - 2ē ⟶ Mg+2 |2 восстановитель (окисление) Задание 2
Вариант 1
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓
Mg2+ + 2Cl- + 2Na+ + 2OH- ⟶ 2Na+ + 2Cl- + Mg(OH)2↓
Mg2+ + 2OH- ⟶ Mg(OH)2↓MgCl2 + Na2CO3 ⟶ 2NaCl + MgCO3↓
Mg2+ + 2Cl- + 2Na+ + CO32- ⟶ 2Na+ + 2Cl- + MgCO3↓
Mg2+ + CO32- ⟶ MgCO3↓MgCl2 + Zn(NO3)2 ⇸
Вариант 2
3MgCl2 + 2K3PO4 ⟶ 6KCl + Mg3(PO4)2↓
3Mg2+ + 6Cl- + 6K+ + PO43- ⟶ 6K+ + 6Cl- + Mg3(PO4)2↓
3Mg2+ + PO43- ⟶ Mg3(PO4)2↓MgCl2 + Na2S ⟶ 2NaCl + MgS↓
Mg2+ + 2Cl- + 2Na+ + S2- ⟶ 2Na+ + 2Cl- + MgS↓
Mg2+ + S2- ⟶ MgS↓MgCl2 + KNO3 ⇸
Задание 3
Вариант 1
а) Реакция идёт до конца т. к. образуется газ не имеющий запаха.
K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
2K+ + CO32- + 2H+ + 2Cl- ⟶ 2K+ + 2Cl- + H2O + CO2↑
2H+ + CO32- ⟶ H2O + CO2↑б) Реакция идёт до конца т. к. образуется газ имеющий резкий запах.
Na2S + H2SO4 ⟶ Na2SO4 + H2S↑
2Na+ + S2- + 2H+ + SO42- ⟶ 2Na+ + SO42- + H2S↑
2H+ + S2- ⟶ H2S↑в) Реакция не идёт, т. к. не образуется осадок или газ.
ZnCl2 + HNO3 ⇸Вариант 2
а) Реакция идёт до конца т. к. образуется газ имеющий резкий запах.
Na2SO3 + 2HCl ⟶ 2NaCl + H2O + SO2↑
2Na+ + SO32- + 2H+ + 2Cl- ⟶ 2Na+ + 2Cl- + H2O + SO2↑
2H+ + SO32- ⟶ H2O + SO2↑б) Реакция не идёт, т. к. не образуется осадок или газ.
CuSO4 + HNO3 ⇸в) Реакция идёт до конца т. к. образуется газ не имеющий запаха.
Na2CO3 + H2SO4 ⟶ Na2SO4 + H2O + CO2↑
2Na+ + CO32- + 2H+ + SO42- ⟶ 2Na+ + SO42- + H2O + CO2↑
2H+ + CO32- ⟶ H2O + CO2↑Задание 4
Вариант 1
а) CaCl2 + Na2CO3 ⟶ 2NaCl + CaCO3↓
б) Na2SO3 + 2HCl ⟶ 2NaCl + SO2↑ + H2O
в) NaOH + HCl ⟶ NaCl + H2O
Вариант 2
а) FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
б) Na2CO3 + 2HCl ⟶ 2NaCl + CO2↑ + H2O
в) AgNO3 + NaCl ⟶ NaNO3 + AgCl↓
Задание 5
Вариант 1
а)
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Fe(OH)3↓
Fe3+ + 3OH- ⟶ Fe(OH)3↓б)
CuSO4 + Na2S ⟶ Na2SO4 + CuS↓
Cu2+ + SO42- + 2Na+ + S2- ⟶ 2Na+ + SO42- + CuS↓
Cu2+ + S2- ⟶ CuS↓Вариант 2
а)
Na2SO3 + 2HCl ⟶ 2NaCl + H2O + SO2↑
2Na+ + SO32- + 2H+ + 2Cl- ⟶ 2Na+ + 2Cl- + H2O + SO2↑
2H+ + SO32- ⟶ H2O + SO2↑б)
CaCl2 + Na2CO3 ⟶ 2NaCl + CaCO3↓
Ca2+ + 2Cl- + 2Na+ + CO32- ⟶ 2Na+ + 2Cl- + CaCO3↓
Ca2+ + CO32- ⟶ CaCO3↓Практическая работа 3. Получение соляной кислоты и изучение ее свойств.
Получение соляной кислоты
Соберите прибор, как показано на рисунке 13 (см. с. 56).
В пробирку насыпьте 2-3 г поваренной соли и прилейте концентрированную серную кислоту (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, чтобы он находился на расстоянии примерно 0,5-1,0 см от поверхности воды. Затем осторожно нагревайте смесь в первой пробирке в течение 5-6 мин. Следите, чтобы кислоту не перебросило в пробирку с водой!
Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях (образуется гидрокарбонат натрия) и при сильном нагревании.
Чем вызвано появление во второй пробирке тонких струек, опускающихся вниз?
Почему конец газоотводной трубки должен находиться на расстоянии 0,5-1,0 см от поверхности воды?
Химические свойства соляной кислоты
Полученную при растворении хлороводорода в воде соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумагу, во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвёртую пробирку поместите немного оксида меди (II) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди (II), в шестую — немного мела или другого карбоната.
Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
Как объяснить образование в четвёртой и пятой пробирках растворов синего цвета, а в шестой – выделение газа? Составьте уравнения соответствующих реакций.
Распознавание соляной кислоты и её солей
В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра (I) или нитрата свинца (II) Pb(NO3)2. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения соответствующих реакций и подумайте, как можно отличить: а) соляную кислоту от других кислот; б) хлориды от других солей; в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II)?
Напишите уравнения проведенных реакций и ответьте на вопрос, что является реактивом на соляную кислоту и её соли.
Ответ:
Получение соляной кислоты
Реакция протекающая между концентрированной серной кислотой и хлоридом натрия при обычных условиях:
NaCl + H2SO4 ⇄ NaHSO4 + HClРеакция протекающая между концентрированной серной кислотой и хлоридом натрия при сильном нагревании:
2NaCl + H2SO4 t ⟶ Na2SO4 + 2HCl↑Появление струек вызвано растворением хлороводорода в воде, образовавшаяся соляная кислота плотнее воды, поэтому она опускается на дно пробирки.
Конец газоотводной трубки должен находиться на расстоянии 0,5-1,0 см от поверхности воды, для того, чтобы не засосало воду в пробирку, где хлорид натрия реагирует с серной кислотой.
Химические свойства соляной кислоты
Соляная кислота окрашивает лакмусовую бумагу в красный цвет.
Соляная кислота реагирует с цинком, наблюдается выделение газа:
Zn + 2HCl ⟶ ZnCl2 + H2↑Соляная кислота реагирует с магнием, наблюдается выделение газа:
Mg + 2HCl ⟶ MgCl2 + H2↑Соляная кислота не реагирует с медью, т. к. в ряду напряжений металлов медь стоит после водорода.
Соляная кислота реагирует с оксидом меди (II), наблюдается окрашивание раствора в синий цвет (из-за ионов меди Cu2+):
CuO + 2HCl t ⟶ CuCl2 + H2OСоляная кислота реагирует с гидроксидом меди (II), наблюдается окрашивание раствора в синий цвет (из-за ионов меди Cu2+):
Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2OСоляная кислота реагирует с мелом, наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑Распознавание соляной кислоты и её солей
При добавлении нитрата серебра (I) в пробирки с растворами хлороводорода, хлорида натрия и хлорида кальция, наблюдается выпадение белого творожистого осадка:
HCl + AgNO3 ⟶ HNO3 + AgCl↓
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
CaCl2 + 2AgNO3 ⟶ Ca(NO3)2 + 2AgCl↓Выпавшие осадки растворяются в концентрированной азотной кислоте.
а) Соляную кислоту от других кислот можно отличить с помощью нитрата серебра (I), в результате реакции должен выпасть белый творожистый осадок хлорида серебра (I).
б) Хлориды от других солей можно отличить с помощью нитрата серебра (I), в результате реакции должен выпасть белый творожистый осадок хлорида серебра (I).
в) Растворы хлоридов от соляной кислоты можно с помощью лакмуса, в соляной кислоте он окрасится в красный цвет.
Вместо раствора нитрата серебра (I) можно также использовать раствор нитрата свинца (II) потому, что он с галогенидами тоже образует нерастворимое соединение – хлорид свинца (II).
Реактивом на соляную кислоту и её соли является нитрат серебра (I) или нитрат свинца (II).
Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера».
Задача 1
Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
Задача 2
Дан раствор сульфата меди (II). Получите из него раствор хлорида меди (II).
Задача 3
Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
Задача 4
Проделайте опыты по осуществлению следующих превращений:
а) цинк ⟶ сульфат цинка ⟶ гидроксид цинка
б) оксид меди (II) ⟶ сульфат меди (II) ⟶ гидроксид меди (II).Задача 5
Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди (II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
Задача 6
Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
Ответ:
Задача 1
а) Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
б) NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
в) Лакмус окрасится в красный цвет.
Задача 2
Дан раствор сульфата меди (II). Получите из него раствор хлорида меди (II).
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓
Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2O
Задача 3
K2S + 2HCl ⟶ 2KCl + H2S↑
K2SO4 + BaCl2 ⟶ 2KCl + BaSO4↓
K2SO3 + 2HCl ⟶ 2KCl + H2O + SO2↑
KBr + AgNO3 ⟶ KNO3 + AgBr↓
Задача 4
а)
Zn + H2SO4 ⟶ ZnSO4 + H2↑
ZnSO4 + 2NaOH ⟶ Na2SO4 + Zn(OH)2↓
б)
CuO + H2SO4 ⟶ CuSO4 + H2O
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓
Задача 5
Взаимодействие цинка с серной кислотой является окислительно-восстановительным процессом.
Zn + H2SO4 ⟶ ZnSO4 + H2↑ 2H+ + 2ē ⟶ H20 1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 1 восстановитель (окисление) Серная кислота реагирует с нитратом стронция, т. к. в результате реакции образуется осадок:
Sr(NO3)2 + H2SO4 ⟶ 2HNO3 + SrSO4↓Серная кислота реагирует с хлоридом кальция, т. к. в результате реакции образуется осадок:
CaCl2 + H2SO4(конц.) ⟶ 2HCl + CaSO4↓Задача 6
H2SO4 + BaCl2 ⟶ Na2SO4 + BaSO4↓
HCl + AgNO3 ⟶ HNO3 + AgCl↓Практическая работа 5. Получение аммиака и изучение его свойств.
Получение аммиака и растворение его в воде
1) В фарфоровой ступке хорошо перемешайте приблизительно равные объёмы кристаллического хлорида аммония NH4Cl и порошка гидроксида кальция Ca(OH)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой; конец которой опущен в другую сухую пробирку, закреплённую в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке.
2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку.
3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты.
О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диссоциации?
Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции
Горение аммиака в кислороде
Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23).
Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Взаимодействие аммиака с кислотами
В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5-6 мм от поверхности кислоты.
Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций.
Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней.
Ответ:
Получение аммиака и растворение его в воде
1) 2NH4Cl + Ca(OH)2 t ⟶ CaCl2 + 2H2O + 2NH3↑
2) NH3 + H2O ⇄ NH4OH
3) Лакмусовая бумага в растворе аммиака окрасилась в синий цвет, а фенолфталеин окрасил раствор в малиновый цвет, это говорит о том, что аммиак проявляет щелочные свойства, так как в результате диссоциации образовываются гидроксид-анионы (OH-):
NH4OH ⇄ NH4+ + OH-При добавлении кислоты происходит обесцвечивание фенолфталеина, т. к. аммиак вступает в реакцию с кислотой:
NH3 + HCl ⟶ NH4ClГорение аммиака в кислороде
В процессе горения аммиака образуется азот и вода.
4NH3 + 3O2 ⟶ 2N2 + 6H2O O20 + 4ē ⟶ 2O-2 3 окислитель (восстановление) 2N-3 - 6ē ⟶ N20 2 восстановитель (окисление) Взаимодействие аммиака с кислотами
Аммиак реагирует с парами хлороводорода, при этом образуется густой белый дым – соль хлорид аммония:
NH3 + HCl ⟶ NH4ClКонец газоотводной трубки нельзя погружать в кислоту, так как хлорид аммония является растворимой солью.
Практическая работа 6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Получение оксида углерода (IV) и изучение его свойств.
1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро за кройте пробкой с газоотводной трубкой. Коней трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду.
Что происходит, если на мел (мрамор) действуют соляной кислотой?
Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё выделяющийся газ. Через не сколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете?
3) В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете?
Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
Распознавание карбонатов.
В трёх пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке.
Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
Ответ:
Получение оксида углерода (IV) и изучение его свойств.
1) При взаимодействии мела с соляной кислотой наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑При пропускании выделяющегося газа через известковую воду, наблюдается помутнение раствора:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
Ca2+ + 2OH- + CO2 ⟶ CaCO3↓ + H2OПри дальнейшем пропускании выделяющегося газа мутный раствор становится прозрачным. Это связано с тем, что нерастворимый карбонат кальция, при взаимодействии с углекислым газом, превращается в растворимый гидрокарбонат кальция:
CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2
CaCO3 + H2O + CO2 ⟶ Ca2+ + 2HCO3-2) При добавлении лакмуса в дистиллированную воду, через которую пропускали углекислый газ, наблюдается окрашивание в красный цвет. Это объясняется тем, что углекислый газ реагирует с водой с образованием слабой угольной кислоты:
H2O + CO2 ⇄ H2CO33) При добавлении фенолфталеина раствор гидроксида натрия, наблюдается окрашивание раствора в малиновый цвет. При пропускании углекислого газа через этот раствор, происходит его обесцвечивание. Это связано с тем, что гидроксид натрия вступает в реакцию с углекислым газом:
2NaOH + CO2 ⟶ Na2CO3 + H2O
2Na+ + 2OH- + CO2 ⟶ 2Na+ + CO32- + H2O
2OH- + CO2 ⟶ CO32- + H2OРаспознавание карбонатов.
В начале добавить соляной кислоты, в пробирке с карбонатом калия выделится газ: K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
В оставшиеся две пробирки добавить хлорид бария, в пробирке с сульфатом натрия образуется осадок белого цвета: Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
В последнюю пробирку добавить гидроксид натрия, если там находится хлорид цинка, то выпадет белый осадок:
ZnCl2 + 2NaOH ⟶ 2NaCl + Zn(OH)2↓Качественной реакцией на карбонат-ионы, является взаимодействие с кислотой, в результате реакции образовывается углекислый газ.
Практическая работа 7. Решение экспериментальных задач по теме «Металлы».
Вариант I
1. В четырёх пробирках даны следующие вещества в твёрдом виде: а) хлорид магния; б) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.
3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
4. Практически осуществите следующие превращения:
Fe ⟶ FeCl2 ⟶ Fe(OH)2 ⟶ Fe(OH)3 ⟶ Fe(NO3)3Вариант II
1. В четырёх пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
2. Докажите, что кристаллы сульфата железа (II) частично окислились и содержат примеси ионов Fe3+.
3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
4. Практически осуществите следующие превращения: Al ⟶ Al2(SO4)3 ⟶ Al(OH)3 ⟶ Na[Al(OH)4]
Ответ:
Вариант I
1. Прильём к пробиркам небольшое количество воды и растворим их содержимое. Добавим во все пробирки соляную кислоту.
В пробирке с карбонатом натрия выделится газ:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑Пробирка с гидроксидом натрия нагреется:
NaOH + HCl ⟶ NaCl + H2O + QВ оставшиеся две пробирки нальём раствор гидроксида натрия, в пробирке с хлоридом магния выпадет белый осадок:
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓В оставшейся пробирке находится нитрат натрия.
2.
Al2(SO4)3 + 3BaCl2 ⟶ 2AlCl3 + 3BaSO4↓
Al2(SO4)3 + 6NaOH ⟶ 3Na2SO4 + 2Al(OH)3↓
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
3. Прильём гидроксид натрия во все пробирки.
В пробирке с хлоридом натрия ничего не произойдёт.
В пробирке с хлоридом стронция выпадет белый осадок:
SrCl2 + 2NaOH ⟶ 2NaCl + Sr(OH)2↓В пробирке с хлоридом алюминия выпадет белый осадок:
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓При дальнейшем добавлении гидроксида натрия, в пробирке где был хлорид алюминия произойдет растворение осадка:
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]В пробирке где не произошло растворение осадка находился хлорид стронция.
4.
Fe + 2HCl ⟶ FeCl2 + H2↑
FeCl2 + 2NaOH ⟶ 2NaCl + Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 ⟶ 4Fe(OH)3
Fe(OH)3 + 3HNO3 ⟶ Fe(NO3)3 + 3H2O
Вариант II
1. В пробирке с карбонатом кальция выделится газ без запаха:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑В пробирке с сульфидом натрия выделится газ имеющий запах тухлых яиц:
Na2S + 2HCl ⟶ 2NaCl + H2S↑В оставшиеся две пробирки нальём раствор хлорида бария, в пробирке с сульфатом натрия выпадет белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓В оставшейся пробирке находится нитрат стронция.
2. Растворим немного кристаллов сульфата железа (II) в пробирке с водой, если раствор содержит ионы Fe3+, то при добавлении роданида калия раствор окрасится в красный цвет:
Fe2(SO4)3 + 6KSCN ⟶ 2Fe(SCN)3 + 3K2SO43. Устранить постоянную и временную жёсткость воды можно с помощью соды:
MgSO4 + Na2CO3 ⟶ Na2SO4 + MgCO3↓
Ca(HCO3)2 + Na2CO3 ⟶ 2NaHCO3 + CaCO3↓4.
2Al + 3H2SO4 ⟶ Al2(SO4)3 + 3H2↑
Al2(SO4)3 + 6NaOH ⟶ 6NaCl + 2Al(OH)3↓
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]


