 Такой школьный предмет как Химия одновременно может быть интересным и тут же вызывающим некое отторжение. Нам кажется, это в больше степени зависит от учителей, которые должны не только сами понимать, что не зря теряют время в школе, а занимаются любимым делом, но и от их умения и желания передать точно такие же порывы своим учащимся. Ведь каждый из предметов по-своему интересен, привлекателен, важен и нужен и донести это до школьников является неким талантом, если хотите искусством, что к сожалению большинству из них (учителей) так и не удается.
Такой школьный предмет как Химия одновременно может быть интересным и тут же вызывающим некое отторжение. Нам кажется, это в больше степени зависит от учителей, которые должны не только сами понимать, что не зря теряют время в школе, а занимаются любимым делом, но и от их умения и желания передать точно такие же порывы своим учащимся. Ведь каждый из предметов по-своему интересен, привлекателен, важен и нужен и донести это до школьников является неким талантом, если хотите искусством, что к сожалению большинству из них (учителей) так и не удается.
Ну что же, не будет уже про тех кто учит, поговорим о учебных пособиях. Ведь у них в любом случае останутся все те же задачи и цели, сделать и выполнить домашние задания вне зависимости нравится им этот предмет или нет, может ли преподаватель до них донести разумное и важное или нет...
В этом случае вам помогут ответы к домашним заданиям. В нашем случае это ГДЗ к рабочей тетради по Химии за 8 класс автора Габриелян. Кстати, автор весьма популярный и под его редакцией выпущен уже не один учебник и рабочая тетрадь.
Итак, в нашем случае речь все же о рабочей тетради. На его обложке изображена колба с красной жидкостью, цифра 8 в красном круге, в левом верхнем углу указаны данные об издательстве "Просвещение" и есть указание авторов Габриелян, Сладков.
ГДЗ Ответы к домашним заданиям по химии, рабочая тетрадь, 8 класс, Габриелян
Кликаем по вкладкам, они откроются и вы сможете увидеть ответы.
Предмет химии. Вещества Часть 1
-
Предмет химии. Вещества Часть 1. Номер №1
Химия изучает:
− _
− _
− _
Решение
Химия изучает:
− вещества
− строение веществ
− химические свойства веществ
Номер №2
Вещество − это _
Решение
Вещество − это то, из чего состоят физические тела.
Номер №3
Признаки, по которым одни вещества отличаются от других, − это _ _ _ _ _ _ _ _, например: _
Решение
Признаки, по которым одни вещества отличаются от других, − это свойства, например: цвет, запах, вкус.
Номер №4
Существует взаимосвязь: свойство вещества − применение вещества.
Например, для стекла:
1) _
2) _
3) _
Решение
Существует взаимосвязь: свойство вещества − применение вещества.
Например, для стекла:
1) блеск − хрустальные изделия
2) прозрачность − оконные стекла
3) цвет − витражные стекла
Номер №5
Вещества состоят из _ _ _ _ _ _ _, которые, в свою очередь, образованы из _ _ _ _ _ _. Определенный вид атомов называют _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _. Всего известно _ _ _ химических элементов.
Решение
Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определенный вид атомов называют химическим элементом. Всего известно 118 химических элементов.
Номер №6
Химический элемент существует в трех формах.
Простые вещества − это _
Вещества, образованные из двух и более химических элементов, называются _ _ _ _ _ _ _ _.
Решение
Химический элемент существует в трех формах.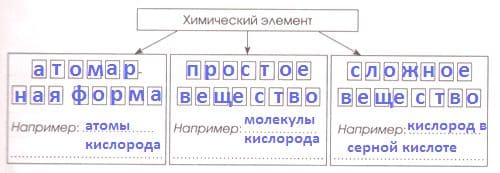
Простые вещества − это вещества, образованные атомами одного химического элемента.
Вещества, образованные из двух и более химических элементов, называются сложными. Часть 2
-
Часть 2. Номер №1
Установите соответствие между понятием и примером.
ПОНЯТИЕ
А) тело
Б) вещество
↓↑
ПРИМЕР
1) гвоздь
2) стекло
3) медь
4) монета
5) ваза
6) железо
Ответ:А Б
Решение
1) гвоздь − тело
2) стекло − вещество
3) медь − вещество
4) монета − тело
5) ваза − тело
6) железо − вещество
Ответ:А Б 1, 4, 5 2, 3, 6
Номер №2
Вычеркните "лишнее":
колба, пробирка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Решение
колба, пробирка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор
Оставшиеся объекты сделаны из стекла (ступка из фарфора, кристаллизатор из стали).
Номер №3
Составьте задание, аналогичное предыдущему.
Решение
Вычеркните "лишнее":
железо, алюминиевая ложка, медь, алюминий, фарфоровая ступка, вода, фарфор.
Укажите признак, общий для оставшихся объектов.
Решение:
железо, алюминиевая ложка, медь, алюминий, фарфоровая ступка, вода, фарфор
Оставшиеся объекты − вещества, а алюминиевая ложка и фарфоровая ступка − физические тела.
Номер №4
Заполните таблицу "Физические свойства веществ". В качестве примеров опишите вещества, используемые на кухне.
Физические свойстваВещество Агрегатное состояние Цвет Запах Растворимость в воде Плотность, $г/см^{3}$ Решение
Физические свойства веществ
Вещество Агрегатное состояние Цвет Запах Растворимость в воде Плотность, $г/см^{3}$ Растительное масло жидкость желтый нет Нерастворимо 0,923 Сахар твердое вещество белый нет Растворим 1,6 Соль твердое вещество белый нет Растворима 2,5 Номер №5
Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая
2) пластичная
3) бесцветная
4) прозрачная
5) ароматная
6) электропроводная
Ответ: _
Решение
Ответ: 1, 3, 4, 6
Номер №6
Заполните таблицу "Сравнение физических свойств газообразных веществ".
Решение
Сравнение физических свойств газообразных веществ
Номер №7
Заполните таблицу "Сравнение физических свойств меди и железа".
Решение
Сравнение физических свойств меди и железа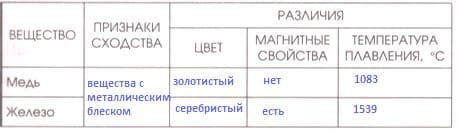
Номер №8
Составьте кроссворд о свойствах и применении какого−либо вещества (по своему выбору).
Решение
Соляная кислота
1) Это соединение по классификации _
2) Реагирует с металлам до _
3) Образует соль нитрат калия при взаимодействии с металлом _
4) В организме человека есть в _
5) Среда этого соединения _
6) По агрегатному состоянию _
7) Связь в соединении ковалентная _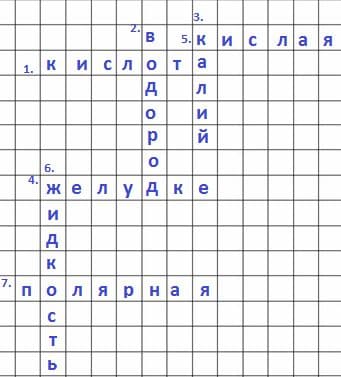
Номер №9*
На примере химического элемента водорода укажите правильную последовательность (1 − 2 − 3) перечисленных понятий от единого к общему. Конкретизируйте ее, используя слова и рисунки моделей частиц.
_ Вещество − это _
_ Атом − это _
_ Молекула − это _
Решение
3 Вещество − это то, из чего состоят физические тела.
1 Атом − это наименьшая, химически неделимая частица вещества.
2 Молекула − это наименьшая частица вещества.
Номер №10
Выражения, являющиеся синонимами понятия "химический элемент".
1) вид одинаковых атомов
2) вид одинаковых молекул
3) вид атомов, имеющих одинаковые свойства
4) простые вещества
5) названия видов атомов
Ответ. _
Решение
Ответ: 1, 3.
Номер №11
Установите соответствие между формой существования химического элемента и рисунками моделей частиц.
ФОРМА СУЩЕСТВОВАНИЯ ХИМИЧЕСКОГО ЭЛЕМЕНТА
А) отдельные атомы
Б) молекулы простых веществ
В) атомы в составе сложного вещества
↓↑
РИСУНКИ МОДЕЛЕЙ ЧАСТИЦ
1)
2)
3)
4)
5)
Ответ:А Б В Решение
Ответ:
А Б В 2 1,4 3,5
Номер №12
Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено _ _ _ _ (укажите сколько) молекул _ _ _ _ _ _ _ веществ, образованных из _ _ _ _ химических элементов.
Решение
На рисунках изображено пять молекул сложных веществ, образованных из трех химических элементов.
Номер №13
Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: _ _ _ _.
1) сера входит в состав лекарственных мазей ... И
2) сера входит в состав молекул серной кислоты ... Х
3) некоторые белки содержат серу ... Л
4) серу применяют в сельском хозяйстве для борьбы с вредителями ... С
5) молекулы сероводорода образованы серой и водородом ... О
6) сера не смачивается водой ... Д
7) молекулы серы состоят из восьми атомов ... Р
В тех фразах, которые вы не выбрали, речь идет о сере как о _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Правильные ответы: 2, 3, 5, 7.
Название химического элемента, соединения которого используют для обеззараживания воды: хлор.
В тех фразах, которые не выбраны, речь идет о сере как о простом веществе. Роль химии в жизни человека. История развития химии. Часть 1
-
Роль химии в жизни человека. История развития химии. Часть 1. Номер №1
Изменения, происходящие с телами и веществами, − это
Решение
Изменения, происходящие с телами и веществами, − это явления.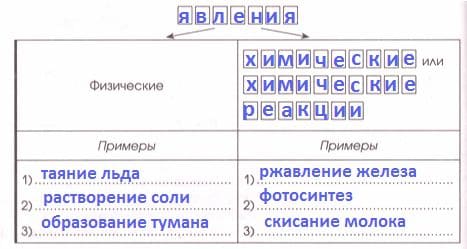
Номер №2
Отношение людей к химии.Положительное − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ − хемофобия Примеры Примеры
Решение
Отношение людей к химии.Положительное − хемофилия Отрицательное − хемофобия Примеры Примеры Изобретение новых технологий и лекарственных препаратов Загрязнение окружающей среды Номер №3
Артефакт алхимии − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Он (укажите роль):
1) ...
2) ...
Решение
Артефакт алхимии − философский камень.
Он (укажите роль):
1) исцеляет
2) превращает любой металл в золото
Номер №4
Заполните таблицу "Великие русские химики".Портрет Фамилия, имя, отчество Вклад в изучение химии 


Решение
Великие русские химикиПортрет Фамилия, имя, отчество Вклад в изучение химии 
Михаил Васильевич Ломоносов Основоположник атомно−молекулярного учения. 
Александр Михайлович Бутлеров Создал теорию химического строения органических веществ. 
Дмитрий Иванович Менделеев Открыл периодическую таблицу химических элементов. Часть 2
-
Часть 2. Номер №1
Выберите синонимы понятия "химические явления".
1) явления, при которых вещество не меняется
2) химические реакции
3) явления, при которых из одних веществ образуются другие вещества
4) явления, при которых изменяется цвет вещества, образуется осадок или газ
5) явления, при которых изменяется агрегатное состояние вещества
Ответ. ...
Решение
Ответ: 2, 3, 4
Номер №2
Разделите явления на физические (А) и химические (Б).
1) порошок серы всплывает в воде, так как не смачивается ею
2) при нагревании сера начинает плавиться и превращается в красноватую вязкую жидкость
3) сера горит синеватым пламенем
4) расплавленная сера соединяется с водородом в ядовитый газ − сероводород
Ответ.А Б
Решение
Ответ:А Б 1,2 3,4
Номер №3
Проанализируйте рисунки и назовите процесс.
а) ...
б) ...
в) ...
г) ...
д) ...
е) ...
Установите соответствие между физическим или химическим явлением и процессом, изображенным на рисунке.ФИЗИЧЕСКИЕ ЯВЛЕНИЯ ХИМИЧЕСКИЕ ЯВЛЕНИЯ б, ..., ... ..., ..., ...
Решение
а) горение
б) падение мяча
в) круговая волна
г) химическая реакция
д) салют
е) действие магнитаФИЗИЧЕСКИЕ ЯВЛЕНИЯ ХИМИЧЕСКИЕ ЯВЛЕНИЯ б, в, е а, г, д Номер №4
Сделайте презентацию на одну из предложенных тем: "Отрицательное значение химии" или "Положительное значение химии", используя возможности Интернета.
Решение
Отрицательное и положительное значение химии
Благодаря химии мы можем синтезироваться необходимые вещества. Например, резину, каучук, пластмассу и многое другое. Многие отрасли зависят от химии:
металлургия, машиностроение, транспорт, производство строительных материалов, электроника, фармацевтическая, легкая и пищевая промышленности.
К сожалению, химия оказывает и отрицательное влияние на нашу жизнь. К таким воздействиям можно отнести: увеличение выбросов в атмосферу, кислотные дожди, парниковый эффект, разливы нефти.

Номер №5
Вычеркните "лишнее": замерзание воды, испарение воды, кипение воды, разложение воды на водород и кислород, фильтрование воды.
Решение
замерзание воды, испарение воды, кипение воды, разложение воды на водород и кислород, фильтрование воды
Обоснование: разложение воды на водород и кислород − химическая реакция, а остальное − это физические явления.
Номер №6
Заполните таблицу "Физические и химические явления", используя результаты своих наблюдений за процессами в быту и в природе.ЯВЛЕНИЯ БЫТОВЫЕ ПРИРОДНЫЕ Физические Химические Решение
Физические и химические явленияЯВЛЕНИЯ БЫТОВЫЕ ПРИРОДНЫЕ Физические испарение воды, кипение воды появление росы, высыхание луж Химические гашение соды уксусом, взаимодействие соды с лимонной кислотой выделение кислорода в процессе фотосинтеза, горение лесов Номер №7
С помощью Интернета и других источников информации (...) сделайте сообщение о жизни и творчестве одного из трех великих русских химиков по следующему плану:
1) детство;
2) учеба в юношеские годы;
3) научная деятельность, основные научные достижения.
Решение
Дмитрий Иванович Менделеев родился 8 февраля 1834 г. в Тобольске в семье Ивана Павловича Менделеева, в то время занимавшего должность директора Тобольской гимназии и училищ Тобольского округа. Дмитрий был в семье последним, семнадцатым ребёнком. В 1841−1849 гг. учился в Тобольской гимназии.
Высшее образование получил на отделении естественных наук физико−математического факультета Главного педагогического института в Петербурге, который окончил в 1855 г. с золотой медалью. В 1856 г. в Петербургском университете защитил в магистерскую диссертацию и с 1857 г. в качестве доцента читал там же курс органической химии.
Открытие Менделеевым периодического закона датируется 1 марта 1869 г., когда он составил таблицу, озаглавленную «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Знаки химических элементов. Часть 1
-
Знаки химических элементов. Часть 1. Номер №1
По горизонтали таблица Д.И. Менделеева делится на _ _ _ _ _ _ _, которые подразделяются на:
а) _ _ _ _ _, это периоды − _, _, _;
б) _ _ _ _ _ _ _, это периоды − _, _, _, _.
Решение
По горизонтали таблица Д.И. Менделеева делится на периоды, которые подразделяются на:
а) малые, это периоды − 1, 2, 3;
б) большие, это периоды − 4, 5, 6, 7.
Номер №2
По вертикали таблица Д.И. Менделеева делится на _ _ _ _ _ _, каждая из которых подразделяется на:
а) _ _ _ _ _ _ _, или _ группу;
б) _ _ _ _ _ _ _ _, или _ группу.
Решение
По вертикали таблица Д.И. Менделеева делится на группы, каждая из которых подразделяется на:
а) главную, или А группу;
б) побочную, или В группу.
Номер №3
IА группа − это группа _ _ _ _ _ _ _ _ металлов.
IIА группа − это группа _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ металлов.
VIIА группа − это группа _ _ _ _ _ _ _ _ _.
VIIIА группа − это группа _ _ _ _ _ _ _ _ _ _ _, или _ _ _ _ _ _ _ _ газов.
Решение
IА группа − это группа щелочных металлов.
IIА группа − это группа щелочноземельных металлов.
VIIА группа − это группа галогенов.
VIIIА группа − это группа благородных, или инертных газов.
Номер №4
Аналогии языка химии с русским языком.РУССКИЙ ЯЗЫК
ХИМИЧЕСКИЙ ЯЗЫК Буквы _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ (символы) Слова _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Предложения _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
РешениеРУССКИЙ ЯЗЫК
ХИМИЧЕСКИЙ ЯЗЫК Буквы Буквы химические знаки (символы) Слова химические формулы Предложения уравнения химических реакций Номер №5
Дополните таблицу "Названия и знаки химических элементов".ЭЛЕМЕНТЫ−МЕТАЛЛЫ
Название Знак Произношение Алюминия Fe Калий Кальций Mg Марганец Cu Натрий Цинк Ba Литий Серебро ЭЛЕМЕНТЫ−НЕМЕТАЛЛЫ
Название Знак Произношение Азот H О Силициум S Фосфор Цэ Br Фтор I Хлор Аргон
Решение
Названия и знаки химических элементов
ЭЛЕМЕНТЫ−МЕТАЛЛЫНазвание Знак Произношение Алюминия Al Алюминий Железо Fe Феррум Калий K Калий Кальций Ca Кальций Магний Mg Магний Марганец Mn Mn Медь Cu Купрум Натрий Na Натрий Цинк Zn Цинк Барий Ba Барий Литий Li Литий Серебро Ag Аргентум ЭЛЕМЕНТЫ−НЕМЕТАЛЛЫ
Название Знак Произношение Азот N Эн Водород H Аш Кислород Кислород О Кремний Si Силициум Сера S Эс Фосфор P Пэ Углерод C Цэ Бром Br Бром Фтор F Фтор Йод I Йод Хлор Cl Хлор Аргон Ar Аргон Номер №6
Примеры названий химических элементов (в скобках укажите химический знак) в соответствии с этимологическими источниками.
1) Свойства простых веществ
..., ..., ...
2) Астрономия
..., ..., ...
3) География
..., ..., ...
4) Древнегреческие мифы
..., ..., ...
5) Великие ученые
..., ..., ...
Решение
1) Свойства простых веществ
Хлор (Cl), Кислород (O), Водород (H)
2) Астрономия
Уран (U), Селен (Se), Теллур (Te)
3) География
Полоний (Po), Галлий (Ga), Германий (Ge)
4) Древнегреческие мифы
Тантал (Ta), Прометий (Pm), Лютеций (Lu)
5) Великие ученые
Менделевий (Md), Резерфордий (Pt), Кюрий (Cm) Часть 2
-
Часть 2. Номер №1
Установите соответствие между положением химического элемента в Периодической системе Д.И. Менделеева и химическим знаком.
ПОЛОЖЕНИЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
А) 3−й период, VIIА группа
Б) 5−й период, IВ группа
В) 2−й период, VIВ группа
Г) 6−й период, VIIА группа
↓↑
ХИМИЧЕСКИЙ ЗНАК
1) Ag
2) O
3) Au
4) At
5) Cl
6) F
Ответ.А Б В Г Решение
Ответ.А Б В Г 5 1 2 4 Номер №2
Выберите символы или названия химических элементов одного большого периода. Из букв, соответствующих правильным ответам, вы составите название металла, который используется для изготовления бенгальских огней: _ _ _ _ _ _.
1) калия ... М
2) Al ... Х
3) Br ... А
4) Si ... О
5) марганец ... Г
6) Cu ... Н
7) углерод ... С
8) Ca ... И
9) Zn ... Й
Решение
Правильные ответы: 1, 3, 5, 6, 8, 9.
Химические элементы большого периода: калий, Br, марганец, Cu, Ca, Zn.
Название металла, который используется для изготовления бенгальских огней: магний.
1) калия ... М
2) Al ... Х
3) Br ... А
4) Si ... О
5) марганец ... Г
6) Cu ... Н
7) углерод ... С
8) Ca ... И
9) Zn ... Й
Номер №3
Впишите в соответствующие столбцы названия следующих химических элементов:
Cl, He, Br, Ne, Li, I, K, Ba, Ca, Na, Xe, SrЩЕЛОЧНЫЕ МЕТАЛЛЫ ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ ГАЛОГЕНЫ БЛАГОРОДНЫЕ ГАЗЫ Решение
ЩЕЛОЧНЫЕ МЕТАЛЛЫ ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ ГАЛОГЕНЫ БЛАГОРОДНЫЕ ГАЗЫ Li, K, Na Ba, Ca, Sr Cl, Br, I He, Ne, Xe Номер №4
Заполните пропуски в логической схеме.
Химический _ _ _ _ _ _ _ (H, _) → Химическая _ _ _ _ _ _ _ ( _ $_{2}O$) → Химическое _ _ _ _ _ _ _ _ _ ($2H_{2}O$ = 2 _ $_{2}$ + _ $_{2}$).
Решение
Химический элемент (H, O) → Химическая формула ($H_{2}O$) → Химическое уравнение ($2H_{2}O = 2H_{2} + O_{2}$).
Номер №5
Сделайте обобщение: химические элементы − углерод, кремний, олово, свинец − относятся к _ _ _ _ _ _ _ _ _ _.
Решение
Сделайте обобщение: химические элементы − углерод, кремний, олово, свинец − относятся к IVА группе.
Номер №6
В левую колонку таблицы запишите, по какому признаку химические элементы разделены на две группы._ _ _ _ _ _ _ Цинк, медь, натрий, золото, серебро, железо _ _ _ _ _ _ _ _ _ Хлор, фтор, водород, кремний, углерод, азот Решение
Металлы Цинк, медь, натрий, золото, серебро, железо Неметаллы Хлор, фтор, водород, кремний, углерод, азот
Номер №7
Установите соответствие между произношением и химическим знаком (символом).
ПРОИЗНОШЕНИЕ ХИМИЧЕСКОГО ЗНАКА (СИМВОЛА)
А) купрум
Б) феррум
В) магний
Г) марганец
Д) силициум
Е) эс
↑↓
ХИМИЧЕСКИЙ ЗНАК (СИМВОЛ)
1) S
2) Mg
3) Cu
4) C
5) Si
6) Fe
7) Mn
8) F
Ответ.А Б В Г Д Е
А Б В Г Д Е
Решение
Ответ.А Б В Г Д Е 3 6 2 7 5 1 Номер №8
Вычеркните лишнее:
кюрий, менделевий, бром, эйнштейний.
Решение
кюрий, менделевий, бром, эйнштейний
Бром лишний, так как остальные химические элементы названы в честь ученых.
Номер №9
Общий этимологический источник названий химических элементов: U, Te, Se − это _ _ _ _ _ _ _ _ _ _.
Решение
Общий этимологический источник названий химических элементов: U, Te, Se − это планетарий.
Номер №10
В честь различных государств или частей света названы элементы: ...
Решение
В честь различных государств или частей света названы элементы: германий, франций, индий, европий. Относительные атомная и молекулярная массы. Часть 1
-
Относительные атомная и молекулярная массы. Часть 1. Номер №1
Решение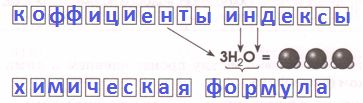
Номер №2
Ar элемента показывает, во сколько раз масса его атома больше ...
Она указана в таблице Д.И. Менделеева, например:
Ar (H) = _
Ar (O) = _
Ar (N) = _
Ar ( _ _ ) = 56
Ar ( _ _ ) = 64
Ar ( _ _ ) = 35,5
Решение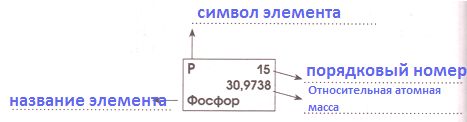
Ar (H) = 1
Ar (O) = 16
Ar (N) = 14
Ar (Fe) = 56
Ar (Cu) = 64
Ar (Cl) = 35,5
Номер №3
Mr вещества показывает, во сколько раз масса ...
Mr равна сумме Ar элементов с учетом их индексов.
Mr ($H_{2}O$) = ...
Mr ($H_{2}SO_{4}$) = ...
Mr ($CO_{2}$) = ...
Mr ($Ca_{3}(PO_{4})_{2}$) = ...
Решение
Mr вещества показывает, во сколько раз масса молекулы больше $\frac{1}{12}$ массы атома углерода.
Mr равна сумме Ar элементов с учетом их индексов.
Mr ($H_{2}O$) = 1 * 2 + 16 = 18
Mr ($H_{2}SO_{4}$) = 1 * 2 + 32 + 16 * 4 = 98
Mr ($CO_{2}$) = 12 + 16 * 2 = 44
Mr ($Ca_{3}(PO_{4})_{2}$) = 40 * 3 + 31 * 2 + 16 * 4 * 2 = 310
Номер №4
Заполните таблицу "Информация о веществе".ИНФОРМАЦИЯ О ВЕЩЕСТВЕ $O_{2}$ $H_{3}PO_{4}$ Название вещества Тип вещества (простое или сложное) Качественный состав (какими элементами образовано вещество) Количественный состав (сколько атомов каждого элемента содержится в молекуле) Mr вещества Массовая доля каждого элемента в составе вещества Решение
Информация о веществе
Заполните таблицу "Информация о веществе".ИНФОРМАЦИЯ О ВЕЩЕСТВЕ $O_{2}$ $H_{3}PO_{4}$ Название вещества Кислород Ортофосфорная кислота Тип вещества (простое или сложное) Простое вещество Сложное вещество Качественный состав (какими элементами образовано вещество) Кислород Водород, фосфор, кислород Количественный состав (сколько атомов каждого элемента содержится в молекуле) 2 атома кислорода 3 атома водорода, 1 атом фосфора и 4 атома кислорода Mr вещества 16 * 2 = 32 1 * 3 + 31 + 16 * 4 = 98 Массовая доля каждого элемента в составе вещества ω (O) = 100% ω (H) = 3 * 1 : 98 = 3%; ω (P) = 31 : 98 = 32%; ω (O) = 16 * 4 : 98 = 65% Часть 2
-
Часть 2. Номер №1
Установите соответствие между формулой вещества и составом молекулы вещества.
ФОРМУЛА ВЕЩЕСТВА
А) $CH_{4}$
Б) $N_{2}O_{5}$
В) $PCl_{5}$
Г) $SiCl_{4}$
↑↓
СОСТАВ МОЛЕКУЛЫ ВЕЩЕСТВА
1) один атом кремния и четыре атома водорода
2) один атом фосфора и пять атомов хлора
3) один атом углерода и два атома кислорода
4) один атом углерода и четыре атома водорода
5) один атом кремния и четыре атома хлора
6) два атома азота и пять атомов кислорода
Ответ.А Б В Г
А Б В Г
Решение
Ответ.А Б В Г 4 6 2 5
Номер №2
Разделите указанные вещества на простые и сложные:
$N_{2}, NO, O_{3}, AlCl_{3}, Na_{2}SO_{4}, FeCl_{2}, Ca, Cl_{2}, KMnO_{4}, P_{4}$ПРОСТЫЕ ВЕЩЕСТВА СЛОЖНЫЕ ВЕЩЕСТВА Решение
ПРОСТЫЕ ВЕЩЕСТВА $N_{2}, O_{3}, Ca, Cl_{2}, P_{4}$ СЛОЖНЫЕ ВЕЩЕСТВА $NO, AlCl_{3}, Na_{2}SO_{4}, FeCl_{2}, KMnO_{4}$
Номер №3
Исправьте неверно вычисленные значения относительных молекулярных масс для некоторых из приведенных формул.
1) Mr ($CH_{3}COOH$) = 60
2) Mr ($CaCO_{3}$) = 100
3) Mr ($AlCl_{3}$) = 132
4) Mr ($HNO_{3}$) = 63
5) Mr ($Ca(OH)_{2}$) = 74
6) Mr ($Al_{2}(SO_{4})_{3}$) = 315
Ответ. ...
Решение
1) Mr ($CH_{3}COOH$) = 12 + 1 * 3 + 12 + 16 + 16 +1 = 60
2) Mr ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100
3) Mr ($AlCl_{3}$) = 27 + 35,5 * 3 = 133,5
4) Mr ($HNO_{3}$) = 1 + 14 + 16 * 3 = 63
5) Mr ($Ca(OH)_{2}$) = 40 + 16 * 2 + 1 * 2 = 74
6) Mr ($Al_{2}(SO_{4})_{3}$) = 27 * 2 + 32 * 3 + 16 * 4 * 3 = 342
Ответ: 3 и 6 неверные.
Номер №4
Установите соответствие между записью и тем, что она обозначает.
ЗАПИСЬ
А) $O_{3}$
Б) 2O
В) $O_{2}$
Г) 2$O_{2}$
↑↓
ЧТО ОБОЗНАЧАЕТ ЗАПИСЬ
1) молекула кислорода
2) две молекулы кислорода
3) два атома кислорода
4) молекула озона
5) три атома кислорода
6) четыре атома кислорода
Ответ.А Б В Г
А Б В Г
Решение
Ответ.А Б В Г 4 3 1 2 Номер №5
Молекула сахарозы состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Напишите ее формулу и рассчитайте относительную молекулярную массу.
Решение
Дано:
12 атомов углерода
22 атома водорода
11 атомов кислорода
Найти: формулу; Mr − ?
Решение:
$C_{12}H_{22}O_{11}$ − формула сахарозы
Mr ($C_{12}H_{22}O_{11}$) = 12 * 12 + 1 * 22 + 16 * 11 = 342
Ответ: $C_{12}H_{22}O_{11}$
Mr ($C_{12}H_{22}O_{11}$) = 342
Номер №6
Сравните по составу молекулы $H_{2}O$ и $H_{2}O_{2}$.
Сходство: ...
Различие: ...
Решение
Сходство: сложные вещества, состоят из атомов водорода и кислорода, содержат по два атома водорода
Различие: молекула воды содержит один атом водорода, а молекула пероксида водорода − два.
Номер №7
Определите массовые доли водорода и кислорода в пероксиде водорода $H_{2}O_{2}$.
Решение
Дано:
$H_{2}O_{2}$
Найти:
ω (H) − ?
ω (O) − ?
Решение:
1) Mr ($H_{2}O_{2}$) = 1 * 2 + 16 * 2 = 34
2) ω (H) = 1 * 2 : 34 * 100% = 5,88%
3) ω (O) = 16 * 2 : 34 * 100% = 94,12%
Ответ: ω (H) = 5,88%; ω (O) = 94,12%
Номер №8
Запишите формулы веществ, зная их произношение. Рассчитайте Mr.
1) энд−два−о
Mr ( ) = ...
2) аш−два−силициум−о−три
Mr ( ) = ...
3) купрум−эс−о−четыре
Mr ( ) = ...
Решение
1) энд−два−о − $N_{2}O$
Mr ($N_{2}O$) = 14 * 2 + 16 = 44
2) аш−два−силициум−о−три − $H_{2}SiO_{3}$
Mr ($H_{2}SiO_{3}$) = 1 * 2 + 28 + 16 * 3 = 78
3) купрум−эс−о−четыре − $CuSO_{4}$
Mr ($CuSO_{4}$) = 64 + 32 + 16 * 4 = 160
Номер №9
Придумайте и решите задачу на расчет массовой доли химического элемента в составе сложного вещества, состоящего из двух элементов.
Решение
Определите массовые доли азота и кислорода в оксиде азота (IV) − $NO_{2}$.
Дано:
$NO_{2}$
Найти:
ω (N) − ?
ω (O) − ?
Решение:
1) Mr ($NO_{2}$) = 14 + 16 * 2 = 46
2) ω (N) = 14 : 46 * 100% = 30,4%
3) ω (O) = 16 * 2 : 46 * 100% = 69,6%
Ответ: Mr ($NO_{2}$) = 46; ω (N) = 30,4%; ω (O) = 69,6% Изотопы. Часть 1
-
Изотопы. Часть 1. Номер №1
Решение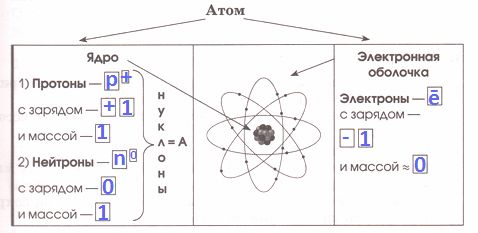
Номер №2
Вся масса атома сосредоточена в _ _ _ _. Число нейтронов _ = _ − _, где Z − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Вся масса атома сосредоточена в ядре. Число нейтронов N = A − Z, где Z − порядковый номер.
Номер №3
Порядковый номер элемента соответствует заряду атомного ядра, т.е. числу _ _ _ _ _ _ _ _ в нем. Так как атом электронейтрален, то порядковый номер элемента также соответствует числу _ _ _ _ _ _ _ _ _ _.
Решение
Порядковый номер элемента соответствует заряду атомного ядра, т.е. числу протонов в нем. Так как атом электронейтрален, то порядковый номер элемента также соответствует числу электронов.
Номер №4
Изменение числа протонов в ядре атома химического элемента приведет к образованию атомов другого _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _. Следовательно, химический элемент − это совокупность атомов с одинаковым _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Изменение числа протонов в ядре атома химического элемента приведет к образованию атомов другого химического элемента. Следовательно, химический элемент − это совокупность атомов с одинаковым числом протонов.
Номер №5
Изменение числа нейтронов в ядре атома химического элемента приводит к образованию _ _ _ _ _ _ _ _.
Решение
Изменение числа нейтронов в ядре атома химического элемента приводит к образованию изотопов.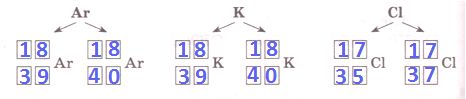
Часть 2
-
Часть 2. Номер №1
Выберите верные утверждения.
1) Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атомов.
2) Нейтрон − это электронейтральная частица с массой, равной 1.
3) Ядро атома не имеет заряда.
4) Электрон − это отрицательно заряженная частица с массой, равной 1.
5) Химический элемент − это мельчайшая частица, сохраняющая его химические свойства.
Ответ. ...
Решение
Ответ: 1, 2
Номер №2
Заполните таблицу "Состав атомов химических элементов".ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА S Si Fe Zn Br Число протонов Число электронов Число нейтронов Решение
Состав атомов химических элементовХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА S Si Fe Zn Br Число протонов 16 14 26 30 35 Число электронов 16 14 26 30 35 Число нейтронов 16 14 26 30 45
Номер №3
Установите соответствие между названием химического элемента и условным обозначениями его атомов. Из букв, соответствующих правильным ответам, вы составите название самого легкого из изотопов водорода: _ _ _ _ _ _.НАЗВАНИЕ ХИМИЧЕСКОГО ЭЛЕМЕНТА $^{35}_{17}Э$ $^{39}_{19}Э$ $^{16}_{18}Э$ $^{37}_{17}Э$ $^{40}_{19}Э$ $^{17}_{18}Э$ Хлор П К Н Т Г О Калия И Р В Ц И Л Кислород М Д О У Ч Й Решение
Хлор − $^{35}_{17}Э$, $^{37}_{17}Э$
Калий − $^{39}_{19}Э$, $^{40}_{19}Э$
Кислород − $^{16}_{18}Э$, $^{17}_{18}Э$
Название самого легкого из изотопов водорода: протий.
Номер №4
Определите, в каких парах химических элементов число нейтронов в ядре атома одного из элементов вдвое больше.
1) $^{108}_{47}Ag$ и $^{56}_{26}Fe$
2) $^{12}_{6}C$ и $^{27}_{13}Al$
3) $^{20}_{10}Ne$ и $^{9}_{4}Be$
4) $^{20}_{10}Ne$ и $^{40}_{20}Ca$
Ответ. ...
Решение
Ответ: 4
Номер №5
Приведите примеры использования явления радиоактивности, применения ядерных процессов, подчеркнув их положительное и отрицательное влияние на человека.ПОЛОЖИТЕЛЬНОЕ ОТРИЦАТЕЛЬНОЕ
РешениеПОЛОЖИТЕЛЬНОЕ ОТРИЦАТЕЛЬНОЕ Лучевая терапия, дезинфекция. Поражает костный мозг, лучевая болезнь. Номер №6
Запишите названия и символы химических элементов, в атомах которых:
1) 5 протонов, 6 нейтронов и 5 электронов
2) 10 протонов, 10 нейтронов и 9 электронов
3) 15 протонов, 15 электронов и 16 нейтронов
Решение
1) Бор − B
2) Неон − Ne
3) Фосфор − P
Номер №7
Установите соответствие между понятием и его определением.
ПОНЯТИЕ
А) химический элемент
Б) атом
В) молекула
Г) простое вещество
Д) сложное вещество
↑↓
ОПРЕДЕЛЕНИЕ ПОНЯТИЯ
1) мельчайшая частица вещества, определяющая его химические свойства
2) мельчайшая химически неделимая частица
3) вещество, состоящее из атомов разных элементов
4) вещество, состоящее из атомов одного элемента
5) определенный вид атомов
Ответ.А Б В Г Д Решение
Ответ.А Б В Г Д 5 2 1 4 3 Строение электронных оболочек атомов. Часть 1
-
Строение электронных оболочек атомов. Часть 1. Номер №1
Совокупность электронов в атоме называется _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Совокупность электронов в атоме называется электронной оболочкой.
Номер №2
Электроны на электронной оболочке атома располагаются по электронным _ _ _ _ _, или энергетическим _ _ _ _ _ _ _.
Решение
Электроны на электронной оболочке атома располагаются по электронным слоям, или энергетическим уровням.
Номер №3
Номер периода соответствует числу _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ в атоме химического элемента.
Решение
Номер периода соответствует числу электронных слоев в атоме химического элемента.
Номер №4
Номер группы соответствует числу электронов на внешнем энергетическом _ _ _ _ _ _.
Решение
Номер группы соответствует числу электронов на внешнем энергетическом уровне.
Номер №5
Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1−го по 10−й в таблице Д.И. Менделеева, а также калия и кальция.
Решение
Часть 2
-
Часть 2. Номер №1
В приведенном перечне: мышьяк, теллур, германий, йод, селен, полоний, астат − число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно:
1) одному
2) двум
3) трем
4) четырем
Ответ. ...
Решение
Ответ: 3
Шесть электронов на внешнем энергетическом уровне у теллура, селена и полония.
Номер №2
Атомы химических элементов 4−го периода имеют одинаковое число:
1) электронов на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4) протонов
Ответ. ...
Решение
Ответ: 3), так как количество энергетических уровне равно номеру периода.
Номер №3
Установите соответствие между символом химического элемента (в заданном порядке) и числом электронов на внешнем энергетическом уровне его атома. Из букв, соответствующих правильным ответам, вы составите название установки, которая позволит человечеству еще глубже познать строение атома: _ _ _ _ _ _ _ _ _.ЧИСЛО е НА ВНЕШНЕМ ЭНЕРГЕТИЧЕСКОМ УРОВНЕ Mg Si I F C Ba Sn Ca Br 2 К А П О Л Й С Е М 4 А О В К А Т Д Ч Я 7 В Й Л Л Н Г О Л Р
РешениеЧИСЛО е НА ВНЕШНЕМ ЭНЕРГЕТИЧЕСКОМ УРОВНЕ Mg Si I F C Ba Sn Ca Br 2 К А П О Л Й С Е М 4 А О В К А Т Д Ч Я 7 В Й Л Л Н Г О Л Р Название установки, которая позволит человечеству еще глубже познать строение атома: коллайдер.
Номер №4
Установите соответствие между символом химического элемента (в заданном порядке) и числом энергетических уровней в электронной оболочке атома. Из букв, соответствующих правильным ответам, вы составите название частиц, из которых, в свою очередь, строят протоны и нейтроны: _ _ _ _ _.ЧИСЛО ЭНЕРГЕТИЧЕСКИЙ УРОВНЕЙ В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ АТОМА H O Ne He Mg S 1 К А П Р Л Й 2 А В А К А Т 3 В Й Л Л К И
РешениеЧИСЛО ЭНЕРГЕТИЧЕСКИЙ УРОВНЕЙ В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ АТОМА H O Ne He Mg S 1 К А П Р Л Й 2 А В А К А Т 3 В Й Л Л К И Название частиц, из которых, в свою очередь, строят протоны и нейтроны: кварки.
Номер №5
Верны ли следующие суждения?
А. Число электронов в электронной оболочке атома Cl равно 7.
Б. Число электронов на внешнем энергетическом уровне атома Br равно 35.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ. ...
Решение
Ответ: 4
Номер №6
Вычеркните "лишний" химический элемент из ряда
P, Be, S, N, Ne, Ca, H
по признаку завершенности внешнего электронного слоя атома.
Решение
P, Be, S, N, Ne, Ca, H
У неона завершенный внешний уровень.
Номер №7
Предложите алгоритм составления электронной схемы атома химического элемента.
1) ...
2) ...
3) ...
4) ...
Решение
Алгоритм составления электронной схемы атома химического элемента
1) Определить общее количество электронов.
2) Определить количество энергетических уровней атома.
3) Определить количество электронов на внешнем энергетическом уровне.
4) Распределить электроны по энергетическим уровням.
Номер №8
Сравните строение электронных оболочек атомов Ca и Mg.
Сходство: ...
Различие: ...
Решение
Сходство: на внешнем энергетическом уровне 2 электрона; на первом энергетическом уровне 2 электрона, на втором − 8.
Различие: кальций имеет 4 энергетических уровня, а магний − 3. Изменение свойств элементов в периодах и группах. Часть 1
-
Изменение свойств элементов в периодах и группах. Часть 1. Номер №1
Химические элементы
(по строению атома)↓ ↓ ↓ Металлы (М) Благородные газы (БГ) Неметаллы (НМ) − имеют _ − _ электрона во внешнем слое атома; − имеют завершённый внешний слой атома − имеют _ и более электрона во внешнем слое атома; − имеют сравнительно большой радиус атома − имеют сравнительно малый радиус атома Решение
Химические элементы
(по строению атома)↓ ↓ ↓ Металлы (М) Благородные газы (БГ) Неметаллы (НМ) − имеют 1 − 3 электрона во внешнем слое атома; − имеют завершённый внешний слой атома − имеют 4 и более электрона во внешнем слое атома; − имеют сравнительно большой радиус атома − имеют сравнительно малый радиус атома Номер №2
Металлы в стремлении получить завершенный внешний электронный слой атома _ _ _ _ _ _ свои внешние _ _ _ _ _ _ _ _ _, а неметаллы _ _ _ _ _ _ _ _ _ недостающие до 8 электроны.
Решение
Металлы в стремлении получить завершенный внешний электронный слой атома отдают свои внешние электроны, а неметаллы принимают недостающие до 8 электроны.
Номер №3
В группе с ростом порядкового номера элементов усиливаются _ _ _ _ _ _ _ _ _ _ свойства и ослабевают, _ _ _ _ _ _ _ _ _ _ _ _ _ _ _, потому что:
1) увеличивается число ...
2) постоянное число ...
3) увеличивается ...
Решение
В группе с ростом порядкового номера элементов усиливаются металлические свойства и ослабевают, неметаллические, потому что:
1) увеличивается число электронных слоев
2) постоянное число электронов на внешнем энергетическом уровне
3) увеличивается радиус атомов
Номер №4
В периоде с ростом порядкового номера элементов усиливаются _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ свойства и ослабевают _ _ _ _ _ _ _ _ _ _ _ _ _, потому что:
1) увеличивается число ...
2) постоянное число ...
3) уменьшается ...
Решение
В периоде с ростом порядкового номера элементов усиливаются неметаллические свойства и ослабевают металлические, потому что:
1) увеличивается число электронов на внешнем энергетическом уровне
2) постоянное число энергетических уровней
3) уменьшается радиус атомов
Номер №5
Заполните таблицу "Свойства химических элементов", указав усиление или ослабевание свойств в ряду.РЯД ЭЛЕМЕНТОВ МЕТАЛЛИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА P, S, Cl P, As, Sb C, B, Be Sn, Ge, Si Решение
Свойства химических элементовРЯД ЭЛЕМЕНТОВ МЕТАЛЛИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА P, S, Cl уменьшаются увеличиваются P, As, Sb увеличиваются уменьшаются C, B, Be увеличиваются уменьшаются Sn, Ge, Si увеличиваются увеличиваются Часть 2
-
Часть 2. Номер №1
Выберите символы химических элементов−неметаллов. Из букв, соответствующих правильным ответам, вы составите название чрезвычайно токсичного газа бледно−желтого цвета с резким запахом: _ _ _ _.
1) F ... Ф
2) K ... Т
3) Na ... А
4) Pb ... Е
5) I ... Т
6) C ... О
7) As ... Р
8) Ca ... Д
Решение
Название чрезвычайно токсичного газа бледно−желтого цвета с резким запахом: фтор.
1) F ... Ф
2) K ... Т
3) Na ... А
4) Pb ... Е
5) I ... Т
6) C ... О
7) As ... Р
8) Ca ... Д
Правильные ответы: 1, 5, 6, 7.
Номер №2
Верны ли следующие суждения?
А. По периоду слева направо радиус атома увеличивается.
Б. По группе снизу вверх радиус атома уменьшается.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ. ...
Решение
Ответ: 3
Номер №3
Обведите знак "больше" или "меньше", если речь идет о металлических свойствах в первом случае и о неметаллических − во втором.
Решение
Номер №4
Составьте кроссворд на тему "Благородные газы", используя Интернет.
Решение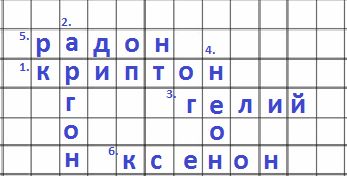
1) Элемент с атомным номером 36
2) Этим газом заполняются электрические лампочки
3) Этим газом заполняются воздушные шары
4) Атом содержит 10 протонов
5) Химический элемент в 6 периоде
6) Массовое число элемента равняется 136
Номер №5
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют электронные схемы атомов:
1) элементов−неметаллов2е, 8е, 5е 2е, 3е 2е, 5е 2е, 8е, 1е 2е, 8е, 7е 2е, 8е, 2е 2е, 1е 2е, 8е, 3е 2е, 8е, 6е 2) элементов−металлов
2е, 8е, 7е 2е, 8е, 3е 2е, 8е, 1е 2е, 1е 2е, 3е 2е, 8е, 6е 2е, 5е 2е, 8е, 2е 2е, 8е, 4е
Решение
1) элементов−неметаллов2е, 8е, 5е 2е, 3е 2е, 5е 2е, 8е, 1е 2е, 8е, 7е 2е, 8е, 2е 2е, 1е 2е, 8е, 3е 2е, 8е, 6е 2) элементов−металлов
2е, 8е, 7е 2е, 8е, 3е 2е, 8е, 1е 2е, 1е 2е, 3е 2е, 8е, 6е 2е, 5е 2е, 8е, 2е 2е, 8е, 4е Выигрышного пути нет!
Номер №6*
Постройте график зависимости порядковых номеров химических элементов одного периода от радиусов их атомов, условно приняв изменение радиусов соседних элементов за 1.
Сделайте вывод. _
Решение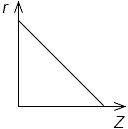
Вывод: в периоде с увеличением порядкового номера химического элемента атомный радиус уменьшается.
Номер №7*
Постройте график зависимости порядковых номеров химических элементов одной группы от радиусов их атомов, условно приняв изменение радиусов соседних элементов за 1.
Сделайте вывод. _
Решение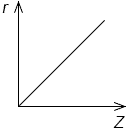
Вывод: в группе с увеличением порядкового номера химического элемента атомный радиус увеличивается.
Ионная химическая связь. Часть 1
-
Ионная химическая связь. Часть 1. Номер №1
Атомы металлов, отдавая внешние электроны, превращаются в _ _ _ _ _ _ _ _ _ _ _ _ _ ионы: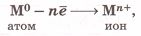
где n − число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
Решение
Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы: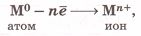
где n − число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
Номер №2
Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в _ _ _ _ _ _ _ _ _ _ _ _ _ ионы: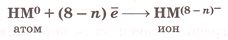
Решение
Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя, превращаются в отрицательные ионы: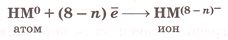
Номер №3
Между разноименно заряженными _ _ _ _ _ _ возникает связь, которая называется _ _ _ _ _ _.
Решение
Между разноименно заряженными ионами возникает связь, которая называется ионной.
Номер №4*
Дополните таблицу "Ионная связь".
Решение
Ионная связь
Часть 2
-
Часть 2. Номер №1
Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из древнейших природных красителей: _ _ _ _ _ _.
1) $F^{0}$ + e → ... Ф
2) $K^{0}$ − e → ... И
3) $Na^{0}$ − e → ... Н
4) $Al^{0}$ − 3e → ... Д
5) $Ba^{0}$ − 2e → ... И
6) $Mg^{0}$ − 2e → ... Г
7) $As^{0}$ + 3e → ... Р
8) $Ca^{0}$ − 2e → ... О
Решение
Название одного из древнейших природных красителей: индиго.
1) $F^{0}$ + e → ... Ф
2) $K^{0}$ − e → ... И
3) $Na^{0}$ − e → ... Н
4) $Al^{0}$ − 3e → ... Д
5) $Ba^{0}$ − 2e → ... И
6) $Mg^{0}$ − 2e → ... Г
7) $As^{0}$ + 3e → ... Р
8) $Ca^{0}$ − 2e → ... О
Правильные ответы: 2, 3, 4, 5, 6, 8.
Номер №2
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.$NH_{3}$ $H_{2}O$ CaO $BaBr_{2}$ $Cl_{2}$ $CO_{2}$ LiF NaCl $K_{2}O$ Решение
$NH_{3}$ $H_{2}O$ CaO $BaBr_{2}$ $Cl_{2}$ $CO_{2}$ LiF NaCl $K_{2}O$ Вещества с ионной связью: CaO, $BaBr_{2}$, LiF, NaCl, $K_{2}O$.
Номер №3
Верны ли следующие утверждения?
А. Электронная схема 2е, 8е, 8е соответствует иону химического элемента, расположенного в 3−м периоде, IА группе.
Б. $^{7}_{3}Li^{0}$ − _ _ _ _ лития и $^{7}_{3}Li^{+}$ _ _ _ лития имеют разное число электронов.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ. ...
Решение
А. Электронная схема 2е, 8е, 8е соответствует иону химического элемента, расположенного в 3−м периоде, IА группе.
Б. $^{7}_{3}Li^{0}$ − атом лития и $^{7}_{3}Li^{+}$ ион лития имеют разное число электронов.
Ответ: 3
Номер №4
Подчекните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
2) водород и фосфор
3) алюминий и фтор
4) водород и азот
Составьте схемы образования химичеcкой связи между выбранными элементами.
Решение
1) калий и кислород: $2K^{0} + O^{0} = K^{+1}_ {2}O^{-2}$
2) водород и фосфор
3) алюминий и фтор: $Al^{0} + 3F^{0} = Al^{+3}F^{-1}_ {3}$
4) водород и азот
Номер №5*
Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
Решение
Процесс образования ионной химической связи.
Номер №6
Составьте схему образования двух химических соединений с ионной связью по условной записи: $А^{0} + 2Б^{0} → А^{2+}Б^{-}_{2}$.
Выберите химические элементы "А" и "Б" из следующего списка: кальций, хлор, калий, кислород, азот, алюминий, магний, углерод, бром.
Решение
$Ca^{0} + 2Cl^{0} → Ca^{2+}Cl^{-}_{2}$
$Mg^{0} + 2Cl^{0} → Mg^{2+}Cl^{-}_{2}$
Номер №7
Напишите небольшое литературное произведение (эссе, новеллу или стихотворение) об одном из веществ с ионной связью, которое человек применяет в быту или на производстве. Для выполнения задания используйте возможноти Интернета.
Решение
Ионная связь − это химическая связь между металлом и неметаллом. Чаще всего встречается в солях, но также есть в основных и амфотерных оксидах. Например, $Na_{2}O, ZnO, CuO$.
Рассмотрим самую распространенную соль − хлорид натрия. Человек добавляет эту соль в пищу каждый день. Нормой является значение 5 − 10 г в сутки.
NaCl − ионная связь, натрий − металл, а хлор − неметалл. Натрий отдает свой электрон хлор и они крепко удерживаются рядом друг с другом в связи. Ковалентная химическая связь. Часть 1
-
Ковалентная химическая связь. Часть 1. Номер №1
Связь между _ _ _ _ _ _ _ элементов − _ _ _ _ _ _ _ _ _ за счет образования _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ называется _ _ _ _ _ _ _ _ _ _ _ или атомной.
Решение
Связь между атомами элементов − неметаллов за счет образования общих электронных пар называется ковалентной или атомной.
Номер №2
Алгоритм составления схемы образования молекул соединения с ковалентной связью (на примере $N_{2}$)
1) определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 − N
2) Запишите электронные схемы атомов неметалла через знак "+" так, чтобы непарные электроны были обращены к соседнему знаку.
3) Поставьте стрелку и запишите электронную формулу молекулы, выделив обобществленные электронные пары.
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару черточкой.
РешениеАлгоритм составления схемы образования молекул соединения с ковалентной связью (на примере $N_{2}$) 1) определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 − N. На внешнем уровне 5 электронов, 3 неспаренных. 2) Запишите электронные схемы атомов неметалла через знак "+" так, чтобы непарные электроны были обращены к соседнему знаку. 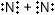
3) Поставьте стрелку и запишите электронную формулу молекулы, выделив обобществленные электронные пары. 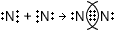
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару черточкой. N≡N Номер №3
По числу общих электронных пар между атомами различают (приведите примеры):
1) _ _ _ _ _ _ _ _ _ связь
2) _ _ _ _ _ _ _ связь
3) _ _ _ _ _ _ _ связь
Решение
По числу общих электронных пар между атомами различают:
1) одинарная связь (H−H)
2) двойная связь (O=O)
3) тройная связь (N≡N)
Номер №4
Допишите таблицу "Ковалентная связь".МОЛЕКУЛЯРНАЯ ФОРМУЛА ЭЛЕКТРОННЫЕ СХЕМЫ АТОМОВ ЭЛЕКТРОННАЯ ФОРМУЛА СТРУКТУРНАЯ ФОРМУЛА $N_{2}$ 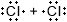
H-H 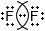
Решение
Ковалентная связьМОЛЕКУЛЯРНАЯ ФОРМУЛА ЭЛЕКТРОННЫЕ СХЕМЫ АТОМОВ ЭЛЕКТРОННАЯ ФОРМУЛА СТРУКТУРНАЯ ФОРМУЛА $N_{2}$ 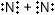
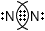
N≡N $Cl_{2}$ 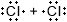
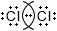
Cl−Cl $H_{2}$ 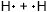
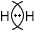
H-H $F_{2}$ 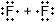
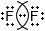
F−F Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, состоящий из формул веществ с ковалентной связью, и запишите схемы их образования.Формулы веществ Формулы веществ Формулы веществ Схемы образования связи $O_{2}$ $K_{2}O$ CaO $AlBr_{3}$ CsCl $CO_{2}$ $BaCl_{2}$ NaF NaF Решение
Формулы веществ Формулы веществ Формулы веществ Схемы образования связи $O_{2}$ $K_{2}O$ CaO 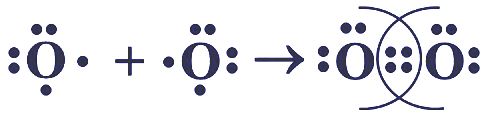
$AlBr_{3}$ CsCl $CO_{2}$ 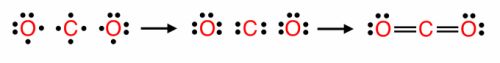
$BaCl_{2}$ NaF NaF нет веществ с ковалентной связью Выигрышного пути нет!
Номер №2
Выберите формулы соединений с ковалентной химической связью. Из букв, соответствующих правильным ответам, составьте название химического элемента, который входит в состав черного пороха: _ _ _ _ .
1) KF ... М
2) Al ... Х
3) $Br_{2}$ ... С
4) $BaO_{2}$ ... О
5) $P_{4}$ ... Е
6) KCl ... Н
7) $O_{3}$ ... Р
8) Ca ... И
9) $S_{2}$ ... А
Решение
Формулы соединений ковалентной химической связью: $Br_{2}$, $P_{4}$, $O_{3}$, $S_{2}$.
Название химического элемента, который входит в состав черного пороха: сера.
1) KF ... М
2) Al ... Х
3) $Br_{2}$ ... С
4) $BaO_{2}$ ... О
5) $P_{4}$ ... Е
6) KCl ... Н
7) $O_{3}$ ... Р
8) Ca ... И
9) $S_{2}$ ... А
Правильные ответы: 3, 5, 7, 9.
Номер №3*
Постройте график зависимости кратности химической связи от ее длины. Сделайте вывод: _
Решение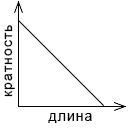
Вывод: при увеличении длины кратность связи уменьшается.
Номер №4*
Постройте график зависимости прочности химической связи от ее кратности.
Сделайте вывод. _
Решение
Вывод: при увеличении кратности прочность связи также увеличивается.
Номер №5*
Придумайте рисунок в стиле комиксов, отражающий процесс образования ковалентной неполярной химической связи.
Решение
Процесс образования ковалентной неполярной химической связи.
Ковалентная полярная химическая связь. Часть 1
-
Ковалентная полярная химическая связь. Часть 1. Номер №1
Электроотрицательность (ЭО) − это _
Решение
Электроотрицательность (ЭО) − это способность атома смещать к себе электронную плотность.
Номер №2
Решение
Номер №3
Если ковалентная химическая связь образуется между атомами разных элементов−_ _ _ _ _ _ _ _ _ _, то общие электронные пары смещены в сторону более _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ элемента. На нем возникает избыточный _ _ _ _ _ _ _ _ _ _ _ _ _ заряд, а на атоме−партнере − избыточный _ _ _ _ _ _ _ _ _ _ _ _ _ заряд. Такая связь называется _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Если ковалентная химическая связь образуется между атомами разных элементов−неметаллов, то общие электронные пары смещены в сторону более электроотрицательного элемента. На нем возникает избыточный отрицательный заряд, а на атоме−партнере − избыточный положительный заряд. Такая связь называется ковалентной полярной.
Номер №4
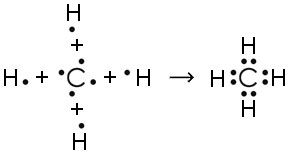
Алгоритм составления схемы образования молекул соединения с ковалентной полярной связью (на примере $H_{2}S$)
1) Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 − N. ...
2) Запишите электронные схемы атомов неметалла через знак (элемент, представленный одним атомом, запишите в центре) через знак "+" так, чтобы непарные электроны были обращены к соседнему знаку. ...
3) Запишите электронную формулу образовавшейся молекулы, показав обобществленные электроны между взаимодействующими атомами. ...
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару чертой. ...
5) Покажите смещение электронных пар к атому (атомам) с большей ЭО, заменив черточки стрелками и обозначив частичные заряды. ...
РешениеАлгоритм составления схемы образования молекул соединения с ковалентной полярной связью (на примере $H_{2}S$)
1) Определите число электронов на внешнем уровне (N) у атомов неметаллов и число непарных электронов по формуле 8 − N. Водород имеет 1 неспаренный электрон, а серв 6 электронов, два из которых неспаренные.
2) Запишите электронные схемы атомов неметалла через знак (элемент, представленный одним атомом, запишите в центре) через знак "+" так, чтобы непарные электроны были обращены к соседнему знаку.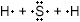
3) Запишите электронную формулу образовавшейся молекулы, показав обобществленные электроны между взаимодействующими атомами.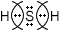
4) Запишите структурную формулу образовавшейся молекулы, обозначив каждую общую электронную пару чертой. H−S−H
5) Покажите смещение электронных пар к атому (атомам) с большей ЭО, заменив черточки стрелками и обозначив частичные заряды. H δ+ → S δ− ← H δ+
Номер №5
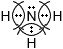
Дополните таблицу "Ковалентная полярная связь".Молекулярная формула Электронные схемы атомов Электронная формула Структурная формула $NH_{3}$ 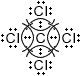
O δ− ← С δ+ → О δ− 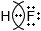
Решение
Ковалентная полярная связьМолекулярная формула Электронные схемы атомов Электронная формула Структурная формула $NH_{3}$ 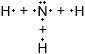
δ−$N ← H_{3}$ δ+ $CCl_{4}$ 

δ+ $C → Cl_{4}$ δ− $CO_{2}$ 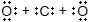
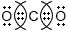
O δ− ← С δ+ → О δ− HF 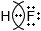
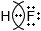
δ+ H → F δ− Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью, и запишите схемы их образования.Формулы веществ Формулы веществ Формулы веществ Схемы образования ковалентной полярной связи $O_{3}$ $H_{2}O$ $AlF_{3}$ HBr $PCl_{5}$ $CH_{4}$ CaO NaCl $Br_{2}$ Решение
Формулы веществ Формулы веществ Формулы веществ Схемы образования ковалентной полярной связи $O_{3}$ $H_{2}O$ $AlF_{3}$ 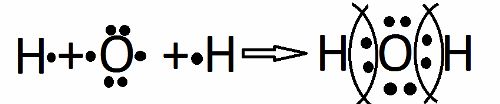
HBr $PCl_{5}$ $CH_{4}$ 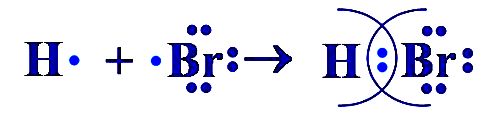
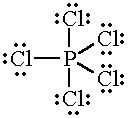
CaO NaCl $Br_{2}$ нет веществ с ковалентной полярной связью
Номер №2
Выберите формулы соединений с ковалентной полярной химической связью. Из букв, соответствующих правильным ответам, вы составите слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла: _ _ _ _ _ .
1) HF ... С
2) Al ... Х
3) $FeBr_{3}$ ... Т
4) $Na_{2}O_{2}$ ... О
5) $SO_{2}$ ... Р
6) KCl ... Н
7) $CO_{2}$ ... А
8) Ca ... И
9) $PCl_{5}$ ... З
Решение
Формулы соединений с ковалентной полярной химической связью: HF, $SO_{2}$, $CO_{2}$, $PCl_{5}$.
Слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла: страз.
Буква Т − $FeBr_{3}$ не соответствует ковалентной полярной связи, соединение имеет ионную связь!
Номер №3*
Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одного периода. Точные значения электроотрицательности найдите с помощью Интернета.
Сделайте вывод: _
Решение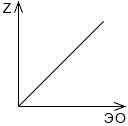
Вывод: электроотрицательность элементов одного периода увеличивается согласно порядковому номеру.
Номер №4*
Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одной главной подгруппы. Точные значения электроотрицательности найдите с помощью Интернета.
Сделайте вывод. _
Решение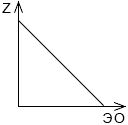
Вывод: электроотрицательность элементов одной главной подгруппы уменьшается согласно порядковому номеру.
Номер №5
Наиболее полярной является химическая связь в молекуле:
1) аммиака − $NH_{3}$
2) сероводорода − $H_{2}S$
3) бромоводорода − HBr
4) фтороводорода − HF
Ответ. _
Решение
Ответ. 4
Номер №6
Расположите следующие вещества в порядке уменьшения полярности химической связи.
1) белый фосфор − $P_{4}$
2) фосфид алюминия − AlP
3) хлорид фосфора (V) − $PCl_{5}$
4) фосфид калия − $K_{3}P$
Ответ. _
Решение
Ответ. 4 2 3 1 Обобщение знаний о типах химической связи. Часть 1
-
Обобщение знаний о типах химической связи. Часть 1. Номер №1
Связь между _ _ _ _ − _ _ _ _ _ _ в _ _ _ _ _ _ _ _ и сплавах за счет обобществленных внешних _ _ _ _ _ _ _ _ _ _ называется _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Связь между атом−ионами в металлах и сплавах за счет обобществленных внешних электронов называется металлической.
Номер №2
Схема образования металлической связи:
Решение
Схема образования металлической связи: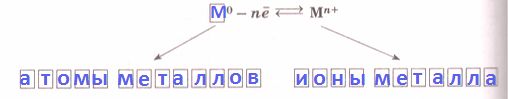
Номер №3
Заполните таблицу "Типы химической связи".
Решение
Типы химической связиПризнаки сравнения Ионная связь Ковалентная связь Металлическая связь Полярная Неполярная Природа связанных химических элементов металл+неметалл неметалл+металл неметалл+металл металл Способ образования передача электронов от атома к неметаллу Образование общих электронных пар Образование общих электронных пар Обобществление электронов Механизм образования Электростатическое притяжение электронов Обменный механизм Обменный механизм Обобществление
внешних электроновПримеры веществ NaCl, LiF HCl, HF Cl2O2 Al, Na Часть 2
-
Часть 2. Номер №1
Установите соответствие между типом химической связи и формулами веществ. Из букв, соответствующих правильным ответам, вы составите название первого металлического сплава, который использовал человек: _ _ _ _ _ _ .Тип связи NaCl $P_{4}$ $P_{2}O_{5}$ $O_{2}$ Na $NH_{3}$ Ионная Б О Г У К В Ковалентная неполярная Ч Р Р Н Н М Ковалентная полярная Д У О Л Ю А Металлическая С Т А Ь З Й Решение
Тип связи NaCl $P_{4}$ $P_{2}O_{5}$ $O_{2}$ Na $NH_{3}$ Ионная Б О Г У К В Ковалентная неполярная Ч Р Р Н Н М Ковалентная полярная Д У О Л Ю А Металлическая С Т А Ь З Й Название первого металлического сплава, который использовал человек: бронза.
Номер №2
Из ряда формул веществ: $Cl_{2}, CaCl_{2}, H_{2}, CO_{2}, NH_{3}, AlCl_{3}, BaF_{2}, F_{2}$ − выберите те, которые соответствуют электронной формуле вещества, представленной в общем виде.m : m 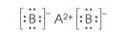
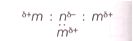
Задание рисунок 1 Задание рисунок 2
Решение
m : m 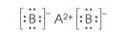
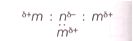
$Cl_{2}, H_{2}, F_{2}$ $CaCl_{2}, BaF_{2}$ $NH_{3}$ $CO_{2}$ не подходит под данные электронные формулы.
Номер №3
Напишите формулы веществ, образованных элементами 2−го периода с помощью всех типов химической связи.
1) _
2) _
3) _
4) _
Запишите схемы образования веществ с ионной и ковалентной полярной химической связью.
1) _
2) _
3) _
Решение
Напишем формулы веществ, образованных элементами 2−го периода с помощью всех типов химической связи.
1) Li − металлическая связь
2) $CO_{2}$ − ковалетная полярная связь
3) $F_{2}$ − ковалентная неполярная связь
4) LiF − ионная связь
Запишем схемы образования веществ с ионной и ковалентной полярной химической связью.
1)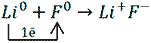
2)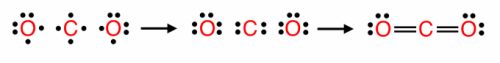
Номер №4
Исключите "лишнее".
1) Na, Al, Si, Ca
2) HCl, $H_{2}O, NH_{3}, H_{2}$
3) $SCl_{2}, CaCl_{2}, MgCl_{2}, KCl$
Решение
1) Na, Al, Si, Ca (кремний − неметалл, а остальные элементы − металлы)
2) HCl, $H_{2}O, NH_{3}$, H$_ {2}$ (в молекуле водорода ковалентая неполярная связь, а в остальных молекулах − полярная)
3) SCl$_ {2}$, $CaCl_{2}, MgCl_{2}, KCl$ (в дихлориде серы ковалентная полярная связь, а остальные вещества − ионного строения)
Номер №5
Верны ли следующие утверждения?
А. Природа любой химической связи электростатическая.
Б. В одном веществе может быть только один вид химической связи.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ: _
Решение
Ответ: 2
Номер №6
Между атомами элементов с порядковыми номерами 11 и 9 образуется химическая связь:
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
Ответ: _
Решение
Ответ: 1 − NaF.
Номер №7
Верны ли следующие суждения?
А. Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Б. Вещества кальций Ca и нитрид кальция $Ca_{3}N_{2}$ образованы соответственно с помощью металлической и ковалентной неполярной связей.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ: _
Решение
Ответ: 4 Простые вещества - металлы. Часть 1
-
Простые вещества - металлы. Часть 1. Номер №1
Металлы (М) располагаются в _ − _ _ _ группах, или в нижней части _ _ − _ _ групп. Только из металлов состоят _ группы.
Решение
Металлы (М) располагаются в I − III группах, или в нижней части IV − VI групп. Только из металлов состоят B группы.
Номер №2
У атомов металлов _ − _ электрона во внешнем электронном слое и сравнительно большой _ _ _ _ _ _ атома. Атомы металлов имеют тенденция к _ _ _ _ _ _ внешних электронов.
Решение
У атомов металлов 1 − 3 электрона во внешнем электронном слое и сравнительно большой радиус атома. Атомы металлов имеют тенденция к отдаче внешних электронов.
Номер №3
Простые вещества − металлы состоят из _ _ _ _ − _ _ _ _ _, связанных _ _ _ _ _ _ _ _ _ _ _ _ _ химической связью, которую можно отобразить общей схемой: _
Решение
Простые вещества − металлы состоят из атом − ионов, связанных металлической химической связью, которую можно отобразить общей схемой: $M^{0} - ne ⇄ M^{n+}$.
Номер №4
Все М − твердые вещества, кроме _ _ . Самые мягкие металлы _ _ группы, самый твердый − _ _ .
Решение
Все М − твердые вещества, кроме Hg. Самые мягкие металлы IA группы, самый твердый − Cr.
Номер №5
М обладают _ _ _ _ _ − и _ _ _ _ _ _ _ проводностью и имеют _ _ _ _ _ _ _ _ _ _ _ _ _ блеск.
Решение
М обладают тепло − и электро проводностью и имеют металлический блеск.
Номер №6
Олово обладает свойством образовывать два простых вещества − _ _ _ _ _ и _ _ _ _ _, т.е. свойством _ _ _ _ _ _ _ _ _ _.
Решение
Олово обладает свойством образовывать два простых вещества − серое и белое, т.е. свойством аллотропии.
Номер №7
Дополните таблицу "Свойства и применение некоторых металлов".Металл Свойства Применение Al Основная часть чугунов и сталей Белое олово Производство ювелирных украшений Решение
Свойства и применение некоторых металловМеталл Свойства Применение Al Электропроводность, легкость Производство электрических проводов, фольги Fe Пластичность, выраженные магнитные свойства Основная часть чугунов и сталей Белое олово Мягкость и пластичность Сплавы со свинцом, медью Au Высокопластичность и мягкость Производство ювелирных украшений Часть 2
-
Часть 2. Номер №1
Выберите названия простых веществ − металлов. Из букв, соответствующих правильным ответам, вы составите название металла, которое в переводе с греческого означает "камень": _ _ _ _ _.
1) бром ... Ф
2) магний ... Л
3) кальций ... И
4) кислород ... Р
5) медь ... Т
6) неон ... А
7) золото ... И
8) ртуть ... Й
Решение
1) бром ... Ф
2) магний ... Л
3) кальций ... И
4) кислород ... Р
5) медь ... Т
6) неон ... А
7) золото ... И
8) ртуть ... Й
Правильные ответы: 2, 3, 5, 7, 8.
Название металла, которое в переводе с греческого означает "камень": литий.
Номер №2
Неверны следующие утверждения, характеризующие металлы:
1) имеют металлический блеск
2) проводят электричество
3) атомы этих элементов отдают электроны с внешнего слоя
4) при обычных условиях − твердые
5) непластичные и нековкие
Ответ: _
Решение
Ответ: 5
Номер №3
Выберите четыре самых электропроводных металла (цифры расположите в порядке убывания электропроводности) из следующего перечня*:
1) золото
2) калий
3) серебро
4) натрий
5) марганец
6) железо
7) магний
8) алюминий
Ответ. _
Решение
Ответ. 3, 1, 8, 7
Номер №4
Составьте схемы образования металлической химической связи для веществ с формулами:
1) Na
2) Ca
3) Al
Решение
1) $Na^{0} - 1e = Na^{+}$
2) $Ca^{0} - 2e = Ca^{2+}$
3) $Al^{0} - 3e = Al^{3+}$
Номер №5
Проанализируйте рисунок "Металлическая кристаллическая решетка".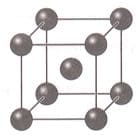
Сделайте вывод о причинах пластичности, тепло− и электропроводности металлов.
Решение
Вывод: металлы пластичны за счет смещение слоев атомов без разрыва связей; тепло− и электропроводность обуславливается хаотичным движением электронов.
Номер №6
Заполните таблицу "Металлы". Даные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.Металл Кем и когда впервые получен Области применения Медь Золото Алюминий Железо Решение
МеталлыМеталл Кем и когда впервые получен Области применения Медь Научное открытие самого металла можно присудить немецкому ученому Готфриду Осанну в 1830 году. Компонент бронзы и латуни Золото Первооткрывателем стал Ерофей Марков в 1747 г Производство ювелирных украшений Алюминий Гансом Эрстедом, 1825 г Производство проводников и фольги Железо Было получено в древние времена, имя первооткрывателя неизвестно Основной компонент сталей и чугунов Номер №7
С помощью Интернета и других источников информации ( _ )подготовьте небольшое сообщение на тему "Ртуть в жизни человека" по следующему плану:
1) знания о ртути в древности и в Средние века;
2) токсичность ртути и меры безопасности при работе с ней;
3) применение ртути в современной промышленности.
Решение
Все алхимики древности и Средневековья были убеждены, что все металлы произошли из ртути и серы. Разницу в свойствах металлов они объясняли присутствием в металле одного из четырех элементов Аристотеля − огня, воздуха, воды и земли.
Характерно, что подобных взглядов придерживались и многие видные ученые далекого прошлого. Так, великий таджикский врач и химик Авиценна тоже считал, что все металлы произошли от ртути и серы.
По данным, ртуть токсична для людей в концентрации 0,005 мг/л. Работая со ртутью, необходимо соблюдать большую осторожность. Ртуть легко испаряется с открытых поверхностей.
Ртуть используется в производстве различных приборов (термометры, манометры), а также для получения хлора и каустической соды на ртутном катоде. Простые вещества - неметаллы. Часть 1
-
Простые вещества - неметаллы. Часть 1. Номер №1
Неметаллы (НМ) располагаются в _ _ _ − _ _ _ группах. Только из НМ состоит _ _ _ _ группа, или группа _ _ _ _ _ _ _ _ _. По физическим свойствам к НМ следует отнести также _ _ _ _ _ группу, или группу _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Неметаллы (НМ) располагаются в III − VII группах. Только из НМ состоит VIIA группа, или группа галогенов. По физическим свойствам к НМ следует отнести также VIIA группу, или группу благородных газов.
Номер №2
У атомов неметаллов _ и более электрона во внешнем слое, небольшой радиус атома, например _ , у атома которого _ внешних e. Поэтому атомы НМ стремятся _ _ _ _ _ _ _ недостающие до 8e. Это свойство атомов характеризуется _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _. В соответствии с ним НМ образуют особый ряд:
_ _ _ _ _ _ _ _ _ _ _.
Решение
У атомов неметаллов 4 и более электрона во внешнем слое, небольшой радиус атома, например $F_{2}$, у атома которого 7 внешних e. Поэтому атомы НМ стремятся принять недостающие до 8e. Это свойство атомов характеризуется электроотрицательностью. В соответствии с ним НМ образуют особый ряд:
H Si P Se C S Br Cl N O F.
Номер №3
Молекулы простых веществ НМ образованы за счет _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ связи. Двухатомные молекулы имеют, например, следующие простые вещества: _ $_{2}$, _ $_{2}$, _ $_{2}$, _ _ _ _ _ _ _ _; трехатомная молекула _ $_{3}$ − у _ _ _ _ _.
Решение
Молекулы простых веществ НМ образованы за счет ковалентной неполярной связи. Двухатомные молекулы имеют, например, следующие простые вещества: $Cl_{2}$, $Br_{2}$, $F_{2}$, галогены; трехатомная молекула $O_{3}$ − у озона.
Номер №4
Аллотропия для неметаллов более характерна, чем для металлов.
Заполните таблицу "Аллотропные модификации неметаллов". Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.
Решение
Аллотропные модификации неметаллов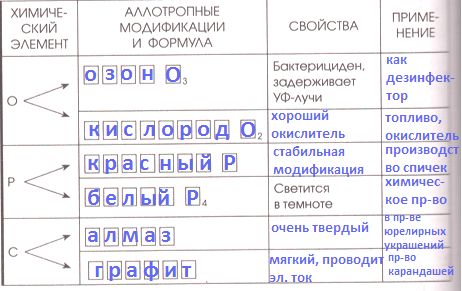
Номер №5
Заполните таблицу "Сравнение свойств металлов и неметаллов".Признаки сравнения Металлы Неметаллы Примечания Положение в Периодической системе Особенности строения атомов: − число е во внешнем слое; − радиус атома Химическая связь в простом веществе Способность к аллотропии Физические свойства: − блеск + - Но у графита и йода металлический блеск. Но графит электропроводен.
Решение
Сравнение свойств металлов и неметалловПризнаки сравнения Металлы Неметаллы Примечания Положение в Периодической системе I − III A группа, а также В подгруппы III − VIIIA группы Особенности строения атомов: − число е во внешнем слое; − радиус атома 1−3 е; большой радиус 4−7 е; маленький радиус Химическая связь в простом веществе Металлическая Ковалентная неполярная Способность к аллотропии Отсутствует Характерна Физические свойства: − блеск + - Но у графита и йода металлический блеск. Но графит электропроводен. Часть 2
-
Часть 2. Номер №1
Выберите названия простых веществ − неметаллов. Из букв, соответствующих правильным ответам, вы составите название неметалла, которое в переводе с греческого означает "гибель", разрешение: _ _ _ _.
1) бром ... Ф
2) магний ... Т
3) кальций ... Л
4) кислород ... Т
5) вольфрам ... Л
6) неон ... О
7) золото ... И
8) йод ... Р
Решение
1) бром ... Ф
2) магний ... Т
3) кальций ... Л
4) кислород ... Т
5) вольфрам ... Л
6) неон ... О
7) золото ... И
8) йод ... Р
Правильные ответы: 1, 4, 6, 8.
Название неметалла, которое в переводе с греческого означает "гибель", разрешение: фтор.
Номер №2
Распределите вещества $Na, Br_{2}, Ne, I_{2}, Li, He, Cl_{2}$ на три группы. Вычислите и запишите относительные молекулярные массы галогенов.Щелочные металлы Благородные газы Галогены Mr вещества
РешениеЩелочные металлы Благородные газы Галогены Mr вещества Na, Li Ne, He $Br_{2}, I_{2}, Cl_{2}$ $Br_{2}$ − 160; $I_{2}$ − 254; $Cl_{2}$ − 71 Номер №3
Неверны следующие утверждения, характеризующие неметаллы:
1) образуют ряд электроотрицательности
2) при обычных условиях фтор, хлор и бром − газы
3) йод и сера при обычных условиях − твердые вещества
4) атомы этих элементов стремятся отдать электроны с внешнего энергетического слоя
5) молекулы простых веществ образованы за счет ковалентной неполярной химической связи
Ответ. _
Решение
Неверны следующие утверждения, характеризующие неметаллы:
1) образуют ряд электроотрицательности
2) при обычных условиях фтор, хлор и бром − газы
3) йод и сера при обычных условиях − твердые вещества
4) атомы этих элементов стремятся отдать электроны с внешнего энергетического слоя
5) молекулы простых веществ образованы за счет ковалентной неполярной химической связи
Ответ. 2, 4
Номер №4
Установите соответствие между названием вещества и его свойствами.
НАЗВАНИЕ ВЕЩЕСТВА
А) алмаз
Б) графит
↑↓
СВОЙСТВА ВЕЩЕСТВА
1) твердый (царапает стекло)
2) мягкий (оставляет следы на бумаге)
3) бесцветный
4) серый
5) имеет слабый металлический блеск
6) преломляет лучи сета
Ответ.А Б
А Б
Решение
Ответ.А Б 1, 3, 6 2, 4, 5 Номер №5
Заполните таблицу "Неметаллы". Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.НЕМЕТАЛЛ КЕМ И КОГДА ВПЕРВЫЕ ПОЛУЧЕН ОБЛАСТИ ПРИМЕНЕНИЯ Йод Аргон Фосфор Бром Решение
НеметаллыНЕМЕТАЛЛ КЕМ И КОГДА ВПЕРВЫЕ ПОЛУЧЕН ОБЛАСТИ ПРИМЕНЕНИЯ Йод Бернар Куртуа, 1811 г В медицине, криминалистике Аргон Уильям Рамзай и Рэйли, 1894 г Сварка металлов, производство лазеров Фосфор Хенниг Бранд, 1669 г Производство спичек Бром Карл Лёвих, 1825 г В медицине
Номер №6
Расположите следующие простые вещества − неметаллы в порядке возрастания их плотности.
1) йод
2) бром
3) азот
4) хлор
5) водород
6) кремний
7) красный фосфор
Ответ: _
Решение
1 − 5) водород
2 − 3) азот
3 − 4) хлор
4 − 7) красный фосфор
5 − 6) кремний
6 − 2) бром
7 − 1) йод
Ответ: 5, 3, 4, 7, 6, 2, 1.
Номер №7
Расположите следующие простые вещества − неметаллы в порядке возрастания интенсивности их окраски.
1) хлор
2) кислород
3) озон
4) бром
5) азот
6) йод
Ответ: _
Решение
1 − 5) азот
2 − 2) кислород
3 − 3) озон
4 − 1) хлор
5 − 4) бром
6 − 6) йод
Ответ: 5, 2, 3, 1, 4, 6. Молярная масса. Часть 1
-
Молярная масса. Часть 1. Номер №1
Единицей количества вещества является _ _ _ _. Обозначает _ или _.
Решение
Единицей количества вещества является моль. Обозначает n или v.
Номер №2
Моль − это также количество вещества, в котором содержится _ * _ _ _ молекул или частиц вещества. Это число называется числом _ _ _ _ _ _ _ _ и обозначается _ _.
Решение
Моль − это также количество вещества, в котором содержится $6 * 10^{23}$ молекул или частиц вещества. Это число называется числом Авогадро и обозначается Na.
Номер №3
Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его _ _ или _ _.
Решение
Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mr или Ar.
Номер №4
Масса 1 моль вещества называется _ _ _ _ _ _ _ _ массой − _. Она измеряется в _ / _ _ _ _ и численно равна _ _ вещества.
Решение
Масса 1 моль вещества называется молярной массой − M. Она измеряется в г/моль и численно равна Mr вещества.
Номер №5
Количество вещества − это величина, равная отношению массы вещества к его _ _ _ _ _ _ _ _ _ _ _ _ _ :
_ = _ / _ → m = _ * _.
Решение
Количество вещества − это величина, равная отношению массы вещества к его молярной массе:
n = m / M → m = n * M.
Номер №6
Число частиц вещества равно произведению числа Авогадро на количество вещества: N = _ * _ _ → n = _ / _ _.
Решение
Число частиц вещества равно произведению числа Авогадро на количество вещества: N = n * $N_{a}$ → n = N / $N_{a}$.
Номер №7
Дополните таблицу, делая необходимые вычисления.Название вещества Формула вещества Mr M n m N Углекислый газ 1,5 моль Серная кислота 196г Глюкоза $C_{6}H_{12}O_{6}$ $3 * 10^{23}$
РешениеНазвание вещества Формула вещества Mr M n m N Углекислый газ $CO_{2}$ 44 44 г/моль 1,5 моль 66 г $9 * 10^{23}$ Серная кислота $H_{2}SO_{4}$ 98 98 г/моль 2 моль 196г $12 * 10^{23}$ Глюкоза $C_{6}H_{12}O_{6}$ 180 180 г/моль 0,5 моль 90г $3 * 10^{23}$ Mr ($CO_{2}$) = 12 + 16 * 2 = 44
m = M * n = 44 * 1,5 моль = 66 г
N = n * $N_{a}$ = 1,5 моль * $6 * 10^{23}$ = $9 * 10^{23}$
Mr ($H_{2}SO_{4}$) = 1 * 2 + 32 + 16 * 4 = 98
n = m : M = 196 г : 98 г/моль = 2 моль
N = n * $N_{a}$ = 2 моль * $6 * 10^{23}$ = $12 * 10^{23}$
Mr ($C_{6}H_{12}O_{6}$) = 12 * 6 + 1 * 12 + 16 * 6 = 180
n = N : $N_{a}$ = $3 * 10^{23} : 6 * 10^{23}$ = 0,5 моль
m = n * M = 0,5 моль * 180 г/моль = 90 г Часть 2
-
Часть 2. Номер №1
Впишите пропущенные числа.
1) Ar (Na) = _ _ → _ _ г натрия содержат _ * _ _ _ _ атомов натрия.
2) Ar ($O_{2}$) = _ _ → _ _ г кислорода содержат _ * _ _ _ _ молекул $O_{2}$.
3) Ar (CO) = _ _ → _ _ г угарного газа содержат _ * _ _ _ _ молекул CO.
Решение
1) Ar (Na) = 23 → 23 г натрия содержат $6 * 10^{23}$ атомов натрия.
2) Ar ($O_{2}$) = 32 → 32 г кислорода содержат $6 * 10^{23}$ молекул $O_{2}$.
3) Ar (CO) = 28 → 28 г угарного газа содержат $6 * 10^{23}$ молекул CO.
Номер №2
Установите соответствие между названием величины и ее условным обозначение.
НАЗВАНИЕ ВЕЛИЧИНЫ
А) количество вещества
Б) постоянная Авогадро
В) молярная масса
Г) относительная молекулярная масса
Д) относительная атомная масса
Е) число частиц
Ж) масса вещества
↑↓
УСЛОВНОЕ ОБОЗНАЧЕНИЕ
1) N
2) $M_{r}$
3) $N_{a}$
4) m
5) M
6) n
7) $A_{r}$
Ответ:А Б В Г Д Е Ж
А Б В Г Д Е Ж
Решение
Ответ:А Б В Г Д Е Ж 6 3 5 2 7 1 4 Номер №3
Впишите пропущенные названия веществ, частиц вещества, числа и единицы измерения.
1) 1 моль _ _ _ _ _ _ _ _ $H_{2}$ содержит _ * _ _ _ _ _ _ _ _ _ _ _ _ .
2) $3 * 10^{23}$ _ _ _ _ _ _ _ углекислого газа $CO_{2}$ составляют количество вещества, равное _ , _ _ _ _ _ .
3) 64 г _ _ _ _ _ _ _ _ _ $O_{2}$ составляют количетво вещества, равное _ _ _ _ _ .
4) 0, 5 моль _ _ _ _ _ _ _ _ _ _ _ _ _ $H_{2}SO_{4}$ составляют массу вещества, равную _ _ г.
Решение
1) 1 моль водорода $H_{2}$ содержит $6 * 10^{23}$ молекул.
2) $3 * 10^{23}$ молекул углекислого газа $CO_{2}$ составляют количество вещества, равное 0,5 моль.
3) 64 г кислорода $O_{2}$ составляют количетво вещества, равное 0,2 моль.
4) 0, 5 моль серной кислоты $H_{2}SO_{4}$ составляют массу вещества, равную 49 г.
Номер №4
Запишите формулу, по которой можно рассчитать молярную массу вещества, если известно его количество и масса.
M = _
Решение
Формула, по которой можно рассчитать молярную массу вещества, если известно его количество и масса:
M = m : n
Номер №5
Запишите формулу, по которой можно рассчитать массу вещества, если известно число структурных единиц данного вещества.
m = _
Решение
Формула, по которой можно рассчитать массу вещества, если известно число структурных единиц данного вещества:
m = M * N / $N_{a}$
Номер №6
Какие величины можно рассчитать, если известно количество вещества?
Ответ: _
Решение
Ответ: если известно количество вещества, можно рассчитать массу, число структурных частиц.
Номер №7
Сколько молекул содержится в 180 г воды?
Решите задачу двумя способами.
Решение:
1-й способ: n = m / M, N = n * $N_{A}$
1) M ($H_{2}O$) =
2) n ($H_{2}O$) =
3) N ($H_{2}O$) =
2-й способ: m / M = N /$N_{A}$ → N = m * $N_{A}$ / M
N ($H_{2}O$) =
Ответ: _
Решение
Дано:
m ($H_{2}O$) = 180 г
Найти: N − ?
Решение:
1-й способ: n = m / M, N = n * $N_{A}$
1) M ($H_{2}O$) = 1 * 2 + 16 = 18 г/моль
2) n ($H_{2}O$) = m : M = 180 г : 18 г/моль = 10 моль
3) N ($H_{2}O$) = 10 моль * $6 * 10^{23}$ молекул/моль = $60 * 10^{23}$ молекул
2-й способ: m / M = N /$N_{A}$ → N = m * $N_{A}$ / M
N ($H_{2}O$) = 180 г * $6 * 10^{23}$ : 18 г/моль = $60 * 10^{23}$ молекул
Ответ: $60 * 10^{23}$ молекул
Номер №8
Придумайте условия задачи, используя величины из задания 2.
Решите ее любимым способом.
Решение
Найди количество вещества хлорида натрия, зная, что масса равна 78 г.
Дано:
m (NaCl) = 78 г
Найти: n − ?
Решение:
n = m / M
M (NaCl) = 23 + 35,5 = 58,5 г/моль
n = 78 г : 58,5 г/моль = 1,33 моль
Ответ: 1,33 моль Молярный объем газов. Часть 1
-
Молярный объем газов. Часть 1. Номер №1
1 моль любого газа при _ . _ . занимает одинаковый объем, равный _ _ , _ л. Этот объем называется _ _ _ _ _ _ _ _ и обозначается _ _ .
Решение
1 моль любого газа при н. у. занимает одинаковый объем, равный 22,4 л. Этот объем называется молярный и обозначается $V_{m}$.
Номер №2
Количество вещества (n) − отношение объема газа при н.у. к _ _ _ _ _ _ _ _ _ _ _ _ _ _ _:
n = _ / _ _ → _ _ измеряется в _ / _ _ _ _ .
Решение
Количество вещества (n) − отношение объема газа при н.у. к молярному объему:
n = V / $V_{m}$ → $V_{m}$ измеряется в м/литр.
Номер №3
Следовательно, количество вещества
n = $\frac{m}{\_}$ = $\frac{\_}{Vm}$ = $\frac{\_}{Na}$
Решение
Следовательно, количество вещества
n = $\frac{m}{M}$ = $\frac{V}{Vm}$ = $\frac{N}{Na}$
Номер №4
Дополните таблицу "Количественные характеристики веществ", делая необходимые вычисления.Название вещества Формула вещества $M_{r}$ M n m V N Метан $CH_{4}$ Сернистый газ $SO_{2}$ $9 * 10^{23}$ Озон 89,6 л
Решение
Количественные характеристики веществНазвание вещества Формула вещества $M_{r}$ M n m V N Метан $CH_{4}$ 16 16 г/моль 3 моль 48г 67,2 л $18 * 10^{23}$ Сернистый газ $SO_{2}$ 64 64 г/моль 1,5 моль 96 г 33,6л $9 * 10^{23}$ Озон $O_{3}$ 48 48 г/моль 4 моль 192 г 89,6 л $24 * 10^{22}$ Часть 2
-
Часть 2. Номер №1
Установите соотношение между названием и разномерностью величины.
НАЗВАНИЕ ВЕЛИЧИНЫ
А) количество вещества
Б) объем
В) молярная масса
Г) масса вещества
Д) молярный объем
↑↓
РАЗМЕРНОСТЬ ВЕЛИЧИНЫ
1) г/моль
2) г
3) моль
4) л/моль
5) л
Ответ.А Б В Г Д
Решение
Ответ.А Б В Г Д 3 5 1 2 4
Номер №2
Укажите формулы, которые являются производными от основной формулы: n = V / $V_{m}$
1) V = m / ρ
2) V = n * $V_{m}$
3) $V_{m}$ = V / n
4) M = m * $V_{m}$ / V
Ответ. _
Решение
Ответ. 2, 3
Номер №3
Сколько молекул содержат 44,8 л (н.у.) углекислого газа? Решите задачу двумя способами.
Решение:
1-й способ: n = V / $V_{m}$, N = n * $N_{a}$
1) M ($CO_{2}$) =
2) n ($CO_{2}$) =
3) N ($CO_{2}$) =
2-й способ: V / $V_{m}$ = N / $N_{a}$ → N = V * $N_{a}$ / $V_{m}$
N ($CO_{2}$) =
Ответ: _
Решение
Дано:
V ($CO_{2}$) = 44,8 л
Найти: N ($CO_{2}$) − ?
Решение:
1-й способ: n = V / $V_{m}$, N = n * $N_{a}$
1) M ($CO_{2}$) = 12 + 16 * 2 = 44 г/моль
2) n ($CO_{2}$) = 44,8 л : 22,4 л/моль = 2 моль
3) N ($CO_{2}$) = 2 моль * $6 * 10^{23}$ молекул/моль = $12 * 10^{23}$ молекул
2-й способ: V / $V_{m}$ = N / $N_{a}$ → N = V * $N_{a}$ / $V_{m}$
N ($CO_{2}$) = 44,8 л * $6 * 10^{23}$ молекул/моль : 22,4 л/моль = $12 * 10^{23}$ молекул
Ответ: N ($CO_{2}$) = $12 * 10^{23}$ молекул
Номер №4
Придумайте условие задачи, в которой нужно найти число молекул N, если известен объем V. Решите задачу любым способом.
Решение
Найдите число молекул в 44,8 л углекислого газа.
Дано:
V ($CO_{2}$) = 44,8 л
Найти:
N − ?
Решение:
N = n * $N_{a}$ = V / $V_{m}$ * $N_{a}$
N = 44,8 л / 22,4 л/моль * $6 * 10^{23}$ молекул/моль = $12 * 10^{23}$ молекул
Ответ: N = $12 * 10^{23}$ молекул
Номер №5
Вычислите массу 78,4 л (н.у.) хлора.
Решение
Дано:
V ($Cl_{2}$) = 78,4 л
Найти: m ($Cl_{2}$) − ?
Решение:
m = M * n = M * V / $V_{m}$
M ($Cl_{2}$) = 35,5 * 2 = 71 г/моль
m = 71 г/моль * 78,4 л / 22,4 л/моль = 248,5 г
Ответ: m = 248,5 г
Номер №6
Найдите объем 297 г фосгена* ($COCl_{2}$).
Как можно защитить себя во время химической тревоги? Приготовьте сообщение об устройстве противогаза.
Решение
Дано:
m ($COCl_{2}$) = 297 г
Найти:
V ($COCl_{2}$) − ?
Решение:
V ($COCl_{2}$) = $V_{m}$ * n = $V_{m}$ * m / M
V ($COCl_{2}$) = 22,4 л/моль * 297 г / 99 г/моль = 67,2 л
Ответ: V ($COCl_{2}$) = 67, 2 л
Противогаз защищает органы дыхания человека от вредных газов. Противогаз состоит из шапки и фильтра, который содержит активированный уголь. На нем оседают вредные вещества для человеческого организма.
Номер №7
Вычислите массу 56 л аммиака, 10%−й водный раствор которого в медицине известен под названием "нашатырный спирт".
Чем объясняется применение нашатырного спирта в медицине?
Решение
Дано:
V ($NH_{3}$) = 56 л
ω = 10%
Найти: m ($NH_{3}$) − ?
Решение:
m ($NH_{3}$) = M * n = M * V / $V_{m}$
M ($NH_{3}$) = 14 + 1 * 3 = 17 г/моль
m ($NH_{3}$) = 17 г/моль * 56 л / 22,4 л/моль = 42,5 г
Ответ: m ($NH_{3}$) = 42,5 г
В медицине нашатырный спирт используется для выведения человека из обморока, так как этот раствор имеет резкий запах.
Номер №8*
Придумайте задачу с использованием изученных понятий. С помощью компьютера создайте рисунок, иллюстрирующий данную задачу. Предложите способ ее решения.
Решение
Найдите количество вещества в 200 л кислорода.
Дано:
V ($O_{2}$) = 200 л
Найти:
n ($O_{2}$) − ?
Решение:
n ($O_{2}$) = V : $V_{m}$
n ($O_{2}$) = 200 л : 22,4 л/моль = 8,9 моль
Ответ: n ($O_{2}$) = 8,9 моль
Основные и производные единицы измерения количества, массы и объема веществ. Часть 1
-
Основные и производные единицы измерения количества, массы и объема веществ. Часть 1. Номер №1
Количество вещества измеряют в молях, миллимолях (в 1000 раз _ _ _ _ _ _ 1 моль) и киломолях (в 1000 раз _ _ _ _ _ _ 1 моль).
Решение
Количество вещества измеряют в молях, миллимолях (в 1000 раз меньше 1 моль) и киломолях (в 1000 раз больше 1 моль).
Номер №2
Массу измеряют в мг, г, кг.
Решение
Массу измеряют в мг, г, кг.
Номер №3
Различают молярную, миллимолярную и киломолярную массы, которые измеряют соответственно в _ _ / _ _ _ _ _, _ / _ _ _ _, _ _ / _ _ _ _ _ .
Решение
Различают молярную, миллимолярную и киломолярную массы, которые измеряют соответственно в мг/моль, г/моль, кг/моль.
Номер №4
Объем измеряют в мл, л, $м^{3}$, а миллимолярный, молярный и киломолярный объемы в _ _ / _ _ _ _ _ , _ / _ _ _ _ , _ _ / _ _ _ _ _ .
Решение
Объем измеряют в мл, л, $м^{3}$, а миллимолярный, молярный и киломолярный объемы в мл/ммоль, л/моль, $м^{3}$/кмоль.
Номер №5
Заполните таблицу "Соотношение некоторых физико−химических величин и их единиц".Название величины, ее обозначение Единица измерения в 1000 раз меньше Единица измерения основная Единица измерения в 1000 раз больше Масса, m Количества вещества, n Молярная масса, M Число частиц в единице количества вещества, N Объем, V Молярный объем, $V_{m}$ Решение
Название величины, ее обозначение Единица измерения в 1000 раз меньше Единица измерения основная Единица измерения в 1000 раз больше Масса, m мг г кг Количества вещества, n ммоль моль кмоль Молярная масса, M M мг/моль г/моль кг/моль Число частиц в единице количества вещества, N − кол−во молекул − Объем, V мл л $м^{3}$ Молярный объем, $V_{m}$ мл/моль л/моль $м^{3}$/моль Номер №6
Дополните таблицу, делая необходимые вычисления.Название вещества Формула $M_{r}$ M n m V N Азот 1,5 кмоль Углекислый газ 11 мг Этан 44,8 $м^{3}$ Водород $1,5 * 10^{23}$
РешениеНазвание вещества Формула $M_{r}$ M n m V N Азот $N_{2}$ 28 28 кг/моль 1,5 кмоль 42 кг 33,6 $м^{3}$ $9 * 10^{26}$ Углекислый газ $CO_{2}$ 44 44 мг/моль 0,25 ммоль 11 мг 5,6 мл $1,5 * 10^{20}$ Этан $C_{2}H_{6}$ 30 30 кг/моль 2 кмоль 60 кг 44,8 $м^{3}$ $12 * 10^{26}$ Водород $H_{2}$ 2 2 г/моль 0,25 моль 0,5 г 5,6 л $1,5 * 10^{23}$ 1) $M_{r}$ ($N_{2}$) = 14 * 2 = 28
m ($N_{2}$) = M * n = 28 * 1,5 = 42 кг
V ($N_{2}$) = $V_{m}$ * n = 22,4 * 1,5 = 33,6 $м^{3}$
N ($N_{2}$) = $N_{a}$ * n = $6 * 10^{23}$ * 1,5 = $9 * 10^{26}$ молекул
2) $M_{r}$ ($CO_{2}$) = 12 + 16 * 2 = 44
n ($CO_{2}$) = m : M = 11 : 44 = 0,25 ммоль
V ($CO_{2}$) = $V_{m}$ * n = 22,4 * 0,25 = 5,6 мл
N ($CO_{2}$) = $N_{a}$ * n = $6 * 10^{23}$ * 0,25 = $1,5 * 10^{20}$ молекул
3) $M_{r}$ ($C_{2}H_{6}$) = 12 * 2 + 1 * 6 = 30
n ($C_{2}H_{6}$) = V * $V_{m}$ = 44,8 : 22,4 = 2 кмоль
m ($C_{2}H_{6}$) = M * n = 30 * 2 = 60 кг
N ($С_{2}H_{6}$) = $N_{a}$ * n = $6 * 10^{23}$ * 2 = $12 * 10^{26}$ молекул
4) $M_{r}$ ($H_{2}$) = 1 * 2 = 2
n ($H_{2}$) = N * $N_{a}$ = $1,5 * 10^{23}$ : $6 * 10^{23}$ = 0,25 моль
m ($H_{2}$) = M * n = 2 * 0,25 = 0,5 г
V ($H_{2}$) = $V_{m}$ * n = 22,4 * 0,25 = 5,6 л Часть 2
-
Часть 2. Номер №1
Сколько молекул содержится в 513 мг сахарозы $C_{12}H_{22}O_{11}$?
Решение
Дано:
m ($C_{12}H_{22}O_{11}$) = 513 мг
Найти:
N ($C_{12}H_{22}O_{11}$) − ?
Решение:
N ($C_{12}H_{22}O_{11}$) = n * $N_{a}$ = m / M * $N_{a}$
M ($C_{12}H_{22}O_{11}$) = 12 * 12 + 1 * 22 + 16 * 11 = 342 г/моль
N ($C_{12}H_{22}O_{11}$) = 0,513 г / 342 г/моль * $6 * 10^{23}$ = $9 * 10^{20}$ молекул
Ответ: N ($C_{12}H_{22}O_{11}$) = $9 * 10^{20}$ молекул
Номер №2
Вычислите массу (н.у.) 89,6 $м^{3}$ азота.
Решение
Дано:
V ($N_{2}$) = 89,6 $м^{3}$
Найти:
m ($N_{2}$) − ?
Решение:
m ($N_{2}$) = n * M = V : $V_{m}$ * M
M ($N_{2}$) = 14 * 2 =28 г/моль
m ($N_{2}$) = 89,6 $м^{3}$ : 22,4 л/моль * 28 г/моль = 112000 г = 112 кг
Ответ: m ($N_{2}$) = 112 кг
Номер №3
Придумайте условие задачи, если масса газообразного вещества дана в килограммах, а требуется найти объем (н.у.).
Решение
Масса кислорода равна 112 кг. Найдите объем.
Дано:
m ($O_{2}$) = 112 кг
Найти:
V ($O_{2}$) − ?
Решение:
V ($O_{2}$) = n * $V_{m}$ = m : M * $V_{m}$
M ($O_{2}$) = 16 * 2 = 32 г/моль
V ($O_{2}$) = 112 кг : 32 г/моль * 22,4 л/моль = 78400 л
Ответ: V ($O_{2}$) = 78400 л
Номер №4
Рассчитайте число молекул в 147 мг серной кислоты.
Решение
Дано:
m ($H_{2}SO_{4}$) = 147 мг
Найти:
N ($H_{2}SO_{4}$) − ?
Решение:
N ($H_{2}SO_{4}$) = n * $N_{a}$ = m : M * $N_{a}$
M ($H_{2}SO_{4}$) = 1 * 2 + 32 + 16 * 4 = 98 г/моль
N ($H_{2}SO_{4}$) = 147 мг : 98 г/моль * $6 * 10^{23}$ молекул/моль = $9 * 10^{20}$ молекул
Ответ: N ($H_{2}SO_{4}$) = $9 * 10^{20}$ молекул
Номер №5
Число молекул метана равно $6 * 10^{26}$. Вычислите его массу.
Решение
Дано:
N ($CH_{4}$) = $6 * 10^{26}$
Найти:
m ($CH_{4}$) − ?
Решение:
m ($CH_{4}$) = n * M = N : $N_{a}$ * M
M ($CH_{4}$) = 12 + 1 * 4 = 16 г/моль
m ($CH_{4}$) = $6 * 10^{26}$ : $6 * 10^{23}$ * 16 г/моль = 16000 г = 16 кг
Ответ: m ($CH_{4}$) = 16 кг
Номер №6
Какое количество вещества содержится в 945 мг фосфата кальция $Ca_{3}(PO_{4})_{2}$?
Решение
Дано:
m ($Ca_{3}(PO_{4})_{2}$) = 945 мг
Найти:
n ($Ca_{3}(PO_{4})_{2}$) − ?
Решение:
n ($Ca_{3}(PO_{4})_{2}$) = m : M
M ($Ca_{3}(PO_{4})_{2}$) = 3 * 40 + 31 * 2 + 2 * 4 * 16 = 310 г/моль
n ($Ca_{3}(PO_{4})_{2}$) = 945 мг : 310 г/моль = 0,003 моль
Ответ: n ($Ca_{3}(PO_{4})_{2}$) = 0,003 моль
Номер №7
Какой одинаковый объем воздуха (при одинаковых условиях) будет иметь большую массу?
1) сухого воздуха
2) влажного воздуха
Обоснуйте свой выбор.
Ответ. _
Решение
Для решения этой задачи воспользуемся законом Авогадро: равные объёмы любых газов при одинаковых условиях содержат равное число молекул.
Так как молярная масса воды равняется 18 г/моль, а сухого воздуха − 29 г/моль, то влажный воздух будет легче.
Ответ. 1 Степень окисления. Часть 1
-
Степень окисления. Часть 1. Номер №1
Степень окисления (с. о.) − это условный _ _ _ _ _ атомов химического элемента в _ _ _ _ _ _ _ веществе, вычисленный на основе предположения, что оно состоит из простых _ _ _ _ _.
Следует знать!
1) В соединениях с.о. водорода = _ _ , кроме гидридов ($NaH^{-1}$, $CaH_{2}^{-1}$).
2) В соединениях с.о. кислорода = _ _ , кроме пероксидов ($Na_{2}O_{2}^{-1}$, $H_{2}O_{2}^{-1}$) и фторидов ($O^{+2}F_{2}$, $O^{+1}F_{2}$).
3) Степень окисления металлов всегда положительна. Для металлов главных подгрупп первых трех групп с.о. постоянна:
металлы IA группы − с.о. = _ _,
металлы IIA группы с.о. = _ _,
металлы IIIA группы с.о. = _ _.
4) У свободных атомов и простых веществ с.о. = _.
5) Суммарная с.о. всех элементов в соединении = _.
Решение
Степень окисления (с. о.) − это условный заряд атомов химического элемента в сложном веществе, вычисленный на основе предположения, что оно состоит из простых ионов.
Следует знать!
1) В соединениях с.о. водорода = +1, кроме гидридов ($NaH^{-1}$, $CaH_{2}^{-1}$).
2) В соединениях с.о. кислорода = −2, кроме пероксидов ($Na_{2}O_{2}^{-1}$, $H_{2}O_{2}^{-1}$) и фторидов ($O^{+2}F_{2}$, $O^{+1}F_{2}$).
3) Степень оксиления металлов всегда положительна. Для металлов главных подгрупп первых трех групп с.о. постоянна:
металлы IA группы − с.о. = +1,
металлы IIA группы с.о. = +2,
металлы IIIA группы с.о. = +3.
4) У свободных атомов и простых веществ с.о. = 0.
5) Суммарная с.о. всех элементов в соединении = 0.
Номер №2
Способ образования названий двухэлементных (бинарных) соединений.
Решение
Способ образования названий двухэлементных (бинарных) соединений.
Номер №3
Алгоритм составления формулы бинарного соединения (на примере оксида алюминия)
1) Запишите символы химических элементов, образующих соединения (слева запишите символ элемента с меньшей электроотрицателностью, а справа − с большей). _
2) Проставьте степени окисления атомов записанных химических элементов (дополните запись в пункте 1). _
3) Найдите наименьшее общее кратное (НОК) между значениями степеней окисления элементов (устно). _
4) Определите индексы, разделив НОК на значение степени окисления каждого химического элемента (дополните запись в пункте 1). _
Решение
Алгоритм составления формулы бинарного соединения (на примере оксида алюминия)
1) Запишите символы химических элементов, образующих соединения (слева запишите символ элемента с меньшей электроотрицателностью, а справа − с большей). $Al_{2}^{+3}O_{3}^{-2}$
2) Проставьте степени окисления атомов записанных химических элементов (дополните запись в пункте 1). $Al_{2}^{+3}O_{3}^{-2}$
3) Найдите наименьшее общее кратное (НОК) между значениями степеней окисления элементов (устно). Наименьшее общее кратное − 6.
4) Определите индексы, разделив НОК на значение степени окисления каждого химического элемента (дополните запись в пункте 1). $Al_{2}^{+3}O_{3}^{-2}$
Номер №4
Дополните таблицу "Названия и формулы бинарных соединений".Название вещества Хлорид железа (III) Оксид хлора (VII) Нитрид кальция Формула вещества $N_{2}O_{5}$ $PCl_{5}$ Решение
Названия и формулы бинарных соединенийНазвание вещества Хлорид железа (III) Оксид азота (V) Оксид хлора (VII) Хлорид фосфора (V) Нитрид кальция Формула вещества $FeCl_{3}$ $N_{2}O_{5}$ $Cl_{2}O_{7}$ $PCl_{5}$ $Ca_{3}N_{2}$ Номер №5
Определите степень окисления выделенного шрифтом элемента сложного соединения.Название соединения Формула соединения с.о. центрального элемента Фосфорная кислота $H_{3}$P$O_{4}$ Сульфат калия $K_{2}$S$O_{4}$ Карбонат натрия $Na_{2}$C$O_{3}$ Нитрат алюминия Al(N$O_{3})_{3}$ Решение
Название соединения Формула соединения с.о. центрального элемента Фосфорная кислота $H_{3}$P$O_{4}$ +5 Сульфат калия $K_{2}$S$O_{4}$ +6 Карбонат натрия $Na_{2}$C$O_{3}$ +4 Нитрат алюминия Al(N$O_{3})_{3}$ +5 Часть 2
-
Часть 2. Номер №1
Определите степени окисления химических элементов в соединениях по их формулам. Запишите названия этих веществ.
1) $SF_{6}$
2) $Na_{3}N$
3) $CuCl_{2}$
4) $PCl_{5}$
5) $N_{2}O_{3}$
6) LiBr
7) $MnO_{2}$
8) $H_{2}S$
9) $CaC_{2}$
10) MgO
Решение
1) $S^{+6}F^{-1}_{6}$ − фторид серы
2) $Na^{+1}_{3}N^{-3}$ − нитрид натрия
3) $Cu^{+2}Cl^{-1}_{2}$ − хлорид меди (II)
4) $P^{+5}Cl^{-1}_{5}$ − хлорид фосфора (V)
5) $N^{+3}_{2}O^{-2}_{3}$ − оксид азота (III)
6) $Li^{+1}Br^{-1}$ − бромид лития
7) $Mn^{+4}O^{-2}_{2}$ − оксид марганца (IV)
8) $H^{+1}_{2}S^{-2}$ − сероводород
9) $Ca^{+2}C^{-1}_{2}$ − карбид кальция
10) $Mg^{+2}O^{-2}$ − оксид магния
Номер №2
Разделите вещества $FeO, Fe_{2}O_{3}, CaCl_{2}, AlBr_{3}, CuO, K_{2}O, BaCl_{2}, SO_{3}$ на две группы. Запишите названия веществ, указав степени окисления.Образованы химическим элементом с постоянной с.о. Образованы химическим элементом с переменной с.о. Решение
Образованы химическим элементом с постоянной с.о. Образованы химическим элементом с переменной с.о.Образованы химическим элементом с постоянной с.о. Образованы химическим элементом с переменной с.о. $Ca^{+2}Cl^{-1}{2}$ − хлорид кальция $Fe^{+2}O^{-2}$ − оксид железа (II) $Al^{+3}Br^{-1}_{3}$ − бромид алюминия $Fe^{+3}_{2}O^{-2}_{3}$ − оксид железа (III $K^{+1}_{2}O^{-2}$ − оксид калия $Cu^{+2}O^{-2}$ − оксид меди (II) $Ba^{+2}Cl^{-1}_{2}$ − хлорид бария $S^{+6}O^{-2}_{3}$ − оксид серы (VI) Номер №3
Установите соответствие между названием и степенью окисления атома химического элемента и формулой соединения.
НАЗВАНИЕ И С.О. ЭЛЕМЕНТА
А) железо (+3)
Б) сера (+4)
В) хлор (−1)
Г) марганец (+7)
Д) углерод (+2)
↑↓
ФОРМУЛА СОЕДИНЕНИЯ
1) $SO_{2}$
2) $AlCl_{3}$
3) $FeCl_{3}$
4) $Mn_{2}O_{7}$
5) CO
6) $CO_{2}$
7) $Fe_{2}O_{3}$
8) $SO_{3}$
9) $H_{2}S$
10) $CaC_{2}$
Ответ.А Б В Г Д
Решение
Ответ.А Б В Г Д 3,7 1 2,3 4 5
Номер №4
Составьте формулы веществ по названию.
1) фосфид кальция
2) карбид кремния (IV)
3) хлорид кремния (IV)
4) сульфид цинка
5) оксид фосфора (V)
6) оксид хрома (III)
7) оксид натрия
8) оксид железа (III)
Решение
1) фосфид кальция − $Ca_{3}P_{2}$
2) карбид кремния (IV) − SiC
3) хлорид кремния (IV) − $SiCl_{4}$
4) сульфид цинка − ZnS
5) оксид фосфора (V) − $P_{2}O_{5}$
6) оксид хрома (III) − $Cr_{2}O_{3}$
7) оксид натрия − $Na_{2}O$
8) оксид железа (III) − $Fe_{2}O_{3}$
Номер №5
Сколько молекул содержится в 48 г оксида серы (IV)?
Решение
Дано:
m ($SO_{2}$) = 48 г
Найти:
N ($SO_{2}$) − ?
Решение:
N ($SO_{2}$) = n * $N_{a}$ = m : M * $N_{a}$
M ($SO_{2}$) = 32 + 16 * 2 = 64 г/моль
N ($SO_{2}$) = 48 г : 64 г/моль * $6 * 10^{23}$ молекул/моль = $4,5 * 10^{23}$ молекул
Ответ: N ($SO_{2}$) = $4,5 * 10^{23}$ молекул
Номер №6
С помощью Интернета и других источников информации ( _ ) подготовьте сообщение о применении какого−либо бинарного соединения по следующему плану:
1) формула;
2) название;
3) свойства;
4) применение.
Решение
Каустическая сода − NaOH
По−другому это соединение называют гидроксид натрия. Оно принадежит классу гидроксидов. Вступает в химические реакции с кислотами, но при условии, что выпадает осадок или образуется газ. А также взаимодействует с кислотными оксидами, образую соль и воду, и солями, тоже при условии, что выпадает осадок или газ.
В быту основное назначение гидроксида натрия − борьба с жировыми и органическими загрязнениями. Его применяют для чистки канализации, обезжиривания поверхностей, в изготовлении мыла ручным способом, отбеливании и стирке белья, борьбе с садовыми вредителями, для санитарной обработки помещений.
Номер №7
Степень окисления марганца соединении $K_{2}MnO_{4}$ равна:
1) +4
2) +7
3) +6
4) +2
Ответ. _
Решение
$K_{2}Mn^{+6}O_{4}$
Ответ. 3
Номер №8
Наименьшую степень окисления хром имеет в соединении, формула которого:
1) $Cr_{2}O_{3}$
2) $CrO_{3}$
3) $K_{2}CrO_{4}$
4) $K_{2}Cr_{2}O_{7}$
Ответ: _
Решение
1) $Cr^{+3}_{2}O_{3}$
2) $Cr^{+6}O_{3}$
3) $K_{2}Cr^{+6}O_{4}$
4) $K_{2}Cr^{+6}_{2}O_{7}$
Ответ: 1
Номер №9
Максимальную степень окисления хлор проявляет в соединении, формула которого:
1) NaCl
2) $KClO_{3}$
3) $Cl_{2}O_{7}$
4) KClO
Ответ: _
Решение
1) $NaCl^{-1}$
2) $KCl^{+5}O_{3}$
3) $Cl^{+7}_{2}O_{7}$
4) $KCl^{+1}O$
Ответ: 3 Оксиды и летучие водородные соединения. Часть 1
-
Оксиды и летучие водородные соединения. Часть 1. Номер №1
Признаки оксидов:
− _ _ _ _ _ _ вещества;
− состоят из _ _ _ _ элементов;
− один из элементов − _ _ _ _ _ _ _ _, с.о. _ _.
Решение
Признаки оксидов:
− сложные вещества;
− состоят из двух элементов;
− один из элементов − кислород, с.о. −2.
Номер №2
Способ образования названий оксидов.
Решение
Способ образования названий оксидов.
Номер №3
Заполните таблицу "Оксиды".Название оксида Формула Оксид меди (I) CuO Оксид фосфора (V) $N_{2}O_{3}$ Оксид углерода (IV) $SO_{3}$ Оксид алюминия $Fe_{2}O_{3}$ Оксид натрия $PbO_{2}$
Решение
ОксидыНазвание оксида Формула Оксид меди (I) $Cu_{2}O$ Оксид меди (II) CuO Оксид фосфора (V) $P_{2}O_{5}$ Оксид азота (III) $N_{2}O_{3}$ Оксид углерода (IV) $CO_{2}$ Оксид серы (VI) $SO_{3}$ Оксид алюминия $Al_{2}O_{3}$ Оксид железа (III) $Fe_{2}O_{3}$ Оксид натрия $Na_{2}O$ Оксид свинца (IV) $PbO_{2}$ Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы высших оксидов элементов IV−VIA групп.$Na_{2}O$ FeO $N_{2}O_{5}$ ZnO $SO_{2}$ $SO_{3}$ $Al_{2}O_{3}$ $P_{2}O_{5}$ $CO_{2}$ Распределите все приведенные в таблице оксиды на две группы. Запишите их названия.
Оксиды металлов Оксиды неметалловРешение
$Na_{2}O$ FeO $N_{2}O_{5}$ ZnO $SO_{2}$ $SO_{3}$ $Al_{2}O_{3}$ $P_{2}O_{5}$ $CO_{2}$ $N_{2}O_{5}$, $SO_{3}$, $CO_{2}$ − выигрышный путь.
Оксиды металлов Оксиды неметаллов $Na_{2}O$ − оксид натрия $N_{2}O_{5}$ − оксид азота (V) FeO − оксид железа (II) $SO_{2}$ − оксид серы (IV) ZnO − оксид цинка $SO_{3}$ − оксид серы (VI) $Al_{2}O_{3}$ − оксид алюминия $P_{2}O_{5}$ − оксид фосфора (V) $CO_{2}$ − оксид углерода (IV)
Номер №2
Впишите в соответствующие столбцы формулы следующих соединений: $P_{2}O_{3}, BaH_{2}, NO, SiH_{4}, H_{2}S, H_{2}O_{2}, KH, Cr_{2}O_{3}, HBr, AlH_{3}, OF_{2}$.
Укажите их названия.
Оксиды Гидриды Летучие водородные соединения
РешениеОксиды Гидриды Летучие водородные соединения $P_{2}O_{3}$ − оксид фосфора (III) $BaH_{2}$ − гидрид бария $SiH_{4}$ − силан NO − оксид азота (II) KH − гидрид калия $H_{2}S$ − сероводород $Cr_{2}O_{3}$ − оксид хрома (III) $AlH_{3}$ − гидрид алюминия HBr − бромоводород
Номер №3
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы гидридов.KH $H_{2}O$ CO $BaH_{2}$ CuO NaOH $CaH_{2}$ $NH_{3}$ $Li_{2}O$ Решение
KH $H_{2}O$ CO $BaH_{2}$ CuO NaOH $CaH_{2}$ $NH_{3}$ $Li_{2}O$ Гидриды: $KH, BaH_{2}, CaH_{2}$.
Номер №4
Напишите формулы оксидов и летучих водородных соединений следующих химических элементов:
1) углерода (IV)
2) азота (III)
3) серы (VI)
Решение
1) $CO_{2}, CH_{4}$
2) $N_{2}O_{3}, NH_{3}$
3) $SO_{3}, H_{2}S$
Номер №5
Дополните таблицу.Название оксида Формула Нахождение в природе Оксид водорода $CO_{2}$ $Al_{2}O_{3}, SiO_{2}$ Решение
Название оксида Формула Нахождение в природе Оксид водорода $H_{2}O$ Гидросфера Оксид углерода (IV) $CO_{2}$ Атмосфера Оксид алюминия и оксид кремния $Al_{2}O_{3}, SiO_{2}$ Глина
Номер №6
Назовите оксиды азота и рассчитайте массовую долю азота в них.
1) $Na_{2}O$ _ ω(N) = _
2) NO _ ω(N) = _
3) $N_{2}O_{3}$ _ ω(N) = _
4) $NO_{2}$ _ ω(N) = _
5) $N_{2}O_{5}$ _ ω(N) = _
Сделайте вывод: с увеличением с.о. азота в оксиде массовая доля данного химического элемента _ _ _ _ _ _ _ _ _ _ _ . Постройте схематический график данной зависимости.
Решение
1) $Na_{2}O$ − оксид натрия
ω(N) = 64%
2) NO − оксид азота (II)
ω(N) = 47%
3) $N_{2}O_{3}$ − оксид азота (III)
ω(N) = 37%
4) $NO_{2}$ − оксид азота (IV)
ω(N) = 30%
5) $N_{2}O_{5}$ − оксид азота (V)
ω(N) = 26%
Сделайте вывод: с увеличением с.о. азота в оксиде массовая доля данного химического элемента уменьшается.
Номер №7
Сколько $м^{3}$ содержится в 45,75 кг оксида хлора (VII)?
Решение
Дано:
m ($Cl_{2}O_{7}$) = 45,75 кг
Найти:
V ($Cl_{2}O_{7}$) − ?
Решение:
V ($Cl_{2}O_{7}$) = n * $V_{m}$ = m : M * $V_{m}$
M ($Cl_{2}O_{7}$) = 35,5 * 2 + 16 * 7 = 183 г/моль
V ($Cl_{2}O_{7}$) = 45,75 кг : 183 г/моль * 22,4 л/моль = 5,6 $м^{3}$
Ответ: V ($Cl_{2}O_{7}$) = 5,6 $м^{3}$
Номер №8
Найдите количество вещества атомов кислорода и атомов фосфора, которое содержится в оксиде фосфора (III) массой 220 г.
Решение:
1) n ( _ ) = _
2) Анализформулы оксида фосфора (III) показывает, что n (P) = 2 * n ( _ ), а n (O) = 3 * n ( _ )
3) N (P) = _
4) N (O) = _
Ответ: _
Решение
Дано:
m ($P_{2}O_{3}$) = 220 г
Найти:
n (O) − ?
n (P) − ?
Решение:
1) n ($P_{2}O_{3}$) = m : M
M ($P_{2}O_{3}$) = 31 * 2 + 16 * 3 = 110 г/моль
n ($P_{2}O_{3}$) = 220 г : 110 г/моль = 2 моль
2) Анализформулы оксида фосфора (III) показывает, что n (P) = 2 * n ($P_{2}O_{3}$), а n (O) = 3 * n ($P_{2}O_{3}$)
3) N (P) = n (P) * Na = 2 * 2 моль * $6 * 10^{23}$ молекул/моль = $24 * 10^{23}$ молекул
N (O) = n (O) * Na = 3 * 2 моль * $6 * 10^{23}$ молекул/моль = $36 * 10^{23}$ молекул
Ответ: N (P) = $24 * 10^{23}$ молекул; N (O) = $36 * 10^{23}$ молекул Основания. Часть 1
-
Основания. Часть 1. Номер №1
Признаки оснований:
− _ _ _ _ _ _ _ вещества;
− состоят из простых ионов _ _ _ _ _ _ _ _ (кроме $NH_{4}^{+}$) и сложных _ _ _ _ _ _ _ _ _ − ионов $OH^{-}$;
− общая формула оснований: $M^{n+}(OH)_{n}$, где n − заряд иона, равный с.о. металла.
Решение
Признаки оснований:
− сложные вещества;
− состоят из простых ионов металлов (кроме $NH_{4}^{+}$) и сложных гидроксид − ионов $OH^{-}$;
− общая формула оснований: $M^{n+}(OH)_{n}$, где n − заряд иона, равный с.о. металла.
Номер №2
Способ образования названий оснований.
Решение
Способ образования названий оснований.
Номер №3
с.о. металла +n ← Не путать! → заряд иона $n^{+}$
с.о. атомов в гидроксид−ионе ($O^{-2}H^{+})^{-}$ ← Не путать! → заряд гидроксид иона $OH^{-}$
Решение
с.о. металла +n ← Не путать! → заряд иона $n^{+}$
с.о. атомов в гидроксид−ионе ($O^{-2}H^{+})^{-}$ ← Не путать! → заряд гидроксид иона $OH^{-}$
Номер №4
Каждому основанию соответствует свой оксид металла. Дополните таблицу "Основания и соответствующие им оксиды".Формула основания и его значение Формула оксида и его название $Fe(OH)_{2}$ − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ ) _ − _ _ _ _ _ _ _ _ _ _ _ ( _ _ ) _ − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ _ ) $Fe_{2}O_{3}$ − _ _ _ _ _ _ _ _ _ _ _ ( _ _ _ ) CuOH − _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ ) _ − _ _ _ _ _ _ _ _ _ ( _ ) _ − _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ ) CuO − _ _ _ _ _ _ _ _ _ ( _ _ ) $Ca(OH)_{2}$ − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ − _ _ _ _ _ _ _ _ _ _ _ _ _ − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ $Na_{2}O$ − _ _ _ _ _ _ _ _ _ _ _ Решение
Основания и соответствующие им оксиды
Формула основания и его значение Формула оксида и его название $Fe(OH)_{2}$ − гидроксид железа (II) FeO − оксид железа (II) $Fe(OH)_{3}$ − гидроксид железа (III) $Fe_{2}O_{3}$ − оксид железа (III) CuOH − гидроксид меди (I) $Cu_{2}O$ − оксид меди (I) $Cu(OH)_{2}$ − гидроксид меди (II) CuO − оксид меди (II) $Ca(OH)_{2}$ − гидроксид кальция CaO − оксид кальция NaOH − гидроксид натрия $Na_{2}O$ − оксид натрия
Номер №5
Щелочи изменяют окраску _ _ _ _ _ _ _ _ _ _ _. Дополните таблицу "Изменение окраски индикатора в щелочной среде".Индикатор Окраска в нейтральной среде Окраска в щелочной среде Малиновая Метилоранж Фиолетовая Решение
Щелочи изменяют окраску индикаторов.
Изменение окраски индикатора в щелочной средеИндикатор Окраска в нейтральной среде Окраска в щелочной среде Фенолфталеин Бесцветная Малиновая Метилоранж Оранжевая Желтая Лакмус Фиолетовая Синяя Номер №6
Решение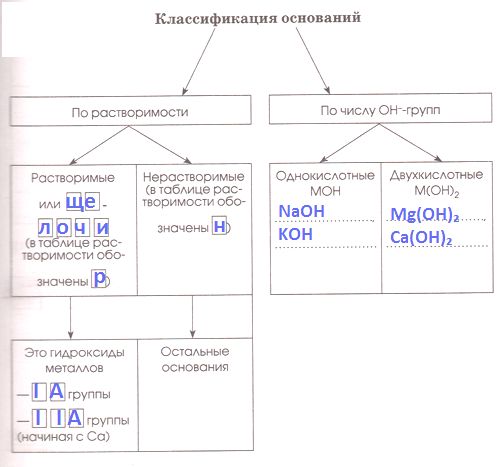
Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы щелочей.NaOH $Cr(OH)_{2}$ LiOH $Mn(OH)_{2}$ $Ba(OH)_{2}$ $Fe(OH)_{2}$ $Fe(OH)_{3}$ $Mg(OH)_{2}$ RbOH Впишите в соответствующие столбцы формулы и названия всех приведенных выше оснований.
Растворимые Нерастворимые Распределите все приведенные выше основания по другому признаку.
Однокислотные Двухкислотные Трехкислотные Решение
Щелочи − NaOH, LiOH, $Ba(OH)_{2}$, RbOH:NaOH $Cr(OH)_{2}$ LiOH $Mn(OH)_{2}$ $Ba(OH)_{2}$ $Fe(OH)_{2}$ $Fe(OH)_{3}$ $Mg(OH)_{2}$ RbOH Выигрышного пути нет!
Растворимые Нерастворимые NaOH $Cr(OH)_{2}$ LiOH $Mn(OH)_{2}$ $Ba(OH)_{2}$ $Fe(OH)_{2}$ RbOH $Fe(OH)_{3}$ $Mg(OH)_{2}$ Однокислотные Двухкислотные Трехкислотные NaOH $Cr(OH)_{2}$ $Fe(OH)_{3}$ LiOH $Mn(OH)_{2}$ $Ba(OH)_{2}$ $Fe(OH)_{2}$ $Mg(OH)_{2}$
Номер №2
Составьте формулы оснований и соответствующих им оксидов металлов для следующих ионов:
1) $Ag^{+}$ _ → _
2) $Pb^{2+}$ _ → _
3) $Fe^{3+}$ _ → _
Решение
1) AgOH → $Ag_{2}O$
2) $Pb(OH)_{2}$ → PbO
3) $Fe(OH)_{3}$ → $Fe_{2}O_{3}$
Номер №3
В пробирках А и Б находятся известковая вода и раствор гидроксида натрия. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
Ответ. _
Решение
Сначала пропустим углекислый газ в две пробирке. В пробирке Б (с известковой водой) выпадет осадок. Затем в пробирку А добавим несколько капель фенолфталеина − раствор приобретет малиновую окраску.
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
$NaOH = Na^{+} + OH^{-}$
Ответ. А − известковая вода; Б − гидроксид натрия.
Номер №4
Определите заряды ионов металлов и степени окисления элементов в основаниях.СОЕДИНЕНИЕ ЗАРЯД ИОНА МЕТАЛЛА С.О. ЭЛЕМЕНТОВ $Ba(OH)_{2}$ $Al(OH)_{3}$ KOH Решение
СОЕДИНЕНИЕ ЗАРЯД ИОНА МЕТАЛЛА С.О. ЭЛЕМЕНТОВ $Ba(OH)_{2}$ 2+ 2+ $Al(OH)_{3}$ 3+ 3+ KOH 1+ 1+ Номер №5
Запишите в таблицу "Области применения некоторых оснований" формулы веществ.Область применения Известковая вода _ Едкое кали _ Едкий натр _ Гашеная известь _ Нашатырный спирт _ Строительство ВА ЛЕ ИН БА ДИ Для распознавания $CO_{2}$ РИ ГЕ МЫ ТЫ ОН Медицина ЛЕЙ УЯ КЕ ТА ТО Производство мыла РА ВАЯ КА НА РЫ Получение тугоплавкого стекла АР ША МУ МА БА
Установите соответствие между веществом и областями его применения. Из слогов, соответствующих правильным ответам, вы составите название насыщенного водного раствора гидроксида бария (II): _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Области применения некоторых основанийОбласть применения Известковая вода _ Едкое кали _ Едкий натр _ Гашеная известь _ Нашатырный спирт _ Строительство ВА ЛЕ ИН БА ДИ Для распознавания $CO_{2}$ РИ ГЕ МЫ ТЫ ОН Медицина ЛЕЙ УЯ КЕ ТА ТО Производство мыла РА ВАЯ КА НА РЫ Получение тугоплавкого стекла АР ША МУ МА БА Название насыщенного водного раствора гидроксида бария (II): баритовая каша.
Номер №6
Вычислите количество вещества, которое составляют 196 г гидроксида калия. Сколько ионов каждого вида будет содержать эта порция щелочи?
Решение:
1) n ( _ ) = _
2) Анализ формулы гидроксида калия показывает, что n ($K^{+}$) = n ( _ ), а n ($OH^{-}$) = n ( _ )
3) N ($K^{+}$) = _
4) N ($OH^{-}$) = _
Ответ: _
Решение
Дано:
m (KOH) = 196 г
Найти:
m (KOH) − ?
N ($K^{+}$) − ?
N ($OH^{-}$) − ?
Решение:
1) n (KOH) = m : M
M (KOH) = 39 + 16 + 1 = 56 г/моль
n (KOH) = 196 г : 56 г/моль = 3,5 моль
2) Анализ формулы гидроксида калия показывает, что n ($K^{+}$) = n (KOH), а n ($OH^{-}$) = n (KOH)
3) N ($K^{+}$) = n ($K^{+}$) * $N_{a}$
N ($K^{+}$) = 3,5 моль* $6 * 10^{23}$ ионов/моль = $2,1 * 10^{24}$ ионов
4) N ($OH^{-}$) = n ($OH^{-}$) * $N_{a}$
N ($OH^{-}$) = 3,5 моль* $6 * 10^{23}$ ионов/моль = $2,1 * 10^{24}$ ионов
Ответ: N ($K^{+}$) = $2,1 * 10^{24}$ ионов; N ($OH^{-}$) = $2,1 * 10^{24}$ ионов
Номер №7
Рассчитайте массу 2,5 кмоль гидроксида бария. Сколько ионов каждого вида будет содержать эта порция щелочи?
Решение
Дано:
n ($Ba(OH)_{2}$) = 2,5 кмоль
Найти:
m ($Ba(OH)_{2}$) − ?
N ($Ba^{2+}$) − ?
N ($OH^{-}$) − ?
Решение:
1) m ($Ba(OH)_{2}$) = n * M
M ($Ba(OH)_{2}$) = 137 + 16 * 2 + 1 * 2 = 171 г/моль
m ($Ba(OH)_{2}$) = 2,5 кмоль * 171 г/моль = 427,5 кг
2) Анализ формулы гидроксида калия показывает, что n ($Ba^{2+}$) = n ($Ba(OH)_{2}$), а n ($OH^{-}$) = 2 * n ($Ba(OH)_{2}$)
3) N ($Ba^{2+}$) = n ($Ba^{2+}$) * $N_{a}$
N ($Ba^{2+}$) = 2,5 кмоль* $6 * 10^{23}$ ионов/моль = $1,5 * 10^{24}$ ионов
4) N ($OH^{-}$) = 2 * n ($OH^{-}$) * $N_{a}$
N ($OH^{-}$) = 2 * 2,5 кмоль* $6 * 10^{23}$ ионов/моль = $3 * 10^{24}$ ионов
Ответ: N ($Ba^{2+}$) = $1,5 * 10^{24}$ ионов; N ($OH^{-}$) = $3 * 10^{24}$ ионов Кислоты. Часть 1
-
Кислоты. Часть 1. Номер №1
Признаки кислот:
− _ _ _ _ _ _ _ вещества;
− состоят из атомов _ _ _ _ _ _ _ _ и _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ;
− в растворе образуют простые ионы _ _ и сложные или простые ионы _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ − Acd.
Общая формула кислот: $H_{n}Acd^{n-}$, где n − заряд кислотного остатка.
Решение
Признаки кислот:
− сложные вещества;
− состоят из атомов водорода и кислотного остатка;
− в растворе образуют простые ионы $H^{+}$ и сложные или простые ионы кислотного остатка − Acd.
Общая формула кислот: $H_{n}Acd^{n-}$, где n − заряд кислотного остатка.
Номер №2
Классификация кислот.
Решение
Классификация кислот

Номер №3
Способ образования названий кислот.
1) Бескислородных.
HCl − _
$H_{2}S$ − _
2) Кислородсодержащие.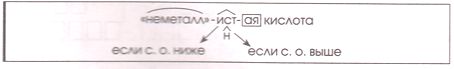
$HNO_{2}$ − _
$HNO_{3}$ − _
Решение
Способ образования названий кислот.
1) Бескислородных.
HCl − хлороводородная кислота
$H_{2}S$ − сероводородная кислота
2) Кислородсодержащие.
$HNO_{2}$ − азотистая кислота
$HNO_{3}$ − азотная кислота
Номер №4
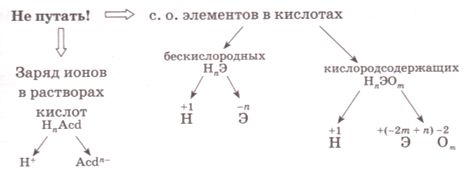
Решение
Номер №5
Каждой кислоте соответствует свой оксид. Дополните таблицу "Кислоты и соответствующие им оксиды".Формула кислоты и ее название Формула оксида и его название $H_{2}SO_{4}$ − _ _ _ _ _ _ _ _ _; _ _ − с.о. центрального элемента
_ − _ _ _ _ _ _ _ _ _ _ _ _ _
$H_{3}PO_{4}$ − _ _ _ _ _ _ _ _ _ _; _ _
_ − _ _ _ _ _ _ _ _; _ __ − _ _ _ _ _ _ _ _ _ ( _ _ )
$SO_{2}$ − _ _ _ _ _ _ _ _ _ ( _ _ )
− с.о. центрального элемента _ − _ _ _ _ _ _ _ _ _ _ _ _ ( _ )
− с.о. центрального элемента $CO_{2}$ − _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ )Решение
Кислоты и соответствующие им оксидыФормула кислоты и ее название Формула оксида и его название $H_{2}SO_{4}$ − серная кислота; +6 − с.о. центрального элемента $SO_{3}$ − оксид серы (VI) $H_{2}SO_{3}$− сернистая кислота; +4 − с.о. центрального элемента $SO_{2}$ − оксид серы (IV) $H_{3}PO_{4}$ − фосфорная кислота; +5 − с.о. центрального элемента $P_{2}O_{5}$ − оксид фосфора (V) $H_{2}CO_{3}$ − угольная кислота; +4 − с.о. центрального элемента $CO_{2}$ − оксид углерода (IV) Формула кислоты и ее название Формула оксида и его название
Номер №6
Кислоты изменяют окраску индикаторов. Дополните таблицу "Изменение окраски индикатора в кислой среде".Индикатор Окраска в нейтральной среде Окраска в кислой среде Красная Оранжевая Фенолфталеин
Решение
Изменение окраски индикатора в кислой средеИндикатор Окраска в нейтральной среде Окраска в кислой среде Лакмус Фиолетовая Красная Метилоранж Оранжевая Красная Фенолфталеин Бесцветная Бесцветная Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы одноосновных кислот.HCl $H_{2}SiO_{3}$ $H_{2}CO_{3}$ HF $HNO_{3}$ $H_{3}PO_{4}$ $H_{2}SO_{3}$ $H_{2}S$ $HNO_{2}$ Распределите все приведенные выше кислоты по группам. Запишите их названия.
Кислородсодержащие Бескислородные Нестабильные Решение
Одноосновные кислоты − HCl, HF, $HNO_{2}$, $HNO_{3}$HCl $H_{2}SiO_{3}$ $H_{2}CO_{3}$ HF $HNO_{3}$ $H_{3}PO_{4}$ $H_{2}SO_{3}$ $H_{2}S$ $HNO_{2}$ Кислородсодержащие Бескислородные $H_{2}SiO_{3}$ HCl $HNO_{3}$ HF $H_{3}PO_{4}$ $H_{2}S$ $H_{2}CO_{3}$ Нестабильные $H_{2}SO_{3}$ $H_{2}SO_{3}$ $HNO_{2}$ $HNO_{2}$ $H_{2}CO_{3}$
Номер №2
Дайте характеристику фосфорной кислоты _ по всем признакам классификации.
1) _
2) _
3) _
4) _
Решение
$H_{3}PO_{4}$ − фосфорная кислота
1) трехосновная
2) кислородсодержащая
3) растворимая
4) стабильная
Номер №3
Напишите формулы кислот и соответствующих им оксидов, образованных неметаллами в следующих степенях окисления:
1) $S^{+6}$ _ → _
2) $S^{+2}$ _ → _
3) $N^{+5}$ _ → _
Решение
1) $H_{2}SO_{4} → SO_{3}$
2) сера не имеет степени окисления равной +2
3) $HNO_{3} → N_{2}O_{5}$
Номер №4
Определите заряды ионов, степени окисления элементов в кислотах.СОЕДИНЕНИЕ ЗАРЯДЫ ИОНОВ С.О. ЭЛЕМЕНТОВ $HNO_{3}$ $H_{2}SO_{4}$ $H_{3}PO_{4}$ Решение
СОЕДИНЕНИЕ ЗАРЯДЫ ИОНОВ С.О. ЭЛЕМЕНТОВ $HNO_{3}$ $H^{+}, NO_{3}^{-}$ $H^{+1}N^{+5}O^{-2}_{3}$ $H_{2}SO_{4}$ $H^{+}, SO_{4}^{2-}$ $H^{+1}_{2}S^{+6}O^{-2}_{4}$ $H_{3}PO_{4}$ $H^{+}, PO_{4}^{3-}$ $H^{+1}_{3}P^{+5}O^{-2}_{4}$ Номер №5
Установите соответствие между опасной ситуацией и необходимыми действиями по оказанию первой помощи во избежание химического ожога.
ПРИ ПОПАДАНИИ НА КОЖУ РАСТВОРА
А) кислоты
Б) щелочи
↑↓
НЕОБХОДИМО
1) смыть химические растворы большим количеством воды
2) промыть место ожога слабым раствором питьевой соды
3) промыть место ожога раствором борной кислоты или слабым раствором уксусной кислоты
Ответ.А Б
Решение
Ответ.А Б 1, 2 1, 3 Номер №6
В пробирках А и Б находятся растворы гидроксида калия и соляной кислоты. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
Ответ. _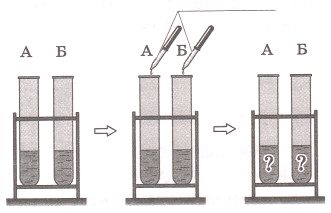
Решение
Ответ: чтобы определить содержимое каждой пробирки надо использовать индикатор − лакмус. Тогда раствор щелочи приобретет синий цвет, а кислоты − красный.
$KOH = K^{+} + OH^{-}$
$H_{2}SO_{4} = 2H^{+} + SO_{4}^{2-}$
Номер №7
Установите соответствие между свойством или применением кислоты и ее формулой. Из букв, соответствующих правильным ответам, вы составите название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины: _ _ _ _ _ _ _ _.Свойства кислот и особенности применения HCl $H_{2}SiO_{3}$ $H_{2}CO_{3}$ $H_{2}SO_{3}$ $H_{2}SO_{4}$ HF Нерастворима в воде ХЛ ЛИ СЕ АЗ ПЛ СО В нее нельзя вливать воду ОТ ОР РН ЛЯ МО АВ Концентрированная кислота дымит на воздухе Н Т И Т Р С Нестабильна Л М Н А Т В Растворяет стекло В А П Р Л Я Решение
Название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины: лимонная.Свойства кислот и особенности применения HCl $H_{2}SiO_{3}$ $H_{2}CO_{3}$ $H_{2}SO_{3}$ $H_{2}SO_{4}$ HF Нерастворима в воде ХЛ ЛИ СЕ АЗ ПЛ СО В нее нельзя вливать воду ОТ ОР РН ЛЯ МО АВ Концентрированная кислота дымит на воздухе Н Т И Т Р С Нестабильна Л М Н А Т В Растворяет стекло В А П Р Л Я лимонная
Номер №8
Вычислите количество вещества, которое составляют 392 кг фосфорной кислоты. Сколько атомов водорода будет содержаться в этой порции кислоты?
Решение
Дано:
m ($H_{3}PO_{4}$) = 392 кг
Найти:
n ($H_{3}PO_{4}$) − ?
N ($H^{+}$) − ?
Решение:
n ($H_{3}PO_{4}$) = m : M
M ($H_{3}PO_{4}$) = 1 * 3 + 31 + 16 * 4 = 98 г/моль
n ($H_{3}PO_{4}$) = 392 кг : 98 г/моль = 4 кмоль
N ($H^{+}$) = n ($H^{+}$) * $N_{a}$
n ($H^{+}$) = 3 * n ($H_{3}PO_{4}$) = 3 * 4 кмоль = 12 кмоль
N ($H^{+}$) = 12 кмоль * $6 * 10^{23}$ атомов/моль = $7,2 * 10^{27}$ атомов
Ответ: n ($H_{3}PO_{4}$) = 4 кмоль; N ($H^{+}$) = $7,2 * 10^{27}$ атомов Соли. Часть 1
-
Соли. Часть 1. Номер №1
Признаки солей:
− _ _ _ _ _ _ _ вещества;
− состоят из положительных _ _ _ _ _ _ _ _ _ _ _ _ и отрицательных ионов _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Признаки солей:
− сложные вещества;
− состоят из положительных ионов металлов и отрицательных ионов кислотного остатка.
Номер №2
Способ образования названий солей.
Решение
Способ образования названий солей.
Номер №3
Дополните таблицу "Кислоты".Название и формула кислоты Формула иона кислотного остатка Название соли Примеры $HNO_{3}$ _ _ _ _ _ _ _ $NO_{3}^{-}$ Нитрат $AgNO_{3}$ − _ _ _ _ _ _ _ _ _ _ _ _ _ $HNO_{2}$ _ _ _ _ _ _ _ _ _ $NO_{2}^{-}$ Нитрит _ _ ( _ _ )₂ − нитрит меди (II) $H_{2}SO_{4}$ _ _ _ _ _ _ $SO_{4}^{2-}$ Сульфат $BaSO_{4}$ − _ _ _ _ _ _ _ _ _ _ _ _ $H_{2}SO_{3}$ _ _ _ _ _ _ _ $SO_{3}^{2-}$ Сульфит _ _ _ _ _ _ − сульфит натрия $H_{2}S$ − _ _ _ _ _ _ _ _ _ $S^{2-}$ Сульфид $K_{2}S$ − сульфид калия $H_{2}CO_{3}$ _ _ _ _ _ _ $CO_{3}^{2-}$ Карбонат $Fe_{2}(CO_{3})_{3}$ − _ _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ _ ) $H_{3}PO_{4}$ $PO_{4}^{3-}$ Фосфат _ _ _ _ _ _ − фосфат меди (I) $H_{2}SiO_{3}$ − _ _ _ _ _ _ _ _ _ _ $SiO_{3}^{2-}$ Силикат _ _ _ _ _ _ − силикат калия HCl (_ _ _ _ _ _ _ )_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ $Cl^{-}$ Хлорид $FeCl_{2}$ − _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ ) HBr _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ $Br^{-}$ Бромид $CaBr_{2}$ − _ _ _ _ _ _ _ _ _ _ _ _ _ HF $F^{-}$ Фторид _ _ − фторид калия Решение
КислотыНазвание и формула кислоты Формула иона кислотного остатка Название соли Примеры $HNO_{3}$ азотная $NO_{3}^{-}$ Нитрат $AgNO_{3}$ − нитрат серебра $HNO_{2}$ азотистая $NO_{2}^{-}$ Нитрит $Cu(NO_{2})_{2}$ − нитрит меди (II) $H_{2}SO_{4}$ серная $SO_{4}^{2-}$ Сульфат $BaSO_{4}$ − сульфат натрия $H_{2}SO_{3}$ сернистая $SO_{3}^{2-}$ Сульфит $Na_{2}SO_{4}$ − сульфит натрия $H_{2}S$ − сероводородная $S^{2-}$ Сульфид $K_{2}S$ − сульфид калия $H_{2}CO_{3}$ угольная $CO_{3}^{2-}$ Карбонат $Fe_{2}(CO_{3})_{3}$ − карбонат железа (III) $H_{3}PO_{4}$ фосфорная $PO_{4}^{3-}$ Фосфат $Cu_{3}PO_{4}$ − фосфат меди (I) $H_{2}SiO_{3}$ − кремниевая $SiO_{3}^{2-}$ Силикат $K_{2}SiO_{3}$ − силикат калия HCl (хлорная) хлороводородная $Cl^{-}$ Хлорид $FeCl_{2}$ − хлорид железа (II) HBr бромоводородная $Br^{-}$ Бромид $CaBr_{2}$ − бромид кальция HF фтороводородная $F^{-}$ Фторид $F^{-}$ Фторид KF − фторид калия Номер №4
Решение
Номер №5
Решение
Номер №6
Каждой соли кислородсодержащей кислоты соответствуют основание и кислота, а также оксиды металла и неметалла:
Решение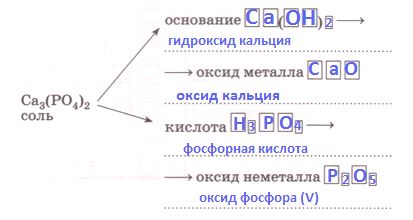
Номер №7
Дополните таблицу "Соли и соответствующие им гидроксиды и оксиды".СОЛЬ $K_{2}SO_{4}$ _ _ _ ( _ _ _ ) _ _ _ _ _ _ _ _ _ ( _ _ _ ) _ НАЗВАНИЕ СОЛИ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ _ ) _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ( _ _ ) СООТВЕТСТВУЮЩЕЕ ОСНОВАНИЕ _ _ _ _ _ $Fe(OH)_{3}$ $Fe(OH)_{2}$ СООТВЕТСТВУЮЩАЯ КИСЛОТА _ _ _ _ _ $H_{2}SO_{4}$ _ _ _ _ _ СООТВЕТСТВУЮЩИЙ ОКСИД МЕТАЛЛА _ _ _ _ _ _ _ _ _ _ Оксид натрия _ _ _ _ _ СООТВЕТСТВУЮЩИЙ ОКСИД НЕМЕТАЛЛА _ _ _ _ _ _ _ _ _ _ Оксид кремния (IV) $N_{2}O_{5}$
Решение
Соли и соответствующие им гидроксиды и оксидыСОЛЬ $K_{2}SO_{4}$ $Fe_{2}(SO_{4})_{3}$ $Na_{2}SiO_{3}$ $Fe(NO_{3})_{2}$ НАЗВАНИЕ СОЛИ Сульфат калия Сульфат железа (III) Силикат натрия Нитрат железа (II) СООТВЕТСТВУЮЩЕЕ ОСНОВАНИЕ KOH $Fe(OH)_{3}$ NaOH $Fe(OH)_{2}$ СООТВЕТСТВУЮЩАЯ КИСЛОТА $H_{2}SO_{4}$ $H_{2}SO_{4}$ $H_{2}SiO_{3}$ $HNO_{3}$ СООТВЕТСТВУЮЩИЙ ОКСИД МЕТАЛЛА $K_{2}O$ $Fe_{2}O_{3}$ Оксид натрия $Na_{2}O$ $FeO$ СООТВЕТСТВУЮЩИЙ ОКСИД НЕМЕТАЛЛА $SO_{3}$ $SO_{3}$ Оксид кремния (IV) $N_{2}O_{5}$ Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют формулы солей.HF $BaSiO_{3}$ $MgCO_{3}$ $CaCl_{2}$ $N_{2}O_{5}$ $H_{3}PO_{4}$ $Na_{2}SO_{3}$ FeS $NH_{4}NO_{2}$ Разделите все приведенные выше соли на растворимые и нерастворимые. Напишите их названия.
Растворимые Нерастворимые Решение
Выигрышный путь − $Na_{2}SO_{3}$, FeS, $NH_{4}NO_{2}$:HF $BaSiO_{3}$ $MgCO_{3}$ $CaCl_{2}$ $N_{2}O_{5}$ $H_{3}PO_{4}$ $Na_{2}SO_{3}$ FeS $NH_{4}NO_{2}$ Растворимые Нерастворимые $CaCl_{2}$ − хлорид кальция
$Na_{2}SO_{3}$ − сульфит натрия
$NH_{4}NO_{2}$ − нитрит аммония$BaSiO_{3}$ − силикат бария
$MgCO_{3}$ − карбонат магния
FeS − сульфид железа (II)Номер №2
Составьте формулы солей по названиям.
1) Фосфаты натрия, кальция, алюминия.
2) Нитраты меди (II), железа (III), серебра.
3) Сульфаты калия, бария, цинка.
Решение
1) $Na_{3}PO_{4}, Ca_{3}(PO_{4})_{2}, AlPO_{4}$
2) $Cu(NO_{3})_{2}, Fe(NO_{3})_{3}, AgNO_{3}$
3) $K_{2}SO_{4}, BaSO_{4}, ZnSO_{4}$
Номер №3
Расставьте заряды ионов в следующих соединениях и степени окисления химических элементов.СОЕДИНЕНИЕ ЗАРЯДЫ ИОНОВ С.О. ЭЛЕМЕНТОВ $Ba(NO_{3})_{2}$ $Al_{2}(SO_{4})_{3}$ $Zn_{3}(PO_{4})_{2}$
РешениеСОЕДИНЕНИЕ ЗАРЯДЫ ИОНОВ С.О. ЭЛЕМЕНТОВ $Ba(NO_{3})_{2}$ $Ba^{2+}, NO_{3}^{-}$ $Ba^{+2}(N^{+5}O^{-2}_{3})_{2}$ $Al_{2}(SO_{4})_{3}$ $Al^{3+}, SO_{4}^{2-}$ $Al^{+3}_{2}(S^{+6}O^{-2}_{4})_{3}$ $Zn_{3}(PO_{4})_{2}$ $Zn^{2+}, PO_{4}^{3-}$ $Zn^{+2}_{3}(P^{+5}O^{-2}_{4})_{2}$ Номер №4
Установите соответствие между формулой соли и ее названием.
ФОРМУЛА СОЛИ
А) $CaSO_{3}$
Б) $AlCl_{3}$
В) MgS
↑↓
НАЗВАНИЕ СОЛИ
1) сульфат марганца (II)
2) сульфид магния
3) хлорид алюминия
4) сульфит кальция
5) сульфат магния
6) сульфит калия
Ответ.А Б В Решение
Ответ.А Б В 4 3 2 Номер №5
Установите соответствие между формулой соли и ее применением или свойством. Из букв, указывающих правильный ответ, вы составите название одного из самых древних связующих материалов на основе сульфата кальция: _ _ _ _ .Применение или свойство NaCl $CaCO_{3}$ $Ca_{3}(PO_{4})_{2}$ NaF Служит основой для производства фосфорных удобрений Р П Г Л Входит в состав лечебных зубных паст Е О А И Образует известняки Р П Л М Используют в медицине 0,9%−й раствор под названием "физиологический раствор" С А Я У
Решение
Название одного из самых древних связующих материалов на основе сульфата кальция: гипс.Применение или свойство NaCl $CaCO_{3}$ $Ca_{3}(PO_{4})_{2}$ NaF Служит основой для производства фосфорных удобрений Р П Г Л Входит в состав лечебных зубных паст Е О А И Образует известняки Р П Л М Используют в медицине 0,9%−й раствор под названием "физиологический раствор" С А Я У
Номер №6
Запишите формулы солей и соответствующих им гидроксидов (кислот и оснований), оксидов и простых веществ.
1) Нитрат кальция _
Основание _ ⟶ оксид _ ⟶ простое вещество _
Кислота _ ⟶ оксид _ ⟶ простое вещество _
2) Фосфат кальция _
Основание _ ⟶ оксид _ ⟶ простое вещество _
Кислота _ ⟶ оксид _ ⟶ простое вещество _
3) Нитрит меди (II) _
Основание _ ⟶ оксид _ ⟶ простое вещество _
Кислота _ ⟶ оксид _ ⟶ простое вещество _
4) Сульфит бария _
Основание _ ⟶ оксид _ ⟶ простое вещество _
Кислота _ ⟶ оксид _ ⟶ простое вещество _
Для каждого варианта составьте формулы бинарных соединений, которые могут быть образованы простыми веществами. Напишите их названия.
1) _
2) _
3) _
4) _
Решение
1) Нитрат кальция $Ca(NO_{3})_ {2}$
Основание $Ca(OH)_ {2}$ ⟶ оксид CaO ⟶ простое вещество Ca
Кислота $HNO_{3}$ ⟶ оксид $N_{2}O_{5}$ ⟶ простое вещество $N_{2}$
2) Фосфат кальция $Ca_{3}(PO_{4})_ {2}$
Основание $Ca(OH)_ {2}$ ⟶ оксид CaO ⟶ простое вещество Ca
Кислота $H_{3}PO_{4}$ ⟶ оксид $P_{2}O_{5}$ ⟶ простое вещество P
3) Нитрит меди (II) $Cu(NO_{2})_ {2}$
Основание $Cu(OH)_ {2}$ ⟶ оксид CuO ⟶ простое вещество Cu
Кислота $HNO_{2}$ ⟶ оксид $N_{2}O_{3}$ ⟶ простое вещество $N_{2}$
4) Сульфит бария $BaSO_{3}$
Основание $Ba(OH)_ {2}$ ⟶ оксид BaO ⟶ простое вещество Ba
Кислота $H_{2}SO_{3}$ ⟶ оксид $SO_{2}$ ⟶ простое вещество S
Для каждого варианта составьте формулы бинарных соединений, которые могут быть образованы простыми веществами. Напишите их названия.
1) $Ca_{3}N_{2}$ − нитрид кальция
2) $Ca_{3}P_{2}$ − фосфид кальция
3) $Cu_{3}N_{2}$ − нитрид меди
4) BaS − сульфид бария
Номер №7
Вычислите количество вещества, которое составляют 222 кг хлорида кальция. Сколько ионов каждого вида будет содержать это количество? Какова массовая доля хлора в соли?
Решение
Дано:
m ($CaCl_{2}$) = 222 кг
Найти:
n ($CaCl_{2}$) − ?
N ($Ca^{2+}$) − ?
N ($Cl^{-}$) − ?
ω (Cl) − ?
Решение:
M ($CaCl_{2}$) = 40 + 35,5 * 2 = 111 г/моль
n ($CaCl_{2}$) = m : M = 222 кг : 111 г/моль = 2000 моль
n ($Ca^{2+}$) = n ($CaCl_{2}$) = 2000 моль
n ($Cl^{-}$) = 2 * n ($CaCl_{2}$) = 2 * 2000 моль = 4000 моль
N ($Ca^{2+}$) = n * $N_{a}$ = 2000 моль * $6 * 10^{23}$ ионов/ моль = $1,2 * 10^{27}$ ионов
N ($Cl^{-}$) = n * $N_{a}$ = 4000 моль * $6 * 10^{23}$ ионов/ моль = $2,4 * 10^{27}$ ионов
ω (Cl) = $\frac{n * A_{r}}{M_{r}}$ * 100%, где n − это индекс
ω (Cl) = $\frac{2 * 35,5}{111}$ * 100% = 64%
Ответ: N ($Ca^{2+}$) = $1,2 * 10^{27}$ ионов; N ($Cl^{-}$) = $2,4 * 10^{27}$ ионов; ω (Cl) = 64%
Номер №8
Придумайте условие задачи по теме "Соли". Запишите решение.
Решение
В 5%−й раствор хлорида натрия массой 200 г добавили 50 г воды. Найдите полученную массовую долю соли.
Дано:
ω = 5%
$m_{р-ра}$ = 200 г
m ($H_{2}O$) = 50 г
Найти:
$ω_{1}$ − ?
Решение:
$ω_{1}$ = $\frac{m}{m_{р-ра} + m(H_{2}O)}$ * 100%
m (NaCl) = $m_{р-ра}$ * ω = 200 г * 0,05 = 10 г
$ω_{1}$ = $\frac{10г}{200 г + 50 г}$ * 100% = 4%
Ответ: $ω_{1}$ = 4% Кристаллические решетки. Часть 1
-
Кристаллические решетки. Часть 1. Номер №1
ПРИМЕРЫ ЗНАЧЕНИЕ ИЛИ ПРИМЕНЕНИЕ ПРИМЕРЫ ЗНАЧЕНИЕ ИЛИ ПРИМЕНЕНИЕ
Решение
ПРИМЕРЫ ЗНАЧЕНИЕ ИЛИ ПРИМЕНЕНИЕ ПРИМЕРЫ ЗНАЧЕНИЕ ИЛИ ПРИМЕНЕНИЕ Парафин Производство свечей Малахит Для резки камней Стекло Производство окон Сахар В пищевой промышленности Номер №2
Заполните таблицу "Виды химических связей и типы кристаллических решеток".ТИП РЕШЕТКИ ВИД ЧАСТИЦ В УЗЛАХ РЕШЕТКИ ХАРАКТЕР СВЯЗИ МЕЖДУ ЧАСТИЦАМИ ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВ ПРИМЕРЫ ВЕЩЕСТВ Ионная Твердые, тугоплавкие, прочные. 
Атомная Твердые или мягкие. _ _ _ _ _ _ _ вещества: алмаз, кремний (кр.), графит, красный фосфор. Молекулярная Очень твердые и тугоплавкие. _ _ _ _ _ _ _ вещества: $SiO_{2}$ (кварц, кремнезём, горный хрусталь), $Al_{2}O_{3}$ (наждак, корунд, рубин, сапфир), т. е. почти все минералы и горные породы. Металлическая Между атомами в молекуле _ _ _ _ _ _ _ _ _ _ _ связь. Между молекулами – слабые силы межмолекулярного взаимодействия. При обычных условиях – газы и жидкости или твёрдые непрочные вещества, способные к сублимации, или _ _ _ _ _ _ _ _ . Твёрдые $O_{2}, CO_{2}, CH_{4}, H_{2}O, NH_{3}, I_{2}, S_{8}$ белый фосфор ($P_{4}$), большинство органических веществ. Решение
Виды химических связей и типы кристаллических решетокТИП РЕШЕТКИ ВИД ЧАСТИЦ В УЗЛАХ РЕШЕТКИ ХАРАКТЕР СВЯЗИ МЕЖДУ ЧАСТИЦАМИ ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВ ПРИМЕРЫ ВЕЩЕСТВ Ионная Ионы Ионная Твердые, тугоплавкие, прочные. 
Атомная Атомы Атомная Твердые или мягкие. Простые вещества: алмаз, кремний (кр.), графит, красный фосфор. Молекулярная Молекулы Между молекулами – слабые силы межмолекулярного взаимодействия. При обычных условиях – газы и жидкости или твёрдые непрочные вещества, способные к сублимации, или возгонка. Очень твердые и тугоплавкие. Сложные вещества: $SiO_{2}$ (кварц, кремнезём, горный хрусталь), $Al_{2}O_{3}$ (наждак, корунд, рубин, сапфир), т. е. почти все минералы и горные породы. Металлическая Атомы и ионы Твёрдые (исключение ртуть), пластичные, тепло− и электропроводные, с металлическим блеском. При обычных условиях – газы и жидкости или твёрдые непрочные вещества, способные к сублимации, или _ _ _ _ _ _ _ _ . Твёрдые $O_{2}, CO_{2}, CH_{4}, H_{2}O, NH_{3}, I_{2}, S_{8}$ белый фосфор ($P_{4}$), большинство органических веществ. Часть 2
-
Часть 2. Номер №1
Поиграйте в "крестики−нолики". Покажите выигрышный путь, который составляют простые вещества с атомной кристаллической решеткой.Li $O_{2}$ Te Sn Si Ca C $F_{2}$ $I_{2}$ Распределите данные простые вещества по соответствующим столбцам.
Атомная кристаллическая решетка Молекулярная кристаллическая решетка Решение
Li $O_{2}$ Te Sn Si Ca C $F_{2}$ $I_{2}$ Атомная кристаллическая решетка Молекулярная кристаллическая решетка Te $O_{2}$ Si $F_{2}$ C $I_{2}$ Номер №2
Запишите формулу вещества, которое является "лишним" в следующем ряду:
оксид кремния (IV), оксид алюминия, алюминий, графит.
Ответ: _
Решение
оксид кремния (IV), оксид алюминия, алюминий, графит
Ответ: Алюминий, так как только это вещество имеет металлическую кристаллическую решетку среди данных.
Номер №3
Верны ли следующие суждения?
А. Мокрое белье высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке).
Б. Мокрое белье высыхает на морозе потому, что молекулы воды имеют низкую $M_{r}$.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ: _
Решение
Ответ: 1
Номер №4
Верны ли следующие суждения?
А. При обычных условиях хлор − газ, бром − жидкость, йод − твердое вещество с металлическим блеском, потому что у них разные кристаллические решетки: у хлора − атомная, у брома − молекулярная, у йода − металлическая.
Б. При обычных условиях хлор − газ, бром − жидкость, йод − твердое вещество с металлическим блеском, потому что у них одинаковое молекулярное строение, но разная плотность.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ: _
Решение
Ответ: 3
Номер №5
Установите соответствие между рисунком кристаллической решетки и названием вещества.
РИСУНОК КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
А)
Б)
В)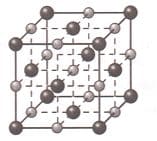
Г)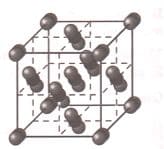
↑↓
НАЗВАНИЕ ВЕЩЕСТВА
1) фторид лития
2) йод
3) литий
4) красный фосфор
Под каждым рисунком укажите формулу соответствующего вещества.
Ответ.А Б В Г Решение
А) − литий
− литий
Б) − красный фосфор
− красный фосфор
В) − фторид лития
− фторид лития
Г) − йод
− йод
Ответ.А Б В Г 3 4 1 2
Номер №6
С помощью Интернета и других источников информации ( _ ) сделайте презентацию о жизни и научных достижениях Ж. Л. Пруста по следующему плану:
1) детство;
2) учеба в юношеские годы;
3) научная деятельность, основные научные достижения.
Решение
Французский химик Жозеф Луи Пруст родился в небольшом городке Анжере в семье аптекаря. Получив химическое образование в Парижском университете, в 1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер. В 1777 г. Пруст получил приглашение на кафедру химии и металлургии.
Одной из важнейших заслуг химика является открытие закона постоянства состава. В Испании Пруст занимался исследованием свойств и состава соединений различных металлов – олова, меди, железа, никеля и др. Он доказал, что при определении состава оксидов металлов многие его современники допускали ошибки, считая гидроксиды оксидами. Пруст показал также, что различные оксиды одного и того же металла имеют вполне определённый состав, который меняется скачкообразно.
Номер №7
К веществам молекулярного строения не относятся:
1) углекислый газ
2) метан
3) фосфорная кислота
4) карбонат кальция
Ответ. _
Решение
Ответ. 4
Номер №8
Молекулярное строение имеет каждое из веществ, формулы которых приведены в ряду:
1) $CO_{2}, HNO_{3}, CaO$
2) $Na_{2}S, Br_{2}, NO_{2}$
3) $H_{2}SO_{4}, Cu, O_{3}$
4) $SO_{2}, I_{2}, HCl$
Ответ. _
Решение
Ответ. 4 Чистые вещества и смеси. Часть 1
-
Чистые вещества и смеси. Часть 1. Номер №1
Чистые вещества представлены одним веществом, имеющим одну химическую формулу.
Смеси состоят из нескольких веществ, каждое из которых имеет свою химическую формулу → если свойства компонентов смеси разные, то их можно _ _ _ _ _ _ _ _ _ на основании этих свойств.
Решение
Чистые вещества представлены одним веществом, имеющим одну химическую формулу.
Смеси состоят из нескольких веществ, каждое из которых имеет свою химическую формулу → если свойства компонентов смеси разные, то их можно разделить на основании этих свойств.
Номер №2
Классификация смесей (примеры).
Решение
Классификация смесей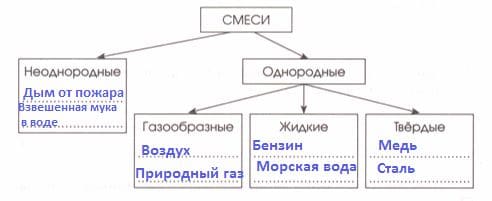
Номер №3
Синонимы:
однородные смеси − _ _ _ _ _ _ _ _ _ _;
неоднородные смеси − _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Синонимы:
однородные смеси − гомогенные;
неоднородные смеси − гетерогенные.
Номер №4
Химический анализ − это _
Решение
Химический анализ − это совокупность действий, которые имеют своей целью получение информации о химическом составе вещества. Часть 2
-
Часть 2. Номер №1
Распределите по двум столбцам следующие вещества:
дистиллированная вода, бронза, алюминий, воздух, гранит, кефир, сера.Чистые вещества Смеси веществ
РешениеЧистые вещества Смеси веществ дистиллированная вода бронза алюминий воздух сера гранит кефир
Номер №2
Напишите, какие минералы входят в состав горной породы − гранита.
Решение
Полевой шпат, кварц и слюда входят в состав горной породы − гранита.
Номер №3
Приведите состав двух используемых на кухне смесей, изучив сведения на их упаковках.
1) _
2) _
Решение
1) уксус: вода, уксусная кислота
2) смесь 5 перцев: черный перец, красный сладкий перец, белый перец, розовый перец, красный острый перец.
Номер №4
Дополните таблицу, записав в нее по два примера смесей.Агрегатное состояние веществ в смесях Примеры смесей Мельхиор, стекло Жидкое − жидкое Минеральная вода, вода в озерах Твердое − газообразное Воздух, природный газ Твердое − жидкое Решение
Агрегатное состояние веществ в смесях Примеры смесей Твердое − твердое Мельхиор, стекло Жидкое − жидкое Уксус, растительное масло Жидкое − жидкое Минеральная вода, вода в озерах Твердое − газообразное Мел, пар Газообразное − газообразное Воздух, природный газ Твердое − жидкое Железо, молоко Номер №5
Дополните таблицу "Смеси и их применение". Для выполнения задания используйте возможности Интернета.Смесь Область использования Чистые вещества, из которых можно приготовить данную смесь Физиологический раствор Заполняют газовые баллоны Дюралюминий Аммиак и вода Пергидроль Медь и олово Решение
Смеси и их применениеСмесь Область использования Чистые вещества, из которых можно приготовить данную смесь Физиологический раствор Медицина Вода, хлорид натрия Пропан и бутан Заполняют газовые баллоны Пропан, бутан Дюралюминий В космонавтике Алюминий, магний, медь, марганец Нашатырный спирт Медицина Аммиак и вода Пергидроль Отбеливание Пероксид водорода, вода Муравьиный спирт Медицина Этанол, муравьиная кислота, вода Бронза Изготовление скульптур и памятников Медь и олово Номер №6
Подготовьте сообщение или презентацию на тему "Использование химического анализа в той или иной области человеческой деятельности" (область применения выберите самостоятельно). Для выполнения задания используйте возможности Интернета.
Решение
Использование химического анализа в той или иной области человеческой деятельности
Химический анализ используется в пищевой промышленности. Благодаря этому методу осуществляется контроль качества сырья и готовой продукции. Химический анализ позволяет контролировать качество продукции, оценивать ее соответствие нормативам. Без лаборантов работа на производстве значительно замедляется, а в некоторых случаях и вовсе невозможна. Лаборант химического анализа определяет качественный состав химического вещества, количественное соотношение химических элементов. В условиях лаборатории он проводит синтез: соединяет реактивы для получения химической реакции, преобразования вещества из одного состояния в другое. Задача лаборанта – оценить вещество, сравнив полученный результат анализа с ожидаемым. Массовая и объемная доли компонентов смеси. Часть 1
-
Массовая и объемная доли компонентов смеси. Часть 1. Номер №1
Для _ _ _ _ _ _ и _ _ _ _ _ _ _ смесей массовая доля компонента (ω) рассчитывается по формуле:
ω = $\frac{m(компонента)}{m(смеси)}$ ( * 100%).
Для растворов массовая доля вещества (ω) рассчитывается по формуле:
ω = $\frac{m(в-ва)}{m(р-ра)}$ ( * 100%).
Если вещество содержит примеси, то его массовая доля (%) равна:
ω (в−ва) = 100% − ω% (примесей).
Решение
Для жидких и твердых смесей массовая доля компонента (ω) рассчитывается по формуле:
ω = $\frac{m(компонента)}{m(смеси)}$ ( * 100%).
Для растворов массовая доля вещества (ω) рассчитывается по формуле:
ω = $\frac{m(в-ва)}{m(р-ра)}$ ( * 100%).
Если вещество содержит примеси, то его массовая доля (%) равна:
ω (в−ва) = 100% − ω% (примесей).
Номер №2
Объемная доля компонента газообразной смеси (φ) рассчитывается по формуле:
φ = $\frac{V(компонента)}{V(смеси)}$ (*100%).
Решение
Объемная доля компонента газообразной смеси (φ) рассчитывается по формуле:
φ = $\frac{V(компонента)}{V(смеси)}$ (*100%).
Номер №3
Используя материал пунктов 1 и 2, выведите формулы для расчетов:
− массы растворенного вещества (р.в.):
m (р.в.) = _
− массы раствора (р−ра):
m (р−ра) = _
− объема компонента газовой смеси:
V (компонента газовой смеси) = _
− объема газовой смеси:
V (газовой смеси) = _
Решение
Формулы для расчетов:
− массы растворенного вещества (р.в.):
m (р.в.) = m (р−ра) * ω
− массы раствора (р−ра):
m (р−ра) = m (р.в.) : ω
− объема компонента газовой смеси:
V (компонента газовой смеси) = V (газовой смеси) * φ
− объема газовой смеси:
V (газовой смеси) = V (компонента газовой смеси) : φ
Номер №4
Для расчета m раствора, если известны его плотность и объем, используют формулу, известную из курса физики:
m (р−ра) = _
Решение
Для расчета m раствора, если известны его плотность и объем, используют формулу, известную из курса физики:
m (р−ра) = V * ρ Часть 2
-
Часть 2. Номер №1
В 40 г дистиллированной воды растворили 2 г хлорида натрия. Рассчитайте массовую долю соли в полученном растворе.
Решение
Дано:
m ($H_{2}O$) = 40 г
m (NaCl) = 2 г
Найти:
ω − ?
Решение:
ω = $\frac{m (в-ва)}{m (р-ра)}$ * 100%
m (р−ра) = m (в−ва) + m ($H_{2}O$)
m (р−ра) = 2 г + 40 г = 42 г
ω = $\frac{2 г}{40 г}$ * 100% = 4,8%
Ответ: ω = 4,8%
Номер №2
В 2 л раствора серной кислоты содержится 456 г $H_{2}SO_{4}$. Рассчитайте массовую долю растворенного вещества, учитывая, что плотность раствора равна 1,14 г/мл.
Решение
Дано:
V ($H_{2}SO_{4}$) = 2 л = 2000 мл
m ($H_{2}SO_{4}$) = 456 г
ρ ($H_{2}SO_{4}$) = 1,14 г/мл
Найти:
ω − ?
Решение:
ω = $\frac{m (в-ва)}{m (р-ра)}$ * 100%
m (р−ра) = V (р−ра) * ρ
m (р−ра) = 2000 мл * 1,14 г/мл = 2280 г
ω = $\frac{456 г}{2280 г}$ * 100% = 20%
Ответ: ω = 20%
Номер №3
Сколько воды и соли нужно взять, чтобы приготовиться 250 г 10%−го раствора нитрата натрия?
Решение
Дано:
$m_{р-ра}$ ($NaNO_{3}$) = 250 г
ω = 10%
Найти:
$m_{воды}$ − ?
$m_{соли}$ − ?
Решение:
$m_{соли}$ = m (р−ра) * ω
$m_{соли}$ = 250 г * 0,1 = 25 г
$m_{воды}$ = $m_{р-ра}$ ($NaNO_{3}$) − $m_{соли}$
$m_{воды}$ = 250 г − 25 г = 225 г
Ответ: $m_{соли}$ = 25 г; $m_{воды}$ = 225 г
Номер №4
К 1 кг 60%−го раствора соли добавили 50 г этой соли. Какова массовая доля соли в полученном растворе? Ответ округлите до десятых.
Решение
Дано:
m (р−ра) = 1 кг = 1000 г
ω = 60%
m (доб. соли) = 50 г
Найти:
$ω_{1}$ − ?
Решение:
$ω_{1}$ = $\frac{m (в-ва) + m (доб. в-ва)}{m (р-ра) + m (доб.в-ва)}$ * 100%
m (в−ва) = m (р−ра) * ω
m (в−ва) = 1000 г * 0,6 = 600 г
$ω_{1}$ = $\frac{600 г + 50 г}{1000 г + 50 г}$ * 100% = 61,9%
Ответ: ω = 61,9%
Номер №5
Какова массовая доля сахара в растворе, полученном при упаривании 200 г 20%−го раствора до 70 г? Ответ округлить до десятых.
Решение
Дано:
m (р−ра) = 200 г
ω = 20%
m (получ. р−ра) = 70 г
Найти:
$ω_{1}$ − ?
Решение:
$ω_{1}$ = $\frac{m (в-ва)}{m (получ. р-ра)}$ * 100%
m (в−ва) = m (р−ра) * ω
m (в−ва) = 200 г * 0,2 = 40 г
$ω_{1}$ = $\frac{40 г}{70 г}$ * 100% = 57,1%
Ответ: ω = 57,1%
Номер №6
Смешали 120 г 40%−го и 280 г 10%−го раствора азотной кислоты. Определите массовую долю азотной кислоты в полученном растворе.
Решение
Дано:
$m_{1}$ (р−ра) = 120 г
$ω_{1}$ = 40%
$m_{2}$ (р−ра) = 280 г
$ω_{2}$ = 10%
Найти:
$ω_{3}$ − ?
Решение:
$ω_{3}$ = $\frac{m_{1} (в-ва) + m_{2} (в-ва)}{m_{1}(р-ра) + m_{2} (р-ра)}$ * 100%
m (в−ва) = m (р−ра) * ω
$m_{1}$ (в−ва) = 120 г * 0,4 = 48 г
$m_{2}$ (в−ва) = 280 г * 0,1 = 28 г
$ω_{3}$ = $\frac{48 г + 28 г}{120 г + 280 г}$ * 100% = 19%
Ответ: $ω_{3}$ = 19%
Номер №7
Сколько хлороводорода нужно растворить в 1 $м^{3}$ воды, чтобы получить 20%−й раствор? Вычислите массу и объем (н.у.) хлороводорода.
Решение
Дано:
V ($H_{2}O$) = 1 $м^{3}$ = 1000 л
ω = 20%
Найти:
m (HCl) − ?
V (HCl) − ?
Решение:
m ($H_{2}O$) = V ($H_{2}O$) * ρ
m ($H_{2}O$) = 1000 мл * 1г/мл = 1000 кг
ω = $\frac{m (в-ва)}{m (р-ра)}$ * 100%
m (р−ра) = m (в−ва) + m ($H_{2}O$)
ω = $\frac{m (в-ва)}{m (в-ва) + m (H_{2}O)}$ * 100%
0,2 = $\frac{m (в-ва)}{m (в-ва) + 1000 г}$ * 100%
m (HCl) = 250 кг
n (HCl) = m : M = 250 кг : 36,5 г/моль = 6,85 кмоль
V (HCl) = $V_{m}$ * n = 22,4 л/моль * 6,85 кмоль = $153м^{3}$
Ответ: m (HCl) = 250 кг; V (HCl) = $153м^{3}$
Номер №8
В воздухе содержится 21% кислорода и 78% азота по объему. Рассчитайте объем кислорода и азота в 250 $м^{3}$ воздуха. Определите для каждого газа количество вещества и массу.
Решение
Дано:
ω ($O_{2}$) = 21%
ω ($N_{2}$) = 78%
V (возд.) = $250м^{3}$
Найти:
V ($O_{2}$) − ?
V ($N_{2}$) − ?
m ($O_{2}$) − ?
m ($N_{2}$) − ?
n ($O_{2}$) − ?
n ($N_{2}$) − ?
Решение:
ω = $\frac{V(газа)}{V(смеси)}$ * 100%
V (газа) = V (смеси) * ω
V ($O_{2}$) = $250м^{3}$ * 0,21 = $52,5м^{3}$
V ($N_{2}$) = $250м^{3}$ * 0,78 = $195м^{3}$
n = V : $V_{m}$
n ($O_{2}$) = $52,5м^{3}$ : 22,4 л/моль = 2,3 кмоль
n ($N_{2}$) = $195м^{3}$ : 22,4 л/моль = 8,7 кмоль
m (газа) = M * n
m ($N_{2}$) = 28 г/моль * 8,7 кмоль = 244 кг
m ($O_{2}$) = 32 г/моль * 2,3 кмоль = 75 кг
Ответ: V ($O_{2}$) = $52,5м^{3}$; V ($N_{2}$) = $195м^{3}$; n ($O_{2}$) = 2,3 кмоль; n ($N_{2}$) = 8,7 кмоль; m ($N_{2}$) = 244 кг; m ($O_{2}$) = 75 кг
Номер №9
К 300 л воздуха добавили 60 л азота. Вычислите массы кислорода и азота, которые можно получить из этой смеси.
Решение
Дано:
V (воздуха) = 300 л
V ($N_{2}$) = 60 л
ω ($O_{2}$) = 21%
ω ($N_{2}$) = 78%
Найти:
m ($N_{2}$) − ?
m ($O_{2}$) − ?
Решение:
ω = $\frac{V(газа)}{V(смеси)}$ * 100%
V (газа) = V (смеси) * ω
V ($O_{2}$) = 300 л * 0,21 = 63 л
V ($N_{2}$) = 300 л * 0,78 + 60 л = 297 л
n = V : $V_{m}$
n ($O_{2}$) = 63 л : 22,4 л/моль = 2,8 моль
n ($N_{2}$) = 297 л : 22,4 л/моль = 13 моль
m (газа) = M * n
m ($N_{2}$) = 28 г/моль * 13моль = 372 г
m ($O_{2}$) = 32 г/моль * 2,8 моль = 90 г
Ответ: m ($N_{2}$) = 372 г; m ($O_{2}$) = 90 г Физические явления в химии. Часть 1
-
Физические явления в химии. Часть 1. Номер №1
Для получения чистых веществ из _ _ _ _ _ _ или _ _ _ _ _ _ _ _ _ _ _ _ смесей используют различные _ _ _ _ _ _ _ _ _ _ свойства веществ, образующих данные смеси.
Решение
Для получения чистых веществ из жидких или гетерогенных смесей используют различные физические свойства веществ, образующих данные смеси.
Номер №2
Способы разделения смесей.Способ разделения Приборы или установки, применяемые в химии Применение в быту и профессиональной деятельности Перегонка, или ... 
Фильтрование 
Кристаллизация, или... 
Отстаивание 
Центрифугирование 
Решение
Способ разделения Приборы или установки, применяемые в химии Применение в быту и профессиональной деятельности Перегонка, или ... 
Получение нефтепродуктов из нефти Фильтрование 
Очистка раствора от примесей Кристаллизация, или... 
Добыча соли из морской воды Отстаивание 
Очистка воды Центрифугирование 
В медицине для анализа крови Номер №3*
Заполните схему "Фильтрование воздуха в профессиональной деятельности человека".
Решение
Фильтрование воздуха в профессиональной деятельности человека
Номер №4
Заполните схему "Фильтрование воды в быту и на производстве".
Решение
Фильтрование воды в быту и на производстве
Часть 2. Номер №1
Назовите физические свойства веществ, на которых основаны способы разделения смесей:
1) дистилляция _
2) кристаллизация _
3) возгонка _
4) отстаивание _
5) фильтрование _
Решение
Физические свойства веществ, на которых основаны способы разделения смесей:
1) дистилляция: различные температуры кипения веществ
2) кристаллизация: различная растворимость веществ
3) возгонка: возможность сублимации
4) отстаивание: разная плотность веществ
5) фильтрование: разные размеры частиц веществ
Номер №2
В сахар попали мелкие кусочки стекла. Как очистить сахар от опасных примесей? Выберите порядок действий.
1) растворение в воде
2) возгонка
3) отстаивание
4) выпаривание
5) фильтрование
6) дистилляция
Ответ. _
Решение
Ответ. 1, 3, 5, 4
Номер №3
Установите соответствие между смесью и оборудованием, которое необходимо для ее разделения. Из слогов, указывающих правильный ответ, вы составите слово, обозначающее осторожное сливание жидкости при образовании осадка на дне сосуда: _ _ _ _ _ _ _ _ _ _ .НАЗВАНИЕ ОБОРУДОВАНИЯ ВОДА И ПОДСОЛНЕЧНОЕ МАСЛО ПЕСОК И ВОДА СОЛЬ И ВОДА НЕФТЬ Делительная воронка ДЕ СУ ВО РЕ Фильтр, химические воронка и стакан БЛИ КАН ЗГО ГЕН Чашка для выпаривания и спиртовка МА ЛО ТА РА Дистиллятор РИЯ МА ЖА ЦИЯ
Решение
Слово, обозначающее осторожное сливание жидкости при образовании осадка на дне сосуда: декантация.НАЗВАНИЕ ОБОРУДОВАНИЯ ВОДА И ПОДСОЛНЕЧНОЕ МАСЛО ПЕСОК И ВОДА СОЛЬ И ВОДА НЕФТЬ Делительная воронка ДЕ СУ ВО РЕ Фильтр, химические воронка и стакан БЛИ КАН ЗГО ГЕН Чашка для выпаривания и спиртовка МА ЛО ТА РА Дистиллятор РИЯ МА ЖА ЦИЯ Номер №4
Предложите последовательность операций для разделения следующей смеси веществ:
песок, соль, железная стружка, сера.
1) растворение в воде
2) возгонка
3) отстаивание
4) выпаривание
5) фильтрование
6) дистилляция
7) магнит
8) воспользоваться ложечкой
9) бидистилляция
Ответ: _
Решение
1 − 7) магнит
2 − 1) растворение в воде
3 − 3) отстаивание
4 − 8) воспользоваться ложечкой
5 − 5) фильтрование
6 − 4) выпаривание
Ответ: 7, 1, 3, 8, 5, 4
Номер №5
Впишите пропущенные слова в схемы получения различных веществ.
1) Кровь → _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ → плазма и форменные элементы крови.
2) Кристаллический йод → _ _ _ _ _ _ _ _ → пары фиолетового цвета.
3) Хлороводород + вода → _ _ _ _ _ _ _ _ _ _ _ → соляная кислота.
4) Нефть → _ _ _ _ _ _ _ _ _ → фракции нефти.
Решение
1) Кровь → центрифугирование → плазма и форменные элементы крови.
2) Кристаллический йод → возгонка → пары фиолетового цвета.
3) Хлороводород + вода → растворение → соляная кислота.
4) Нефть → перегонка → фракции нефти.
Номер №6
Подготовьте небольшое сообщение об одной из фракций нефти (название, физические свойства, области применения). Используйте дополнительные источники информации, в том числе Интернет.
Решение
Нефтяной газ
При переработке нефти образуются газы, которые по сути являются алканами: бутан, пропан, этан. Промышленное название данной фракции – нефтяной газ. Газовую фракцию нефти удаляют до первичной перегонки нефти. Нефтяной газ используется как горючее, который затем используется в качестве сырья для получения этилена (алкена).
Номер №7*
Используя Интернет, познакомьтесь с системой очистки воды, поступающей в водопроводную систему города. Укажите последовательность основных операций этого процесса в виде схемы.
Решение
Вода из реки поступает в бассейн для отстаивания – отстойник. Затем поступает в колодец. Проходит через фильтр – слой песка для задержки более крупных частиц. Через главный насос вода поступает в прибор для обеззараживания воды. Далее, вода поступает в водонапорную башню, а после − в водопровод.
Номер №8
Укажите, в какой последовательности происходит испарение основных компонентов жидкой воздушной смеси. Приведите названия и формулы веществ.
1) _
2) _
3) _
Решение
1) Кислород − $O_{2}$
2) Азот − $N_{2}$
3) Аргон − Ar Химические реакции. Часть 1
-
Химические реакции. Часть 1. Номер №1
Химические явления, или _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _, − это _
Решение
Химические явления, или химические реакции, − это реакции, в ходе которых происходит превращение одних веществ в другие.
Номер №2
Образование новых веществ сопровождается появлением новых признаков или _ _ _ _ _ _ _, характеризующих эти вещества, что можно зафиксировать с помощью органов чувств, т. е. заметить _ _ _ _ _ _ _ _ химических реакций.
Решение
Образование новых веществ сопровождается появлением новых признаков или свойств, характеризующих эти вещества, что можно зафиксировать с помощью органов чувств, т. е. заметить признаки химических реакций.
Номер №3
Заполните таблицу "Признаки химических реакций".ОПЫТ ПРИЗНАК ХИМИЧЕСКОЙ РЕАКЦИИ ОБЪЯСНЕНИЕ Взаимодействие щелочи с фенолфталеином Обесцвечивание подкрашенного раствора щелочи кислотой Взаимодействие растворов соды и кислоты Взаимодействие растворов щелочи и медного купороса Растворение полученного осадка кислотой Решение
Признаки химических реакцийОПЫТ ПРИЗНАК ХИМИЧЕСКОЙ РЕАКЦИИ ОБЪЯСНЕНИЕ Взаимодействие щелочи с фенолфталеином Изменение окраски раствора $NaOH = Na^{+} + OH^{-}$ Обесцвечивание подкрашенного раствора щелочи кислотой Изменением окраски раствора $BaCl_{2} + H_{2}SO_{4} = BaSO_{4} + 2HCl$ Взаимодействие растворов соды и кислоты Выделение газа $NaHCO_{3} + HCl = NaCl + H_{2}O + CO_{2}$ Взаимодействие растворов щелочи и медного купороса Выпадение осадка голубого цвета $Cu(OH)_{2}$ − осадок голубого цвета Растворение полученного осадка кислотой Исчезновение осадка $CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$ Номер №4
Классификация реакций по признаку выделения или поглощения теплоты.
Решение
Классификация реакций по признаку выделения или поглощения теплоты.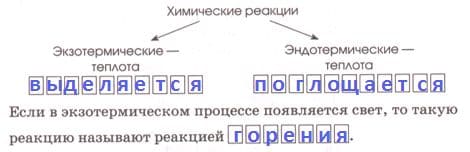
Номер №5
Условия течения химических реакций:
− _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ реагирующих веществ;
− первоначальное нагревание для некоторых _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ реакций;
− постоянное нагревание для _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ реакций.
Решение
Условия течения химических реакций:
− соприкосновение реагирующих веществ;
− первоначальное нагревание для некоторых экзотермических реакций;
− постоянное нагревание для эндотермических реакций. Часть 2
-
Часть 2. Номер №1
В каком случае можно говорить, что протекает химическая реакция?
1) В пробирку с раствором щелочи приливают индикатор фенолфталеин.
2) В пробирку с раствором кислоты приливают индикатор фенолфталеин.
3) В пробирку с раствором щелочи приливают индикатор метиловый оранжевый.
Ответ: _
Ответ поясните.
Решение
Ответ: 1, 3, так как в результате этих реакций происходит изменение окраски раствора.
Номер №2*
Прочитайте внимательно стихотворение.
Явил ряд признаков подряд
Нам, разлагаясь, бихромат:
Цвет, звук, огонь и даже газ
Заметить каждый мог из нас.
Чтоб превращенье началось,
Поджечь кристаллы нам пришлось.
Тепло наружу − это экзо,
Горенье − свет,
Тепло вовнутрь − это эндо −
Обратный тепловой эффект!
О каких признаках описанной реакции говорится в стихотворении? _
Если на уроке вам не демонстрировали эту реакцию, найдите в Интернете видеофрагмент "Разложение бихромата аммония", посмотрите его и сделайте рисунок, навеянный этой замечательной реакцией.
Решение
В стихотворении говорится об изменении цвета, выделении тепла, света и образовании газа.
Разложение бихромата аммония:
$(NH_{4})_{2}Cr)_{2}O_{7} = Cr_{2}O_{3} + N_{2} + 4H_{2}O$
Номер №3
Установите соответствие между признаком и химической реакцией.
ПРИЗНАК ХИМИЧЕСКОЙ РЕАКЦИИ
А) выделение газа
Б) выпадение осадка
В) изменение цвета
↑↓
ХИМИЧЕСКАЯ РЕАКЦИЯ
1) сжигание серы
2) качественная реакция на известковую воду
3) взаимодействие лакмуса с кислотой
Ответ:А Б В Решение
Ответ:А Б В 1 2 3
Номер №4
При приготовлении раствора серной кислоты следует:
1) приливать воду к серной кислоте;
2) серную кислоту приливать к воде.
Ответ: _
Ответ поясните.
Решение
Ответ: 1, если воду вливать в кислоту, то она будет закипать и разбрызгиваться.
Номер №5
Верны ли следующие суждения?
А. Экзотермические реакции, как правило, идут при постоянном нагревании.
Б. Эндотермические реакции могут протекать без нагревания.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ: _
Решение
Ответ: 4
Номер №6
Чтобы увеличить скорость химической реакции между твердыми и газообразными веществами, нужно _
Решение
Чтобы увеличить скорость химической реакции между твердыми и газообразными веществами, нужно нагреть твердое вещество, увеличить площадь их соприкосновения, то есть измелить твердое вещество.
Номер №7
Чтобы увеличить скорость химической реакции между твердыми растворимыми веществами, нужно _
Решение
Чтобы увеличить скорость химической реакции между твердыми растворимыми веществами, нужно нагреть вещества, увелить площадь их соприкосновения, растворить в воде.
Номер №8
Укажите, что нужно сделать, чтобы ликвидировать возгорание:
1) твердых веществ и материалов
2) нефтепродуктов
3) электроприборов
Решение
Чтобы ликвидировать возгорание:
1) твердых веществ и материалов − нужно потушить возгорание водой
2) нефтепродуктов − нужно ограничить зону распространение нефтепродуктов, потушить пенным огнетушителем
3) электроприборов − нужно обесточить прибор, потушить углекислым огнетушителем Химические уравнения. Часть 1
-
Химические уравнения. Часть 1. Номер №1
Закон Ломоносова − Лавуазье − закон _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ :
m веществ, вступивших в реакцию, = m веществ, получившихся в результате ее.
Решение
Закон Ломоносова − Лавуазье − закон сохранения массы веществ :
m веществ, вступивших в реакцию, = m веществ, получившихся в результате ее.
Номер №2
Уравнение химической реакции − это _
Решение
Уравнение химической реакции − это условная запись химической реакции с помощью химических формул и коэффициентов.
Номер №3
Химическое уравнение должно соответствовать закону сохранения массы веществ, что достигается расстановкой коэффициентов в уравнении реакции.
Решение
Химическое уравнение должно соответствовать закону сохранения массы веществ, что достигается расстановкой коэффициентов в уравнении реакции.
Номер №4
Что показывает химическое уравнение?
1) Какие вещества _ _ _ _ _ _ _ _ в реакцию.
2) Какие вещества _ _ _ _ _ _ _ _ _ _ _ _ в результате.
3) Количественные отношения веществ в реакции, т.е. количества _ _ _ _ _ _ _ _ _ _ _ и _ _ _ _ _ _ _ _ _ _ _ _ веществ в реакции.
4) Тип химической реакции.
Решение
Что показывает химическое уравнение?
1) Какие вещества вступают в реакцию.
2) Какие вещества образуются в результате.
3) Количественные отношения веществ в реакции, т.е. количества реагирующих и образующихся веществ в реакции.
4) Тип химической реакции.
Номер №5
Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и воды.
а) Запишите схему реакции, т.е. формулы реагирующих и образующихся веществ:
_ _ ( _ _ ) _ + _ _ _ _ _ → _ _ _ ( _ _ _ ) _ + _ _ _
б) начинайте уравнивать схему реакции с формулы соли (если она имеется). При этом помните, что несколько сложных ионов в составе основания или соли обозначаются скобками, а их число − индексами за скобками:
... _ _ ( _ _ ) _ + ... _ _ _ _ _ → _ _ _ ( _ _ _ ) _ + _ _ _
в) водород уравняйте в предпоследнюю очередь:
... _ _ ( _ _ ) _ + ... _ _ _ _ _ → _ _ _ ( _ _ _ ) _ + ... _ _ _
г) кислород уравняйте последним − это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Например:
$C_{6}H_{6} + ... O_{2} = ... CO_{2} + ... H_{2}O$ (х2)
$... C_{6}H_{6} + ... O_{2} = ... CO_{2} + ... H_{2}O$
Решение
Правила расстановки коэффициентов в схеме химической реакции на примере взаимодействия гидроксида бария и фосфорной кислоты с образованием фосфата бария и воды.
а) $Ba(OH)_{2} + H_{3}PO_{4} → Ba_{3}(PO_{4})_{2} + H_{2}O$
б) $3Ba(OH)_{2} + 2H_{3}PO_{4} → Ba_{3}(PO_{4})_{2} + H_{2}O$
в) $3Ba(OH)_{2} + 2H_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 6H_{2}O$
г) кислород уравняйте последним − это индикатор верной расстановки коэффициентов.
Перед формулой простого вещества возможна запись дробного коэффициента, после чего уравнение необходимо переписать с удвоенными коэффициентами.
Например:
$C_{6}H_{6} + 15/12 O_{2} = 6CO_{2} + 3H_{2}O$ (х2)
$2C_{6}H_{6} + 7O_{2} = 4CO_{2} + 6H_{2}O$ Часть 2
-
Часть 2. Номер №1
Составьте уравнения реакций, схемы которых:
1) $Ca(OH)_{2}$ + _ HBr → $CaBr_{2}$ + _ $H_{2}O$
2) $H_{3}PO_{4}$ + _ NaOH → $Na_{3}PO_{4}$ + _ $H_{2}O$
3) $Na_{2}CO_{3}$ + _ HCl → _ NaCl + $CO_{2} + H_{2}O$
4) $Fe_{2}(SO_{4})_ {3}$ + _ $BaCl_{2}$ → _ $BaSO_{4}$ + _ $FeCl_{3}$
Решение
1) $Ca(OH)_{2} + 2HBr → CaBr_{2} + 2H_{2}O$
2) $H_{3}PO_{4} + 3NaOH → Na_{3}PO_{4} + 3H_{2}O$
3) $Na_{2}CO_{3} + 2HCl → 2NaCl + CO_{2} + H_{2}O$
4) $Fe_{2}(SO_{4})_{3} + 3BaCl_{2} → 3BaSO_{4} + 2FeCl_{3}$
Номер №2
Напишите уравнения химических реакций:
1) между серной кислотой и гидроксидом калия с образованием сульфата калия и воды _
2) разложение йодида серебра на свету на серебро и йод _
3) между магнием и соляной кислотой с образованием водорода и хлорида магния _
4) между натрием и водой с образованием гидроксида натрия и водорода _
Решение
1) $H_{2}SO_{4} + 2KOH = K_{2}SO_{4} + 2H_{2}O$
2) $2AgI = 2Ag + I_{2}$
3) $Mg + 2HCl = MgCl_{2} + H_{2}$
4) $2Na + 2H_{2}O = 2NaOH + H_{2}$
Номер №3
Установите соответствие между схемой реакции и суммой коэффициентов в химической реакции.
СХЕМА ХИМИЧЕСКОЙ РЕАКЦИИ
А) Ca + _ HCl → $CaCl_{2} + H_{2}$
Б) $SO_{3} + H_{2}O → H_{2}SO_{4}$
В) _ Li + $N_{2} → Li_{3}N$
Г) _ CO + $O_{2} → CO_{2}$
↑↓
СУММА КОЭФФИЦИЕНТОВ В УРАВНЕНИИ РЕАКЦИИ
1) 5
2) 3
3) 9
4) 0
5) 2
Ответ.А Б В Г
Решение
ОтветА Б В Г 1 2 3 1 А) $Ca + 2HCl = CaCl_{2} + H_{2}$
Б) $SO_{3} + H_{2}O = H_{2}SO_{4}$
В) 6Li + $N_{2} = 2Li_{3}N$
Г) 2CO + $O_{2} = 2CO_{2}$
Номер №4
Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА
А) фосфорная кислота и гидроксид калия
Б) нитрат бария
В) оксид азота (V) и вода
Г) оксид кальция и углекислый газ
↑↓
ПРОДУКТЫ РЕАКЦИИ
1) сульфат бария и нитрат калия
2) карбонат кальция
3) азотная кислота
4) фосфат калия и вода
Ответ.А Б В Г Запишите уравнения соответствующих химических реакций:
А) _
Б) _
В) _
Г) _
Решение
Ответ.А Б В Г 4 1 3 2 А) $H_{3}PO_{4} + 3KOH = K_{3}PO_{4} + 3H_{2}O$
Б) $Ba(NO_{3})_{2} + H_{2}SO_{4} = BaSO_{4} + 2HNO_{3}$
В) $N_{2}O_{5} + H_{2}O = 2HNO_{3}$
Г) $CaO + CO_{2} = CaCO_{3}$
Номер №5
Что показывает уравнение следующей химической реакции:
$Cu(OH)_{2} + 2HCl = CuCl_{2} + H_{2}O$?
1) _
2) _
3) _
Решение
$Cu(OH)_{2} + 2HCl = CuCl_{2} + H_{2}O$
1) Реагентами реакции являются гидроксид меди − $Cu(OH)_ {2}$ и соляная кислота − HCl.
2) Продуктами реакции являются хлорид меди (II) − $CuCl_{2}$ и вода − $H_{2}O$.
3) При взаимодействии 1 моль гидроксида меди и 2 моль соляной кислоты образуется 1 моль хлорида меди (II) и 1 моль воды.
Номер №6
С помощью следующей схемы составьте уравнение химической реакции, используя удвоение дробного коэффициента:
$C_{2}H_{2}$ + _ $O_{2}$ = _ $CO_{2} + H_{2}O$ (х2)
_ $C_{2}H_{2}$ + _ $O_{2}$ = _ $CO_{2}$ + _ $H_{2}O$
Решение
$C_{2}H_{2} + 5/2 O_{2} = 2CO_{2} + H_{2}O$ (х2)
$2C_{2}H_{2} + 5O_{2} = 4CO_{2} + 2H_{2}O$
Номер №7
Уравнение химической реакции:
$4P + 5O_{2} = 2P_{2}O_{5}$
показывает количество вещества исходных веществ и продуктов, их массу или объем:
1) фосфора − _ моль или _ _ _ г;
2) оксида фосфора (V) − _ моль, _ _ _ г;
3) кислорода − _ моль или _ _ _ л.
Решение
Уравнение химической реакции:
$4P + 5O_{2} = 2P_{2}O_{5}$
показывает количество вещества исходных веществ и продуктов, их массу или объем:
1) фосфора − 4 моль или 124 г;
2) оксида фосфора (V) − 2 моль, 284 г;
3) кислорода − 5 моль или 112 л. Расчеты по химическим уравнениям. Часть 1
-
Расчеты по химическим уравнениям. Часть 1. Номер №1
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ
1) Запишите уравнение химической реакции (обязательно расставьте коэффициенты).
2) Исходные данные задачи переведите в количества веществ (в моли).
3) Над формулами веществ в уравнении запишите найденные количества заданных веществ.
4) По уравнению с учетом коэффициентов вычислите количество искомого вещества. Если этого требуют условия задачи, количество вещества переведите в единицы массы или объема.
5) Запишите ответ.
Решение
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ
1) Запишите уравнение химической реакции (обязательно расставьте коэффициенты).
2) Исходные данные задачи переведите в количества веществ (в моли).
3) Над формулами веществ в уравнении запишите найденные количества заданных веществ.
4) По уравнению с учетом коэффициентов вычислите количество искомого вещества. Если этого требуют условия задачи, количество вещества переведите в единицы массы или объема.
5) Запишите ответ.
Номер №2
Рассмотрим пример.
Рассчитайте массу серной кислоты, которая взаимодействует с 5,6 г гидроксида калия. В результате реакции образуются сульфат калия и вода.
Дано:
m ( _ ) = 5,6 г
Решение:
1) $H_{2}SO_{4} + 2KOH = K_{2}SO_{4} + 2H_{2}O$
2) n (KOH) = 5,6 г : 56 г/моль = 0,1 моль.
3) $H_{2}SO_{4} + 2KOH = K_{2}SO_{4} + 2H_{2}O$
4) n ($H_{2}SO_{4}$) : n (KOH) = 1 : 2 (по уравнению) → n ($H_{2}SO_{4}$) = 0,5 * n (KOH) = 0,5 * 0,1 моль = 0,05 моль
m ($H_{2}SO_{4}$) = 0,05 моль * ...г/моль = ... г
Ответ: m ( ... ) = ... г
Решение
Дано:
m (KOH) = 5,6 г
Найти:
m ($H_{2}SO_{4}$) − ?
Решение:
1) $H_{2}SO_{4} + 2KOH = K_{2}SO_{4} + 2H_{2}O$
2) n (KOH) = 5,6 г : 56 г/моль = 0,1 моль.
3) $H_{2}SO_{4} + 2KOH = K_{2}SO_{4} + 2H_{2}O$
4) n ($H_{2}SO_{4}$) : n (KOH) = 1 : 2 (по уравнению) → n ($H_{2}SO_{4}$) = 0,5 * n (KOH) = 0,5 * 0,1 моль = 0,05 моль
m ($H_{2}SO_{4}$) = 0,05 моль * 98 г/моль = 4,9 г
Ответ: m ($H_{2}SO_{4}$) = 4,9 г Часть 2
-
Часть 2. Номер №1
Заполните пропуски, проанализировав уравнение реакции.
$4P + 5O_{2} = 2P_{2}O_{5}$Число частиц, N _ атома _ молекул _ молекулы Количества вещества, n _ моль _ моль _ моль Молярная масса, M г/моль г/моль г/моль Масса, m г г г Молярный объем, Vm − л/моль − Объем, V − −л − 1) Если в реакцию вступит 3 моль фосфора, то потребуется _ , _ _ моль кислорода, и образуется _ , _ моль оксида фосфора (V).
2) Для получения 213 г оксида фосфора (V) необходимо _ _ л кислорода и _ _ г фосфора.
3) Из _ _ , _ г фосфора при взаимодействии с 11,2 л кислорода образуется _ _ , _ оксида фосфора (V).
Решение
$4P + 5O_{2} = 2P_{2}O_{5}$Число частиц, N 4 атома 5 молекул 2 молекулы Количества вещества, n 4 моль 5 моль 2 моль Молярная масса, M 31 г/моль 32 г/моль 142 г/моль Масса, m 124 г 160 г 284 г Молярный объем, Vm − 22,4 л/моль − Объем, V − 112 л − 1) Если в реакцию вступит 3 моль фосфора, то потребуется 3,75 моль кислорода, и образуется 1,5 моль оксида фосфора (V).
2) Для получения 213 г оксида фосфора (V) необходимо 84 л кислорода и 93 г фосфора.
3) Из 12,4 г фосфора при взаимодействии с 11,2 л кислорода образуется 28,4 оксида фосфора (V).
Номер №2
Рассчитайте массу магния, который может сгореть в кислороде объемом 33,6 л (н.у.). Схема химической реакции:
$Mg + O_{2} → MgO$
Решение:
1-й способ
_ $Mg + O_{2}$ → _ $MgO$
1) n ($O_{2}$) = 33,6 л : 22,4 л/моль = 1,5 моль.
2) n (Mg) : n ($O_{2}$) = 2 : 1 (по уравнению) → n (Mg) = 2 * n ($O_{2}$) = 2 * 1,5 моль = 3 моль
3) n (Mg) = 3 моль * ... г/моль = ... г
Ответ: m (...) = ... г
2-й способ
1) По условию: m (Mg) = x г; V ($O_{2}$) = ...
_ $Mg + O_{2}$ → _ $MgO$
По уравнению:
n (Mg) = ...
M (Mg) = ...
m (Mg) = ...
n ($O_{2}$) = ...
M ($O_{2}$) = ...
V ($O_{2}$) = ...
2) Составьте и решите пропорцию:
m (Mg) = $\frac{V (O_{2}) по условию * m (Mg) по уравнению }{V(O_{2}) по уравнению}$;
m (Mg) = $\frac{\_}{\_}$ = ... г
Ответ: m ( ... ) = ... г
Решение
Дано:
V ($O_{2}$) = 33,6 л
Найти: m (Mg) − ?
Решение:
1-й способ
$2Mg + O_{2}$ → $2MgO$
1) n ($O_{2}$) = 33,6 л : 22,4 л/моль = 1,5 моль.
2) n (Mg) : n ($O_{2}$) = 2 : 1 (по уравнению) → n (Mg) = 2 * n ($O_{2}$) = 2 * 1,5 моль = 3 моль
3) n (Mg) = 3 моль * 24 г/моль = 72 г
Ответ: m (Mg) = 72 г
2-й способ
1) По условию: m (Mg) = x г; V ($O_{2}$) = 33,6 л
$2Mg + O_{2}$ → $2MgO$
По уравнению:
n (Mg) = 2 моль
M (Mg) = 24 г/моль
m (Mg) = 48 г
n ($O_{2}$) = 1 моль
$V_{m}$ ($O_{2}$) = 22,4 л/моль
V ($O_{2}$) = 22,4 л
2) Составьте и решите пропорцию:
m (Mg) = $\frac{V (O_{2}) по условию * m (Mg) по уравнению }{V(O_{2}) по уравнению}$;
m (Mg) = $\frac{33,6 л * 48 г}{22,4 л}$ = 72 г
Ответ: m (Mg) = 72 г
Номер №3
В реакцию вступило 13 г цинка и соляная кислота. В результате реакции образовались водород и хлорид цинка. Определите объем (н.у.) и число молекул водорода.
Решение:
1) Запишите уравнение реакции (коэффициенты!): _
2) Рассчитайте количество вещества цинка: _
3) Рассчитайте количество водорода: _
4) Рассчитайте объем водорода: _
5) Вычислите число молекул водорода: _
Ответ: V ( ... ) = ..., N ( ... ) = ... молекул.
Решение
Дано:
m (Zn) = 13 г
Найти:
V ($H_{2}$) − ?
N ($H_{2}$) − ?
Решение:
1) Запишите уравнение реакции (коэффициенты!):
$Zn + 2HCl = ZnCl_{2} + H_{2}$
2) Рассчитайте количество вещества цинка:
n (Zn) = m : M = 13 г : 65 г/моль = 0,2 моль
3) Рассчитайте количество водорода:
n ($H_{2}$) = n (Zn) = 0,2 моль
4) Рассчитайте объем водорода:
V ($H_{2}$) = $V_{m}$ * n = 22, 4 л/моль * 0,2 моль = 4,48 л
5) Вычислите число молекул водорода:
N ($H_{2}$) = n * $N_{a}$ = 0,2 моль * $6 * 10^{23}$ молекул/моль = $1,2 * 10^{23}$ молекул
Ответ: V ($H_{2}$) = 4,48 л; N ($H_{2}$) = $1,2 * 10^{23}$ молекул
Номер №4
Навеска 1,12 г железа полностью "растворилась" в растворе сульфата меди (II). Вычислите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (II) получилось при этом?
Решение
Дано:
m (Fe) = 1,12 г
Найти:
m (Cu) − ?
n ($FeSO_{4}$) − ?
Решение:
$Fe + CuSO_{4} = FeSO_{4} + Cu$
n (Fe) = m : M = 1,12 г : 56 г/моль = 0,02 моль
n (Cu) = n (Fe) = 0,02 моль
m (Cu) = M * n = 64 г/моль * 0,02 моль = 1,28 г
n ($FeSO_{4}$) = n (Fe) = 0,02 моль
Ответ: m (Cu) = 1,28 г* n ($FeSO_{4}$) = 0,02 моль
Номер №5
Вычислите массу гидроксида меди (II), который образуется при взаимодействии 200 г 20%−го раствора гидроксида натрия и избытка раствора сульфата меди (II). В результате реакции образуется также сульфат натрия.
Решение:
1) Вычислите массу растворенного вещества, ведь именно оно вступает в реакцию: m (NaOH) = m раствора (NaOH) * ω (NaOH)
m (NaOH) = _
2) Составьте уравнение химической реакции (коэффициены!): _
3) Рассчитайте количество вещества гидроксида натрия: _
4) Вычислите количество вещества гидроксида меди (II): _
5) Определите массу вещества гидроксида меди (II): _
Ответ: _
Решение
Дано:
m раствора (NaOH) = 200 г
ω (NaOH) = 20%
Найти:
m ($Cu(OH)_ {2}$) − ?
Решение:
1) Вычислите массу растворенного вещества, ведь именно оно вступает в реакцию: m (NaOH) = m раствора (NaOH) * ω (NaOH)
m (NaOH) = 200 г * 0,2 = 40 г
2) Составьте уравнение химической реакции (коэффициены!):
$2NaOH + CuSO_{4} = Na_{2}SO_{4} + Cu(OH)_ {2}$
3) Рассчитайте количество вещества гидроксида натрия:
M (NaOH) = 23 + 16 + 1 = 40 г/моль
n (NaOH) = m : M = 40 г : 40 г/моль = 1 моль
4) Вычислите количество вещества гидроксида меди (II):
n ($Cu(OH)_ {2}$) = 0,5 * n (NaOH) = 0,5 * 1 моль = 0,5 моль
5) Определите массу вещества гидроксида меди (II):
M ($Cu(OH)_ {2}$) = 64 + 16 * 2 + 1* 2 = 98 г/моль
m ($Cu(OH)_ {2}$) = M * n = 98 г/моль * 0,5 моль = 49 г
Ответ: m ($Cu(OH)_{2}$) = 49 г
Номер №6
Определите объема азота $N_{2}$, необходимого для взаимодействия с кислородом, если в результате реакции получается 250 мл оксида азота (II).
Решение
Дано:
V (NO) = 250 мл = 0,25 л
Найти:
V ($N_{2}$) − ?
Решение:
$N_{2} + O_{2} = 2NO$
n (NO) = V : $V_{m}$
n (NO) = 0,25 л : 22,4 л/моль = 0,011 моль
n ($N_{2}$) = 0,5 * n (NO)
n ($N_{2}$) = 0,5 * 0,011 моль = 0,0055 моль
V ($N_{2}$) = $V_{m}$ * n = 22,4 л/моль * 0,0055 моль = 0,1232 л
Ответ: V ($N_{2}$) = 0,1232 л
Номер №7
Какой объем воздуха потребуется для взаимодействия 17,5 г лития, содержащего 20% примесей? В результате реакции получается оксид лития.
Решение
Дано:
m (Li) = 17,5 г
ω (примесей) = 20%
Найти:
V (воздуха) − ?
Решение:
$4Li + O_{2} = 2Li_{2}O$
ω (чист.) = 100% − 20% = 80%
m (Li) = 17,5 г * 0,8 = 14 г
n (Li) = m : M = 14 г : 7 г/моль = 2 моль
n ($O_{2}$) = $\frac{1}{4}$ * 2 моль = 0,5 моль
V ($O_{2}$) = $V_{m}$ * n = 22,4 л/моль * 0,5 моль = 11,2 л
V (воздуха) = V ($O_{2}$) : 0,21 = 53 л, так как содержание кислорода в воздухе 21%
Ответ: V (воздуха) = 53 л
Номер №8
Придумайте задачу, при решении которой необходимо использовать следующую схему реакции:
$H_{2}SO_{4}$ + _ $Pb(NO_{3})_{2} → PbSO_{4}↓ + HNO_{3}$
Запишите условие задачи и решите ее.
Решение
В реакцию с $Pb(NO_{3})_ {2}$ вступило 400 г раствора серной кислоты. Какое количество соли образовалось?
Дано:
m ($H_{2}SO_{4}$) = 400 г
Найти: n ($PbSO_{4}$) − ?
Решение:
$H_{2}SO_{4} + Pb(NO_{3})_{2} → PbSO_{4} + HNO_{3}$
n ($H_{2}SO_{4}$) = m : M
M ($H_{2}SO_{4}$) = 1 * 2 + 32 + 16 * 4 = 98 г/моль
n ($H_{2}SO_{4}$) = 400 г : 98 г/моль = 4,08 моль
n ($PbSO_{4}$) = n ($H_{2}SO_{4}$) = 4,08 моль
Ответ: n ($PbSO_{4}$) = 4,08 моль Реакции разложения. Часть 1
-
Реакции разложения. Часть 1. Номер №1
Признаки реакции разложения:
− в реакцию вступает одно _ _ _ _ _ _ _ вещество;
− в результате реакции образуются два и более новых _ _ _ _ _ _ _ или _ _ _ _ _ _ _ вещества;
− почти все эти реакции по тепловому эффекту _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Решение
Признаки реакции разложения:
− в реакцию вступает одно сложное вещество;
− в результате реакции образуются два и более новых простых или сложных вещества;
− почти все эти реакции по тепловому эффекту эндотермические.
Номер №2
Интенсивность протекания реакций характеризует ее _ _ _ _ _ _ _ _ .
Решение
Интенсивность протекания реакций характеризует ее скорость.
Номер №3
Вещества, изменяющие скорость реакции, называются _ _ _ _ _ _ _ _ _ _ _ _ _ _ , а реакции с их участием − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _. Например, разложение пероксида водорода в присутствии катализатора:
_ _ _ _ → _ _ _ + _ _ ↑
Решение
Вещества, изменяющие скорость реакции, называются катализаторами , а реакции с их участием − каталитическими. Например, разложение пероксида водорода в присутствии катализатора:
$2H_{2}O_{2}$ $\overset{MnO_{2}}{→}$ $2H_{2}O + O_{2}↑$
Номер №4
Биологические катализаторы белковой природы называются _ _ _ _ _ _ _ _ _ _, а реакции с их участием − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ . Например, разложение пероксида водорода в присутствии фермента:
_ _ _ _ → _ _ _ + _ _ ↑
Решение
Биологические катализаторы белковой природы называются ферментами, а реакции с их участием − ферментативными. Например, разложение пероксида водорода в присутствии фермента:
$2H_{2}O_{2}$ $\overset{каталаза}{→}$ $2H_{2}O + O_{2}↑$ Часть 2
-
Часть 2. Номер №1
Напишите уравнения химических реакций по описанию. Допишите, где необходимо, условия проведения реакций.
1) Нитрат меди (II) при нагревании разлагается на оксид меди (II), оксид азота (IV) и кислород. _
2) При нагревании гидроксида меди (II) разлагается на оксид меди (II) и воду. _
3) Нитрат серебра на свету разлагается на серебро, оксид азота (IV) и кислород. _
4) При нагревании нитрат натрия разлагается на нитрит натрия и кислород. _
Решение
1) $2Cu(NO_{3})_{2} = 2CuO + 4NO_{2} + O_{2}$
2) $Cu(OH)_{2} = CuO + H_{2}O$
3) $2AgNO_{3} = 2Ag + 2NO_{2} + O_{2}$
4) $2NaNO_{3} = 2NaNO_{2} + O_{2}$
Номер №2
Расставьте коэффициенты в схемах химических реакций.
1) $Al_{2}S_{3} + ... H_{2}O → ... Al(OH)_{3} + ... H_{2}S$
2) $... KMnO_{4} → K_{2}MnO_{4} + MnO_{2} + O_{2}$
3) $ ... KClO_{3} → KCl + ... O_{2}$
4) $Al_{4}C_{3} + ... H_{2}O → ... Al(OH)_{3} + 3CH_{4}$
5) $NH_{3} → N_{2} + ... H_{2}$
6) $... H_{3}PO_{4} + ... CaSO_{4} → ... H_{2}SO_{4} + Ca_{3}(PO_{4})_{2}$
Какие реакции относятся к реакциям разложения?
Ответ: _
Решение
1) $Al_{2}S_{3} + 6H_{2}O → 2Al(OH)_{3} + 3H_{2}S$
2) $2KMnO_{4} → K_{2}MnO_{4} + MnO_{2} + O_{2}$
3) $2KClO_{3} → 2KCl + 3O_{2}$
4) $Al_{4}C_{3} + 12H_{2}O → 4Al(OH)_{3} + 3CH_{4}$
5) $2NH_{3} → N_{2} + 3H_{2}$
6) $2H_{3}PO_{4} + 3CaSO_{4} → 3H_{2}SO_{4} + Ca_{3}(PO_{4})_{2}$
Ответ: 2, 3, 5.
Номер №3
Верны ли следующие суждения?
А. Почти все реакции разложения эндотермические.
Б. Катализаторы ускоряют химические реакции, но сами при этом не расходуются.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ. _
Решение
Ответ. 1
Номер №4
Проведите домашний эксперимент.
1) Возьмите сырую и вареную катофелины.
2) Аккуратно порежьте их на мелкие кусочки.
3) Добавьте по отдельности перекись водорода к сырому и вареному картофелю.
Что наблюдаете? _
Объясните результаты опыта. _
Какой газ выделяется? Как это можно доказать? _
Решение
Что наблюдаете? При добавлении перекиси водорода к кусочку сырого картофеля выделяются пузырьки газа, а при добавлении перекиси к вареному картофелю видимых изменений не наблюдается.
Объясните результаты опыта. При варке фермент − каталаза − разрушается, поэтому разложение перекиси водорода не идет.
Какой газ выделяется? Как это можно доказать? В результате разложения перекиси водорода выделяется кислород. Это можно доказать с помощью тлеющей лучинки.
Номер №5
С помощью Интернета и других источников информации ( _ ) найдите интересный факт применения катализатора или фермента в быту или на производстве. Опишите его.
Решение
Ферменты получили широкое применение в пищевой и химической промышленности, а также в медицинской практике.
В пищевой промышленности ферменты используют при приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей.
Хотя в наше время, и особенно в последние двадцать лет, интерес к использованию ферментов в промышленности все более возрастает, их внедрение в производство происходит медленно.
В пищевых технологиях используют в основном ферменты, присутствующие в пищевом сырье, которые поступают в организм человека при потреблении свежих фруктов и овощей, орехов, молока, сброженных и консервированных продуктов.
Номер №6
Рассчитайте массу воды, которую необходимо разложить в электролизере для получения 89,6 л кислорода.
Решение
Дано:
V ($O_{2}$) = 89,6 л
Найти:
m ($H_{2}O$) − ?
Решение:
$2H_{2}O = 2H_{2} + O_{2}$
n ($O_{2}$) = V : $V_{m}$ = 89,6 л : 22,4 л/моль = 4 моль
n ($H_{2}O$) = 2 * n ($O_{2}$) = 2 * 4 моль = 8 моль
m ($H_{2}O$) = M * n = 18 г/моль * 8 моль = 144 г
Ответ: m ($H_{2}O$) = 144 г
Номер №7
В лаборатории необходимо заполнить банку объемом 1,5 л кислородом. Можно ли это сделать, если имеется всего 15,8 г $KMnO_{4}$?
Решение
Дано:
V ($O_{2}$) = 1,5 л
m ($KMnO_{4}$) = 15,8 г
Найти:
V ($O_{2}$) − ?
Решение:
$2KMnO_{4} = 2K_{2}MnO_{4} + MnO_{2} + O_{2}$
M ($KMnO_{4}$) = 39 + 55 + 16 * 4 = 158 г/моль
n ($KMnO_{4}$) = m : M = 15,8 г : 158 г/моль = 0,1 моль
n ($O_{2}$) = $\frac{1}{2}$ * n ($KMnO_{4}$) = $\frac{1}{2}$ * 0,1 моль = 0,05 моль
V ($O_{2}$) = n * $V_{m}$ = 0,05 моль * 22,4 л/моль = 1,12 л
Ответ: если имеется всего 15,8 г $KMnO_{4}$, кислорода не хватит для заполнения банки объемом 1,5 л Реакции соединения. Часть 1
-
Реакции соединения. Часть 1. Номер №1
Реакции соединения − это "химический антоним" реакции разложения.
Решение
Реакции соединения − это "химический антоним" реакции разложения.
Номер №2
Запишите признаки реакции соединения:
− _
− _
− _
Решение
Запишите признаки реакции соединения:
− в реакцию вступают два или более веществ;
− в результате реакции образуется одно сложное вещество;
− большинство реакций по тепловому эффекту экзотермические.
Номер №3
На основании выделенных признаков дайте определение реакций соединения.
Реакции соединения − _
Решение
Реакции соединения − это реакции, в результате которых из двух или более веществ образуется одно сложное.
Номер №4
Цепочка переходов − это условная запись формул веществ, последовательно превращающихся друг в друга в результате _ _ _ _ _ _ _ _ _ _ реакций. Число этих превращений соответствует числу _ _ _ _ _ _ _ в цепочке переходов. Цепочка переходов отражает единую природу различных химических веществ, образованных одним химическим элементом, поэтому ее также называют _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Цепочка превращений:
$Li →$ _ _ _ _ $→ LiOH$ − это генетический ряд _ _ _ _ _ .
Цепочка превращений:
_ $→ P_{2}O_{5} →$ _ _ _ _ _ − это генетический ряд _ _ _ _ _ _ _.
Решение
Цепочка переходов − это условная запись формул веществ, последовательно превращающихся друг в друга в результате химических реакций. Число этих превращений соответствует числу стрелок в цепочке переходов. Цепочка переходов отражает единую природу различных химических веществ, образованных одним химическим элементом, поэтому ее также называют генетической связью.
Цепочка превращений:
$Li → Li_{2}O → LiOH$ − это генетический ряд лития.
Цепочка превращений:
$P → P_{2}O_{5} → H_{3}PO_{4}$ − это генетический ряд фосфора.
Номер №5
По направлению протекания реакции делят на:
Решение
По направлению протекания реакции делят на: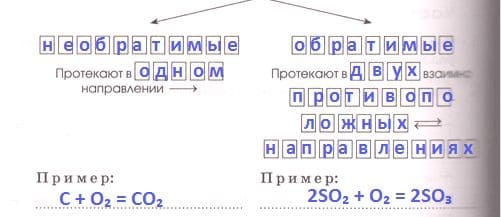
Часть 2
-
Часть 2. Номер №1
Запишите уравнения химических реакций:
1) между алюминием и хлором с образованием хлорида алюминия _
2) между углеродом и алюминием с образованием карбида алюминия _
3) между оксидом азота (II) и кислородом с образованием оксида азота (IV) _
4) между оксидом азота (V) и водой с образованием азотной кислоты _
Все указанные реакции являются реакциями _ _ _ _ _ _ _ _ _ _ .
Решение
Уравнения химических реакций:
1) между алюминием и хлором с образованием хлорида алюминия
$2Al + 3Cl_{2} = 2AlCl_{3}$
2) между углеродом и алюминием с образованием карбида алюминия
$3C + 4Al = Al_{4}C_{3}$
3) между оксидом азота (II) и кислородом с образованием оксида азота (IV)
$2NO + O_{2} = 2NO_{2}$
4) между оксидом азота (V) и водой с образованием азотной кислоты
$N_{2}O_{5} + H_{2}O = 2HNO_{3}$
Все указанные реакции являются реакциями соединения.
Номер №2
Напишите уравнения химических реакций между хлором:
1) и натрием _
2) и кальцием _
3) и железом с образованием хлорида железа (III) _
Решение
Уравнения химических реакций между хлором:
1) и натрием $2Na + Cl_{2} = 2NaCl$
2) и кальцием $Ca + Cl_{2} = CaCl_{2}$
3) и железом с образованием хлорида железа (III) $2Fe + 3Cl_{2} = 2FeCl_{3}$
Номер №3
Дайте характеристику реакции
$...SO_{2} + O_{2}$ $\overset{V_{2}O_{5}}{⇔}$ $... SO_{3}$ + Q
1) по числу и составу исходных веществ и продуктов реакции _
2) по тепловому эффекту _
3) по направлению протекания _
4) по участию катализатора _
Решение
$2SO_{2} + O_{2}$ $\overset{V_{2}O_{5}}{⇔}$ $2SO_{3}$ + Q
1) по числу и составу исходных веществ и продуктов реакции − реакция соединения
2) по тепловому эффекту − экзотермическая
3) по направлению протекания − обратимая
4) по участию катализатора − каталитическая
Номер №4
Дайте характеристику реакции
$...HBr ⇔ H_{2} + Br_{2}$ − Q
1) по числу и составу исходных веществ и продуктов реакции
2) по тепловому эффекту
3) по направлению протекания
4) по участию катализатора
Решение
$2HBr ⇔ H_{2} + Br_{2}$ − Q
1) по числу и составу исходных веществ и продуктов реакции − реакция разложения
2) по тепловому эффекту − эндотермическая
3) по направлению протекания − обратимая
4) по участию катализатора − некаталитическая
Номер №5
Запишите уравнения реакций соединения, протекающих согласно схемам:
1) $C → CO → CO_{2}$
2) $Ba → BaO → Ba(OH)_{2}$
3) $S → SO_{2} → SO_{3} → H_{2}SO_{4}$
Решение
1) $C → CO → CO_{2}$
$2C + O_{2} = 2CO$
$2CO + O_{2} = 2CO_{2}$
2) $Ba → BaO → Ba(OH)_{2}$
$2Ba + O_{2} = 2BaO$
$BaO + H_{2}O = Ba(OH)_{2}$
3) $S → SO_{2} → SO_{3} → H_{2}SO_{4}$
$S + O_{2} = SO_{2}$
$2SO_{2} + O_{2} = 2SO_{3}$
$SO_{3} + H_{2}O = H_{2}SO_{4}$
Номер №6
Расставьте коэффициенты в уравнениях реакций, схемы которых:
1) $...NO_{2} + ... H_{2}O + O_{2} → HNO_{3}$
2) $... Fe + ... H_{2}O + O_{2} → ... Fe(OH)_{3}$
3) $...HNO_{2} → HNO_{3} + ... NO + H_{2}O$
Решение
1) $4NO_{2} + 2H_{2}O + O_{2} = 4HNO_{3}$
2) $4Fe + 6H_{2}O + 3O_{2} = 4Fe(OH)_{3}$
3) $3HNO_{2} = HNO_{3} + 2NO + H_{2}O$
Номер №7
Верны ли следующие суждения?
А. Большинство реакций соединения являются экзотермическими.
Б. При повышении температуры скорость химической реакции увеличивается.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ: _
Решение
Ответ: 1
Номер №8
Рассчитайте объем водорода и массу серы, которые необходимы для образования 85 г сероводорода.
Решение
Дано:
m ($H_{2}S$) = 85 г
Найти:
V ($H_{2}$) − ?
m (S) − ?
Решение:
$H_{2} + S = H_{2}S$
M ($H_{2}S$) = 1 * 2 + 32 = 34 г/моль
n ($H_{2}S$) = m : M = 85 г : 34 г/моль = 2,5 моль
n ($H_{2}$) = n ($H_{2}S$) = 2,5 моль
V ($H_{2}$) = n * $V_{m}$ = 2,5 моль * 22,4 л/моль = 56 л
n (S) = n ($H_{2}S$) = 2,5 моль
m (S) = M * n = 32 г/моль * 2,5 моль = 80 г
Ответ: V ($H_{2}$) = 56 л; m (S) = 80 г Реакции замещения. Часть 1
-
Реакции замещения. Часть 1. Номер №1
Признаки реакций замещения:
− вступают в реакцию два вещества − _ _ _ _ _ _ _ и _ _ _ _ _ _ _;
− образуются в результате реакции также два вещества − новое _ _ _ _ _ _ _ и _ _ _ _ _ _ _ _ _ _ _ _ .
Решение
Признаки реакций замещения:
− вступают в реакцию два вещества − простое и сложное;
− образуются в результате реакции также два вещества − новое простое и новое сложное.
Номер №2
Два правила ряда активности металлов:
$Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, H_{2}, Cu, Hg, Ag, Au$
− металлы, стоящие в ряду активности до _ _, вытесняют его из растворов _ _ _ _ _ _;
− металлы, стоящие в ряду активности до _ _ _ _ _ _ _ _ _ _ _, вытесняют его из растворов _ _ _ _ _.
Решение
Два правила ряда активности металлов:
$Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, H_{2}, Cu, Hg, Ag, Au$
− металлы, стоящие в ряду активности до $H_{2}$, вытесняют его из растворов кислот;
− металлы, стоящие в ряду активности до металла соли, вытесняют его из растворов солей. Часть 2
-
Часть 2. Номер №1
Запишите уравнения реакций замещения.
1) $Zn + HCl → ... + ...$
2) $Al + ... → Al_{2}(SO_{4})_{3} + ...$
3) $... + HBr → MgBr_{2} + ...$
4) $CuCl_{2} + Cr → CrCl_{3} + ...$
5) $Fe_{2}O_{3} + Mg → ... + ...$
Решение
1) $Zn + 2HCl = ZnCl_{2} + H_{2}$
2) $2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}$
3) $Mg + 2HBr = MgBr_{2} + H_{2}$
4) $3CuCl_{2} + 2Cr = 2CrCl_{3} + 3Cu$
5) $Fe_{2}O_{3} + 3Mg = 2Fe + 3MgO$
Номер №2
Запишите уравнения возможных реакций.
1) $HgCl_{2} + Fe →$ _
2) $CuCl_{2} + Al →$ _
3) $AgNO_{3} + Zn →$ _
4) $ZnCl_{2} + Fe →$ _
5) $AgNO_{3} + Au →$ _
6) $Cu + H_{2}SO_{4(разб)} →$ _
7) $Ag + HCl →$ _
Решение
1) $HgCl_{2} + Fe = FeCl_{2} + Hg$
2) $3CuCl_{2} + 2Al = 2AlCl_{3} + 3Cu$
3) $2AgNO_{3} + Zn = Zn(NO_{3})_{2} + 2Ag$
4) $ZnCl_{2} + Fe ↛$
5) $AgNO_{3} + Au ↛$
6) $Cu + H_{2}SO_{4(разб)} ↛$
7) $Ag + HCl ↛$
Номер №3
Напишите уравнения реакций замещения:
1) между алюминием и оксидом меди (II) _
2) между оксидом кремния (IV) и магнием _
3) между бромидом хрома (III) и хлором _
Решение
Уравнения реакций замещения:
1) между алюминием и оксидом меди (II)
$2Al + 3CuO = Al_{2}O_{3} + 3Cu$
2) между оксидом кремния (IV) и магнием
$SiO_{2} + 2Mg = 2MgO + Si$
3) между бромидом хрома (III) и хлором
$2CrBr_{3} + 3Cl_{2} = 2CrCl_{3} + 3Br_{2}$
Номер №4
Допишите уравнение реакции $Zn + H_{2}SO_{4} → ... + ... $ + Q
Дайте характеристику записанной реакции по следующим признакам:
1) число и состав исходных веществ и продуктов реакции _
2) тепловой эффект _
3) направление протекания _
4) участие катализатора _
Решение
$Zn + H_{2}SO_{4} → ZnSO_{4} + H_{2}$ + Q
1) число и состав исходных веществ и продуктов реакции − реакция замещения
2) тепловой эффект − экзотермическая
3) направление протекания − необратимая
4) участие катализатора − некаталитическая
Номер №5
39 г технического цинка, содержащего 20% примесей, растворили в избытке соляной кислоты. Найдите объем полученного водорода (н.у.) и количество вещества соли.
Решение
Дано:
$m_{тех}$ (Zn) = 39 г
$ω_{прим}$ = 20%
Найти:
V ($H_{2}$) − ?
n ($ZnCl_{2}$) − ?
Решение:
$Zn + 2HCl = ZnCl_{2} + H_{2}$
$ω_{чист}$ = 100% − $ω_{прим}$ = 100% − 20% = 80%
$m_{чист}$ (Zn) = $m_{тех}$ (Zn) * $ω_{чист}$ = 39 г * 0,8 = 31 г
n (Zn) = m : M = 31 г : 65 г/моль = 0,48 моль
n ($ZnCl_{2}$) = n (Zn) = 0,48 моль
n ($H_{2}$) = n (Zn) = 0,48 моль
V ($H_{2}$) = $V_{m}$* n = 22,4 л/моль * 0,48 моль = 10,8 л
Ответ: n ($ZnCl_{2}$) = 0,48 моль; V ($H_{2}$) = 10,8 л
Номер №6
Железо массой 1,12 г полностью прореагировало с раствором сульфата меди (II). Найдите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (II) при этом получилось?
Решение
Дано:
m (Fe) = 1,12 г
Найти:
m (Cu) − ?
n ($FeSO_{4}$) − ?
Решение:
$Fe + CuSO_{4} = FeSO_{4} + Cu$
n (Fe) = m : M = 1,12 г : 56 г/моль = 0,02 моль
n ($FeSO_{4}$) = n (Fe) = 0,02 моль
n (Cu) = n (Fe) = 0,02 моль
m (Cu) = M * n = 64 г/моль * 0,02 моль = 1,28 г
Ответ: n ($FeSO_{4}$) = 0,02 моль; m (Cu) = 1,28 г
Номер №7*
Придумайте рисунки "Взаимодействия различных металлов с соляной кислотой" и "Взаимодействие различных кислот с цинком", иллюстрирующие зависимость скорости протекания реакций от природы металла и кислоты.
Решение
Взаимодействия различных металлов с соляной кислотой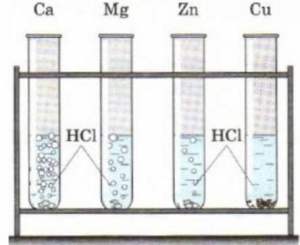
Взаимодействие различных кислот с цинком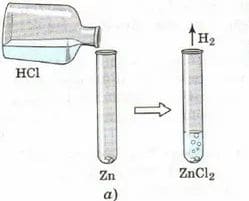
При взаимодействии всех кислот с цинком выделяется водород.
Реакции обмена. Часть 1
-
Реакции обмена. Часть 1. Номер №1
Признаки реакций обмена:
− вступают в реакцию два _ _ _ _ _ _ _ вещества;
− образуются в результате реакции два новых _ _ _ _ _ _ _ вещества.
Решение
Признаки реакций обмена:
− вступают в реакцию два сложных вещества;
− образуются в результате реакции два новых сложных вещества.
Номер №2
Условия протекания реакции обмена до конца:
− _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ или ↓
Например: _
− _ _ _ _ _ _ _ _ _ _ _ _ _ или ↑
Например: _
− _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ или $H_{2}O$
Например: _
Это правило носит название правила Бертолле (= ↓, ↑ или $H_{2}O$).
Решение
Условия протекания реакции обмена до конца:
− выпадение осадка или ↓
Например: $BaCl_{2} + H_{2}SO_{4} = BaSO_{4}↓ + 2HCl$
− образование газа или ↑
Например: $Na_{2}CO_{3} + 2HCl = 2NaCl + H_{2}O + CO_{2}$↑
− образование воды или $H_{2}O$
Например: $NaOH + HCl = NaCl + H_{2}O$
Это правило носит название правила Бертолле (= ↓, ↑ или $H_{2}O$).
Номер №3
Частный случай реакции обмена − это реакция между щелочью и кислотой, которая носит название реакции _ _ _ _ _ _ _ _ _ _ _ _ _.
Например: _
Решение
Частный случай реакции обмена − это реакция между щелочью и кислотой, которая носит название реакции нейтрализации.
Например: $NaOH + HCl = NaCl + H_{2}O$ Часть 2
-
Часть 2. Номер №1
Запишите уравнения реакций обмена между:
1) гидроксидом лития и фосфорной кислотой
2) сульфидом железа (II) и соляной кислотой
3) хлоридом бария и сульфатом натрия
4) азотной кислотой и гидроксидом алюминия
Решение
Уравнения реакций обмена между:
1) гидроксидом лития и фосфорной кислотой
$3LiOH + H_{3}PO_{4} = Li_{3}PO_{4} + 3H_{2}O$
2) сульфидом железа (II) и соляной кислотой
$FeS + 2HCl = FeCl_{2} + H_{2}S$
3) хлоридом бария и сульфатом натрия
$BaCl_{2} + Na_{2}SO_{4} = BaSO_{4} + 2NaCl$
4) азотной кислотой и гидроксидом алюминия
$3HNO_{3} + Al(OH)_{3} = Al(NO_{3})_{3} + 3H_{2}O$
Номер №2
Составьте уравнения реакций, идущих до конца.
1) $...CuO + ... HCl → $ _
2) $... KCl + ... NaNO_{3} →$ _
3) $...Na_{2}CO_{3} + ... HCl →$ _
4) $...HF + ...MgCl_{2} →$ _
5) $...Na_{3}PO_{4} + ... BaCl_{2} →$ _
6) $...KBr + ... AlCl_{3} →$ _
Решение
1) $CuO + 2HCl → CuCl_{2} + H_{2}O$
2) $KCl + NaNO_{3} ↛$
3) $Na_{2}CO_{3} + 2HCl → 2NaCl + H_{2}O + CO_{2}$
4) $HF + MgCl_{2} ↛$
5) $2Na_{3}PO_{4} + 3BaCl_{2} → 6NaCl + Ba_{3}(PO_{4})_{2}$
6) $KBr + AlCl_{3} ↛$
Номер №3
Напишите уравнения реакций обмена, протекающих:
1) с выпадением осадка
2) с выделением газа
3) с образованием осадка и выделением газа
4) с образованием воды
5) с образованием воды и осадка
Решение
Уравнения реакций обмена, протекающих:
1) с выпадением осадка
$BaCl_{2} + H_{2}SO_{4} = BaSO_{4} + 2HCl$
2) с выделением газа
$Na_{2}CO_{3} + 2HCl = 2NaCl + H_{2}O + CO_{2}$
3) с образованием осадка и выделением газа
$3Li_{2}S + 2H_{3}PO_{4} = 2Li_{3}PO_{4} + 3H_{2}S$
4) с образованием воды
$NaOH + HCl = NaCl + H_{2}O$
5) с образованием воды и осадка
$Ba(OH)_{2} + H_{2}SO_{4} = BaSO_{4} + 2H_{2}O$
Номер №4
Установите соответствие между типом реакции и уравнением химической реакции.
ТИП ХИМИЧЕСКОЙ РЕАКЦИИ
А) соединения
Б) разложения
В) замещения
Г) обмена
↑↓
УРАВНЕНИЕ РЕАКЦИИ
1) $CaO + SiO_{2} = CaSiO_{3}$
2) $Fe_{2}O_{3} + 2Al = Al_{2}O_{3} + 2Fe$
3) $Fe + 2HCl = FeCl_{2} + H_{2}$
4) $3KOH + H_{3}PO_{4} = K_{3}PO_{4} + 3H_{2}O$
5) $2KClO_{3} = 2KCl + 3O_{2}$
6) $H_{2}SO_{4} + 2RbOH = Rb_{2}SO_{4} + 2H_{2}O$
Ответ:А Б В Г Укажите реакции нейтрализации (цифрами): _
Решение
Ответ:А Б В Г 1 5 2,3 4,6 Укажите реакции нейтрализации (цифрами): 4, 6
Номер №5
Определите массу соли и количество вещества воды, полученных при взаимодействии гидроксида меди (II) с 58,8 г серной кислоты.
Решение
Дано:
m ($H_{2}SO_{4}$) = 58,8 г
Найти:
m ($CuSO_{4}$) − ?
n ($H_{2}O$) − ?
Решение:
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
n ($H_{2}SO_{4}$) = m : M
M ($H_{2}SO_{4}$) = 1 * 2 + 32 + 16 * 4 = 98 г/моль
n ($H_{2}SO_{4}$) = 58,8 г : 98 г/моль = 0,6 моль
n ($CuSO_{4}$) = n ($H_{2}SO_{4}$) = 0,6 моль
m ($CuSO_{4}$) = M * n
M ($CuSO_{4}$) = 64 + 32 + 16 * 4 = 160 г/моль
m ($CuSO_{4}$) = 160 г/моль * 0,6 моль = 96 г
n ($H_{2}O$) = 2 * n ($CuSO_{4}$) = 2 * 0,6 моль =1,2 моль
Ответ: m ($CuSO_{4}$) = 96 г; n ($H_{2}O$) = 1,2 моль
Номер №6
Запишите уравнения реакций со следующими продуктами:
1) нитрат азота, вода и углекислый газ
2) гидроксид железа (III) и хлорид натрия
Решение
Уравнения реакций со следующими продуктами:
1) нитрат азота, вода и углекислый газ
$NaCO_{3} + 2HNO_{3} = NaNO_{3} + H_{2}O + CO_{2}$
2) гидроксид железа (III) и хлорид натрия
$FeCl_{3} + 3NaOH = Fe(OH)_{3} + 3NaCl$
Номер №7
Запишите уравнения 3−4 реакций обмена, в результате которых образуется сульфат железа (II).
Решение
Уравнения реакций обмена, в результате которых образуется сульфат железа (II):
1) $FeS + H_{2}SO_{4} = FeSO_{4} + H_{2}S$
2) $FeO + H_{2}SO_{4} = FeSO_{4} + H_{2}O$
3) $Fe(OH)_{2} + H_{2}SO_{4} = FeSO_{4} + 2H_{2}O$ Типы химических реакций на примере свойств воды. Часть 1
-
Типы химических реакций на примере свойств воды. Часть 1. Номер №1
Реакции разложения воды:
− под действием электрического тока называют _ _ _ _ _ _ _ _ _ _ _ _;
− под действием света называют _ _ _ _ _ _ _ _ _.
Уравнение реакции: _
Решение
Реакции разложения воды:
− под действием электрического тока называют электролизом;
− под действием света называют фотолизом.
Уравнение реакции: $2H_{2}O = 2H_{2} + O_{2}$
Номер №2
Реакции соединения воды с оксидами:
− металлов идут с образованием _ _ _ _ _ _ _, например: _
− неметаллов идут с образованием _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _, например: _
Решение
Реакции соединения воды с оксидами:
− металлов идут с образованием щелочей, например: $Na_{2}O + H_{2}O = 2NaOH$
− неметаллов идут с образованием растворимой кислоты, например: $SO_{3} + H_{2}O = H_{2}SO_{4}$
Номер №3
Реакции замещения водорода в молекуле воды на металл идут с образованием _ _ _ _ _ _:
1) 2M + 2HOH = 2 _ _ _ + _ _ для металлов _ _ группы, например: _
2) M + 2HOH = _ ( _ _ ) _ + _ _ для металлов _ _ _ группы, например: _
Решение
Реакции замещения водорода в молекуле воды на металл идут с образованием водорода:
1) 2M + 2HOH = 2MOH + $H_{2}$ для металлов IA группы, например: $2Na + 2H_{2}O = 2NaOH + H_{2}$
2) M + 2HOH = $M(OH)_{2} + H_{2}$ для металлов IIA группы, например: $Ca + 2H_{2}O = Ca(OH)_{2} + H_{2}$
Номер №4
Реакции обмена − это реакции разложения веществ водой, или реакции _ _ _ _ _ _ _ _ _, например: _
В таблице растворимости такие вещества обозначены знаком _.
Решение
Реакции обмена − это реакции разложения веществ водой, или реакции гидролиза, например: $Al_{4}C_{3} + 12H_{2}O = 4Al(OH)_{3} + 3CH_{4}$
В таблице растворимости такие вещества обозначены знаком −. Часть 2
-
Часть 2. Номер №1
"Химическим антонимом" реакции разложения воды является ее синтез из соответствующих простых веществ. Напишите уравнение этого процесса: _
Придумайте и решите задачу, если известен объем одного из исходных веществ (н.у.), а требуется найти массу воды.
Решение
"Химическим антонимом" реакции разложения воды является ее синтез из соответствующих простых веществ. Напишите уравнение этого процесса: $2H_{2} + O_{2} = 2H_{2}O$
Дано:
V ($H_{2}$) = 10 л
Найти:
m ($H_{2}O$) − ?
Решение:
$2H_{2} + O_{2} = 2H_{2}O$
n ($H_{2}$) = V : $V_{m}$ = 10 л : 22,4 л/моль = 0,45 моль
n ($H_{2}O$) = n ($H_{2}$) = 0,45 моль
M ($H_{2}O$) = 1 * 2 + 16 = 18 г/моль
m ($H_{2}O$) = M * n = 18 г/моль * 0,45 моль = 8,1 г
Ответ: m ($H_{2}O$) = 8,1 г
Номер №2
Запишите уравнения возможных реакций соединения с водой:
1) оксида серы (VI)
2) оксида кремния (IV)
3) оксида азота (V)
4) оксида лития
5) оксида свинца (IV)
6) оксида бария
7) оксида фосфора (V)
8) оксида железа (III)Распределите образовавшиеся гидроксиды на две группы.
Кислородсодержащие кислоты Щелочи Решение
Уравнения возможных реакций соединения с водой:
1) оксида серы (VI) $SO_{3} + H_{2}O = H_{2}SO_{4}$
2) оксида кремния (IV) $SiO_{2} + H_{2}O↛$
3) оксида азота (V) $N_{2}O_{5} + H_{2}O =2HNO_{3}$
4) оксида лития $Li_{2}O + H_{2}O = 2LiOH↛$
5) оксида свинца (IV) $Pb_{2}O_{5} + H_{2}O↛$
6) оксида бария $BaO + H_{2}O = Ba(OH)_ {2}$
7) оксида фосфора (V) $P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
8) оксида железа (III) $Fe_{2}O_{3} + H_{2}O↛$
Распределите образовавшиеся гидроксиды на две группы.Кислородсодержащие кислоты Щелочи $H_{2}SO_{4}$ LiOH $HNO_{3}$ $Ba(OH)_{2}$ $H_{3}PO_{4}$ Номер №3
Запишите уравнения реакций замещения с водой:
1) бария
2) калия
3) железа с образованием оксида железа (III)
4) цинка с образованием его оксида
Решение
Уравнения реакций замещения с водой:
1) бария
$Ba + H_{2}O = 2Ba(OH)_{2} + H_{2}$
2) калия
$2K + 2H_{2}O = 2KOH + H_{2}$
3) железа с образованием оксида железа (III)
$3Fe + 4H_{2}O = Fe_{3}O_{4} + 4H_{2}$
4) цинка с образованием его оксида
$Zn + H_{2}O = ZnO + H_{2}$
Номер №4
Запишите уравнения реакций гидролиза:
1) $Ca_{3}P_{2}$
2) $Al_{4}C_{3}$
3) NaH
Решение
Уравнения реакций гидролиза:
1) $Ca_{3}P_{2} + 6H_{2}O = 3Ca(OH)_{2} + 2PH_{3}$
2) $Al_{4}C_{3} + 12H_{2}O = 4Al(OH)_{3} + 3CH_{4}$
3) $NaH + H_{2}O = NaOH + H_{2}$
Номер №5
Запишите название продуктов гидролиза органических веществ, используя свои знания по теме "Пищеварительная система" из курса биологии.
1) Белки + воды → _ _ _ _ _ _ _ _ _ _ _ _ .
2) Крахмал + вода → _ _ _ _ _ _ _ .
3) Жиры + вода → _ _ _ _ _ _ _ _ + _ _ _ _ _ _ _ _ _ _ _ _ _ .
Решение
1) Белки + воды → аминокислоты.
2) Крахмал + вода → глюкоза.
3) Жиры + вода → глицерин + жирные кислоты.
Номер №6
Найдите массу фосфорной кислоты, которая образуется при растворении в воде 2,5 моль оксида фосфора (V).
Решение
Дано:
n ($P_{2}O_{5}$) = 2,5 моль
Найти:
m ($H_{3}PO_{4}$) − ?
Решение:
$P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
n ($H_{3}PO_{4}$) = 2 * n ($P_{2}O_{5}$) = 2 * 2,5 моль = 5 моль
M ($H_{3}PO_{4}$) = 1 * 3 + 31 + 16 * 4 = 98 г/моль
m ($H_{3}PO_{4}$) = M * n = 98 г/моль * 5 моль = 490 г
Ответ: m ($H_{3}PO_{4}$) = 490 г
Номер №7
Найдите массу щелочи, которая образуется при растворении в воде 1,5 моль натрия.
Решение
Дано:
n (Na) = 1,5 моль
Найти:
m (NaOH) − ?
Решение:
$2Na + 2H_{2}O = 2NaOH + H_{2}$
n (NaOH) = n (Na) = 1,5 моль
M (NaOH) = 23 + 16 + 1 = 40 г/моль
m (NaOH) = M * n = 40 г/моль * 1,5 моль = 60 г
Ответ: m (NaOH) = 60 г Растворы. Растворение. Часть 1
-
Растворы. Растворение. Часть 1. Номер №1
Растворы − это _
Решение
Растворы − это гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия.
Номер №2
Решение
Номер №3
Гидратация − это _
Кристаллогидраты − это _
Например:
1) медный купорос − _ _ _ _ _ * 5 _ _ _;
2) _ − $Na_{2}CO_{3} * 10H_{2}O$.
Решение
Гидратация − это присоединение воды к первичным минералам горных пород.
Кристаллогидраты − это кристаллы, содержащие молекулы воды.
Например:
1) медный купорос − $CuSO_{4} * 5H_{2}O$;
2) кристаллическая сода − $Na_{2}CO_{3} * 10H_{2}O$.
Номер №4
Дайте определение каждого типа растворов.
1) _
2) _
3) _
Решение
1) Насыщенный раствор − это раствор, в котором при данной температуре вещество больше не может растворяться.
2) Ненасыщенный раствор − это раствор, в котором растворенного вещества меньше, чем в насыщенном растворе.
3) Пересыщенный раствор − это раствор, в котором растворенного вещества больше, чем в насыщенном растворе. Часть 2
-
Часть 2. Номер №1
Подпишите схему "Значение растворов".
Решение
Значение растворов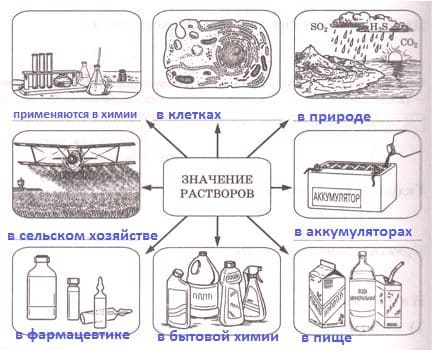
Номер №2
Заполните таблицу "Теории растворов".Признаки сравнения Физическая теория Химическая теория Сторонники теории Определение раствора Решение
Теории растворовПризнаки сравнения Физическая теория Химическая теория Сторонники теории С.А. Аррениус Д.И. Менделеев Определение растворения Результат диффузии Результат химического взаимодействия Определение раствора Однородная система, состоящая из растворителя и растворённого вещества Однородная система, состоящая из растворителя, растворённого вещества и продуктов их взаимодействия
Номер №3
Сформулируйте основные положения физико−химической теории растворов, которая принята в настоящее время.
Решение
Основные положения физико−химической теории растворов, которая принята в настоящее время:
1) Раствор − это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
2) Растворитель является инертной средой, в которую могут диффундировать частицы растворенного вещества.
Номер №4
Составьте формулы кристаллогидратов.
Образец. На 1 моль сульфата цинка приходится 7 моль воды → формула − $ZnSO_{4} * 7H_{2}O$.
а) Медный купорос (на 1 моль сульфата меди (II) приходится 5 моль воды) _
б) Соль кристаллическая (на 1 моль карбоната катрия приходится 10 моль воды) _
в) Гипс (на 1 моль сульфата кальция приходится 2 моль воды) _
Решение
Формулы кристаллогидратов:
а) Медный купорос (на 1 моль сульфата меди (II) приходится 5 моль воды) → формула − $CuSO_{4} * 5H_{2}O$.
б) Соль кристаллическая (на 1 моль карбоната катрия приходится 10 моль воды) → формула − $Na_{2}CO_{2} * 10H_{2}O$.
в) Гипс (на 1 моль сульфата кальция приходится 2 моль воды) → формула − $CaSO_{4} * 2H_{2}O$.
Номер №5
Заполните текст формулами и названиями соединений, числовыми значениями.
Примечание. Воспользуйтесь данными графиков растворимости веществ (см. рис. 126 в учебнике) и таблицей растворимости.
Растворимость твердых веществ в воде зависит:
1) от температуры:
−растворимость хлорида калия _ при 30℃ _ _ г, а при _ _ ℃ − 50 г;
−растворимость _ _ _ _ _ _ _ _ _ _ _ _ _ при 40℃ 10 г, а при 80℃ − _ _ г;
−растворимость хлорида бария _ при 90℃ _ _ г, а при _ ℃ − 30 г;
2) от природы веществ:
−хорошо растворимые _
−малорастворимые _
−практически нерастворимые _
Решение
Растворимость твердых веществ в воде зависит:
1) от температуры:
−растворимость хлорида калия KCl при 30℃ 40 г, а при 65℃ − 50 г;
−растворимость сульфата калия при 40℃ 10 г, а при 80℃ − 20 г;
−растворимость хлорида бария $BaCl_{2}$ при 90℃ 60 г, а при 0℃ − 30 г;
2) от природы веществ:
−хорошо растворимые − более 1 г на 100 г $H_{2}O$
−малорастворимые − 0,1−1 г наи 100 г $H_{2}O$
−практически нерастворимые − менее 0,1−1 г наи 100 г $H_{2}O$
Номер №6
Установите соответствие между действием, которое нужно совершить для получения раствора, и типом раствора. Из букв, соответствующих правильным ответам, вы составите название раствора сахара в воде: _ _ _ _ _ .Исходный раствор → получаемый раствор Добавить воду Добавить соль Нагреть раствор Охладить раствор Выпарить раствор Ненасыщенный → насыщенный А С Н И Р Ненасыщенный → насыщенный О Е П К У Решение
Название раствора сахара в воде: сироп.Исходный раствор → получаемый раствор Добавить воду Добавить соль Нагреть раствор Охладить раствор Выпарить раствор Ненасыщенный → насыщенный А С Н И Р Ненасыщенный → насыщенный О Е П К У
Номер №7
Растворимость хлорида калия в воде при 60°C равна 50 г. Определите массовую долю соли в растворе, насыщенном при указанной температуре.
Решение
Дано:
m ($CaCl_{2}$) = 50 г
t = 50℃
Найти:
ω − ?
Решение:
Растворимость рассчитывается на 100 г воды, значит $m_{р-ра}$ = 100 г + 50 г = 150 г
ω = $\frac{m_в-ва}{m_р-ра}$ * 100% = 50 г : 150 г * 100% = 33,3%
Ответ: ω = 33,3%
Номер №8
По графику (см. рис. 126 в учебнике) определите растворимость сульфата калия при 80°C. Рассчитайте массовую долю соли в растворе, насыщенном при указанной температуре.
Решение
Дано:
m ($K_{2}SO_{4}$) = 20 г
t = 80℃
Найти:
ω − ?
Решение:
Растворимость рассчитывается на 100 г воды, значит $m_{р-ра}$ = 100 г + 20 г = 120 г
ω = $\frac{m_в-ва}{m_р-ра}$ * 100% = 20 г : 120 г * 100% = 16,7%
Ответ: ω = 16,7%
Номер №9
Навеску 161 г глауберовой соли $Na_{2}SO_{4} * 10H_{2}O$ растворили в 180 л воды. Вычислите массовую долю сульфата натрия в полученном растворе. Сколько ионов каждого вида в нём находится?
Решение
Дано:
m ($Na_{2}SO_{4} * 10H_{2}O$) = 161 г
V ($H_{2}O$) = 180 л
Найти:
ω − ?
N ($Na^{+}$) − ?
N ($SO_{4}^{2-}$) − ?
Решение:
m ($H_{2}O$) = V * ρ = 180 л * 1 кг/л = 180 кг = 180000 г
$m_{р-ра}$ = m ($H_{2}O$) + m ($Na_{2}SO_{4} * 10H_{2}O$) = 180000 г + 161 г = 180161 г
M ($Na_{2}SO_{4} * 10H_{2}O$) = 23 * 2 + 32 + 16 * 4 + 1 * 2 * 10 + 16 * 10 = 322 г/моль
n ($Na_{2}SO_{4} * 10H_{2}O$) = m : M = 161 г/моль : 322 г/моль = 0,5 моль
n ($Na_{2}SO_{4}$) = n ($Na_{2}SO_{4} * 10H_{2}O$) = 0,5 моль
M ($Na_{2}SO_{4}$) = 23 * 2 + 32 + 16 * 4 = 142 г/моль
m ($Na_{2}SO_{4}$) = M * n = 142 г * 0,5 моль = 71 г
ω = m ($Na_{2}SO_{4}$) : $m_{р-ра}$
ω = 71 г : 180161 г * 100% = 0,0394%
n ($Na^{+}$) = 2 * n ($Na_{2}SO_{4}$) = 2 * 0,5 моль = 1 моль
N ($Na^{+}$) = n * $N_{a}$ = 1 моль * $6 * 10^{23}$ ионов/моль = $6 * 10^{23}$ ионов
n ($SO_{4}^{2-}$) = n ($Na_{2}SO_{4}$) = 0,5 моль
N ($SO_{4}^{2-}$) = 0,5 моль * $6 * 10^{23}$ ионов/моль = $3 * 10^{23}$ ионов
Ответ: ω = 0,0394%; N ($Na^{+}$) = $6 * 10^{23}$ ионов; N ($SO_{4}^{2-}$) = $3 * 10^{23}$ ионов
Номер №10
Заполните таблицу "Научные достижения Д.И. Менделеева и С. Аррениуса".Портрет ученого Имя ученого Точка зрения на растворы и растворение Другие научные достижения 

Решение
Научные достижения Д.И. Менделеева и С. АррениусаПортрет ученого Имя ученого Точка зрения на растворы и растворение Другие научные достижения 
Д.И. Менделеев Считал, что растворение − это процесс взаимодействия растворяемого вещества с водой Создание периодической таблицы химических элементов 
С. Аррениус Считал, что растворение − это процесс диффузии Разработал теорию электролитической диссоциации Основные положения теории электролитической диссоциации (ТЭД). Часть 1
-
Основные положения теории электролитической диссоциации (ТЭД). Часть 1. Номер №1
Электролиты − это _
Признаки электролитов:
− состоят из _ _ _ _ _;
− растворяются в _ _ _ _.
Решение
Электролиты − это вещества, которые проводят электрический ток.
Признаки электролитов:
− состоят из ионов;
− растворяются в воде.
Номер №2
Диссоциация − это _
Решение
Диссоциация − это процесс распада вещества на ионы при его растворении либо плавлении.
Номер №3
Основные положения ТЭД.
1) По способности проводить электрический ток в растворах
2) В растворах электролиты _ _ _ _ _ _ _ _ _ _ _ _ на _ _ _ _, т.е. _ _ _ _ _ _ _ _ _ _ _ _. Ионы различают:
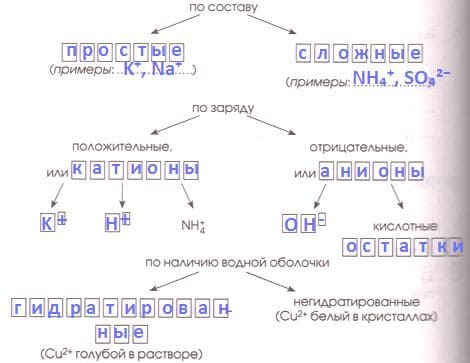
Механизмы диссоциации электролитов с разным типом химической связи
Электролиты с ионной связью (щелочи, соли) Электролиты с ковалентной полярной связью (кислоты)
Ориентация молекул воды вокруг противоположно заряженных ионов электролита Ориентация _
Гидратация − _ Гидратация − _
Ионизация − превращение ковалентной полярной связи в ионную
Диссоциация − _ Диссоциация − _
3) Разные электролиты по−разному диссоциируют на ионы, что характеризует степень электрической диссоциации − _ :
Задание рисунок 3
Задание рисунок 4
α зависит:
− от природы электролита, например: _
− от разбавления (как?) _
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты − это электролиты, которые диссоциируют на _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ и _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Например: $HNO_{3}$ = _ _ + _ _ _ _ ; $H_{2}SO_{4}$ = _ _ _ + _ _ _ _ _
б) Основания − _
Например: KOH = _ _ + _ _ _ ;
$Ba(OH)_ {2}$ = _ _ _ _ + _ _ _ _ .
в) Соли − _
Например: $Fe(NO_{3})_ {3}$ = _ _ _ _ + _ _ _ _ _ ;
$AlCl_{3}$ = _ _ _ _ + _ _ _ _.
Решение
Основные положения ТЭД.
1) По способности проводить электрический ток в растворах
2) В растворах электролиты распадаются на ионы, т.е. диссоциируют. Ионы различают:

Механизмы диссоциации электролитов с разным типом химической связи
Электролиты с ионной связью (щелочи, соли) Электролиты с ковалентной полярной связью (кислоты) Ориентация молекул воды вокруг противоположно заряженных ионов электролита Ориентация молекул воды вокруг электроотрицательного и электроположительного концов молекулы электролита. Гидратация − взаимодействие молекул воды с противоположно заряженными ионами поверхностного слоя электролита. Гидратация − взаимодействие молекул воды с молекулами электролита. Ионизация − превращение ковалентной полярной связи в ионную Диссоциация − распад на катионы металла или аммония и на гидроксид−анионы или анионы кислотного остатка. Диссоциация − распад на катионы водорода и анионы кислотного остатка 3) Разные электролиты по−разному диссоциируют на ионы, что характеризует степень электрической диссоциации − _ :

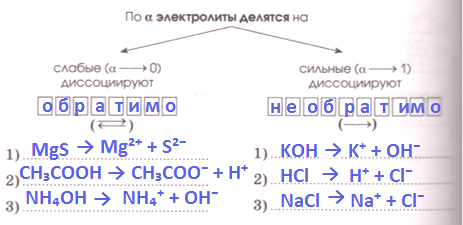
α зависит:
− от природы электролита, например: нерастворимые основания практически не диссоциируют
− от разбавления (как?): степень диссоциации растет по мере разбавления раствора
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты − это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Например: $HNO_{3}$ = $H^{+} + NO_{3}^{-}$; $H_{2}SO_{4}$ = $H^{+} + SO_{4}^{2-}$
б) Основания − это электролиты, которые диссоциируют на катионы металла и гидроксид−анионы.
Например: KOH = $K^{+} + OH^{-}$;
$Ba(OH)_ {2}$ = $Ba^{2+} + 2OH^{-}$.
в) Соли − это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
Например: $Fe(NO_{3})_{3}$ = $Fe^{3+} + 3NO_{3}^{-}$;
$AlCl_{3}$ = $Al^{3+} + 3Cl^{-}$. Часть 2
-
Часть 2. Номер №1
При испытании веществ на электропроводность лампочка загорится, если погрузить электроды:
1) в водный раствор глюкозы
2) в водный раствор гидроксида калия
3) в кристаллы хлорида натрия
Ответ: _
Напишите уравнение реакции диссоциации электролита.
Решение
Ответ: 3
$NaCl = Na^{+} + Cl^{-}$
Номер №2
Наиболее сильным электролитом является:
1) фтороводородная кислота
2) хлороводородная кислота
3) сернистая кислота
4) фосфорная кислота
Ответ: _
Напишите уравнение реакции диссоциации наиболее сильного электролита.
Решение
Ответ: 2
$HCl = H^{+} + Cl^{-}$
Номер №3
К слабым электролитам относится каждое из веществ:
1) хлорид железа (III) и гидроксид лития
2) сероводородная кислота и гидрат аммиака
3) азотистая кислота и гидроксид калия
4) хлорная кислота и гидроксид бария
Ответ: _
Напишите уравнения реакции диссоциации наиболее сильных электролитов.
Решение
Ответ: 2
1) $FeCl_{3} = Fe^{3+} + 3Cl^{-}$
$LiOH = Li^{+} + OH^{-}$
3) $HNO_{2}$ − слабая кислота
$KOH = K^{+} + OH^{-}$
4) $HClO_{4} = H^{+} + ClO_{4}^{-}$
$Ba(OH)_{2} = Ba^{2+} + 2OH^{-}$
Номер №4
Степень электролитической диссоциации уксусной кислоты в растворе уменьшится:
1) при нагревании раствора
2) при разбавлении раствора
3) при добавлении кислоты
4) при добавлении щёлочи
Ответ: _
Решение
Ответ: 3
Номер №5
Наибольшее (суммарное) число ионов образуется при диссоциации 1 моль:
1) нитрата железа (III)
2) карбоната натрия
3) сульфата железа (III)
4) хлорида бария
Ответ: _
Напишите уравнения электролитической диссоциации в молекулярном и ионном видах.
Решение
Ответ: 3
1) $Fe(NO_{3})_{3} = Fe^{3+} + 3NO_{3}^{-}$
2) $Na_{2}CO_{3} = 2Na^{+} + CO_{3}^{2-}$
3) $Fe_{2}(SO_{4})_{3} = 2Fe^{3+} + 3SO_{4}^{2-}$
4) $BaCl_{2} = Ba^{2+} + 2Cl^{-}$
Номер №6
Наибольшее число ионов натрия образуется при диссоциации 1 моль:
1) карбоната натрия
2) нитрата натрия
3) сульфата натрия
4) фосфата натрия
Ответ: _
Напишите уравнения электролитической диссоциации в молекулярном и ионном видах.
Решение
Ответ: 4
1) $Na_{2}CO_{3} = 2Na^{+} + CO_{3}^{2-}$
2) $NaNO_{3} = Na^{+} + NO_{3}^{-}$
3) $Na_{2}SO_{4} = 2Na^{+} + SO_{4}^{2-}$
4) $Na_{3}PO_{4} = 3Na^{+} + PO_{4}^{3-}$
Номер №7
Установите соответствие между названием соли и образующимися в результате диссоциации анионами.
НАЗВАНИЕ СОЛИ
А) сульфат алюминия
Б) хлорид железа (III)
В) нитрат кальция
Г) нитрит калия
↑↓
ОБРАЗУЮЩИЕСЯ АНИОНЫ
1) $3Cl^{-}$
2) $3SO_{4}^{2-}$
3) $NO_{3}^{-}$
4) $2NO_{3}^{-}$
5) $NO_{2}^{-}$
6) $2NO_{2}^{-}$
Ответ:А Б В Г
Решение
Ответ:А Б В Г 2 1 4 5 Оксиды, их классификация и химические свойства. Часть 1
-
Оксиды, их классификация и химические свойства. Часть 1. Номер №1
Оксиды − это _
Решение
Оксиды − это бинарные соединения, степень окисления кислорода в которых равна −2.
Номер №2
Решение
Номер №3
Химические свойства основных и кислотных оксидов.Основные оксиды Кислотные оксиды 1) Взаимодействуют с кислотами с образованием _ _ _ _ и _ _ _ _ : $Na_{2}O + ... → ... NaNO_{3} + ... $ 1) Взаимодействуют с щелочами с образованием _ _ _ _ и _ _ _ _ : $N_{2}O_{5} + ... → ... KNO_{3} + ... $ Полное ионное уравнение: _ Полное ионное уравнение: _ Сокращенное ионное уравнение: _ Сокращенное ионное уравнение: _ 2) Взаимодействуют с кислотными оксидами с образованием _ _ _ _ : $CaO + ... → CaSiO_{3}$ 2) Взаимодействуют с основными оксидами с образованием _ _ _ _ : $SO_{3} + ... → K_{2}SO_{4}$ 3) Взаимодействуют с водой, если образуется _ _ _ _ _ _ : $BaO + ... → ... $ Но! $CuO + H_{2}O$ ≠ 3) Взаимодействуют с водой, если образуется _ _ _ _ _ _ _ _ _ _ _ кислота : $P_{2}O_{5} + ... → ... $ Но! $SiO_{2} + H_{2}O$ ≠ Решение
Химические свойства основных и кислотных оксидов.Основные оксиды Кислотные оксиды 1) Взаимодействуют с кислотами с образованием соли и воды: $Na_{2}O + 2HNO_{3} → 2NaNO_{3} + H_{2}O$ 1) Взаимодействуют с щелочами с образованием соли и воды: $N_{2}O_{5} + 2KOH → 2KNO_{3} + H_{2}O$ Полное ионное уравнение: $Na_{2}O + 2H^{+} + 2NO_{3}^{-} → 2Na^{+} + 2NO_{3}^{-} + H_{2}O$ Полное ионное уравнение: $N_{2}O_{5} + 2K^{+} + 2OH^{-} → 2K^{+} + 2NO_{3}^{-} + H_{2}O$ Сокращенное ионное уравнение: $Na_{2}O + 2H^{+} → 2Na^{+} + H_{2}O$ Сокращенное ионное уравнение: $N_{2}O_{5} + 2OH^{-} → 2NO_{3}^{-} + H_{2}O$ 2) Взаимодействуют с кислотными оксидами с образованием соли: $CaO + SiO_{2} → CaSiO_{3}$ 2) Взаимодействуют с основными оксидами с образованием соли: $SO_{3} + K_{2}O → K_{2}SO_{4}$ 3) Взаимодействуют с водой, если образуется щелочь: $BaO + H_{2}O → Ba(OH)_{2}$ Но! $CuO + H_{2}O$ ↛ 3) Взаимодействуют с водой, если образуется растворимая кислота : $P_{2}O_{5} + 3H_{2}O → 2H_{3}PO_{4}$ Но! $SiO_{2} + H_{2}O$ ↛ Часть 2
-
Часть 2. Номер №1
Основание образуется при взаимодействии с водой оксида, формула которого:
1) $Fe_{2}O_{3}$
2) CuO
3) CaO
4) FeO
Ответ: _
Запишите уравнение реакции.
Решение
Ответ: 3
$CaO + H_{2}O = Ca(OH)_{2}$
Номер №2
С гидроксидом натрия реагирует:
1) CaO
2) $N_{2}O$
3) $SiO_{2}$
4) $P_{2}O_{5}$
Ответ: _
Составьте уравнения возможных реакций.
1) молекулярное уравнение _
полное ионное уравнение _
сокращенное ионное уравнение _
2) молекулярное уравнение _
полное ионное уравнение _
сокращенное ионное уравнение _
Решение
Ответ: 3, 4
1) молекулярное уравнение
$SiO_{2} + 2NaOH = Na_{2}SiO_{3} + H_{2}O$
полное ионное уравнение
$SiO_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SiO_{3}^{2-} + H_{2}O$
сокращенное ионное уравнение
$SiO_{2} + 2OH^{-} = SiO_{3}^{2-} + H_{2}O$
2) молекулярное уравнение
$P_{2}O_{5} + 6NaOH = 2Na_{3}PO_{4} + 3H_{2}O$
полное ионное уравнение
$P_{2}O_{5} + 6Na^{+} + 6OH^{-} = 6Na^{+} + 2PO_{4}^{3-} + 3H_{2}O$
сокращенное ионное уравнение
$P_{2}O_{5} + 6OH^{-} = 2PO_{4}^{3-} + 3H_{2}O$
Номер №3
С соляной кислотой реагирует:
1) оксид железа (III)
2) оксид серы (VI)
3) оксид кремния (IV)
4) оксид меди (II)
Ответ: _
Составьте уравнения возможных реакций.
1) молекулярное уравнение _
полное ионное уравнение _
сокращенное ионное уравнение _
2) молекулярное уравнение _
полное ионное уравнение _
сокращенное ионное уравнение _
Решение
Ответ: 1, 4
1) молекулярное уравнение
$Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$
полное ионное уравнение
$Fe_{2}O_{3} + 6H^{+} + 6Cl^{-} = 2Fe^{3+} + 6Cl^{-} + 3H_{2}O$
сокращенное ионное уравнение
$Fe_{2}O_{3} + 6H^{+} = 2Fe^{3+} + 3H_{2}O$
2) молекулярное уравнение
$CuO + 2HCl = CuCl_{2} + H_{2}O$
полное ионное уравнение
$CuO + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + H_{2}O$
сокращенное ионное уравнение
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
Номер №4
Запишите по одному уравнению реакций соединения и разложения для получения:
1) оксида меди (II)
2) оксида кремния (IV)
Решение
1) $Cu(OH)_{2} = CuO + H_{2}O$
$2Cu + O_{2} = 2CuO$
2) $H_{2}SiO_{3} = SiO_{2} + H_{2}O$
$Si + O_{2} = SiO_{2}$
Номер №5
Какой объём сернистого газа (н. у.) образуется при сгорании 67,2 л сероводорода?
Решение
Дано:
V ($H_{2}S$) = 67,2 л
Найти:
V ($SO_{2}$) − ?
Решение:
$2H_{2}S + 3O_{2} = 2SO_{2} + 2H_{2}O$
n ($H_{2}S$) = n ($SO_{2}$), так как коэффициенты перед этими газами одинаковые.
V ($SO_{2}$) = V ($H_{2}S$) = 67,2 л
Ответ: V ($SO_{2}$) = 67,2 л
Номер №6
Сколько граммов 25%−го раствора гидроксида натрия потребуется для поглощения объёма сернистого газа, найденного при решении задачи 5?
Решение
Дано:
ω (NaOH) = 25%
V ($SO_{2}$) = 67,2 л
Найти:
$m_{р-ра}$ (NaOH) − ?
Решение:
$2NaOH + SO_{2} = Na_{2}SO_{3} + H_{2}O$
n ($SO_{2}$) = V : $V_{m}$ = 67,2 л : 22,4 л/моль = 3 моль
n (NaOH) = 2 * n ($SO_{2}$) = 2 * 3 моль = 6 моль
M (NaOH) = 23 + 16 + 1 = 40 г/моль
m (NaOH) = M * n = 40 г/моль * 6 моль = 240 г
$m_{р-ра}$ (NaOH) = m (NaOH) : ω (NaOH) = 240 г : 0,25 = 960 г
Ответ: $m_{р-ра}$ (NaOH) = 960 г Кислоты, их классификация и химические свойства в свете ТЭД. Часть 1
-
Кислоты, их классификация и химические свойства в свете ТЭД. Часть 1. Номер №1
Кислоты − это _
Решение
Кислоты − это сложные вещества, состоящие из атомов металла и кислотного остатка.
Номер №2
Вспомните классификацию кислот и распределите кремниевую, соляную, азотную, угольную, фосфорную кислоты в соответствующие группы, вписав их формулы.
Решение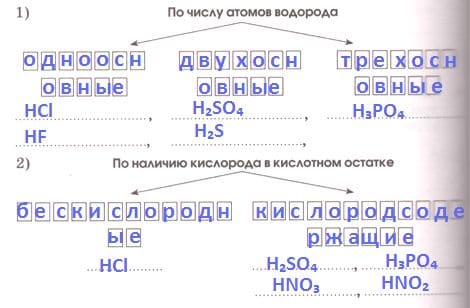
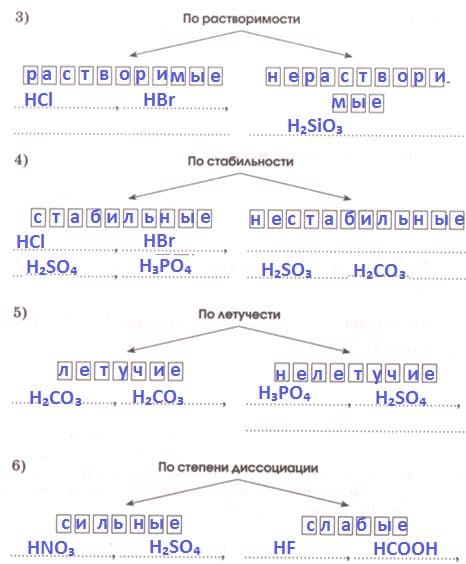
Номер №3
Общие химические свойства кислот.
1) Кислота + _ _ _ _ _ _ → соль + $H_{2}$↑,
если:
− _
− _
− _
− _
2) Кислота + оксид металла → _ + _
3) Кислота + _ → _ + _
Если щелочь, то реакция _ _ _ _ _ _ _ _ _ _ _ _ _ .
4) Кислота + _ → новая _ _ _ _ _ _ _ + новая _ _ _ _,
если:
− _
− _
Решение
Общие химические свойства кислот.
1) Кислота + металл → соль + $H_{2}$↑,
если:
−металл стоит до водорода в ряду напряжений металлов;
−металл не является щелочным или щелочноземельным;
−кислота растворима, но не концентрированная азотная/серная;;
−образуется растворимая соль.
2) Кислота + оксид металла → соль + вода
3) Кислота + основание → соль + вода
Если щелочь, то реакция нейтрализации.
4) Кислота + соль → новая кислота + новая соль,
если:
−образуется осадок/газ;
−кислота сильнее вытесняемой кислоты.
Номер №4
Приведите примеры уравнений реакций, характеризующих общие свойства кислот, в молекулярном, полном ионном и сокращённом ионном видах:
1) $...HCl + ... → ZnCl_{2} + ...$
2) $H_{2}SO_{4} + ... → CuSO_{4} + ...$
3) $HNO_{3} + ... → NaNO_{3} + ...$
4) $H_{2}SO_{4} + ... → BaSO_{4} + ...HCl$
5) $HCl + Fe(OH)_{3} → ... + ...$
6) $HNO_{3} + ... → H_{2}SiO_{3}↓ + ...$
Решение
1) $2HCl + Zn = ZnCl_{2} + H_{2}$
$2H^{+} + 2Cl^{-} + Zn = Zn^{2+} + 2Cl^{-} + H_{2}$
$2H^{+} + Zn = Zn^{2+} + H_{2}$
2) $H_{2}SO_{4} + CuO = CuSO_{4} + H_{2}O$
$2H^{+} + SO_{4}^{2-} + CuO = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$2H^{+} + CuO = Cu^{2+} + H_{2}O$
3) $HNO_{3} + NaOH = NaNO_{3} + H_{2}O$
$H^{+} + NO_{3}^{-} + Na^{+} + OH^{-} = Na^{+} + NO_{3}^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
4) $H_{2}SO_{4} + BaCl_{2} = BaSO_{4} + 2HCl$
$2H^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = BaSO_{4} + 2H^{+} + 2Cl^{-}$
$SO_{4}^{2-} + Ba^{2+} = BaSO_{4}$
5) $3HCl + Fe(OH)_{3} = FeCl_{3} + 3H_{2}O$
$3H^{+} + 3Cl^{-} + Fe(OH)_{3} = Fe^{3+} 3Cl^{-} + 3H_{2}O$
$3H^{+} + Fe(OH)_{3} = Fe^{3+} + 3H_{2}O$
6) $2HNO_{3} + Na_{2}SiO_{3} = H_{2}SiO_{3}↓ + 2NaNO_{3}$
$2H^{+} + 2NO_{3}^{-} + 2Na^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}↓ + 2Na^{+} + 2NO_{3}^{-}$
$2H^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}↓$ Часть 2
-
Часть 2. Номер №1
Соляная кислота взаимодействует со следующими из перечисленных веществ:
медь, магний, оксид меди (II), оксид кремния (IV), сульфат калия, нитрат серебра, карбонат кальция.
Ответ: _
Запишите возможные уравнения реакций в молекулярном и ионном видах.
Решение
Ответ: магний, оксид меди (II), нитрат серебра, карбонат кальция.
1) $Mg + 2HCl = MgCl_{2} + H_{2}$
$Mg + 2H^{+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + H_{2}$
$Mg + 2H^{+} = Mg^{2+} + H_{2}$
2) $CuO + 2HCl = CuCl_{2} + H_{2}O$
$CuO + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
3) $AgNO_{3} + HCl = AgCl + HNO_{3}$
$Ag^{+} + NO_{3}^{-} + H^{+} + Cl^{-} = AgCl + H^{+} + NO_{3}^{-}$
$Ag^{+} + Cl^{-} = AgCl$
4) $CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$
$CaCO_{3} + 2H^{+} + 2Cl^{-} = Ca^{2+} + 2Cl^{-} + H_{2}O + CO_{2}$
$CaCO_{3} + 2H^{+} = Ca^{2+} + H_{2}O + CO_{2}$
Номер №2
Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
$3Ba^{2+} + 2PO_{4}^{3-} = Ba_{3}(PO_{4})_{2}$
Решение
1) $3Ba(OH)_{2} + 2H_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 3H_{2}O$
2) $3Ba(OH)_{2} + 2Na_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 6NaOH$
3) $3BaCl_{2} + 2Na_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 6NaCl$
Номер №3
Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
Решение
1) $Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$
2) $2Fe(OH)_{3} + 3H_{2}SO_{4} = Fe_{2}(SO_{4})_{3} + 3H_{2}O$
3) $Fe(OH)_{3} + 3HNO_{3} = Fe(NO_{3})_{3} + 3H_{2}O$
Номер №4
Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
$CaCO_{3} + 2H^{+} = Ca^{2+} + CO_{2} + H_{2}O$
Решение
1) $CaCO_{3} + 2HCl = CaCl_{2} + CO_{2} + H_{2}O$
2) $CaCO_{3} + H_{2}SO_{4} = CaSO_{4} + CO_{2} + H_{2}O$
3) $CaCO_{3} + 2HNO_{3} = Ca(NO_{3})_{2} + CO_{2} + H_{2}O$
Номер №5
Определите неизвестные вещества и запишите молекулярные и ионные уравнения реакций, протекающих согласно схеме: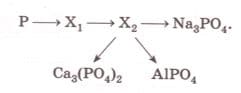
Решение
1) $4P + 5O_{2} = 2P_{2}O_{5}$
2) $P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
3) $H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$
4) $2H_{3}PO_{4} + 3Ca(OH)_{2} = Ca_{3}(PO_{4})_{2} + 6H_{2}O$
5) $2H_{3}PO_{4} + Al_{2}O_{3} = 2AlPO_{4} + 3H_{2}O$
Номер №6
Сколько граммов 30%−й азотной кислоты потребуется для взаимодействия с 250 г известняка, содержащего 20% примесей? Какой объём углекислого газа (н. у.) при этом образуется?
Решение
Дано:
ω ($HNO_{3}$) = 30%
m ($CaCO_{3}$) = 250 г
ω (примесей) = 20%
Найти:
$m_{р-ра}$ ($HNO_{3}$) − ?
V ($CO_{2}$) − ?
Решение:
$CaCO_{3} + 2HNO_{3} = Ca(NO_{3})_{2} + H_{2}O + CO_{2}$
ω (чист) = 100% − 20% = 80%
$m_{чист}$ ($CaCO_{3}$) = 250 г * 0,8 = 200 г
M ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100 г/моль
n ($CaCO_{3}$) = m : M = 200 г : 100 г/моль = 2 моль
n ($HNO_{3}$) = 2 * n ($CaCO_{3}$) = 2 * 2 моль = 4 моль
m ($HNO_{3}$) = M * n
M ($HNO_{3}$) = 1 + 14 + 16 * 3 = 63 г/моль
m ($HNO_{3}$) = 63 г/моль * 4 моль = 252 г
$m_{р-ра}$ ($HNO_{3}$) = m ($HNO_{3}$) : ω ($HNO_{3}$) = 252 г : 0,3 = 840 г
n ($CO_{2}$) = n ($CaCO_{3}$) = 2 моль
V ($CO_{2}$) = $V_{m}$ * n* = 22,4 л/моль * 2 моль = 44,8 л
Ответ: $m_{р-ра}$ ($HNO_{3}$) = 840 г; V ($CO_{2}$) = 44,8 л Основания, их классификация и химические свойства в свете ТЭД. Часть 1
-
Основания, их классификация и химические свойства в свете ТЭД. Часть 1. Номер №1
Основания − это _
Решение
Основания − это сложные вещества, состоящие из катиона металла и гидроксогрупп.
Номер №2
Вспомните классификацию оснований и распределите гидроксид натрия, гидроксид магния, гидроксид кальция, гидроксид аммиака по соответствующим группам, вписав их формулы.
Решение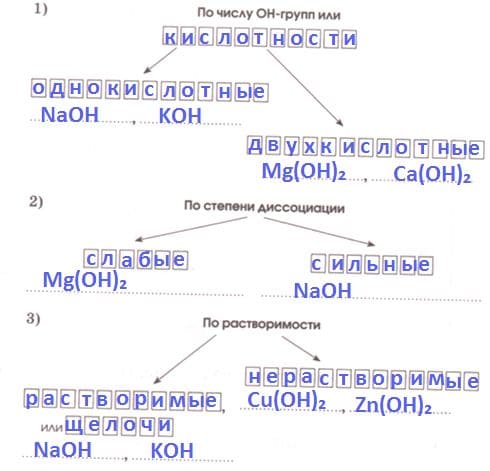
Номер №3
Общие химические свойства оснований.
ЩЁЛОЧИ НЕРАСТВОРИМЫЕ ОСНОВАНИЯ 1) Щёлочь + _ _ _ _ _ _ _ → _ _ _ _ + _ _ _ _ (реакция _ _ _ _ _ _ _ _ _ _ _ _ _ ) 1) Нерастворимое основание + _ _ _ _ _ _ _ → _ _ _ _ + _ _ _ _ 2) Щёлочь + _ _ _ _ _ _ _ _ _ _ _ _ _ _ → _ _ _ _ + _ _ _ _ 2) Разлагается при нагревании: нерастворимое основание → _ _ _ _ _ _ _ _ _ _ _ _ + _ _ _ _
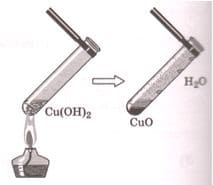
3) Щёлочь + _ _ _ _ → новая _ _ _ _ + новое _ _ _ _ _ _ _ _ _, если выделяется газ ↑ или выпадает осадок ↓ Решение
Общие химические свойства оснований.ЩЁЛОЧИ НЕРАСТВОРИМЫЕ ОСНОВАНИЯ 1) Щёлочь + кислота → соль + вода (реакция нейтрализации 1) Нерастворимое основание + кислота → соль + вода 2) Щёлочь + оксид неметалла → соль + вода 2) Разлагается при нагревании: нерастворимое основание → оксид металла + вода

3) Щёлочь + соль → новая соль + новое основание, если выделяется газ ↑ или выпадает осадок ↓
Номер №4
Приведите примеры уравнений реакций, характеризующих общие свойства оснований, в молекулярном, полном ионном и сокращенном ионном видах.
1) $H_{2}SO_{4} + ...NaOH → ... + ... $
2) $H_{2}SO_{4} + ...Cu(OH)_{2} → ... + ... $
3) $SO_{3} + ... → Na_{2}SO_{4} + ...$
4) $...Fe(OH)_{3} → ... + ...$
5) $...KOH + ... → Cu(OH)_{2}↓ + ...$
6) $Ba(OH)_{2} + ... → BaSO_{4}↓ + NaOH$
7) $NH_{4}Cl + ... → NaCl + NH_{3} + H_{2}O$
Решение
1) $H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O$
$2H^{+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} → 2Na^{+} + SO_{4}^{2-} + 2H_{2}O$
$2H^{+} + 2OH^{-} → 2H_{2}O$
2) $H_{2}SO_{4} + Cu(OH)_{2} → CuSO_{4} + 2H_{2}O$
$2H^{+} + SO_{4}^{2-} + Cu(OH)_{2} → Cu^{2+} + SO_{4}^{2-} + 2H_{2}O$
$2H^{+} + Cu(OH)_{2} → Cu^{2+} + 2H_{2}O$
3) $SO_{3} + 2NaOH → Na_{2}SO_{4} + H_{2}O$
$SO_{3} + 2Na^{+} + 2OH^{-} → 2Na^{+} + SO^{2-}_{4} + H_{2}O$
$SO_{3} + 2OH^{-} → SO^{2-}_{4} + H_{2}O$
4) $2Fe(OH)_{3} → Fe_{2}O_{3} + 3H_{2}O$
$2Fe(OH)_{3} → Fe_{2}O_{3} + 3H_{2}O$
$2Fe(OH)_{3} → Fe_{2}O_{3} + 3H_{2}O$
Ионное уравнение совпадает с молекулярным!
5) $2KOH + CuCl_{2} → Cu(OH)_{2}↓ + 2KCl$
$2K^{+} + 2OH^{-} + Cu^{2+} + 2Cl^{-} → Cu(OH)_{2}↓ + 2K^{+} + 2Cl^{-}$
$2OH^{-} + Cu^{2+} → Cu(OH)_{2}↓$
6) $Ba(OH)_{2} + Na_{2}SO_{4} → BaSO_{4}↓ + 2NaOH$
$2Ba^{2+} + 2OH^{-} + 2Na^{+} + SO_{4}^{2-} → BaSO_{4}↓ + 2Na^{+} + 2OH^{-}$
$2Ba^{2+} + SO_{4}^{2-} → BaSO_{4}↓$
7) $NH_{4}Cl + NaOH → NaCl + NH_{3} + H_{2}O$
$NH_{4}^{+} + Cl^{-} + Na^{+} + OH^{-} → Na^{+} + Cl^{-} + NH_{3} + H_{2}O$
$NH_{4}^{+} + OH^{-} → NH_{3} + H_{2}O$ Часть 2
-
Часть 2. Номер №1
Гидроксид натрия взаимодействует со следующими из перечисленных веществ:
сульфат меди (II), хлорид магния, оксид меди (II), оксид серы (IV), сульфат калия, азотная кислота, хлорид аммония.
Ответ запишите формулами.
Ответ: _
Составьте возможные молекулярные и ионные уравнения реакций.
Решение
Ответ: $CuSO_{4}, MgCl_{2}, SO_{2}, NH_{4}Cl$
1) $2NaOH + CuSO_{4} = Cu(OH)_{2} + Na_{2}SO_{4}$
$2Na^{+} + 2OH^{-} + Cu^{2+} + SO_{4}^{2-} = Cu(OH)_{2} + 2Na^{+} + SO_{4}^{2-}$
$2OH^{-} + Cu^{2+} = Cu(OH)_{2}$
2) $2NaOH + MgCl_{2} = Mg(OH)_{2} + 2NaCl$
$2Na^{+} + 2OH^{-} + Mg^{2+} + 2Cl^{-} = Mg(OH)_{2} + 2Na^{+} + 2Cl^{-}$
$2OH^{-} + Mg^{2+} = Mg(OH)_{2}$
3) $2NaOH + SO_{2} = Na_{2}SO_{3} + H_{2}O$
$SO_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO^{2-}_{3} + H_{2}O$
$SO_{2} + 2OH^{-} = SO^{2-}_{3} + H_{2}O$
4) $NaOH + NH_{4}Cl = NaCl + NH_{3} + H_{2}O$
$NH_{4}^{+} + Cl^{-} + Na^{+} + OH^{-} = Na^{+} + Cl^{-} + NH_{3} + H_{2}O$
$NH_{4}^{+} + OH^{-} = NH_{3} + H_{2}O$
Номер №2
Приведите не менее трёх молекулярных уравнений с участием щёлочи, соответствующих следующему сокращённому ионному:
$3Ba^{2+} + 2PO_{4}^{3-} = Ba_{3}(PO_{4})_{2}$
Решение
1) $3Ba(OH)_{2} + 2H_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 6H_{2}O$
2) $3BaCl_{2} + 2H_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 6HCl$
3) $3BaO + 2H_{3}PO_{4} = Ba_{3}(PO_{4})_{2} + 3H_{2}O$
Номер №3
Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
$H_{2}SiO_{3} + 2OH^{-} = SiO_{3}^{2-} + 2H_{2}O$
Решение
1) $H_{2}SiO_{3} + 2NaOH = Na_{2}SiO_{3} + 2H_{2}O$
2) $H_{2}SiO_{3} + 2KOH = K_{2}SiO_{3} + 2H_{2}O$
3) $H_{2}SiO_{3} + 2RbOH = Rb_{2}SiO_{3} + 2H_{2}O$
Номер №4
Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращенному ионному:
$CO_{2} + 2OH^{-} = CO_{3}^{2-} + H_{2}O$
Решение
1) $CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
2) $CO_{2} + 2KOH = K_{2}CO_{3} + H_{2}O$
3) $CO_{2} + 2RbOH = Rb_{2}CO_{3} + H_{2}O$
Номер №5
Определите неизвестные вещества и запишите молекулярные и ионные уравнения реакций, протекающих согласно схеме: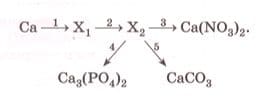
Решение
1) $2Ca + O_{2} = 2CaO$ − ионные уравнения совпадают с молекулярными уравнением
2) $CaO + H_{2}O = Ca(OH)_{2}$ − ионные уравнения совпадают с молекулярными уравнением
3) $Ca(OH)_{2} + 2HNO_{3} = Ca(NO_{3})_{2} + 2H_{2}O$
$Ca^{2+} + 2OH^{-} + 2H^{+} + 2NO_{3}^{-} = Ca^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$OH^{-} + H^{+} = H_{2}O$
4) $3Ca(OH)_{2} + 2Na_{3}PO_{4} = 6NaOH + Ca_{3}(PO_{4})_{2}$
$3Ca^{2+} + 6OH^{-} + 6Na^{+} + 2PO_{4}^{3-} = 6Na^{+} + 6OH^{-} + Ca_{3}(PO_{4})_{2}$
$3Ca^{2+} + 2PO_{4}^{3-} = Ca_{3}(PO_{4})_{2}$
5) $Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
$Ca^{2+} + 2OH^{-} + CO_{2} = CaCO_{3} + H_{2}O$
Номер №6
Вычислите массу (г) 10%−го раствора гидроксида кальция, необходимого для взаимодействия с 67,2 л углекислого газа (н. у.). Сколько граммов осадка образуется?
Решение
Дано:
ω = 10%
V ($CO_{2}$) = 67,2 л
Найти:
$m_{р-ра}$ ($Ca(OH)_{2}$) − ?
m ($CaCO_{3}$) − ?
Решение:
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
n ($CO_{2}$) = V : $V_{m}$ = 67,2 л : 22,4 л/моль = 3 моль
n ($CaCO_{3}$) = n ($CO_{2}$) = n ($Ca(OH)_{2}$) = 3 моль
m ($Ca(OH)_{2}$) = M * n
M ($Ca(OH)_{2}$) = 40 + 16 * 2 + 1 * 2 = 74 г/моль
m ($Ca(OH)_{2}$) = 74 г/моль * 3 моль = 222 г
$m_{р-ра}$ ($Ca(OH)_{2}$) = m ($Ca(OH)_{2}$) : ω = 222 г : 0,1 = 2220 г
m ($CaCO_{3}$) = M * n
M ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100 г/моль
m ($CaCO_{3}$) = 100 г/мол * 3 моль = 300 г
Ответ: $m_{р-ра}$ ($Ca(OH)_{2}$) = 2220 г; m ($CaCO_{3}$) = 300 г Соли, их классификация и химические свойства в свете ТЭД. Часть 1
-
Соли, их классификация и химические свойства в свете ТЭД. Часть 1. Номер №1
Соли − это _
Решение
Соли − это сложные вещества, состоящие из катиона метала и кислотного остатка.
Номер №2
Классификация солейНормальные, или _ _ _ _ _ _ _ , − продукты _ _ _ _ _ _ _ замещения атомов _ _ _ _ _ _ _ _ в кислоте на металл. Кислые − продукты _ Например: $Na_{2}CO_{3}$ Например: $NaHCO_{3}$ − гидрокарбонат натрия; $Ca_{3}(PO_{4})_{2}$ $Ca(H_{2}PO_{4})$ − дигидрофосфат кальция. Решение
Классификация солей
Классификация солейНормальные, или средние , − продукты полного замещения атомов водорода в кислоте на металл. Кислые − продукты продукты неполного замещения атомов водорода в кислоте на металл Например: $Na_{2}CO_{3}$ − карбонат натрия Например: $NaHCO_{3}$ − гидрокарбонат натрия; $Ca_{3}(PO_{4})_{2}$ $Ca(H_{2}PO_{4})$ − дигидрофосфат кальция.
Номер №3
Химические свойства солей.
1) Соль + кислота → _ + _ , если образуется ↓ или ↑. Приведите примеры для каждого случая, напишите молекулярное и ионные уравнения реакций:
а) _
б) _
2) Соль + щёлочь ⟶ _ + _ , если образуется ↓ или ↑. Приведите примеры для каждого случая, напишите молекулярное и ионные уравнения реакций:
а) _
б) _
3) Соль + металл ⟶ новая соль + металл исходной соли, если:
− металл стоит в ряду напряжений до _ _ ;
− обе соли растворимы.
Например:
а) $CuSO_{4} + Fe $ = _ + _ молекулярное уравнение
_ полное ионное уравнение
_ сокращённое ионное уравнение
б) $HgCl_{2} + Cu$ = _ + _ молекулярное уравнение
_ полное ионное уравнение
_ сокращённое ионное уравнение
Но! $Cu + ZnCl_{2}$ ≠
$Pb + CuSO_{4}$ ≠
4) Соль + соль ⟶ две новые соли, если образуется ↓.
Например:
а) $BaCl_{2} + _ = BaSO_{4}$ + _ молекулярное уравнение
_ полное ионное уравнение
_ сокращённое ионное уравнение
б) $BaCl_{2} + _ = AgCl$ + _ молекулярное уравнение
_ полное ионное уравнение
_ сокращённое ионное уравнение
Решение
Химические свойства солей.
1) Соль + кислота → соль + кислота, если образуется ↓ или ↑. Приведите примеры для каждого случая, напишите молекулярное и ионные уравнения реакций:
а) $CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$
б) $BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO_{4}$
2) Соль + щёлочь ⟶ соль + основание, если образуется ↓ или ↑. Приведите примеры для каждого случая, напишите молекулярное и ионные уравнения реакций:
а) $Na_{2}SO_{4} + Ba(OH)_{2} = 2NaOH + BaSO_{4}$
б) $CaCl_{2} + Na_{2}CO_{3} = 2NaCl + CaCO_{3}$
3) Соль + металл ⟶ новая соль + металл исходной соли, если:
– металл стоит в ряду напряжений до $H_{2}$;
– обе соли растворимы.
Например:
а) $CuSO_{4} + Fe = Cu + FeSO_{4}$ молекулярное уравнение
$Cu^{2+} + SO_{4}^{2-} + Fe = Cu + Fe^{2+} + SO_{4}^{2-}$ полное ионное уравнение
$Cu^{2+} + Fe = Cu + Fe^{2+}$ сокращённое ионное уравнение
б) $HgCl_{2} + Cu = CuCl_{2} + Hg$ молекулярное уравнение
$Hg^{2+} + 2Cl^{-} + Cu = Cu^{2+} + 2Cl^{-} + Hg$ полное ионное уравнение
$Hg^{2+} + Cu = Cu^{2+} + Hg$ сокращённое ионное уравнение
Но! $Cu + ZnCl_{2}$ ≠
$Pb + CuSO_{4}$ ≠
4) Соль + соль ⟶ две новые соли, если образуется ↓.
Например:
а) $BaCl_{2} + Na_{2}SO_{4} = BaSO_{4} + 2NaCl$ молекулярное уравнение
$Ba^{2+} + 2Cl^{-} + 2Na^{+} + SO_{4}^{2-} = BaSO_{4} + 2Na^{+} + 2Cl^{-}$ полное ионное уравнение
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}$ сокращённое ионное уравнение
б) $BaCl_{2} + 2AgNO_{3} = 2AgCl + Ba(NO_{3})_{2}$ молекулярное уравнение
$Ba^{2+} + 2Cl^{-} + 2Ag^{+} + NO_{3}^{-} = 2AgCl + Ba^{2+} + 2NO_{3}^{-}$ полное ионное уравнение
$Cl^{-} + Ag^{+} = AgCl$ сокращённое ионное уравнение Часть 2
-
Часть 2. Номер №1
Запишите формулы следующих солей:
1) сульфат алюминия
2) гидросульфат алюминия
3) фосфат кальция
4) гидрофосфат кальция
5) дигидрофосфат кальция
6) карбонат калия
7) гидрокарбонат калия
Решение
1) $Al_{2}(SO_{4})_{3}$
2) $Al(HSO_{4})_{3}$
3) $Ca_{3}(PO_{4})_{2}$
4) $CaHPO_{4}$
5) $Ca(H_{2}PO_{4})_{2}$
6) $K_{2}CO_{3}$
7) $KHCO_{3}$
Номер №2
Распределите соли из задания 1 по двум группам:Средние Кислые Решение
Средние Кислые $Al_{2}(SO_{4})_{3}$ $Al(HSO_{4})_{3}$ $Ca_{3}(PO_{4})_{2}$ $CaHPO_{4}$ $K_{2}CO_{3}$ $Ca(H_{2}PO_{4})_{2}$ $KHCO_{3}$ Номер №3
Сульфат железа (II) не может быть получен при взаимодействии:
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) оксида железа (II) и оксида серы (VI)
Ответ: _
Запишите молекулярные и ионные уравнения реакций, с помощью которых можно получить сульфат железа (II).
Решение
Ответ: 3
1) $Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}$
$Fe + 2H^{+} + SO_{4}^{2-} = Fe^{2+} + SO_{4}^{2-} + H_{2}$
$Fe + 2H^{+} = Fe^{2+} + H_{2}$
2) $Fe + CuSO_{4} = FeSO_{4} + Cu$
$Fe + Cu^{2+} + SO_{4}^{2-} = Fe^{2+} + SO_{4}^{2-} + Cu$
$Fe + Cu^{2+} = Fe^{2+} + Cu$
3) $FeO + SO_{3} = FeSO_{4}$
$FeO + SO_{3} = Fe^{2+} + SO_{4}^{2-}$
Номер №4
Веществами, при взаимодействии которых образуется соль, являются:
1) щёлочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Ответ: _
Запишите пример уравнения возможной реакции.
_ молекулярное уравнение
_ полное ионное уравнение
_ сокращенное ионное уравнение
Решение
Ответ: 3
$P_{2}O_{5} + 6NaOH = 2Na_{3}PO_{4} + 3H_{2}O$ молекулярное уравнение
$P_{2}O_{5} + 6Na^{+} + 6OH^{-} = 6Na^{+} + 2PO_{4}^{3-} + 3H_{2}O$ полное ионное уравнение
$P_{2}O_{5} + 6OH^{-} = 2PO_{4}^{3-} + 3H_{2}O$ сокращенное ионное уравнение
Номер №5
Запишите уравнения реакций, подтверждающих ионный состав хлорида кальция:
1) качественная реакция на $Ca^{2+}$:
_ молекулярное уравнение
_ полное ионное уравнение
_ сокращенное ионное уравнение
2) качественная реакция на $Cl^{-}$:
_ молекулярное уравнение
_ полное ионное уравнение
_ сокращенное ионное уравнение
Решение
1) качественная реакция на $Ca^{2+}$:
$Na_{2}CO_{3} + CaCl_{2} = 2NaCl + CaCO_{3}$ молекулярное уравнение
$2Na^{+} + CO_{3}^{2-} + Ca^{2+} + 2Cl^{-} = 2Na^{+} + 2Cl^{-} + CaCO_{3}$ полное ионное уравнение
$CO_{3}^{2-} + Ca^{2+} = CaCO_{3}$ cокращенное ионное уравнение
2) качественная реакция на $Cl^{-}$:
$AgNO_{3} + HCl = AgCl + HNO_{3}$ молекулярное уравнение
$Ag^{+} + NO_{3}^{-} + H_{+} + Cl^{-} = AgCl + H^{+} + NO_{3}^{-}$ полное ионное уравнение
$Ag^{+} + Cl^{-} = AgCl$ сокращенное ионное уравнение
Номер №6
Запишите по одному уравнению реакций замещения, соединения и обмена, с помощью которых можно получить сульфат магния, в молекулярной и ионной формах.
Решение
Реакция замещения:
1) $Mg + H_{2}SO_{4} = MgSO_{4} + H_{2}$
$Mg + 2H^{+} + SO_{4}^{2-} = Mg^{2+} + SO_{4}^{2-} + H_{2}$
$Mg + 2H^{+} = Mg^{2+} + H_{2}$
Реакция соединения:
2) $MgO + SO_{3} = MgSO_{4}$
$MgO + SO_{3} = Mg^{2+} + SO_{4}^{2-}$
$MgO + SO_{3} = Mg^{2+} + SO_{4}^{2-}$
Реакция обмена:
3) $MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O$
$MgO + 2H^{+} + SO_{4}^{2-} = Mg^{2+} + SO_{4}^{2-} + H_{2}O$
$MgO + 2H^{+} = Mg^{2+} + H_{2}O$
Номер №7
Составьте три молекулярных уравнения реакций между солями, соответствующих следующему сокращённому ионному:
$Zn^{2+} + S^{2-} = ZnS$
Решение
1) $ZnCl_{2} + Na_{2}S = ZnS + 2NaCl$
2) $Zn(NO_{3})_{2} + K_{2}S = ZnS + 2KNO_{3}$
3) $ZnSO_{4} + Na_{2}S = ZnS + Na_{2}SO_{4}$
Номер №8
Вычислите, сколько граммов 10%−х растворов исходных солей потребуется для получения 75 г карбоната кальция.
Решение
Дано:
ω = 10%
$m_{в-ва}$ = 75 г
Найти:
$m_{р-ра}$ − ?
Решение:
$m_{р-ра}$ = $m_{в-ва}$ : ω
$m_{р-ра}$ = 75 г : 0,1 = 750 г
Ответ: $m_{р-ра}$ = 750 г Генетическая связь между классами неорганических соединений. Часть 1.
-
Генетическая связь между классами неорганических соединений. Часть 1. Номер №1
Генетическая связь – это _
Решение
Генетическая связь – это связь между веществами разных классов, основанная на их взаимопревращениях.
Номер №2
Генетический ряд металла объединяет:
– один и тот же элемент−металл;
– вещества разных классов, образованные этим металлом;
– взаимопревращения веществ ряда.
Например: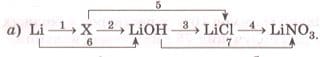
Название и формула вещества, обозначенного X: _
Уравнение реакции, соответствующих приведенным выше превращениям: _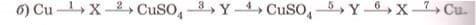
Название и формула вещества, обозначенного X и Y: _
Уравнение реакции, соответствующих приведенным выше превращениям: _
Решение а
Название и формула вещества, обозначенного X: $Li_{2}O$
Уравнение реакции, соответствующих приведенным выше превращениям:
1) $4Li + O_{2} = 2Li_{2}O$
2) $Li_{2}O + H_{2}O = 2LiOH$
3) $LiOH + HCl = LiCl + H_{2}O$
4) $LiCl + AgNO_{3} = LiNO_{3} + AgCl$
5) $Li_{2}O + 2HCl = 2LiCl + H_{2}O$
6) $2Li + 2H_{2}O = 2LiOH + H_{2}$
7) $LiOH + HNO_{3} = LiNO_{3} + H_{2}O$
Решение б
Название и формула вещества, обозначенного X и Y: $CuO, Cu(OH)_{2}$
Уравнение реакции, соответствующих приведенным выше превращениям:
1) $2Cu + O_{2} = 2CuO$
2) $CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
3) $CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
4) $Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
5) $CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
6) $Cu(OH)_{2} = CuO + H_{2}O$
7) $CuO + H_{2} = Cu + H_{2}O$
Номер №3
Генетический ряд неметалла объединяет:
− _
− _
− _
Например:
а) S $\overset{1}{→}$ X $\overset{2}{→}$ $H_{2}SO_{3}$ $\overset{3}{→}$ $Na_{2}SO_{3}$ $\overset{4}{→}$ X
Название и формула вещества, обозначенного X: _
Уравнения реакций, соответствующих приведенным выше превращениям: _
б) Si $\overset{1}{→}$ X $\overset{2}{→}$ $H_{2}SiO_{3}$ $\overset{3}{→}$ $Na_{2}SiO_{3}$ $\overset{4}{→}$ Y $\overset{5}{→}$ X $\overset{6}{→}$ Si
Название и формула вещества, обозначенного X и Y: _
Уравнения реакций, соответствующих приведенным выше превращениям: _
Решение
Генетический ряд неметалла объединяет:
− один и тот же элемент−неметалл;
− вещества разных классов, образованные этим неметаллом;
− взаимопревращения веществ ряда.
Например:
а) S $\overset{1}{→}$ X $\overset{2}{→}$ $H_{2}SO_{3}$ $\overset{3}{→}$ $Na_{2}SO_{3}$ $\overset{4}{→}$ X
Название и формула вещества, обозначенного X: $SO_{2}$ − оксид серы (IV)
Уравнения реакций, соответствующих приведенным выше превращениям:
1) $S + O_{2} = SO_{2}$
2) $SO_{2} + H_{2}O = H_{2}SO_{3}$
3) $H_{2}SO_{3} + 2NaOH = Na_{2}SO_{3} + 2H_{2}O$
4) $Na_{2}SO_{3} + 2HCl = 2NaCl + SO_{2} + H_{2}O$
б) Si $\overset{1}{→}$ X $\overset{2}{→}$ $H_{2}SiO_{3}$ $\overset{3}{→}$ $Na_{2}SiO_{3}$ $\overset{4}{→}$ Y $\overset{5}{→}$ X $\overset{6}{→}$ Si
Название и формула вещества, обозначенного X и Y: _
Уравнения реакций, соответствующих приведенным выше превращениям:
1) $Si + O_{2} = SiO_{2}$
2) оксид кремния не реагирует с водой; ошибка в условии! Часть 2.
-
Часть 2. Номер №1
В схеме превращений
$SO_{2}$ $\overset{X_{1}}{→}$ $SO_{3}$ $\overset{X_{2}}{→}$ $H_{2}SO_{4}$ $\overset{X_{3}}{→}$ $Na_{2}SO_{4}$
веществами $X_{1}, X_{2}, X_{3}$ являются соответственно:
1) $O_{2}, H_{2}O, NaOH$
2) $NO_{2}, H_{2}, NaCl$
3) $O_{2}, H_{2}O, N_{2}$
4) $O_{2}, H_{2}, NH_{3} * H_{2}O$
Запишите уравнения реакций, соответствующих приведенным выше превращениям: _
Генетический ряд какого химического элемента предложен в этом задании?
Ответ: _
Решение
Ответ: 1
$2SO_{2} + O_{2} = 2SO_{3}$
$SO_{3} + H_{2}O = H_{2}SO_{4}$
$H_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2H_{2}O$
В этом задании предложен генетический ряд серы.
Номер №2
В цепочке превращений
S $\overset{1}{→}$ $X_{1}$ $\overset{2}{→}$ $SO_{3}$ $\overset{3}{→}$ $X_{2}$ $\overset{4}{→}$ $CuSO_{4}$ $\overset{5}{→}$ $X_{3}$ $\overset{6}{→}$ CuO $\overset{7}{→}$ Cu
веществами $X_{1}, X_{2}, X_{3}$ являются соответственно:
1) $H_{2}S, H_{2}SO_{4}, Cu(OH)_{2}$
2) $FeS, H_{2}SO_{4}, Cu(OH)_{2}$
3) $SO_{2}, H_{2}SO_{4}, CuCl_{2}$
4) $SO_{2}, H_{2}SO_{4}, Cu(OH)_{2}$
Уравнения реакций, соответствующих приведенным выше превращениям: _
Генетические ряды каких химических элементов предложены в этом задании?
Ответ: _
Решение
Ответ: 4
$S + O_{2} = SO_{2}$
$2SO_{2} + O_{2} = 2SO_{3}$
$SO_{3} + H_{2}O = H_{2}SO_{4}$
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}$
$Cu(OH)_{2} = CuO + H_{2}O$
$CuO + H_{2} = Cu + H_{2}O$
В этом задании предложены генетические ряды серы и меди.
Номер №3
В цепочке превращений
Ca $\overset{1}{→}$ $X_{1}$ $\overset{2}{→}$ $Ca(OH)_{2}$ $\overset{3}{→}$ $X_{2}$ $\overset{4}{→}$ CaO $\overset{5}{→}$ $X_{3}$ $\overset{6}{→}$ AgCl
веществами $X_{1}, X_{2}, X_{3}$ являются соответственно:
1) $CaO, CaCO_{3}, CaCl_{2}$
2) $CaSO_{4}, CaCO_{3}, CaCl_{2}$
3) $CaO, CaSO_{4}, CaCl_{2}$
4) $CaO, Ca(HCO_{3})_{2}, CaCO_{3}$
Уравнения реакций, соответствующих приведенным выше превращениям: _
Какое соединение выпадает из общего генетического ряда?
Ответ: _
Решение
Ответ: 1
$2Ca + O_{2} = 2CaO$
$CaO + H_{2}O = Ca(OH)_{2}$
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
$CaCO_{3} = CaO + CO_{2}$
$CaO + 2HCl = CaCl_{2} + H_{2}O$
$CaCl_{2} + 2AgNO_{3} = Ca(NO_{3})_{2} + 2AgCl$
Из общего списка выпадает хлорид серебра.
Номер №4
К раствору гидроксида натрия добавили неизвестный раствор голубого цвета. Выпал студенистый осадок ярко−синего цвета. При нагревании последнего цвет изменился на чёрный. К полученной смеси прилили раствор серной кислоты. При нагревании исследуемой смеси образовался прозрачный раствор исходного голубого цвета. Запишите уравнения превращений в молекулярной и ионной формах.
Решение
1) $2NaOH + CuSO_{4} = Cu(OH)_{2} + Na_{2}SO_{4}$
$2Na^{+} + 2OH^{-} + Cu^{2+} + SO_{4}^{2-} = Cu(OH)_{2} + 2Na^{+} + SO_{4}^{2-}$
$2OH^{-} + Cu^{2+} = Cu(OH)_{2}$
2) $Cu(OH)_{2} = CuO + H_{2}O$
Ионные уравнения совпадают с молекулярным.
3) $CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
Номер №5
Вычислите массу осадка, который выпадает при сливании 807 г 20%−го раствора нитрата свинца с раствором, содержащим необходимое количество иодида калия. Определите количество иодида калия.
Решение
Дано:
$m_{р-ра}$ ($Pb(NO_{3})_{2}$) = 807 г
ω = 20%
Найти:
m ($PbI_{2}$) − ?
n (KI) − ?
Решение:
$Pb(NO_{3})_{2} + 2KI = PbI_{2} + 2KNO_{3}$
m ($PbI_{2}$) = M * n
M ($PbI_{2}$) = 207 + 127 * 2 = 461 г/моль
n ($PbI_{2}$) = n ($Pb(NO_{3})_{2}$)
n ($Pb(NO_{3})_{2}$) = m : M
m ($Pb(NO_{3})_{2}$) = $m_{р-ра}$ ($Pb(NO_{3})_{2}$) * ω
m ($Pb(NO_{3})_{2}$) = 807 г * 0,2 = 161,4 г
M ($Pb(NO_{3})_{2}$) = 207 + 14 * 2 + 16 * 3 * 2 = 331 г/моль
n ($Pb(NO_{3})_{2}$) = 161,4 г : 331 г/моль = 0,488 моль
n ($PbI_{2}$) = 0,488 моль
m ($PbI_{2}$) = 461 г/моль * 0,488 моль = 225 г
n (KI) = 2 * n ($Pb(NO_{3})_{2}$) = 2* 0,488 моль = 0,98 моль
Ответ: m ($PbI_{2}$) = 225 г; n (KI) = 0,98 моль Окислительно-восстановительные реакции (ОВР). Часть 1
-
Окислительно-восстановительные реакции (ОВР). Часть 1. Номер №1
ОВР − это реакции, в результате которых _
Решение
ОВР − это реакции, в результате которых происходит изменение степени окисления химических элементов.
Номер №2
Восстановитель − это элемент или вещество, _ _ _ _ _ _ _ _ электроны. Само оно при этом _ _ _ _ _ _ _ _ _ _ .
Окислитель − это элемент или вещество, _ _ _ _ _ _ _ _ _ _ _ электроны. Само оно при этом _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Решение
Восстановитель − это элемент или вещество, отдающее электроны. Само оно при этом окисляется.
Окислитель − это элемент или вещество, принимающее электроны. Само оно при этом восстанавливается.
Номер №3
Некоторые активные окислители:
1) галогены: $Г_{2} + 2e → 2Г^{-1}$;
2) кислород: $O_{2} + 4e →2O_{-2}$;
3) азот в азотной кислоте: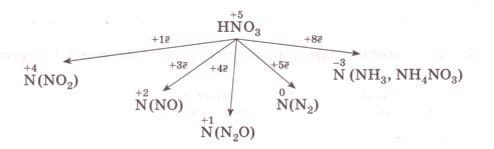
4) сера в серной кислоте:
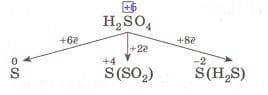
Решение
Некоторые активные окислители:
1) галогены: $Г_{2} + 2e → 2Г^{-1}$;
2) кислород: $O_{2} + 4e →2O_{-2}$;
3) азот в азотной кислоте:
4) сера в серной кислоте:

Номер №4
Некоторые активные восстановители:
1) металлы: $M - ne → M^{+2}$;
2) водород: $H_{2}^{0} - 2e → 2H^{+1}$;
3) азот в аммиаке:
$N^{+2}$ $(NO)\overset{-5e}{←}$ $N^{-}H_{3}$ $\overset{-3e}{→}$ $N^{0} (N_{2})$
4) сера в сероводороде:
$S^{+4}$ $(SO_{2})\overset{-4e}{←}$ $H_{2}S^{-}$ $\overset{-3e}{→}$ $S^{0}$
Решение
Некоторые активные восстановители:
1) металлы: $M - ne → M^{+2}$;
2) водород: $H_{2}^{0} - 2e → 2H^{+1}$;
3) азот в аммиаке:
$N^{+2}$ $(NO)\overset{-5e}{←}$ $N^{-3}H_{3}$ $\overset{-3e}{→}$ $N^{0} (N_{2})$
4) сера в сероводороде:
$S^{+4}$ $(SO_{2})\overset{-4e}{←}$ $H_{2}S^{-2}$ $\overset{-3e}{→}$ $S^{0}$ Часть 2
-
Часть 2. Номер №1
Самым сильным восстановителем среди элементов IVA группы является:
1) германий
2) углерод
3) кремний
4) свинец
Ответ: _
Обоснуйте свой выбор.
Решение
Ответ: 4, так как восстановительные свойства в группе сверху вниз увеличиваются.
Номер №2
Наиболее слабым окислителем среди элементов VА группы является:
1) мышьяк
2) сурьма
3) азот
4) фосфор
Ответ: _
Обоснуйте свой выбор.
Решение
Ответ: 2, так как окислительные свойства в группе сверху вниз уменьшаются.
Номер №3
Окислительная активность галогенов возрастает от иода к фтору, потому что:
1) радиус атомов галогенов не изменяется
2) уменьшается их электроотрицательность
3) увеличивается радиус атомов галогенов
4) увеличивается их электроотрицательность
Ответ: _
Решение
Окислительная активность галогенов возрастает от иода к фтору, потому что увеличивается их электроотрицательность.
Ответ: 4
Номер №4
Максимальное значение степени окисления хлор проявляет в соединении, формула которого:
1) NaCl
2) $KClO_{3}$
3) $Cl_{2}O_{7}$
4) KClO
Ответ: _
Решение
Максимальное значение степени окисления хлор проявляет в соединении, формула которого $Cl_{2}O_{7}$.
Ответ: 3
Номер №5
Наименьшую степень окисления сера проявляет:
1) в сульфате калия _
2) в сульфите калия _
3) в сульфиде калия _
4) в гидросульфите калия _
Ответ: _
Решение
1) в сульфате калия $K_{2}S^{+6}O_{4}$
2) в сульфите калия $K_{2}S^{+4}O_{3}$
3) в сульфиде калия $K_{2}S^{-2}$
4) в гидросульфате калия $KHS^{+6}O_{4}$
Ответ: 3
Номер №6
Наименьшую степень окисления хром имеет в соединении:
1) $Cr_{2}O_{3}$
2) $CrO_{3}$
3) $K_{2}CrO_{4}$
4) $K_{2}Cr_{2}O_{7}$
Ответ: _
Решение
1) $Cr_{2}^{+3}O_{3}$
2) $Cr^{+6}O_{3}$
3) $K_{2}Cr^{+6}O_{4}$
4) $K_{2}Cr^{+6}_{2}O_{7}$
Ответ: 1
Номер №7
Окислительно−восстановительная реакция возможна между:
1) CaO и $H_{2}O$
2) CuO и $HNO_{3}$
3) $CaCO_{3}$ и HCl
4) CuO и C
Ответ: _
Запишите уравнение ОВР и составьте электронный баланс.
Решение
Ответ: 4
$Cu^{+2}O + C^{0} = Cu^{0} + C^{+2}O$
$Cu^{+2} + 2e = Cu^{0}$ 1 − окислитель
$C^{0} - 2e = C^{+2}$ 1 − восстановитель
Номер №8
Сера проявляет восстановительные свойства в реакции, схема которой:
1) $H_{2}S + KOH = K_{2}S + H_{2}O$
2) $Na_{2}S + Pb(NO_{3})_{2} = PbS + NaNO_{3}$
3) $H_{2}S + O_{2} = SO_{2} + H_{2}O$
4) $Na_{2}S + HCl = H_{2}S + NaCl$
Запишите уравнение искомой ОВР и составьте электронный баланс.
Решение
Ответ: 3
$2H_{2}S^{-2} + 3O^{0}_{2} = 2S^{+4}O_{2} + 2H_{2}O^{-2}$
$S^{-2} - 6e = S^{+4}$ 2 − восстановитель
$O_{2}^{0} + 4e = 2O^{-2}$ 3 − окислитель
Номер №9
Рассмотрите взаимодействие алюминия с соляной кислотой:
– в свете теории электролитической диссоциации
_ молекулярное уравнение
_ полное ионное уравнение
_ сокращённое ионное уравнение
– в свете процессов окисления−восстановления
Решение
– в свете теории электролитической диссоциации
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}$ молекулярное уравнение
$2Al + 6H^{+} + 6Cl^{-} = 2Al^{3+} + 6Cl^{-} + 3H_{2}$ полное ионное уравнение
$2Al + 6H^{+} = 2Al^{3+} + 3H_{2}$ сокращённое ионное уравнение
– в свете процессов окисления−восстановления
$2Al^{0} + 6H^{+1}Cl = 2Al^{+3}Cl_{3} + 3H_{2}^{0}$
$Al^{0} - 3e = Al^{+3}$ 2 − восстановитель
$2H^{+1} + 2e = H_{2}^{0}$ 3 − окислитель
Номер №10
Верны ли следующие суждения?
А. Сероводород проявляет только восстановительные свойства.
Б. Серная кислота проявляет как окислительные, так и восстановительные свойства.
1) оба суждения верны
2) верно только А
3) верно только Б
4) оба суждения неверны
Ответ:_
Решение
Ответ: 2, так как сера в сероводороде проявляет свою низшую степень окисления (−2). Серная кислота проявляет только окислительные свойства, так как имеет серу в максимальной степени окисления равной +6.


