 В 8 классе начинается изучение такого предмета как химия. Предмет весьма интересный, но требующий увлеченности. Ведь в нем много что надо запомнить, чтобы в итоге знать как будут проходить те или иные реакции. В целом сейчас в анонсе к ГДЗ учебника нет смысла говорить об основах химии, так как вам об этом должны рассказывать прежде всего на уроках!
В 8 классе начинается изучение такого предмета как химия. Предмет весьма интересный, но требующий увлеченности. Ведь в нем много что надо запомнить, чтобы в итоге знать как будут проходить те или иные реакции. В целом сейчас в анонсе к ГДЗ учебника нет смысла говорить об основах химии, так как вам об этом должны рассказывать прежде всего на уроках!
Наша задача помочь вам с ответами к домашним работам по учебнику химии за 8 класс, автора Габриелян. Так как мы уже говорили, что это самые основы химии, то и вопросы зачастую туту будут простые, как обычно говорится общие. На забрасывайте изучение даже самого простого, тогда и в будущем будет легче со специализированным сложным!
Пару слово о знаках химических реакций. Итак, для обозначения различных типов реакций используются символы: стрелка - если реакция идет необратимо (образуется газ, осадок или малодиссоциирующее вещество, индикатор меняет цвет), стрелки туда-сюда - когда реакция обратима, = (равно) - в любых случаях при условии соблюдения стехиометрического соотношения. То есть в любых реакциях, где расставлены все коэффициенты, можно использовать равно вместо стрелки или стрелок. В учебнике Габриеляна стрелочка используется только в схемах химических реакций, а когда вы расставите коэффициенты, уже ставите знак =.
Ответы (ГДЗ) к учебнику химия 8 класс Габриелян:
Выбирайте нужную страничку и смотрите ответы!
§1
-
ВВЕДЕНИЕ
§1. Химия - часть естествознания
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
http://examchemistry.com/content/lesson/primenenie/issledovanie.html
https://megaobuchalka.ru/11/61679.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Наблюдение
Наблюдение – это целенаправленное восприятие химических объектов (веществ, их свойств и превращений) с целью их изучения.
Наблюдение является целенаправленным, планомерным, активным методом научного познания: оно ведётся для решения заранее поставленных задач, строго по составленному исследователем плану, согласованному с поставленными задачами и сопровождается активными действиями исследователя. Результаты научных наблюдений фиксируются в виде описания признаков наблюдаемого объекта, таблиц, схем и т.д. Всё это является базисом науки, опираясь на который учёные создают эмпирические обобщения, сравнивают изучаемые объекты по тем или иным признакам, проводят классификацию, выявляют закономерности.
Наблюдения могут быть непосредственными, воспринимаемыми органами чувств человека, и опосредованными, которые проводятся с использованием технических средств наблюдения: микроскопов, телескопов и др.
В процессе наблюдения могут совершаться открытия новых явлений, позволяющих обосновать какую−либо научную гипотезу или подтвердить какое−либо положение известной теории.Из учебника:
"Чтобы наблюдение было плодотворным, необходимо выполнить ряд условий:
1. Четко определить предмет наблюдения, т.е. то, на что будет обращено внимание наблюдателя, − конкретное вещество, то или иное превращение вещества и т.д.
2. Знать, зачем проводится наблюдение, т.е. четко сформулировать его цель.
3. Составить план наблюдения. А для этого следует выдвинуть гипотезу (предположение), о возможности происхождения наблюдаемого явления. Гипотеза может быть выдвинута и результате наблюдения, когда получен какой − то результат, который нужно объяснить.
Научное наблюдение проводится в строго контролируемых условиях, которые, при желании наблюдателя можно изменять. Чаще всего такое наблюдение проводится в лаборатории (специализированное помещение)."Из всего сказанного следует, что наблюдение является важнейшим методом научного познания, позволяющим собрать обширную информацию об окружающем мире.
?. Вопросы и задания
1. Как вы считаете, будут ли зависеть ваши успехи в изучении химии от достижений при изучении математики; других естественных дисциплин? Обоснуйте свою точку зрения.
Ответ ©:
Химия тесно связана с математикой тем, что в ней присутствуют математические расчеты, поэтому знание математики повлияет на успехи в изучении химии. Естественные науки также все взаимосвязаны, поскольку изучают окружающий мир, предметы вокруг нас и нас самих, закономерности, происходящие в мире, в том числе и химия.
2. Приведите примеры материальных и знаковых моделей, которыми вы пользовались при изучении:
а) биологии; б) физической географии; в) физики.Ответ ©:
Материальные модели:
а) в биологии: скелет человека, барельефные модели внутреннего строения животных, барельефная модель цветка;
б) физической географии: глобус, макет солнечной системы, макет вулкана;
в) физики: модель парового двигателя, двигателя внутреннего сгорания, маятника.
Знаковые модели:
а) в биологии: схемы классификаций растительного и животного мира, схема фотосинтеза;
б) физической географии: карта полушарий, таблица типов почв, схема строения слоев Земли, схема круговорота воды в природе;
в) физики: графики, формулы.3. Какими универсальными качествами должен владеть ученик, чтобы успешно проводить наблюдение за объектами и процессами в естествознании?
Ответ ©:
Ученик должен обладать внимательностью, терпением, должен уметь проводить наблюдение по четкому плану, выполнять условия наблюдения (см. i №2) уметь делать выводы из наблюдения.
4. Какими личностными качествами должен обладать ученик, чтобы с максимальной пользой для дела (учёбы) получать химическую информацию от общения со специалистами?
Ответ ©:
Ученик должен быть любознательным, уметь слушать, не перебивая, обладать хорошей памятью.
5. Предложите список литературы, которая, на ваш взгляд, поможет глубже и шире изучить удивительную и увлекательную химию. Обменяйтесь списками сайтов и литературы с одноклассниками и после консультации с учителем сформируйте на основе обмена универсальный список этих источников информации. Вклейте его в тетрадь и пополняйте его после изучения каждого параграфа учебника.
Ответ:
Интернет−сайты:
https://ru.wikipedia.org/
https://xumuk.ru/
http://www.hemi.nsu.ru/ (интернет−учебник по химии от А. В. Мануйлова, В. И. Родионова);
https://himi4ka.ru/;
http://www.chem.msu.su/rus/elibrary/.
Литература:
Трифонов Д.Н. Как были открыты химические элементы/ Пособия для учащихся/ Д.Н. Трифонов, В.Д. Трифонов. − М.: Просвещение, 1980. − 224 с.
Френкель Е.Н.: Самоучитель по химии, или Пособие для тех, кто НЕ знает, НО хочет узнать и понять химию. Издательство: Спутник, 2012. − 133 стр. §2
-
§2. Предмет химии. Вещества
Лабораторный опыт №1
Сравнение свойств твёрдых кристаллических веществ и растворов.
Сравните, используя приведённый на с. 10 план, свойства выданных вам в стаканчиках образцов веществ:
вариант 1 − кристаллических сахара и поваренной соли;
вариант 2 − глюкозы и лимонной кислоты.Ответ:
Вариант 1.
Свойства Кристаллический сахар Поваренная соль
Агрегатное
состояние Твёрдое Твёрдое
Цвет Бесцветное Бесцветное
Запах Без запаха Без запаха
Твёрдость
по шкале Мосса 2 2
Физические
свойства Не пластичен Не пластичен
и не эластичен и не эластичен
Растворимость Растворим Растворим
в воде в воде
Температура 186°C 801°C
плавления
Температура
кипения -* 1465 °C
Плотность 1,587 $г/см^3$ 2,165 $г/см^3$
Тепло- и В сухом виде В сухом виде
электро- не проводит не проводит
проводность эл. ток и тепло эл. ток и тепло.
В виде раствора или расплава
обладает тепло − и электропроводностью
*при более высокой температуре сахар карамелизуется, поэтому температуры кипения не имеет.Вариант 2.
Свойства Глюкоза Лимонная кислота
Агрегатное
состояние Твёрдое Твёрдое
Цвет Белый Белый цвет,
имеет блеск
Запах Без запаха Без запаха
Твёрдость по
шкале Мосса 2 2
Физические
свойства Не пластичен Не пластичен
и не эластичен и не эластичен
Растворимость Растворима Растворима
в воде в воде
Температура 146°C 153 °C
плавления
Температура
кипения -* -*
Плотность 1,56 $г/см^3$ 1,66 $г/см^3$
Тепло- и
электро-
проводность Не проводит Не проводит
эл. ток и тепло эл. ток и тепло.
*при плавлении разлагается, поэтому температуры кипения нет.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1.http://www.hemi.nsu.ru/ucheb113.htm
2.https://himi4ka.ru/arhiv−urokov/urok−1−atomy−i−himicheskie−jelementy.html
3.https://himi4ka.ru/arhiv−urokov/urok−3−molekuly−i−prostye−veshhestva.html
4. https://ru.wikipedia.org/wiki/Вещество%28химия%29#:~:text=Вещества%20в%20химии%20принято%20разделять,железо,%20озон,%20алмаз,%20азот,%20…%29
5.https://ru.wikipedia.org/wiki/Химическийэлемент2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Вещества простые и сложные
Простым называют вещество, состоящее из однотипных атомов, то есть образованное одним элементом. Его нельзя разложить на другие вещества.
Простые вещества подразделяют на две группы:
−металлы: натрий, алюминий, марганец, золото, железо и т. д.;
−неметаллы: кислород, озон, водород, хлор, графит и пр.
Если атомы связаны в молекулы, то простое вещество считается соединением (бром, фосфор, большинство газов). В отличие от них, металлы, алмаз, графит, инертные газы – это атомарные вещества.
Понятие простого вещества необходимо отличать от понятия химического элемента. Элемент – это совокупность химически одинаковых атомов. В свободном виде он существует в форме природного или искусственного простого вещества.
Характеристики химического элемента:
− атомный номер;
− относительная атомная масса;
− распространенность;
− изотопный состав;
− валентность;
− химический символ.
Примеры высказываний:
− относительная атомная масса хлора равна 35,5;
− азот входит в состав многих соединений.
Характеристики простых веществ:
− физические свойства (магнитные, оптические, термические и пр.);
− молярная масса;
− растворимость;
− токсичность;
− химическая формула.
Примеры высказываний:
− молекула хлора имеет относительную массу 71;
− азот входит в состав атмосферы.
Сложное вещество построено из химически связанных атомов различных элементов. Получение и разложение сложных веществ осуществляется в химических реакциях. Это отличает их от смесей.
Классификация сложных химических веществ.
Исходя из строения и свойств, выделяют следующие классы сложных соединений:
1. бинарные. Это вещества, образованные двумя элементами: гидриды (CaH2, KH), карбиды (SiC, Mg2C) бескислородные кислоты (соляная HCl, сероводород H2S) и их соли (хлориды, сульфиды и др.).
2. оксиды. Это сложные бинарные вещества, в составе которых есть кислород со степенью окисления (условным зарядом иона) −2. Различают основные K2O, MgO (степень окисления металла +1, +2), кислотные SO3, CO2, CrO3 с неметаллами или металлами в степени окисления от +5 до +7, амфотерные ZnO, Al2O3 и несолеобразующие (CO, SiO, NO и N2O) оксиды.
3. гидроксиды характеризуются составом вида «элемент – группа OH». К этому классу веществ относят:
− кислоты (азотная HNO3, фосфорная H3PO4, серная H2SO4). Образуются в результате взаимодействия кислотных оксидов с водой. Имеют в составе один или несколько атомов водорода, которые могут замещаться атомом металла, и кислотный остаток.
− основания (едкий натр NaOH, гашеная известь Ca(OH)2), образующиеся в реакциях воды с основными оксидами. Растворимые основания (KOH, NaOH) называются щелочами.
− амфотерные гидроксиды способны проявлять и кислотные, и основные свойства.
4. Соли. Это сложные химические вещества с составом типа «металл – кислотный остаток». Соль – продукт реакции между кислотой и основанием. Карбонат калия (поташ) K2(CO)3, сульфат меди (медный купорос) CuSO4 – примеры солей.?. Вопросы и задания
1. Филео (греч.) означает «люблю», фобос − «боюсь». Дайте объяснение терминов «хемофилия» и «хемофобия», отражающих резко противоположное отношение групп людей к химии. Кто из них прав? Обоснуйте свою точку зрения.
Ответ ©:
Хемофилия — «любовь к химии», хемофобия — «боязнь химии». Это две крайности отношения к химии, поэтому моя точка зрения лежит где-то посередине. С одной стороны, без химии невозможна жизнь современного человека, поскольку любое промышленное производство - это химия. Человек научился изготавливать пластмассы из нефти, извлекать металлы из руд, делать лекарства, удобрения, инсектициды. Без всего этого современная жизнь немыслима. С другой стороны, многие продукты и выбросы химической промышленности загрязняют окружающую среду, все больше химических веществ применяется в производстве продуктов питания, а это вредно для здоровья человека.
2. Обязательный атрибут множества детективных произведений — цианистый калий, точнее, цианид калия, который обладает свойством парализовывать нервную систему, приводя тем самым жертву к мгновенной смерти. Приведите примеры свойств других веществ, которые используются в литературных произведениях.
Ответ:
Свойство белого фосфора светиться при окислении кислородом воздуха использовано в детективе Артура Конана Дойла "Собака Баскервилей" , собака светилась из−за того, что она была обмазана белым фосфором с каким−то другим веществом без запаха.
В повести Михаила Афанасьевича Булгакова "Собачье сердце" используется хлороформ в качестве наркоза во время хирургической операции.
В романе Жюль Верна "Таинственный остров" описывается способ получения нитроглицерина, который они использовали для того, чтобы взорвать гранитную скалу. Нитроглицерин, в те времена, широко применялся во взрывотехнике. В чистом виде он очень неустойчив и взрывоопасен.
В романе Александра Дюма "Граф Монте−Кристо" граф Монте−Кристо рассказывает популярный способ убийства с помощью мышьяка, который продавался в малых количествах в аптеках того времени. Мышьяк и все его соединения ядовиты.
В романе Алексея Николаевича Толстого "Гиперболоид инженера Гарина" описан способ получения тетрила, обладающий большой силой взрыва.
В рассказе писателя Николая Носова "Бенгальские огни" рассказывалось о том, как самому сделать бенгальские огни, в рецепте говорилось о ряде веществ: сера, сахар, алюминиевые опилки.
В произведении Владимира Короткевича "Черный замок Ольшанский. Дикая охота короля Стаха" есть эпизод, про пещеру в которую человек войдет и ходит, а собака или кролик погибают через несколько минут. Речь идет об углекислом газе, который собирается внизу пещеры: человеческая голова выше этой зоны, а собачья и кроличья – нет.
В фантастическом романе Александра Богданова "Красная звезда" приведено описание космического корабля, в котором хранились запасы кислорода в виде 25 тонн бертолетовой соли, из которой можно было выделить кислород. При нагревании хлората калия выделяется кислород.
В романе Генри Райдер Хаггарда "Клеопатра" есть следующие строки: "…она вынула из уха одну из тех огромных жемчужин… и… опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа…". Карбонат кальция, из которого состоит жемчужина, реагирует с уксусной кислотой, эта реакция показана в произведении.3. Выпишите отдельно названия веществ и названия тел из приведённого перечня: медь, монета, стекло, стакан, ваза, керамика, проволока, алюминий. Воспользуйтесь подсказкой: к названию тела − существительному – можно подобрать относительное прилагательное, образованное от названия вещества, например: железо и гвоздь − железный гвоздь.
Ответ:
Вещество Тело
Медь Монета
Стекло Стакан
Керамика Ваза
Алюминий Проволока4. Выпишите качественные прилагательные: лёгкий, круглый, длинный, тяжёлый, твёрдый, пахучий, растворимый, увесистый, вогнутый, мягкий, жидкий, прозрачный, − которые могут быть отнесены:
а) к веществам; б) к телам; в) и к телам, и к веществам.Ответ:
Вещества Тела Вещества и тела
Пахучий Круглый Лёгкий
Растворимый Длинный Тяжёлый
Жидкий Увесистый Твёрдый
Прозрачный Вогнутый Мягкий5. Сравните понятия «простое вещество» и «сложное вещество». Найдите сходство и различие.
Ответ:
Сходство состоит в том, что любые вещества состоят из атомов. Но простые вещества образованы атомами одного химического элемента, а сложные вещества образованы атомами разных химических элементов.
6. Определите, какие из веществ, модели молекул которых изображены на рисунке 2 на с.5, относят:
а) к простым веществам; б) к сложным веществам.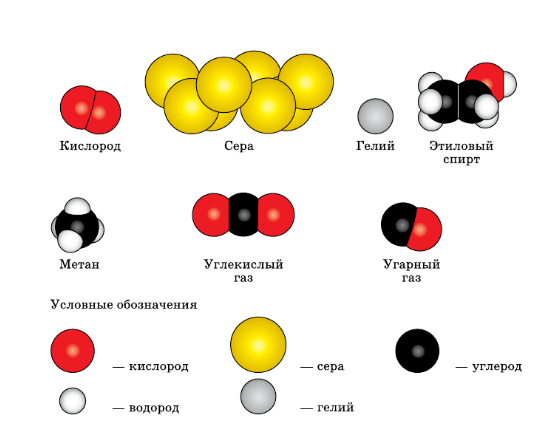
рис. 2. Модели молекул некоторых веществОтвет:
Простые вещества: кислород (O2), сера (S), гелий (He).
Сложные вещества: этиловый спирт (C2H5OH), метан (CH4), углекислый газ (CO2), угарный газ (CO).7. Какое понятие более широкое — «химический элемент» или «простое вещество»? Дайте доказательный ответ.
Ответ ©:
Понятие "химический элемент" более широкое по сравнению с понятием "простое вещество". Один химический элемент может образовывать различные вещества - и простые, и сложные. Например, химический элемент водород может образовать простое вещество водород (Н2) и множество сложных веществ (неорганические кислоты, основания, органические и другие вещества)
8. Укажите, где о кислороде говорится как о химическом элементе, а где − как о простом веществе:
а) кислород мало растворим в воде;
б) молекулы воды состоят из двух атомов водорода и одного атома кислорода;
в) в воздухе содержится 21% кислорода (по объёму);
г) кислород входит в состав углекислого газа.Ответ:
Кислород как химический элемент: б), г).
Кислород O как химический элемент представлен атомами в составе воды H2O, углекислого газа СO2.
Кислород как простое вещество: а), в).
Кислород O2 как простое вещество − газ, плохо растворимый в воде, имеет объёмную долю 21% в атмосферном воздухе.9. Укажите, где о водороде говорится как о простом веществе, а где − как о химическом элементе:
а) водород входит в состав большинства органических соединений;
б) водород − самый лёгкий газ;
в) водородом заполняют воздушные шары;
г) молекула метана содержит четыре атома водорода.Ответ:
Водород как химический элемент: а), г).
Водород Н как химический элемент представлен атомами в составе молекул метана (CН4) и других органический соединений.
Водород как простое вещество: б), в).
Водород Н2 как простое вещество − газ.10. Рассмотрите связь между свойствами вещества и его применением на примере:
а) стекла;
б) полиэтилена;
в) сахара;
г) железа.Ответ:
а) Свойства стекла:
− Прозрачность, поэтому его применяют для изготовления оптических приборов, оконных стекол, изготовления посуды, в том числе лабораторной, оптического волокна.
− Низкая теплопроводность, поэтому его применяют для изготовления утеплителей (пеностекло, стекловата).
− Химическая инертность, поэтому его применяют для изготовления лабораторной посуды и оборудования, остекловывания радиоактивных отходов.
б) Свойства полиэтилена:
− Прозрачность и эластичность, поэтому его применяют для производства плёнки, упаковки.
− Амортизационность, поэтому его применяют для изготовления тары (бутылки, канистры и т. д.), бронежилетов.
− Химическая инертность в отношении щелочей и солей, поэтому его применяют для изготовления упаковки щелочесодержащих продуктов.
в) Сахар растворим в воде, имеет сладкий вкус, съедобен, поэтому его применяют в пищевой промышленности.
г) Свойства железа:
− Распространенность в земной коре, дешевизна, ковкость, металлический блеск. Из−за совокупности этих свойств железо является основным компонентом сталей и чугунов.
− Ферромагнитные свойства, поэтому его применяют в электротехнике для изготовления магнитопроводов, трансформаторов и электродвигателей. §3
-
§3. Превращения веществ. Роль химии в жизни человека
Лабораторный опыт №2
Сравнение скорости испарения воды, одеколона и этилового спирта с фильтровальной бумаги.
На фильтровальную бумагу или белую бумажную салфетку капните с помощью пипетки на значительном расстоянии друг от друга по 1 капле: воды, одеколона (туалетной воды), этилового спирта. Какая из капель высыхает быстрее? Какая — медленнее? Какие явления — физические или химические − происходят при этом? Ощущаемый вами запах одеколона свидетельствует о проникновении молекул пахучих веществ, входящих в его состав, между молекулами газов, образующих воздух. Как называется это явление?Ответ:
Быстрее всего высохнет капля этилового спирта, потом одеколона и медленнее всего – капля воды. Объясняется это тем, что температура кипения спирта ниже, чем температура кипения воды. Одеколон занимает промежуточное место, т. к. он является раствором воды, спирта и ароматических веществ.
Наблюдаемое явление называется испарением, это физическое явление. Явление проникновение молекул пахучих веществ между молекулами газов, образующих воздух, называется диффузия.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb112.htm
2. https://ru.wikipedia.org/wiki/Химическаяреакция#:~:text=Хими́ческая%20реа́кция%20—%20превращение%20одного%20или,и%20образуются%20новые%20химические%20вещества
3. https://studref.com/563830/matematikahimiyafizik/fizicheskiehimicheskieyavleniya
4. https://uchitel.pro/физические−и−химические−явления/
5. http://schooled.ru/textbook/chemistry/7klas2/20.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Достижения химии и их правильное использование
Химия постоянно развивается как наука. И не только в теоретическом аспекте. На нынешнем уровне развития человечества химические открытия приобрели огромное практическое значение в самых разных сферах человеческой деятельности. Именно поэтому инновации в химической отрасли часто выступают не изолированно, а соотносятся с другими науками, другими областями знаний и практическими сферами: физикой, биологией, экологией, утилизацией отходов, альтернативной энергетикой. В этих областях открытия в химии обычно реализуются, получают свое практическое применение.
Химическая промышленность производит десятки тысяч наименований продуктов, многие из которых по технологическим и экономическим характеристикам успешно конкурируют с традиционными материалами, а часть — являются уникальными по своим параметрам. Химия дает материалы с заранее заданными свойствами, в том числе и такими, которые не встречаются в природе. Подобные материалы позволяют проводить технологические процессы с большими скоростями, температурами, давлениями, в условиях агрессивных сред. Для промышленности химия поставляет такие продукты, как кислоты и щелочи, краски, синтетические волокна и т. п. Для сельского хозяйства химическая промышленность выпускает минеральные удобрения, средства защиты от вредителей, химические добавки и консерванты к кормам для животных. Для домашнего хозяйства и быта химия поставляет моющие средства, краски, аэрозоли и другие продукты.
Химия характерна не только тем, что обеспечивает производство многих необходимых продуктов, материалов, лекарств. Во многих отраслях промышленности и сельскохозяйственного производства широко используются также химические методы обработки: беление, крашение, печатание в текстильной промышленности; обезжиривание, травление, цианирование в машиностроении; кислородное дутье в металлургии; консервация, синтезирование витаминов и аминокислот — в пищевой и фармацевтической промышленности и т. д. Внедрение химических методов ведет к интенсификации технологических процессов, увеличению выхода полезного вещества, снижению отходов, повышению качества продукции.
Таким образом, химизация, как процесс внедрения химических методов в общественное производство и быт, позволила человеку решить многие технические, экономические и социальные проблемы.
Однако масштабность, а нередко и неуправляемость этого процесса обернулась «второй стороной медали». Химия прямо или опосредованно затронула практически все компоненты окружающей среды — сушу, атмосферу, воду Мирового океана, внедрилась в природные круговороты веществ. В результате этого нарушилось сложившееся в течение миллионов лет равновесие природных процессов на планете, химизация стала заметно отражаться на здоровье самого человека. Получилась ситуация, которую ученые обоснованно именуют химической войной против населения,3емли.
Основными источниками, загрязняющими окружающую среду, кроме собственно химической промышленности, являются металлургия, автомобильный транспорт, тепловые электростанции. Они дают большой объем газообразных отходов, загрязняют водоемы рек и озер сточными водами, используемыми в технологических целях.
В целях предотвращения загрязнения среды новые технологии по своим параметрам должны приближаться к природным процессам, отличаться от промышленных своей безотходностью или малоотходностью. В безотходном производстве технологический цикл «сырье — производство — использование готовое продукта — вторичное сырье» вписывается в окружающую среду, не нарушая экономического развития. В настоящее время наметились следующие пути решения сложных экологических проблем: комплексная переработка сырья; пересмотр традиционных процессов и схем получения известных продуктов; внедрение бессточных и замкнутых схем водопотребления; очистка выбрасываемых газов; использование промышленных комплексов с замкнутой структурой материальных и энергетических потоков.?. Вопросы и задания
1. Приведите несколько примеров хорошо известных вам химических и физических явлений.
Ответ:
Химические явления Физические явления
Прокисание молока Кипение воды
Прогоркание масла Растворение сахара в воде
Коррозия металлов Замерзание воды
Гашение соды уксусом Распространение запаха в воздухе
Гниение листьев Таяние снега
Возгорание спички Свечение лампочки
Горение дров Появление молнии2. Стальные детали в результате длительного пребывания во влажной атмосфере покрываются ржавчиной. Как называют это явление? К физическим или химическим явлениям вы его отнесёте? Почему?
Ответ:
Это коррозия, она относится к химическим явлениям, так как в результате окисления железа кислородом воздуха образуется новое вещество — оксид железа (ржавчина).
3. Почему процессы горения веществ относят к химическим? Приведите примеры практического применения процессов горения.
Ответ:
Процессы горения относят к химическим, так как в результате горения протекает реакция сжигаемого вещества с кислородом воздуха, в результате которой образуются новые вещества (продукты горения).
При горении выделяется много тепла, поэтому его применяют следующим образом:
1. Горение природного газа применяют для производства электроэнергии.
2. Горение бензина применяют в двигателях внутреннего сгорания.
4. Процессы горения и взрыва составляют основу для создания огнестрельного оружия, взрывчатых веществ, боеприпасов и различных видов обычных вооружений.4. Назовите вещества, применяемые вами в быту, но не встречающиеся в живой и неживой природе.
Ответ:
Вещества, получаемые искусственно в химической промышленности и не существующие в природе − пластмассы, резина, чистящие и моющие средства, пестициды, косметическая продукция, синтетические волокна, пищевые добавки, некоторые лекарства.
5. Приведите примеры веществ, используемых при создании автомобиля, и химических реакций, протекающих при его эксплуатации.
Ответ:
При создании автомобиля используется сталь (для корпуса), резина (для шин), пластик и текстильные материалы (для внутренней отделки салона), стекло (для окон).
Примеры химических реакций, протекающих при эксплуатации автомобиля:
− горение бензина. В качестве горючего применяется бензин, представляющий собой компонент нефти, а давление выделяющихся при горении топлива газов, обуславливает работу двигателя;
− коррозия железа;
− химические реакции между свинцом, диоксидом свинца и серной кислотой при разрядке автомобильного аккумулятора. §4
-
§4. Краткий очерк истории развития химии
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Историяхимии
2. https://groh.ru/gro/chem/chemhist.html
3. http://www.chem.msu.ru/rus/books/2007/zefirova−history/fulltext.pdf
4. http://ddutvyborg.spb.ru/wp−content/uploads/2017/06/1Istoriakhimiikaknauki.pdf
5. http://www.physchem.chimfak.sfedu.ru/Source/History/Sketch0.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Точки зрения на происхождение слова "химия"
Исследователи до сих пор не пришли к единому мнению по поводу происхождения слова «химия». Существует несколько версий.
Согласно первой версии, термин "химия" произошел от египетского слова "Хем" − арабского названия этой страны. В таком случае "химия" можно перевести как "египетская наука".
Это же слово означало "черный" − видимо, по цвету почвы в долине реки Нил, протекающей по территории Египта (в противовес бесплодным пескам пустыни). "Кем", или "Хем" (Khemia − "Черная страна", «страна с черной землей») − так называли в древней Греции Египет; этот термин встречается у Плутарха. В таком варианте слово "химия" переводится как "черная наука" или "наука черной земли", но и в этом случае имеется в виду Египет, то есть смысл такого перевода такой же, как в первом варианте.
Вторая версия выводит слово "химия" из греческого χυμος ("хюмос"), которое можно перевести как "сок растения". Этот термин встречается в рукописях, содержащих сведения по медицине и фармакологии.
Согласно же третьей версии, слово "химия" происходит от другого греческого слова − χυμα ("хюма"), означающего "литье", "сплав". В таком случае "химия" − это искусство литья выплавки металлов, то есть металлургии.
Термин "химия" впервые употребил греческий алхимик Зосима Панополитанский в V веке н. э. Он использовал этот термин в смысле «настаивание», «наливание». Современное слово для обозначения науки химии произошло от позднелатинского chimia и является интернациональным: например, в английском языке − chemistry, в немецком − Chemie, французском − chimie. В русском языке этот термин появился в эпоху Петра I.?. Вопросы и задания
1. Изучив происхождение слова «химия», составьте рассказ о химии и её значении в истории древних цивилизаций.
Ответ:
Одно из предположений происхождения слова химия с египетского «хеме» переводится как «черный, тайный». Тогда для людей эта наука была загадкой. Они знали, но не могли объяснить протекания тех или иных химических реакций.
С коптского языка «хеми» тоже переводится как «черный», но еще это древнее название Египта, который они отождествляли с плодородными землями. И для них значение химии сводилось к способам удобрения своей пустынной почвы, чтобы она стала похожа на черные и урожайные земли долины Нила.
«Хема» на древнегреческом языке означает «литье». Судя по всему, для древних греков значение химии заключалось в выплавке металлов.
С древнекитайского языка «ким» переводится как «золото». Для китайцев химия отождествлялась с изготовлением золота.
В истории возникновения и становления химии как науки с IV по XVI в. н.э. выделяют так называемый алхимический период, когда, основываясь на учении Аристотеля и наблюдая взаимные превращения веществ, алхимики не видели причин, почему в результате таких превращений нельзя получить золото из других веществ, Алхимики считали, что при помощи философского камня они из любого вещества смогут получить золото.
Химия в древних цивилизациях считалась «божественной» наукой, находилась целиком в руках жрецов и тщательно скрывалась ими от всех непосвященных.
С течением времени химические знания, непрерывно накапливаемые людьми, постепенно отделялись от религии и переходили в самостоятельную область человеческой деятельности.
С XVII в. началось становление химии как науки.2. Сформулируйте закон сохранения массы веществ. Подумайте, почему при горении свечи её масса постепенно уменьшается. Противоречит ли это наблюдение закону сохранения массы веществ?
Ответ:
Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
Парафиновая свеча состоит из насыщенных углеводородов. При сгорании этих углеводородов образуется углекислый газ и водяной пар, которые улетучиваются в атмосферу, поэтому при горении свечи её масса постепенно уменьшается. Уменьшение массы свечи не противоречит закону сохранения массы вещества, так как масса продуктов реакции никуда не исчезает, а распределяется в атмосфере в виде газа.3. Какими чертами русского характера, по вашему мнению, объясняется тот факт, что величайшие обобщения в химии были сделаны именно русскими химиками: М.В. Ломоносов открыл закон сохранения массы веществ, А.М. Бутлеров создал теорию строения органических соединений, а Д.И. Менделеев сформулировал Периодический закон и разработал Периодическую систему химических элементов?
Ответ:
Русским людям свойственен здравый смысл и деловитость (из учебника), их отличает независимость собственных суждений. Они обладают незаурядными талантами и способностями, и зачастую не в одной области. Немаловажным фактором также является трудолюбие и целеустремленность. Вероятно, поэтому величайшие обобщения в химии были сделаны именно русскими химиками.
4. Подготовьте небольшие сообщения (по выбору) о жизни и деятельности М. В. Ломоносова, А. М. Бутлерова, Д.И. Менделеева.
Ответ:
Михаил Васильевич Ломоносов (1711 − 1765 гг.).
Выдающийся русский ученый, первый русский академик, поэт, реформатор русского языка, художник и историк Михаил Васильевич Ломоносов родился 19 ноября (8 ноября по старому стилю) 1711 года в деревне Мишанинской (ныне село Ломоносово) Куростровской волости Двинского уезда Архангельской губернии в семье крестьянина помора Василия Дорофеевича Ломоносова, занимавшегося морским промыслом на собственных судах.
В декабре1730 г., стремясь получить образование, Михаил Ломоносов ушел с рыбным обозом в Москву.
В январе 1731 г. Ломоносов, выдав себя за дворянского сына, поступил в Московскую славяно-греко-латинскую академию при Заиконоспасском монастыре ("Спасские школы").
В 1735 г. в числе 12 лучших студентов академии он был отправлен учиться в Санкт Петербургскую академию наук.
В 1736 г. трое из способных студентов, в том числе Ломоносов, были отправлены Академией наук в Германию для обучения математике, физике, философии, химии и металлургии. За границей Ломоносов пробыл пять лет.
В июне 1741 г. (по другим сведениям, в январе 1742 г.) Ломоносов вернулся в Россию и был назначен в академию адъюнктом Академии наук по физическому классу, а в августе 1745 г. стал первым русским, избранным на должность профессора (академика) химии.
Ломоносов неоднократно ставил вопрос об открытии университета в Москве. Его предложения, сформулированные в письме к Ивану Шувалову, легли в основу проекта Московского университета.
25 (12 по старому стилю) января 1755 г. Елизавета Петровна подписала указ об основании Московского университета. 7 мая (26 апреля по старому стилю) 1755 г. состоялось торжественное открытие университета в здании Аптекарского дома, находившегося на месте Исторического музея. В 1940 г., в дни празднования 185 летнего юбилея, университету было присвоено имя Михаила Ломоносова.
В марте 1757 г. Ломоносов был назначен советником Академической канцелярии. В ведении Ломоносова находились Академическое собрание, университет, гимназия и Географический департамент.
В 1763 г. Михаил Ломоносов был избран членом Российской академии художеств. В конце жизни Ломоносов стал почетным членом Стокгольмской (в 1760 г.) и Болонской (в 1764 г.) академий наук.
Умер Михаил Ломоносов 15 апреля (4 апреля по старому стилю) 1765 г., похоронен на Лазаревском кладбище Александро-Невской лавры в Петербурге.
Открытия Ломоносова в области химии, физики и астрономии на десятилетия опередили работы западноевропейских ученых. Он развил атомно молекулярные представления о строении вещества, высказал принцип сохранения материи и движения, заложил основы физической химии, исследовал атмосферное электричество и силу тяжести. Он выдвинул учение о свете, создал ряд оптических приборов, открыл атмосферу на планете Венера, объяснил происхождение многих полезных ископаемых и минералов. Известны его труды в области истории.
Ломоносов – крупнейший поэт XVIII века, создатель русской оды философского и высокого гражданского звучания, автор поэм, поэтических посланий, трагедий, сатир, филологических трудов и научной грамматики русского языка.
Имя Ломоносова носят многие учреждения науки, образования и культуры России: Московский государственный университет имени М. В. Ломоносова, Музей М.В. Ломоносова Российской Академии Наук, Московская государственная академия тонкой химической технологии им. М. В. Ломоносова, Архангельский театр драмы имени М. В. Ломоносова, Поморский государственный университет имени М. В. Ломоносова и др.
Именем Ломоносова названы город в Ленинградской области, течение в Атлантическом океане, горный хребет на Новой Земле, подводный хребет в Северном Ледовитом океане, возвышенность на острове Западный Шпицберген, кратер на Луне.Дмитрий Иванович Менделеев (1834 − 1907 гг.).
Д.И. Менделеев родился 8 февраля (27 января по старому стилю) 1834 года в Тобольске.
В 1855 году с золотой медалью окончил отделение естественных наук физико−математического факультета Главного педагогического института в Петербурге.
В 1856 году защитил в Петербургском университете магистерскую диссертацию, а с 1857 года в качестве доцента читал там же курс органической химии.
В январе 1859 года Менделеев был отправлен в двухгодичную командировку в Гейдельберг (Германия), где, устроив небольшую лабораторию, произвел свои исследования над капиллярностью жидкостей. В это время им были написаны работы "О расширении жидкостей" и "О температуре абсолютного кипения".
В 1861 году Менделеев вернулся в Петербург, где возобновил чтение лекций по органической химии, в 1861 году опубликовал учебник "Органическая химия", удостоенный Петербургской Академией наук Демидовской премии.
В 1864−1866 годах — профессор Петербургского технологического института.
В 1865 году Менделеев защитил докторскую диссертацию "О соединении спирта с водой" и тогда же был утвержден профессором Петербургского университета.
Работая над учебником "Основы химии", ученый совершил одно из величайших открытий в истории химии — вывел периодический закон химических элементов. Первый вариант периодической таблицы элементов был опубликован в 1869 году под названием "Опыт системы элементов, основанной на их атомном весе и химическом сходстве". Окончательная формулировка закона была дана ученым в июле 1871 года. В классическом труде "Основы химии", выдержавшем при жизни ученого восемь изданий на русском языке и несколько изданий на иностранных языках, Менделеев впервые изложил неорганическую химию на основе периодического закона.
В 1871−1875 годах Менделеев занимался исследованием упругости и расширения газов и опубликовал свое сочинение "Об упругости газов".
В 1876 году он был избран членом−корреспондентом Петербургской АН. В 1880 году виднейшие русские ученые выдвинули Менделеева в члены Петербургской АН, но его кандидатура была отвергнута, что вызвало резкий протест общественности в России и за рубежом.
В конце 1870−х — первой половине 1880−х годов Менделеев занимался исследованием растворов, их результаты сведены в обширном сочинении "Исследования растворов по удельному весу" (1887).
Менделеев уделял много внимания нефтяной промышленности. В 1876 году по поручению правительства он предпринял путешествие в Америку для ознакомления с постановкой там нефтяного дела, также неоднократно посещал с той же целью кавказские месторождения. В 1888 году он изучал экономическое состояние Донецкого каменноугольного района. Результаты этих работ были изложены им в ряде статей и отдельных монографий.
В 1876−1880 годах Менделеев провел исследования в области метеорологии и воздухоплавания. Им был создан чувствительный дифференциальный барометр. В августе 1887 года без пилота совершил полет на воздушном шаре для наблюдения солнечного затмения и изучения высоких слоев атмосферы.
В 1890−1895 годах он состоял консультантом Научно−технической лаборатории Морского министерства. В 1890 году изобрел новый вид бездымного пороха ("пироколлодий") и в 1892 году организовал его производство.
В 1892 году Дмитрий Менделеев был назначен ученым хранителем Депо образцовых гирь и весов, в 1883 году преобразованного по его инициативе в Главную палату мер и весов. Ее управляющим (директором) он и оставался до конца жизни.
Дмитрий Менделеев умер 2 февраля (20 января по старому стилю) 1907 года в Петербурге от воспаления легких. Похоронен на Волковом кладбище.
Научная деятельность Менделеева чрезвычайно обширна и многогранна. Среди его печатных трудов (более 500) — фундаментальные работы по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, по вопросам экономики, народного просвещения и многим др.
Дмитрий Менделеев был инициатором создания Русского химического общества (1868) и Русского физического общества (1872).
Являлся почетным доктором многих университетов. Почти все крупные учреждения — академии, университеты, научные общества — как в России, так и за рубежом, избрали Менделеева своим почетным членом. Ученый был удостоен многих наград.
В честь ученого были названы химический элемент № 101 менделевий, подводный хребет в Северном Ледовитом океане, действующий вулкан на о. Кунашир (Курильские острова), кратер на Луне, минерал менделеевит. В 1964 году имя Менделеева занесено на Доску почета науки Бриджпортского университета (США) в числе имен величайших ученых мира.
В крупнейших научных и культурных центрах России не реже одного раза в 4−5 лет проводятся Менделеевские съезды по химии.
Александр Михайлович Бутлеров (1828 − 1886 гг.).
Русский химик А.М. Бутлеров родился 3(15) сентября в Чистополе Казанской губернии в семье помещика, офицера в отставке. Рано лишившись матери, Бутлеров воспитывался в одном из частных пансионов в Казани, затем учился в Казанской гимназии. В шестнадцатилетнем возрасте он поступил на физико−математическое отделение Казанского университета, который в то время был центром естественнонаучных исследований в России. В первые годы студенчества Бутлеров увлекался ботаникой и зоологией, но затем под влиянием лекций К. К. Клауса и Н. Н. Зинина заинтересовался химией и решил посвятить себя этой науке. В 1849 г. Бутлеров окончил университет и по представлению Клауса был оставлен на кафедре в качестве преподавателя.
Работа
1849−1863, Казанский университет: преподаватель (с 1849), экстраординарный профессор химии (с 1854), ординарный профессор химии (с 1858), ректор (дважды) (1860−1863 гг., 1878−1882 гг.), Русское физико−химическое общество: председатель отделения химии Открытия.
А.М. Бутлеров — создатель теории химического строения вещества (так называемой «структурной теории»), положившей начало синтетическому образованию новых органических соединений и лежащей в основе современной органической химии.
В 1858 году открыл новый способ синтеза йодистого метилена и выполнил серию работ, связанных с получением его производных.
Синтезировал диацетат метилена, получил продукт его омыления — полимер формальдегида, а на основе последнего в 1861 году впервые получил гексаметилентетрамин (уротропин) и сахаристое вещество «метиленитан», то есть осуществил первый полный синтез сахаристого вещества.
Русский химик, создатель теории химического строения, родоначальник крупной химической школы, общественный деятель. Его теория химического строения позволила объяснить многие факты, накопившиеся в органической химии ко второй половине ХIХ века и доказала, что с помощью химических методов можно установить порядок соединения атомов в молекулах, что, в свою очередь, доказывало возможность познания строения вещества. Теория Бутлерова внесла новое в атомно−молекулярное учение — она рассматривала молекулы вещества как упорядоченную систему, наделенную динамикой взаимодействующих атомов. Кроме того, она позволила предвидеть свойства органических соединений на основании строения, синтезировать новые вещества, придерживаясь плана, позволила объяснить многообразие органических соединений и, наконец, дала мощный толчок синтезу органических соединений, развитию промышленности органического синтеза. Также Бутлеров внес существенный вклад в разработку принципов построения курса химии для школы, подходов к отбору теоретического и фактологического материалов.
Кроме химии, Бутлеров много внимания уделял практическим вопросам сельского хозяйства, садоводству, пчеловодству, а позднее также и разведению чая на Кавказе. С конца 1860−х гг. Бутлеров активно интересовался спиритизмом и медиумизмом, которым посвятил несколько статей; это увлечение Бутлерова и его попытки дать спиритизму научное обоснование стали причиной его полемики с Менделеевым. Умер Бутлеров 5 (17) августа 1886 года в дер. Бутлеровка Казанской губернии, не дожив до окончательного признания своей теории. Два наиболее значительных русских химика – Д. И. Менделеев и Н. А. Меншуткин – лишь спустя десять лет после смерти Бутлерова признали справедливость теории химического строения.5. Назовите литературные произведения, в которых описаны опыты алхимиков и философский камень.
Ответ:
"Алтын Толобас" Б. Акунин
"Алхимик" П. Коэльо.
"Гарри Поттер и философский камень" Дж. К. Роулинг.
"Духовная алхимия" В. А. Перепелицын
"Знак алхимика. Загадка Исаака Ньютона." К. Филип
"Завещание алхимика" Н. Н. Александрова
"Сокровище алхимиков" С. Жак
"Философский камень" С. С. Венедиктович
"Феномен Фулканелли. Тайна алхимика XX века." К. Р. Джонсон §5
-
§5. Периодическая система химических элементов Д.И.Менделеева. Знаки химических элементов
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
https://elementy.ru/trefil/13/PeriodicheskayasistemaMendeleeva
https://externat.foxford.ru/polezno−znat/wiki−himiya−periodicheskaya−tablica−mendeleeva
https://ru.wikipedia.org/wiki/Периодический_закон2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Периодическая система химических элементов (таблица) Д.И. Менделеева.
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.
Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам.
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно−молекулярного учения, способствовала формулировке современного понятия "химический элемент" и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.
По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.?. Вопросы и задания
1. Пользуясь словарями (этимологическим, энциклопедическим и химических терминов), назовите важнейшие свойства, которые отражены в названиях химических элементов: бром Br, азот N, фтор F.
Ответ:
Бром переводится с греческого как зловонный. Это жидкость красно−бурого цвета с сильным неприятным запахом, напоминающим запах одновременно йода и хлора.
Азот в переводе с французского означает безжизненный, потому что этот газ не поддерживает ни горения, ни дыхания.
Фтор в переводе с греческого означает разрушение, порча, вред. Его так назвали из−за активной реакционной способности.2. Объясните, как в названии химических элементов титана и ванадия отражено влияние древнегреческих мифов.
Ответ:
Элемент титан назван в честь персонажей мифов Древней Греции − титанов, детей Урана и Геи. Титаны в древнегреческой мифологии великаны, которые держали небо. Титан − крепкий, прочный и износоустойчивый металл.
Элемент ванадий образует соединения с яркой окраской, поэтому название его шведский химик Н.Г. Сефстрем взял от имени скандинавской богини любви и красоты. Именно скандинавской, поскольку ученый хотел связать название нового элемента с культурным наследием своей страны.3. Почему латинское название золота Aurum (аурум), а серебра — Argentum (аргентум)?
Ответ:
Золото имеет желтый цвет, а латинское aurum означает "жёлтое".
Серебро имеет серебристо−белый цвет, а латинское argentum означает "белый, блистающий".4. Расскажите историю открытия какого−либо (по вашему выбору) химического элемента и объясните этимологию его названия.
Ответ:
Бериллий, Beryllium, Be (4)
Содержащие бериллий минералы (драгоценные камни) − берилл, смарагд, изумруд, аквамарин и др.− известны с глубокой древности. Некоторые из них добывались на Синайском полуострове еще в XVII в. до н. э.
В Стокгольмском папирусе (III в.) описываются способы изготовления поддельных камней.
Название берилл встречается у греческих и латинских (Beryll) античных писателей и в древнерусских произведениях.
Исследование химического состава драгоценных минералов этой группы началось лишь в конце XVIII в. с наступлением химико−аналитического периода. Первые анализы (Клапрот, Биндгейм и др.) не обнаружили в берилле ничего особенного. В конце XVIII в. известный минералог аббат Гаюи обратил внимание на полное сходство кристаллического строения берилла из Лиможа и смарагда из Перу.
Вокелен произвел химический анализ обоих минералов (1797) и обнаружил в обоих новую землю, отличную от алюмины. Получив соли новой земли, он установил, что некоторые из них обладают сладким вкусом, почему и назвал новую землю глюцина (Glucina) от греческого − сладкий. Новый элемент, содержащийся в этой земле, был назван соответственно глюцинием (Glucinium). Это название употреблялось во Франции в XIX в., существовал даже символ − Gl. Клапрот, будучи противником наименования новых элементов по случайным свойствам их соединений, предложил именовать глюциний бериллием (Beryllium), указав, что сладким вкусом обладают соединения и других элементов. Металлический бериллий был впервые получен Велером и Бусси в 1728 г. путем восстановления хлорида бериллия металлическим калием. Отметим здесь выдающиеся исследования русского химика И.В.Авдеева по атомному весу и составу окисла бериллия (1842). Авдеев установил атомный вес бериллия 9,26 (совр.9,0122), тогда как Берцелиус принимал его равным 13,5, и правильную формулу оксида.
О происхождении названия минерала берилл, от которого образовано слово бериллий, существует несколько версий. А. М. Васильев (по Диргарту) приводит следующее мнение филологов: латинское и греческое названия берилла могут быть сопоставлены с практритским veluriya и санскритским vaidurya. Последнее является названием некоторого камня и происходит от слова vidura (очень далеко), что, по−видимому, означает какую−то страну или гору. Мюллер предложил другое объяснение: Vaidurya произошло от первоначального vaidarya или vaidalya, а последнее от vidala (кошка). Иначе говоря, vaidurya означает приблизительно "кошачий глаз". Рай указывает, что в санскрите топаз, сапфир и коралл считались кошачьим глазом. Третье объяснение дает Липпман, который считает, что слово берилл обозначало какую−то северную страну (откуда поступали драгоценные камни) или народ. В другом месте Липпман отмечает, что Николай Кузанский писал, что немецкое Brille (очки) происходит от варварско−латинского berillus. Наконец, Лемери, объясняя слово берилл (Beryllus), указывает, что Berillus, или Verillus, означает "мужской камень".5. Запишите «координаты», т. е. положение в Периодической системе Д.И. Менделеева (номер элемента, номер периода и его вид − большой или малый, номер группы и подгруппа − главная или побочная), для следующих химических элементов: кальций, цинк, сурьма, тантал, европий.
Ответ:
Элемент Символ Порядковый Номер Вид Номер Подгруппа
№ элемента периода периода группы
кальций Са 20 4 большой II Главная
цинк Zn 30 4 большой II Побочная
сурьма Sb 51 5 большой V Главная
тантал Ta 73 6 большой V Побочная
европий Eu 63 6 большой III Побочная6. Распределите химические элементы, перечисленные в таблице 1, на три группы по признаку «произношение химического символа». Может ли выполнение этого задания помочь вам в запоминании химических символов и произношении символов элементов?
Таблица 1. Названия некоторых химических элементов.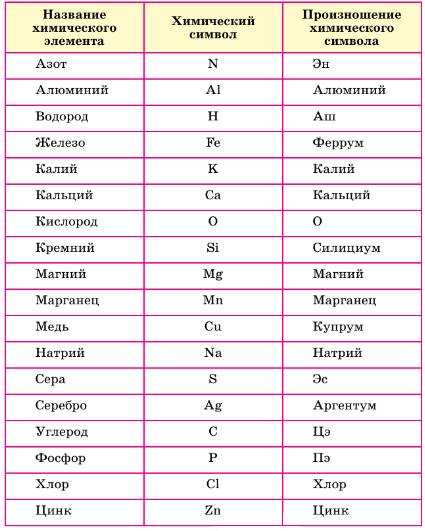
Ответ:
Произношение химических символов.
Совпадает Совпадает Латинское название
с названием буквы с названием элемента
N− Эн Al − Алюминий Fe − Феррум
H − Аш К − Калий Si − Силициум
О − О Са − Кальций Сu − Купрум
S − Эс Mg − Магний Ag − Аргентум
С − Цэ Mn − Марганец
P − Пэ Na − Натрий
Сl − Хлор
Zn − Цинк §6
-
§6. Химические формулы. Относительная атомная и молекулярная массы
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−2−otnositelnaja−atomnaja−massa−himicheskih−jelementov.html
2. https://himi4ka.ru/arhiv−urokov/urok−5−himicheskaja−formula.html
3. https://himi4ka.ru/arhiv−urokov/urok−7−otnositelnaja−molekuljarnaja−i−otnositelnaja−formulnaja−massy.html
4. https://ru.wikipedia.org/wiki/Химическая_формула
5. https://foxford.ru/wiki/himiya/massovaya−dolya−elementa−massovaya−dolya−veschestva2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Относительная атомная масса (Ar)
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Значительно позже работ Берцелиуса массы атомов химических элементов стали сравнивать с 1/12 массы атома углерода Относительная атомная масса химического элемента показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Относительная атомная масс обозначается Аr, она не имеет единиц измерения, так как показывает отношение масс атомов.
Абсолютная масса 1/12 атома углерода является эталонной единицей, значение которой вычислено с высокой точностью и составляет 1,66 *10-24 г или 1,66 *10-27 кг. Эта эталонная масса называется атомной единицей массы (а.е.м.).
При расчетах значения относительных атомных масс принято округлять до целых. Исключение составляет относительная атомная масса хлора – для хлора используют значение 35,5?. Вопросы и задания
1. Что означают записи: 3H; 2H2O; 5O2?
Ответ:
3H – 3 атома водорода;
2H2O – 2 молекулы воды, состоящих из 1 атома кислорода и 2 атомов водорода каждая;
5O2 – 5 молекул кислорода, состоящих из 2 атомов кислорода каждая.2. Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
Ответ:
Сахароза − C12H22O11.
3. Используя рисунок 2 (см. с. 5), запишите формулы веществ и рассчитайте их относительные молекулярные массы.

рис. 2. Модели молекул некоторых веществ.Ответ:
Кислород − O2.
Ar (O) = 16
Mr (O2) = 2 * Ar(O)= 2 * 16 = 32
Сера − S8
Ar (S)= 32
Mr (S8) = 8 * Ar(S) = 8 * 32= 256
Гелий − Не
Ar (Не) = 4
Mr (He) = 1 * Ar(He) = 1 * 4= 4
Этиловый спирт − C2H5OH
Ar (C) = 12
Ar (Н) = 1
Ar (O) = 16
Mr(C2H5OH) = 2 * Ar(C) + 6 * Ar(H) + Ar(O) = 2 * 12 + 6 * 1 + 16 = 46
Метан − CH4
Ar (C) = 12
Ar (Н) = 1
Mr(CH4) = Ar(C) + 4 * Ar(H) = 12 + 4 * 1 = 16
Углекислый газ − CO2
Ar (C) = 12
Ar (O) = 16
Mr(CO2) = Ar(C) + 2 * Ar(O) = 12 + 2 * 16 = 44
Угарный газ − CO
Ar (C) = 12
Ar (O) = 16
Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 284. Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O2; 4CO2?
Ответ:
3O – атомарное состояние кислорода (3 атома).
5O2 – простое двухатомное вещество кислород (5 молекул).
4CO2 – 4 молекулы углекислого газа, в каждой из которых присутствуют 2 атома кислорода и 1 атом углерода, сложное трёхатомное вещество.5. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
Ответ:
Относительная атомная масса элемента и относительная молекулярная масса вещества показывают, во сколько раз масса атома химического элемента или молекула вещества, больше, чем 1/12 массы атома углерода.
А кратность (то есть показатель "во сколько раз") не имеет единицы измерения.6. В каком из веществ, формулы которых $SO_{2}$ и $SO_{3}$, массовая доля серы больше? Ответ подтвердите расчётами.
Ответ:
Дано:
$SO_{2}$;
$SO_{3}$
_____________
$w_{1}(S)$ − ?
$w_{2}(S)$ − ?
Решение:
$w (Э) = \frac{n * Ar (Э)}{Mr (вещ-ва)}$;
Ar (S) = 32;
Ar (O) = 16;
Mr ($SO_2$) = 1 * Ar(S) + 2 * Ar(O)= 32 + 2 * 16 = 64;
$w_{1} (S) = \frac{n * Ar (S)}{Mr(SO_{2})} = \frac{1 * 32}{64} = 0,5$ = 50 %;
Mr ($SO_3$) = 1 * Ar(S) + 3 * Ar(O)= 32 + 3 * 16 = 80;
$w_{2} (S) = \frac{n * Ar (S)}{Mr(SO_{3})} = \frac{1 * 32}{80} = 0,4$ = 40%.
$w_{1}(S) > w_{2}(S)$
Ответ: массовая доля серы в молекуле $SO_{2}$ больше, чем в молекуле $SO_{3}$.7. Вычислите массовые доли элементов в азотной кислоте $HNO_{3}$?
Ответ:
Дано:
$HNO_{3}$.
_____________
w (Н) − ?
w (N) − ?
w (О) − ?
Решение:
$w (Э) = \frac{n * Ar (Э)}{Mr (вещ-ва)}$;
Ar (Н) = 1;
Ar (N) = 14;
Ar (O) = 16;
Mr ($HNO_{3}$) = 1 * Ar (H) + 1 * Ar (N) + 3 * Ar (O) = 1 * 1 + 1 * 14 + 3 * 16 = 63.
$w (Н) = \frac{n * Ar (H)}{Mr(HNO_{3})} = \frac{1 * 1}{63}$ * 100 % = 1,6 %.
$w (N) = \frac{n * Ar (N)}{Mr(HNO_{3})} = \frac{1 * 14}{63}$ * 100 % = 22,2 %
$w (O) = \frac{n * Ar (O)}{Mr(HNO_{3})} = \frac{3 * 16}{63}$ * 100 % = 76,2 %
Ответ: 1,6 %; 22,2 %; 76,2 %.8. Дайте полную характеристику глюкозы $C_{6}H_{12}O_{6}$, используя пример описания углекислого газа $CO_{2}$ (см. с.42).
Ответ:
Глюкоза $C_{6}H_{12}O_{6}$.
1. Конкретное вещество: глюкоза.
2. Качественный состав: состоит из трех элементов: углерода, водорода и кислорода.
3. Тип вещества: сложное вещество.
4. Количественный состав вещества: 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
5. Относительная молекулярная масса
Mr ($C_{6}H_{12}O_{6}$) = 6 * Ar (C) + 12 * Ar (Н) + 6 * Ar (O) = 6 * 12 + 12 * 1 + 6 * 16 = 180.
6. Соотношение масс элементов: m (H) : m (C) : m (O) = 72 : 12 : 96 = 6 : 1 : 8.
7. Массовые доли элементов в этом веществе:
$w (С) = \frac{n * Ar (C)}{Mr(C_{6}H_{12}O_{6})} = \frac{6 * 12}{180}$ * 100 % = 40 %.
$w (O) = \frac{n * Ar (O)}{Mr(C_{6}H_{12}O_{6})} = \frac{12 * 1}{180}$ * 100 % = 6,7 %
$w (H) = \frac{n * Ar (H)}{Mr(C_{6}H_{12}O_{6})} = \frac{6 * 16}{180}$ * 100 % = 53,3 %Темы для дискуссии
1. Отношение людей к достижениям химии: хемофилия и хемофобия. Какую точку зрения вы поддерживаете?
Ответ ©:
Хемофилия — «любовь к химии», хемофобия — «боязнь химии». Это две крайности отношения к химии, поэтому моя точка зрения лежит где-то посередине. С одной стороны, без химии невозможна жизнь современного человека, поскольку любое промышленное производство - это химия. Человек научился изготавливать пластмассы из нефти, извлекать металлы из руд, делать лекарства, удобрения, инсектициды. Без всего этого современная жизнь немыслима. С другой стороны, многие продукты и выбросы химической промышленности загрязняют окружающую среду, все больше химических веществ применяется в производстве продуктов питания, а это вредно для здоровья человека. Во всем нужен рациональный подход.
2. Оцените вклад российских учёных в развитие мировой химической науки. Насколько, с вашей точки зрения, значим этот вклад?
Ответ:
М.В.Ломоносов, А.М.Бутлеров, Д.И.Менделеев, С.В.Лебедев, Н.Ф.Зелинский – представить себе существование химии (а равно и всей современной промышленности) без этих имен невозможно.
При освоении атомно−молекулярного учения всегда упоминается великий вклад М.В.Ломоносова, который в 1748 году сформулировал закон сохранения массы веществ, а в 1756 году подтвердил его опытами с запаянными сосудами. Значительно позже, в 1789 году этот же закон, независимо от Ломоносова, был выведен французским химиком Лавуазье.
Именно по настоянию М.В.Ломоносова и его проекту, в 1756 году был открыт первый в России университет в Москве.
Трудно не то чтобы переоценить, а реально осмыслить роль Д.И.Менделеева в развитии химии (даже не в развитии, а гигантском скачке вперед). В 1869 году, в возрасте 35 лет, он открывает периодический закон и создает периодическую систему химических элементов. Менделеев не только распределяет химические элементы в периодической таблице, но и оставляет свободные места в периодах для еще не открытых, но уже предсказанных элементов. В течение последующих 15 лет три описанных элемента были открыты.
Французский химик Лекок де Буабодрак открыл галлий, затем в Швеции Л.Ф.Нильсон открывает скандий, в Германии К.А.Винклер открыл германий. Ни в малой степени не умаляя значений этих открытий, следует отметить, что ученые шли уже по проторенной дороге.
Последующее развитие науки позволило, опираясь на периодический закон, глубоко познать строение вещества.
Огромный вклад в развитие органической химии внес А.М.Бутлеров. Трудно себе представить, какой хаос царил в органике в начале XIX в. Ученые умели определять качественный и количественный состав веществ, но не имели представления о том, как атомы соединяются в молекулы, не пользовались привычными для нас формулами, не знали валентности, химических реакции описывали словами, а не формулами. До Бутлерова было много попыток классифицировать органические вещества:
− теория этерина французского химика Ж.Б.Дюма (1820);
− теория радикалов Ф.Велера и Ю.Либиха (1832);
− теория типов О.Лорана и Ш.Жерара (1840);
− открытие Э.Франклиндом валентности, которое было обобщено и развито немецким химиком Ф.А.Кекуле (1853).
Постепенное накопление экспериментального материала и его осмысление вылились в теорию химического строения органических веществ Бутлерова в 1861 году. Согласно этой теории, свойства соединений определяются их качественным и количественным составом, химическим строением, т.е. последовательным порядком соединения между собой образующих молекулу атомов, и их взаимным влиянием. Большое значение для становления теории химического строения имело её экспериментальное подтверждение в работах как самого Бутлерова, так и его школы. Он предвидел, а затем и доказал существование позиционной и скелетной изомерии.
Основоположником промышленного способа получения синтетического каучука, одного из важнейших разделов современной химической промышленности, явился С.В.Лебедев, русский химик, академик. Он провел цикл работ в области высоко− и низкотемпературной полимеризации изобутилена, лежащей в основе методов производства бутилкаучука (новейшая разновидность синтетического каучука), 100−октановых компонентов моторных топлив и загустителей смазочных масел.
В 1928 году С.В.Лебедев получил синтетический каучук полимеризацией 1,3−бутадиена под действием натрия.
И это далеко не полный перечень выдающихся умов России, активно способствовавших поступательному развитию мирового прогресса.
Таким образом, вклад российских учёных в развитие мировой химической науки не оценим. Именно благодаря нашим учёным, происходил рывок в развитии химической науки.3. Насколько этимологическое значение термина «атом» соответствует современным представлениям о нём?
Ответ:
Атом − заимствовано в Петровскую эпоху из греч. яз., в котором atomos «неделимый»: из a − «не» и temnō − «делю, ломаю». Атом − частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов.
Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что реальная частица, которой было присвоено имя атома, в действительности не является неделимой.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Таким образом, этимологическое значение термина «атом» не соответствует современным представлениям о нём. §7
-
ГЛАВА ПЕРВАЯ. Атомы химических элементов
§7. Основные сведения о строении атомов
Лабораторный опыт №3
Распакуйте пластинку жевательной резинки и с помощью указательного пальца (своеобразного сканера) сделайте вывод об относительной гладкости каждой из трёх поверхностей упаковки жевательной резинки и её содержимого: а) бумаги; б) фольги; в) самой резинки. Этот принцип используется при изготовлении печатной продукции для слепых.
Ответ:
Поверхность жевательной резинки, фольга, упаковочная бумага имеют разную гладкость. Фольга имеет наиболее гладкую поверхность, менее гладкую поверхность имеет оберточная бумага, а сама жевательная резинка наименее гладкую поверхность, она шероховата на ощупь.
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb121.htm
2. http://www.hemi.nsu.ru/ucheb122.htm
3. https://bigenc.ru/physics/text/1839003
4. https://ru.wikipedia.org/wiki/Атом
5. https://xumuk.ru/encyklopedia/401.html
6. http://endic.ru/encsovet/Atom−71156.html
7. https://ru.wikipedia.org/wiki/Сканирующиймикроскоп
8. https://ru.wikipedia.org/wiki/Нанотехнология#:~:text=Нанотехноло́гия%20—%20область%20фундаментальной%20и%20прикладной,структурой%20путём%20контролируемого%20манипулирования%20отдельными2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Атом
А́том (от др.−греч. ἄτομος «неделимый, не разрезаемый») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Атомы состоят из ядра и электронов (точнее, электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Z×e) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что реальная частица, которой было присвоено имя атома, в действительности не является неделимой.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Современная модель атома является развитием планетарной модели Бора−Резерфорда. Согласно современной модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько−нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов. Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы (дальтонах), равных 1⁄12 от массы атома стабильного изотопа углерода 12C.?. Вопросы и задания
1. Какие научные открытия доказали, что атом − сложная частица, что он делим?
Ответ:
Открытие электрона как частицы принадлежит Эмилю Вихерту и Джорджу Томсону, которые в 1897 году установили, что отношение заряда к массе для катодных лучей не зависит от материала источника.
29 апреля 1897 г. Дж. Томсон изложил гипотезу о существовании материи в состоянии ещё более тонкого дробления, чем атомы.
То, что атом является сложной частицей было доказано благодаря опыту рассеяния альфа−частиц на металлической фольге проведенному в 1911 году Эрнестом Резерфордом. На основе результатов опыта Э. Резерфорд создал планетарную модель атома, который состоял из положительно заряженного ядра и отрицательно заряженных электронов вокруг него. В 1919 году Э. Резерфорд провел эксперимент, суть которого заключалась в том, что под воздействием α−частиц из азота выбивались какие−то новые частицы, без труда проникавшие через фольгу, непроходимую для α−частиц. Оказалось, что неизвестные частицы имеют положительный заряд, равный по величине заряду электрона, а их масса равна массе ядра атома водорода. Эти частицы Резерфорд назвал протонами.
В 1930 году В. А. Амбарцумян и Д. Д. Иваненко показали, что ядро не может, состоять из протонов и электронов, что электроны, вылетающие из ядра при бета−распаде, рождаются в момент распада, и что кроме протонов, в ядре должны присутствовать некие нейтральные частицы. 27 февраля 1932 был открыт нейтрон физиком Джеймсом Чедвиком, который объяснил результаты опытов В. Боте и Г. Беккера (1930), в которых обнаружилось, что α−частицы, вылетающие при распаде полония, воздействуя на лёгкие элементы, приводят к возникновению сильно проникающего излучения. Чедвик первый предположил, что новое проникающее излучение состоит из нейтронов и определил их массу.2. Определите число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота.
Ответ:
Элемент Число протонов (p+) = Число электронов (e-) = Число нейтронов ($n^{0}$) =
номеру элемента номеру элемента массовое число (А) −
номер элемента (Z)
Nа (натрий) 11 11 23 − 11 = 12
P (фосфор) 15 15 31 − 15 = 16
Au (золото) 79 79 197−79 = 1183. Пользуясь этимологическим словарём, объясните, почему планетарную модель строения атома, предложенную Э. Резерфордом, называют также нуклеарной. Почему протоны и нейтроны вместе называют нуклонами?
Ответ:
Планетарная модель атома Э. Резерфорда представляет собой положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Нуклон от лат. nucleus — ядро, поэтому планетарную модель строения атома, предложенную Э. Резерфордом, называют также нуклеарной.
Протон электрически заряжен, а нейтрон — нет. Однако, с точки зрения ядерного взаимодействия, эти частицы неразличимы, поэтому и был введен термин "нуклон", а протон и нейтрон стали рассматриваться как два различных состояния нуклона.4. Порядковый номер элемента в таблице Д.И. Менделеева равен 35. Какой это элемент? Чему равен заряд ядра его атома? Сколько протонов, электронов и нейтронов в его атоме?
Ответ:
Элемент с порядковым номером (Z) 35 — бром (Br).
Заряд ядра его атома равен 35.
Число протонов и электронов равно порядковому номеру элемента Z = p+ = e- = 35.
Массовое число 80.
Число нейтронов n0 = А − Z = 80 − 35 = 45.5. На уроках биологии вы рассматривали клетки растений, используя световой микроскоп. Каков принцип действия этого микроскопа?
Ответ:
Главный принцип работы светового микроскопа состоит в том, что через прозрачный или полупрозрачный предмет (объект исследования), размещенный на предметном столике, проходят лучи света и попадают на систему линз объектива, которые увеличивают изображение.
В состав микроскопа входят три функциональных элемента: осветительная часть, воспроизводящая и визуализирующая.
Осветительный элемент создает световой поток для освещения объекта исследования для того, чтобы возможно его было увеличить и рассмотреть. В осветительную часть входят источник света и оптико−механическая система.
Предназначение воспроизводящей части микроскопа – воспроизведение изображения предмета в плоскости с необходимым качеством изображения и кратностью увеличения. Воспроизводящий элемент – это объектив и промежуточная оптическая система.
Визуализирующий элемент необходим для получения изображения предмета на сетчатке глаза, фотопленке, экране и дополнительного увеличения. В визуализирующую часть входят монокулярная, бинокулярная и тринокулярная визуальная насадка с наблюдательной системой (окулярами), проекционные насадки, системы дополнительного увеличения, рисовальные аппараты, системы анализа и документирования изображений.6. Что выступает в роли аналога света в сканирующем микроскопе? Каков принцип действия этого микроскопа?
Ответ:
Главным элементом сканирующих туннельных микроскопов является очень тонкий металлический зонд (щуп или игла), двигающийся вдоль поверхности. Между зондом и поверхностью приложено электрическое напряжение, в результате чего возникает туннельный ток, величина которого позволяет фиксировать неоднородности или иные особенности исследуемой поверхности. При этом зонд должен находиться на расстоянии 1 мкм от образца, что является условием возникновения и поддержания туннельного тока. Сканируя поверхность, подобно лучу в электронной трубке телевизора, исследователь получает высокоточную картину состояния поверхности. При идеальной «остроте» зонда, когда на его поверхности будет находиться один−единственный атом, точность описания будет соответствовать отдельным атомам.
7. Что такое нанотехнологии? Почему эта отрасль науки и производства получила такое название?
Ответ:
Нанотехнология (англ. nanotechnology) — данный термин в настоящее время не имеет единого, признаваемого всеми определения.
Под термином «нанотехнологии» РОСНАНО понимает совокупность технологических методов и приемов, используемых при изучении, проектировании и производстве материалов, устройств и систем, включающих целенаправленный контроль и управление строением, химическим составом и взаимодействием составляющих их отдельных наномасштабных элементов (с размерами порядка 100 нм и меньше как минимум по одному из измерений), которые приводят к улучшению, либо появлению дополнительных эксплуатационных и/или потребительских характеристик и свойств получаемых продуктов.
Также под термином «нанотехнология» можно понимать понимать комплекс научных и инженерных дисциплин, исследующих процессы, происходящие в атомном и молекулярном масштабе.
Эта отрасль науки и производства получила такое название, потому что она имеет дело с объектами, которые имеют размеры масштаба 10-9 м, т. е. размера нанометра ("нано", от лат. "карлик"). §8
-
§8. Изменения в составе ядер атомов химических элементов. Изотопы
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb123.htm
2. https://dic.academic.ru/dic.nsf/ruwiki/1219102
3. http://nuclphys.sinp.msu.ru/enc/e064.htm
4. https://www.krugosvet.ru/enc/naukaitehnika/himiya/IZOTOPI.html
5. http://www.lomonosov−fund.ru/enc/ru/encyclopedia:01310482. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа
Ответ:
Изотопы
Изотопы – разновидности одного и того же химического элемента, близкие по своим физико−химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно−нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов $^{А}_{Z}Х$ , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение $^{А}Х$.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1H называют иногда протием).
Применение изотопов
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях.
В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Изотопные технологии находят широкое применение в медицине.?. Вопросы и задания
1. Как вы думаете, почему изотопы калия $^{40}_{19}K$ и аргона $^{40}_{18}Ar$, имеющие одинаковые массы, проявляют разные свойства?
Ответ:
Химические свойства изотопов определяются зарядом ядра, а не его массой.
Изотопы калия $^{40}_{19}K$ и аргона $^{40}_{18}Ar$ имеют одинаковую массу, но разный разряд ядра (+19 у калия, +18 у аргона). Поэтому калий и аргон проявляют разные свойства.2. Почему в таблице Д.И. Менделеева относительная атомная масса аргона близка к 40, а калия — к 39?
Ответ:
Относительные атомные массы химических элементов — это средние значения атомных масс изотопов элемента с учетом их долей содержания в природе. Содержание в природе изотопа $^{39}K$ значительно больше, чем изотопа $^{40}K$, поэтому среднее значение относительной атомной массы калия приближается к 39.
Содержание в природе изотопа $^{40}Ar$ значительно больше, чем изотопа $^{39}Ar$ , поэтому среднее значение относительной атомной массы аргона приближается к 40.3. Пользуясь названиями элементарных частиц, из которых состоят атомные ядра, дайте другое определение изотопов.
Ответ:
Изотопы − разновидности атомов одного элемента, имеющие одинаковое количество протонов, но разное количество нейтронов (то есть заряжены одинаково, но весят по−разному).
4. Почему изотопы хлора одинаковы между собой по свойствам, тогда как свойства изотопов водорода различны?
Ответ:
Относительная атомная масса хлора − 35,5, следовательно, изменение числа нейтронов его ядра на 1−3 не повлияет значительно на его массу. Заряд ядра при этом остаётся +17.
У изотопов водорода, не смотря на постоянство заряда ядра (+1), при добавлении одного и двух нейтронов масса ядра изменяется в 2 или 3 раза, поэтому свойства изотопов водорода будут разные.5. Почему дейтериевую воду $D_{2}O$ называют тяжёлой водой? Подготовьте сообщение «Сравнение свойств лёгкой и тяжёлой воды», пользуясь дополнительными источниками информации.
Ответ:
Хотя у тяжеловодородной воды та же химическая формула, что и у обычной, вместо атомов лёгкого изотопа водорода протия она содержит атомы тяжёлого изотопа водорода дейтерия. Поэтому ее называют тяжелой водой.
Таблица. Сравнение характеристик лёгкой и тяжёлой воды.
Параметр D2O H2O
Температура плавления, °C 3,82 0,00
Температура кипения, °C 101,4 100,0
Плотность при 20 °C, г/см³ 1,1056 0,9982
Температура максимальной
плотности, °C 11,6 4,0
Вязкость при 20 °C,
сантипуаз 1,2467 1,0016
Поверхностное натяжение
при 25 °C, дин·см 71,87 71,98
Молярное уменьшение
объёма при плавлении,
см³/моль 1,567 1,634
Молярная теплота
плавления, ккал/моль 1,515 1,436
Молярная теплота
парообразования, ккал/моль 10,864 10,515
pH при 25 °C 7,41 7,006. Найдите в таблице Д. И. Менделеева три пары элементов, у которых, подобно паре Ar − K, вначале расположен элемент с бо́льшим значением относительной атомной массы.
Ответ:
Элементы в таблице Д. И. Менделеева , у которых, подобно паре Ar − K, вначале расположен элемент с бо́льшим значением относительной атомной массы:
$^{128}_{52}Тe - ^{127}_{53}I$ (теллур − йод).
$^{232}_{90}Тh - ^{231}_{91}Pa$ (торий −протактиний).
$^{238}_{92}U - ^{237}_{93}Np$ (уран − нептуний) §9
-
§9. Строение электронных оболочек атомов
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb125.htm
2. http://www.hemi.nsu.ru/ucheb126.htm
3. https://ru.wikipedia.org/wiki/Электронная_оболочка
4. https://uchitel.pro/строение−электронных−оболочек−атомо/#:~:text=Электронная%20оболочка%20атома%20—%20это%20все,энергия%20его%20взаимодействия%20с%20ядром.
5. https://foxford.ru/wiki/himiya/stroenie−elektronnyh−obolochek
6. http://www.chemnet.ru/rus/teaching/general/lection7.pdf
7. https://dic.academic.ru/dic.nsf/ruwiki/246602. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Электронная оболочка атома
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается
Валентная оболочка— самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
На самом деле всё немного иначе. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.?. Вопросы и задания
1. Изобразите схемы строения электронной оболочки атомов: а) алюминия; б) фосфора; в) кислорода.
Ответ:
а) Алюминий.
Al +13 $)_{2})_{8})_{3}$
$^{}_{13}Al$ $2e^{-},8e^{-},3e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{1}$
б) Фосфор.
P +15 $)_{2})_{8})_{5}$
$^{}_{15}P$ $2e^{-},8e^{-},5e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{3}$
в) Кислород.
O +8 $)_{2})_{6}$
$^{}_{8}O$ $2e^{-},6e^{-}$
$1s^{2}2s^{2}2p^{4}$2. Сравните строение электронной оболочки атомов: а) азота и фосфора; б) фосфора и серы.
Ответ:
а) Азот и фосфор.
N +7 $)_{2})_{5}$
$^{}_{7}N$ $2e^{-},5e^{-}$
$1s^{2}2s^{2}2p^{3}$
P +15 $)_{2})_{8})_{5}$
$^{}_{15}P$ $2e^{-},8e^{-},5e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{3}$
У фосфора больше заряд ядра. Оба атома содержат по 5 электронов на последнем энергетическом уровне. Строение электронной оболочки этих атомов схоже, однако у азота всего 2 энергетических уровня, а у фосфора их 3.
б) Фосфор и сера.
P +15 $)_{2})_{8})_{5}$
$^{}_{15}P$ $2e^{-},8e^{-},5e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{3}$
S +16 $)_{2})_{8})_{6}$
$^{}_{16}S$ $2e^{-},8e^{-},6e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{4}$
Атомы фосфора и серы имеют по 3 энергетических уровня, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы их 6.3. Впишите пропущенные слова в предложения: «Атом кремния содержит в ядре ... протонов и ... нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно ... элемента. Число энергетических уровней определяется номером ... и равно ... . Число электронов на внешнем электронном слое определяется номером ... и равно ...»
Ответ:
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число электронов на внешнем электронном слое определяется номером группы и равно 4.
4. Определите положение химического элемента в Периодической системе Д.И. Менделеева по его электронной формуле: а)$2e^{-}, 8e^{-}$; б)$2e^{-}, 8e^{-}, 4e^{-}$.
Ответ:
Число электронов равно порядковому номеру элемента.
а) У этого элемента порядковый номер 10 (так как содержит 10 электронов), он располагается во 2 периоде (так как имеет 2 энергетических уровня), в главной подгруппе VIII группы (так как 8 электронов на внешнем энергетическом уровне). Это неон Ne.
б) У этого элемента порядковый номер 14 (так как содержит 14 электронов),он располагается во 3 периоде (так как имеет 3 энергетических уровня), в главной подгруппе IV группы (так как 4 электрона на внешнем энергетическом уровне). Это кремний Si.5. Почему в 1−м периоде Периодической системы Д.И. Менделеева содержится только два элемента, а во 2−м — только восемь?
Ответ:
Максимальное число электронов, находящихся на энергетическом уровне, можно определить по формуле: $2n^{2}$, где n−номер уровня. Следовательно, первый энергетический уровень максимально может содержать 2 электрона ($2 * 1^{2} = 2$), а второй энергетический уровень 8 электронов ($2 * 2^{2} = 8$). Поэтому в 1−м периоде Периодической системы Д. И. Менделеева содержится только два элемента, а во 2−м – восемь.
6. Приведите примеры периодически повторяющихся явлений, с которыми вы познакомились при изучении других учебных предметов
Ответ:
Примеры периодически повторяющихся явлений:
− колебания маятника;
− смена времён года;
− смена дня и ночи;
− приливы и отливы;
− биоритмы;
− лунные и солнечные затмения;
− график синусоиды.7. Попробуйте дать собственное толкование следующих строк из стихотворения В. Брюсова «Мир электрона»:
Быть может, эти электроны −
Миры, где пять материков,
Искусства, званья, войны, троны
И память сорока веков.
Ещё, быть может, каждый атом −
Вселенная, где сто планет;
Там всё, что здесь, в объёме сжатом,
Но также то, чего здесь нет.Ответ:
Электроны и строение атома были открыты в начале XX века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома. Автор допускает, что эта сжатая планетарная система не такая, как наша.
Также автор допускает возможность, что и электроны тоже сложные частицы, строение которых мы еще просто не изучили.8. О каком поэтическом даре говорят приведённые выше строчки, если учесть, что стихотворение было написано в 1922 г.?
Ответ:
Приведенные четверостишия говорят о гибком уме В. Брюсова, раз он мог так легко понять и принять все достижения современной ему науки, а также, по всей видимости, просвещенности и образованности в данной области. У В. Брюсова был дар объяснять сложные вещи простыми словами, да еще и в стихах.
§10
-
§10. Ионная химическая связь
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://dic.academic.ru/dic.nsf/ruwiki/942689
2. https://obrazovaka.ru/himiya/ionnaya−himicheskaya−svyaz−shema−obrazovaniya−11−klass.html
3. http://www.chem.msu.ru/rus/school/zhukov1/07.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Ионная химическая связь
Ионы – это атомы, потерявшие или получившие электроны и, как следствие, некоторый заряд. Ионы бывают двух типов: катионы (положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы (заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Атомы, имеющие практически полную или практически пустую валентную (внешнюю) оболочку, наиболее охотно вступают в химические реакции. Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Типичный металл охотно отдает электроны, тогда как типичный неметалл охотнее их забирает. Поэтому чаще всего ионную связь образуют металлы и неметаллы.
Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве.?. Вопросы и задания
1. Сравните строение и свойства атомов: а) углерода и кремния; б) кремния и фосфора.
Ответ:
а) Углерод и кремний.
С +6 $)_{2})_{4}$
$^{}_{6}С$ $2e^{-},4е^{-}$
$1s^{2}2s^{2}2p^{2}$
Si +14 $)_{2})_{8})_{4}$
$^{}_{14}Si$ $2e^{-},8e^{-},4e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{2}$
По строению электронной оболочки эти элементы схожи, оба на последнем энергетическом уровне имеют по 4 электрона, но у углерода два энергетических уровня, а у кремния их три. Т. к. у кремния количество энергетических уровней больше, чем у углерода, то радиус атома кремния больше, чем у углерода, поэтому металлические свойства у кремния выражены сильнее, чем у углерода.
б) Кремний и фофор.
Si +14 $)_{2})_{8})_{4}$
$^{}_{14}Si$ $2e^{-},8e^{-},4e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{2}$
P +15 $)_{2})_{8})_{5}$
$^{}_{15}P$ $2e^{-},8e^{-},5e^{-}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{3}$
Атомы кремния и фосфора имеют по 3 энергетических уровня, но у кремния на последнем энергетическом уровне 4 электрона, а у фосфора их 5. У фосфора неметаллические свойства выражены сильнее, чем у кремния, потому что фосфору для завершения энергетического уровня необходимо 3 электрона, а кремнию 4 электрона.2. Рассмотрите схемы образования ионной связи между атомами химических элементов: а) калия и кислорода; б) лития и хлора; в) магния и фтора.
Ответ:
а) Калий (К) и кислород (O).
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов калия нужно взять, чтобы они отдали два электрона (т.е. надо взять 2 атома калия), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом кислорода).
K0 — 1e- → K+
O0 + 2e- → O2-
2K0 + O0 → K2+O2-
| 2e ↑
б) Литий (Li) и хлор (Cl).
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7.
Хлор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов лития нужно взять, чтобы они отдали один электрон (т.е. надо взять 1 атом лития), и сколько атомов хлора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом хлора).
Li0 — 1e- → Li+
Cl0 + 1e- → Cl-
Li0 + Cl0 → Li+Cl-
| 1e ↑
в) Магний (Mg) и фтор (F).
Магний — элемент II группы главной подгруппы, металл. Его атому легче отдать 2 внешних электрона, чем принять недостающие 6.
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов магния нужно взять,чтобы они отдали два электрона (т.е. надо взять 1 атом магния), и сколько атомов фтора надо взять, чтобы они могли принять два электрон (т.е. нужно взять 2 атом фтора).
Mg0 — 2e- → Mg2+
F0 + 1e- → F-
Mg0 + 2F0 → Mg2+F2-
| 2e ↑3. Назовите самый типичный металл и самый типичный неметалл Периодической системы Д.И. Менделеева.
Ответ:
Металлические свойства усиливаются в периодах справа налево, а в группах сверху вниз, поэтому самый типичный металл – франций (Fr). Неметаллические свойства усиливаются в периодах слева направо, а в группах снизу вверх, поэтому самый типичный неметалл – фтор (F).
4. Пользуясь дополнительными источниками информации, объясните, почему инертные газы стали называть благородными.
Ответ:
Благородными называют обычно инертные вещества, встречающиеся в природе в свободном виде. Эти вещества вступают в химические реакции только в довольно сложных условиях.
§11
-
§11. Ковалентная химическая связь
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb132.htm
2. https://dic.academic.ru/dic.nsf/ruwiki/972648
3. https://ru.wikipedia.org/wiki/Ковалентная_связь
4. https://foxford.ru/wiki/himiya/kovalentnaya−svyaz−i−ee−harakteristiki2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Ковалентная химическая связь
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы.
Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов ($H_{2}, Cl_{2}, N_{2}$) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Существуют три вида ковалентной химической связи, отличающихся механизмом ее образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующиеся связь в равной степени владеют обобществленной электронной парой, такая связь называется неполярной ковалентной связью. Если атомы различны, тогда степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов, атом с большей электроотрицательностью в большей степени обладает парой электронов связи, и поэтому его истинный заряд имеет отрицательный знак, атом с меньшей электроотрицательностью приобретает соответственно такой же по величине заряд, но с положительным знаком.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов (донор), второй из атомов, участвующий в образовании связи называется акцептором. В образовавшейся молекуле формальный заряд атома донора увеличивается на единицу, а формальный заряд атома акцептора уменьшается на единицу.
3.Семиполярная связь. Этот вид ковалентной связи образуется между атомом, обладающим неподеленной парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
− окисление (перенос одного электрона) атома с НЭП атомом с двумя неспаренными электронами. В результате атом с НЭП превращается в катион−радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами − в анион−радикал (отрицательно заряженная частица с неспаренным электроном).
− обобществление неспаренных электронов (как в случае простой ковалентной связи).?. Вопросы и задания
1. Все элементы главной подгруппы VII группы (VIIА группы) Периодической системы Д.И. Менделеева (подгруппы фтора) образуют простые вещества, состоящие из двух атомных молекул. Запишите электронную схему образования и структурную формулу таких молекул, пользуясь общим химическим знаком для всей подгруппы Г (галоген).
Ответ:
Электронная формула:
•• •• •• ••
:Г• + •Г : → :Г(:)Г:
•• •• •• ••
Структурная формула.
Г- Г2. Запишите схемы образования химических связей для веществ, состав которых отображают формулами KCl и $Cl_{2}$.
Ответ:
1. KCl.
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Хлор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов калия нужно взять, чтобы они отдали один электрон (т.е. надо взять 1 атом калия), и сколько атомов хлора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом хлора).
K0 — 1e- → K+
Cl0 + 1e- → Cl-
K0 + Cl0 → K+Cl-
| 1e ↑
2. $Cl_{2}$
Хлор — это элемент главной подгруппы VII группы. Его атомы имеют по семь электронов на внешнем уровне. Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 – N = число неспаренных электронов, где N— номер группы химического элемента.
Следовательно, атомы хлора будут иметь (8 – 7 = 1) один неспаренный электрон.
•• •• •• ••
:Cl• + •Cl: → :Cl(••)Cl:
•• •• •• ••
Cl − Cl
Связь между атомами одного и того же элемента ковалентная.3. Сколько неспаренных электронов имеют атомы серы? Какая связь будет в молекулах $S_{2}$? Запишите схему образования химической связи в молекулах $S_{2}$.
Ответ:
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 – N = число неспаренных электронов, где N— номер группы химического элемента.
Следовательно, атомы серы будут иметь (8 – 6 = 2) два неспаренный электрона.
В молекуле $S_{2}$ атомы связаны двумя общими электронными парами, поэтому связь двойная. Связь между атомами одного и того же элемента, ковалентна.
Схема образования химической связи в молекуле $S_{2}$:
•• •• •• ••
•S• + •S• → S(::)S
•• •• •• ••
S = S4. Расположите в порядке увеличения прочности химической связи вещества с формулами $S_{2}, Cl_{2}, N_{2}$ и обоснуйте правильность своего решения. Как будет изменяться длина связи в молекулах составленного вами ряда?
Ответ:
Чем больше общих электронных пар у атомов в молекуле, тем прочнее связаны они друг с другом и тем меньше расстояние между ядрами атомов, соответственно, меньше длина связи.
В ряде соединений $Cl_{2}, S_{2}, N_{2}$ увеличивается прочность связи и уменьшается длина связи. Это связано с кранотстью связи как показано далее.
У хлора 7 электронов на внешнем энергетическом уровне.
•• •• •• ••
:Cl• + •Cl: → :Cl(••)Cl:
•• •• •• ••
$Cl - Cl$
В молекуле $Сl_{2}$ атомы связаны одной общей электронной парой, поэтому связь одинарная.
У серы 6 электронов на внешнем энергетическом уровне.
•• •• •• ••
•S• + •S• → S(::)S
•• •• •• ••
$S = S$
В молекуле $S_{2}$ атомы связаны двумя общими электронными парами, поэтому связь двойная.
У азота 5 электронов на внешнем энергетическом уровне.
• • • •
:N• + •N: = :N(:::)N:
• • • •
N ≡ N
В молекуле $N_{2}$ атомы связаны тремя общими электронными парами, поэтому связь тройная.5. Разделите вещества на две группы по типу химической связи: $N_{2}, Li_{2}O, KCl, O_{2}, CaF_{2}, H_{2}$.
Ответ:
Ионная связь Ковалентная связь
(между металлом (между атомами
и неметаллом) неметаллов)
$Li_{2}O$ $N_{2}$
$KCl$ $O_{2}$
$CaF_{2}$ $H_{2}$ §12
-
§12. Ковалентная полярная химическая связь
Лабораторный опыт №4
Изготовление моделей молекул бинарных соединений.
Используя шаростержневые наборы, соберите модели молекул следующих веществ:
вариант 1 − хлороводорода HCl, четырёххлористого углерода $ССl_{4}$;
вариант 2 − сернистого газа $SO_{2}$, метана $CH_{4}$.Ответ:
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb132.htm
2. https://dic.academic.ru/dic.nsf/ruwiki/972648
3. https://scienceland.info/chemistry8/covalent−bond12. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Электроорицательность
При взаимодействии элементов образуются электронные пары за счёт принятия или отдачи электронов. Способность атома оттягивать электроны была названа Лайнусом Полингом электроотрицательностью химических элементов. Полинг составил шкалу электроотрицательности элементов от 0,7 до 4.
Электроотрицательность (ЭО) – количественная характеристика элемента, показывающая, с какой силой притягиваются электроны ядром атома. ЭО также характеризует способность удерживать валентные электроны на внешнем энергетическом уровне.
Возможность отдавать или принимать электроны определяет принадлежность элементов к металлам или неметаллам. Ярко выраженными металлическими свойствами обладают элементы, легко отдающие электроны. Элементы, принимающие электроны проявляют неметаллические свойства.
Электроотрицательность проявляется в химических соединениях и показывает смещение электронов в сторону одного из элементов.
Электроотрицательность увеличивается слева направо и уменьшается сверху вниз в периодической таблице Менделеева.
Определить значение можно с помощью таблицы электроотрицательности химических элементов или шкалы Полинга. За единицу принята электроотрицательность лития.
Наибольшей ЭО обладают окислители и галогены. Значение их электроотрицательности больше двух. Рекордсменом является фтор с электроотрицательностью 4
Наименьшую ЭО (меньше двух) имеют металлы первой группы периодической таблицы. Активными металлами считаются натрий, литий, калий, т.к. им легче расстаться с единственным валентным электроном, чем принять недостающие электроны.
Некоторые элементы занимают промежуточное положение. Их электроотрицательность близка к двум. Такие элементы (Si, B, As, Ge, Te) проявляют металлические и неметаллические свойства.
Для удобства сравнения ЭО используется ряд электроотрицательности элементов. Слева располагаются металлы, справа – неметаллы. Чем ближе к краям, тем активнее элемент. Самый сильным восстановителем, легко отдающим электроны и имеющим наименьшую электроотрицательность, является цезий. Активным окислителем, способным притягивать электроны, является фтор.?. Вопросы и задания
1. У атомов водорода и фосфора почти одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина $PH_{3}$?
Ответ:
В молекуле фосфина $PH_{3}$ ковалентная неполярная химическая связь, так как значения электроотрицательности (ЭО) водорода H и фосфора P приблизительно одинаковы.
Н
|
Н-Р-Н2. Определите тип химической связи и запишите схему её образования для веществ с формулами:
а) $S_{2}, K_{2}O$ и $H_{2}S$;
б) $N_{2}, LiF$ и $Cl_{3}N$.Ответ:
а) $S_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 – N = число неспаренных электронов, где N— номер группы химического элемента.
Следовательно, атомы серы будут иметь (8 – 6 = 2) два неспаренный электрона.
В молекуле $S_{2}$ атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования химической связи в молекуле $S_{2}$:
•• •• •• ••
•S• + •S• → S(::)S
•• •• •• ••
S = S
$K_{2}O$ − ионная связь, так как она образована атомами элементов металла и неметалла.
Калий — это элемент главной подгруппы I группы Периодической системы Д.И. Менделеева, металл. Его атому легче отдать один внешний электрон, чем принять недостающие семь.
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2 * 1). Затем определим, сколько атомов калия нужно взять, чтобы они отдали два электрона (т.е. надо взять 2 атома калия), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом кислорода).
K0 — 1e- → K+
O0 + 2e- → O2-
2K0 + O0 → K2+O2-
|_2e_↑
$H_{2}S$ − ковалентная полярная связь, так как она образована атомами разных элементов − неметаллов.
Водород (H) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Сера (S) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Непарных электронов будет: 8−6 = 2.
•• ••
H• + •S• + •H → H(••)S(••)H
•• ••
Н − S − H
Общие электронные пары будут смещены от водорода к сере, как к более электроорицательному элементу.
Hδ+ → S2δ- ← Hδ+
б) $N_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
В молекуле $N_{2}$ атомы связаны тремя общими электронными парами, поэтому связь тройная.
Схема образования химической связи в молекуле $N_{2}$:
• • • •
:N• + •N: = :N(:::)N:
• • • •
N ≡ N
$LiF$ − ионная связь.
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7.
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Найдём наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1 (1 * 1). Затем определим, сколько атомов лития нужно взять, чтобы они отдали один электрон (т.е. надо взять 1 атом лития), и сколько атомов фтора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом фтора).
Li0 — 1e- → Li+
F0 + 1e- → F-
Li0 + F0 → Li+F-
|_1e_↑
$Cl_{3}N$ − ковалентная полярная связь.
Хлор (Cl) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Непарных электронов будет: 8−7 = 1.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
Cl-N-Cl
|
Cl
Общие электронные пары будут смещены от азота к хлору, как к более электроорицательному элементу.3. В какой из молекул − хлороводорода HCl или фтороводорода HF − ковалентная химическая связь более полярна?
Ответ:
В ряду электроотрицательности фтор (самый э/о элемент) и водород более отдалены друг от друга, чем хлор и водород, значит у молекулы фтороводорода HF связь более полярная.
4. В следующих предложениях впишите пропущенные слова и выражения: «Ковалентная химическая связь образуется за счёт .... По числу общих электронных пар она бывает .... По ЭО ковалентную связь делят на ... и ...»
Ответ:
Ковалентная химическая связь образуется за счет образования общих электронных пар. По числу общих электронных пар она бывает одинарной, двойной и тройной. По ЭО ковалентную связь делят на полярную и неполярную.
5. Определите валентности элементов в соединениях с формулами:
PbS, $PbO_{2}, FeS_{2}, Fe_{2}S_{3}, SF_{6}$.Ответ:
PbS
Свинец (Pb) в своих соединениях проявляет валентности равные II и IV.
В данном соединении валентность у свинца II.
Определим общее число валентностей всех атомов свинца: II * 1 = 2.
Разделим полученное число на число атомов серы − это и будет значение её валентности: 2 : 1 = II.
$\overset{II}{Pb}\overset{II}{S}$
$PbO_{2}$
Валентность кислорода постоянна $Pb\overset{II}{S_{2}}$.
Общее число валентностей всех атомов кислорода: II * 2 = 4.
Валентность серы: 4 : 1 = IV
$\overset{IV}{Pb}\overset{II}{S_{2}}$.
$ FeS_{2}$
Сера в своих соединениях проявляет валентности равные II, IV и VI.
В данном соединении валентность у серы II.
Общее число валентностей всех атомов серы: II * 2 = 4.
Валентность железа: 4 : 1 = IV
$\overset{IV}{Fe}\overset{II}{S_{2}}$.
$Fe_{2}S_{3}$
Валентность серы II. $Fe_{2}\overset{II}{S_{3}}$.
Общее число валентностей всех атомов серы: II * 3 = 6.
Валентность железа: 6 : 2 = 3
$\overset{III}{Fe_{2}}\overset{II}{S_{3}}$.
$SF_{6}$.
Валентность фтора постоянна $S\overset{I}{F_{6}}$.
Общее число валентностей всех атомов фтора: I * 6 = 6.
Валентность серы: 6 : 1 = VI
$\overset{VI}{S}\overset{I}{F_{6}}$.6. Запишите формулы хлоридов — соединений элементов с одновалентным хлором: железа (III), меди (I), меди (II),марганца (IV), фосфора (V).
Ответ:
Fe (III): $\overset{III}{Fe}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 3 * 1 = 3.
Разделим наименьшее общее кратное на валентность каждого элемента − определим индексы, т.е. число атомов каждого элемента в формуле данного вещества: 3 : III = 1; 3 : I = 3 → $FeCl_{3}$ − хлорид железа (III)
Сu (I): $\overset{I}{Cu}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 1 * 1 = 1.
Разделим наименьшее общее кратное на валентность каждого элемента:
1 : I = 1; 1 : I = 1 → CuCl − хлорид меди (I)
Сu (II): $\overset{II}{Cu}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 2 * 1 = 2.
Разделим наименьшее общее кратное на валентность каждого элемента:
2 : II = 1; 2 : I = 2 → $CuCl_{2}$ − хлорид меди (II)
Mn (IV): $\overset{IV}{Mn}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 4 * 1 = 4.
Разделим наименьшее общее кратное на валентность каждого элемента:
4 : IV = 1; 4 : I = 4 → $MnCl_{4}$ − хлорид марганца (IV)
P (V): $\overset{V}{P}\overset{I}{Cl}$
Наименьшее общее кратное между валентностями элементов: 5 * 1 = 5.
Разделим наименьшее общее кратное на валентность каждого элемента:
5 : V = 1; 5 : I = 5 → $PCl_{5}$ − хлорид фосфора (V) §13
-
§13. Металлическая химическая связь
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Металлическаясвязь
2. https://obrazovaka.ru/himiya/metallicheskaya−himicheskaya−svyaz−primery.html
3. https://cifra.school/media/conspectfiles/3f5e9378−4eed−4e9c−9ebf−3f8ed5bed28e.pdf2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
− на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
− атом имеет сравнительно большой радиус;
− атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3−м энергетическом уровне, который имеет десять орбиталей (одну s−, три р− и пять d−орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом−ионами.
Металлическая связь − это связь, образующаяся между атом−ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро− и теплопроводность.?. Вопросы и задания
1. Металлическая связь имеет черты сходства с ковалентной связью. Сравните эти химические связи между собой.
Ответ:
Сходство между ковалентной и металлической связью состоит в обобществлении валентных электронов. Однако, при образовании ковалентной связи обобществляются внешние неспаренные электроны между двумя соседними атомами, в рамках одной молекулы, в то время как, при образовании металлической связи обобществляются валентные электроны всех атомов.
2. Металлическая связь имеет черты сходства с ионной связью. Сравните эти химические связи между собой.
Ответ:
В металлической и в ионной связи участвуют элементы−металлы. Ионная связь образуется между металлом и неметаллом, а металлическая между атомами металла. Металл в ионной связи представлен в виде положительно заряжённого иона, а металлической связи металл представлен то в виде нейтрального атома, то в виде иона. В ионной связи металл отдает валентные электроны неметаллу, а в металлической связь основана на обобществлении валентных электронов всех атомов металла.
3. Как можно повысить твёрдость металлов и сплавов?
Ответ:
Твёрдость металлов и сплавов повысится от добавления веществ с ковалентной связью. Наиболее распространёнными являются карбиды и нитриды. Объясняется это тем, что нитриды и карбиды имеют алмазоподобную кристаллическую решетку.
А так же повысить твёрдость можно:
− термически (различные виды закалки, рекристаллизация)
− химико−термически (легирование, алитирование, хромирование и др.)
− механически (наклеп, старение, обкатывание и др.)4. По формулам веществ определите тип химической связи в них: $Ba, BaBr_{2}, HBr, Br_{2}$.
Ответ:
Ba: Ва − металл, простое вещество, следовательно, связь − металлическая
$BaBr_{2}$: Ва − металл, Br − неметалл, следовательно, связь − ионная.
HBr: H − металл с низкой элетроотрицательностью, Br − металл с высокой элетроотрицательностью, следовательно, связь − ковалентная полярная.
$Br_{2}$: Ва − неметалл, вещество образовано двумя одинаковыми атомами нематалла, следовательно, связь − ковалентная неполярная.Темы для дискуссии
1. На примере изотопов различных химических элементов покажите, как их относительная атомная масса влияет на свойства образованных ими веществ.
Ответ:
Разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное массовое число, называют изотопами.
Большинство химических свойств изотопов хлора, калия ($^{39}_{19}K$ и $^{40}_{19}K$) или аргона ( $^{39}_{18}Ar$ и $^{40}_{18}Ar$), как и изотопов многих других химических элементов, практически не отличаются, кроме самых лёгких элементов.
Химические свойства определяются конфигурацией электронного облака атома.
Например, атомы природного хлора представляют собой смесь двух изотопов с массой 35 $^{35}_{17}Cl$ (их в природе 75%) и 37 $^{37}_{17}Cl$ (их 25%). Относительная атомная масса хлора равна 35,5:
Ar(Cl) = 35 * 0,75 + 37 * 0,25 = 35,5.
Изменение числа нейтронов его ядра на 1−3 не повлияет значительно на его массу. Заряд ядра при этом остаётся +17.
У изотопов водорода, не смотря на постоянство заряда ядра (+1), при добавлении одного и двух нейтронов масса ядра изменяется в 2 или 3 раза. Что и влияет на значительные различия в свойствах изотопов водорода.
Им даже присвоены индивидуальные названия и химические знаки: протий − $^{1}_{1}Н$; дейтерий − $^{2}_{1}Н$, или $^{2}_{1}D$; тритий − $^{3}_{1}Н$, или $^{3}_{1}T$.
Таким образом, только у очень лёгких изотопов свойства изотопов могут заметно отличаться.2. Приведите аргументы, доказывающие, что деление химической связи на типы относительно.
Ответ:
Деление химических связей на типы носит условный характер, поскольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Например, фторид лития LiF относят к ионным соединениям. Фактически же в нем связь на 80% ионная и на 20% ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
Различные типы связей могут содержаться в одних и тех же веществах, например:
− в основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой − ионная;
− в солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка − ковалентная полярная, а между металлом и кислотным остатком − ионная;
− в солях аммония, метиламмония и т. д.: между атомами азота и водорода − ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком − ионная;
− в пероксидах металлов (например, $Na_{2}O_{2}$) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т.д.
Различные типы связей могут переходить одна в другую:
− при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
− при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно−ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно−ядерного взаимодействия атомов, сопровождающегося выделением энергии. §14
-
ГЛАВА ВТОРАЯ. Простые вещества
§14. Простые вещества - металлы
Лабораторный опыт №5
Ознакомление с коллекцией металлов.
Ознакомьтесь с коллекцией металлов.
Запишите химические знаки выданных вам металлов, расположите их в порядке возрастания:
1) плотности;
2) пластичности;
3) твёрдости;
4) металлического блеска;
5) электропроводности;
6) теплопроводности.
Для выполнения задания используйте приложения 1 и 2, дополнительные источники информации.Ответ:
Учитель может выдать любые металлы. Например, литий, магний, медь, цинк.
По возрастанию
1) плотности: Li → Mg → Zn → Cu;
2) пластичности: Mg → Zn → Cu → Li ;
3) твёрдости: Li → Zn → Mg → Cu ;
4) металлического блеска: Cu → Zn → Mg → Li;
5) электропроводности: Li → Zn → Mg → Cu ;
6) теплопроводности: Li → Zn → Mg → Cu .i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Металлы
2. https://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g414.html
3. https://allmetalls.ru/fiz.html
4. http://delta−grup.ru/bibliot/6/10.htm
5. https://obrazovaka.ru/himiya/fizicheskie−svoystva−metallov−primenenie−tablica−9−klass.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Физические свойства металлов
Металлы обладают рядом сходных химических свойств, которые отличают их от неметаллов. Цвет металлов довольно однообразен и изменяется от серебристо−белого (алюминий, серебро) до серебристо−серого (железо, свинец). Обладают цветом только золото – оно желтое и медь – красная. Некоторые металлы имеют оттенки серого, например, висмут – красноватый, цинк – синеватый.
В компактном состоянии все металлы в большей или меньшей степени обладают металлическим блеском, довольно высокой плотностью, тепло− и электропроводностью и пластичностью. Твердость металлов различна, так же значительно различаются их температуры плавления и кипения. Основные физические свойства металлов:
1. Металлический блеск. Способность поверхности металла отражать световые лучи. In и Ag отражают свет лучше других металлов, поэтому применяются для изготовления зеркал.
2. Плотность, ρ. Физическая величина, измеряемая отношением массы тела к его объему. Самый легкий металл – литий: ρ = 530 $кг/м^{3}$;
самый тяжелый – осмий: ρ = 22600 $кг/м^{3}$.
3. Твердость, Н. Способность (свойство) твердого тела сопротивляться проникновению в него другого тела. Самые мягкие металлы: K, Rb, Cs, Na
(режутся ножом); самый твердый металл – Cr (режет стекло).
4. Пластичность. Способность тела изменять форму под действием внешних сил без разрушения. Из пластичного золота можно изготовить фольгу толщиной 0,003 мм.
5. Температура плавления, Тпл. Температура, при которой осуществляется процесс перехода вещества из твердого состояния в жидкое. Самая низкая температура плавления у ртути – 39°С, самая высокая – у вольфрама – 3410°С.
6. Теплопроводность. Способность тела передавать теплоту от более нагретых его частей менее нагретым.
7. Электропроводность. Свойство вещества проводить электрический ток (обусловлено наличием в нем свободных электронов). При нагревании электропроводность уменьшается, так как усиливается колебательное движение атомов и ионов в узлах решетки и затрудняется движение электронов.?. Вопросы и задания
1. Какое из веществ, названных в приведённом ниже стихотворении, не относится к металлам?
Семь металлов создал свет
По числу семи планет:
Медь, железо, серебро...
Дал нам Космос на добро.
Злато, олово, свинец...
Сын мой, сера — их отец.
А ещё ты должен знать:
Всем им ртуть — родная матьОтвет:
Среди всех перечисленных вещества сера является неметаллом.
2. Как понимать приведённые в этом стихотворении образные выражения: «сера − их отец» и «ртуть — родная мать»
Ответ:
Согласно алхимической ртутно−серной теории происхождения металлов, сера и ртуть, соединяясь в различных отношениях, образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото.
3. О каком свойстве металлов говорится в начальной строке стихотворения А.С. Пушкина «Кинжал»?
Лемносский бог тебя сковал...О каком свойстве металлов говорится в строках:
Как адский луч, как молния богов,
Немое лезвие злодею в очи блещет,
И, озираясь, он трепещет
Среди своих пиров.Ответ:
В первой строке стихотворения «Кинжал» говорится о ковкости металлов. В следующих строчках говорится о металлическом блеске.
4. Почему авиакомпаниям запрещено перевозить аппараты и приборы, содержащие ртуть?
Ответ ©:
Ртуть ядовита и летуча, она легко испаряется и покрывает все поверхности помещения. Ртуть способна разрушать алюминий, а самолеты сделаны преимущественно из алюминиевых сплавов. Когда ртуть смачивает поверхность алюминиевых деталей, она проникает под оксидный слой и поддерживает эту поверхность в активированном состоянии, на ней больше не может образовываться оксидный слой. Алюминий будет растворяться в ртути и окисляться в контакте с воздухом, деталь будет разрушаться. В ходе этой реакции не происходит расхода ртути, поэтому один раз начавшись, она, в принципе, не остановится, пока вся ртуть не испарится. Посмотреть на это жуткое зрелище можно тут https://www.youtube.com/watch?v=Z7Ilxsu-JlY
5. Пользуясь дополнительной литературой, подготовьте сообщение о появлении зеркал в жизни человека и совершенствовании способов их изготовления.
Ответ:
Археологи обнаружили первые небольшие зеркала из олова, золота и платины, относящиеся к эпохе Бронзы.
Современную историю зеркал отсчитывают с 1240 года, когда в Европе научились выдувать сосуды из стекла. Изобретение настоящего стеклянного зеркала следует отнести к 1279 году, когда итальянский монах-францисканец Джон Пекам описал способ покрывать стекло тонким слоем олова.
Производство зеркала выглядело так. В сосуд через трубку мастер вливал расплавленное олово, которое растекалось ровным слоем по поверхности стекла, а когда шар остывал, его разбивали на куски. Первое зеркало было несовершенным: вогнутые осколки слегка искажали изображение, но оно стало ярким и чистым.
В XIII веке в Голландии освоили кустарную технологию производства зеркал. За ней последовали Фландрия и немецкий город мастеров Нюрнберг, где в 1373 году возник первый зеркальный цех.
В 1407 году венецианские братья Данзало дель Галло выкупили у фламандцев патент, и Венеция целых полтора века удерживала монополию на производство отличных венецианских зеркал, которые следовало бы именовать фламандскими. И хотя Венеция была не единственным местом производства зеркал в то время, но именно венецианские зеркала отличало высочайшее качество. Венецианские мастера добавляли в отражающие составы золото и бронзу. Стоимость одного венецианского зеркала равнялась стоимости небольшого морского судна, и для их покупки французские аристократы иногда были вынуждены продавать целые имения. Например, цифры, дошедшие до наших дней, говорят, что не такое уж большое зеркало размером 100х65 см стоило больше 8000 ливров, а картина Рафаэля того же размера — около 3000 ливров. Зеркала были чрезвычайно дороги. Покупать и коллекционировать их могли лишь очень богатые аристократы и королевские особы.
В начале XVI века братья Андреа Доменико с острова Мурано разрезали вдоль ещё горячий цилиндр из стекла и половинки его раскатали на медной столешнице. Получилось листовое зеркальное полотно, отличавшееся блеском, хрустальной прозрачностью и чистотой. Такое зеркало, в отличие от осколков шара, ничего не искажало. Так произошло главное событие в истории производства зеркал.
В конце XVI века, поддавшись моде, французская королева Мария Медичи заказала в Венеции 119 зеркал для своего зеркального кабинета, заплатив за заказ огромную сумму. Венецианские зеркальщики в ответ на королевский жест проявили также необыкновенную щедрость — подарили французской королеве Марии Медичи зеркало. Оно является самым дорогим в мире, и сейчас хранится в Лувре. Украшено зеркало агатами и ониксами, а рама инкрустирована драгоценными камнями.
Французские аристократы во время роскошных приёмов в своих замках и дворцах, демонстрируя гостям своё благосостояние, с гордостью показывали зеркала в богатых, отделанных драгоценными камнями оправах, более того, знать, а также их жены и любовницы обожали украшать маленькими зеркалами свои парадные наряды. Однажды французская королева Анна Австрийская, мать Людовика XIV, появилась на балу в платье, усыпанном кусочками зеркал. В свете свечей от неё исходило поистине царственное сияние. Это зеркальное платье стоило государственной казне огромных денег, и министр финансов — месье Кольбер — решил, что необходимо что-то срочно делать, иначе страна разорится. Кольбер отправил на Мурано своих доверенных лиц, которые смогли подкупить четырёх мурановских мастеров и под покровом ночи вывезли их на маленькой лодочке во Францию. Французы, поселив беглецов в прекрасной усадьбе, вывезли с Мурано и их семьи. Конечно же, Венеция так просто смириться с дерзким побегом своих подданных не могла — мастерам послали два строгих предупреждения, но те на них не среагировали, понадеявшись на защиту Французской короны. Некоторое время итальянцы работали, наслаждаясь вольной жизнью и высокими заработками. Но потом от отравления умер лучший и самый опытный из них, через две недели — второй. Оставшиеся в живых, осознав, что им грозит, в ужасе стали проситься обратно, домой. Их не удерживали — сообразительные французы уже успели освоить все секреты изготовления зеркал, и в Тур де Виле в 1665 году открылась первая во Франции зеркальная мануфактура.
Французы оказались способными учениками, и вскоре даже превзошли своих учителей. Зеркальное стекло стали получать не выдуванием, как это делали на Мурано, а литьём. Технология заключается в следующем: расплавленное стекло прямо из плавильного горшка выливают на ровную поверхность и раскатывают вальцом. Автором этого способа называют Луку Де-Негу.
После открытия французской зеркальной мануфактуры цены на зеркала стали резко снижаться. Этому способствовали также немецкие и богемские стекольные заводы, производившие зеркала по более низкой цене. Зеркала стали появляться на стенах частных домов, в картинных рамах. В XVIII веке уже две трети парижан обзавелись ими. Кроме того, дамы стали носить на поясе маленькие зеркальца, прикрепленные цепочками.
Революцию в производство зеркал принёс немецкий химик, Юстус фон Либих, начав применять серебро[1] в 1835 году для серебрения зеркал и получая более ясное изображение. Эта технология, практически без изменений до сих пор используется в производстве зеркал.
Источник: https://ru.wikipedia.org/wiki/Зеркало §15
-
§15. Простые вещества - неметаллы
Лабораторный опыт №6
Ознакомление с коллекцией неметаллов.
Ознакомьтесь с коллекцией неметаллов.
Запишите химические формулы выданных вам неметаллов, расположите их в порядке возрастания:
1) плотности;
2) твёрдости;
3) блеска;
4) интенсивности изменения цвета.
Для выполнения задания используйте приложения 1 и 2, дополнительные источники информации.Ответ:
Рассмотрим на примере серы, графита и йода.
В порядке возрастания:
1) плотности: S → C → $I_{2}$;
2) твёрдости: С → S → $I_{2}$;
3) блеска: S → C → $I_{2}$;
4) интенсивности изменения цвета: С → S → $I_{2}$.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Неметаллы
2. https://rosuchebnik.ru/material/nemetally
3. https://nauka.club/khimiya/nemetallу.html
4. https://prosto−o−slognom.ru/chimia/nemetally.html
5. https://al−himik.ru/nemetally/
6. http://chemistrykz.blogspot.com/p/blog−page_22.html
7. https://dic.academic.ru/dic.nsf/ruwiki/8122292. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Благородные газы
Инертные, или благородные газы — химические элементы 18−й группы периодической таблицы химических элементов. К инертным газам относятся гелий, неон, аргон, криптон, ксенон, радон, и, возможно, унуноктий.
Химические свойства
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определенных условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он сильно радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Унуноктий, несмотря на его принадлежность к 18 группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов он будет находиться в твердом состоянии.
Физические свойства
Инертные газы имеют самые большие энергии ионизации.
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет−гигантов.
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти. Известны случаи гибели людей при утечках аргона.
Вдыхание радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются в следующем порядке (в сравнении приведены также азот и водород): $Xe - Кr - Ar - N_{2} - H_{2} - Ne - He$. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа, азот — свыше 0,6 МПа, водород — свыше 2,0 МПа.?. Вопросы и задания
1. Рассмотрите этимологию названий отдельных благородных газов.
Ответ:
Гелий He – от др.−греч. ἥλιος (илиос) – солнце. Впервые был обнаружен на Солцне (путём изучения спектров солнечного излучения).
Неон Ne – от греч. νέος (неос) — новый.
Аргон Аг – от др.−греч. ἀργός (аргос) — ленивый, медленный, неактивный. На момент открытия аргон был самым малоактивным химическим веществом, известным людям.
Криптон Kr – от греч. κρυπτός (криптос) – скрытый, секретный. Криптон удалось обнаружить в воздухе, лишь переведя его в жидкое состояние и удалив кислород, азот и аргон.
Ксенон Xe – др.−греч. ξένος (ксенос) – чужой. Ксенон обнаружен при изучении криптона, он является примесью криптона.
Радон Ra – от латинского radium – луч, название дано по аналогии с другим химическим элементом – радием. Радон обнаружили при изучении свойств радиоактивного радия.2. Почему химически неверно поэтическое выражение: «В воздухе пахло грозой»?
Ответ:
Выражение "В воздухе пахло грозой" химически неверно, т. к. гроза – природное явление, которое не может пахнуть. Запах грозе даёт озон (O3), образующийся в воздухе при разрядах молнии.
3. Запишите схемы образования молекул: $Na_{2}, Br_{2}, O_{2}, N_{2}$. Каков тип химической связи в этих молекулах?
Ответ:
В виде $Na_{2}$ существуют пары натрия, а в парах металлов атомы связаны ковалентной неполярной связью.
Натрий − это элемент главной подгруппы I группы, металл. Его атомы имеют по одному электрону на внешнем уровне.
В молекуле $Na_{2}$ атомы связаны одной общей электронной парой, поэтому связь одинарная.
Схема образования химической связи в молекуле $Na_{2}$:
Na• + •Na = Na(••)Na
Na − Na
$Br_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента неметалла.
Бром (Br) — это элемент главной подгруппы VII группы, неметалл. Его атомы имеют по семь электронов на внешнем уровне.
Неcпаренных электронов будет: 8−7 = 1.
В молекуле $Br_{2}$ атомы связаны одной общей электронной парой, поэтому связь одинарная.
Схема образования химической связи в молекуле $Br_{2}$:
•• •• •• ••
:Br• + :Br• = :Br(••)Br:
•• •• •• ••
Br − Br
$O_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Кислород (O) — это элемент главной подгруппы VI группы, неметалл. Его атомы имеют по шесть электронов на внешнем уровне.
Неcпаренных электронов будет: 8−6 = 2.
В молекуле $O_{2}$ атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования химической связи в молекуле $O_{2}$:
•• •• •• ••
•О• + •О• = О(::)О
•• •• •• ••
O = O
$N_{2}$ − ковалентная неполярная связь, так как она образована атомами одного и того же элемента.
Азот (N) — это элемент главной подгруппы V группы, неметалл. Его атомы имеют по пять электронов на внешнем уровне.
Непарных электронов будет: 8−5 = 3.
В молекуле $N_{2}$ атомы связаны тремя общими электронными парами, поэтому связь тройная.
Схема образования химической связи в молекуле $N_{2}$:
• • • •
:N• + •N: = :N(:::)N:
• • • •
N ≡ N4. Какой тип химической связи должен быть в металлическом водороде?
Ответ:
В металлическом водороде связь должна быть металлической, так как именно она обеспечивает все металлические свойства.
5. Экспедиция полярного исследователя Р. Скотта к Южному полюсу в 1912 г. погибла из−за того, что потеряла весь запас горючего: оно находилось в запаянных оловом баках. Какой химический процесс лежал в основе этого?
Ответ:
В основе этого лежал процесс перехода из одной аллотропной модификации олова, в другую. При низких температурах происходит процесс перехода из β−олова в α−олово, которое представляет из себя серый порошок. По этой причине запаянные оловом баки с горючим были разгерметизированы.
§16
-
§16. Количество вещества
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb154.htm
2. https://ru.wikipedia.org/wiki/Количество_вещества
3. https://resh.edu.ru/subject/lesson/2063/main/
4. https://nauka.club/khimiya/kolichestvo−veshchestva.html
5. https://himi4ka.ru/arhiv−urokov/urok−8−himicheskoe−kolichestvo−veshhestva−i−mol.html
6. https://himi4ka.ru/arhiv−urokov/urok−9−moljarnaja−massa−i−moljarnyj−obem.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Молярная масса
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится $6,02 * 10^{23}$ элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково.
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).?. Вопросы и задания
1. Сколько молекул содержит:
а) 1 кмоль вещества;
б) 1 ммоль вещества.Ответ:
а) Дано:
n = 1 кмоль = $1 * 10^{3}$ моль;
$N_{A} = 6,02 * 10^{23}$ молекул/моль;
_____________
N −?
Решение:
$N = N_{А} * n$;
$N = 6,02 * 10^{23} *1 * 10^{3} = 6,02 * 10^{26}$ молекул;
Ответ. в 1 кмоль вещества содержится $6,02 * 10^{26}$ молекул.
б) Дано:
n = 1 ммоль = $1 * 10^{-3}$ моль.
$N_{A} = 6,02 * 10^{23}$ молекул/моль
_____________
N − ?
Решение:
$N = N_{А} * n$;
$N = 6,02 * 10^{23} *1 * 10^{-3} = 6,02 * 10^{20}$ молекул.
Ответ. в 1 ммоль вещества содержится $6,02 * 10^{20}$ молекул.2. Найдите массу:
а) азота $N_{2}$ количеством вещества 0,75 моль азота;
б) $9*10^{23}$ молекул глюкозы $C_{6}H_{12}O_{6}$;
в) серной кислоты $H_{2}SO_{4}$ количеством вещества 3 кмоль.Ответ:
а) Дано:
n ($N_{2}$)= 0,75 моль
_____________
m ($N_{2}$) − ?
Решение:
m = n * M;
M ($N_{2}$) = 2 * Ar = 2 * 14 = 28 г/моль;
m ($N_{2}$) = 0,75 * 28 = 21 г
Ответ. 21 г.
б) Дано:
N ($C_{6}H_{12}O_{6}$)= $9*10^{23}$ молекул;
_____________
m ($C_{6}H_{12}O_{6}$) − ?
Решение:
m = n * M;
$n = \frac{N}{N_{A}}$
$N_{A} = 6,02 * 10^{23}$ молекул/моль
$n (C_{6}H_{12}O_{6}) = \frac{9*10^{23}}{6,02 * 10^{23}}$ = 1,5 моль
M ($C_{6}H_{12}O_{6}$) = 6 * Ar (C) + 12 * Ar (H) + 6 * Ar (O) = 6 * 12 + 12 * 1 + 6 * 16 = 180;
m ($C_{6}H_{12}O_{6}$) = 1,5 * 180 = 270 г
Ответ. 270 г.
в) Дано:
n ($H_{2}SO_{4}$)= 3 кмоль;
_____________
m ($H_{2}SO_{4}$) − ?
Решение:
m = n * M;
$n = 3 * 10^{3}$ моль;
M ($H_{2}SO_{4}$) = 2 * Ar (H) + 1 * Ar (S) + 4 * Ar (O) = 2 * 1 + 1 * 32 + 4 * 16 = 98;
$m (H_{2}SO_{4}) = 3 * 10^{3} * 98 = 294 * 10^{3}$ = 294 кг
Ответ. 294 кг.3. Сколько молекул содержат:
а) водород количеством вещества 1,5 моль;
б) водород количеством вещества 7 г;
в) водород количеством вещества 4 кмоль?Ответ:
а) Дано:
$n_{a} (Н_{2})$ = 1,5 моль;
$N_{A} = 6,02 * 10^{23}$ молекул/моль;
_____________
N ($Н_{2})$−?
Решение:
$N = n * N_{А}$;
$N (Н_{2}) = 1,5 * 6,02 * 10^{23} = 9,03 * 10^{23}$ молекул.
Ответ. $9,03 * 10^{23}$ молекул.
б) Дано:
$ m (Н_{2})$ = 7 г;
$N_{A} = 6,02 * 10^{23}$ молекул/моль;
_____________
N ($Н_{2}$) −?
Решение:
$N = n * N_{А}$;
$n = \frac{m}{M}$;
М ($Н_{2}$) = 2 * Ar = 2 * 1 = 2 г/моль;
$n (Н_{2}) = \frac{7}{2}$ = 3,5 моль
$N (Н_{2})= 3,5 * 6,02 * 10^{23} = 2,1 * 10^{24}$ молекул.
Ответ. $2,1 * 10^{24}$ молекул.
в) Дано:
а) $n_{a} (Н_{2})$ = 4 кмоль;
$N_{A} = 6,02 * 10^{23}$ молекул/моль;
_____________
N ($Н_{2})$−?
Решение:
$N = n * N_{А}$;
4 кмоль = 4 * $10^{3}$ моль
$N (Н_{2}) = 4 * 10^{3} * 6,02 * 10^{23} = 2,4 * 10^{27}$ молекул.
Ответ. $2,4 * 10^{27}$ молекул.4. Вставьте пропущенные слова в предложения: «Массу измеряют в миллиграммах, ..., килограммах. Количество вещества измеряют в ..., ..., ...».
Ответ:
"Массу измеряют в миллиграммах, граммах, килограммах. Количество вещества измеряют в миллимолях, молях, киломолях".
5. Плотность кислорода равна 1,3 г/л. Вычислите количество вещества кислорода, которое содержится в 1 л его. Сколько молекул кислорода содержится в 1 л; в 1 мл; в 1 $м^{3}$?
Ответ:
Дано:
ρ(O)=1,3 г/л;
$V_{1} (O_{2})$ = 1 л;
$V_{2} (O_{2})$ = 1 мл;
$V_{3} (O_{2}) = 1 м^{3}$;
$N_{A}= 6,02 * 10^{23}$ молекул/моль
_____________
$n_{1} (O_{2})$ − ?
$N_{1} (O_{2})$ − ?
$N_{2} (O_{2})$ − ?
$N_{3} (O_{2})$ − ?
Решение:
$n = \frac{m}{M}$
m = ρ * V;
$m_{1} (O_{2})= 1,3 * 1 = 1,3 $ г;
M ($O_{2}$) = 2 * Ar = 2 * 16 = 32 г/моль;
$n_ {1} (O_{2}) = \frac{1,3}{32}$ = 0,04 моль;
$N = n * N_{А}$;
$N_{1} (O_{2}) = 0,04 * 6,02 * 10^{23} = 2,4 * 10^{22}$ молекул;
$V_{2} (O_{2})$ = 1 мл = 0,001 л;
$m_{2} (O_{2})= 1,3 * 0,001 = 0,0013$ г;
$n_ {2} (O_{2}) = \frac{0,0013}{32}$ = 0,00004 моль;
$N_{2} (O_{2}) = 0,00004 * 6,02 * 10^{23} = 2,4 * 10^{19}$ молекул;
$V_{3} (O_{2}) = 1 м^{3} = 1000 $л;
$m_{3} (O_{2})= 1,3 * 1000 = 1300$ г;
$n_ {3} (O_{2}) = \frac{1300}{32}$ = 40,625 моль;
$N_{3} (O_{2}) = 40,625 * 6,02 * 10^{23} = 2,44 * 10^{25}$ молекул.
Ответ: 0,04 моль; $2,4 * 10^{22}$ молекул; $2,4 * 10^{19}$ молекул; $2,44 * 10^{25}$ молекул. §17
-
§17. Молярный объем газов
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−9−moljarnaja−massa−i−moljarnyj−obem.html
2. http://www.hemi.nsu.ru/ucheb155.htm
3. https://obrazovaka.ru/himiya/molyarnyy−obem−tablica−8−klass.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Молярный объём газов
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается $V_{m}$.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(x) к его химическому количеству n(x):
$V_{m}=\frac{V(x)}{n(x)}$.
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 л/моль. Другими словами, молярный объем любого газа при нормальных условиях:
$V_{m}=\frac{V(x)}{n(x)} =\frac{22,4}{1} - 22,4 $ л/моль.
Молярный объем − это объем, равный 22,4 л, который занимает 1 моль любого газа при нормальных условиях.?. Вопросы и задания
1. Найдите массу и число молекул при н.у. для:
а) кислорода объёмом 11,2 л;
б) азота объёмом 5,6 $м^{3}$;
в) хлора объёмом 22,4 мл.Ответ:
а) Дано:
V ($O_{2}$) = 11,2 л;
_____________
m ($O_{2}$) − ?
N ($O_{2}$) − ?
Решение:
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n (O_{2}) =\frac{11,2}{22,4}$ = 0,5 моль;
m = n * M;
M ($O_{2}$) = 2 * Ar = 2 * 16 = 32 г/моль;
m ($O_{2}$) = 0,5 * 32 = 16 г;
$N = n * N_{А}$;
$N_{A}= 6,02 * 10^{23}$ молекул/моль;
$N (O_{2})= 0,5 * 6,02 * 10^{23} = 3,01 * 10^{23}$ молекул.
Ответ. 16 г; $3,01 * 10^{23}$ молекул.
б) Дано:
$V (N_{2}) = 5,6 м^{3}$;
_____________
m ($N_{2}$) − ?
N ($N_{2}$) − ?
Решение:
$n=\frac{V}{V_{m}}$;
$V (N_{2}) = 5,6 м^{3} = 5,6 * 1000 = 5600$ л;
$V_{m}$= 22,4 л/моль;
$n (N_{2}) =\frac{5600}{22,4}$ = 250 моль;
m = n * M;
M ($N_{2}$) = 2 * Ar = 2 * 14 = 28 г/моль;
m ($N_{2}$) = 250 * 28 = 7000 г = 7 кг;
$N = n * N_{А}$;
$N_{A}= 6,02 * 10^{23}$ молекул/моль;
$N (N_{2})= 250 * 6,02 * 10^{23} = 1,5 * 10^{26}$ молекул.
Ответ. 7 кг; $1,5 * 10^{26}$ молекул.
в) Дано:
V ($Cl_{2}$) = 22,4 мл;
_____________
m ($Cl_{2}$) − ?
N ($Cl_{2}$) − ?
Решение:
$n=\frac{V}{V_{m}}$;
V ($Cl_{2}$) = 22,4 * 0,001 = 0,0224 л;
$V_{m}$= 22,4 л/моль;
$n (Cl_{2}) =\frac{0,0224}{22,4}$ = 0,001 моль;
m = n * M;
M ($Cl_{2}$) = 2 * Ar = 2 * 35,5 = 71 г/моль;
m ($Cl_{2}$) = 0,001 * 71 = 0,071 г = 71 мг;
$N = n * N_{А}$;
$N_{A}= 6,02 * 10^{23}$ молекул/моль;
$N (Cl_{2})= 0,001 * 6,02 * 10^{23} = 6 * 10^{20}$ молекул.
Ответ. 71 мг; $6 * 10^{20}$ молекул.2. Найдите объём, который при н.у. займут:
а) водород массой 3 г;
б) озон массой 96 кг;
в) $12 * 10^{20}$ молекул азота.Ответ:
а) Дано:
m ($H_{2}$) = 3 г.
_____________
V ($H_{2}$) − ?
Решение:
$n = \frac{m}{M}$;
M ($H_{2}$) = 2 * Ar = 2 * 1 = 2 г/моль;
$n (H_{2}) = \frac{3}{2} = 1,5$ моль;
$V = V_{m}* n$;
$V_{m}$= 22,4 л/моль;
V ($H_{2}$) = 22,4 * 1,5 = 33,6 л
Ответ: 33,6 л.
б) Дано:
m ($O_{3}$) = 96 кг;
_____________
V ($O_{3}$) − ?
Решение:
$n = \frac{m}{M}$;
m = 96 * 1000 = 96 000 г;
M ($O_{3}$) = 3 * Ar = 3 * 16 = 48 г/моль;
$n (O_{3}) = \frac{96000}{48} = 2000 $ моль;
$V = V_{m}* n$;
$V_{m}$= 22,4 л/моль;
$V (O_{3}) = 22,4 * 2000 = 44800 л = 44,8 м^{3}$;
Ответ: $44,8 м^{3}$.
в) Дано:
N ($N_{2}$) = $12 * 10^{20}$ молекул.
_____________
V ($N_{2}$) − ?
Решение:
$n = \frac{N}{N_{A}}$;
$N_{A}= 6,02 * 10^{23}$
$n = \frac{12 * 10^{20}}{6,02 * 10^{23}} = 0,002 $ моль.
$V = V_{m}* n$;
$V_{m}$= 22,4 л/моль;
V ($N_{2}$) = 22,4 * 0,002 = 0,0448 л = 44,8 мл.
Ответ: 44,8 л.3. Найдите плотности (массу 1 л) аргона, хлора, кислорода и озона при н.у. Сколько молекул каждого вещества будет содержаться в 1 л при тех же условиях?
Ответ:
Дано:
V = 1 л;
Ar;
$Cl_{2}$;
$O_{2}$;
$O_{3}$.
_____________
ρ − ?
N − ?
Решение:
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n (Ar) = n (Cl_{2}) = n (O_{2}) = n (O_{3}) = \frac{1}{22,4} = 0,0446$ моль;
$N = n * N_{А}$;
$N_{A}= 6,02 * 10^{23}$;
$N (Ar) = N (Cl_{2}) = N (O_{2}) = N (O_{3}) = 0,0446 * 6,02 * 10^{23} = 2,68 * 10^{22}$ молекул;
m = n * M;
$ρ=\frac{m}{V} = \frac{n * M}{V}$;
M (Ar) = 1 * Ar (Ar) = 1 * 40 = 40 г/моль;
M ($Cl_{2}$) = 2 * Ar (Cl) = 2 * 35,5 = 71 г/моль;
M ($O_{2}$) = 2 * Ar (O) = 2 * 16 = 32 г/моль;
M ($O_{3}$) = 3 * Ar (O) = 3 * 16 = 48 г/моль;
$ρ (Ar)= \frac{0,0446 * 40}{1} = 1,78$ г/л;
$ρ (Cl_{2})= \frac{0,0446 * 71}{1} = 3,17$ г/л;
$ρ (Ol_{2})= \frac{0,0446 * 32}{1} = 1,43$ г/л;
$ρ (Ol_{3})= \frac{0,0446 * 48}{1}= 2,14$ г/л.
Ответ:1,78 г/л; 3,17 г/л; 1,43 г/л; 2,14 г/л; $2,68 * 10^{22}$ молекул.4. Рассчитайте массу:
а) кислорода;
б) озона;
в) углекислого газа $CO_{2}$, взятых объёмом 5,6 л (н.у.).Ответ:
а) Дано:
V = 5,6 л.
_____________
m ($O_{2}$) − ?
Решение:
m = n * M;
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n=\frac{5,6}{22,4} = 0,25$ моль;
M ($O_{2}$) = 2 * Ar (O) = 2 * 16 = 32 г/моль;
m ($O_{2}$) = 0,25 * 32 = 8 г;
Ответ: 8 г.
б) Дано:
V = 5,6 л.
_____________
m ($O_{3}$) − ?
Решение:
m = n * M;
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n=\frac{5,6}{22,4} = 0,25$ моль;
M ($O_{3}$) = 3 * Ar (O) = 3 * 16 = 48 г/моль;
m ($O_{3}$) = 0,25 * 48 = 12 г;
Ответ: 12 г.
в) Дано:
V = 5,6 л.
_____________
m ($CO_{2}$) − ?
Решение:
m = n * M;
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n=\frac{5,6}{22,4} = 0,25$ моль;
M ($CO_{2}$) = 1 * Ar (C) + 2 * Ar (O) = 1 * 12 + 2 * 16 = 44 г/моль;
m ($CO_{2}$) = 0,25 * 44 = 11 г.
Ответ: 11 г.5. Укажите, что тяжелее:
а) 5 л сернистого газа ($SO_{2}$) или 5 л углекислого газа ($CO_{2}$);
б) 2 л углекислого газа ($CO_{2}$) или 3 л угарного газа (CO).Ответ:
а) Дано:
V ($SO_{2}$) = 5 л;
V ($CO_{2}$) = 5 л;
_____________
m ($SO_{2}$) ? m ($СO_{2}$)
Решение:
m = n * M;
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n (SO_{2}) = n (CO_{2}) =\frac{5}{22,4} = 0,22$ моль;
M ($SO_{2}$) = 1 * Ar (S) + 2 * Ar (O) = 1 * 32 + 2 * 16 = 64 г/моль;
M ($CO_{2}$) = 1 * Ar (C) + 2 * Ar (O) = 1 * 12 + 2 * 16 = 44 г/моль;
m ($SO_{2}$) = 0,22 * 64 = 14,08 г;
m ($CO_{2}$) = 0,22 * 44 = 9,68 г.
m ($SO_{2}$) > m ($CO_{2}$)
Таким образом, 5 л сернистого газа тяжелее 5 л углекислого газа.
Ответ: m ($SO_{2}$) > m ($CO_{2}$).
б) Дано:
V ($CO_{2}$) = 2 л;
V (CO) = 3 л;
_____________
m ($СO_{2}$) ? m (СO)
Решение:
m = n * M;
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n (CO_{2})=\frac{2}{22,4} = 0,09$ моль;
M ($CO_{2}$) = 1 * Ar (C) + 2 * Ar (O) = 1 * 12 + 2 * 16 = 44 г/моль;
m ($CO_{2}$) = 0,09 * 44 = 3,96 г;
$n (CO)=\frac{3}{22,4} = 0,13$ моль;
M (CO) = 1 * Ar (C) + 1 * Ar (O) = 1 * 12 + 1 * 16 = 28 г/моль;
m (CO) = 0,13 * 28 = 3,64 г.
m ($СO_{2}$) > m (CO)
Таким образом, 2 л углекислого газа тяжелее 3 л угарного газа.
Ответ: m ($СO_{2}$) > m (CO).Темы для дискуссии
1. На примере свойств простых веществ докажите, что деление их на металлы и неметаллы носит относительный характер.
Ответ:
Простые вещества − металлы обладают рядом характерных свойств: высокой тепло− и электропроводностью; повышенной способностью к пластической деформации; хорошей отражательной способностью (металлы непрозрачны и обладают специфическим, так называемым металлическим блеском) ; термоэлектронной эмиссией, т. е. способностью испускать электроны при нагреве; возрастанием электрического сопротивления с повышением температуры; большое число металлов обладает сверхпроводимостью, у них при температуре, близкой к абсолютному нулю, электросопротивление падает скачкообразно практически до нуля. Все металлы, кроме ртути, при обычных условиях находятся в твёрдом состоянии.
Неметаллы − это простые вещества, не обладающие ковкостью и металлическим блеском. Они плохо проводят электрический ток и теплоту. Электросопротивление их понижается с повышением температуры. Простые вещества−неметаллы при обычных условиях могут быть газами (водород, азот, фтор, кислород и др. ) или твёрдыми веществами (бор, кремний, алмаз и др.) . Один неметалл при обычных условиях − жидкость (бром) .
Деление простых веществ на металлы и неметаллы носит относительный характер, так как некоторых физические свойства проявляются как у металлов, так и у неметаллов.
Например, йод (I) – неметалл. Галоген, но находится в твердом состоянии при нормальных условиях. Имеет кристаллическое строение, проводит электрический ток − свойства металла.
Олово (Sn) – неметалл. Образует 2 простых вещества: α−олово – серое олово – неметалл; β−олово – металл.
Углерод (С) – неметалл. Образует простые вещества: алмаз – неметалл; графит – неметалл, который имеет некоторые свойства металла – проводит электрический ток.2. Обоснуйте выделение благородных газов в отдельный класс простых веществ.
Ответ:
Инертные газы — группа элементов в таблице Менделеева, обладающих однотипными свойствами. Все эти вещества — одноатомные газы, с большим трудом взаимодействующие с другими веществами. Это объясняется тем, что их внешние атомные оболочки полностью «укомплектованы» (кроме гелия) восемью электронами и являются энергетически стабильными. Ни отдавать, ни принимать электроны атому энергетически не выгодно. Эти газы еще называют благородными или редкими. В группу входят: гелий, неон, аргон, криптон, ксенон и радиоактивный радон.
Заполненная валентная оболочка объясняет химическую пассивность благородных газов и позволяет выделит их в особый класс простых веществ.3. Обоснуйте универсальность понятия «количество вещества» для массы, объёма и числа структурных частиц вещества. Предложите формулу для нахождения одной физической величины по другой с использованием понятия «количество вещества».
Ответ:
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
Понятие «количество вещества» универсально для любого вещества. Зная количество вещества можно найти массу, объём и число структурных частиц вещества.
m = n * M,
где m — масса вещества, M — молярная масса вещества. Молярная масса − это масса, которая приходится на один моль данного вещества.
$N = n * N_{A}$,
где N − число частиц в веществе, $N_{A}$ − число Авогадро. $N_{A}= 6,02 * 10^{23}$ молекул/моль.
$V = n * V_{m}$,
где − V − объём газообразного вещества, $V_{m}$ − молярный объём. $V_{m}$= 22,4 л/моль
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
$n = \frac{N}{N_{A}}= \frac{m}{M} = \frac{V}{V_{m}}$. §18
-
ГЛАВА ТРЕТЬЯ. Соединения химических элементов
§18. Степень окисления
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Бинарноесоединение
2. https://foxford.ru/wiki/himiya/binarnye−soedineniya
3. https://dic.academic.ru/dic.nsf/ruwiki/596970
4. https://ru.wikipedia.org/wiki/Степеньокисления
5. https://www.fknz.ru/obrazovanie/stepen−okisleniya/
6. https://www.uchmet.ru/library/material/143766/92199/2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Бинарные, или двухэлементные соединения
Бинарные соединения − химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов. При этом несолеобразующие оксиды включают в бинарные соединения. Многоэлементные вещества, в формульной единице которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Номенклатура
Бинарные соединения − это собирательная группа веществ, которые имеют различное химическое строение. Поэтому их номенклатура может варьироваться в зависимости от генетической принадлежности.
Свойства
Группа бинарных соединений включает в себя очень большое число веществ, и, естественно, все эти вещества различаются по физическим свойствам. Среди бинарных соединений есть представляющие собой при нормальных условиях газы (например, аммиак, фосфин), жидкости (например, тетрахлорид титана $TiCl_{4}$, дисульфид углерода $CS_{2}$) и твердые вещества (например, нитрид бора BN, карбид кремния SiC).
Химическая связь в бинарных соединениях — ковалентная полярная (в соединениях неметаллов и некоторых амфотерных элементов) или ионная (в солях бескислородных кислот).
Многие бинарные соединения гидролизуются водой, например фосфин или хлорид алюминия.
Получение
Часто бинарные соединения можно получить прямым взаимодействием простых веществ между собой.
Другие бинарные вещества могут получаться более сложным путем — через реакции обмена или окислительно−восстановительные реакции.
Применение
В силу того, что к данной группе веществ можно отнести очень большое их количество, можно сказать, что бинарные соединения применяются практически во всех областях деятельности человека, от приготовления пищи до использования в качестве сырья для крупнотоннажных производств.?. Вопросы и задания
1. Запишите формулы оксидов азота (II), (V), (I), (III), (IV).
Ответ:
Степень окисления кислорода в оксидах постоянна: −2.
1. N (II).
$\overset{+2}{N}\overset{-2}{O}$.
Наименьшее общее кратное для элементов: 2.
Разделим наименьшее общее кратное на степень окисления каждого элемента − определим индексы, т.е. число атомов каждого элемента в формуле данного вещества: 2 : 2 = 1; 2 : 2 = 1.
Таким образом, NO − оксид азота (II).
2. N (V).
$\overset{+5}{N}\overset{-2}{O}$.
Наименьшее общее кратное для элементов: 5 * 2 = 10.
Разделим наименьшее общее кратное на степень окисления каждого элемента: 10 : 5 = 2; 10 : 2 = 5.
Таким образом, $N_{2}O{5}$ − оксид азота (V).
3. N (I).
$\overset{+1}{N}\overset{-2}{O}$.
Наименьшее общее кратное для элементов: 1 * 2 = 2.
Разделим наименьшее общее кратное на степень окисления каждого элемента: 2 : 1 = 2; 2 : 2 = 1.
Таким образом, $N_{2}O$ − оксид азота (I).
4. N (III).
$\overset{+3}{N}\overset{-2}{O}$.
Наименьшее общее кратное для элементов: 3 * 2 = 6.
Разделим наименьшее общее кратное на степень окисления каждого элемента: 6 : 3 = 2; 6 : 2 = 13
Таким образом, $N_{2}O_{3}$ − оксид азота (III).
5. N (IV).
$\overset{+4}{N}\overset{-2}{O}$.
Наименьшее общее кратное для элементов: 4.
Разделим наименьшее общее кратное на степень окисления каждого элемента: 4 : 4 = 1; 4 : 2 = 2
Таким образом, $NO_{2}$ − оксид азота (IV).2. Дайте названия бинарных соединений, формулы которых:
а) $Cl_{2}O_{7}, Cl_{2}O, ClO_{2}$;
б) $FeCl_{2}, FeCl_{3}$;
в) $MnS, MnO_{2}, MnF_{4}, MnO, MnCl_{4}$;
г) $Cu_{2}O, Mg_{2}Si, SiCl_{4}, Na_{3}N, FeS$.Ответ:
а) $Cl_{2}O_{7}$ − оксид хлора (VII),
$Cl_{2}O$ − оксид хлора (I),
$ClO_{2}$ − оксид хлора (IV).
б) $FeCl_{2}$ − хлорид железа (II),
$FeCl_{3}$ − хлорид железа (III).
в) MnS − сульфид марганца (II),
$MnO_{2}$ − оксид марганца (IV),
$MnF_{4}$ − фторид марганца (IV),
MnO − оксид марганца (II),
$MnCl_{4}$ − хлорид марганца (IV).
г) $Cu_{2}O$ − оксид меди (I),
$Mg_{2}Si$ − силицид магния (IV),
$SiCl_{4}$ − хлорид кремния(IV),
$Na_{3}N$ − нитрид натрия (III),
FeS − сульфид железа (II).3. Найдите по справочникам и словарям всевозможные названия веществ с формулами: а) $CO_{2}$ и CO; б) $SO_{2}$ и $SO_{3}$. Объясните их этимологию. Дайте по два названия этих веществ по международной номенклатуре в соответствии с правилами, изложенными в параграфе.
Ответ:
а) $CO_{2}$ − углекислый газ, двуокись углерода, оксид углерода (IV), диоксид углерода, угольный ангидрид.
Углекислым газом назван, так как образуется при сгорании (окислении) угля.
Названия по международной номенклатуре: диоксид углерода или оксид углерода (IV).
CO − угарный газ, монооксид углерода или оксид углерода (II), окись углерода.
Угарным газом назван, так как производит отравляющее действие на живой организм (говорят, человек "угорает").
Названия по международной номенклатуре: монооксид углерода или оксид углерода (II).
б) $SO_{2}$ − сернистый газ, сернистый ангидрид, двуокись серы, диоксид серы или оксид серы (IV).
Названия по международной номенклатуре: диоксид серы или оксид серы (IV).
$SO_{3}$ − серный ангидрид, серный газ, треокись серы, триоксид серы или оксид серы (VI).
Названия по международной номенклатуре: триоксид серы или оксид серы (VI).
Примечание. Названия со словом окись являются устаревшими и в настоящее время не употребляются.4. Какое ещё название можно дать аммиаку $H_{3}N$?
Ответ:
$H_{3}N$ − аммиак, нитрид водорода.
5. Найдите объём, который имеет при н. у. сероводород массой 17 г. Сколько молекул его содержится в этом объёме?
Ответ:
Дано:
m ($H_{2}S$) = 17 г;
_____________
V − ?
N − ?
Решение:
$n = \frac{m}{M}$;
M ($H_{2}S$) = 2 * Ar (H) + 1 * Ar (S) = 2 * 1 + 32 = 32 г/моль;
$n = \frac{17}{32} = 0,5 $ моль;
$V = V_{m}* n$;
$V_{m}$= 22,4 л/моль;
V ($H_{2}S$) = 22,4 * 0,5 = 11,2 л;
$N = n * N_{А}$;
$N_{A}= 6,02 * 10^{23}$;
$N (H_{2}S) = 0,5 * 6,02 * 10^{23} = 3,01 * 10^{23}$ молекул.
Ответ. 0,5 моль; 11,2 л; $3,01 * 10^{23}$ молекул.6. Вычислите массу метана $CH_{4}$ объёмом 33,6 $м^{3}$ при н.у. и определите число его молекул, содержащееся в этом объёме.
Ответ:
Дано:
V ($CH_{4}$) = 33,6 $м^{3}$;
_____________
m − ?
N − ?
Решение:
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
V ($CH_{4}$) = 33,6 $м^{3}$ = 33,6 * 1000 = 33600 л;
$n=\frac{33600}{22,4} = 1500$ моль;
m = n * M;
M ($CH_{4}$) = 1 * Ar (C) + 4 * Ar (Н) = 1 * 12 + 4 * 1 = 16 г/моль;
m ($CH_{4}$) = 1500 * 16 = 24 000 г = 24 кг;
$N = n * N_{А}$;
$N_{A}= 6,02 * 10^{23}$;
$N (CH_{4}) = 1500 * 6,02 * 10^{23} = 9 * 10^{26}$ молекул.
Ответ. 24 кг; $9 * 10^{26}$ молекул.7. Определите степень окисления углерода и запишите структурные формулы следующих веществ, зная, что углерод в органических соединениях всегда четырёхвалентен: метана $CH_{4}$, тетрахлорметана $CCl_{4}$, этана $C_{2}H_{4}$, ацетилена $C_{2}H_{2}$.
Ответ:
$\overset{-4}{С}\overset{+1}{Н_{4}}$
H
|
H-C-H
|
H
$\overset{+4}{С}\overset{-1}{Cl_{4}}$
Cl
|
Cl-C-Cl
|
Cl
$\overset{-2}{C_{2}}\overset{+1}{Н_{4}}$
H H
\ /
C=C
/ \
H H
$\overset{-1}{C_{2}}\overset{+1}{Н_{2}}$
H-C≡C-H §19
-
§19. Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
Лабораторный опыт №7
Ознакомление с коллекцией оксидов.
Ознакомьтесь с коллекцией оксидов. Запишите формулы представленных в ней оксидов. Опишите их физические свойства.Ответ:
Рассмотрим задание на примерах: оксид железа (III) Fe2O3, оксид кремния (IV) SiO2, оксид кальция (II) CаO и оксид водорода Н2O.
Оксид железа (III) Fe2O3 − твёрдое вещество тёмно-коричневого цвета, tпл. = 1566°C, tкип. = 1987°C. Без запаха.
Оксид кремния (IV) (SiO2) − твёрдое вещество в виде бесцветных кристаллов. Обладают высокой твёрдостью и прочностью. tпл. = 1710°C, tкип. = 2230°C.
Оксид кальция (II) CаO − белое кристаллическое вещество, tпл. = 2 572°C, tкип. = 2850°C.
Оксид водорода (Н2O). Жидкость без цвета, без запаха. tпл. = 0 °C, tкип. = 100 °C.Лабораторный опыт №8
Ознакомление со свойствами аммиака.
Ознакомьтесь со свойствами аммиака, выданного вам в ампуле в виде водного раствора. Для этого вскройте ампулу, соблюдая правила техники безопасности. Крепко возьмите ампулу двумя пальцами, постучите по верхней части её указательным пальцем другой руки, надрежьте наконечник ампулы специальной пилочкой, накройте его носовым платком или кусочком ткани и отломайте его. Осторожно понюхайте нашатырный спирт, отметьте характер запаха. Как это свойство используется в медицине?Ответ:
Нашатырный спирт (аммиак) обладает резким запахом. В медицине резкий запах аммиака используется для возбуждения дыхания и выведения из обморочного состояния.
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−31−oksidy.html
2. http://www.hemi.nsu.ru/ucheb164.htm
3. https://ru.wikipedia.org/wiki/Оксиды2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Негашёная известь
Оксид кальция (окись кальция, негашёная известь, в просторечии − кирабит, кипелка) — белое кристаллическое вещество, формула CaO.
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической кристаллической решётке, по типу хлорида натрия.
Применение
В настоящее время в основном используется в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и т.д.
До второй половины XX века известь широко использовали в качестве строительной побелки — прокаленный мел или известняк (оксид кальция) при смешивании с водой образует ярко−белую гашеную известь ($Ca(OH)_{2}$), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция. В настоящее время известковый раствор при строительстве жилых домов практически не применяется в виду значительной гигроскопичности и сложности производства работ, уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешевый и эффективный агент для осушения растворителей и жидких веществ.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E−529.
В промышленyости водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести $Са(OH)_{2}$ и диоксида серы получается осадок сульфита кальция $СаSO_{3}$. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать $SO_{2}$ и $CO_{2}$.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещенный между двух стенок емкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Оксид кальция относится к высокоопасным веществам. Это едкое вещество, особенно опасен при смешивании с водой.?. Вопросы и задания
1. Выпишите из приведённого ниже перечня формул в два столбика формулы оксидов металлов и оксидов неметаллов и дайте их названия: $Na_{2}O, N_{2}O_{5}, NaOH, HNO_{3}, CuO, SO_{2}, SCl_{2}, Cl_{2}O_{7}, FeS, Fe_{2}O_{3}, Cu_{2}O, CuF_{2}, P_{2}O_{5}$.
Ответ:
Оксиды металлов Оксиды неметаллов
$Na_{2}O$ − оксид натрия $N_{2}O_{5}$ − оксид азота (V)
CuO − оксид меди (II) $SO_{2}$ − оксид серы (IV)
$Fe_{2}O_{3}$ − оксид железа (III) $Cl_{2}O_{7}$ − оксид хлора (VII)
$Cu_{2}O$ − оксид меди (I) $ P_{2}O_{5}$ − оксид фосфора (V)
В веществах NaOH, $HNO_{3}$ находятся атомы трёх разных элементов, а оксиды − сложные вещества, состоящие из двух химических элементов.
В веществах $SCl_{2}, FeS, CuF_{2}$ нет атомов кислорода, а в оксидах один из элементов обязательно кислород.2. Какие из перечисленных ниже названий соответствуют формуле $H_{2}O$: оксид водорода, гидрид кислорода, пероксид водорода, водород, вода, кислородный водород?
Ответ:
Формуле $H_{2}O$ соответствуют названия: вода, оксид водорода, гидрид кислорода.
3. Найдите плотность (массу 1 л) при н.у.:
а) аммиака; б) хлороводорода; в) углекислого газа.Ответ:
а) Дано:
V ($NH_{3}$) = 1 л;
_____________
ρ − ?
Решение:
$ρ = \frac{m}{V}$;
m = n * M;
$n=\frac{V}{V_{m}}$;
$ρ = \frac{M}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
M = 1 * Ar (N) + 3 * Ar (H) = 1 * 14 + 3 * 1 = 17 г/моль;
$ρ = \frac{17}{22,4} = 0,76$ г/л;
Ответ. 0,76 г/л.
б) Дано:
V (HCl) = 1 л;
_____________
ρ − ?
Решение:
$ρ = \frac{m}{V}$;
m = n * M;
$n=\frac{V}{V_{m}}$;
$ρ = \frac{M}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
M = 1 * Ar (Н) + 1 * Ar (Сl) = 1 * 1 + 1 * 35,5 = 36,5 г/моль;
$ρ = \frac{36,5}{22,4} = 1,63$ г/л;
Ответ. 1,63 г/л.
в) Дано:
V ($CO_{2}$) = 1 л;
_____________
ρ − ?
Решение:
$ρ = \frac{m}{V}$;
m = n * M;
$n=\frac{V}{V_{m}}$;
$ρ = \frac{M}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
M = 1 * Ar (C) + 2 * Ar (O) = 1 * 12 + 2 * 16 = 44 г/моль;
$ρ = \frac{44}{22,4} = 1,96$ г/л;
Ответ. 1,96 г/л.4. Сколько молекул каждого вещества содержится в 1 г $CO_{2}, HCl, NH_{3}$?
Ответ:
Дано:
m ($CO_{2}$) = 1 г;
m (HCl) = 1 г;
m ($NH_{3}$) = 1 г;
_____________
N ($CO_{2}$) = 1 г;
N (HCl) = 1 г;
N ($NH_{3}$) = 1 г;
Решение:
$n = \frac{m}{M}$;
$N = n * N_{А}$;
M ($CO_{2}$) = 1 * Ar (C) + 2 * Ar (O) = 1 * 12 + 2 * 16 = 44 г/моль;
M (HCl) = 1 * Ar (Н) + 1 * Ar (Cl) = 1 * 1 + 1 * 35,5 = 36,5 г/моль;
M ($NH_{3}$) =1 * Ar (N) + 3 * Ar (H) = 1 * 14 + 3 * 11 = 17 г/моль;
$n (CO_{2}) = \frac{1}{44} = 0,023$;
$n (HCl) = \frac{1}{36,5} = 0,027$;
$n (NH_{3}) = \frac{1}{17} = 0,059$;
$N_{A}= 6,02 * 10^{23}$;
$N (CO_{2}) = 0,023 * 6,02 * 10^{23} = 0,14 * 10^{23} = 1,4 * 10^{22}$ моль;
$N (HCl) = 0,027 * 6,02 * 10^{23} = 0,16 * 10^{23} = 1,6 * 10^{22}$ моль;
$N (NH_{3}) = 0,059 * 6,02 * 10^{23} = 0,35 * 10^{23} = 3,5 * 10^{22}$ моль.
Ответ: $1,4 * 10^{22}$ моль; $1,6 * 10^{22}$ моль; $3,5 * 10^{22}$ моль.5. Выпишите из текста параграфа все приведённые в нём формулы веществ и дайте их названия по международной номенклатуре.
Ответ:
$SiO_{2}$ – оксид кремния (IV);
$H_{2}O$ – оксид водорода;
$Fe_{2}O_{3}$ – оксид железа (III);
$Fe_{3}O_{4} $– оксид железа (II,III);
CO – оксид углерода (II);
$CO_{2} $– оксид углерода (IV);
CaO – оксид кальция;
$Al_{2}O3$ – оксид алюминия;
NaH – гидрид натрия;
$CaH_{2}$ – гидрид кальция;
$NH_{3}$ – нитрид водорода;
HCl – хлорид водорода6. Как следует располагать сосуд для собирания аммиака и углекислого газа − вверх или вниз дном? Почему?
Ответ:
Это зависит от того, легче или тяжелее воздуха собираемый газ. Молекулярная масса воздуха 29 г/моль. Молекулярная масса аммиака 17 г/моль. Аммиак легче воздуха, значит будет подниматься вверх, поэтому сосуд держим вверх дном.
Молекулярная масса углекислого газа больше, чем воздуха - 44 г/моль, значит углекислый газ тяжелее. Собирать его надо, держа сосуд дном вниз. §20
-
§20. Основания
Лабораторный опыт №9
Качественная реакция на углекислый газ.
Повторите опыт, приведённый на рисунке 60. Используйте в качестве трубки соломку для соков. Углекислый газ через прозрачную известковую воду продувайте осторожно и не торопясь. Что наблюдаете?
рис. 60. Качественная реакция на углекислый газ.Ответ:
При продувании углекислого газа через прозрачную известковую воду наблюдается помутнение раствора. Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−37−osnovanija.html
2. http://www.hemi.nsu.ru/ucheb184.htm
3. https://ru.wikipedia.org/wiki/Основание%28химия%29
4. https://ru.wikipedia.org/wiki/Гидроксид−ион
5. https://ru.wikipedia.org/wiki/Кислотно−основныеиндикаторы2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Индикаторы: лакмус, метиловый оранжевый, фенолфталеин.
Среду водных растворов экспериментально можно определить различными способами.
Одним из способов является применение индикаторов, изменяющих свою окраску при изменении среды раствора.
Индикаторы − вещества, обратимо изменяющие цвет в зависимости от среды раствора.
В качестве индикаторов чаще всего на практике используют:
− метилоранж;
− лакмус;
− фенолфталеин;
− универсальный индикатор.
1) Метилоранж в водном растворе (в нейтральной среде) имеет оранжевый цвет, лакмус — фиолетовый.
В кислой среде и метилоранж, и лакмус приобретают красный цвет.
В щелочной среде метилоранж приобретает жёлтый цвет, лакмус становится синим.
Оба индикатора более удобны на практике для определения кислой среды.
2) Фенолфталеин является индикатором на щелочную среду. Только в ней он приобретает яркую малиновую окраску. В остальных средах он бесцветный.
3) Универсальный индикатор изменяет окраску в широком диапазоне значений рН раствора.
Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка к пробе исследуемого раствора.
Другой способ применения — использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (например, Универсальный индикатор). Такие полоски выпускают в самых разнообразных вариантах — с нанесенной на них цветной шкалой — эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми значениями pH; для точного измерения в узких диапазонах pH, и для ориентировочного исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек.
Современные индикаторные полоски могут быть изготовлены с красителем − индикатором, привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до многократного использования.?. Вопросы и задания
1. Почему гидроксиды натрия и калия называют едкими щелочами?
Ответ:
Гидроксиды натрия и калия называют едкими щелочами, потому что они разъедают кожу, ткани, бумагу и другие материалы.
2. Составьте химические формулы оснований для хрома (II) и меди (I), назовите их. Изменяют ли окраску индикаторов эти вещества? Почему?
Ответ:
$Cr(ОН)_{2}$ − гидроксид хрома (II).
CuO − гидроксид меди (I).
Они не изменяют окраску индикаторов, так как не растворяются в воде.3. Составьте формулы оксидов, соответствующих веществам, формулы которых: $Fe(OH)_{2}, CuOH, Cu(OH)_{2}$ и дайте им названия.
Ответ:
$\overset{+2}{Fe} (OH)_{2}$ – гидроксид железа (II), соответствует $\overset{+2}{Fe} \overset{-2}{O}$ – оксид железа (II).
$\overset{+3}{Fe}(OH)_{3}$ – гидроксид железа (III), соответствует $\overset{+3}{Fe_{2}} \overset{-2}{O_{3}}$ – оксид железа (III).
$\overset{+2}{Сu}(OH)_{2}$ – гидроксид меди (II), соответствует $\overset{+2}{Cu} \overset{-2}{O}$ – оксид меди (II).4. Каким из оксидов, формулы которых: $CO_{2}, CuO, Cl_{2}O_{7}, P_{2}O_{5}, FeO, MgO$, соответствуют основания? Запишите формулы этих оснований и дайте их названия.
Ответ:
$CO_{2}$ − оксид углерода (IV). Углерод − неметалл, следовательно, оксид углерода − кислотный оксид. Ему соответствует не основание, а кислота.
$\overset{+2}{Cu}O$ − оксид меди (II), соответствует основание $\overset{+2}{Cu}(OH)_{2}$ – гидроксид меди (II).
$Cl_{2}O_{7}$ − оксид хлора (VII). Хлор − неметалл, следовательно, оксид хлора − кислотный оксид. Ему соответствует не основание, а кислота.
$P_{2}O_{5}$ − оксид фосфора (V). Фосфор − неметалл, следовательно, оксид фосфора − кислотный оксид. Ему соответствует не основание, а кислота.
$\overset{+2}{Fe}O$ − оксид железа (II), соответствует основание $\overset{+2}{Fe}(OH)_{2}$ – гидроксид железа (II).
$\overset{+2}{Mg}O$ − оксид магния (II), соответствует основание $\overset{+2}Mg(OH)_{2}$ – гидроксид магния (II).5. Hассчитайте количество вещества, которое соответствует:
а) 120 г гидроксида натрия;
б) 49 г гидроксида меди (II).Ответ:
а) Дано:
m (NaOH) = 120 г.
_____________
n−?
Решение:
$n = \frac{m}{M}$;
M (NaOH) = 1 * Ar (Na) + 1 * Ar (O) + 1 * Ar (Н) = 1 * 23 + 1 * 16 + 1 * 1 = 40 г/моль;
$n (NaOH) = \frac{120}{40} = 3$ моль.
Ответ. 3 моль.
б) Дано:
m ($Cu(OH)_{2}$) = 49 г.
_____________
n−?
Решение:
$n = \frac{m}{M}$;
M ($Cu(OH)_{2}$) = 1 * Ar (Cu) + 2 * Ar (O) + 2 * Ar (Н) = 1 * 64 + 2 * 16 + 2 * 1 = 98 г/моль;
$n (Cu(OH)_{2}) = \frac{49}{98} = 0,5 $ моль.
Ответ. 0,5 моль.6. Найдите массу гидроксида железа (II), взятого количеством вещества 5 моль, и гидроксида железа (III), взятого количеством вещества 0,5 моль.
Ответ:
а) Дано:
n ($Fe(OH_{2})$) = 5 моль.
_____________
m − ?
Решение:
m = n * M;
M ($Fe(OH_{2})$) = 1 * Ar (Fe) + 2 * Ar (O) + 2 * Ar (Н) = 1 * 56 + 2 * 16 + 2 * 1 = 90 г/моль;
m ($Fe(OH_{2})$) = 5 * 90 = 450 г.
Ответ. 450 г.
б) Дано:
n ($Fe(OH_{3})$) = 0,5 моль.
_____________
m − ?
Решение:
m = n * M;
M ($Fe(OH_{3})$) = 1 * Ar (Fe) + 3 * Ar (O) + 3 * Ar (Н) = 1 * 56 + 3 * 16 + 3 * 1 = 107 г/моль;
m ($Fe(OH_{3})$) = 0,5 * 107 = 53,5 г.
Ответ. 53,5 г. §21
-
§21. Кислоты
Лабораторный опыт №10
Определение pH растворов кислоты, щёлочи и воды.
Нанесите на полоску универсальной индикаторной бумаги с помощью пипетки или стеклянной палочки по капле выданных вам растворов кислот, щелочей, воды. Сравните изменение цвета со шкалой, определите среду растворов и значения их рН.Ответ:
При нанесении на полоску универсальной индикаторной бумаги кислоты полоска окрасится в красный, щелочи - в синий, воды - в зеленоватый цвет. Записываем pH, сверяя цвет со шкалой.
Лабораторный опыт №11
Определение pH лимонного и яблочного соков на срезе плодов.
Мы знаем, что лимон кислее яблока. Тем не менее приложите полоски универсальной индикаторной бумаги к свежему срезу лимона и яблока и подтвердите эту аксиому количественно, т.е. укажите значения рН для сока лимона и яблока.Ответ:
pH лимонного сока 3, а яблочного сока – 5. Лимон имеет более кислую среду, чем яблоко.
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−34−kisloty.html
2. http://www.hemi.nsu.ru/ucheb183.htm
3. https://ru.wikipedia.org/wiki/Кислоты
4. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/kisloty−sostav−svoistva−poluchenie−13840/re−ace47ed9−dfa5−4bbe−a27f−2a334675af76
5. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/kisloty−sostav−svoistva−poluchenie−13840/re−007aeae0−fef4−45ce−935e−62e66b67c115
6. https://ru.wikipedia.org/wiki/Неорганические_кислоты2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Кислоты кислородсодержащие и бескислородные
Кислоты − это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Классификация кислот по наличию или отсутствию кислорода в молекуле кислоты:
1) Бескислородные кислоты − это кислоты, состоящие из двух элементов: водорода и неметалла.
2) Кислородные (кислородсодержащие) кислоты − это кислоты, состоящие из трех элементов: водорода, кислорода и неметалла (или металла в высокой степени окисления).
Водород в кислотах всегда записывают на первом месте. Он имеет заряд (степень окисления) 1+.
Всю остальную часть формулы называют кислотным остатком. Кислотный остаток − это анион, который всегда имеет отрицательный заряд.
Этот отрицательный заряд равен сумме степеней окисления элементов, образующих кислотный остаток.
Заряд аниона кислотного остатка равен количеству атомов водорода в молекуле кислоты со знаком «−».?. Вопросы и задания
1. Дайте характеристику фосфорной кислоты по плану:
а) формула; б) наличие кислорода; в) основность; г) растворимость; д) степени окисления элементов, образующих кислоту; е) заряд иона, образуемого кислотным остатком; ж) соответствующий оксид.Ответ:
Характеристика фосфорной кислоты:
а) формула $H_{3}PO_{4}$;
б) наличие кислорода: кислота является кислородсодержащей;
в) основность: трехосновная кислота;
г) растворимость: растворимая кислота;
д) степени окисления элементов, образующих кислоту:
$\overset{+1}{H_{3}}\overset{+5}{P}\overset{-2}{O_{4}}$;
е) заряд иона, образуемого кислотным остатком: $PO_{4}^{3-}$ (+5−2*4= −3);
ж) соответствующий оксид: $P_{2}O_{5}$.2. Почему нельзя приливать воду в серную кислоту для её разбавления?
Ответ:
При смешивании серной кислоты с водой выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
3. Составьте химические формулы кислот, соответствующих оксидам, формулы которых: $N_{2}O_{3}, CO_{2}, P_{2}O_{5}, SiO_{2}, SO_{2}$. Дайте названия всех веществ.
Ответ:
Оксид Кислота
$\overset{+3}{N_{2}} O_{3}$ − оксид азота (III) $\overset{+1}{H}\overset{+3}{N}\overset{-2}{O_{2}}$ − азотистая кислота
$\overset{+4}{C}O_{2}$ − оксид углерода (IV) $\overset{+1}{H_{2}}\overset{+4}{C}\overset{-2}{O_{3}}$ − угольная кислота
$\overset{+5}{P_{2}}O_{5}$ − оксид фосфора (V) $\overset{+1}{H_{3}}\overset{+5}{P}\overset{-2}{O_{4}}$ − фосфорная кислота
$\overset{+4}{Si}O_{2}$ − оксид кремния (IV) $\overset{+1}{H_{2}}\overset{+4}{Si}\overset{-2}{O_{3}}$ − кремниевая кислота
$\overset{+4}{S}O_{2}$ − оксид серы (IV) $\overset{+1}{H_{2}}\overset{+4}{S}\overset{-2}{O_{3}}$ − сернистая кислота4. Вычислите количество вещества, соответствующее:
а) 490 г серной кислоты $H_{2}SO{4}$;
б) 9,8 г фосфорной кислоты $H_{3}PO{4}$.Ответ:
а) Дано:
m ($H_{2}SO{4}$) = 490 г
_____________
n−?
Решение:
$n = \frac{m}{M}$;
M = 2 * Ar (H) + 1 * Ar (S) + 4 * Ar (O) = 2 * 1 + 1 * 32 + 4 * 16 = 98 г/моль;
$n = \frac{490}{98} = 5 $ моль.
Ответ. 5 моль.
б) Дано:
m ($H_{3}PO{4}$) = 9,8 г
_____________
n−?
Решение:
$n = \frac{m}{M}$;
M = 3 * Ar (H) + 1 * Ar (P) + 4 * Ar (O) = 3 * 1 + 1 * 31 + 4 * 16 = 98 г/моль;
$n = \frac{9,8}{98} = 0,1 $ моль.
Ответ. 0,1 моль. §22
-
§22. Соли
Лабораторный опыт №12
Ознакомление с коллекцией солей.
Ознакомьтесь с коллекцией выданных вам образцов солей. Запишите их формулы, охарактеризуйте физические свойства, в том числе и растворимость в воде. Рассчитайте относительные молекулярные (молярные) массы солей, а также массовые доли образующих их элементов. Найдите массу 2 моль каждой соли.Ответ:
Учитель по программе должен вам выдать хлорид натрия (NaCl) и карбонат кальция ($СаСО_{3}$).
Хлорид натрия (NaCl)
Свойства Значение
Состояние Твёрдые кристаллы
Плотность 2,165 г/$см^3$
Температура
плавления 800,8 ℃
Температура
кипения 1465 ℃
Цвет белый
Растворимость
в воде растворим
Теплопроводность
и электропроводность Проводит тепло и электрический ток
M (NaCl) = 1 * Ar (Na) + 1 * Ar (Cl) = 1 * 23 + 1 * 35,5 = 58,5 г/моль.
$ ω (Na) = \frac{M(Na)}{M(NaCl)} = \frac{23}{58,5} = 0,39$ или 39%.
$ ω (Cl) = \frac{M(Cl)}{M(NaCl)} = \frac{35,5}{58,5} = 0,61$ или 61%.
m = n * M;
m (NaCl) = 2 * 58,5 = 117 г.
Ответ: 117 г.
Карбонат кальция ($СаСО_{3}$).
Свойства Значение
Состояние Твёрдые кристаллы
Плотность 2.74 г/$см^3$ (кальцит), 2.83 г/$см^3$ (арагонит)
Температура
плавления 825 ℃ (кальцит), 1339 ℃ (арагонит)
Температура
разложения 900−1000 °C
Цвет белый
Растворимость
в воде нерастворим
Теплопроводность низкая
M ($СаСО_{3}$) = 1 * Ar (Ca) + 1 * Ar (C) + 3 * Ar (O) = 1 * 40 + 1 * 12 + 3 * 16 = 100 г/моль.
$ ω (Са) = \frac{M (Ca)}{M(СаСО_{3})} = \frac{40}{100}$ = 0,4 или 40%.
$ ω (С) = \frac{M (C)}{M(СаСО_{3})} = \frac{12}{100}$ = 0,12 или 12%.
$ ω (O) = \frac{3* M(O)}{M(СаСО_{3})} = \frac{3*16}{100}$ = 0,48 или 48%.
m = n * M;
m ($СаСО_{3}$) = 2 * 100 = 200 г.
Ответ: 200 г.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−25−soli.html
2. http://www.hemi.nsu.ru/ucheb187.htm
3. https://ru.wikipedia.org/wiki/Соли
4. https://compendium.su/chemistry/universal/38.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Растворимые, нерастворимые и малорастворимые соли
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Названия солей кислородсодержащих кислот составляются из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами −aт для высшей степени окисления и −ит для низшей степени окисления атомов элемента−неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой.
По растворимости в воде соли делятся на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
1. Растворимы все соли азотной кислоты — нитраты.
2. Растворимы все соли соляной кислоты — хлориды, кроме AgCl (Н), PbCl_{2} (М).
3. Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_{4} (Н), PbSO_{4}$ (Н).
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей $Na^{+}$ и $K^{?. Вопросы и задания
1. Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной. Дайте их названия. Какие из солей растворимы в воде?
Ответ:
Соли − сложные вещества, состоящие из ионов металлов и кислотных остатков.
Определи заряды ионов натрия ($Na^{+}$), кальция ($Сa^{2+}$), алюминия ($Al^{3+}$).
Заряды ионов, образованных кислотным остатком азотной кислоты ($NO_{3}^{-}$), серной кислоты ($SO_{4}^{2-}$), фосфорной кислоты ($PO_{4}^{3-}$)Формула Название Растворимость соли
$NaNO_{3}$ нитрат натрия растворима
$Сa^{2+}(NO_{3})_{2}^{-}$ нитрат кальция растворима
$Al^{3+}(NO_{3})_{3}^{-}$ нитрат алюминия растворима
$Na_{2}^{+}SO_{4}^{2-}$ сульфат натрия растворима
$Сa^{2+}SO_{4}^{2-}$ сульфат кальция плохо растворима
$Al_{2}^{3+}(SO_{4})_{3}^{2-}$ сульфат алюминия растворима
$Na_{3}^{+} PO_{4}^{3-}$ фосфат натрия растворима
$Сa_{3}^{2+}(PO_{4})_{2}^{3-}$ фосфат кальция нерастворима
$Al^{3+} PO_{4}^{3-}$ фосфат алюминия нерастворима2. Запишите формулы следующих солей:
а) карбоната калия, сульфида свинца (II), нитрата железа (III);
б) хлорида свинца (IV), фосфата магния, нитрата алюминия.Ответ:
а) карбонат калия − $K_{2}CO_{3}$;
сульфид свинца (II) − PbS;
нитрат железа (III) −$ Fe(NO_{3})_{3}$;
б) хлорид свинец (IV) − $PbCl_{4}$;
фосфат магния − $Mg_{3}(PO_{4})_{2}$;
нитрат алюминия − $Al(NO_{3})_{3}$.3. Из перечисленных формул: $H_{2}S, K_{2}SO_{3}, KOH, SO_{3}, Cr(OH)_{2}, FeO, N_{2}O_{3}, Cu_{3}(PO_{4})_{2}, Cu_{2}O, P_{2}O_{5}, H_{3}PO_{4}$ выпишите формулы:
а) оксидов;
б) кислот;
в) оснований;
г) солей.
Дайте названия веществ.Ответ:
а) оксиды: $SO_{3}$ – оксид серы (VI); FeO – оксид железа (II); $Cu_{2}O$ – оксид меди (I) ; $P_{2}O_{5}$ – оксид фосфора (V).
б) кислоты: $H_{2}S$ – сульфид водорода; $H_{3}PO_{4}$ – фосфорная кислота.
в) основания: KOH – гидроксид калия ; $Cr(OH)_{2}$ – гидроксид хрома (II) .
г) соли: $K_{2}SO_{3}$ – сульфат калия; $N_{2}O_{3}$ – оксид азота (III); $Cu_{3}(PO_{4})_{2}$ – фосфат меди (II). §23
-
§23. Кристаллические решетки
Лабораторный опыт №13
Ознакомление с коллекцией веществ с разным типом кристаллической решётки. Изготовление моделей кристаллических решёток.
Ознакомьтесь с коллекцией выданных вам образцов веществ. Запишите их формулы, охарактеризуйте физические свойства и на их основе определите тип кристаллической решётки.
Соберите модель одной из кристаллических решёток.Ответ:
По программе учитель должен выдать хлорид натрия (NaCl), кремний (Si), медь (Cu), йод $I_{2}$.
Хлорид натрия (NaCl) − соль. Это твёрдое белое вещество, хорошо растворимое в воде.
Плотность − 2,165 г/$см^3$;
Температура плавления − 800,8 ℃;
Температура кипения − 1465 ℃.
Имеет ионную кристаллическую решётку.
Кремний (Si) − неметалл, твёрдое вещество тёмно−серого цвета с небольшим блеском, не растворимо в воде.
Плотность − 2,33 г/$см^3$;
Температура плавления − 1414,85 ℃;
Температура кипения − 2349,85 ℃.
Атомная кристаллическая решётка.
Медь (Cu) − металл золотисто−красного цвета, твёрдый, не растворим в воде, хорошо проводит электрический ток.
Плотность − 8,92 г/$см^3$;
Температура плавления − 1083,4 ℃;
Температура кипения − 2567 ℃.
Металлическая кристаллическая решётка.
Йод ($I_{2}$) − неметалл, твёрдые кристаллы тёмно−фиолетового цвета с лёгким блеском.
Плотность − 4,93 г/$см^3$;
Температура плавления − 113,5 ℃;
Температура кипения − 184,35 ℃.
Молекулярная кристаллическая решётка.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Кристаллическая_решётка
2. https://www.yaklass.ru/p/himija/89−klass/stroenie−veshchestva−18844/amorfnye−i−kristallicheskie−veshchestva−56119/re−70fd157c−38ab−4b72−b278−d3824d173d95
3. https://www.yaklass.ru/p/himija/89−klass/stroenie−veshchestva−18844/kristallicheskie−reshetki−61860/re−a6ccb0b0−4b1a−4645−897f−e8a126bdc853
4. https://chemege.ru/materials/stroenie−veschestva/2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Твёрдые вещества: аморфные и кристаллические.
Кристаллические и аморфные тела в зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества.
Все твердые тела обладают следующими общими свойствами:
− способностью долгое время сохранять форму и объем (геометрические размеры);
− наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).
Аморфные тела.
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела.
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.?. Вопросы и задания
1. В каком агрегатном состоянии будет находиться кислород при − 205°C?
Ответ:
Температура плавления кислорода −218°C, температура кипения кислорода −183°C. Кислород при −205°C и стандартном давлении будет находится в жидком агрегатном состоянии.
2. Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твёрдого кислорода, используя его описание, приведённое в книге.
Ответ:
В книге нет описания свойств твердого кислорода, а приводится описание свойств жидкого воздуха: "Жидкий воздух!.. Ведь его плотность в 800 раз больше атмосферного. Жидкий воздух представляет легко подвижную прозрачную жидкость бледно−голубого цвета с температурой минус сто девяносто три градуса Цельсия при нормальном атмосферном давлении… Полученный из аппарата воздух бывает мутным вследствие примеси замерзшей углекислоты, которая в незначительном количестве содержится в воздухе. После профильтрования через бумажный фильтр воздух становится прозрачным...При испарении жидкого воздуха сначала выделяется кипящий азот, точка кипения которого минус сто девяносто четыре градуса Цельсия, потом аргон...".
3. К какому типу веществ (кристаллические или аморфные) относятся пластмассы? Какие свойства пластмасс лежат в основе их промышленного применения?
Ответ:
Пластмассы относятся к аморфным веществам, они не имеют чёткой температуры плавления, при нагревании они постепенно размягчаются и переходят в текучее состояние, таким образом из пластмассы можно создавать предметы любой формы.
Пластичность при нагревании и способность сохранять форму после охлаждения или отвердения лежат в основе широкого промышленного применения пластмасс.4. К какому типу относится кристаллическая решётка алмаза? Перечислите характерные для алмаза физические свойства.
Ответ:
У алмаза атомная кристаллическая решетка. Каждый атом углерода в ней окружен другими атомами углерода, находящимися в вершинах правильного тетраэдра.
Алмаз имеет следующие физические свойства: высокая твёрдость и температура плавления, прочность, теплопроводность, у него большой показатель преломления и дисперсия, алмаз не растворим в воде.5. К какому типу относится кристаллическая решётка йода? Перечислите характерные для йода физические свойства.
Ответ:
Йод имеет молекулярную кристаллическую решетку, так как в узлах кристаллической решётки йода расположены молекулы $I_{2}$, содержащие прочные ковалентные связи, между которыми действует слабое межмолекулярное притяжение. Йод имеет следующие физические свойства: при нормальных условиях это кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, малая твёрдость, низкие температуры плавления и кипения, слабо растворим в воде, летуч (сублимирует при н. у.).
6. Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу.
Ответ:
Температура плавления металлов изменяется в очень широких пределах из-за разницы в значениях энергии связи между атомами и ионами металлов. Разница в значениях энергии связи обусловлена тем, что разные металлы имеют разные диаметры атомов (разное количество электронных оболочек), разные заряды ядер, разное количество внешних электронов.
7. Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком − нет? Почему?
Ответ:
Атомы кремния соединены очень прочной ковалентной связью Si–Si (атомная кристаллическая решётка), поэтому при ударе в кристалле кремния происходит разрушение ковалентной химической связи, и изделие из кремния раскалывается на кусочки.
Свинец имеет металлическую химическую связь, поэтому при ударе по металлу атомы свинца смещаются, деформируется его металлическая кристаллическая решетка, но ее разрушения не происходит, поскольку этому мешают общие электроны (изменяется взаимное расположение атомов). Поэтому изделие из свинца только расплющивается §24
-
§24. Чистые вещества и смеси
Лабораторный опыт №14
Ознакомление с образцом горной породы.
Ознакомьтесь с выданным вам образцом горной породы. Рассмотрите его под лупой. Какие минералы образуют эту горную породу? К какому типу смесей она относится?Ответ:
Допустим, ученикам выдали мрамор. Эту горную породу образует минерал кальцит $CaCO_{3}$ бело−серого цвета. Горная порода относится к твёрдым смесям.
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://microschool.io/ru/book/chemistry/chistye−veshchestva−i−smesi
2. https://izamorfix.ru/himiya/fiz/chistyeveshestvai_smesi.html
3. https://obrazovaka.ru/himiya/chistye−veschestva−i−smesi−8−klass.html
4. https://xumuk.ru/encyklopedia/2/3160.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Все вещества можно разделить на две категории – чистые и смешанные. К чистым веществам относятся элементы и соединения, состоящие из одинаковых атомов, молекул или ионов. Это вещества с постоянным составом, сохраняющие постоянные свойства.
Смеси состоят из нескольких разных по структуре чистых веществ, которые называются компонентами. Смеси могут иметь любое агрегатное состояние.
По структуре смеси могут быть однородными или сочетать вещества в разных агрегатных состояниях. В соответствии с этим выделяют:
− гомогенные или однородные – частицы нельзя обнаружить без химического анализа, их показатель одинаков в любом месте пробы (сплав металлов);
− гетерогенные или неоднородные – частицы легко обнаружить, их частота неоднородна в разных местах смеси (вода с песком).
К гетерогенным смесям относятся:
− суспензии – смеси твёрдых и жидких веществ (угля и воды);
− эмульсии – смеси разных по плотности жидкостей (масла и воды).
Способы очистки
Абсолютно чистых веществ не существует. Чистыми веществами считают вещества, содержащие незначительное количество примесей, которые не отражаются на физических и химических свойствах вещества. Чтобы максимально очистить вещество, используются способы разделения смесей:
− отстаивание – оседание тяжёлых веществ в жидкостях;
− фильтрация – отделение частиц от жидкости с помощью фильтров;
− выпаривание – нагревание раствора до испарения влаги;
− применение магнита – выделение с помощью намагничивания;
− дистилляция – разделение веществ с разной температурой кипения;
− адсорбция – скопление одного вещества на поверхности другого.
Сравнение чистых веществ и смесей.
Состав Чистое вещество состоит из частиц одного вида, имеет постоянный состав. Смесь состоит из частиц разного вида, не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным.
Свойства Чистое вещество имеет постоянные свойства. В смеси каждое вещество в основном сохраняет свои свойства. Физические свойства смеси отчасти меняются с изменением её количественного состава.?. Вопросы и задания
1. Приведите примеры жидких, твёрдых и газообразных смесей.
Ответ:
Жидкие смеси: уксус, морская вода, бензин, молоко, сок, бульон.
Твердые смеси: чугун, сталь, комплексные удобрения, стекло, цемент.
Газообразные смеси: воздух, природный газ, газовое топливо, выхлопные газы.2. Можно ли дистиллированную воду считать особо чистым веществом? Почему?
Ответ:
Дистиллированную воду нельзя считать особо чистым веществом, потому что в ней могут быть растворены атмосферные газы, соединения с низкой температурой кипения (хлорорганические соединения, углеводороды и другие органические соединения).
Бидистиллированная вода — дважды очищенная вода. Получают перегонкой дистиллированной воды в кварцевом аппарате — бидистилляторе. По свойствам близка к химически чистой воде.3. Как применяют методы химического анализа в своей работе криминалисты, археологи, медики и искусствоведы? Подготовьте сообщение об этом, используя дополнительные источники информации.
Ответ:
Химия и криминалистика
Главной задачей криминалистики является содействие своими средствами и методами делу борьбы с преступностью. Один из разделов криминалистики, изучающий закономерности возникновения следов, называется трасологией. Он разрабатывает рекомендации по применению методов и средств по обнаружению следов, их фиксации, изъятию и проведению анализа. Важное место среди методов исследования в криминалистике занимает аналитическая химия – наука о методах анализа вещества. Изучение химического состава позволяет получать данные о совершенном преступлении, через познание химического состава объектов материального мира реконструируется событие преступления. Аналитические методы являются одними из наиболее часто используемых в криминалистической практике. Некоторые из них, например микроскопия, люминесцентный анализ, уже давно используются в криминалистике, другие же стали применяться лишь в последнее время (например, хроматография).
Современные методы обнаружения следов на исследуемых объектах можно подразделить на три основные группы: визуальные, физические и химические. Преимуществом использования химических методов является их способность к выявлению застарелых или замытых следов. Эти способы основаны на химической реакции между компонентами потожирового вещества следа и специальными химическими реактивами.
Следы биологического происхождения несут существенную информацию, которая может быть использована в целях раскрытия, расследования и предупреждения преступлений. К ним относятся следы крови, спермы, слюны, пота, волосы, ткани человеческого организма и т. п. Фактически все новые методики исследования биологических объектов (кроме специфических для каких-либо объектов) разрабатываются вначале применительно к крови, а уже затем адаптируются к другим объектам биологического происхождения.
При их исследовании применяются такие химические методы, как метод цветных капельных реакций, определение PH-среды исследуемого объекта и продуктов его превращения с помощью индикаторов, метод хемилюминесценции, метод, связанный с появлением осадка или газообразования в результате воздействия на вещество объекта специфичными или селективными реактивами (например, выделение пузырьков газообразного кислорода при взаимодействии перекиси водорода с кровью), оксигенный метод (изучение способности вещества гореть на воздухе). Также для определения класса вещества и его состава изучается их растворимость в различных растворителях (воде, кислотах, щелочах, бензоле, четыреххлористом водороде, дихлорэтане). Часто проводят люминесцентный анализ, в том числе при воздействии на вещество объекта специальными реактивами.Исследование № 1. Как определить является ли пятно кровью?
Распознать пятна крови можно с помощью перекиси водорода (H2O2), роданида калия(КCNS), желтой кровяной солью (гексацианоферрат калия K4[Fe(CN)6]) и раствора люминола.
Опыт № 1. Обнаружение пятен крови с помощью перекиси водорода.
Методика проведения. 2 грамма фенолфталеина, 20 граммов гидроксида калия растворили в 100 мл дистиллированной воды, добавить 20 граммов порошкового цинка до полного обесцвечивания раствора. Рабочий раствор готовить разведением основного раствора этанолом в соотношении 1:5. Образцы крови и кетчупа нанести на дно чашек Петри.
Добавить 1 каплю щелочного раствора фенолфталеина и несколько капель раствора перекиси водорода, наблюдаем вспенивание и появление розового оттенка в опытах с кровью, в опыте с кетчупом признаков не наблюдаем.
Опыт № 2. Обнаружение пятен крови растворами роданида калия и гексацианоферрата калия (желтой кровяной соли).
Методика проведения. Способ основан на взаимодействии ионов трехвалентного железа, входящего в состав гемоглобина крови, с раствором роданида калия и гексацианоферрата калия.
Для опыта берем растворы кетчупа и крови. В пронумерованные стаканы с исследуемыми растворами добавляем роданид калия, В стакане с образцом 1 наблюдаем появление темно–красное окрашивание. В стакане с образцом 2 изменений не наблюдается. Вывод: образец 1 – это кровь.
2. В стаканы с исследуемыми образцами добавляем желтую кровяную соль. В стакане с образцом 1 наблюдаем появление осадка темно-синего цвета. В стакане с образцом 2 изменений не наблюдается. Вывод: образец 1 – это кровь.
Вывод: так как в состав крови входит белок гемоглобин, содержащий трехвалентное железо, то кровь можно обнаружить с помощью качественных химических реакций. Реактивом на трехвалентное железо является роданид аммония, признак химической реакции – кроваво-красный осадок, желтая кровяная соль признак химической реакции – темно-синий осадок (Берлинская лазурь).
Опыт № 3. Использование люминола на предварительной пробе на кровь.
Методика проведения. Для самостоятельного изготовления люминола нам необходимы следующие компоненты: иммуномоделирующие таблетки «Галавит», содержащие в своем составе соль люминола, 3% перекись водорода и нашатырный спирт. Приготовление реактива заключается в следующем: растираем таблетки в порошок, добавляем 50 мл воды, 40 мл перекись водорода и 10 мл нашатырного спирта. В качестве добавки на качественное определение ионов Fe3+ используем желтую кровяную соль. Подготовленные образцы нумеруем наносим на дно чашек Петри, даем время высохнуть и наносим пульверизатором реагент.
Вывод: появление голубоватого свечения и образование пены свидетельствуют о положительной реакции на кровь.
Исследование № 2. Идентификация отпечатков пальцев.
Отпечаток следует проявить диоксидом марганца (IV) или мелкодисперсным оксидом меди. После обработки на исследуемых поверхностях хорошо видны следы рук.
Вывод: следовательно, таким простым способом, мы можем доказать, что определенные отпечатки пальцев принадлежат какому-либо человеку.
Можно использовать соли серебра (в частности, нитрата серебра) для выявления наличия скрытых следов. Ообработаем исследуемую поверхность из пульверизатора раствором нитрата серебра. В итоге наблюдаем четкое проявление отпечатков рук.
Вывод: данный метод пригоден к использованию, так как руки человека выделяют определенное количество пота, который содержит хлорид натрия. А нитрат серебра используется как реактив на ионы хлора. Наблюдается выпадение белого творожистого осадка.
На основании проведенных исследований хочется отметить, что серьезное изучение криминалистики невозможно без прочных знаний по химии.
4. Предложите способы разделения смесей:
а) железные и медные опилки;
б)порошки железа и серы.Ответ:
Способы разделения смесей:
а) железных и медных опилок − использование магнита (железные опилки притянутся, а медные нет).
б) порошка железа и серы − использование воды (железный порошок осядет на дно, а сера будет плавать на поверхности); использование магнита (порошок железа притянется, а сера нет). §25
-
§25. Массовая и объемная доли компонентов смеси (раствора)
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://foxford.ru/wiki/himiya/massovaya−dolya−elementa−massovaya−dolya−veschestva
2. https://www.yaklass.ru/p/himija/89−klass/raschetnye−zadachi−po−khimii−14608/vychislenie−massovoi−doli−veshchestva−v−rastvore−228938/re−cc5a9349−444d−4292−a42e−b71a7bfb9b7c
3. https://dic.academic.ru/dic.nsf/stroitel/6082
4. https://interneturok.ru/lesson/chemistry/8−klass/bpervonachalnye−himicheskie−predstavleniyab/massovaya−dolya−himicheskogo−elementa−v−veschestve2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Массовая доля
Массовой долей называют отношение массы растворенного вещества к массе раствора. Ее обозначают буквой ω («омега»). Важно заметить, что в понятие раствора входит как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле
$ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$.
Полученное число будет показывать массовую долю в долях от единицы, если нужно получить в процентах − его нужно умножить на 100%.
Масса раствора равна сумме его компонентов:
m (р−ра) = m (в−ва) + m (р−ля).
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%:
ω (в−ва) + ω (р−ля)=100%.
Масса раствора находится сложением масс компонентов, входящих в раствор:
m (р−ра) = m (в−ва) + m (р−ля).?. Вопросы и задания
1. Для борьбы с болезнями растений, особенно плодовых деревьев и виноградников, применяют раствор сульфата меди (II). Обычно растворяют 100 г соли на ведро воды (8л). Какова массовая доля соли в полученном растворе? Сколько воды и соли содержится в 500 г этого раствора?
Ответ:
Дано:
$m_{1}(CuSO_{4})$ = 100 г;
V ($H_{2}O$) = 8 л;
$m_{2} (р-ра)$ = 500 г.
_____________
ω ($CuSO_{4}$) − ?
$m_{2} (CuSO_{4})$ − ?
$m_{2} (H_{2}O)$ − ?
Решение:
V ($H_{2}O$) = 8 л = 8000 мл;
m = ρ · V;
Допустим, плотность воды 1 г/мл, тогда
$m_{1}(H_{2}O)$ = 1 * 8000 = 8000 г.
$m_{1}(р-ра)=m_{1}(CuSO_{4})+m_{1}(H_{2}O) = 100 + 8000 = 8100$ г;
$ ω =\frac{m (в-во)}{m (р-р)}$;
$ω (CuSO_{4}) = \frac{100}{8100} = 0,012$ или 1,2%;
m (вещ−во) = m (р−р) * ω;
$m_{2} (CuSO_{4}) = 500 * 0,012 = 6$ г;
$m_{2} (H_{2}O) = m_{2}(р-ра) - m_{2} (CuSO_{4})$ = 500 − 6 = 494 г.
Ответ. 1,2 %; 6 г; 494 г.2. Вычислите массы йода и спирта, необходимые для приготовления 30 г 5%−го раствора иодной настойки.
Ответ:
Дано:
ω ($I_{2}$) = 5%;
m (р−ра) = 30 г.
_____________
m ($I_{2}$) − ?
m (спирт) − ?
Решение:
m (вещ−во) = m (р−р) * ω;
ω ($I_{2}$) = 5 * 0,01 = 0,05;
m ($I_{2}$) = 30 * 0,05 = 1,5 г;
m (спирт) = m (р−ра) − m ($I_{2}$) = 30 − 1,5 = 28,5 г.
Ответ: 1,5 г; 28,5 г.3. Рассчитайте количество вещества спирта $C_{2}H_{6}O$, который содержится в 500 г водки (40%−й раствор спирта). Не забудьте, что количество вещества измеряется в молях.
Ответ:
Дано:
ω ($C_{2}H_{6}O$) = 40%;
m (р−ра) = 500 г;
_____________
n ($C_{2}H_{6}O$) − ?
Решение:
$ω (C_{2}H_{6}O) = \frac {40}{100}$= 0,4;
m (вещ−во) = m (р−р) * ω;
m ($C_{2}H_{6}O$) = 500 * 0,4 = 200 г;
$n = \frac{m}{M}$;
M ($C_{2}H_{6}O$) = 2 * Ar (C) + 6 * Ar (H) + 1 * Ar (O) = 2 * 12 + 6 * 1 + 1 * 16 = 46;
$n = (C_{2}H_{6}O) = \frac{200}{46}$ = 4,35 моль;
Ответ. 4,35 моль этилового спирта.4. Из 250 г 20%−го раствора хлорида калия выпарили 100 мл воды. Какой стала массовая доля соли в растворе?
Ответ:
Дано:
$m _{1} (р-ра)$= 250 г;
$ω_{1} (KCl)$ = 20%;
Vвыпар. ($H_{2}O$) = 100 мл;
_____________
$ω_{2} (KCl)$ − ?
Решение:
m = ρ · V;
Допустим, плотность воды 1 г/мл, тогда
$m_{выпар.} (H_{2}O)$ = 1 * 100 = 100 г;
$ω_ {1}(KCl) = \frac {20}{100}$= 0,2;
$m (вещ-во) = m_{1}(р-р) * ω_{1} (KCl)$;
$m_{1} (KCl) = 250 * 0,2 = 50$ г;
$m_{2} (р-ра) = m _{1} (р-ра) - m_{выпар.} (H_{2}O) = 250 - 100 = 150$ г;
$ω (вещ-во) = \frac{m (в-во)}{m (р-р)}$;
$ω_{2} (KCl) = \frac{50}{150} = 0,33$ или 33 %.
Ответ. 33 %.5. В 180 г 15%−го раствора гидроксида натрия растворили ещё 20 г щёлочи. Рассчитайте массовую долю щёлочи в полученном растворе.
Ответ:
Дано:
$m_{1} (р-ра) = 180$ г;
$ω_{1} (NaOH) = 15$ %;
$m_{добав.}(NaOH) = 20$ г.
_____________
$ω_{2} (NaOH)$ − ?
Решение:
$ω_ {1}(NaOH) = \frac {15}{100}$= 0,15;
m (вещ−во) = m (р−р) * ω (вещ−во);
$m_{1} (NaOH) = m_{1} (р-ра) * ω_ {1}(NaOH) = 180 * 0,15 = 27$ г;
$m_{2} (NaOH) = m_{1} (NaOH) + m_{добав.}(NaOH) = 27 + 20 = 47$ г;
$m_{2} (р-ра) = m_{1} (р-ра) + m_{добав.}(NaOH) = 180 + 20 = 200$ г;
$ ω (вещ-во) = \frac{m (в-во)}{m (р-р)}$;
$ω_{2} (NaOH) = \frac{m_{2} (NaOH)}{m_{2} (р-ра)} = \frac{47}{200}$ = 0,235 или 23,5%.
Ответ. 23,5 %.6. Смешали два раствора серной кислоты: 240 г 30%−го и180 г 5%−го. Рассчитайте массовую долю кислоты в полученном растворе.
Ответ:
Дано:
$m_{1}(р-ра) = 240$ г;
$ω_{1}(H_{2}SO_{4})=30$ %;
$m_{2}(р-ра)=180$ г;
$ω_{2}(H_{2}SO_{4})=5$ %.
_____________
$ω_{3}(H_{2}SO_{4})$ − ?
Решение:
$ω_ {1}(H_{2}SO_{4}) = \frac {30}{100} = 0,3$;
$ω_ {2}(H_{2}SO_{4}) = \frac {5}{100} = 0,05$;
m (вещ−во) = m (р−р) * ω (вещ−во);
$m_{1} (H_{2}SO_{4}) = m_{1} (р-ра) * ω_ {1}(H_{2}SO_{4}) = 240 * 0,3 = 72$ г;
$m_{2} (H_{2}SO_{4}) = m_{2} (р-ра) * ω_ {2}(H_{2}SO_{4}) = 180 * 0,05 = 9$ г;
$m_{3} (H_{2}SO_{4}) = m_{1} (H_{2}SO_{4}) + m_{2} (H_{2}SO_{4}) = 72 + 9 = 81$ г;
$m_{3}(р-ра) = m_{1}(р-ра) + m_{2}(р-ра) = 240 + 180 = 420$ г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω_{3}(H_{2}SO_{4}) = \frac{m_{3} (H_{2}SO_{4}}{m_{3}(р-ра)} = \frac{81}{420} = 0,19$ или 19%.
Ответ. 19 %.Темы для дискуссии
1. Докажите относительность деления веществ при обычных условиях на твёрдые и жидкие, используя понятие «аморфные вещества».
Ответ:
Относительно деление веществ на типы по их агрегатному состоянию. Твёрдое состояние вещества по своему строению и свойствам подразделяют на кристаллическое и аморфное.
Кристаллическое состояние характеризуется упорядоченной структурой. Упорядоченность в кристаллах обусловливается правильным геометрическим расположением частиц, из которых состоит твердое вещество. Каждое кристаллическое вещество имеет определенную, характерную форму.
Аморфные вещества не образуют правильной геометрической структуры, представляя собой структуры неупорядоченно расположенных молекул. В отличие от кристаллических веществ, имеющих вполне определенную температуру плавления, аморфные вещества плавятся в широком интервале температур. При нагревании они постепенно размягчаются, затем начинают растекаться и, наконец, становятся жидкими. Аморфное состояние веществ неустойчиво, и рано или поздно оно переходит в кристаллическое.
Таким образом, вещества в аморфном состоянии с точки зрения их структуры можно рассматривать как очень вязкие жидкости, а с точки зрения их свойств — как твёрдые вещества.
Также относительность деления веществ на типы по их агрегатному состоянию подтверджают жидкие кристаллы.
Жидкими кристаллами называются вещества, которые одновременно обладают свойствами жидкости (текучестью, способностью находиться в каплевидном состоянии) и твёрдого кристаллического вещества (анизотропией, т. е. зависимостью физических свойств — механических, тепловых, электрических и др. — от направления).2. Обоснуйте, что знание химической номенклатуры необходимо человеку в любой сфере деятельности.
Ответ:
Знание номенклатуры и умение правильно ею пользоваться необходимо каждому научному работнику, так как химическая номенклатура по существу — это особый химический язык, который должен быть понятен любому человеку, имеющему дело с веществом. Номенклатура химических соединений имеет и международный характер, так как строится на принципах, рекомендованных к использованию во всем мире. Знание номенклатуры химических соединений облегчает обучение и обмен научной информацией ученых, говорящих на различных языках.
Кроме того, человек в любой сфере деятельности может столкнуться с химическими веществами. Химические вещества могут принести огромный вред всему живому при неправильном их использовании. Знать химию нужно для своей безопасности, чтобы не нанести вред себе и окружающему миру.3. Что вы понимаете под термином «чистое вещество»?
Ответ:
Теоретически, химически чистое вещество должно состоять из частиц одного вида. Практически химически чистым считают вещество наивысшей возможной степени очистки при данном уровне развития науки и техники.
Особо чистые вещества получают при глубокой очистке, для которых используют различные физико−химические методы − осаждение, ректификация, дистилляция, экстракция, ионный обмен и др.
Особо чистые вещества содержат примеси в таком незначительном количестве, что они не влияют на основные специфические свойства веществ. §26
-
ГЛАВА ЧЕТВЕРТАЯ. Изменения происходящие с веществами
§26. Физические явления в химии
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Дистилляция
2. https://xumuk.ru/encyklopedia/1400.html
3. https://www.yaklass.ru/p/himija/89−klass/pervonachalnye−khimicheskie−poniatiia−i−teoreticheskie−predstavleniia−15840/razdelenie−smesei−metody−ochistki−veshchestv−179819/re−f291ca17−2e30−46d6−9383−72bc212acd6c
4. http://orgchemlab.com/distillation/simple−distillation.html
5. https://ru.wikipedia.org/wiki/Выпаривание#:~:text=Выпаривание%20—%20это%20метод%20химико−технологической,кристаллизации%20из%20них%20твёрдого%20вещества.
6. https://xumuk.ru/encyklopedia/840.html
7. http://www.himikatus.ru/art/htlab/93vyparivani1.php
8. https://ru.wikipedia.org/wiki/Сублимация_%28физика%29
9. https://dic.academic.ru/dic.nsf/ruwiki/62242. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Дистилляция или перегонка
Перегонка (или дистилляция) — это способ разделения жидких смесей, основанный на значительной разнице температуры кипения компонентов смеси.
При нагревании более летучая жидкость (с меньшей температурой кипения) испаряется. Затем её пары охлаждают — происходит конденсация (переход из газообразного в жидкое состояние).
Простейший прибор для дистилляции состоит из двух сосудов (например, пробирок), пробки с газоотводной трубкой и стакана с холодной водой для охлаждения паров.
Смесь нагревается в одном сосуде, а пары более летучего вещества конденсируются в другом. Так можно отделить жидкость от растворённых в ней веществ.
В более сложных приборах для охлаждения паров используют специальный холодильник, через кожух которого проходит проточная вода. При нагревании смеси сначала испаряется вещество с самой низкой температурой кипения. Его пары охлаждаются в холодильнике, и в сосуде собирается чистое вещество. Затем нагревание усиливают и отделяют следующее вещество с более высокой температурой кипения.
В химических лабораториях при производстве лекарств таким методом получают дистиллированную воду (без примесей растворённых солей).
Перегонка используется для опреснения морской воды в тех странах, где питьевой воды не хватает.
Перегонка является одним из основных способов переработки нефти. Нефть представляет собой смесь многих веществ. С помощью перегонки из неё выделяют разные виды топлива.?. Вопросы и задания
1. Какой способ разделения смесей описан в научно−фантастическом произведении А. Беляева «Продавец воздуха»?
Ответ:
В научно−фантастическом произведении А. Беляева "Продавец воздуха" описан способ разделения смесей основанный на разности температур кипения компонентов водящих в состав жидкого воздуха, то есть это способ дистилляции.
"...При испарении жидкого воздуха сначала выделяется кипящий азот, точка кипения которого минус сто девяносто четыре градуса Цельсия, потом аргон..."2. Откуда берёт своё начало поверье, что рассыпанная соль − к ссоре? Как помирить людей, поссорившихся из−за рассыпанной соли?
Ответ:
Поверье, что рассыпанная соль к ссоре пошло с далеких времен, когда соль стоила очень дорого и пустая растрата такого дорогого продукта неизбежно вела к ссоре.
Чтобы люди, рассыпая соль, не поругались, необходимо каждому через левое плечо перекинуть три щепотки соли. Эта примета была придумана много позже, когда люди уже могли спокойно позволить себе рассыпать эту соль, не переживая за ее стоимость.3. Укажите способы разделения следующих смесей:
а) зубной порошок и поваренная соль;
б) спирт и вода;
в) бензин и вода.Ответ:
а) Смесь зубного порошка и поваренной соли нужно высыпать в стакан с водой. Поваренная соль растворится в воде, а порошок не растворится. Затем раствор профильтровать. На фильтре останется зубной порошок. Поваренную соль можно выделить из раствора выпариванием.
б) Спирт и вода имеют разные температуры кипения, а значит их смесь можно разделить с помощью перегонки.
в) Плотность бензина меньше, чем воды. Смесь бензина и воды расслоится в делительной воронке на 2 фракции, нужно слить воду, а потом бензин.4. Как в походных условиях очистить и обеззаразить речную воду и сделать её пригодной для питья и приготовления пищи?
Ответ:
Речную воду надо отстоять для осаждения нерастворимых примесей, профильтровать через несколько слоёв ткани, прокипятить для уничтожения бактерий.
5. Почему работники элеваторов (зернохранилищ) при просеивании и сортировке зерна надевают специальную маску?
Ответ:
Работники элеваторов надевают маски для защиты дыхательной системы от частичек пыли, спор грибов и бактерий, которые поднимаются в воздух при просеивании и сортировке зерна.
6. Какой способ очистки чайной заварки от чаинок вы используете, когда наливаете её из чайника через ситечко?
Ответ:
Когда наливаю заварку из чайника через ситечко, то я использую фильтрование, как способ очистки чайной заварки от чаинок.
§27
-
§27. Химические реакции
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−10−priznaki−himicheskih−reakcij.html
2. http://www.hemi.nsu.ru/ucheb151.htm
3. https://www.yaklass.ru/p/himija/89−klass/pervonachalnye−khimicheskie−poniatiia−i−teoreticheskie−predstavleniia−15840/priznaki−i−usloviia−protekaniia−khimicheskikh−reaktcii−213908/re−ad9a7eee−5e3d−428b−9f47−0479de6b9656
4. https://www.yaklass.ru/p/himija/89−klass/pervonachalnye−khimicheskie−poniatiia−i−teoreticheskie−predstavleniia−15840/priznaki−i−usloviia−protekaniia−khimicheskikh−reaktcii−213908/re−08cf908a−8c09−4480−bcb8−545e1d891d0c
5. https://izamorfix.ru/himiya/fiz/usloviya_reakcii.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Признаки химических реакций
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества − с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Признаки химических реакций:
− выделение газа;
− образование или растворение осадка;
− изменение цвета;
− изменение запаха;
− излучение света;
− выделение или поглощение тепла.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создать определенные условия.?. Вопросы и задания
1. В крепко заваренный свежий чай в стакане поместите кусочек лимона или несколько кристаллов лимонной кислоты. Что наблюдаете?
Ответ:
Чай станет светлее.
2. Приготовьте с помощью лимонной кислоты домашний шипучий напиток. Немного кислоты на кончике чайной ложки растворите в воде, а затем добавьте в полученный раствор столько же пищевой (питьевой) соды. Что наблюдаете?
Ответ:
Наблюдается образование пузырьков углекислого газа.
3. Старинные медные монеты и бронзовые изделия часто бывают покрыты зеленоватым налётом, а серебряные − чёрным. О чём говорит появление этих налётов? Как очистить изделия от них?
Ответ:
Появление этих налетов говорит о том, что металлические изделия взаимодействуют с веществами, которые входят в состав воздуха.
Медь реагирует с углекислым газом $CO_{2}$ и парами воды $H_{2}O$ , образуя основной карбонат меди $(CuOH)_{2}CO_{3}$ зелёного цвета, а серебро окисляется сероводородом $H_{2}S$ воздуха до черного сульфида серебра $Ag_{2}S$.
Очистить изделия от этих налетов можно с помощью нашатырного спирта (10% раствор аммиака $NH_{3}$ в воде), а также с помощью слабой кислоты (например, лимонной).4. Какую химическую ошибку допускали журналисты, когда в своих репортажах писали, например, такую фразу: «Место происшествия освещалось непрерывными вспышками магния»?
Ответ:
С середины XIX века до середины XX века в основе фотовспышки лежала реакция окисления магния. Но магний не может гореть непрерывно, он быстро сгорает. Журналисты, наверное, просто имели в виду, что было много таких вспышек, то есть много фоторепортеров.
5. Расскажите об устройстве и работе огнетушителя.
Ответ:
Работа огнетушителя основана на том, что оксид углерода (IV) вытесняется из корпуса огнетушителя под действием собственного избыточного давления, которое создается при заправке огнетушителя. При приведении огнетушителя в действие заряд CO2 по сифонной трубке поступает к раструбу. Расширяясь, сжиженная двуокись углерода переходит в снегообразное (твердое) состояние с резким понижением температуры до минус 70°C. Огнетушащее действие углекислого газа основано на охлаждении зоны горения и заполнении зоны возгорания негорючим веществом до концентраций, при которых происходит прекращение реакции горения.
6. Почему загоревшиеся нефтепродукты или вспыхнувшие электрические провода нельзя тушить водой? Как их погасить?
Ответ:
Загоревшиеся нефтепродукты нельзя тушить водой, потому что они с ней не смешиваются, а поднимаются на поверхность и горят дальше.
Тушат нефтепродукты химической пеной, песком или порошком.
Электрические провода нельзя тушить водой, поскольку вода проводит электрический ток из−за наличия в ней растворенных солей, и возникает опасность поражения пожарного током. Их тушат обычно углекислотным огнетушителем. §28
-
§28. Химические уравнения
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−11−himicheskie−uravnenija.html
2. http://www.hemi.nsu.ru/ucheb151.htm
3. https://ru.wikipedia.org/wiki/Химическое_уравнение
4. http://www.chem.msu.su/rus/school/zhukov1/02a.html
5. https://dic.academic.ru/dic.nsf/ruwiki/6979492. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Химические уравнения
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Уравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии, в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций – условные записи, дающие представление о природе реагентов и продуктов, т. е. качественную информацию о химической реакции.
История
Сначала не было представления о химических уравнениях, ещё не были известны основные химические законы, но уже в стародавние времена, в алхимический период развития химии начали обозначать химические элементы символами.
С дальнейшим развитием химии менялись представления о символике химических элементов, расширялись знания об их соединениях. С открытием множества химических явлений возникла необходимость в переходе от их словесного описания к более удобной математической записи, используя химические формулы. Первым предложил использовать химические уравнения Жан Бегун (Jean Beguin) в 1615 году в первом учебнике по химии Tyrocinium Chymicum («Начала химии»).
Конец XVIII — начало XIX вв.−становление законов стехиометрии. У истоков этих исследований стоял немецкий ученый И. В. Рихтер. В студенческие годы на него большое впечатление произвели слова его учителя − философа И. Канта о том, что в отдельных направлениях естественных наук истинной науки столько, сколько в ней математики. Рихтер посвятил свою диссертацию использованию математики в химии. Не будучи в сущности химиком, Рихтер ввел первые количественные уравнения химических реакций, стал использовать термин стехиометрия.
Правила составления
В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком "плюс". В правой части уравнения записывают формулы (формулу) образовавшихся веществ, также соединенных знаком "плюс". Между частями уравнения ставят стрелку. Затем находят коэффициенты − числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Для составления уравнений химических реакций , кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты. Это можно сделать, используя несложные правила:
1. Перед формулой простого вещества можно записывать дробный коэффициент, который показывает количество вещества реагирующих и образующихся веществ.
2. Если в схеме реакции есть формула соли, то вначале уравнивают число ионов, образующих соль.
3. Если участвующие в реакции вещества содержат водород и кислород, то атомы водорода уравнивают в предпоследнюю очередь, а атомы кислорода − в последнюю.
4. Если в схеме реакции имеется несколько формул солей, то необходимо начинать уравнивание с ионов, входящих в состав соли, содержащей большее их число.?. Вопросы и задания
1. Запишите в виде химических уравнений следующие предложения:
а) «При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)»;
б) «При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота».
Какая из реакций будет экзотермической, а какая − эндотермической?Ответ:
а) Если имеется обжиг, то на вещество действует температура.
$CaCO_{3} \overset{t}{→} CaO + CO_{2}$.
Так как происходит поглощение теплоты, то реакция эндотермическая.
б) $P_{2}O_{5} + 3H_{2}O ⟶ 2H_{3}PO_{4}$ − при реакции выделяется теплота, следовательно, реакция экзотермическая.2. Составьте уравнения по следующим схемам:
а) $CuCl_{2} + Al \overset{t}{→} AlCl_{3} + Cu$;
б) $P + O_{2} → P_{2}O_{5}$;
в) $Fe_{2}(SO_{4})_{3} + KOH → Fe(ОН)_{3} + K_{2}SO_{4}$;
г) $CuOH \overset{t}{→} Cu_{2}О + H_{2}O$;
д) $CS_{2} + O_{2} → CO_{2} + SO_{2}$;
е) $С_{2}H_{2} (ацетилен) + O_{2} → CO_{2} + H_{2}O$;
ж) $FeS_{2} (колчедан)+ O_{2} \overset{t}{→} Fe_{2}О_{3} + SO_{2}$;
Под формулами веществ напишите их названия.Ответ:
а) $CuCl_{2} + Al \overset{t}{→} AlCl_{3} + Cu$;
Уравняем число ионов, образующих соль $AlCl_{3}$:
$3CuCl_{2} + Al \overset{t}{→} 2AlCl_{3} + Cu$;
Уравняем оставшиеся металлы:
$\underset{хлорид\;меди (II)}{3CuCl_{2}} + \underset{алюминий}{2Al} \overset{t}{=} \underset{хлорид\;алюминия}{2AlCl_{3}} + \underset{медь}{3Cu}$.
б) $P + O_{2} → P_{2}O_{5}$;
Уравняем число атомов кислорода:
$P + 5O_{2} → 2P_{2}O_{5}$;
Уравняем число атомов фосфора:
$\underset{фосфор}{4P} + \underset{кислород}{5O_{2}} = \underset{оксид\;фосфора (V)}{2P_{2}O_{5}}$.
в) $Fe_{2}(SO_{4})_{3} + KOH → Fe(ОН)_{3} + K_{2}SO_{4}$;
Уравняем гидроксиды:
$Fe_{2}(SO_{4})_{3} + 3KOH → Fe(ОН)_{3} + K_{2}SO_{4}$;
Уравняем сульфаты:
$Fe_{2}(SO_{4})_{3} + 3KOH → Fe(ОН)_{3} + 3K{2}SO_{4}$;
Уравняем оставшиеся катионы:
$\underset{сульфат\;железа (III)}{Fe_{2}(SO_{4})_{3} } + \underset{гидроксид\;калия}{6KOH} = \underset{гидроксид\;железа (III)}{2Fe(ОН)_{3}} + \underset{сульфат\;калия}{3K{2}SO_{4}}$.
г) $CuOH \overset{t}{→} Cu_{2}О + H_{2}O$;
Уравняем число атомов меди и водорода:
$\underset{гидроксид\;меди (I)}{$2CuOH} \overset{t}{=} \underset{оксид\;меди (I)}{Cu_{2}О} + \underset{оксид\;водорода (I)}{H_{2}O}$.
д) $CS_{2} + O_{2} → CO_{2} + SO_{2}$;
Уравняем число атомов серы:
$CS_{2} + O_{2} → CO_{2} + 2SO_{2}$;
Уравняем число атомов кислорода:
$\underset{сульфид\;углерода (IV)}{CS_{2}} + \underset{кислород}{3O_{2}} = \underset{оксид\;углерода (IV)}{CO_{2}} + \underset{оксид\;серы (IV)}{ 2SO_{2}} $;
е) $С_{2}H_{2} + O_{2} → CO_{2} + H_{2}O$;
Уравняем число атомов углерода:
$С_{2}H_{2} + O_{2} → 2CO_{2} + H_{2}O$;
Уравняем число атомов кислорода:
$С_{2}H_{2} + 2,5O_{2} → 2CO_{2} + H_{2}O$;
Избавимся от дробного числа, удвоив коэффициенты:
$ \underset{ацетилен}{2С_{2}H_{2}} + \underset{кислород}{5O_{2}} = \underset{оксид\;углерода (IV)}{4CO_{2}} +\underset{оксид\;водорода (I)}{2H_{2}O}$.
ж) $FeS_{2} + O_{2} \overset{t}{→} Fe_{2}О_{3} + SO_{2}$;
Уравняем число атомов железа и серы:
$2FeS_{2} + O_{2} \overset{t}{→} Fe_{2}О_{3} + 4SO_{2}$;
Уравняем число атомов кислорода:
$2FeS_{2} + 5,5O_{2} \overset{t}{→} Fe_{2}О_{3} + 4SO_{2}$;
Избавимся от дробного числа, удвоив коэффициенты:
$ \underset{колчедан}{4FeS_{2}} + \underset{кислород}{11O_{2} } \overset{t}{=} \underset{оксид\;железа (III)}{2Fe_{2}О_{3}} + \underset{оксид\;серы (IV)}{8SO_{2}}$3. Запишите уравнения химических реакций по следующим схемам:
а) фосфорная кислота + гидроксид натрия → фосфат натрия + вода;
б) оксид натрия + вода → гидроксид натрия;
в) оксид железа (II) + алюминий \overset{t}{→} оксид алюминия + железо;
г) гидроксид меди (II) \overset{t}{→} оксид меди (II) + вода.Ответ:
а) $H_{3}PO_{4} + NaOH ⟶ Na_{3}PO_{4} + H_{2}O$;
$H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$.
б) $Na_{2}O + H_{2}O ⟶ NaOH$;
$Na_{2}O + H_{2}O = 2NaOH$.
в) $FeO + Al \overset{t}{→} Al_{2}O_{3} + Fe$;
$3FeO + 2Al \overset{t}{=} Al_{2}O_{3} + 3Fe$.
г) $Cu(OH)_{2} \overset{t}{→} CuO + H_{2}O$;
$Cu(OH)_{2} \overset{t}{=} CuO + H_{2}O$.4. Что показывает уравнение следующей химической реакции:
$Fe_{2}O_{3} + 3H_{2} \overset{t}{→} 2 Fe + 3H_{2}O$?
Вычислите количество вещества водорода, которое взаимодействует с 1 моль оксида железа (III). Вычислите объём водорода, который взаимодействует с 1 моль оксида железа (III). Вычислите количество вещества железа, которое при этом образуется. Сколько молекул воды при этом получается?Ответ:
Уравнение показывает, что железо можно восстановить из его оксида с помощью водорода при нагревании, в результате этого процесса образуется чистое железо и вода.
Дано:
n ($Fe_{2}O_{3}$) = 1 моль;
_____________
n ($H_{2}$) − ?
V ($H_{2}$) − ?
n (Fe) − ?
N ($H_{2}O$) − ?
Решение:
$Fe_{2}O_{3} + 3H_{2} \overset{t}{=} 2 Fe + 3H_{2}O$
При взаимодействии: 1 молекулы оксида железа (III) с 3 молекулами водорода получится 2 молекул железа и 3 молекулы воды.
Составим пропорции:
1 моль 3 моль 2 моль 3 моль
1 моль х моль y моль z моль
$ х = n (H_{2}) = \frac{1 * 3}{1}$ = 3 моль;
$ y = n (Fe) = \frac{1 * 2}{1}$ = 2 моль;
$ z = n (H_{2}O) = \frac{1 * 3}{1}$ = 3 моль;
$V = V_{m}* n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m}* n (H_{2})$ = 22,4 * 3 = 67,2 л;
$ N = n * N_{A}$;
$N_{A} = 6,02 * 10^{23}$;
$N (H_{2}O) = n (H_{2}O) * 6,02 * 10^{23} = 3 * 6,02 * 10^{23} = 1,8 * 10^{24}$ молекул.
Ответ. 3 моль; 2 моль; 67,2 л; $1,8 * 10^{24}$ молекул. §29
-
§29. Расчеты по химическим уравнениям
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1.https://foxford.ru/wiki/himiya/raschety−po−himicheskim−uravneniyam
2. https://himi4ka.ru/arhiv−urokov/urok−14−raschety−po−uravnenijam−himicheskih−reakcij.html
3. https://sites.google.com/site/himiaprostodostupnonagladno/ma/prostaa−zadacka/rascety−po−himiceskim−uravneniam2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Вычисления по уравнению реакции
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
Эти расчеты проводят по уравнениям реакций. Расчёты количеств веществ, участвующих в химических реакциях, называются стехиометрическими.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое внимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Универсального способа решения всех химических задач не существует и не может быть, однако следует придерживаться наиболее общего алгоритма решения.
Например:
1. Внимательно прочитайте текст задачи.
2. Запишите условия задачи: что дано, что надо найти.
3. Составьте уравнение реакции, описанной в задаче.
4. В уравнении реакции подчеркните формулы тех веществ, о идёт речь в задаче.
5. Под формулами отмеченных веществ укажите следующие величины:
а) количества вещества (определить по коэффициентам;
б) молярные массы (подсчитывается по формулам веществ);
в) массы веществ в соответствии с указанным количеством вещества;
6. Над формулами отмеченных веществ запишите массы, заданные условием задачи.
7. Составьте рассуждение на основе условия задачи.
8. Составьте пропорцию на основе рассуждения и решите её.
9. Дайте ответ в соответствии с главным вопросом задачи.?. Вопросы и задания
1. Какой объём водорода (н.у.) и количество вещества соли образуется при взаимодействии соляной кислоты с алюминием массой 540 мг, содержащим примеси с массовой долей 4%?
Ответ:
Дано:
m (Al с примесями) = 540 мг;
ω (примеси) = 4 %;
_____________
$V (H_{2})$ − ?
$ n (AlCl_{3})$ − ?
Решение:
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}$;
$ω_{чист} (Al) = 100 - 4 = 96$ % или 0,96;
m (Al с примесями) = 540 * 0,001 = 0,54 г;
$m_{чист} (Al) = m (Al\;с\;примесями) * ω_{чист} (Al) = 0,54 * 0,96 = 0,5184$ г;
$n = \frac{m}{M}$;
M (Al) = 27 г/моль;
$n (Al) = \frac{$m_{чист} (Al)}{M (Al)} = \frac{0,5184}{27} = 0,0192$ моль.
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{0,0192 моль}{2Al}} + 6HCl = \underset{2 моль}{\overset{х}{2AlCl_{3}}} + \underset{3 моль}{\overset{y}{3H_{2}}}$;
$x = n (AlCl_{3}) = \frac{0,0192 * 2}{2} = 0,0192$ моль;
$y = n (H_{2}) = \frac{0,0192 * 3}{2} = 0,0288 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 0,0288 = 0,6451$ л.
Ответ. 0,0192 моль; 0,6451 л.2. Какая масса оксида кальция получится при разложении 250 кг карбоната кальция, содержащего 20% примесей? Какой объём (н.у.) оксида углерода (IV) при этом выделится?
Ответ:
Дано:
m ($СаCO_{3}$ с примесями) = 250 кг;
ω (примеси) = 20 %;
_____________
m (CaO) − ?
$ V (CO_{2})$ − ?
Решение:
$СаCO_{3} \overset{t}{=} CaO + CO_{2}↑$;
$ω (СаCO_{3}) = 100 - 20 = 80$ % или 0,8;
m ($СаCO_{3}$ с примесями) = 250 * 1000 = 250000 г;
m ($СаCO_{3} ) = m (СаCO_{3}\;с\;примесями) * ω (СаCO_{3})$ = 250000 * 0,8 = 200000 г;
$n = \frac{m}{M}$;
M ($СаCO_{3}$ ) = 1 * Ar (Са) + 1 * Ar (С) +3 * Ar (O) = 1 * 40 + 1 * 12 +3 * 16 = 100 г/моль;
$n (СаCO_{3}) = \frac{m(СаCO_{3})}{M (СаCO_{3})} = \frac{200000}{100} = 2000 $ моль.
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{2000 моль}{СаCO_{3}}} \overset{t}{=} \underset{1 моль}{\overset{х}{CaO}} + \underset{1 моль}{\overset{y}{CO_{2}}}$;
$x = n (CaO) = \frac{2000 * 1}{1} = 2000 $ моль;
$y = n (CO_{2}) = \frac{2000 * 1}{1} = 2000 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (CO_{2}) = V_{m} * n (CO_{2})$ = 22,4 * 2000 = 44800 л или 44,8 $м^{3}$
m = n * M;
M (CaO) = 1 * Ar (Са) + 1 * Ar (O) = 1 * 40 + 1 * 16 = 56 г/моль;
m (CaO) = n (CaO) * M (CaO) = 2000 * 56 = 112 000 г или 112 кг.
Ответ. 112 кг; 44800 л;3. Сколько молекул кислорода и какой объём водорода (н.у.) образуется при разложении 180 г воды?
Ответ:
Дано:
m ($H_{2}O$) = 180 г;
_____________
N ($O_{2}$) − ?
V ($H_{2}$) − ?
Решение:
$2H_{2}O = 2H_{2} +O_{2}$;
$n = \frac{m}{M}$;
M ($H_{2}O$) = 2 * Ar (H) + 1 * Ar (O) = 2 * 1 + 1 * 16 = 18 г/моль;
$n (H_{2}O) = \frac{m(H_{2}O)}{M (H_{2}O)} = \frac{180}{18} = 10 $ моль.
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{10 моль}{2H_{2}O}} =\underset{2 моль}{\overset{х}{2H_{2}}} + \underset{1 моль}{\overset{y}{O_{2}}}$;
$x = n (H_{2}) = \frac{10 * 2}{2} = 10 $ моль;
$y = n (O_{2}) = \frac{10 * 1}{2} = 5 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2})$ = 22,4 * 10 = 224 л;
$N = n * N_{A}$;
$N_{A}= 6,02 * 10^{23}$;
$N (O_{2}) = n (O_{2}) * N_{A} = 5 * 6,02 * 10^{23} = 3 * 10^{24}$ молекул.
Ответ. 112 кг; 44800 л;4. Придумайте условие задачи, в которой необходимо использовать приведённое ниже уравнение, и решите её:
$H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$Ответ:
Какой объём воды и количество вещества соли образуется при нейтрализации 250 г раствора фосфорной кислоты гидроксидом натрия, если известно, что массовая доля фосфорной кислоты равна 40%.
Дано:
m (р−ра) = 250 мг;
ω ($H_{3}PO_{4}$) = 40 %;
_____________
$V (H_{2}O)$ − ?
$ n (Na_{3}PO_{4})$ − ?
Решение:
$H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$;
$m (H_{3}PO_{4}) = m (р-ра) * ω (H_{3}PO_{4}) = 250 * 0,4 = 90 $ г;
$n = \frac{m}{M}$;
$M (H_{3}PO_{4})$ = 3 * Ar (H) + 1 * Ar (P) + 4 * Ar (O) = 3 * 1 + 1 * 31 + 4 * 16 = 98 г/моль;
$n (H_{3}PO_{4}) = \frac{m (H_{3}PO_{4})}{M(H_{3}PO_{4})} = \frac{90}{98} = 0,092$ моль.
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{0,092 моль}{H_{3}PO_{4}}} +3NaOH = \underset{1 моль}{\overset{х}{Na_{3}PO_{4}}} + \underset{3 моль}{\overset{y}{3H_{2}O}}$;
$x = n (Na_{3}PO_{4}) = \frac{0,092 * 1}{1} = 0,092$ моль;
$y = n (H_{2}O) = \frac{0,092 * 3}{1} = 0,276 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}O) = V_{m} * n (H_{2}O) = 22,4 * 0,276 =6,18 $ л.
Ответ. 0,092 моль; 6,18 л.5. Придумайте и решите задачу, в условиях которой была бы дана масса раствора вещества с определённой массовой долей растворённого вещества, а требовалось бы найти количество вещества одного из веществ и объём другого.
При составлении задачи используйте уравнение реакции:
$Zn + H_{2}SO_{4}= ZnSO_{4} + H_{2}$.Ответ:
Какой объём водорода (н. у.) и количество вещества соли образуется при взаимодействии 400 г 15% раствора серной кислоты с цинком?
Дано:
m (р−ра) = 400 г;
$ω (H_{2}SO_{4})$ = 15 %
_____________
$n(ZnSO_{4})$ − ?
$V(H_{2})$ − ?
Решение:
$Zn + H_{2}SO_{4}= ZnSO_{4} + H_{2}$.
$m (H_{2}SO_{4}) = m (р-ра) * ω (H_{2}SO_{4})= 400 * 0,15 = 60$ г;
$n = \frac{m}{M}$;
M ($H_{2}SO_{4}$) = 2 * Ar (H) + 1 * Ar (S) + 4 * Ar (O) = 2 * 1 + 1 * 32 + 4 * 16 = 98 г/моль;
$n (H_{2}SO_{4}) = \frac{m (H_{2}SO_{4})}{M (H_{2}SO_{4})} = \frac{60}{98} = 0,61$ моль.
Запишем уравнение реакции и составим пропорции:
$Zn + \underset{1 моль}{\overset{0,61 моль}{H_{2}SO_{4}}} = \underset{1 моль}{\overset{х}{ZnSO_{4}}} + \underset{1 моль}{\overset{y}{H_{2}}}$;
$x = n (ZnSO_{4}) = \frac{0,61 * 1 }{1} = 0,61$ моль;
$y = n (H_{2}) = \frac{0,61 * 1}{1} = 0,61 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 0,61 = 13,7 $ л.
Ответ. 0,61 моль; 13,7 л. §30
-
§30. Реакции разложения
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−13−tipy−himicheskih−reakcij.html
2. https://bookeditor.cc/taskeditor/books/130/editor?number=236
3. https://ru.wikipedia.org/wiki/Скоростьхимической_реакции2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Реакции разложения
Реакции разложения − химические реакции, в которых из одного, более сложного вещества образуются два или более других, более простых веществ.
Фактором, вызывающим разложение, могут являться различные физические и химические воздействия. Соответственно, выделяют различные виды реакций разложения:
− биодеградация (биологический распад, биоразложение) — разложение в результате деятельности живых организмов;
− сольволиз — реакция обменного разложения между растворенным веществом и растворителем:
− алкоголиз — растворителем выступает какой−либо спирт;
− гидролиз — растворителем выступает вода;
и т. д.
− радиолиз — разложение под действием ионизирующих излучений;
− термолиз — под действием повышенной температуры:
− пиролиз — термическое разложение органических соединений без доступа воздуха.
− электролиз — разложение под действием электрического тока.
и др.
Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.?. Вопросы и задания
1. Запишите уравнения реакций разложения, схемы которых:
а) $Fe(ОН)_{3} \overset{t}{→} Fe_{2}O_{3} + H_{2}О$;
б) $CaSO_{4} \overset{t}{→} СаO + SO_{2} + O_{2}$;
в) $HNO_{3} \overset{t}{→} H_{2}O + NO_{2} + O_{2}$;
г) $Сu(NO_{3})_{2} \overset{t}{→} CuO + NO_{2} + O_{2}$.Ответ:
а) $Fe(ОН)_{3} \overset{t}{→} Fe_{2}O_{3} + H_{2}О$;
$2Fe(ОН)_{3} \overset{t}{=} Fe_{2}O_{3} + 3H_{2}О$;
б) $CaSO_{4} \overset{t}{→} СаO + SO_{2} + O_{2}$;
$2CaSO_{4} \overset{t}{=} 2СаO + 2SO_{2} + O_{2}$;
в) $HNO_{3} \overset{t}{→} H_{2}O + NO_{2} + O_{2}$;
$4HNO_{3} \overset{t}{=} 2H_{2}O + 4NO_{2} + 2O_{2}$;
г) $Сu(NO_{3})_{2} \overset{t}{→} CuO + NO_{2} + O_{2}$;
$2Сu(NO_{3})_{2} \overset{t}{=} 2CuO + 4NO_{2} + O_{2}$.2. Какое количество вещества воды разложилось под действием постоянного электрического тока, если при этом образовался кислород объёмом 67,2 $м^{2}$ (н. у.)? Каков объём (н.у.) полученного при этом водорода?
Ответ:
Дано:
$V (O_{2}) = 67, 2 м^{3}$;
_____________
$n (H_{2}O)$ − ?
$V (H_{2})$ − ?
Решение:
$2H_{2}O = 2H_{2}↑+O_{2}↑$;
$n = \frac{V}{V_{m}}$;
$V (O_{2}) = 67,2 * 1 * 10^{3} = 67,2* 10^{3}$ л;
$V_{m}$= 22,4 л/моль;
$n (O_{2}) = \frac{V (O_{2})}{V_{m}} = \frac{67,2* 10^{3}}{22,4} = 3* 10^{3}$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{x}{2H_{2}O}} = \underset{2 моль}{\overset{y}{2H_{2}}} + \underset{1 моль}{\overset{3000}{O_{2}}}$;
$x = n (H_{2}O) = \frac{3000 * 2}{1} = 6 * 10^{3}$ моль;
$y = n (H_{2}) = \frac{3000 * 2}{1} = 6 * 10^{3}$ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 6 * 10^{3} = 134 * 10^{3}$ л или 134 $м^{3}$;
Ответ. $6 * 10^{3}$ моль; 134 $м^{3}$;3. Какие группы реакций вы знаете по признаку выделения или поглощения теплоты? Как можно назвать реакцию, протекающую с участием катализатора? А как − с участием фермента?
Ответ:
Экзотермические реакции протекают с выделением теплоты. Эндотермические реакции протекают с поглощением теплоты.
Реакцию, протекающую с участием катализатора, можно назвать каталитической.
Реакцию, протекающую с участием фермента, можно назвать ферментативной.4. Запишите уравнение реакции разложения нитрата серебра, если в результате неё образуются кислород, оксид азота (IV) и серебро.
Ответ:
$AgNO_{3} ⟶ Ag + NO_{2}↑ + O_{2}$↑;
$2AgNO_{3} = 2Ag + NO_{2}↑ + O_{2}$↑.5. Какая масса перманганата калия потребуется для получения кислорода объёмом 11,2 л (н.у.)?
Ответ:
Дано:
$V (O_{2})$ = 11,2 л;
_____________
$m (KMnO_{4})$ − ?
Решение:
$2KMnO_{4} \overset{t}{=} K_{2}MnO_{4}+MnO_{2}+O_{2}↑$;
$n=\frac{V}{V_{m}}$;
$V_{m}$= 22,4 л/моль;
$n (O_{2}) =\frac{V(O_{2})}{V_{m}} = \frac{11,2}{22,4} = 0,5$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{x}{2KMnO_{4}}} \overset{t}{=} K_{2}MnO_{4}+MnO_{2} + \underset{1 моль}{\overset{0,5}{O_{2}}}$;
$x = n (KMnO_{4}) = \frac{0,5 * 2}{1} = 1$ моль;
m = n * M;
M ($KMnO_{4}$) = 1 * Ar (K) + 1 * Ar (Mn) + 4 * Ar (O) = 1 * 39 + 1 * 55 + 4 * 16 = 158 г/моль;
$m (KMnO_{4}) = n (KMnO_{4}) * M (KMnO_{4}$) = 1 * 158 = 158 г.
Ответ. 158 г.6. Запишите формулы соответствующих кислот и оксидов, если известны формулы солей: $KMnO_{4}, K_{2}CrO_{4}$.
Ответ:
Соль Оксид Кислота
$\overset{+1}{К}\overset{+7}{Mn}O_{4}$ $Mn_{2}O_{7}$ $HMnO_{4}$
$\overset{+1}{K_{2}}\overset{+6}{CrO_{4}}$ $CrO_{3}$ $H_{2}CrO_{4}$ §31
-
§31. Реакции соединения
Лабораторный опыт №15
Прокаливание меди в пламени спиртовки.
Рассмотрите выданную вам медную проволоку(пластину) и опишите её внешний вид. Прокалите проволоку, удерживая её тигельными щипцами, в верхней части пламени спиртовки в течение 1 мин. Опишите условие проведения реакции. Опишите признак, подтверждающий, что произошла химическая реакция. Составьте уравнение проведённой реакции. Назовите исходные вещества и продукты реакции. Объясните, изменилась ли масса медной проволоки(пластины) после окончания проведения опыта. Ответ обоснуйте, используя знания о законе сохранения массы веществ.Ответ:
Красноватый цвет, металлический блеск.
Прокаливаем медную проволоку в верхней части пламени спиртовки в течение 1 мин. Поверхность проволоки чернеет.
$\underset{медь}{2Cu} + \underset{кислород}{O_{2}} \overset{t}{=} \underset{оксид\;меди\;(II)}{CuO}$
При нагревании медной проволоки протекает химическая реакция между медью и кислородом, при этом поверхность проволоки покрывается оксидом меди (II), который имеет черный цвет:
После окончания опыта масса увеличится, т. к. это реакция присоединения (кислород входит в состав оксида меди (II)).i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−13−tipy−himicheskih−reakcij.html
2. https://compendium.su/chemistry/universal/15.html
3. https://mplast.by/encyklopedia/obratimyie−i−neobratimyie−himicheskie−reaktsii/
4. https://examer.ru/egepohimii/teoriya/obratimyeineobratimyeximicheskie
5. https://prosto−o−slognom.ru/chimia/18chim_reak.html
6. https://studarium.ru/article/1602. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Реакции соединения − антонимы реакций разложения.
Реакция соединения − химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое. В такие реакции могут вступать как простые, так и сложные вещества.
К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе. Например, углерод горит на воздухе $С +О_{2}→СО_{2}$ (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла.
Если в реакции участвуют простые вещества, то такие реакции чаще всего являются окислительно−восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция соединения между сложными веществами относиться к ОВР нельзя.?. Вопросы и задания
1. Запишите уравнения реакций соединения, протекающих согласно схемам:
а) $Li → Li_{2}О → LiOH$;
б) $Ca → CaО → Ca(OH)_{2}$;
в) $N_{2} → NO → NО_{2} → HNO_{3}$;
г) $S → SO_{2} → SO_{3} → H_{2}SO_{4}$;
д) $P → P_{2}О_{3} →P_{2}О_{5} →H_{3}PO{4}$.Ответ:
а) $Li \overset{1}{→} Li_{2}О \overset{2}{→} LiOH$;
1)$4Li + O_{2} → 2 Li_{2}O$;
2)$Li_{2}O + H_{2}O = 2LiOH$.
б) $Ca \overset{1}{→} CaО \overset{2}{→} Ca(OH)_{2}$;
1)$2Ca + O_{2} →2 CaO$;
2)$СаO + H_{2}O → Ca(OH)_{2}$.
в) $N_{2} \overset{1}{→} NO \overset{2}{→} NО_{2} \overset{3}{→} HNO_{3}$;
1)$N_{2} + O_{2} →2NO$;
2)$2NO + O_{2} → 2NO_{2}$;
3) $4NO_{2} + 2H_{2}O + O_{2} → 4HNO_{3}$.
г) $S \overset{1}{→} SO_{2} \overset{2}{→} SO_{3} \overset{3}{→} H_{2}SO_{4}$;
1)$S + O_{2} → SO_{2}$;
2)$2SO_{2} + O_{2} → 2SO_{3}$;
3) $SO_{3} + H_{2}O → H_{2}SO_{4}$.
д) $P \overset{1}{→} P_{2}О_{3} \overset{2}{→} P_{2}О_{5} \overset{3}{→}H_{3}PO_{4}$;
1)$4P + 3O_{2} → 2P_{2}O_{3}$;
2)$P_{2}O_{3} + O_{2} → P_{2}O_{5}$;
3) $P_{2}O_{5} + 3H_{2}O → 2H_{3}PO_{4}$.2. Запишите уравнения реакций, схемы которых:
а) $Li + O_{2} \overset{t}{→}$ ...?;
б) $Al + O_{2} \overset{t}{→}$ ...?;
в) $Fe + Cl_{2} \overset{t}{→} FeCl_{3}$;
г) $Fe + H_{2}O + O_{2} → Fe(OH)_{3}$.Ответ:
а) $Li + O_{2} \overset{t}{→}$ ...?;
$4Li + O_{2} \overset{t}{=} 2Li_{2}O$.
б) $Al + O_{2} \overset{t}{→}$ ...?;
$4Al + 3O_{2} \overset{t}{=} 2Li_{2}O_{3}$.
в) $Fe + Cl_{2} \overset{t}{→} FeCl_{3}$;
$2Fe + 3Cl_{2} \overset{t}{=} 2FeCl_{3}$.
г) $Fe + H_{2}O + O_{2} → Fe(OH)_{3}$;
$4Fe + 6H_{2}O + 3O_{2} = 4Fe(OH)_{3}$.3. Не производя вычислений, укажите, в каком из оксидов серы − (IV) или (VI) − содержание кислорода больше. Найдите массовую долю кислорода в каждом из указанных оксидов.
Ответ:
$SO_{2}$ – оксид серы (IV), в молекуле 2 атома кислорода.
$SO_{3}$ – оксид серы (VI), в молекуле 3 атома кислорода.
Из формул оксидов видно, что содержание кислорода больше в оксиде серы (VI) ($SO_{3}$).
Дано:
$SO_{2}$;
$SO_{3}$;
_____________
ω (O) − ?
Решение:
$ ω_{1}(O) = \frac{Ar (O)*2}{Mr(SO_{2})}$;
$Mr (SO_{2})$ = 1 * Ar (S) + 2 * (O) = 1 * 32 + 2 *16 = 64 г/моль;
$ ω_{1}(O) = \frac{16*2}{64} = 0,5$ или 50%;
$ ω_{2}(O) = \frac{Ar (O)*3}{Mr(SO_{3})}$;
$Mr (SO_{3})$ = 1 * Ar (S) + 2 * (O) = 1 * 32 + 3 *16 = 80 г/моль;
$ ω_{2}(O) = \frac{16*3}{80} = 0,6$ или 60%.
Ответ: содержание кислорода больше в оксиде серы (VI) ($SO_{3}$).4. Для проведения каких реакций − соединения или разложения − необходима постоянная подача теплоты для их протекания, а для каких − только первоначальная подача теплоты?
Ответ:
Большинство реакций соединения − экзотермические, в результате их протекания выделяется теплота. Поэтому для их проведения необходима только первоначальная подача тепла.
Реакции разложения в большинстве своём эндометрмические, они постоянно поглощают теплоту, необходимую для разрыва химический связей, поэтому необходим постоянный подвод тепла.5. Проделайте дома следующий опыт.
Вылейте в стакан 1/3 аптечного пузырька 3%−й перекиси водорода. Положите в стакан четверть чайной ложки свеженатёртой моркови или картофеля, аккуратно взболтайте смесь. Что наблюдаете? Опустите в стакан (не касаясь жидкости) зажжённую лучинку. Что наблюдаете? Попробуйте дать объяснение наблюдаемому явлению.Ответ:
После добавления в 3%−ную перекись водорода свеженатёртых моркови или картофеля наблюдается образование пузырьков газа, реакция протекает бурно, так как свеженатёртые овощи содержат фермент каталазу, который ускоряет разложение перекиси водорода на на воду и кислород.
$2H_{2}O (кат. каталоза) → 2H_{2}O + O_{2}↑$
Если пустить в стакан зажженную лучинку, то наблюдается усиление горения. Объясняются это тем, что перекись водорода разлагается с выделением кислорода, который усиливает горение лучины.6. Приведите примеры действия ферментов, с которыми вы знакомились на уроках анатомии человека.
Ответ:
Ферменты присутствуют во всех узлах пищеварительной системы:
− в слюне: амилаза − расщепляет крахмал до олигосахаридов;
− в слизистой оболочке желудка: пепсин – расщепляет белки до пептидов;
− в тонкой кишке: пептидаз, липаза − расщепляет триглицериды на глицерин и жирные кислоты, эрепсин − расщепляет белки.7. Сухой хлор хранят в железных баллонах. Влажный хлор разрушает железо. Какую роль играет вода в последнем процессе?
Ответ:
Железо покрывает тонкая пленка из окислов железа, которая мешает хлору вступать в реакцию с чистым железом.
Хлор взаимодействует с водой, образуя кислоты
$Cl_{2}+ H_{2}O → \underset{соляная\;кислота}{HCl} + \underset{хлорноватистая\; кислота}{HClO}$,
которые взаимодействуют с оксидами железа
$FeO + 2HCl ⟶ FeCl_{2} + H_{2}O$;
$2Fe_{2}O_{3} + 6HClO ⟶ 2Fe(ClO)_{3} + 3H_{2}O$,
в результате этих процессов "оголяется" чистое железо, которое вступает в реакцию с кислотами и чистым хлором:
$Fe + 2HClO ⟶ Fe(ClO)_{2} + H_{2}$↑
$Fe + 2HCl ⟶ FeCl_{2}+ H_{2}↑ $
$2Fe + 3Cl_{2} ⟶ 2FeCl_{3}$.
Вода, в данных химических процессах, постепенно расходуется, поэтому она не выполнят роль катализатора, а выполнят роль "спускового крючка", без которого процесс разрушения железа был бы невозможен.
(Катализатор − химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции).8. Дайте характеристику реакций, приведённых в параграфе, по плану:
а) характер и число реагентов и продуктов;
б) направление;
в) наличие катализатора;
г) выделение или поглощение теплоты.Ответ:
$4P + 5O_{2} = 2P_{2}O_{5}$
а) реакция соединения. Из двух простых веществ образуется одно сложное;
б) необратимая;
в) некаталитическая;
г) экзотермическая.
$P_{2}O_{5}+3H_{2}O=2H_{3}PO_{4}$
а) реакция соединения. Из двух сложных веществ образуется одно сложное;
б) необратимая;
в) некаталитическая;
г) экзотермическая.
$2SO_{2}+O_{2}\overset{t, кат}{⇄ } 2SO_{3}$
а) реакция соединения. Из одного сложного и одного простого веществ образуется одно сложное;
б) обратимая;
в) каталитическая;
г) экзотермическая.
$4NO_{2}+2H_{2}O+O_{2} = 4HNO_{3}$
а) реакция соединения. Из двух сложных и одного простого веществ образуется одно сложное;
б) необратимая;
в) некаталитическая;
г) экзотермическая. §32
-
§32. Реакции замещения
Лабораторный опыт №16
Замещение меди в растворе сульфата меди (II) железом.
Налейте в две пробирки по 2 мл раствора сульфата меди (II). Опишите цвет раствора. Осторожно погрузите в одну из пробирок железный гвоздь (скрепку), привязанный на нитке. Опишите условие проведения реакции. Через 5 мин извлеките гвоздь из раствора и опишите произошедшие с ним изменения. Образованием какого вещества они вызваны? Опишите цвет образовавшегося раствора и сравните его с цветом исходного раствора. На пишите уравнение реакции сульфата меди (II) с железом, учитывая, что в продукте реакции степень окисления железа равна +2.Ответ:
Раствор сульфата меди (II) имеет голубой цвет. После погружения железного гвоздя в раствор сульфата меди (II) начинает протекать реакция замещения меди из её соли железом, т. к. железо более активный металл, чем медь.
Та часть гвоздя, которая находится в растворе, покрылась красным налётом выделившейся меди.
После протекания реакции цвет раствора изменится на светло−зеленый.
$Fe + CuSO_{4} ⟶ FeSO_{4} + Cu$↓i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Электрохимическийрядактивностиметаллов
2. https://www.yaklass.ru/p/himija/89−klass/klassifikatciia−khimicheskikh−reaktcii−i−zakonomernosti−ikh−protekaniia−212242/klassifikatciia−khimicheskikh−reaktcii−po−chislu−i−sostavu−vstupivshikh−−212243/re−c8ce7f2c−24cd−4728−a9d0−c4f2cc943787
3. http://ru.solverbook.com/spravochnik/ximiya/11−klass/klassifikaciya−ximicheskix−reakcij/2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Ряд активности металлов
Во многих химических реакциях принимают участие простые вещества, в частности металлы. Металлы могут взаимодействовать почти со всеми классами неорганических соединений.
Однако разные металлы проявляют разную активность в химических взаимодействиях, и от этого зависит, произойдет реакция или нет.
Чем больше активность металла, тем энергичнее он взаимодействует с другими веществами. По активности все металлы можно расположить в ряд, который называется рядом активности металлов. Этот ряд впервые составил и изучил выдающийся украинский ученый Η. Н. Бекетов, поэтому у данного ряда есть еще одно название — ряд Бекетова.
Li > K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > $H_{2}$ > Cu > Ag > Hg > Au
В этом ряду металлы расположены по уменьшению их химической активности в водных растворах. Таким образом, среди приведенных металлов наиболее активным является калий, а наименее активным — золото. С помощью этого ряда легко выяснить, какой металл активнее другого. Также в этом ряду находится водород. Конечно, водород не является металлом, но в данном ряду его активность принята за точку отсчета (своего рода ноль)?. Вопросы и задания
1. Какие реакции называют реакциями замещения? Сравните их с реакциями соединения и разложения.
Ответ:
Реакциями замещения называются реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
В реакциях замещения, в отличие от реакций соединения и разложения, число веществ, вступающих в реакцию, равно числу образовавшихся веществ.
В случае реакций разложения из одного сложного вещества образуется два и более простых и/или сложных веществ.
При протекании реакций соединения из двух или более простых и/или сложных веществ образуется одно сложное.2. Запишите уравнения следующих реакций замещения:
а) оксид железа (III) + алюминий $ \overset{t}{→} $
б) оксид железа (III) + водород $ \overset{t}{→} $
в) хлорид меди (II) (р−р) + алюминий ⟶
г) оксид свинца (IV) + углерод $\overset{t}{→} $
д) бромид железа (III) (р−р) + хлор ⟶Ответ:
а) $Fe_{2}O_{3} + Al \overset{t}{→} Al_{2}O_{3} + Fe$;
$Fe_{2}O_{3} + Al \overset{t}{=} 2Al_{2}O_{3} + 2Fe$.
б) $Fe_{2}O_{3} + H_{2} \overset{t}{→} Fe + H_{2}O$;
$Fe_{2}O_{3} + 3H_{2} \overset{t}{=} 2Fe + 3H_{2}O$.
в) $CuCl_{2} + Al → AlCl_{3} + Cu$;
$3CuCl_{2} + 2Al = 2AlCl_{3} + 3Cu$.
г) $PbO_{2} + C \overset{t}{→} CO_{2} + Pb$;
$PbO_{2} + C \overset{t}{=} CO_{2} + Pb$.
д) $FeBr_{3} + Cl_{2} → FeCl_{3} + Br_{2}$;
$2FeBr_{3} + 3Cl_{2} = 2FeCl_{3} + 3Br_{2}$.3. Рассчитайте объём водорода (н. у.), который образуется при взаимодействии 1,5 моль алюминия с соляной кислотой. Какое количество вещества хлороводорода потребуется для этой реакции?
Ответ:
Дано:
n (Al) = 1,5 моль;
_____________
V ($H_{2}$) − ?;
n (HCl) − ?
Решение:
$2Al + 6HCl = AlCl_{3} + 3H_{2}$↑;
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{1,5 моль}{2Al}} + \underset{6 моль}{\overset{x моль}{6HCl }} = AlCl_{3} + \underset{3 моль}{\overset{y}{3H_{2}}}$;
$x = n (HCl) = \frac{1,5 * 6}{2} = 4,5 $ моль;
$y = n (H_{2}) = \frac{1,5 * 3}{2} = 2,25 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2})$ = 22,4 * 2,24 = 50,4 л.
Ответ. 4,5 моль; 50,4 л;4. Определите объём водорода (н. у.), который потребуется для замещения всей меди из 640 мг образца оксида меди (II), содержащего 25% примесей.
Ответ:
Дано:
m (смеси) = 640 мг;
ω (примеси) = 25%;
_____________
$V (H_{2})$ −?
Решение:
$CuO+H_{2} = Cu + H_{2}O$;
$ω_{чист} (СuO) = 100 - 25 = 75$ % или 0,75;
m (смеси) = 640 мг * 0,001 = 0,64 г;
$m_{чист} (СuO) = m (смеси) *ω _{чист} (СuO) = 0,64 * 0,75 = 0,48$ г;
$n = \frac{m}{M}$;
M (СuO) = 1 * Ar (Cu) + 1 * Ar (O) = 1 * 64 + 1 * 16 = 80 г/моль;
$n (СuO) = \frac{m_{чист} (СuO) }{M (СuO)} = \frac{0,48}{80} = 0,006$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{0,006 моль}{CuO}} + \underset{1 моль}{\overset{х}{H_{2}}} = Cu + H_{2}O$;
$x = n (H_{2}) = \frac{0,006 * 1}{1} = 0,006$ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 0,006 = 0,13$ л.
Ответ. 0,13 л.5. Найдите количество вещества серебра, которое выделится на медной пластинке, помещённой в 169 г 2,5%−го раствора нитрата серебра, если исходить из предположения, что вся соль вступит в реакцию.
Ответ:
Дано:
m (р−ра) = 169 г;
ω ($AgNO_{3}$) = 2,5%;
_____________
n (Ag) − ?
Решение:
$2AgNO_{3}+Cu = Cu(NO_{3})_{2} + 2Ag$;
$ω (AgNO_{3}) = \frac{2,5}{100} = 0,025$;
m (вещ−во) = m (р−ра) * ω;
$m (AgNO_{3}) = 169 * 0,025 = 4,225$ г.
$n = \frac{m}{M}$;
M ($AgNO_{3}$) = 1 * Ar (Ag) + 1 * Ar (N) + 3 * Ar (O) = 1 * 108 + 1 * 14 + 3 * 16 = 170 г/моль;
$n (AgNO_{3}) = \frac{m (AgNO_{3})}{M (AgNO_{3})} = \frac{4,225}{170} = 0,025$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{0,025 моль}{2AgNO_{3}}} +Cu = Cu(NO_{3})_{2} + \underset{2 моль}{\overset{х}{2Ag}}$;
$x = n (Ag) = \frac{0,025 * 2}{2} = 0,025$ моль.
Ответ. 0,025 моль. §33
-
§33. Реакции обмена
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ru.wikipedia.org/wiki/Реакция_обмена
2. https://interneturok.ru/lesson/chemistry/8−klass/bklassy−neorganicheskih−vewestv−b/reaktsiya−neytralizatsii
3. https://ru.wikipedia.org/wiki/Нейтрализация
4. https://nauka.club/khimiya/reaktsiya−neytralizatsii.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Реакции нейтрализации
Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода. Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль.
В большинстве своем, реакции нейтрализации экзотермичны. Тем не менее, существуют также и эндотермические реакции нейтрализации.
Процесс химической нейтрализации может происходить между веществами с разной активностью: сильной кислотой и таким же основанием или между слабой кислотой и сильной щёлочью. В химии выделяют 2 типа реакции:
− необратимые — получившиеся вещества не распадаются, то есть реакция протекает в 1 сторону. Обычно так протекает реакция сильной кислоты и сильного основания.
− обратимые — протекают в обе стороны. То есть соль может распадаться и снова получается кислота и основание. Встречаются, если слабый компонент встречается с сильным.
Применение на практике.
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
1.. В диагностике заболеваний пищеварительной системы титрование применяют для определения количества соляной кислоты в желудочном соке.
2. В фармакологии и аналитической химии титрование применяют для определения количества органических и неорганических кислот в составе вещества. Кроме того, метод позволяет определить, проходят ли лекарственные средства через клеточные мембраны и с какой скоростью.
3. Метод нейтрализации используется в пищевой и химической промышленности. С его помощью определяют количество кислоты или щёлочи в том или ином веществе, продукте или жидкости.
Нередко эта химическая реакция используется в быту.?. Вопросы и задания
1. Какие реакции называют реакциями обмена? Чем они отличаются от реакций соединения, разложения и замещения?
Ответ:
Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями.
Они отличаются от других реакций тем, что в данном типе реакции два сложных вещества обмениваются своими частями, то есть из сложных веществ образуются сложные вещества.
В случае реакций разложения из одного сложного вещества образуется два и более простых и/или сложных веществ.
При протекании реакций соединения из двух или более простых и/или сложных веществ образуется одно сложное.
В реакциях замещения − из одного простого и одного сложного образуется одно сложное и одно простое.2. Можно ли утверждать, что взаимодействие раствора карбоната какого−либо металла и кислоты является только реакцией обмена? Почему?
Ответ:
$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}CO3$
Из реакции видно, что два сложных вещества обмениваются своими составными частями, поэтому это реакция обмена.
Однако, в результате реакции образуется угольная кислота, которая быстро разлагается на углекислый газ и воду.
$ H_{2}CO3 = H_{2}O + CO_{2}$↑.
Таким образом, любая реакция между карбонатом какого−либо металла и кислотой включает и реакцию обмена, и реакцию разложения.3. Запишите уравнения реакций обмена между растворами:
а) хлорида кальция и фосфата калия;
б) серной кислоты и гидроксида железа (III).Ответ:
а) $3CaCl_{2} + 2K_{3}PO_{4} = Ca_{3}(PO_{4})_{2}↓ + 6KCl$
б) $3H_{2}SO_{4} + 2Fe(OH)_{3} = Fe_{2}(SO_{4})_{3}↓ + 6H_{2}O$4. Какие из реакций обмена, схемы которых:
а) $BaCl_{2} + AgNO_{3}$ ⟶
б) $Cu(NO_{3})_{2} + NaCl $⟶
в) $Pb(NO_{3})_{2} + K_{2}S$ ⟶
г) $MgCl_{2} + K_{2}SO_{4}$ ⟶
д) $HNO_{3} + ZnSO_{4}$ ⟶
е) $Ca(NO_{3})_{2} + H_{3}PO_{4} $⟶
ж) $Ba(NO_{3})_{2} + Na_{2}SO_{4} $⟶
будут протекать до конца?
Для ответа воспользуйтесь таблицей растворимости гидроксидов и солей в воде.Ответ:
а) $BaCl_{2} + 2AgNO_{3} ⟶ Ba(NO_{3})_{2} + 2AgCl↓$ ;
б) $Cu(NO_{3})_{2} + 2NaCl ⇄ CuCl_{2} + 2NaNO_{3}$ ;
в) $Pb(NO_{3})_{2} + K_{2}S ⟶ 2KNO_{3} + PbS↓ $ ;
г) $MgCl_{2} + K_{2}SO_{4} ⇄ MgSO_{4} + 2KCl$ ;
д) $2HNO_{3} + ZnSO_{4} ⇄ H_{2}SO_{4} + Zn(NO_{3})_{2}$ ;
е) $3Ca(NO_{3})_{2} + 2H_{3}PO_{4} ⟶ 6HNO_{3} + Ca_{3}(PO_{4})_{2}↓ $ ;
ж) $Ba(NO_{3})_{2} + Na_{2}SO_{4} ⟶ 2NaNO_{3} + BaSO_{4}↓$.
До конца будут протекать только те реакции, в результате которых образуется осадок. В остальных реакциях все соли/реагенты растворимы, реакции обратимые.5. Определите количество вещества гидроксида натрия, которое потребуется для полной нейтрализации 980 г 20%−го раствора серной кислоты.
Ответ:
Дано:
m (р−ра) = 980 г;
ω ($H_{3}PO_{4}$) = 30%;
_____________
n (NaOH) − ?
Решение:
$H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$;
$ω (H_{3}PO_{4}) = \frac {30}{100}$ = 0,3;
m (вещ−во) = m (р−ра) * ω;
m ($H_{3}PO_{4}$) = m (р−ра) * ω ($H_{3}PO_{4}$) = 980 * 0,3 = 294 г;
$n = \frac{m}{M}$;
M ($H_{3}PO_{4}$) = 3 * Ar (H) + 1 * Ar (P) + 4 * Ar (O) = 3 * 1 + 1 * 31 + 4 * 16 = 98 г/моль;
$n (H_{3}PO_{4}) = \frac{m (H_{3}PO_{4})}{M (H_{3}PO_{4})} = \frac {294}{98}$ = 3 моль.
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{3 моль}{H_{3}PO_{4}}} + \underset{3 моль}{\overset{x моль}{3NaOH}} = Na_{3}PO_{4} + 3H_{2}O$;
$x = n (NaOH) = \frac{3 * 3}{1} = 9$ моль.
Ответ. 9 моль.6. Вычислите количество вещества и массу осадка, выпавшего при взаимодействии 20%−го раствора сульфата меди (II) массой 980 г с необходимым количеством гидроксида калия.
Ответ:
Дано:
m (р−ра) = 980 г;
ω($CuSO_{4}$) = 20%;
_____________
n ($Cu(OH)_{2}$) − ?
m ($Cu(OH)_{2}$) − ?
Решение:
$CuSO_{4} + 2KOH = K_{2}SO_{4} + Cu(OH)_{2}↓$;
$ω (CuSO_{4}) = \frac {20}{100}$ = 0,2;
m (вещ−во) = m (р−ра) * ω;
$m (CuSO_{4}) = m (р-ра) * ω (CuSO_{4}) = 980 * 0,2 = 196$ г;
$n = \frac{m}{M}$;
M ($CuSO_{4}$) = 1 * Ar (Cu) + 1 * Ar (S) + 4 * Ar (O) = 1 * 64 + 1 * 32 + 4 * 16 = 160 г/моль;
$n (CuSO_{4}) = \frac{m (CuSO_{4})}{M (CuSO_{4})} = \frac {196}{160}$ = 1,225 моль.
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{1,225 моль}{CuSO_{4}}} + 2KOH = K_{2}SO_{4} +\underset{1 моль}{\overset{x моль}{Cu(OH)_{2}}}$;
$x = n (Cu(OH)_{2}) = \frac{1,225 * 1}{1} = 1,225$ моль;
m = n * M;
M (($Cu(OH)_{2}$)) = 1 * Ar (Cu) + 2 * Ar (O) + 2 * Ar (H) = 1 * 64 + 2 * 16 + 2 * 1 = 98 г/моль;
$m (Cu(OH)_{2}) = n (Cu(OH)_{2}) * M (Cu(OH)_{2}) = 1,225 * 98 = 120$ г.
Ответ. 1,225 моль; 120 г. §34
-
§34. Типы химических реакций на примере свойств воды
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://www.yaklass.ru/p/himija/89−klass/klassifikatciia−khimicheskikh−reaktcii−i−zakonomernosti−ikh−protekaniia−212242/klassifikatciia−khimicheskikh−reaktcii−po−chislu−i−sostavu−vstupivshikh−_−212243/re−160925e1−56b7−452d−8614−0fd958e743cd
2. https://videouroki.net/video/32−tipy−khimichieskikh−rieaktsii−na−primierie−svoistv−vody.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Электролиз
Для воды характерна реакция разложения – электролиз воды. Он протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.
Электролиз − это процесс, в котором постоянный электрический ток, пропускаемый через ионизированный раствор или расплав вещества (электролит), используется для инициирования химической реакции на электродах (положительно заряженном аноде+ и отрицательном катоде−), приводящей к диссоциации вещества на положительные ионы−катионы на стороне катода и отрицательные ионы−анионы на стороне анода. При электролизе воды, при прохождении через нее постоянного электрического тока, на стороне анода происходит диссоциация воды с образованием молекул кислорода $O_{2}$ и выделением положительно заряженных ионов водорода $H^{+}$ и имеющих отрицательный заряд электронов $e^{-}$. На катоде−, ионы водорода $H^{+}$ принимают электроны, образуя газообразный водород $H_{2}$.
$2Н_{2}О\overset {эл. ток}{→} 2Н_{2}↑+ О_{2}$↑.
Вышеописанный электролиз чистой воды без чрезмерных затрат энергии проходит очень медленно или не проходит совсем. Для того, чтобы эффективно проводить электролиз воды, в нее добавляют электролит − или растворимый в воде, или твердый − увеличивающий электрическую проводимость воды.
При выборе электролита необходимо, чтобы между катионами (положительно заряженными ионами) электролита и катионами, которые может отдать вода, то есть $H^{+}$, не было конкуренции − иначе, не будет произведен водород. Для этого, катион электролита должен иметь меньший электродный потенциал, чем катион $H^{+}$; на роль катиона подходят Li, Rb, K, Cs, Ba, Sr, Ca, Na и Mg.
Также, в роли электролита можно рассматривать и кислоты, т.к. при их диссоциации образуется ион $H^{+}$ , как и при диссоциации воды − и конкуренции между ними нет.
В качестве электролита для электролиза воды используются сильные щелочи: гидроксид калия KOH и едкий натр NaOH. Иногда, используется сильная кислота, как правило, серная кислота $H_{2}SO_{4}$.
Кроме растворов электролитов, для электролизного производства воды могут использоваться и твердые электролиты.?. Вопросы и задания
1. Закончите уравнения реакций, схемы которых:
а)$ H_{2}O + SO_{2}$ ⟶
б) $K_{2}O + H_{2}O$ ⟶
в) $Ba + H_{2}O$ ⟶
г) $K + H_{2}O$ ⟶
д) $CaH_{2}+Н_{2}O$ ⟶
е) $Al_{4}C_{3}+ H_{2}O$ ⟶
Укажите типы реакций по признаку "число и состав исходных веществ и продуктов реакции".
Назовите продукты реакций.Ответ:
а) $ \underset{оксид\;водорода}{H_{2}O} + \underset{оксид\;серы\;IV}{SO_{2}} = \underset{сернистая\;кислота}{H_{2}SO_{3}}$ − реакция соединения
б) $\underset {оксид\;калия}{K_{2}O} + \underset{оксид\;водорода}{H_{2}O} = \underset {гидроксид\;калия}{2 KOH}$ − реакция соединения
в) $\underset {барий}{Ba} + \underset{оксид\;водорода}{2H_{2}O} = \underset {гидроксид\;бария}{BA(OH)_{2}} + \underset {водород}{H_{2}}↑$ − реакция замещения
г) $\underset {калия}{2K} + \underset{оксид\;водорода}{2H_{2}O} = \underset {гидроксид\;калия}{2 KOH} + \underset {водород}{H_{2}}↑$ − реакция замещения
д) $\underset {гидрид\;кальция}{CaH_{2}} + \underset{оксид\;водорода}{2Н_{2}O} = \underset {гидроксид\;кальция}{Ca(OH)_{2}} + \underset {водород}{2H_{2}↑}$ − реакция обмена
е) $\underset {карбид\;алюминия}{Al_{4}C_{3}} + \underset{оксид\;водорода}{12H_{2}O} = \underset{гидроксид\;алюминия}{4Al (OH)_{3}} + \underset{метан}{3CH_{4}}$ − реакция обмена2. Какой объём ацетилена (н.у.) образуется в результате гидролиза 320 мг карбида кальция, содержащего 2% примесей?
Ответ:
Дано:
m (смеси) = 320 мг;
ω (примеси) = 2 %;
_____________
V ($C_{2}H_{2}$) − ?
Решение:
$CaC_{2}+2H_{2}O = Ca(OH)_{2}+C_{2}H_{2}↑$;
$ω _{чист}(СаС_{2}) = 100 - ω (примеси) = 100 - 2 = 98$% или 0,98;
m (вещ−во) = m (р−ра) * ω;
m (смеси) = 320 * 0,001 = 0,32 г
$m (СаС_{2}) = m (смеси) * ω _{чист}(СаС_{2}) = 0,32 * 0,98 = 0,314$ г;
$n = \frac{m}{M}$;
M ($СаС_{2}$) = 1 * Ar (Ca) + 2 * Ar (C) = 40 + 2 * 12 = 64 г/моль;
$n (СаС_{2}) = \frac {m (СаС_{2})}{M (СаС_{2})} = \frac {0,314} {64} = 0,005$ моль
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{0,005 моль}{CaC_{2}}} +2H_{2}O = Ca(OH)_{2} + \underset{1 моль}{\overset{x}{C_{2}H_{2}}}$;
$x = n (C_{2}H_{2}) = \frac{0,005 * 1}{1} = 0,005 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (C_{2}H_{2}) = V_{m} * n (C_{2}H_{2})$ = 22,4 * 0,005 = 0,112 л = 112 мл.
Ответ. 112 мл.3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1 2 3
Li → Li2O → LiOH → Li2SO4
|____4_______↑
Укажите типы реакций по признаку числа и состава исходных веществ и продуктов реакции.Ответ:
1) $4Li + O_{2} = 2Li_{2}O$ − реакция соединения;
3) $Li_{2}O + H_{2}O = 2LiOH$ − реакция соединения;
4) $2LiOH + H_{2}SO_{4} = Li_{2}SO_{4} + 2H_{2}O$ − реакция обмена;
5) $2Li + 2H_{2}O = 2LiOH + H2↑$ − реакция замещения.4. Вычислите объём (н.у.) водорода, который образуется при взаимодействии 9,2 г натрия, содержащего 2,5% примесей, с водой. Вычислите количество вещества щёлочи, которое получится при этом.
Ответ:
Дано:
m (смеси) = 9,2 г;
ω (примеси) = 2,5 %;
_____________
$V (H_{2})$ − ?
n (NaOH) − ?
Решение:
$2Na + 2H_{2}O =2 NaOH + H_{2}↑$
$ω_{чист} (Na) = 100 - 2,5 = 97,5$ % или 0,975;
$m_{чист} (Na) = m (cмеси) * ω_{чист} (Na) = 9,2 * 0,975 = 8,97$ г;
$n = \frac{m}{M}$;
M (Na) = 23 г/моль;
$n (Al) = \frac{$m_{чист} (Na)}{M (Na)} = \frac{8,97}{23} = 0,39$ моль.
Запишем уравнение реакции и составим пропорции:
$\underset{2 моль}{\overset{0,39 моль}{2Na}} + 2H_{2}O = \underset{2 моль}{\overset{x}{2 NaOH}} + \underset{1 моль}{\overset{y}{H_{2}}}$;
$x = n (NaOH) = \frac{0,39 * 2}{2} = 0,39$ моль;
$y = n (H_{2}) = \frac{0,39 * 1}{2} = 0,195 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 0,195 = 4,37 $ л.
Ответ. 0,39 моль; 4,37 л.5. Найдите массу глюкозы и объём кислорода (н. у.), образующихся в процессе фотосинтеза, если в реакцию вступило 448 $м^{3}$ углекислого газа (н.у.). Вычислите количество вещества воды, которое для этого потребовалось.
Ответ:
Дано:
$V (CO_{2})$ = 448 $м^{3}$
_____________
$m (C_{6}H_{12}O_{6})$ − ?
$V (O_{2})$ − ?
$n (H_{2}O)$ − ?
Решение:
$6CO_{2}+6H_{2}O = C_{6}H_{12}O_{6} + 6O_{2}$;
$n=\frac{V}{V_{m}}$;
$V (CO_{2})$ = 448 * 1000 = 448 000 л;
$V_{m}$= 22,4 л/моль;
$n=\frac{V (CO_{2})}{V_{m}} = \frac {448000}{22,4} = 20 000$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{6 моль}{\overset{20000 моль}{6CO_{2}}} + \underset{6 моль}{\overset{x}{6H_{2}O}} = \underset{1 моль}{\overset{y}{C_{6}H_{12}O_{6}}} + \underset{6 моль}{\overset{z}{6O_{2}}}$;
$x = n (H_{2}O) = \frac{20000 * 6}{6} = 20000 $ моль;
$y = n (C_{6}H_{12}O_{6}) = \frac{20000 * 1}{6} = 3333 $ моль;
$z = n (O_{2}) = \frac{20000 * 6}{6} = 20000 $ моль;
m = n * M;
M ($C_{6}H_{12}O_{6}$) = 6 * Ar (С) + 12 * Ar (H) + 6 * Ar (O) = 6 * 12 + 12 * 1 + 6 * 16 = 180 г/моль;
$m (C_{6}H_{12}O_{6}) = n (C_{6}H_{12}O_{6}) * M (C_{6}H_{12}O_{6}) = 3333 * 180 = 599 940$ г или 599 кг.
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (O_{2}) = V_{m} * n (O_{2})$ = 22,4 * 20000 = 448000 л или 448 $м^{3}$
Ответ. 599 кг; 448 $м^{3}$; 20000 моль.Темы для дискуссии
1. Предложите свой простой и доступный способ очистки водопроводной воды на основе физических свойств.
Ответ:
Вода в быту используется постоянно, но не всегда безопасно то, что течет из−под крана, поэтому чтобы избавить воду от вредных примесей существуют определенные способы очистки воды в быту, например, кипячение, отстаивание, вымораживание и фильтрация с применением различных современных технологий.
Кипячение.
Самый доступный и распространенный способ водоочистки в быту − это, конечно, кипячение. Ее необходимо кипятить не менее 15 минут, затем дать время отстоятся и остыть перед употреблением. Вследствие длительного кипячения в воде погибают многие бактерии и микроорганизмы, но все же существуют и такие, которые выдерживают и длительное кипячение. Такой способ очистки делает воду мягче, потому что соли жесткости переходят в нерастворимое состояние и оседают на стенках чайника, улетучивается хлор и другие растворенные газы, но долго хранить такую воду невозможно, потому что в ней быстро начинают размножаться бактерии.
Фильтрование
Фильтрование – это, по сути, осветление воды, в процессе которого из нее удаляются посторонние примеси. Удаление происходит с помощью фильтров водоочистки.
Отстаивание
Очистить воду в быту способом отстаивания тоже довольно проблематично, потому что отстаивать воду следует не меньше 7 часов. Использовать можно только верхние слои отстоянной воды, а в оставшейся содержатся вредные вещества, хлор и другие примеси. Помимо всего такая вода обязательно нуждается в дополнительной обработке, например, кипячении или вымораживании.
Вымораживание
Еще одним способом очистки воды в быту является вымораживание и считается, что чистая вода без примесей замерзает первой, именно ее и следует употреблять людям. Та жидкость, которая не замерзает, содержит примеси и ее необходимо выливать. Вымораживание неплохой способ очистки, смягчения, но достаточно трудоемкий и дорогостоящий процесс.2. Докажите, что используемый вашей семьёй бытовой фильтр для очистки воды наиболее оптимален.
Ответ:
Рассмотрим принцип действия кувшинного фильтра.
Вода поступает в верхнюю чашу, затем под тяжестью собственного веса проходит через специальный картридж в нижнюю чашу. Производительность кувшина от одного до полутора литров в минуту при pecypce (зависит от модели) 150−400 литров. Достоинство кувшина состоит в том, что он не требует подключения к водопроводу. Опять же, картридж можно менять, что добавляет кувшину универсальности, так как используя разные картриджи, можно убирать различные загрязнения. Например, чтобы смягчить воду и удалить железо, ставится специальная кассета. Кроме того, кувшин легко мыть, а менять кассеты в нём достаточно просто.
К недостаткам этих фильтров можно отнести то, что они ограничены в объеме, то есть за раз можно получить только полтора, два с половиной литра чистой воды. Кроме того, нужно ждать от 4 до 20 минут.
Еще один недостаток: фильтр нужно использовать ежедневно. Интервал простоя не должен превышать 8 часов, т.к. запускается механизм размножения бактерий в кассете, где существует питательная среда для размножения микроорганизмов.
Следует строго следить за своевременной заменой кассет, делая поправку на качество воды, иначе фильтр будет отдавать больше вредных примесей и бактерий, чем поглощать.3. Предложите четыре пары химических антонимов для классификации реакций.
Ответ:
1. По признаку обратимости:
− обратимые (реакции, которые в данных условиях протекает одновременно в двух взаимно противоположных направлениях):
$ЗН_{2} + N_{2} ⇄ 2NH_{3}$
− необратимые (реакции, которые в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции):
$СН_{4} + 2O_{2} → СO_{2}↑ + 2Н_{2}O$
2. По тепловому эффекту:
− экзотерические (реакции, проходящая с выделением теплоты):
$СН_{4} + 2O_{2} → CO_{2}↑ + 2Н_{2}O $
− эндотермические (реакции, проходящие с поглощением теплоты):
$CaCO_{3} \overset{t}{→} CaO + CO_{2}$
3. По изменению степени окисления:
− проходящие с изменением степени окисления атомов (окислительно−восстановительные) (реакции, при которой происходит переход электронов от одних атомов, молекул или ионов к другим):
$\overset{+2}{Cu}SO_{4} + \overset{0}{Fe} → \overset{+2}{Fe}SO_{4} + \overset{0}{Cu} ↓$
− проходящие без изменения степени окисления (реакции, в которой степень окисления каждого атома после реакции остается неизменной):
$\overset{+2}{Ca}\overset{+4}{C}\overset{-2}{O_{3}} \overset{t}{→} \overset{+2}{Ca}\overset{-2}{O} + \overset{+4}{C}\overset{-2}{O_{2}}$
4. По использованию катализатора:
− каталитические:
$4NH_{3} + 5O_{2} \overset{кат.}{→} 4NO + 6H_{2}O$
− некаталитические:
$4NH_{3} + 3O_{2} → 2N_{2} + 6H_{2}O$ Химический практикум №1
-
ХИМИЧЕСКИЙ ПРАКТИКУМ №1. Простейшие операции с веществом
Практическая работа №2
Опыт 1
Физические явления при горении свечи.
Зажгите свечу. Вы увидите, как начинает таять парафин около фитиля, образуя круглую лужицу. Какой процесс (физический или химический) здесь имеет место? Возьмите тигельными щипцами изогнутую под прямым углом стеклянную трубку, один конец её внесите в среднюю часть пламени, а другой опустите в пробирку. Что вы наблюдаете?Ответ:
Таяние парафина, который образует круглую лужицу около горящего фитиля − это физический процесс, так как состав парафина остался без изменения, а изменилось лишь его агрегатное состояние: из твёрдого он превратился в жидкий.
Если поместить один конец стеклянной трубки в среднюю часть пламени, а другой опустить в пробирку, то стенки пробирки запотевают − на стенках конденсируется вода − это физический процесс, так как состав вещества остался без изменения, а изменилось лишь его агрегатное состояние.Опыт 2
Обнаружение продуктов горения в пламени.
Возьмите тигельными щипцами кусочек жести (2x2 см) от консервной банки или предметное стекло, внесите в зону тёмного конуса горящей свечи и подержите 3—5 с. Быстро поднимите жесть (стекло), посмотрите на нижнюю плоскость. Объясните, что там появилось.
В химический стакан объёмом 500 мл поместите огарок свечи и зажгите его. Наблюдайте за процессом горения 3−4 минуты. Что замечаете на стенках стакана? Погасите свечку и налейте в стакан 5 мл известковой воды. Что наблюдаете? Дайте объяснение.Ответ:
На нижней плоскости появилось черное пятно — это сажа (углерод), образовавшаяся при горении парафина.
На стенках пробирки конденсируется вода, один из продуктов горения парафина.
После добавлении в пробирку известковой воды она мутнеет, т. к. углекислый газ, образующийся при горении парафина, вступает в реакцию с известковой водой, с образованием нерастворимого карбоната кальция:
$Ca(OH)_{2} + CO_{2} ⟶ CaCO_{3}↓ + H_{2}O$.
Следовательно, ещё один продукт горения парафина, присутствующий в пробирке − углекислый газ.Опыт 3
Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую грушу. Сжимая её рукой, продуйте в пламя горящей свечи воздух. Как изменилась яркость пламени?
Прикрепите две свечи при помощи расплавленного парафина к картону (фанере, оргалиту). Зажгите их и накройте одну пол-литровой банкой, другую — двухлитровой (можно взять химические стаканы различной
вместимости). В каком случае свеча горит дольше? Почему?
Запишите уравнения реакций горения, если вещества, из которых состоит свеча, имеют формулы $С_{16}Н_{34}$ и $С_{17}Н_{36}$.Ответ:
При нагнетании воздуха в пламя горящей свечи яркость пламени увеличилась, так как вблизи пламени увеличилась концентрация кислорода.
Если накрыть горящие свечи сосудами разного объема, то свеча в большей банке горит дольше, так как больший объём воздуха содержит большее количество кислорода.
Реакции горения свечи состоящей из $С_{16}Н_{34}$ и $С_{17}Н_{36}$: $2С_{16}Н_{34} + 49O_{2} ⟶ 32CO_{2} + 34H_{2}O$;
$С_{17}Н_{36} + 26O_{2} ⟶ 17CO_{2} + 18H_{2}O$.Практическая работа №3
Опыт 1
Механический анализ почвы.
В пробирку поместите почву (столбик почвы должен быть 2—3 см). Прилейте дистиллированную воду, объём которой должен быть в 3 раза больше объёма почвы. Закройте пробирку пробкой и тщательно встряхивайте 1—2 минуты, а затем вооружитесь лупой и наблюдайте за осаждением частиц почвы и структурой осадков. Опишите и объясните свои наблюдения.Ответ:
Почва имеет неоднородную структуру, она состоит из частиц разного размера и форм.
После встряхивания пробирки с почвой и водой в пробирке сначала будут оседать тяжелые частички почвы, затем более легкие, но раствор будет оставаться мутным – самые легкие частички находятся во взвешенном состоянии.Опыт 2
Получение почвенного раствора и опыты с ним.
Приготовьте бумажный фильтр, вставьте его в воронку, закреплённую в кольце штатива. Подставьте под воронку чистую сухую пробирку и профильтруйте полученную в первом опыте смесь почвы и воды. Перед фильтрованием смесь не следует встряхивать. Почва останется на фильтре, а собранный в пробирке фильтрат представляет собой почвенную вытяжку (почвенный раствор).
Несколько капель этого раствора поместите на стеклянную пластинку и с помощью пинцета подержите её над горелкой до выпаривания воды. Что наблюдаете?
Объясните.Ответ:
Фильтр задержит нерастворимые частицы почвы, а в колбе останется прозрачный раствор. Если его выпарить, на стеклянной пластине останется белый налет. Это смесь солей, которые содержались в почве и растворились в воде при смешивании с ней.
Опыт 3
Определение прозрачности воды.
Для опыта нужен прозрачный плоскодонный стеклянный цилиндр диаметром 2—2,5 см, высотой 30—35 см. Можно использовать мерный цилиндр на 250 мл без пластмассовой подставки. Мы рекомендуем провести опыт сначала с дистиллированной водой, а затем с водой из водоёма и сравнить результаты. Установите цилиндр на печатный текст и вливайте исследуемую воду, следя за тем, чтобы можно было читать через воду текст. Отметьте, на какой высоте вы не будете видеть шрифт. Измерьте высоты столбиков воды линейкой. Сделайте выводы.Ответ:
Возьмем мерный цилиндр без пластмассовой подставки и будем потихоньку приливать туда дистиллированную воду. Даже заполнив сосуд доверху и поместив его на печатный текст, написанное можно будет прочитать, так как дистиллированная вода очень чистая и не содержит взвешенных частиц.
Затем оставив цилиндр на тексте, будем приливать потихоньку воду из водоема. На определенной высоте водного столба текст станет невозможным для понимания, так как вода из водоёма содержит большое количество примесей. Отметим высоту исчезновения видимости шрифта, измерив ее линейкой.
Вывод. Современные водоемы сильно загрязнены и уровень видимости в них чрезвычайно мал.Опыт 4
Определение интенсивности запаха воды.
Коническую колбу наполните на 2/3 объёма исследуемой водой, плотно закройте пробкой (желательно стеклянной) и сильно встряхните. Затем откройте колбу и отметьте характер и интенсивность запаха. Дайте оценку интенсивности запаха воды в баллах, пользуясь таблицей 8.
Таблица 8. Определение запаха воды.
Хар-ка запаха Интенс-ть
Отсутствие ощутимого запаха 0
Очень слабый запах 1
Слабый запах 2
Запах легко обнаруживается 3
Отчетливый запах 4
Очень сильный запах 5Ответ:
В коническую колбу с пробкой нальем исследуемую воду и сильно встряхнём в закрытом состоянии. Открыв колбу и отметив характер и интенсивность запаха, дадим оценку интенсивности запаха воды в баллах.
Из−за наличия разных примесей вода может иметь запах разной интенсивности.
Дистиллированная вода очень чистая и не имеет запаха.
Водопроводная вода может иметь очень слабый запах в зависимости от применяемых методов очистки, качества труб.
Вода из водоёма может как иметь отчетливый запах (землистый, илистый, травянистый или болотный), так и не иметь запаха.Практическая работа №4
Опыт 1
Прокаливание медной проволоки и взаимодействие оксида меди (II) с серной кислотой.
Зажгите спиртовку (газовую горелку). Возьмите тигельными щипцами медную проволоку и внесите её в пламя. Через некоторое время выньте проволоку из пламени и счистите с неё образовавшийся чёрный налёт на лист бумаги. Опыт повторите несколько раз. Поместите полученный чёрный налёт в пробирку и прилейте в неё раствор серной кислоты. Подогрейте смесь. Что наблюдаете? Образовалось ли новое вещество при накаливании меди? Запишите уравнение химической реакции и определите её тип по признаку числа и состава исходных веществ и продуктов реакции. Какие признаки химической реакции вы наблюдали? Образовалось ли новое вещество при взаимодействии оксида меди (II) с серной кислотой? Определите тип реакции по признаку числа и состава исходных веществ и продуктов реакции и запишите её уравнение.Ответ:
При прокаливании медной проволоки медь окислятся кислородом воздуха, при этом образуется оксид меди (II) чёрного цвета:
$2Cu + O_{2} \overset{t}{=} 2CuO$ − реакция соединения.
О химической реакции свидетельствует изменение цвета с красноватого на черный.
Счистим образовавшийся налет на лист бумаги. Повторим опыт несколько раз. Полученный налет поместим в пробирку и прильем в нее раствор серной кислоты, смесь подогреем. Весь порошок растворился, раствор стал голубым, т. к. в результате реакции образуется сульфат меди (II):
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$ − реакция обмена.
О химической реакции свидетельствует изменение цвета, растворение оксида меди.Опыт 2
Взаимодействие мрамора с кислотой.
Положите в небольшой стакан 1 − 2 кусочка мрамора. Прилейте в стакан столько соляной кислоты, чтобы ею покрылись кусочки. Зажгите лучинку и внесите её в стакан. Образовались ли новые вещества при взаимодействии мрамора с кислотой? Какие признаки химических реакций вы наблюдали? Запишите уравнение химической реакции и укажите её тип по признаку числа и состава исходных веществ и продуктов реакции.Ответ:
Поместим в химический стакан кусочек мрамора, и нальём в стакан соляной кислоты, ровно столько, чтобы ей покрылся кусочек; наблюдаем выделение пузырьков газа. Произошла химическая реакция, мрамор растворился, выделился углекислый газ $СO_{2}$.
$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$↑.
Реакция обмена, при которой также протекает разложение слабой угольной кислоты на углекислый газ и воду ($H_{2}CO_{3} = H_{2}O + CO_{2}$↑).
Внесём в стакан зажженную лучинку, она погасла, т.к. углексислый газ $СO_2$ не поддерживает горение.Опыт 3
Взаимодействие хлорида железа (III)с роданидом калия.
В пробирку налейте 2 мл раствора хлорида железа (III), а затем несколько капель раствора роданида калия KSCN − соли кислоты HSCN, с кислотным остатком $SCN^{-}$. Какими признаками сопровождается эта реакция? Запишите её уравнение и тип реакции по признаку числа и состава исходных веществ и продуктов реакции.Ответ:
После добавления к раствору хлорида железа (III) нескольких капель раствора роданида калия образуется роданит железа и хлорид калия. Происходит окрашивание раствора в темно−красный цвет.
$FeCl_{3} + 3KSCN = 3KCl + Fe(SCN)_{3}$ − реакция обмена.
О химической реакции свидетельствует изменение цвета.Опыт 4
Взаимодействие карбоната натрия с хлоридом кальция.
В пробирку налейте 2 мл раствора карбоната натрия. Затем добавьте несколько капель раствора хлорида кальция. Что наблюдаете? Запишите уравнение химической реакции и укажите её тип по признаку числа и состава исходных веществ и продуктов реакции.Ответ:
После добавления к карбоната натрия нескольких капель раствора хлорида кальция, наблюдается образование белого осадка (карбоната кальция): $Na_{2}CO_{3} + CaCl_{2} = 2NaCl + CaCO_{3}$↓ − реакция обмена.
О химической реакции свидетельствует образование осадка.Практическая работа №5
Приготовление раствора сахара и расчёт его массовой доли в растворе.
Отмерьте мерным цилиндром 50 мл дистиллированной воды и влейте её в коническую колбочку ёмкостью 100 мл. Чайную ложку сахарного песка (или два кусочка) взвесьте на лабораторных весах, затем поместите его в колбочку с водой и перемешивайте стеклянной палочкой до полного растворения. Теперь приступайте к расчётной части. Вначале рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара, объём воды, плотность воды примите равной 1 г/мл.
$ω (сах.) = \frac{m(сах.)}{m(р-р)}$,
m (р−р) = m (сах.) + m (вода),
m (вода) = V (вода) * ρ (вода),
Вы также сможете рассчитать, сколько молекул сахара содержится в полученном растворе, используя известные вам соотношения:
$N (мол.сах.) =N_{А} * n (сах.)$,
$n (сах.) = \frac{m(сах.)}{M(сах.)}$.
Поскольку сахар состоит на 99,9% из сахарозы, имеющей формулу $C_{12}H_{22}O_{11}$, вы легко рассчитаете молярную массу сахара и затем найдёте число молекул сахара в полученном вами растворе.Ответ:
В коническую колбочку ёмкостью 100 мл нальём 50 мл дистиллированной воды и поместим в колбочку чайную ложку сахарного песка, предварительно взвешенного. Раствор перемешаем стеклянной палочкой.
Рассчитаем массовую долю сахара в растворе. Пусть масса сахарного песка, взвешенного на весах, равна х, тогда:
$ω (сах.) = \frac{m(сах.)}{m(р-р)}$,
$ω (сах.) = \frac{х}{m(р-р)}$.
Так как ρ воды = 1 г/мл, то
m (вода) = V (вода) * ρ (вода) = 1 * 50 = 50 г.
m (р−р) = m (сах.) + m (вода) = 50 + x
$ω (сах.) = \frac{х}{50 + x}$.
$n (сах.) = \frac{m(сах.)}{M(сах.)}$;
M ($C_{12}H_{22}O_{11}$) = 12 *Ar (C) + 22 * Ar (H) + 11 * Ar (O) = 12 * 12 + 22 * 1 + 11 * 16 = 342 г/моль;
$n (сах.) = \frac{x}{342}$;
$N (мол.сах.) =N_{А} * n (сах.)$,
$N_{A}= 6,02 * 10^{23}$;
$N (мол.сах.) =\frac{6,02x * 10^{23}}{342} = 1,76x * 10^{21}$. §35
-
ГЛАВА ПЯТАЯ. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции
§35. Растворение. Растворимость веществ в воде
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1.http://www.hemi.nsu.ru/ucheb176.htm
2. https://ru.wikipedia.org/wiki/Растворимость
3. https://blog.tutoronline.ru/rastvorenie−rastvorimost−vewestv−v−vode
4. https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/rastvorenie−rastvorimost−88647
5. http://schooled.ru/chemistry/admission/49.html
6. https://nauka.club/khimiya/kristallogidraty.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Гидраты и кристаллогидраты, кристаллизационная вода
Гидраты – продукты присоединения воды (гидратации) к молекулам, атомам, ионам. Они могут быть твердые, жидкие и реже газообразные. Твердые гидраты, имеют свое название – кристаллогидраты.
Кристаллогидраты – твердые вещества, продукты присоединения воды (гидратация) к атомам, молекулам или ионам.
Кристаллизационная вода – вода, входящая в состав кристаллогидратов.
Кристаллогидраты создаются, когда катионы вещества кристаллической решетки образуют связи с водными молекулами. Соединения более прочные, чем связи анионов и катионов в кристаллах безводной соли. Примечательным свойством кристаллогидратов является то, что при низких температурах содержащаяся в них жидкость связывается с катионами и ионами солей. Основания, кислоты, а также значительное количество солей из водных растворов в осадок выпадают кристаллогидратами, завершая кристаллизационный процесс.
История.
История этих химических элементов начинается с 1826 года, когда были открыты гидраты спирта.Дальнейшее продолжение их изучения связано с Д. И. Менделеевым. В процессе исследования реакции соединения воды и спирта он определил, что при этом образуются новые соединения, которые сопровождают химические и физические процессы. В 1880 году понятие гидраты было введено в химии для характеристики определённых соединений веществ, растворенных в жидкости. Однако систематическое и подробное изучение кристаллогидратов, возможность рассчитать их массовую долю, выявление и установление составляющих началось только в 1889 году.
Растворение в воде.
Растворение кристаллогидратов в воде — сложный химико−физический процесс. При этом решетка кристаллическая у соединения может рушиться, а образуемые вследствие этого элементы (частички) распространяются по всему раствору. Такое преобразование способно выдать значительную тепловую энергию.
Объём в соединениях воды может быть различным: от молей дробного числа на моль вещества до значительного молярного объема. В зависимости от состояния температуры среды одно и то же вещество может иметь в себе различное количество молекул воды. Отдельные кристаллогидраты при попадании на воздух могут терять кристаллизационную воду самостоятельно (самопроизвольно), что называется выветриванием. В большинстве случаев, чтобы удалить жидкость (воду) искусственно, привести ее к обезвоживанию, используют нагревание и прокаливание.
Области применения.
Кристаллогидраты нашли применение в различных отраслях народного хозяйства. Так, гипс используется в медицинской сфере (в стоматологии, хирургии, ортопедии).
В медицине широко применяются сульфат натрия, сульфат магния, сульфат цинка, цитрат натрия, хлорид кальция, нитрат кальция, хлористое железо. Медный купорос известен как красящее вещество для тканей. Его растворами защищают древесину, протравливают семена. Метан в природных условиях в виде кристаллогидрата залегает в недрах Земли в огромных количествах, являясь перспективным моторным топливом.?. Вопросы и задания
1. Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
Ответ:
Растворимость веществ в воде зависит от температуры. Как правило, растворимость твёрдых веществ в воде увеличивается с повышением температуры. Чем выше температура, тем выше скорость движения молекул воды и сахара, т. е. молекулы воды чаще взаимодействуют с молекулами сахара, поэтому интенсивнее происходит растворение.
2. Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
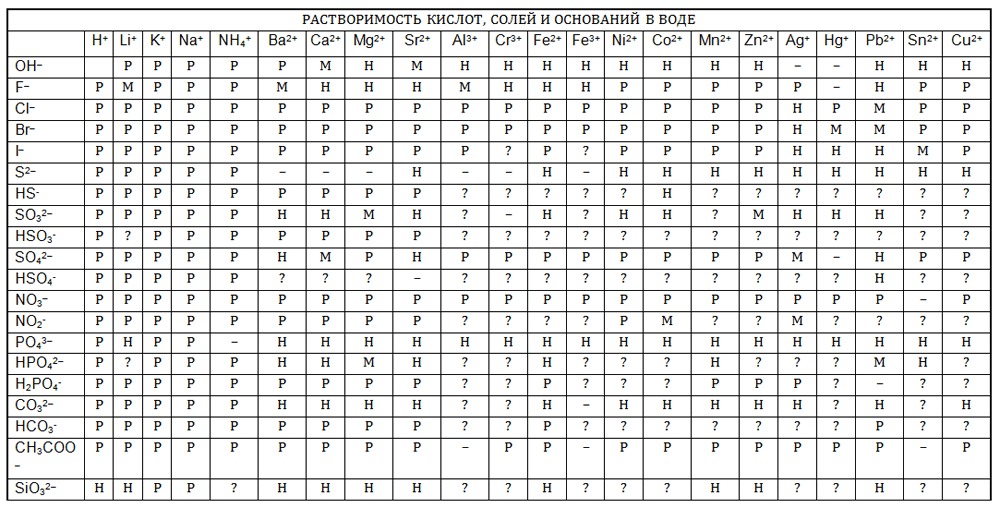
Ответ:
Хорошо растворимые: $AgNO_{3}$ – нитрат серебра (I), $BaCl_{2}$ – хлорид бария, $CaBr_{2}$ – бромид кальция, $MgI_{2}$ – иодид магния, $ZnSO_{4}$ – сульфат цинка, $Pb(NO_{3})_{2}$ – нитрат свинца (II).
Малорастворимые: $Ag_{2}SO_{3}$ – сульфит серебра (I), $BaF_{2}$ – фторид бария, $CaSO_{4}$ – сульфат кальция, $Mg(OH)_{2}$ – гидроксид магния, $ZnSO_{3}$ – сульфит цинка.
Практически нерастворимые: AgCl – хлорид серебра (I), $BaSO_{4}$ – сульфат бария, $CaCO_{3}$ – карбонат кальция, $Mg_{3}(PO_{4})_{2}$ – фосфат магния, ZnS – сульфид цинка, $PbI_{2}$ – иодид свинца (II).3. Почему аквариумы нельзя заполнять быстро охлаждённой прокипячённой водой (она должна постоять несколько дней)?
Ответ:
Аквариумы нельзя заполнять быстро охлаждённой прокипячённой водой, так как при увеличении температуры растворимость газов уменьшается (кислорода в том числе), соответственно рыбам нечем будет дышать. Поэтому прежде чем заполнять прокипячённой водой аквариум, необходимо дать ей постоять, чтобы атмосферный кислород успел снова раствориться в ней.
4. Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
Ответ:
Серебро растворяется в воде с образованием ионов серебра, которые обладают бактерицидным действием, поэтому ранки промытые такой водой заживают быстрее.
5. Пользуясь рисунком 124, определите массовую долю хлорида калия, содержащегося в насыщенном растворе при 20°C.
Рис. 124. Растворимость веществ в зависимости от температуры.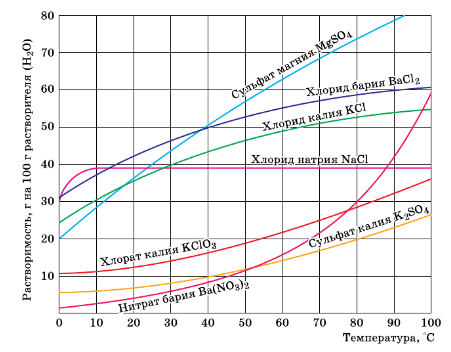
Ответ:
Дано:
m ($H_{2}O$) = 100 г;
__________________
ω (KCl) − ?
Решение:
Согласно рисунку при температуре 20°C в 100 г воды содержится 35 г KCl
m (р−ра) = m (вода) + m (KCl) = 100 + 35 = 135 г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω (KCl) =\frac{m (KCl)}{m (р-р)} = \frac {35}{135} = 0,26$ или 26%.
Ответ. 26 %.6. Может ли разбавленный раствор быть одновременно и насыщенным?
Ответ:
Разбавленным называют раствор с низкой концентрацией вещества. Когда вещество малорастворимо, раствор может быть разбавленным и насыщенным одновременно.
7. К 500 г насыщенного при 20 °C раствора сульфата магния (см. рис. 124) прилили достаточный для проведения реакции объём раствора хлорида бария. Найдите массу выпавшего осадка.
Рис. 124. Растворимость веществ в зависимости от температуры.
Ответ:
Дано:
$m_{1} (H_{2}O)$ = 100 г;
$m_{2} (р-ра)$ = 500 г;
t = 20 °C;
_____________________
$ω (BaSO_{4})$ − ?
Решение:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓$;
Согласно рисунку при температуре 20°C в 100 г воды содержится 37 г $MgSO_{4}$.
$m_{1}(р-ра) = m_{1} (H_{2}O) + m_{1}(MgSO_{4}) = 100 + 37 = 137$ г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω (MgSO_{4}) =\frac{m_{1}(MgSO_{4})}{m_{1} (р-ра)} = \frac {37}{137} = 0,27$ или 27%;
m (вещ−во) = m (р−ра) * ω;
$m_{2}(MgSO_{4}) = m_{2} (р-ра) * ω = 500 * 0,27 = 135$ г;
$n = \frac{m}{M}$;
M ($MgSO_{4}$) = 1 * Ar (Mg) + 1 * Ar (S) + 4 * Ar (O) = 1 * 24 + 1 * 32 + 4 * 16 = 120 г/моль;
$n (MgSO_{4}) = \frac{m_{2}(MgSO_{4})}{M (MgSO_{4})} = \frac {135}{120} = 1,125$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{1,125 моль}{MgSO_{4}}} + BaCl_{2} = MgCl_{2} + \underset{1 моль}{\overset{x}{BaSO_{4}↓}}$;
$x = n (BaSO_{4}) = \frac{1,125 * 1}{1} = 1,125$ моль;
m = n * M;
M ($BaSO_{4}$)= 1 * Ar (Ba) + 1 * Ar (S) + 4 * Ar (O) = 1 * 137 + 1 * 32 + 4 * 16 = 233 г/моль;
$m (BaSO_{4}) = n (BaSO_{4}) * M (BaSO_{4}) = 1,125 * 233 = 262$ г.
Ответ. 262 г. §36
-
§36. Электролитическая диссоциация
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://nauka.club/khimiya/elektroliticheskаyа−dissotsiatsiуа.html
2. https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/elektroliticheskaia−dissotciatciia−kislot−osnovanii−i−solei−102805
3. https://ru.wikipedia.org/wiki/Электролитическаядиссоциация
4. https://ru.wikipedia.org/wiki/Ассоциация%28химия%29
5. https://dic.academic.ru/dic.nsf/ruwiki/73639
6. https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/elektrolity−i−neelektrolity−88879/re−3f747e10−90e8−48f8−a17b−16f272f87e592. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Механизм диссоциации веществ с различным типом связи
Из механизма диссоциации ясно, что диссоциировать будут вещества, обладающие ионной или полярной связью, поэтому степень диссоциации зависит от природы растворенного вещества, вернее, от типа связи в его молекулах.
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами – к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы . Диссоциация полярных молекул может быть полной или частичной.
Если же в растворе оказываются сложные молекулы с различным типом химической связи, то распад на ионы произойдет в том месте молекулы, где существуют ионная и полярная связь. Так, молекула азотной кислоты $HNO_{3}$ диссоциирует на ионы водорода $Н^{+}$ кислотный остаток $N0_{3}$ , который не распадается под действием воды, так как азот с кислородом связаны ковалентной связью.?. Вопросы и задания
1. Объясните, почему раствор гидроксида калия проводит электрический ток, а раствор глюкозы $C_{6}H_{12}O_{6}$ − нет.
Ответ:
Гидроксид калия – сильный электролит. Гидроксид калия полностью диссоциирует на ионы, которые являются носителями зарядов.
$КОН = К^{+} + ОН^{-}$.
Глюкоза – неэлектролит. Глюкоза в растворе не диссоциирует на ионы, в растворе нет носителей зарядов, поэтому раствор не проводит электрический ток.2. Почему при разбавлении раствора электролита степень его диссоциации увеличивается?
Ответ:
В результате диссоциации электролит распадается на ионы. При разбавлении раствора образование молекул из ионов затрудняется из-за более редкого столкновения ионов в разбавленном растворе, поэтому при разбавлении раствора электролита степень его диссоциации увеличивается.
3. Докажите, что деление химических связей на ковалентную полярную и ионную условно.
Ответ:
В обоих типах химической связи осуществляется смещение электронов к более электроотрицательному элементу, частичное – в случае ковалентной полярной, и практически полное – в случае ионной химической связи. Однако, отнесение смещения к полному или частичному условно, поэтому и деление химический связей на ковалентную полярную и ионную условно.
Кроме того, в растворе под действием диполей воды происходит превращение ковалентной полярной связи в ионную.4. Как отличается по своей природе электропроводность металлов и электролитов?
Ответ:
Электропроводность металлов обеспечивается благодаря обобщенным электронам, а электропроводность электролитов обеспечивается благодаря ионам, которые образуются в результате диссоциации.
5. Как объяснить электрическую проводимость водных растворов электролитов?
Ответ:
В растворе электролита имеются положительно и отрицательно−заряженные ионы. При подаче разности потенциалов положительно заряженные ионы движутся к отрицательно заряженному полюсу, а отрицательно заряженные ионы к положительному полюсу. Возникает направленное движение заряженных частиц – электрический ток.
§37
-
§37. Основные положения теории электролитической диссоциации
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://ido.tsu.ru/schools/chem/data/res/chemfor/uchpos/text/g173.html
2.https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/elektrolity−i−neelektrolity−88879/re−0bb77687−93a2−4244−8af4−54a10510db05
3. https://stepik.org/lesson/340920/step/3?unit=324488
4. https://www.calc.ru/Kisloty−Soli−I−Osnovaniya−V−Teorii−Elektroliticheskoy−Dissot.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Кислоты, основания и соли в свете теории электролитической диссоциации
С позиций теории электролитической диссоциации к кислотам относятся
вещества, способные диссоциировать в растворе с образованием ионов водорода, а к основаниям − вещества, которые при диссоциации дают гидроксид−ионы.
Наличие в молекулах кислот ионов водорода определяет важнейшие общие
свойства этого класса соединений:
1. Способность взаимодействовать с основаниями с образованием солей.
2. Способность выделять водород при взаимодействии с активными
металлами (Zn, Fe, Mg, AI и др.).
3. Изменение окраски индикаторов.
4. Кислый вкус.
Сильные кислоты полностью диссоциированы на ионы. Слабые кислоты диссоциируют частично: Слабые многоосновные кислоты диссоциируют ступенчато:
Наличие в молекулах оснований гидроксид−ионов обусловливают следующие общие свойства этих соединений:
1. способность взаимодействовать с кислотами с образованием солей;
2. водные растворы оснований изменяют окраску индикаторов;
3. растворы оснований имеют горький вкус и скользкие на ощупь.
Щелочи диссоциируют в водных растворах полностью. Слабые основания диссоциируют частично. Слабые многокислотные основания диссоциируют ступенчато:
В растворах многоосновных кислот, а также оснований, содержащих
несколько гидроксильных групп, устанавливаются ступенчатые равновесия,
отвечающие последовательным стадиям диссоциации.
Соли диссоциируют с образованием катионов металла и анионов кислотного остатка:
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы.?. Вопросы и задания
1. Сравните по строению и свойствам:
а) $Ca^{0}$ и $Ca^{2+}$;
б) $Cu^{2+}_{гидр}$ и $Cu^{2+}_{негидр}$;
в) $H^{0}_{2}$ и $H^{+}$.Ответ:
а) $Ca^{0}$ − атомы металла кальция, серебристо−белого цвета. На внешнем уровне содержит два электрона, которые участвуют в образовании металлической химической связи. Металл кальций имеет металлическую кристаллическую решётку. Легко взаимодействует с водой с образованием иона $Ca^{2+}$.
Са +20 $)_{2})_{8})_{8})_{2}$
$_{20}Ca^{0}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{2}$
$Ca^{2+}$ − ион (катион). На внешнем уровне не содержит электронов. Существует в соединениях (белого цвета) и в растворах (бесцветные) в виде ионов. Соединения $Ca^{2+}$ в большинстве имеют ионную кристаллическую решётку.
$Ca^{2+}$ +20 $)_{2})_{8})_{8}$
$_{20}Ca^{2+}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{0}$
б) $Cu^{2+}_{гидр}$ − катион голубого цвета в соединениях и растворе.
$Cu^{2+}_{негидр}$ − катион, бесцветный в соединениях, не связан с молекулами воды.
$Cu^{2+}_{гидр}$ и $Cu^{2+}_{негидр}$ имеют одинаковое электронное строение, однако, ионы $Cu^{2+}_{негидр}$ окружены диполями воды.
$Cu^{2+}$ +29 $)_{2})_{8})_{17}$
$_{29}Cu^{2+}$
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{0}$
в) $H^{0}_{2}$ − простое вещество, газ без цвета и запаха, легче воздуха. Имеет неполярную ковалентную связь.
$H^{+}$ − катион, существует в соединениях и растворах, придавая кислотную среду растворам, окрашивая индикаторы в соответствующий цвет. В его электронной оболочке нет электронов, он представляет собой положительно заряженное ядро.
$_{1}H^{+}$ $1s^{0}$2. Используя таблицу растворимости, приведите примеры пяти веществ, которые в растворах образуют сульфат−ионы $SO^{2-}_4$. Запишите уравнения электролитической диссоциации этих веществ.
Таблица.
Ответ:
Серная кислота $H_{2}SO_{4} = 2H^{+} + SO_{4}^{2-}$.
Сульфат лития $Li_{2}SO_{4} = 2Li^{+} + SO_{4}^{2-}$.
Сульфат натрия $Na_{2}SO_{4} = 2Na^{+} + SO_{4}^{2-}$.
Сульфат калия $K_{2}SO_{4} = 2K^{+} + SO_{4}^{2-}$.
Сульфат магния $MgSO_{4} = Mg^{2+} + SO_{4}^{2-}$.3. Какую информацию несёт в себе следующее уравнение:
$Al(NO_{3})_{3}= Al^{3+} + 3NO^{-}_{3}$?
Дайте названия вещества и ионов.Ответ:
$\underset {нитрат\;алюминия}{Al(NO_{3})_{3}}= \underset {катион\;алюминия}{Al^{3+}} + \underset{нитрат-анион}{3NO^{-}_{3}}$.
Уравнение показывает, что нитрат алюминия диссоциирует на катион алюминия ($Al^{3+}$) и 3 нитрата−аниона ($NO^{3-}$).4. Запишите уравнения диссоциации: сульфата железа (III), карбоната калия, сульфата аммония, нитрата меди (II), гидроксида бария, соляной кислоты, гидроксида калия, хлорида железа (II). Дайте названия ионов.
Ответ:
$\underset {cульфат\;железа (III)} {Fe_{2}(SO_{4})_{3}} ⇄ \underset {катион\;железа\;(III)}{2Fe^{3+}}+\underset {сульфат-анион}{3SO_{2}^{−4}}$.
$\underset {карбонат\;калия} {K_{2}CO_{3}}⇄\underset {катион\;калия}{2K+}+\underset{карбонат-анион} {CO^{2−}_{3}}$.
$\underset {сульфат\;аммония} {(NH_{4})_{3}PO_{4}}⇄\underset {катион\;аммония} {3NH_{4}^{+}}+\underset {фосфат-анион}{PO_{3}^{-4}}$.
$\underset {нитрат\;меди (II) } {Cu(NO_{3})_{2} }⇄\underset {катион\;меди\;(II)} {Cu^{2+}}+\underset {нитрат-анион}2NO^{−3}$.
$\underset {гидроксида\;бария } {Ba(OH)_{2}}⇄\underset {катион\;бария}{Ba^{2+}} +\underset {гидроксид-анион}{2OH^{-}}$.
$\underset {соляная\;кислота}{ HCl}⇄\underset {катион\;водорода}{H^{+}}+\underset {хлорид-анион}{Cl^{−}}$.
$\underset {гидроксид\;калия} {KOH}⇄\underset {катион\;калия}{K^{+}}+\underset {гидроксид-анион}{OH^{−}}$.
$\underset {хлорид\;железа\;(II) } {FeCl_{2}}⇄\underset{катион\;железа\;(II)}{Fe^{2^+}} +\underset {хлорид-анион}{2Cl^{−}}$.5. Для каких из перечисленных ниже веществ можно записать уравнения диссоциации: гидроксид железа (II), гидроксид калия, кремниевая кислота, азотная кислота, оксид серы (IV), оксид кремния (IV), сульфид натрия, сульфид железа (II), серная кислота? Почему? Запишите возможные уравнения диссоциации.
Ответ:
Диссоциировать на ионы будут электролиты, растворимые в воде.
$Fe(OH)_{2}$ ⇸ – гидроксид железа (II) – слабое основание, не растворим, поэтому не диссоциирует.
$KOH = K^{+} + OH^{-}$ – гидроксид калия – щелочь.
$H_{2}SiO_{3}$ ≠ – кремниевая кислота – слабая кислота, не растворима, поэтому не диссоциирует.
$HNO_{3} = H^{+} + NO_{3}^{-}$ – азотная кислота – сильная кислота.
$SO_{2} + Н_{2}O = H_{2}SO_{3}$ – оксид серы (IV), растворим в воде с образованием сернистой кислоты, которая диссоциирует.
$H_{2}SO_{3} = 2H^{+} + SO_{3}^{2-}$
$SiO_{2}$ ≠ – оксид кремния (IV) – неэлектролит.
$Na_{2}S = 2Na^{+} + S^{2-}$ – сульфид натрия – растворимая соль сильного основания и слабой кислоты.
FeS ≠ – сульфид железа (II) – нерастворимая соль слабого основания и слабой кислоты, поэтому не диссоциирует.
$H_{2}SO_{4} = 2H^{+} + SO_{4}^{2-} $ – серная кислота – сильная кислота.6. В записи уравнений ступенчатой диссоциации серной кислоты для первой ступени используют знак равенства, а для второй — знак обратимости. Почему?
Ответ:
Серная кислота − сильный электролит, по первой ступени она диссоциирует практически полностью.
$H_{2}SO_{4} = H^{+} + HSO_{4}^{-}$.
Диссоциация по второй ступени проходит намного слабее, чем по первой, процесс обратим.
$HSO_{4}^{-} ⇄ H^{+} + SO_{4}^{2-}$. §38
-
§38. Ионные уравнения
Лабораторный опыт №17
Взаимодействие растворов хлорида натрия и нитрата серебра.
К 1 мл раствора хлорида натрия в пробирке добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения реакции. Согласно сокращённому ионному уравнению предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения проделанных реакций.Ответ:
При добавлении нитрата серебра к хлориду натрия выпадает белый творожистый осадок хлорида серебра.
$NaCl + AgNO_{3} = NaNO_{3} + AgCl↓$;
$Na^{+} + Cl^{-} + Ag^{+} + NO3^{-} = Na^{+} + NO_{3}^{-} + AgCl↓$;
$Ag^{+} + Cl^{-} = AgCl↓$.
Варианты с другими электролитами согласно сокращённому ионному уравнению:
$ZnCl_{2} + 2AgF = ZnF_{2} + 2AgCl↓$;
$FeCl_{2} + 2AgNO_{3} = Fe(NO_{3})_{2} + 2AgCl↓$;
$AlCl_{3} + 3AgNO_{3} = Al(NO_{3})_{3} + 3AgCl↓$.Лабораторный опыт №18
Получение нерастворимого гидроксида и взаимодействие его с кислотами.
В три пробирки налейте по 1 мл раствора хлорида или сульфата железа (III). Прилейте в каждую пробирку по 1 мл раствора щёлочи. Что наблюдаете? Затем добавьте в пробирки соответственно растворы серной, азотной и соляной кислот до исчезновения осадка. Запишите молекулярные и ионные уравнения реакции.
Предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения предложенных реакций.Ответ:
При добавлении к хлориду железа гидроксида натрия выпадает бурый осадок гидроксида железа.
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$;
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓ $;
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓$.
При добавлении в пробирку раствор кислоты, осадок растворится.
Добавление серной кислоты.
$2Fe(OH)_{3} + 3H_{2}SO4 = Fe_{2}(SO_{4})_{3} + 6H_{2}O $;
$2Fe(OH)_{3} + 6H^{+} + 3SO_{4}^{2-} = 2Fe^{3+} + 3SO_{4}^{2-} + 6H_{2}O$;
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$.
Добавление азотной кислоты.
$Fe(OH)_{3} + 3HNO_{3} = Fe(NO_{3})_{3} + 3H_{2}O$;
$Fe(OH)_{3}+ 3H^{+} + 3NO^{3-} = Fe^{3+}+ 3NO^{3-} + 3H_{2}O$;
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$.
Добавление соляной кислоты.
$Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$;
$Fe(OH)_{3} + 3H^{+} + 3Cl^{-} = Fe^{3+} + 3Cl^{-} + 3H_{2}O$;
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$.
С солями металлов, которые образуют нерастворимые гидроксиды, так же можно провести подобные реакции.
При добавлении к хлориду цинка гидроксида натрия выпадает осадок гидроксида цинка.
$ZnCl_{2} + 2NaOH = 2NaCl + Zn(OH)_{2}↓$;
$Zn^{2+} + 2OH^{-} = Zn(OH)_{2}↓$.
Добавление соляной кислоты.
$Zn(OH)_{2} + 2HCl = ZnCl_{2} + 2H_{2}O$;
$Zn(OH)_{2} + 2H^{+} = Zn^{2+} + 2H_{2}O$.
При добавлении к хлориду алюминия гидроксида натрия выпадает осадок гидроксида алюминия.
$AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$;
$Al^{3+} + 3OH^{-} = Al(OH)_{3}↓$.
Добавление соляной кислоты.
$Al(OH)_{3} + 3HCl = AlCl_{3} + 3H_{2}O$;
$Al(OH)_{3} + 3H^{+} = Al^{3+} + 3H_{2}O$.
При добавлении к сульфату меди гидроксида натрия выпадает осадок гидроксида меди.
$СuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓$;
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓$.
Добавление азотной кислоты.
$Cu(OH)_{2} + 2HNO_{3} = Cu(NO_{3})_{2} + 2H_{2}O$;
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://repetitor2000.ru/ionnyeuravnenija01.html
2. https://ru.wikipedia.org/wiki/Реакцииионногообмена
3. https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/−reaktcii−ionnogo−obmena−reaktciia−neitralizatcii−1415552. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Реакции ионного обмена
Многие химические реакции протекают в водных растворах. Если в этих реакциях участвуют электролиты, то нужно учитывать, что эти вещества находятся в водном растворе в диссоциированном состоянии, то есть в виде ионов (сильные электролиты) или частично в виде ионов (слабые электролиты).
Таким образом, реакции между водными растворами электролитов — это реакции, в которых участвуют ионы. Поэтому такие реакции называются ионными реакциями.
Ионные реакции возможны только в том случае, если между ионами происходит химическое взаимодействие, т. е. какие−либо ионы одного электролита и какие−либо ионы другого электролита связываются друг с другом и образуют:
− нерастворимое вещество, выпадающее в виде осадка;
− газообразное вещество;
− молекулы малодиссоциирующего вещества (слабого электролита).
Уравнения ионных реакций называют ионными уравнениями.
Реакцию обмена в растворе можно выразить тремя видами уравнений: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Правила написания реакций ионного обмена
1. При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
2. Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
3. Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.?. Вопросы и задания
1. Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, – между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария. В чём суть обеих реакций?
Ответ:
$K_{2}SO4 + Ba(NO_{3})_{2} = 2KNO_{3} + BaSO_{4}↓ $;
$2K^{+} + SO_{4}^{2-} + Ba^{2+} + 2NO^{3-} = 2K^{+} + 2NO^{3-} + BaSO_{4}↓$;
$B^{2+} + SO_{4}^{2-} = BaSO_{4}↓$.
$H_{2}SO_{4} + BaCl_{2} = 2HCl + BaSO_{4}↓ $;
$2H^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = 2H^{+} + 2Cl^{-} + BaSO_{4}↓ $;
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $.
Суть обеих реакций заключается в том, что катион бария и сульфат−анион образуют нерастворимый сульфат бария.2. Запишите молекулярные и ионные уравнения реакций, о которых говорилось во второй части параграфа, — между гидроксидом меди (II) и соляной кислотой, между гидроксидом меди (II) и азотной кислотой. В чём суть обеих реакций?
Ответ:
$Cu(OH)_{2} + 2HCl = CuCl_{2} + 2H_{2}O$;
$Cu(OH)_{2} + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + 2H_{2}O$;
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$.
$Cu(OH)_{2} + 2HNO3 = Cu(NO_{3})_{2} + 2H_{2}O$;
$Cu(OH)_{2} + 2H^{+} + 2NO_{3}^{-} = Cu^{2+} + 2NO_{3}^{-} + 2H_{2}O$;
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$.
Суть обеих реакций заключается в том, что нерастворимый гидроксид меди (II), под действием катионов водорода, растворяется с образованием воды.3. Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет эту реакцию и те реакции, о которых говорилось в конце параграфа?
Ответ:
$3K_{2}CO_{3} + 2H_{3}PO_{4} = 2K_{3}PO_{4} + 3H_{2}O + 3CO_{2}↑ $;
$6K^{+} + 3CO_{3}^{2-} + 6H^{+} + 2PO_{4}^{3-} = 6K^{+} + 2PO_{4}^{3-} + 3H_{2}O + 3CO_{2}↑ $;
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑ $.
Объединяет их то, что карбонат−анионы, под действием катионов водорода, образуют воду и углекислый газ.4. Предложите примеры реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.
Ответ:
$FeSO_{4} + 2NaOH ⟶ Na_{2}SO_{4} + Fe(OH)_{2}↓ $;
$Fe^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + Fe(OH)_{2}↓$;
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}$.
$CuCl_{2} + Na_{2}CO_{3} ⟶ 2NaCl + CuCO_{3}↓$;
$Cu^{2+} + 2Cl_{-} + 2Na^{+} + CO_{3}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + CuCO_{3}↓$;
$Cu^{2+}+ CO_{3}^{2-} ⟶ CuCO_{3}↓$.
$CuSO_{4} + K_{2}S ⟶ K_{2}SO_{4} + CuS↓$;
$Cu^{2+} + SO_{4}^{2-} + 2K^{+} + S^{2-} ⟶ 2K^{+} + SO_{4}^{2-} + CuS↓$;
$Cu^{2+}+ S^{2-} ⟶ CuS↓$.5. Приведите по два молекулярных уравнения реакций для следующих ионных:
а) $3Ca^{2+} + 2PO^{3-}_{4} = Ca_{3}(PO_{4})_{2}$↓;
б) $Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓$;
в) $2H^{+} + S^{2-} = H_{2}S↑$;
г) $H_{2}SiO_{3} + 2OH^{-} = SiO^{2-}_{3} + 2H_{2}O$;
д) $Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$.Ответ:
а) $3Ca^{2+} + 2PO^{3-}_{4} = Ca_{3}(PO_{4})_{2}↓$
$3Ca(NO_{3})_{2} + 2Na_{3}PO_{4} = 6NaNO_{3} + Ca_{3}(PO_{4})_{2}↓ $
$3CaCl_{2} + 2K_{3}PO_{4} = 6KCl + Ca_{3}(PO_{4})_{2}↓ $
б) $Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓$;
$Fe_{2}(SO_{4})_{3} + 6NaOH = 3Na_{2}SO_{4} + 2Fe(OH)_{3}↓ $
$FeBr_{3} + 3LiOH = 3LiBr + Fe(OH)_{3}↓ $
в) $2H^{+} + S^{2-} = H_{2}S↑$;
$Na_{2}S + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}S↑ $
$BaS + 2HNO_{3} = Ba(NO_{3})_{2} + H_{2}S↑$
г) $H_{2}SiO_{3} + 2OH^{-} = SiO^{2-}_{3} + 2H_{2}O$;
$H_{2}SiO_{3} + 2NaOH = Na_{2}SiO_{3} + 2H_{2}O$
$H_{2}SiO_{3} + 2KOH = K_{2}SiO_{3} + 2H_{2}O$
д) $Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$.
$2Fe(OH)_{3}+ 3H_{2}SO_{4} = Fe_{2}(SO_{4})_{3} + 6H_{2}O$
$Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$ §39
-
§39. Кислоты, их классификация и свойства
Лабораторный опыт №19
Взаимодействие кислот с основаниями.
Налейте в пробирку 2 мл раствора гидроксида натрия и добавьте к нему 1—2 капли фенолфталеина. Что наблюдаете? Объясните, какие частицы в растворе гидроксида натрия вызвали изменение окраски индикатора. К раствору щёлочи с фенолфталеином добавляйте по каплям соляную кислоту, перемешивая содержимое пробирки. Что вы наблюдаете? Объясните, образование какого вещества привело к изменению окраски индикатора. Потрогайте пробирку, в которой проводили реакцию. Сделайте вывод о её тепловом эффекте. С помощью пипетки поместите 1—2 капли раствора из пробирки на стеклянную или фарфоровую пластину и выпарьте. Что наблюдаете?
Получите нерастворимое основание − гидроксид железа (II): налейте в пробирку 1 мл раствора сульфата железа (II) и добавьте к нему 3 − 4 капли раствора гидроксида калия.
Добавьте в пробирку с гидроксидом железа (II)1 − 2 мл соляной кислоты. Что вы наблюдаете? Поместите 1 − 2 капли полученного раствора на стеклянную или фарфоровую пластину и выпарьте. Рассмотрите образовавшиеся кристаллы. Отметьте их цвет. Составьте молекулярные и ионные уравнения проделанных реакций.Ответ:
После добавления фенолфталеина к раствору гидроксида натрия индикатор изменяет цвет с бесцветного на малиновый. Изменение окраски фенолфталеина вызывают гидроксид−ионы $(OH^{-})$.
$NaOH = Na^{+} + OH^{-}$.
При добавлении соляной кислоты протекает реакция нейтрализации (катионы водорода связываются с гидроксид−анионами, образуя воду). Раствор становится бесцветным.
$NaOH + HCl = NaCl + H_{2}O$
$Na^{+} + OH^{-} + H^{+} + Cl^{-} = Na^{+} + Cl^{-}+ H_{2}O $
$H^{+} + OH^{-} = H_{2}O$
После протекания реакции нейтрализации пробирка нагрелась, значит эта реакция экзотермическая.
Если поместить 1—2 капли раствора из пробирки на стеклянную пластину и выпарить, то вода испарится, а на пластине останется хлорид натрия в виде белого налёта.
Для получения гидроксида железа смешаем растворы сульфата железа и гидроксида калия.
$FeSO_{4} + 2KOH = K_{2}SO_{4}+ Fe(OH)_{2}↓$
$Fe^{2+} + SO_{4}^{2-}+ 2К^{+} + 2 ОН^{-} = 2K^{+} + SO_{4}^{2-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} = Fe(OH)_{2}↓ $
Если в пробирку добавить раствор соляной кислоты, осадок растворится.
$Fe(OH)_{2} + 2HCl = FeCl_{2} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + 2 Cl^{-} = Fe^{2+} + 2Cl^{-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} = Fe^{2+} + 2H_{2}O$
Если поместить 1—2 капли раствора из пробирки на стеклянную пластину и выпарить, то вода испарится, а на пластине останутся белые с зеленоватым оттенком кристаллы хлорида железа (II), темнеющие на воздухе.Лабораторный опыт №20
Взаимодействие кислот с оксидами металлов (рис.136).
В пробирку поместите немного (объёмом со спичечную головку) порошка оксида меди (II). Отметьте цвет вещества.
Налейте в пробирку с оксидом меди (II) 1−2 мл раствора серной кислоты. Для ускорения реакции слегка нагрейте (не доводя до кипения) содержимое пробирки. Что наблюдаете?
Поместите на стеклянную пластину 1−2 капли полученного раствора, используя стеклянную палочку или пипетку, и выпарьте его. Что наблюдаете?
Напишите молекулярное и ионные уравнения реакции оксида меди (II) с серной кислотой.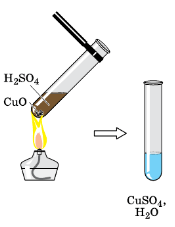
рис. 136. Взаимодействие серной кислоты с оксидом меди (II).Ответ:
В пробирку поместим немного порошка оксида меди (II). Порошок оксида меди (II) имеет черный цвет.
Нальём в пробирку с оксидом меди (II) 1−2 мл раствора серной кислоты. Для ускорения реакции слегка нагреем (не доводя до кипения) содержимое пробирки. Мы видим, что порошок растворяется.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
Поместим на стеклянную пластину 1−2 капли полученного раствора, используя стеклянную палочку или пипетку, и выпарим его. После выпаривания воды из раствора на стекле остаются голубые кристаллы кристаллогидрата сульфата меди (II).
Если продолжить нагревание, то кристаллы станут белого цвета − безводный сульфат меди.Лабораторный опыт №21
Взаимодействие кислот с металлами.
Поместите в четыре пробирки металлы (гранулы или кусочки проволоки): в 1−ю − цинк, во 2−ю − алюминий, в 3−ю − свинец, в 4−ю − медь. Налейте в 1−ю и 3−ю пробирки по 2 мл раствора серной кислоты, а во 2−ю и 4−ю − по 2 мл соляной кислоты.
Сделайте вывод о том, в каких пробирках произошли химические реакции. Сформулируйте вывод о возможности взаимодействия кислот с металлами.Ответ:
Пробирка 1.
$Zn + H_{2}SO4 = ZnSO_{4} + H_{2}↑$
Металл растворился, выделился газ.
Пробирка 2.
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑$
Металл растворился, выделился газ.
Пробирка 3.
$Pb + H_{2}SO_{4}$ ⇸ реакция не идет, т. к. на поверхности свинца образуется пленка из сульфата свинца (II), которая защищает его от дальнейшего взаимодействия с серной кислотой.
Пробирка 4.
Cu + HCl ⇸ реакция не идет, т. к. медь в ряду напряжений металлов стоит после водорода.
Вывод. Взаимодействие кислот с металлами возможно, если металл стоит до водорода в ряду напряжений металлов, и если на поверхности металла не образуется нерастворимой пленки, а продуктами реакции являются соль и водород.Лабораторный опыт №22
Взаимодействие кислот с солями.
В трёх пробирках слейте попарно по 1 − 2 мл растворов веществ: 1−я пробирка − соляной кислоты и силиката натрия; 2−я пробирка − серной кислоты и карбоната калия; 3−я пробирка − соляной кислоты и хлорида или нитрата бария.
Сформулируйте вывод о возможности взаимодействия кислот с солями, вписав пропущенные слова в предложение: «Кислоты взаимодействуют с солями, если в результате реакции образуется ... или ...».Ответ:
Пробирка 1.
$2HCl + Na_{2}SiO_{3} = 2NaCl + H_{2}SiO_{3}↓ $
Пробирка 2.
$H_{2}SO_{4} + K_{2}CO_{3} = K_{2}SO_{4} + H_{2}O + CO_{2}↑ $
Пробирка 3.
$HCl + Ba(NO_{3})_{2} $ ⇸ реакция не идет.
Вывод: Кислоты взаимодействуют с солями, если в результате реакции образуется осадок или газ.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb183.htm
2. https://himi4ka.ru/arhiv−urokov/urok−35−himicheskie−svojstva− kislot.html
3. https://foxford.ru/wiki/himiya/klassifikatsiya−i−nomenklatura−kislot
4. https://obrazovaka.ru/himiya/himicheskie−svoystva−kislot−8−klass.html
5. https://chemege.ru/kisloty/
6. https://multiurok.ru/files/tipichnyie−rieaktsii−kislot−osnovanii−oksidov−soli.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Типичные свойства кислот: взаимодействие их с металлами, оксидами металлов, гидроксидами металлов и солями.
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов.
Важнейшие химические свойства кислот:
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
2. Взаимодействие кислот с основаниями. Эта реакция называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями.
3.Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации.
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
4. Взаимодействие кислот с металлами. Для взаимодействия кислот с металлом должны выполняться некоторые условия: металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам (чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами); кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части ряда напряжения металлов.
5.Взаимодействие с солями. Кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Такие реакции протекают по механизму ионного обмена.?. Вопросы и задания
1. Выберите формулу сильной кислоты:
а) $H_{2}S$;
б) $HNO_{3}$;
в) $H_{2}SiO_{3}$.
Запишите уравнение диссоциации кислоты.Ответ:
б)$HNO_{3}$ − азотная кислота. В водных растворах диссоциируют практически все её молекулы.
$HNO_{3} = H^{+} + NO^{3-}$.2. Дайте характеристику азотистой кислоты, используя различные признаки классификации кислот.
Ответ:
Азотистая кислота ($HNO_{2}$) – кислородосодержащая, одноосновная, растворимая в воде, летучая, слабая и нестабильная кислота.
3. Определите степени окисления элементов в следующих кислотах: хлорной $HClO_{4}$, хромовой $H_{2}CrO_{4}$, двухромовой $H_{2}Cr_{2}O_{7}$, азотистой $HNO_{2}$, пирофосфорной $H_{4}P_{2}O_{7}$.
Ответ:
1.$HClO_{4}$ − хлорная кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления хлора. Пусть степень окисления хлора равна − х.
1 + х + (−2) * 4 = 0,
х = 7.
${\overset{+1}{H}}{\overset{+7}{Cl}}{\overset{-2}{O_{4}}}$
2.$H_{2}CrO_{4}$ − хромовая кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления хрома.Пусть степень окисления хрома равна − х.
1 * 2 + х + (−2) * 4 = 0,
х = 6.
${\overset{+1}{H}}{\overset{+6}{Cr}}{\overset{-2}{O_{4}}}$
3.$H_{2}Cr_{2}O_{7}$ − двухромовая кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления хрома. Пусть степень окисления хрома равна − х.
1 * 2 + х * 2 + (−2) * 7 = 0,
х = 6.
${\overset{+1}{H_{2}}}{\overset{+6}{Cr}}{\overset{-2}{O_{7}}}$
4.$HNO_{2}$ − азотистая кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления азота. Пусть степень окисления азота равна − х.
1 + х + (−2) * 2 = 0,
х = 3.
${\overset{+1}{H}}{\overset{+3}{N}}{\overset{-2}{O_{2}}}$
5.$H_{4}P_{2}O_{7}$ − пирофосфорная кислота.
Водород с неметаллами всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления фосфора. Пусть степень окисления фосфора равна − х.
1 * 4 + х * 2 + (−2) * 7 = 0,
х = 5.
${\overset{+1}{H_{4}}}{\overset{+5}{P_{2}}}{\overset{-2}{O_{7}}}$4. Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения:
а) $ZnO + HNO_{3}$ ⟶
б) $Al + H_{2}SO_{4(разб.)}$ ⟶
в) $HNO_{3} + CuSO_{4}$ ⟶
г) $HCl + FeS$ ⟶
д) $H_{2}SO_{4} + Fe(OH)_{3}$ ⟶
Если реакция не может быть осуществлена, объясните почему.Ответ:
а) $ZnO + 2HNO_{3} = Zn(NO_{3})_{2} + H_{2}O $
$ZnO + 2H^{+} + 2NO^{3-} = Zn^{2+} + 2NO^{3-} + H_{2}O$
$ZnO + 2H^{+} = Zn^{2+} + H_{2}O $
б) $2Al + 3H_{2}SO_{4(разб.)} = Al_{2}(SO_{4})_{3} + 3H_{2}↑ $
$2Al^{3+} + 6H^{+} + 3SO_{4}^{2-} = 2Al^{3+} + 3SO_{4}^{2-} + 3H_{2}↑ $
$2Al^{3+} + 6H^{+} = 2Al^{3+} + 3H_{2}↑ $
в) $HNO_{3} + CuSO_{4} $ ⇸
реакция не идет, т. к. не выделяется газ, не выпадает осадок и не образуется малодиссоциирующее вещество
г) $2HCl + FeS = FeCl_{2} + H_{2}S↑ $
$2H^{+} + 2Cl^{-}+ FeS = Fe^{2+} + 2Cl^{-} + H_{2}S↑ $
$2H^{+} + FeS = Fe^{2+} + H_{2}S↑ $
д) $3H_{2}SO_{4} + 2Fe(OH)_{3} = Fe_{2}(SO_{4})_{3} + 6H_{2}O$
$6H^{+} + 3SO_{4}^{2-} + 2Fe(OH)_{3} = 2Fe^{3+} + 3SO_{4}^{2-} + 6H_{2}O $
$3H^{+} + Fe(OH)_{3} = Fe^{3+} + 3H_{2}O$5. Рассчитайте объём водорода (н. у.), который выделится при растворении в соляной кислоте 120 г магния, содержащего 2,5% примесей.
Ответ:
Дано:
m (Мg + примеси) = 120 г;
ω (примеси) = 2,5%;
_____________
V ($H_{2}$) − ?
Решение:
$Mg + 2HCl = MgCl_{2} + H_{2}↑$;
ω (Mg) = 100 − ω (примеси) = 100 − 2,5 = 97,5% или 0,975;
m (вещ−во) = m (р−ра) * ω;
m (Mg) = m (Мg + примеси) * ω (Mg) = 120 * 0,975 = 117 г;
$n = \frac{m}{M}$;
M (Mg) = 1 * Ar (Mg) = 24 г/моль;
$n (Mg) = \frac{m (Mg)}{M(Mg)} = \frac{117}{24} = 4,875$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{4,875 моль}{Mg}} + 2HCl =MgCl_{2} + \underset{1 моль}{\overset{x}{H_{2}}}$;
$x = n (H_{2}) = \frac{4,875 * 1}{1} = 4,875$ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (H_{2}) = V_{m} * n (H_{2}) = 22,4 * 4,875 = 109,2$ л.
Ответ. 109,2 л.6. Запишите формулы оксидов, соответствующих следующим кислотам: $HNO_{2}, HNO_{3}, H_{3}PO_{4}, H_{2}SO_{3}, H_{2}SO_{4}, H_{2}SiO_{3}$.
Ответ:
Кислота Оксид
$H{\overset{+3}{N}}O_{2}$ ${\overset{+3}{N_{2}}}O_{3}$
$H{\overset{+5}{N}}O_{3}$ $ {\overset{+5}{N_{2}}}O_{5}$
$H_{3}{\overset{+5}{P}}O_{4} $ $ {\overset{+5}{P_{2}}}O_{5} $
$H_{2}{\overset{+4}{S}}O_{3} $ ${\overset{+4}{S}}O_{2} $
$H_{2}{\overset{+6}{S}}O_{4} $ ${\overset{+6}{S}}O_{3} $
$H_{2}{\overset{+4}{Si}}O_{3}$ ${\overset{+4}{ Si}}O_{2}$ §40
-
§40. Основания, их классификация и свойства
Лабораторный опыт №23
Взаимодействие щелочей с кислотами.
Запишите два молекулярных уравнения реакций, сущность которых выражается следующим ионным уравнением: $H^{+} + ОН^{-}= H_{2}O$.
Проведите реакции, уравнения которых вы составили. Вспомните, какие вещества (кроме кислоты и щёлочи) необходимы для наблюдения за этими химическими реакциями.Ответ:
$H^{+} + ОН^{-}= H_{2}O$
$HCl + NaOH = NaCl + H_{2}O$
$2HNO_{3} + Ca(OH)_{2} = Ca(NO_{3})_{2} + 2H_{2}O$
Необходимо использовать индикаторы, которые изменяют свой цвет в зависимости от pH раствора.Лабораторный опыт №24
Взаимодействие щелочей с оксидами неметаллов.
Повторите опыт, который вы проделывали раньше. В пробирку налейте 2 − 3 мл прозрачного раствора известковой воды. Поместите в неё соломинку для сока, которая выполняет роль газоотводной трубки. Осторожно пропускайте через раствор выдыхаемый воздух. Что наблюдаете? Запишите молекулярное и ионное уравнения реакции.Ответ:
В пробирку нальём 2 − 3 мл прозрачного раствора известковой воды. Поместим в неё соломинку для сока. Осторожно пропустим через раствор выдыхаемый воздух, который содержит углекислый газ. При пропускании воздуха через прозрачный раствор известковой воды, наблюдаем помутнение раствора за счет выпадения осадка карбоната кальция.
$Ca(OH)_{2} + CO_{2} = CaCO_{3}↓ + H_{2}O$
$Ca^{2+} + 2OH^{-}+ CO_{2} = CaCO_{3}↓ + H_{2}O$Лабораторный опыт №25
Взаимодействие щелочей с солями.
В трёх пробирках слейте попарно по 1 − 2 мл растворов веществ:
1−я пробирка − гидроксида натрия и хлорида аммония;
2−я пробирка − гидроксида калия и сульфата железа (III);
3−я пробирка − гидроксида натрия и хлорида бария.
Нагрейте содержимое 1−й пробирки и определите по запаху один из продуктов реакции.
Сформулируйте вывод о возможности взаимодействия щелочей с солями.Ответ:
Пробирка 1.
$NaOH + NH_{4}Cl = NaCl + NH_{3}↑ + H_{2}O$
При нагревании происходит выделение аммиака - вещества с характерным запахом.
Пробирка 2.
$6KOH + Fe_{2}(SO_{4})_{3} = 3K_{2}SO_{4} + 2Fe(OH)_{3}↓ $
Пробирка 3.
$NaOH + BaCl_{2}$ ⇸
Таким образом, щелочи взаимодействуют с солями, если в результате реакции образуется осадок, или газ, или малодиссоциирующие вещество.Лабораторный опыт №26
Получение и свойства нерастворимых оснований.
В две пробирки налейте по 1 мл раствора сульфата или хлорида меди (II). В каждую пробирку добавьте по 3 − 4 капли раствора гидроксида натрия. Опишите образовавшийся гидроксид меди (II).
Примечание. Оставьте пробирки с полученным гидроксидом меди (II) для проведения следующих опытов.
Составьте молекулярное и ионные уравнения проведённой реакции. Укажите тип реакции по признаку «число и состав исходных веществ и продуктов реакции».
Добавьте в одну из пробирок с полученным в предыдущем опыте гидроксидом меди (II) 1 − 2 мл соляной кислоты. Что наблюдаете?
Используя пипетку, поместите 1− 2 капли полученного раствора на стеклянную или фарфоровую пластину и, используя тигельные щипцы, выпарьте его. Рассмотрите образующиеся кристаллы. Отметьте их цвет.
Составьте молекулярное и ионные уравнения проведённой реакции. Укажите тип реакции по признаку «число и состав исходных веществ и продуктов реакции», «участие катализатора» и «обратимость химической реакции».
Нагрейте одну из пробирок с полученным ранее или выданным учителем гидроксидом меди (II) (рис. 141).Что наблюдаете?
Составьте уравнение проведённой реакции, укажите условие её протекания и тип реакции по признакам «число и состав исходных веществ и продуктов реакции», «выделение или поглощение теплоты» и «обратимость химической реакции».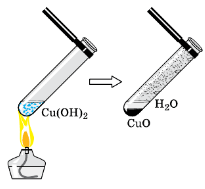
рис. 141. Разложение гидроксида меди (II) при нагревании.Ответ:
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓ $
$Cu^{2+} + SO_{4}^{2-}+ 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
Выпадает синий осадок гидроксида меди (II). Это реакция ионного обмена.
При добавлении соляной кислоты к гидроксиду меди (II) наблюдается растворение осадка:
$2HCl + Cu(OH)_{2} = CuCl_{2} + 2H_{2}O $
$2H^{+} + 2Cl^{-} + Cu(OH)_{2} = Cu^{2+} + 2Cl^{-} + 2H_{2}O$
$2H^{+} + Cu(OH)_{2} = Cu^{2+} + 2H_{2}O$
Эта реакция ионного обмена, необратимая, некаталитическая.
Используя пипетку, поместим 1− 2 капли полученного раствора на стеклянную пластину и, используя тигельные щипцы, выпарим его. При выпаривании раствора образуются кристаллы зеленого цвета, это хлорид меди (II).
При нагревании гидроксида меди (II) наблюдается его почернение, т. к. образуется оксид меди (II):
$Cu(OH)_{2} \overset{t}{=} CuO + H_2O$
Реакция протекает при нагревании. Это реакция разложения, эндотермическая, необратимая.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. http://www.hemi.nsu.ru/ucheb184.htm
2. http://lib.repetitors.eu/himiya/160−2010−07−16−04−24−25/2150−2010−08−21−05−33−37
3. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/osnovaniia−klassifikatciia−svoistva−poluchenie−13717
4. https://himi4ka.ru/arhiv−urokov/urok−37−osnovanija.html2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Типичные свойства оснований: взаимодействие их с кислотами, оксидами неметаллов, солями.
Основания − это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания − это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид−ионы.
Химические свойства.
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид−ионы.
2. Фактически с индикатором взаимодействуют гидроксид−ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Фенолфталеин: бесцветный → малиновый.
Лакмус: фиолетовый → синий.
Метилоранж : оранжевый → жёлтый.
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
4. Щёлочи взаимодействуют с с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. .
5. Щёлочи могут взаимодействовать с растворимыми в воде солями. Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества — щелочь и соль — обмениваются своими составными частями. При этом валентность атомов металлов и кислотных остатков не изменяется. Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).?. Вопросы и задания
1. Выберите сильное основание: $NH_{3}*H_{2}O, Cu(OH)_{2}, KOH$.
Ответ:
Сильным основанием является гидроксид калия КОН. В водном растворе диссоциируют практически все его молекулы.
$КОН = К^{+} + OH^{-}$2. Дайте характеристику гидроксида бария, используя различные признаки классификации оснований.
Ответ:
Гидроксид бария $Ba(OH)_{2}$ – сильное, растворимое, двухкислотное, стабильное основание.
3. Закончите молекулярные уравнения возможных реакций, запишите соответствующие им ионные уравнения:
а) $P_{2}O_{5} + NaOH_{(изб.)}$ ⟶
б) $Fe(OH)_2 + HNO_{3(изб.)}$ ⟶
в) $(NH_{4})_{2}SO_{4} + KOH$ ⟶
г) $Ca(OH)_{2(изб.)} + CO_{2}$ ⟶
д) $Ba(OH)_{2} + Fe(NO_{3})_{3}$ ⟶
е) $KOH + NaNO_{3}$ ⟶
ж) $Mg(OH)_{2} + FeO$ ⟶
з) $CuOH \overset{t}{→}$
Если реакция не будет протекать, укажите причину этого.Ответ:
а) $P_{2}O_{5} + 6NaOH_{(изб.)} = 2Na_{3}PO_{4} + 3H_{2}O$
$P_{2}O_{5} + 6Na^{+} + 6OH^{-} = 6Na^{+} + 2PO_{4}^{3-} + 3H_{2}O$
$P_{2}O5_{5} + 6OH^{-} = 2PO_{4}^{3-} + 3H_{2}O $
б) $Fe(OH)_{2} + 2HNO_{3(изб.)} = Fe(NO_{3})_{2} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + 2NO^{3-} = Fe^{2+} + 2NO^{3-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} = Fe^{2+} + 2H_{2}O $
в) $ (NH_{4})_{2}SO_{4} + 2KOH = K_{2}SO_{4} +2NH_{3}↑ + 2Н_{2}O $
$2NH_{4}^{+} + SO_{4}^{2-} + 2K^{+} + 2OH^{-} = 2K^{+} + SO_{4}^{2-} + 2NH_{3}↑ + 2Н_{2}O $
$NH4^{+} + OH^{-} = NH_{3}↑ + Н_{2}O$
г) $Ca(OH)_{2(изб.)} + CO_{2} = H_{2}O + CaCO_{3}↓ $
$Ca_{2}^{+} + 2OH^{-} + CO_{2} = H_{2}O + CaCO_{3}↓ $
д) $ 3Ba(OH)_{2} + 2Fe(NO_{3})_{3} = 3Ba(NO_{3})_{2} + 2Fe(OH)_{3}↓$
$3Ba^{2+} + 6OH^{-} + 2Fe^{3+} + 6NO^{3-} = 3Ba^{2+} + 6NO^{3-} + 2Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
е) $KOH + NaNO_{3} ⇄ NaOH + KNO_{3}$
Реакция обратимая т. к. не образуется вода, не выделяется газ, не выпадает осадок.
ж) $ Mg(OH)_{2} + FeO$ ⇸
Реакция не идет, т. к. гидроксиды металлов не взаимодействуют с оксидами металлов
з) $2CuOH \overset{t}{=} Cu_{2}O + H_{2}O$4. Вычислите объём аммиака (н.у.), который выделится при взаимодействии нитрата аммония массой 890 г, содержащего 20% примесей, с раствором гидроксида натрия. Какая масса 20%−го раствора щёлочи потребуется для реакции?
Ответ:
Дано:
m ($NH_{4}NO_{3}$ + присмеси) = 890 г;
ω (примеси) = 20 %;
ω (NaOH) = 20 %;
_____________
V ($NH_{3}$) − ?
$m_{р-ра}(NaOH)$ − ?
Решение:
$NH_{4}NO_{3} + NaOH = NaNO_{3} + H_{2}O + NH_{3}$ ↑;
$ω(NH_{4}NO_{3}) = 100 − ω (примеси) = 100 − 20 = 80$ % или 0,8;
m (вещ−во) = m (р−ра) * ω;
$m (NH_{4}NO_{3}) = m (NH_{4}NO_{3} + примеси) * ω (NH_{4}NO_{3}) = 890 * 0,8 = 712$ г;
$n = \frac{m}{M}$;
M ($NH_{4}NO_{3}$) = 1 * Ar (N) + 4 * Ar (H) + 1 * Ar (N) + 3 * Ar (O) = 1 * 14 + 4 * 1 + 1 * 14 + 3 * 16 = 80 г/моль;
$n (NH_{4}NO_{3}) = \frac{m (NH_{4}NO_{3})}{M(NH_{4}NO_{3})} = \frac{712}{80} = 8,9$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{8,9 моль}{NH_{4}NO_{3}}} + \underset{1 моль}{\overset{x}{NaOH}} =NaNO_{3} + H_{2}O+ \underset{1 моль}{\overset{y}{NH_{3}}}↑$;
$x = n (NaOH) = \frac{8,9 * 1}{1} = 8,9 $ моль;
$y = n (NH_{3}) = \frac{8,9 * 1}{1} = 8,9 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (NH_{3}) = V_{m} * n (NH_{3}) = 22,4 * 8,9 = 199,36 $ л.
m = n * M;
M (NaOH) = 1 * Ar (Nа) + 1 * Ar (O) + 1 * Ar (H) = 1 * 23 + 1 * 16 + 1 * 1 = 40 г/моль;
m (NaOH) = n (NaOH) * M (NaOH) = 8,9 * 40 = 356 г;
$ m (р-р) =\frac{m (в-во)}{ω (вещ-во)}$
$m_{р-ра}(NaOH) = \frac{m (NaOH)}{ω (NaOH)} = \frac{356}{20} * 100% = 1780$ г = 1,78 кг.
Ответ. 199,36 л; 1,78 кг.5. Запишите формулы оксидов, которые соответствуют гидроксидам: $Cu(OH)_{2}, CuOH, Fe(OH)_{2}, NaOH$.
Назовите все веществаОтвет:
Гидроксид Оксид
$Cu(OH)_{2}$ − гидроксид меди (II) CuO − оксид меди (II)
CuOH − гидроксид меди (I) $Cu_{2}O$ − оксид меди (I)
$Fe(OH)_{2}$ − гидроксид железа (II) FeO − оксид железа (II)
NaOH − гидроксид натрия $Na_{2}O$ − оксид натрия6. Составьте уравнения реакций, характеризующих химические свойства:
а) гидроксида калия;
б) гидроксида железа (II).Ответ:
а) Гидроксид калия KOH − сильное основание, щелочь.
1) реакция с кислотным оксидом (образуется соль):
$2KOH + SO_{2} ⟶ K_{2}SO_{3} + H_{2}O $
2) реакция с кислотой. При добавлении соляной кислоты протекает реакция нейтрализации, ионы $Н^{-}$ связываются с ионами $H^{+}$, образуя воду.
$KOH + HCl ⟶ KCl + H_{2}O $
3) обменная реакция с солью (образуется осадок или газ):
$2KOH + CuSO_{4} ⟶ K_{2}SO_{4} + Cu(OH)_{2}↓ $
4) при добавлении к гидроксиду калия фенолфталеин раствор окрашивается в малиновый цвет, указывая на наличие $ОН^{-}$ ионов и щелочную среду:
$KOH ⟶ K^{+} + OH^{-}$
б) Гидроксид железа (II) $Fe(OH)_{2}$ – слабое основание, щелочь
1) реакция с кислотным оксидом:
$3Fe(OH)_{2} + P_{2}O_{5} ⟶ Fe_{3}(PO_{4})_{2} + 3H_{2}O $
2) реакция с кислотой:
$Fe(OH)_{2} + H_{2}SO_{4} ⟶ FeSO_{4} + 2H_{2}O $
3) обменная реакция с солью:
$Fe(OH)_{2} + CuSO_{4} ⟶ FeSO_{4} + Cu(OH)_{2} $
4) разложение при нагревании:
$Fe(OH)_{2} \overset{t}{⟶} FeO + H_{2}O$
5) со временем светло−зеленый осадок $Fe(OH)_{2}$ темнеет, так как в присутствии кислорода происходит окисление железа до степени окисления +3:
$4Fe(OH)_{2} ⟶ FeO + H_{2}O$ §41
-
§41. Оксиды, их классификация и свойства
Лабораторный опыт №27
Взаимодействие основных оксидов с кислотами.
В пробирку поместите немного (объёмом со спичечную головку) порошка оксида меди (II). Отметьте его цвет. Налейте в пробирку с оксидом меди (II) 1 − 2 мл раствора серной кислоты. Для ускорения реакции слегка нагрейте содержимое пробирки. Что наблюдаете? Поместите на стеклянную или фарфоровую пластину 1 − 2 капли полученного раствора, используя стеклянную палочку или пипетку, и выпарьте его. Что образовалось на стеклянной пластине? Напишите молекулярное и ионные уравнения реакций между оксидом меди (II) и серной кислотой.Ответ:
В пробирку поместим немного порошка оксида меди (II). Оксид меди (II) имеет черный цвет. Нальём в пробирку с оксидом меди (II) 1 − 2 мл раствора серной кислоты. Для ускорения реакции слегка нагреем содержимое пробирки. При нагревании наблюдается растворение оксида меди (II) и окрашивание раствора в синий цвет.
$CuO + H_{2}SO_{4} ⟶ CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} ⟶ Cu2^{+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} ⟶ Cu^{2+} + H_{2}O$
Поместим на стеклянную пластину 1 − 2 капли полученного раствора и выпарим его. После выпаривания полученного раствора образуются кристаллы синего цвета, это сульфат меди (II).Лабораторный опыт №28
Взаимодействие осно́вных оксидов с водой.
Налейте в две пробирки по 2 − 3 мл дистиллированной воды. Добавьте в каждую пробирку по 2 − 3 капли раствора фенолфталеина.
Поместите в 1−ю пробирку немного (не более половины спичечной головки) оксида кальция, а во 2−ю− оксида меди (II).
Перемешайте содержимое пробирок. Что наблюдаете?
Составьте возможные молекулярные и ионные уравнения проведённых реакций.
Сформулируйте вывод о взаимодействии осно́вных оксидов с водой.Ответ:
В пробирке с оксидом кальция наблюдается окрашивание раствора фенолфталеина в малиновый цвет, потому что в результате реакции оксида кальция с водой образуются гидроксид−ионы
$CaO + H_{2}O = Ca(OH)_{2}$
$CaO + H_{2}O = Ca + 2OH^{-} $
В пробирке с оксидом меди (II) не наблюдается изменение цвета раствора.
$CuO + H_{2}O$ ⇸
Таким образом, основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочь.
Основные оксиды других металлов не взаимодействуют с водой.Лабораторный опыт №29
Взаимодействие кислотных оксидов с щелочами.
Налейте в пробирку 2 мл известковой воды. Опишите раствор. Используя трубку с тонко оттянутым концом, продуйте через известковую воду в пробирке выдыхаемый вами воздух. Что наблюдаете? Составьте молекулярные и ионные уравнения реакции. В чём сущность реакции щёлочи с кислотным оксидом?Ответ:
В пробирку нальём 2 − 3 мл известковой воды. Это мутный раствор, поскольку гидроксид кальция плохо растворим в воде. Поместим в пробирку трубку с тонко оттянутым концом. Осторожно пропустим через раствор выдыхаемый воздух, который содержит углекислый газ. При пропускании воздуха через известковую воду, наблюдаем еще большее помутнение раствора из-за выпадения карбоната кальция в виде белого осадка.
$Ca(OH)_{2} + CO_{2} ⟶ CaCO_{3}↓ + H_{2}O$
$Ca^{2+} + 2OH^{-}+ CO_{2} ⟶ CaCO_{3}↓ + H_{2}O$
В результате реакции щёлочи с кислотным оксидом образуется соль и вода (реакция обмена).Лабораторный опыт №30
Взаимодействие кислотных оксидов с водой.
Налейте в 1−ю пробирку 2 − 3 мл дистиллированной воды, а во 2−ю − газированную воду (раствор оксида углерода (IV) в воде). Поместите в 1−ю пробирку немного (на кончике шпателя) оксида кремния (IV). Добавьте в каждую пробирку по 2 − 3 капли раствора лакмуса. Перемешайте содержимое пробирок. Что наблюдаете? Составьте молекулярные уравнения проведённых реакций. Сформулируйте вывод о взаимодействии кислотных оксидов с водой.Ответ:
После добавления раствора лакмуса в пробирку с дистиллированной водой и оксидом кремния (IV), цвет индикатора не изменяется.
$SiO_{2} + H_{2}O$ ⇸
После добавления раствора лакмуса в пробирку с газированной водой (раствором оксида углерода (IV) в воде), цвет индикатора изменился на красный, т. к. в результате реакции оксида углерода (IV) и воды образуется угольная кислота:
$CO_{2} + H_{2}O ⇄ H_{2}CO_{3}$
Таким образом, кислотные оксиды взаимодействуют с водой (за исключением $SiO_{2}$) с образованием кислоты.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/oksidy−klassifikatciia−svoistva−poluchenie−13609
2. http://www.hemi.nsu.ru/ucheb182.htm
3. https://himi4ka.ru/arhiv−urokov/urok−32−himicheskie−svojstva−oksidov.html
4. https://ru.wikipedia.org/wiki/Солеобразующие_оксиды
5. http://ddutvyborg.spb.ru/wp−content/uploads/2017/06/Oxidy.pdf
6. https://blog.tutoronline.ru/oksidy−klassifikacija−i−himicheskie−svojstva
7. https://foxford.ru/wiki/himiya/oksidy2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Типичные свойства основных оксидов: взаимодействие их с кислотами, кислотными оксидами и водой.
Основные оксиды − солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2. К ним относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Химические свойства.
1. Могут взаимодействовать с водой с образованием соответствующих гидроксидов. В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп Периодической таблицы.
2. Взаимодействуют с кислотами с образованием соли и воды. В образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
3. Взаимодействуют с кислотными оксидами с образованием соли.В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. В состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию.
4. Многие основные оксиды могут восстанавливаться до простых веществ.
5. Оксиды благородных металлов и ртути разлагаются при нагревании.?. Вопросы и задания
1. Из перечня выпишите формулы осно́вных и кислотных оксидов и запишите соответствующие им формулы оснований и кислот:
$SiO_{2}, CrO_{3}, MgO, Mn_{2}O_{7}, Cu_{2}O, SO_{2}, FeO, N_{2}O_{3}, K_{2}O, NiO, Na_{2}O, NO, BaO$.
Назовите все вещества.Ответ:
Основные оксиды и основания.
Основные оксиды Основания
MgO − оксид магния $ Mg(OH)_{2}$ − гидроксид магния
$Cu_{2}O$ − оксид меди (I) CuOH − гидроксид меди (I)
FeO− оксид железа (II) $Fe(OH)_{2}$ − гидроксид железа (II)
$K_{2}O $ − оксид калия KOH − гидроксид калия
NiO − оксид никеля (II) $Ni(OH)_{2} $− гидроксид никеля (II)
$Na_{2}O$ − оксид натрия NaOH − гидроксид натрия
BaO − оксид бария $Ba(OH)_{2}$ − гидроксид бария
Кислотные оксиды и кислоты.
Кислотный оксид Кислота
$ SiO_{2}$ − оксид кремния (IV) $H_{2}SiO_{3}$ − кремниевая кислота
$CrO_{3} $ − оксид хрома (VI) $ H_{2}CrO_{4}$ − хромовая кислота
$Mn_{2}O_{7}$ − оксид марганца (VII) $ HMnO_{4}$ − марганцовая кислота
$SO_{2} $ − оксид серы (IV) $ H_{2}SO_{3}$ − сернистая кислота
$N_{2}O_{3} $ − оксид азота (III) $HNO_{2}$ − азотистая кислота
NO − оксид азота (II) несолеобразующий оксид2. Дайте характеристику химических свойств оксида серы (IV). Запишите уравнения характерных реакций.
Ответ:
Оксид серы (IV) – кислотный оксид.
1) Растворяется в воде с образованием слабой и неустойчивой сернистой кислоты:
$SO_{2} + H_{2} ⇄ H_{2}SO_{3}$
2) С основными оксидами образует сульфиты:
$SO_{2} + CaO = CaSO_{3} $
3) С щелочами образует сульфиты:
$ SO_{2} + 2NaOH = Na_{2}SO_{3} + H_{2}O$
4) Окислительно−восстановительные реакции:
$5SO_{2} + 2KMnO_{4} + 2 H_{2}O = MnSO_{4} + K_{2}SO_{4} + 2H_{2}SO_{4}$3. Допишите уравнения возможных химических реакций:
а) $Fe_{2}O_{3} + H_{2}O$ ⟶
б) $KOH_{(изб.)} + P_{2}O_{5}$ ⟶
в) $BaO + HNO_{3}$ ⟶
г) $CaO + SiO_{2}$ ⟶
д) $Na_{2}O + N_{2}O_{5}$ ⟶
е) $N_{2}O + NaOH$ ⟶
Если реакция не протекает, укажите причину.Ответ:
а) $Fe_{2}O_{3} + H_{2}O$ ⇸ реакция не идёт, т. к. образуется нерастворимое основание $Fe(OH)_{3}$
б) $KOH_{(изб.)} + P_{2}O_{5} ⟶ 2K_{3}PO_{4} + 3H_{2}O $
в) $BaO + HNO_{3} ⟶ Ba(NO_{3})_{2} + H_{2}O $
г) $CaO + SiO_{2} ⟶ CaSiO_{3} $
д) $Na_{2}O + N_{2}O_{5} ⟶ 2NaNO_{3}$
е) $N_{2}O + NaOH$ ⇸ реакция не идёт, т. к. $N_{2}O$ несолеобразующий оксид4. В воде объёмом 420 мл растворили оксид серы (VI) массой 40 г. Вычислите массовую долю серной кислоты в полученном растворе.
Ответ:
Дано:
V ($H_{2}O$) = 420 мл;
m ($SO_{3}$) = 40 г;
_____________
ω ($H_{2}SO_{4}$) − ?
Решение:
$SO_{3}+H_{2}O = H_{2}SO_{4}$;
$n = \frac{m}{M}$;
M ($SO_{3}$) = 1 * Ar (S) + 3 * Ar (O) = 1 * 32 + 3 * 16 = 80 г/моль;
$n (SO_{3}) = \frac{m (SO_{3})}{M(SO_{3})} = \frac{40}{80} = 0,5$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{0,5 моль}{SO_{3}}} +H_{2}O = \underset{1 моль}{\overset{x}{H_{2}SO_{4}}}$;
$x = n ( H_{2}SO_{4}) = \frac{0,5 * 1}{1} = 0,5 $ моль;
m = n * M;
M ($H_{2}SO_{4}$) = 2 * Ar (H) + 1 * Ar (S) + 4 * Ar (O) = 2 * 1 + 1 * 32 + 4 * 16 = 98 г/моль;
$m (H_{2}SO_{4}) = n (H_{2}SO_{4}) * M (H_{2}SO_{4}) = 0,5 * 98 = 49$ г;
Допустим, ρ ($H_{2}O$) = 1 г/мл,
m = ρ * V;
$m (H_{2}O) = ρ (H_{2}O) * V(H_{2}O) = 1 * 420 = 420$ г;
$m (р-ра) = m (SO_{3}) + m (H_{2}O) = 40 + 420 = 460$ г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω (H_{2}SO_{4}) =\frac{m(H_{2}SO_{4})}{m (р-ра) } = \frac {49}{460} * 100 = 10,7$ %.
Ответ. 10,7 %5. Вычислите объём углекислого газа (н.у.), который образуется при обжиге известняка массой 500 г, содержащего 20% примесей. Вычислите количество вещества оксида кальция, образующегося при этом.
Ответ:
Дано:
m ($CaCO_{3}$ + примеси) = 500 г;
ω (примеси) = 20%
_____________
V ($CO_{2}$) − ?
n (CaO) − ?
Решение:
$CaCO_{3} = CaO + CO_{2} ↑$
ω($CaCO_{3}$) = 100 − ω (примеси) = 100 − 20 = 80 % или 0,8;
m (вещ−во) = m (р−ра) * ω;
$m (CaCO_{3}) = m (CaCO_{3} + примеси) * ω (CaCO_{3}) = 500 * 0,8 = 400$ г;
$n = \frac{m}{M}$;
M ($CaCO_{3}$) = 1 * Ar (Ca) + 1 * Ar (C) + 3 * Ar (O) = 1 * 40 + 1 * 12 + 3 * 16 = 100 г/моль;
$n (CaCO_{3}) = \frac{m (CaCO_{3})}{M(CaCO_{3})} = \frac{400}{100} = 4$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{4 моль}{CaCO_{3} }} = \underset{1 моль}{\overset{x}{CaO}} + \underset{1 моль}{\overset{y}{CO_{2}}}↑$;
$x = n (CaO) = \frac{4 * 1}{1} = 4 $ моль;
$y = n (CO_{2}) = \frac{4 * 1}{1} = 4 $ моль;
$V = V_{m} * n$;
$V_{m}$= 22,4 л/моль;
$V (CO_{2}) = V_{m} * n (CO_{2}) = 22,4 * 4 = 89,6 $ л.
Ответ. 89,6 л; 4 моль. §42
-
§42. Соли, их классификация и свойства
Лабораторный опыт №31
Взаимодействие солей с кислотами.
В трёх пробирках слейте попарно по 1 − 2 мл растворов:
1−я пробирка − силиката натрия и серной кислоты;
2−я пробирка − карбоната натрия и азотной кислоты;
3−я пробирка − нитрата натрия и серной кислоты.
Составьте молекулярные и ионные уравнения проведённых реакций.
Ответьте на вопрос: при каких условиях соли взаимодействуют с кислотами?Ответ:
Пробирка 1.
$Na_{2}SiO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}SiO_{3}↓ $
$2Na^{+} + SiO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}SiO_{3}↓$
$2H^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}↓ $
Пробирка 2.
$Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + CO_{2}↑ $
$2Na^{+} + CO_{3}^{2-} + 2H^{+} + 2NO^{3-} = 2Na^{+} + 2NO^{3-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑$
Пробирка 3.
$NaNO_{3} + H_{2}SO_{4}$ ⇸
Соли взаимодействуют с кислотами, если в результате реакции образуется осадок или газ.Лабораторный опыт №32
Взаимодействие солей с щелочами.
В трёх пробирках слейте попарно по 1 − 2 мл растворов веществ:
1−я пробирка — сульфата железа (III) и гидроксида натрия;
2−я пробирка — сульфата аммония и гидроксида калия;
3−я пробирка — нитрата бария и гидроксида калия.
Немного нагрейте содержимое 2−й пробирки и определите по запаху один из продуктов реакции.
Ответьте на вопрос: при каких условиях соли взаимодействуют с щелочами?Ответ:
Пробирка 1.
$Fe_{2}(SO_{4})_{3} + 6NaOH = 3Na_{2}SO_{4} + 2Fe(OH)_{3}↓$
$2Fe^{3+} + 3SO_{4}^{2-} + 6Na^{2+} + 6OH^{-} = 6Na^{+} + 3SO_{4}^{2-} + 2Fe(OH)_{3}↓$
$Fe3^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
Пробирка 2.
$(NH_{4})_{2}SO_{4} + 2KOH = K_{2}SO_{4} + 2NH_{3}↑ + 2H_{2}O$
$2NH^{4+} + SO_{4}^{2-} + 2K^{+} + 2OH^{-} = 2K^{+} + SO_{4}^{2-} + 2NH_{3}↑ + 2H_{2}O $
$NH_{4}^{+} + OH^{-} = NH_{3}↑ + H_{2}O $
При нагревании содержимого 2−й пробирки чувствуется запах аммиака.
Пробирка 3.
$Ba(NO_{3})_{2} + KOH$ ⇸
Соли взаимодействуют с щелочами, если в результате реакции образуется осадок, или газ, или малодиссоциирующие соединение.Лабораторный опыт №33
Взаимодействие солей с солями.
Проведите качественные реакции, подтверждающие состав хлорида железа (III), используя в качестве реактивов только соли. Составьте молекулярные и ионные уравнения проведённых реакций.Ответ:
Реакция, подтверждающая, что в составе соли имеется катион железа (III): $FeCl_{3} + Na_{3}PO_{4} ⟶ 3NaCl + FePO_{4}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + PO_{4}^{3-} ⟶ 3Na^{+} + 3Cl^{-} + FePO_{4}↓$
$Fe^{3+} + PO_{4}^{3-} ⟶ FePO_{4}↓$
В результате реакции образуется желтоватый осадок.
Реакция подтверждающая, что в составе соли имеются хлорид−анионы:
$FeCl_{3} + 3AgNO_{3} ⟶ Fe(NO_{3})_{3} + 3AgCl↓$
$Fe^{3+} + 3Cl^{-} + 3Ag^{+} + 3NO^{3-} ⟶ Fe^{3+} + 3NO_{3}^{-} + 3AgCl↓ $
$Ag^{+} + Cl^{-} ⟶ AgCl↓ $
В результате реакции образуется белый творожистый осадок.Лабораторный опыт №34
Взаимодействие растворов солей с металлами.
Возьмите три пробирки.
В 1−ю пробирку поместите кусочек железной проволоки (скрепку), во 2−ю − свинцовую пластину, а в 3−ю — медную проволоку.
Налейте в 1−ю и во 2−ю пробирки по 2—3 мл раствора сульфата меди (II), а в 3−ю — раствор сульфата железа (II).
Через 5 минут извлеките с помощью пинцета металлические предметы из растворов и рассмотрите их.
Составьте уравнения реакций в молекулярной и ионной формах.
Сделайте вывод о том, в какой из пробирок произошла химическая реакция.
Сделайте вывод об условиях, при которых растворы солей взаимодействуют с металлами.Ответ:
Пробирка 1.
$Fe + CuSO_{4} = FeSO_{4} + Cu↓$
$Fe + Cu^{2+} + SO_{4}^{2-} = Fe^{2+} + SO_{4}^{2-} + Cu↓ $
$Fe + Cu^{2+} = Fe^{2+} + Cu↓$
Пробирка 2.
$Pb + CuSO_{4} $ ⇸
Пробирка 3.
$Cu + FeSO_{4} $ ⇸
Реакция протекает в 1−й пробирке, железная проволока покрывается красноватым налётом меди.
Во второй пробирке реакция не протекает, т. к. на поверхности свинца образуется пленка из сульфата свинца (II), которая защищает его от дальнейшего взаимодействия с сульфатом меди (II).
В третьей пробирке реакция не протекает, т. к. медь в ряду напряжений металлов стоит левее железа.
Таким образом, взаимодействие солей с металлами возможно, если металл более активный, чем вытесняемый из соли металл, и если на поверхности металла не образуется нерастворимой плёнки.i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/soli−sostav−i−svoistva−15178
2. http://www.hemi.nsu.ru/ucheb188.htm
3. https://himi4ka.ru/arhiv−urokov/urok−40−himicheskie−svojstva−solej.html
4. https://foxford.ru/wiki/himiya/himicheskie−svoystva−soley
5. http://www.hemi.nsu.ru/text187.htm2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Типичные свойства средних солей: взаимодействие их с кислотами, щелочами, другими солями и металлами.
Солями называют сложные вещества, состоящие из металлических элементов и кислотных остатков.
С точки зрения теории электролитической диссоциации, солями называют электролиты, которые, диссоциируя, образуют положительно заряженные ионы (катионы) металла (или аммония) и отрицательно заряженные ионы (анионы) кислотного остатка.
Химические свойства.
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный. Образующиеся в этих реакциях менее активные металлы осаждаются на поверхности более активных металлов в виде рыхлой корочки. Если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей пленки.
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную. Соль реагирует в растворе с кислотой лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Валентность атомов металлов и кислотных остатков не изменяется.
4. Растворимые в воде соли могут взаимодействовать со щелочами.
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).Валентность атомов металлов, гидроксогрупп и кислотных остатков не изменяется.
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.Валентность атомов металлов и кислотных остатков не изменяется.
6. Некоторые соли при нагревании разлагаются.
Разложение солей может происходить:
− без изменения степени окисления элементов;
− с изменением степени окисления элементов (то есть, протекают окислительно−восстановительные реакции).?. Вопросы и задания
1. Из перечня формул выпишите отдельно формулы средних, кислых и осно́вных солей, дайте их названия и запишите уравнения их диссоциации:
$Ca(HSO_{4})_{2}, (CaOH)_{2}SO_{4}, Ca(NO_{3})_{2}, NaH_{2}PO_{4}, Na_{3}PO_{4}, MgOHNO_{3}$.Ответ:
Средние соли:
$Ca(NO_{3})_{2} $− нитрат кальция
$Ca(NO_{3})_{2} ⟶ Ca^{2+} + 2NO^{3-} $
$Na_{3}PO_{4}$ − фосфат натрия
$Na_{3}PO_{4} ⟶ 3Na^{+} + PO_{4}^{3-}$
Кислые соли:
$Ca(HSO_{4})_{2} $− гидросульфат кальция
$Ca(HSO_{4})_{2} ⟶ Ca^{2+} + 2HSO^{4-} $
$NaH_{2}PO_{4} $− дигидрофосфат натрия
$NaH_{2}PO_{4} ⟶ Na^{+} + H_{2}PO_{4}^{-}$
Основные соли:
$(CaOH)_{2}SO_{4} $− гидроксосульфат кальция
$(CaOH)_{2}SO_{4} ⟶ 2CaOH^{+} + SO_{4}^{2-}$
$MgOHNO_{3}$ − гидроксонитрат магния
$MgOHNO_{3} ⟶ MgOH^{+} + NO_{3}^{-}$2. Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
а) $HCl + Na_{2}SO_{4}$ ⟶
б) $H_{3}PO_{4} + CaCl_{2}$ ⟶
в) $FeCl_{3} + AgNO_{3}$ ⟶
г) $KNO_{3} + NaCl$ ⟶
д) $NaOH + FeS$ ⟶
е) $KOH + Al_{2}(SO_{4})_{3}$ ⟶
ж) $Ca + CuCl_{2}$ ⟶
з) $Cu + AgNO_{3}$ ⟶
и) $Mg + ZnS$ ⟶
к) $Cu + Fe(NO_{3})_{2}$⟶
Если реакция не может быть осуществлена, объясните почему.Ответ:
а) $2HCl + Na_{2}SO_{4} ⇄ 2NaCl + H_{2}SO_{4}$
Реакция обратима, т.к. все реагенты растворимы.
Реакция не идет, т. к.не образуется вода, не выделяется газ, и не выпадает осадок.
б) $2H_{3}PO_{4} + 3CaCl_{2} = 6HCl + Ca_{3}(PO_{4})_{2}$↓
$6H^{+} + 2PO_{4}^{3-} + 3Ca^{2+} + 6Cl^{-} = 6H^{+} + 6Cl^{-} + Ca_{3}(PO_{4})_{2}↓$
$3Ca^{2+} + 2PO_{4}^{3-} = Ca_{3}(PO_{4})_{2}↓$
в) $FeCl_{3} + 3AgNO_{3} = Fe(NO_{3})_{3} + 3AgCl↓$
$Fe^{3+} + 3Cl^{-} + 3Ag^{+} + 3NO_{3}^{-} = Fe^{3+} + 3NO_{3}^{-} + 3AgCl↓$
$Ag^{+} + Cl^{-} = AgCl↓$
г) $KNO_{3} + NaCl = NaNO_{3} + KCl$
Реакция обратима, т.к. все соли растворимы.
Реакция не идет, т. к.не образуется вода, не выделяется газ, и не выпадает осадок.
д) NaOH + FeS ⇸ реакция не идет, т. к. FeS − сульфид железа (II) растворим только в кислотах.
е) $6KOH + Al_{2}(SO_{4})_{3} = 3K_{2}SO_{4} + 2Al(OH)_{3}↓$
$6K^{+} + 6OH^{-} + 2Al^{3+} + 3SO_{4}^{2-} = 6K^{+} + 3SO_{4}^{2-} + 2Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} = Al(OH)_{3}↓$
ж) $Ca + CuCl_{2} = CaCl_{2} + Cu↓$
Реакция не идёт, т.к. $СuCl_{2}$ и $CaCl_{2}$ распадаются, а ионы Ca и Cu после обмена не могут давать никаких реакций.
з) $Cu + 2AgNO_{3} = Cu(NO_{3})_{2} + 2Ag↓$
$Cu + 2 Ag^{+} + 2NO_{3}^{-} = Cu^{2+} + 2NO_{3}^{-} + 2 Ag ↓$
$Cu+ 2 Ag^{+} = Cu^{2+} + 2 Ag ↓$
и) Mg + ZnS ⇸ реакция не идет, т. к. ZnS (сульфид цинка (II)) – нерастворимая соль, MgS в растворе не существует.
к) $Cu + Fe(NO_{3})_{2}$ ⇸ медь не может вытеснить железо, т. к. в электрохимическом ряду напряжений металлов Cu правее Fe, поэтому реакция не идет.3. К 5%−му раствору серной кислоты массой 980 г прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.
Ответ:
Дано:
m (р−ра) = 980 г;
ω ($H_{2}SO_{4}$) = 5% = 0,05.
_____________
m($BaSO_{4}$) − ?
Решение:
$H_{2}SO_{4}+Ba(NO_{3})_{2(изб.)} = 2HNO_{3} + BaSO_{4}$↓
m (вещ−во) = m (р−ра) * ω;
$m (H_{2}SO_{4}) = m (р-ра) * ω (H_{2}SO_{4}) = 980 * 0,05 = 49$ г;
$n = \frac{m}{M}$;
M ($H_{2}SO_{4}$) = 2 * Ar (H) + 1 * Ar (S) + 4 * Ar (O) = 2 * 1 + 1 * 32 + 4 * 16 = 98 г/моль;
$n (H_{2}SO_{4}) = \frac{m (H_{2}SO_{4})}{M (H_{2}SO_{4})} = \frac{49}{98} = 0,5$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{0,5 моль}{H_{2}SO_{4}}} +Ba(NO_{3})_{2(изб.)} = 2HNO_{3} + \underset{1 моль}{\overset{x}{BaSO_{4}}}↑$;
$x = n (BaSO_{4}) = \frac{0,5 * 1}{1} = 0,5 $ моль;
m = n * M;
M ($BaSO_{4}$) = 1 * Ar (Ba) + 1 * Ar (S) + 4 * Ar (O) = 1 * 137 + 1 * 32 + 4 * 16 = 233 г/моль;
$m (BaSO_{4}) = n (BaSO_{4}) * M (BaSO_{4}) = 0,5 * 233 = 116,5$ г.
Ответ.116,5 г.4. Запишите уравнения реакций всех возможных способов получения сульфата железа (II).
Ответ:
Способы получения сульфата железа (II) $FeSO_{4}$
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}↑$
$Fe(OH)_{2} + H_{2}SO_{4} = FeSO_{4} + 2H_{2}O$
$FeO + H_{2}SO_{4} = FeSO_{4} + H_{2}O$
$FeS + H_{2}SO_{4} = FeSO_{4} + H_{2}S↑ $
$FeCO_{3} + H_{2}SO_{4} = FeSO_{4} + H_{2}O + CO_{2}↑$
$FeCl_{2} + Ag_{2}SO_{4(разб.)} = FeSO_{4} + 2AgCl↓$
$CuSO_{4} + Fe = FeSO_{4} + Cu↓ $5. Определите степени окисления элементов в солях, формулы которых:
$Na_{2}SO_{4}, K_{2}SO_{3}, Fe(NO_{3})_{3}, Fe(NO_{2})_{2}, Mg(HCO_{3})_{2}, Ca_{3}(PO_{4})_{2}, NaHSO_{4}, CuOHNO_{3}$.
Дайте названия солейОтвет:
1.$Na_{2}SO_{4}$ − сульфат натрия.
Натрий в соединениях всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления серы. Пусть степень окисления серы равна − х.
1 * 2 + х + (−2) * 4 = 0,
х = 6.
${\overset{+1}{Na_{2}}}{\overset{+6}{S}}{\overset{-2}{O_{4}}}$.
2.$K_{2}SO_{3}$ − сульфит калия.
Калий в соединениях всегда проявляет степень окисления +1, кислород в сложных соединениях всегда проявляет степень окисления −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления серы. Пусть степень окисления серы равна − х.
1 * 2 + х + (−2) * 3 = 0,
х =4.
${\overset{+1}{K_{2}}}{\overset{+4}{S}}{\overset{-2}{O_{3}}}$.
3.$Fe(NO_{3})_{3}$ − нитрат железа (III).
Нитрат − это остаток азотной кислоты $HNO_{3}$. Степень окисления водородов в кислотах всегда +1. Степень окисления кислородов в кислотах всегда −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления азота.
Пусть степень окисления азота равна − х.
1 * 1 + х + (−2) * 3 = 0,
х =5
Степень окисления азота +5.
Азотная кислота имеет 1 атом водорода, значит суммарный заряд 3 остатков кислоты равен −1 * 3 = − 3. Чтобы молекула была нейтральной, суммарный положительный заряд должен быть равен +3, значит и степень окисления железа равна +3.
${\overset{+3}{Fe}}({\overset{+5}{N}}{\overset{-2}{O_{3}})_{3}}$.
4.$Fe(NO_{2})_{2}$ − нитрит железа (II).
Нитрит − это остаток азотистой кислоты $HNO_{2}$. Степень окисления водородов в кислотах всегда +1. Степень окисления кислородов в кислотах всегда −2. Молекула электронейтральная, исходя из этого, вычислим степень окисления азота.
Пусть степень окисления азота равна − х.
1 * 1 + х + (−2) * 2 = 0,
х =3
Степень окисления азота +3.
Азотистая кислота имеет 1 атом водорода, значит суммарный заряд 2 остатков кислоты равен −1 * 2 = − 2. Чтобы молекула была нейтральной, суммарный положительный заряд должен быть равен +2, значит и степень окисления железа равна +2.
${\overset{+2}{Fe}}({\overset{+3}{N}}{\overset{-2}{O_{2}})_{2}}$.
5.$Mg(HCO_{3})_{2}$ − гидрокарбонат магния.
Углерод в карбонат − анионах всегда проявляет степень окисления +4, кислород в сложных соединениях всегда проявляет степень окисления −2, водород в соединениях с неметаллами всегда проявляет степень окисления +1, магний в соединениях проявляет степень окисления +2.
${\overset{+2}{Mg}}({\overset{+1}{H}}{\overset{+4}{C}}\overset{-2}{O_{3})_{2}}$.
6.$Ca_{3}(PO_{4})_{2}$ − фосфат кальция.
Фосфор в фосфат − анионах всегда проявляет степень окисления +5, кислород в соединениях всегда проявляет степень окисления −2, кальций в соединениях всегда проявляет степень окисления +2.
${\overset{+2}{Са_{3}}}({\overset{+5}{P}}{\overset{-2}{O_{4}})_{2}}$.
7. $NaHSO_{4}$ − гидросульфат натрия.
Сера в нитрат − анионах проявляет степень окисления +6, кислород в сложных соединениях всегда проявляет степень окисления −2, натрий проявляет степень окисления +1, водород проявляет степень окисления +1,
${\overset{+1}{Na}}{\overset{+1}{H}}{\overset{+6}{S}}\overset{-2}{O_{4}}$.
8.$CuOHNO_{3}$ − гидроксонитрат меди (II).
Азот в нитрат − анионах всегда проявляет степень окисления +5, кислород в сложных соединениях всегда проявляет степень окисления −2, водород в соединениях с неметаллами всегда проявляет степень окисления +1. Молекула электронейтральная, исходя из этого, вычислим степень окисления меди. Пусть степень окисления меди равна − х.
x + 1 * (−2) + 1 * 1 + 1 * 5 + (−2) * 3 = 0,
х = 2.
${\overset{+2}{Cu}}{\overset{-2}{O}}{\overset{+1}{H}}\overset{+5}{N}\overset{-2}{O_{3}}$. §43
-
§43. Генетическая связь между классами веществ
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://www.yaklass.ru/p/himija/89−klass/klassy−neorganicheskikh−veshchestv−14371/vzaimosviaz−mezhdu−klassami−neorganicheskikh−veshchestv−195050/re−d872a67a−1888−46ac−b92e−05018349cc45
2. https://foxford.ru/wiki/himiya/geneticheskie−ryady−himicheskih−soedineniy
3. http://diva106.blogspot.com/2011/09/interneturok.html
4. https://dic.academic.ru/dic.nsf/ruwiki/13711552. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Генетический ряд металлов и его разновидности
Из веществ одного класса можно получить вещества другого класса. Такую связь, отражающую происхождение веществ, называют генетической (от греч. «генезис» − происхождение).
В ходе химических реакций химический элемент не исчезает, атомы переходят из одного вещества в другое. Атомы химического элемента как бы передаются от простого вещества к более сложному, и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся простым веществом − металлом или неметаллом − и заканчивающиеся солью.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь.
Из металла в результате реакции соединения с кислородом можно получить основный оксид, основный оксид при взаимодействии с водой дает основание (только, если это основание − щелочь), из основания в результате реакции обмена с кислотой, солью или кислотным оксидом можно получить соль.
металл − основный оксид − основание − соль.
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл − основный оксид − соль − основание − основный оксид − металл.
Самые важные признаки генетических рядов:
1. Вещества одного ряда должны быть образованы исключительно одним химическим элементом.
2. Вещества, которые образованы одним и тем же элементом, должны относиться к разным классам химических веществ.
3. Вещества, которые образовывают генетический ряд элемента, должны быть скоординированы взаимопревращениями. Ряд можно назвать полным, если он начинается и заканчивается простым веществом. И неполным, если он оканчивается другим веществом.?. Вопросы и задания
1. Запишите уравнения реакций, с помощью которых можно осуществить превращения, лежащие в основе приведённых генетических рядов металлов и неметаллов. Дайте названия веществ, уравнения реакций с участием электролитов запишите также и в ионной форме.
Ответ:
$\underset{металл}{Ca} \overset{1}{→} \underset{основный\;оксид}{CaO} \overset{2}{→}\underset{основание(щёлочь)}{Ca(ОН)_{2}} \overset{3}{→} \underset{соль}{Ca_{3}(PO_{4})_{2}}$
1)$\underset{кальций}{2Ca} + \underset{кислород}{O_{2}} = \underset{оксид\;кальция}{2CaO} $
2)$\underset{оксид\;кальция}{CaO} + \underset{вода}{H_{2}O} = \underset{гидроксид\;кальция}{Ca(OH)_{2}} $
3)$\underset{гидроксид\;кальция}{3Ca(OH)_{2}} + \underset{фосфорная\;кислота}{2H_{3}PO_{4}} = \underset{фосфат\;кальция}{Ca_{3}(PO_{4})_{2}}↓ + \underset{вода}{6H_{2}O}$
$ 3Ca^{2+}+6OH^{-}+6H^{+}+2PO_{4}^{3-} = Ca_{3}(PO_{4})_{2}↓ + 6H_{2}O$
$\underset{металл}{Cu} \overset{1}{→} \underset{основный\;оксид}{CuO} \overset{2}{→} \underset{cоль}{CuCl_{2}} \overset{3}{→} \underset{основание}{Cu(OH)_{2}} \overset{4}{→} \underset{основный\;оксид}{CuO} \overset{5}{→} \underset{металл}{Cu}$
1)$\underset{медь}{2Cu} + \underset{кислород}{O_{2}} = \underset{оксид\;меди(II)}{2CuO} $
2)$\underset{оксид\;меди (II)}{CuO} + \underset{соляная кислота}{2HCl} = \underset{хлорид\;меди(II)}{CuCl_{2}} + \underset{вода}{H_{2}O} $
$CuO + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
3)$\underset{хлорид\;меди(II)}{CuCl_{2}} + \underset{гидроксид\;натрия}{2NaOH} = \underset{хлорид\;натрия}{2NaCl} + \underset{гидроксид\;меди (II)}{Cu(OH)_{2}} ↓$
$Cu^{2+}+2Cl^{-}+2Na^{+}+2OH^{-} = 2Na^{+} + 2Cl^{-} + Cu(OH)_{2}$↓
$Cu^{2+} +2OH^{-} = Cu(OH)_{2}$↓
$\underset{неметалл}{P} \overset{1}{→} \underset{кислотный\;оксид}{P_{2}O_{5}} \overset{2}{→} \underset{кислота}{H_{3}PO_{4}} \overset{3}{→} \underset{соль}{Ca_{3}(PO_{4})_{2}}$
1)$\underset{фосфор}{4P} + \underset{кислород}{5O_{2}} = \underset{оксид\;фосфора}{2P_{2}O_{5}} $
2)$\underset{оксид\;фосфора(V)}{P_{2}O_{5}} + \underset{вода}{3H_{2}O} = \underset{фосфорная\;кислота}{2H_{3}PO_{4} }$
3)$\underset{фосфорная\;кислота}{2H_{3}PO_{4} } + \underset{гидроксид\;кальция}{3Ca(OH)_{2}} = \underset{вода}{6H_{2}O} + \underset {фосфат\;кальция}{Ca_{3}(PO_{4})_{2}}↓$
$6H^{+}+2PO_{4}^{3-}+3Ca^{2+}+6OH^{-} = 6H_{2}O + Ca_{3}(PO_{4})_{2}↓$
$\underset{неметалл}{Si} \overset{1}{→} \underset{кислотный\;оксид}{SiO_{2}} \overset{2}{→} \underset{cоль}{Na_{2}SiO_{3}} \overset{3}{→} \underset{кислота}{H_{2}SiO_{3}} \overset{4}{→} \underset{кислотный\;оксид}{SiO_{2}} \overset{5}{→} \underset{неметалл}{Si}$
1)$\underset{кремний}{Si} + \underset{кислород}{O_{2}} \overset{t}{=} \underset{оксид\;кремния(IV)}{SiO_{2}} $
2)$\underset{оксид\;кремния(IV)}{SiO_{2}} + \underset{гидроксид\;натрия}{2NaOH} \overset{t}{=} \underset{силикат\;натрия}{Na_{2}SiO_{3}} + \underset{вода}{H_{2}O} $
3)$\underset{силикат\;натрия}{Na_{2}SiO_{3}} + \underset{серная\;кислота}{H_{2}SO_{4}} = \underset{сульфат\;натрия}{Na_{2}SO_{4}}+ \underset{кремниевая\;кислота}{H_{2}SiO_{3}} ↓$
$2Na^{+} + SiO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}SiO_{3}↓$
$2H^{+} + SiO_{2}^{2-} = H_{2}SiO_{3}$↓
4)$\underset{кремниевая\;кислота}{H_{2}SiO_{3}} \overset{t}{=} \underset{вода}{H_{2}O} + \underset{оксид\;кремния (IV)}{SiO_{2}}$
5)$\underset{оксид\;кремния (IV)}{SiO_{2}} + \underset{магний}{2Mg} \overset{t}{=} \underset{оксид\;магния}{2MgO} + \underset{кремний}{Si}$2. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $Li \overset{1}{→} Li_{2}O \overset{2}{→} LiOH \overset{3}{→} LiNO_{3}$;
б) $S \overset{1}{→} SO_{2} \overset{2}{→} H_{2}SO_{3} \overset{3}{→} Na_{2}SO_{3} \overset{4}{→} SO_{2} \overset{5}{→} CaSO_{3}$.
Уравнения реакций с участием электролитов запишите также и в ионной форме.Ответ:
а) $Li \overset{1}{→} Li_{2}O \overset{2}{→} LiOH \overset{3}{→} LiNO_{3}$;
1) $4Li + O_{2} = 2Li_{2}O$
2) $Li_{2}O + H_{2}O = 2LiOH$
3) $ LiOH+ HNO_{3} = LiNO_{3} + H_{2}O$
$ Li^{+} + OH^{-}+ H^{+} + NO_{3}^{-} = Li^{+} + NO_{3}^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O $
б) $S \overset{1}{→} SO_{2} \overset{2}{→} H_{2}SO_{3} \overset{3}{→} Na_{2}SO_{3} \overset{4}{→} SO_{2} \overset{5}{→} CaSO_{3}$.
1) $S + O_{2} = SO_{2} $
2) $ SO_{2} + H_{2}O = H_{2}SO_{3}$
3) $ H_{2}SO_{3} + 2NaOH = Na_{2}SO_{3} + 2H_{2}O $
$2H^{+} + SO_{3}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{3}^{2-} + 2H_{2}O$
$H^{+} + OH^{-} = H_{2}O $
4) $ Na_{2}SO_{3} + 2HCl = 2NaCl + H_{2}O + SO_{2}↑$
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + 2Cl^{-} = 2Na^{+} + 2Cl^{-} + H_{2}O + SO_{2}↑$
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑$
5) $ SO_{2} + CaO = CaSO_{3}$3. Какие из перечисленных ниже веществ взаимодействуют с соляной кислотой: магний, оксид меди (II), гидроксид меди (II), медь, нитрат магния, гидроксид железа (III), оксид кремния (IV), нитрат серебра, сульфид железа (II)?
Запишите уравнения возможных реакций в молекулярной и ионной формах. Если реакции не могут быть осуществлены, объясните почему.Ответ:
1) $Mg + 2HCl ⟶ MgCl_{2} + H_{2}↑$
$Mg + 2H^{+} + 2Cl^{-} =Mg^{2+} + 2Cl^{-} + H_{2}↑ $
$Mg + 2H^{+} = Mg^{2+} + H_{2}↑ $
2) $CuO + 2HCl ⟶ CuCl_{2} + H_{2}O$
$CuO + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
3) $Cu(OH)_{2} + 2HCl ⟶ CuCl2 + 2H_{2}O $
$Cu(OH)_{2} + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O $
4) Cu + HCl ⇸ реакция не идет, т. к. медь в электрохимическом ряду активности металлов стоит правее водорода. Медь не сможет вытеснить водород из раствора кислоты.
5) $Mg(NO_{3})_{2} + HCl $⇸ реакция не идет, т. к. не образуется газ, или осадок, или вода
6) $Fe(OH)_{3} + 3HCl ⟶ FeCl_{3} + 3H_{2}O $
$Fe(OH)_{3} + 3H^{+} + 3Cl^{-}= Fe^{3+} + 3Cl^{-} + 3H_{2}O $
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
7) $SiO_{2} + HCl$ ⇸ кислотные оксиды не реагируют с кислотами
8) $AgNO_{3} + HCl ⟶ HNO_{3} + AgCl↓$
$Ag^{+} + NO_{3}^{-} + H^{+} + Cl^{-} = H^{+} + NO_{3}^{-} + AgCl↓ $
$Ag^{+} + Cl^{-} = AgCl↓$
9) $FeS + 2HCl ⟶ FeCl2 + H2S↑$
$FeS + 2H^{+} + 2Cl^{-} = Fe^{2+} + 2Cl^{-} + H_{2}S↑$
$FeS + 2H^{+} = Fe^{2+} + H_{2}S↑$4. Какие из перечисленных ниже веществ взаимодействуют с гидроксидом натрия: оксид углерода (IV), гидроксид кальция, оксид меди (II), нитрат меди (II), хлорид аммония, кремниевая кислота, сульфат калия? Запишите уравнения возможных реакций в молекулярной и ионной формах. Если реакции не протекают, объясните почему.
Ответ:
1) $CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
$CO_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + CO_{3}^{2-} + H_{2}O$
$CO_{2} + 2OH^{-} = CO_{3}^{2-} + H_{2}O$
2) $Ca(OH)_{2} + NaOH$ ⇸ не идет, т. к. основные оксиды не взаимодействуют между собой.
3) CuO + NaOH ⇸ не идет, т. к. гидроксиды и основные оксиды не взаимодействуют друг с другом.
4) $Cu(NO_{3})_{2} + 2NaOH = 2NaNO_{3} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2NO_{3}^{-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + 2NO_{3}^{-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
5) $NH_{4}Cl + NaOH = NaCl + NH_{3}↑ + Н_{2}O $
$NH_{4}^{+} + Cl^{-} + Na^{+} + OH^{-} = Na^{+} + Cl^{-} + NH_{3}↑ + Н_{2}O $
$NH_{4}^{+} + OH^{-} = NH_{3}↑ + Н_{2}O $
6) $H_{2}SiO_{3} + 2NaOH = Na_{2}SiO_{3} + 2H_{2}O$
$H_{2}SiO_{3} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SiO_{3}^{2-} +2H_{2}O $
$H_{2}SiO_{3} + 2OH^{-} = SiO_{3}^{2-}+ 2H_{2}O$
7) $K_{2}SO_{4} + NaOH$ ⇸ реакция не идет, т. к. не образуется газ, или осадок, или вода5. Дайте определения всех классов веществ, приведённых в схеме 1. На какие группы делится каждый класс веществ?
Схема 1. Классификация неорганических веществ.
Вещества
простые | сложные
неметаллы металлы | оксиды основания кислоты солиОтвет:
Определения классов веществ
Неметаллы – химические элементы, атомы которых могут принимать электроны для завершения внешнего энергетического уровня.
Металлы – химические элементы, атомы которых не могут принимать электроны для завершения внешнего энергетического уровня.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород в степени окисления -2.
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов. Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Группы классов веществ
Класс оксидов делится на группы:
по способности образовывать соли: солеобразующие, несолеобразующие;
по способности образовывать кислоты и гидроксиды: кислотные, основные, амфотерные.
Класс оснований делится на группы:
по кислотности: одноосновные, двухосновные, трехосновные;
по растворимости в воде: растворимые, нерастворимые;
по стабильности: стабильные, нестабильные.
по степени электролитической диссоциации: сильные, слабые.
Класс кислот делится на группы:
по наличию кислорода: кислородсодержащие, бескислородные;
по основности: одноосновные, двухосновные, трехосновные;
по растворимости в воде: растворимые, нерастворимые;
по стабильности: стабильные, нестабильные;
по степени электролитической диссоциации: сильные, слабые;
по летучести: летучие, нелетучие.
Класс солей делится на группы:
по типу катионов: средние, кислые, основные. §44
-
§44. Окислительно-восстановительные реакции
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://www.tyuiu.ru/wp−content/uploads/2017/05/7.−MU−OVR.pdf
2. http://www.chem.msu.su/rus/teaching/general/praktika/part4.html
3. https://www.1spbgmu.ru/images/home/Obrazovanie/kafedra/Общейибиоорганическойхимии/Удаленка/Окислительно−восстановительныереакции.pdf
4. https://www.yaklass.ru/p/himija/89−klass/klassifikatciia−khimicheskikh−reaktcii−i−zakonomernosti−ikh−protekaniia−212242/klassifikatciia−khimicheskikh−reaktcii−ovr−287184/re−78d287b5−029b−4b9e−94e0−7aefe0d35704
5. https://ru.wikipedia.org/wiki/Окислительно−восстановительные_реакции2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Метод электронного баланса
Окислительно−восстановительные реакции – это реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
При составлении уравнений окислительно−восстановительных реакций необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты в уравнениях окислительно−восстановительных реакций подбирают, используя либо метод электронного баланса, либо метод полуреакций.
В методе электронного баланса проводят следующие действия:
1. Определить с.о. всех элементов в молекулах исходных веществ (реагентов) и продуктов реакции.
2. Подчеркнуть символы элементов, изменяющих степень окисления в ходе реакции.
3. Определить окислитель и восстановитель и подписать под формулами молекул, в которых происходит изменение с.о. элементов
4. Составить уравнение процессов окисления и восстановления (электронный баланс). Для этого записать элементы в начальной степень окисления, поставить стрелку и после неё записать этот элемент с измененной степень окисления в продукте. Затем прибавить необходимое количество электронов от начальной степень окисления элемента для получения измененной степень окисления элемента в окисленной форме восстановителя.
5. Число электронов, отдаваемые восстановителем должно быть равно числу электронов, принимаемому окислителем. Для уравнения найти наименьшее общее кратное для количества электронов, участвующих в процессах окисления и восстановления, и записать дополнительные множители для процессов окисления и восстановления.
6. Найденные множители – это коэффициенты в окислительно−восстановительных реакциях. Подставить коэффициенты в уравнение окислительно−восстановительных реакций перед окислителем и его восстановленной формой, а также перед восстановителем и его окисленной формой
7. Уравнять количество атомов элементов, которые не изменяют степень окисления в последовательности: металл → неметалл → атомы водорода → атомы кислорода.
8. Проверить правильность составления уравнения окислительно−восстановительных реакций и коэффициентов, подсчитав количества атомов кислорода в левой и правой частях уравнения. Оно должно быть одинаковым.?. Вопросы и задания
1. Какие из реакций, уравнения которых записаны ниже, относят к окислительно−восстановительным?
а) $CaCO_{3} \overset{t}{=} CaO + CO_{2}$;
б) $CO_{2} + 2Mg \overset{t}{=} 2MgO + C$;
в) $Ba(NO_{3})_{2} + Na_{2}SO_{4} = 2NaNO_{3} + BaSO_{4}$;
г) $2Al + Cr_{2}O_{3} \overset{t}{=} Al_{2}O_{3} + 2Cr$.
Для окислительно−восстановительных реакций укажите окислитель и восстановитель, процессы окисления и восстановления, составьте электронные уравнения.Ответ:
а) $\overset{+2}{Ca}\overset{+4}{C}\overset{-2}{O_{3}} \overset{t}{=} \overset{+2}{Ca}\overset{-2}{O} + \overset{+4}{C}\overset{-2}{O_{2}}$
Ни один из элементов не изменил свою степень окисления, поэтому реакция не является окислительно−восстановительной.
б) t
СO2 + 2 Mg → 2MgO + C
+4 восст-е 0
С + 4 e- → С | 4 | | 1 окислитель
0 окисление +2 4
Mg — 2e- → Mg | 2 | | 2 восстановитель
в) $Ba(NO_{3})_{2} + Na_{2}SO_{4} = 2NaNO_{3} + BaSO_{4}$;
$\overset{+2}{Ba}(\overset{+5}{N}\overset{-2}{O_{3})_{2}} + \overset{+1}{Na_{2}}\overset{+6}{S}\overset{-2}{O_{4}} = \overset{+1}{2Na}\overset{+5}{N}\overset{-2}{O_{3}} + \overset{+2}{Ba}\overset{+6}{S}\overset{-2}{O_{4}}$
Ни один из элементов не изменил свою степень окисления, поэтому реакция не является окислительно−восстановительной.
г) $2Al + Cr_{2}O_{3} \overset{t}{=} Al_{2}O_{3} + 2Cr$.
+3 восст-е 0
Сr + 3 e- → Сr | 3 | | 1 окислитель
0 окисление +3 3
Al — 3e- → Al | 3 | | 1 восстановитель2. Дайте характеристику реакции синтеза аммиака по всем изученным вами признакам классификации химических реакций.
Ответ:
$3H_{2} + N_{2} \overset{кат.}{⇄} 2NH_{3} + Q$
Реакция синтеза аммиака является реакцией:
− соединения (из двух простых веществ образуется одно сложное);
− экзотермической (в результате протекания реакции в прямом направлении выделяется теплота);
− окислительно−восстановительной ($Н_{2}^{0}$ − водород − восстановитель, повысил свою степень до +1, N^{3−} − окислитель, понизил свою степень окисления до −3);
− каталитической (для ускорения реакции используется катализатор);
− обратимой (идёт и в прямом, и в обратном направлениях).3. Из следующих утверждений выберите истинные:
а) к окислительно−восстановительным будут относиться все реакции ионного обмена;
б) все реакции ионного обмена не будут являться окислительно−восстановительными;
в) все реакции замещения являются окислительно−восстановительными;
г) только некоторые реакции замещения являются окислительно−восстановительными реакциями;
д) к окислительно−восстановительным реакциям относят те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество;
е) все реакции разложения и соединения не являются окислительно−восстановительными.
Обоснуйте свою точку зрения, докажите её примерами уравнений реакций.Ответ:
а) к окислительно−восстановительным будут относиться все реакции ионного обмена.
Утверждение неверно, т.к. существуют реакции ионного обмена, в которых не происходит окислительно−восстановительных процессов.
$\overset{+1}{Na_{2}}\overset{+6}{S}\overset{-2}{O_{4}} + \overset{+2}{Ba}\overset{-1}{Cl_{2} } = \overset{+1}{Na}\overset{-1}{Cl} + \overset{+2}{Ba}\overset{+6}{S}\overset{-2}{O_{4}} ↓$
б) все реакции ионного обмена не будут являться окислительно−восстановительными.
Верно. Все реакции ионного обмена протекают без изменения степеней окисления. Происходит простой обмен катионами и анионами.
$\overset{+1}{H} \overset{-1}{Cl} + \overset{+1}{K}\overset{+3}{N}\overset{-2}{O_{2} }= \overset{+1}{K} \overset{-1}{Cl} + \overset{+1}{H} \overset{+3}{N}\overset{-2}{O_{3}}$
в) все реакции замещения являются окислительно−восстановительными.
Верно. В реакциях замещения атомы простого вещества замещают атомы одного из химических элементов в сложном веществе, поэтому все реакции замещения являются окислительно−восстановительными.
$\overset{+2}{Cu}SO_{4} + \overset{0}{Fe} = \overset{+2}{Fe}SO_{4} + \overset{0}{Cu} ↓$
г) только некоторые реакции замещения являются окислительно−восстановительными реакциями.
Неверно, т.к. все реакции замещения являются окислительно−восстановительными.
$2Na\overset{-1}{I} + \overset{0}{Cl_{2}} = 2Na\overset{-1}{Cl} + \overset{0}{I_{2}}$
д) к окислительно−восстановительным реакциям относят те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество.
Верно. Если в реакции соединения участвует простое вещество, то у него изменяется степень окисления.
$\overset{+2}{2N}\overset{-2}{O} + \overset{0}{O_{2}} = \overset{+4}{2N}\overset{-2}{O_{2}}$
Если в результате реакции разложения образуется простое вещество, то значит у элемента простого вещества изменяется степень окисления на 0.
$2K\overset{+7}{Mn}\overset{0}{O_{4}} = K_{2}\overset{+6}{Mn}O_{4} + \overset{+4}{Mn}O_{2} + \overset{0}{O_{2}}↑$
е) все реакции разложения и соединения не являются окислительно−восстановительными.
Неверно, т.к. существуют реакции разложения и соединения, которые являются окислительно−восстановительными.
$\overset{-3}{N}\overset{+1}{H_{4}}\overset{+5}{N}\overset{-2}{O_{3}} = \overset{+1}{N_{2}}\overset{-2}{O} + \overset{+1}{2H_{2}}\overset{-2}{O}$4. Согласны ли вы с утверждением, что $HNO_{3}$ проявляет только окислительные свойства, а $NH_{3}$ − только восстановительные?
Ответ обоснуйте.Ответ:
В азотной кислоте HNO3 азот находится в максимальной степени окисления +5, т. е. азот больше не может отдавать электроны, а может только принимать их, поэтому N+5 проявляет только окислительные свойства.
В аммиаке NH3 азот находится в минимальной степени окисления -3, т. е. азот больше не может принимать электроны, а может их только отдавать, поэтому N-3 проявляет только восстановительные свойства.5. Какое из веществ — сероводород $H_{2}S$ и серная кислота $H_{2}SO_{4}$ − проявляет только окислительные или только восстановительные свойства? Почему?
Ответ:
В серной кислоте $H_{2}SO_{4}$ сера и водород находится в максимальных степенях окисления +6 и +1 соответственно, поэтому серная кислота проявляет только окислительные свойства, принимая электроны.
В сероводороде $H_{2}S$ сера находится в минимальной степени окисления −2, т. е. сера проявляет только восстановительные свойства, а водород находится в максимальной степени окисления +1, т. е. водород проявляет только окислительные свойства, поэтому сероводород проявляет как окислительные, так и восстановительные свойства.6. Обоснуйте тезис, что $SO_{2}$ может быть и окислителем, и восстановителем.
Ответ:
В оксиде серы (IV) $SO_{2}$ сера находится в промежуточной степени окисления +4, т. е. сера может как принимать, так и отдавать электроны, поэтому $SO_{2}$ может быть и окислителем, и восстановителем.
7. Расставьте коэффициенты методом электронного баланса в следующих схемах реакций:
а) $NH_{3} + O_{2} ⟶ NO + H_{2}O$;
б) $Al + I_{2} ⟶ AlI_{3}$;
в) $HNO_{3} + P + H_{2}O ⟶ H_{3}PO_{4} + NO$;
г) $HCl + KMnO_{4} ⟶ Cl_{2} + KCl + MnCl_{2} + H_{2}O$.Решение
а) $4NH_{3} + 5O_{2} ⟶ 4NO + 6H_{2}O$;
0 восст-е -2
O2 + 4 e- → 2O | 4 | | 5 окислитель
-3 окисление +2 | | 20 |
N — 5e- → N | 5 | | 4 восстановитель
б) $2Al + 3I_{2} ⟶ 2AlI_{3}$;
0 восст-е -1
I2 + 2 e- → 2I | 2 | | 3 окислитель
0 окисление +3 | | 6 |
Al — 3e- → Al | 3 | | 2 восстановитель
в) $5HNO_{3} + 3P + 2H_{2}O ⟶ 3H_{3}PO_{4} + 5NO$;
+5 восст-е +2
N + 3 e- → N | 3 | | 5 окислитель
0 окисление +5 | | 15 |
P — 5e- → P | 5 | | 3 восстановитель
г) $16HCl + 2KMnO_{4} ⟶ 5Cl_{2} + 2KCl + 2MnCl_{2} + 8H_{2}O$.
+7 восст-е +2
Mn + 5 e- → Mn | 5 | | 2 окислитель
-1 окисление 0 | | 10 |
2Cl — 2e- → Cl2 | 2 | | 5 восстановитель8. Назовите окислитель в реакциях взаимодействия цинка с соляной и азотной кислотами. Для последней реакции используйте аналогию взаимодействия азотной кислоты с медью.
Ответ:
Zn + 2 HCl → ZnCl2 + H2↑
+1 восст-е 0
2H + 2 e- → H2 | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Zn — 2e- → Zn | 2 | | 1 восстановитель
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO↑ + 4H2O
+5 восст-е +2
N + 3 e- → N | 3 | | 2 окислитель
0 окисление +2 | | 6 |
Zn — 2e- → Zn | 2 | | 3 восстановительТемы для дискуссии
1. Растворение — процесс физический или химический? Обоснуйте свою точку зрения.
Ответ:
При растворении частиц вещества происходят физические и химические взаимодействия этих частиц с молекулами растворителя.
Сторонники физической теории растворов, которую развивали Вант−Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии, т. е. проникновения растворённого вещества в промежутки между молекулами воды.
В противоположность представлениям физической теории растворов Д. И. Менделеев и сторонники химической теории растворов доказывали, что растворение является результатом химического взаимодействия растворённого вещества с молекулами воды. В результате химического взаимодействия растворённого вещества с водой образуются соединения — гидраты.
Доказательства физических и химических явлений при растворении:
1. Признаки физических явлений:
− диффузия: перемещение частиц растворённого вещества между молекулами растворителя. Появление «качеств» растворённого вещества в растворе.
Растворившийся в воде сахар придаёт сладкий вкус всему раствору.
При растворении в воде краситель окрашивает весь раствор.
2. Признаки химических явлений:
− выделение или поглощение теплоты в процессе растворения.
Процесс растворения концентрированной серной кислоты в воде сопровождается сильным разогреванием раствора. Это явление используется для "химических грелок".
При растворении нитрата аммония в воде происходит сильное поглощение тепла, раствор охлаждается. Этот эффект используют в гипотермимеском пакете автомобильной аптечки для оказания первой помощи, когда нужно приложить холод.
− изменение цвета некоторых соединений при образовании растворов.
Безводный сульфат меди(II) имеет белый цвет, а при его растворении в воде образуется голубой раствор.
В настоящее время принята теория, которая объединяет обе точки зрения, — физико−химическая теория растворов.2. Диссоциация — процесс физический или химический? Обоснуйте свою точку зрения.
Ответ:
Электролитическая диссоциация − процесс распада электролита на ионы при его растворении или плавлении.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что распад на ионы происходит без какого−либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Русские химики И. А. Каблуков и В. А. Кистяковский в 1891 году применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
В ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов, тем самым подтверждая, что диссоциация − физико−химический процесс.3. Предложите несколько формулировок для понятия «соли и их классификация»
Ответ:
Солями называют сложные вещества, состоящие из металлических элементов и кислотных остатков.
С точки зрения теории электролитической диссоциации, солями называют электролиты, которые, диссоциируя, образуют положительно заряженные ионы (катионы) металла (или аммония) и отрицательно заряженные ионы (анионы) кислотного остатка.
Классификация солей:
1. По степени замещения водорода на металл в кислоте:
− средние;
− кислые;
− основные.
2. По числу присутствующих в структуре катионов и анионов:
− простые;
− двойные;
− смешанные.
3. По растворимости:
− растворимые;
− мало растворимые;
− нерастворимые соли. Химический практикум №2
-
ХИМИЧЕСКИЙ ПРАКТИКУМ №2. Свойства электролитов
Практическая работа №6
Опыт 1
Обнаружение сульфат−ионов $SO^{2-}_{4}$.
В одну пробирку налейте 1 − 2 мл раствора сульфата натрия, а в другую − 1 − 2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращённое ионные уравнения реакции.
Какие соединения могут служить реактивом на ионы бария $Ba^{2+}$?
В чём сущность обнаружения ионов с помощью реактива?Ответ:
При добавлении раствора хлорида бария в раствор сульфата натрия образуется белый осадок сульфата бария:
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
$Na_{2}SO_{4} → 2Na^{+} + SO_{4}^{2-}$
$BaCl_{2} → Ba^{2+} + 2Cl^{-}$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
При добавлении раствора хлорида бария в раствор сульфата калия также образуется белый осадок сульфата бария:
$K_{2}SO_{4} + BaCl_{2} = 2KCl + BaSO_{4}↓$
$K_{2}SO_{4} → 2K^{+} + SO_{4}^{2-}$
$BaCl_{2} → Ba^{2+} + 2Cl^{-}$
$2K^{+} +SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = 2K^{+} + 2Cl^{-} + BaSO_{4}↓ $
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
Растворимые сульфаты, сульфиты, карбонаты и фосфаты могут служить реактивом на ионы бария $Ba2^{2+}$, которые образуют нерастворимые соли с катионом бария.
Сущность обнаружения ионов с помощью реактива в том, чтобы найти такое вещество, которое дает специфичную реакцию.Опыт 2
Обнаружение хлорид−ионов $Cl^{-}$.
По таблице растворимости выясните, какие соли, содержащие хлорид−ион $Cl^{-}$, нерастворимы (малораствиримы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид−ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращённые ионные уравнения проведённых реакций.
Таблица.
Ответ:
По таблице растворимости видно, что нерастворимым является AgCl − хлорид серебра (I) и малорастворимым является $PbCl_{2}$ хлорид свинца (II).
Для того, чтобы обнаружить хлорид−ионы в растворе хлорида натрия, добавим к раствору нитрат серебра (I), в результате реакции должен образоваться белый творожистый осадок:
$NaCl + AgNO_{3} = NaNO_{3} + AgCl↓$
$NaCl → Na^{+} + Cl^{-} $
$AgNO_{3} → Ag^{+} + NO_{3}^{-} $
$Na^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} = Na^{+} + NO_{3}^{-} + AgCl↓ $
$Ag^{+} + Cl^{-} = AgCl↓$Опыт 3
Обнаружение сульфат−ионов $SO^{2-}_{4}$ и хлорид−ионов $Cl^{-}$.
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой – раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую – раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей – KCl или $MgSO_{4}$ содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведённых вами реакций и полные и сокращённые ионные уравнения реакций обнаружения ионов.Ответ:
Чтобы доказать, что в пробирке находится раствор хлорида калия, можно использовать раствор растворимой соли серебра (I) или свинца (II).
Осадок выпадет в той пробирке, где добавили нитрат свинца (II) или нитрат серебра (I) к хлориду калия:
$2KCl + Pb(NO_{3})_{2} = 2KNO_{3} + PbCl_{2}↓$
$2K^{+} + 2Cl^{-} + Pb^{2+} + 2NO_{3}^{-} = 2K^{+} + 2NO_{3}^{-} + PbCl_{2}↓$
$Pb^{2+} + 2Cl^{-} = PbCl2↓$
$KCl + AgNO_{3}= KNO_{3} + AgCl↓$
$K^{+} + Cl^{+} + Ag^{+} + NO_{3}^{-} = K^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} = AgCl↓$
Если к раствору хлорида калия добавить раствор хлорида бария, то осадка не будет.
$2KCl + BaCl_{2}$ − нет изменений.
Чтобы доказать, что в пробирке находится раствор сульфата магния, можно использовать раствор растворимой соли бария.
Осадок выпадет в той пробирке, где добавили раствор хлорида бария к сульфату магния:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓ $
$Mg^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$Опыт 4
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.
Таблица 12. Определение ионов.Ответ:
а) $BaCl_{2}$ − хлорид бария
Для подтверждения того, что в хлориде бария содержится катион бария, необходимо к его раствору добавить раствор сульфата натрия, в результате реакции образуется белый осадок:
$BaCl_{2} + Na_{2}SO_{4} = 2NaCl + BaSO_{4}↓ $
$Ba^{2+} + 2Cl^{-} + 2Na^{+} + SO_{4}^{2-} = 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Для подтверждения того, что в хлориде бария содержится хлорид−анион, необходимо к его раствору добавить раствор нитрата серебра (I), в результате реакции образуется белый осадок:
$BaCl_{2} + 2AgNO_{3} = Ba(NO_{3})_{2} + 2AgCl↓ $
$Ba^{+} + 2Cl^{-} + 2Ag^{+} + 2NO_{3}^{-} = Ba^{+} + 2NO_{3}^{-} + 2AgCl↓ $
$Ag^{+} + Cl^{-} = AgCl↓$
б) $MgSO_{4}$ − сульфат магния
Для подтверждения того, что в сульфате магния содержится катион магния, необходимо к его раствору добавить раствор гидроксида натрия, в результате реакции образуется белый осадок:
$MgSO_{4} + 2NaOH = Na_{2}SO_{4} + Mg(OH)2↓$
$Mg^{2+} + SO_{4}^{2-} + 2Na^{2+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Mg(OH)_{2}↓$
$Mg^{2+} + 2OH^{-} = Mg(OH)2↓$
Для подтверждения того, что в сульфате магния содержится сульфат−анион, необходимо к его раствору добавить раствор хлорида бария, в результате реакции образуется белый осадок:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓$
$Mg^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = Mg^{2+} + 2Cl ^{-} + BaSO_{4}↓ $
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
в) $(NH_{4})_{2}CO_{3}$ − карбонат аммония
Для подтверждения того, что в карбонате аммония содержится катион аммония, необходимо к его раствору добавить раствор гидроксида натрия, после протекания реакции будет чувствоваться запах аммиака:
$(NH_{4})_{2}CO_{3} + 2NaOH = Na_{2}CO_{3} + 2NH_{3}↑ + 2H_{2}O $
$2NH_{4}^{+} + CO_{3}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + CO_{3}^{2-} + 2NH_{3}↑ + 2H_{2}O $
$NH_{4}^{+} + OH^{-} = NH_{3}↑ + H_{2}O $
Для подтверждения того, что в карбонате аммония содержится карбонат−анион, необходимо к его раствору добавить раствор соляной кислоты, в результате реакции образуется газ:
$(NH_{4})_{2}CO3 + 2HCl = 2NH_{4}Cl + H_{2}O + CO_{2}↑ $
$2NH_{4}^{+} + CO_{3}^{2-} + 2H^{+} + 2Cl^{-} = 2NH_{4}^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑$Практическая работа №7
Опыт 1
Возьмите три пробирки и налейте в каждую по 2 − 3 мл раствора:
в 1−ю — сульфата меди (II),
во 2−ю — хлорида калия,
в 3−ю — сульфата алюминия.
Затем в каждую пробирку добавьте:
в 1−ю — немного раствора гидроксида натрия,
во 2−ю — раствора фосфата натрия,
а в 3−ю — раствора хлорида бария.
Что наблюдаете?
Составьте молекулярные и ионные уравнения реакций.
Сделайте вывод.Ответ:
1− я пробирка с сульфатом меди (II).
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓ $
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
Катион меди (II) взаимодействует с гидроксид−анионами, образуя нерастворимый гидроксид меди (II) голубого цвета.
2−я пробирка с хлоридом калия.
$KCl + Na_{3}PO_{4} $ ⇸ реакция не идет.
3−я пробирка с сульфатом алюминия.
$Al_{2}(SO_{4})_{3} + 3BaCl_{2} = 2AlCl_{3} + 3BaSO_{4}↓ $
$2Al^{3+} + 3SO_{4}^{2-} + 3Ba^{2+} + 6Cl^{-} = 2Al^{3+} + 6Cl^{-} + 3BaSO_{4}↓ $
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Катион бария взаимодействует с сульфат−анионом, образуя нерастворимый сульфат бария белого цвета.
Таким образом, реакции идут до конца, если в результате реакции образуется нерастворимое соединение.Опыт 2
В две пробирки налейте по 2 − 3 мл растворов сульфита натрия и карбоната натрия соответственно. Затем прилейте в каждую из них раствор азотной кислоты. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод.
Ответ:
При добавлении к солям раствора азотной кислоты выделяется газ.
Пробирка с сульфитом натрия.
$Na_{2}SO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + SO_{2}↑ $
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + 2NO_{3}^{-} = 2Na^{+} + 2NO_{3}^{-}+ H_{2}O + SO_{2}↑$
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑ $
Пробирка с карбонатом натрия.
$Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + CO_{2}↑$
$2Na^{+} + CO_{3}^{2-} + 2H^{+} + 2NO_{3}^{-} = 2Na^{+} + 2NO_{3}^{-} + H_{2}O + CO_{2}↑ $
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑ $
Реакции идут до конца, когда в результате реакции образуется газ. Азотная кислота сильнее угольной и сернистой, поэтому вытесняет их из раствора их солей.Опыт 3
В одну пробирку налейте 3− 4 мл раствора гидроксида натрия и добавьте две−три капли фенолфталеина .Раствор приобретает малиновый цвет. Затем прилейте соляную кислоту или раствор серной кислоты до обесцвечивания.
В другую пробирку налейте примерно 2—3 мл сульфата меди (II) и добавьте немного раствора гидроксида натрия. Образуется голубой осадок гидроксида меди (II).
Прилейте в пробирку серную кислоту до растворения осадка.
Составьте уравнения происходящих реакций в молекулярном и ионном виде. Поясните, почему в первой пробирке произошло обесцвечивание, а во второй − растворение осадка. Каким общим свойством обладают растворимые и нерастворимые основания?Ответ:
Пробирка 1.
При добавлении фенолфталеина к гидроксиду натрия раствор окрашивается в малиновый цвет, среда щелочная.
$NaOH → Na^{+} + OH^{-}$
При добавлении соляной кислоты раствор становится бесцветным, значит протекает реакция нейтрализации.
$NaOH + HCl = NaCl + H2O$
$Na^{+} + OH^{-} + H^{+} + Cl^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O $
Пробирка 2.
При добавлении к сульфату меди (II) гидроксида натрия образуется белый осадок.
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓ $
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
При добавлении раствора серной кислоты осадок растворится, т.к. образуется растворимый сульфат меди (II).
$Cu(OH)_{2}↓ + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$Cu(OH)_{2} ↓ + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + 2H_{2}O $
$Cu(OH)_{2} ↓ + 2H^{+} = Cu^{2+} + 2H_{2}O$
Осадок гидроксида меди (II) растворился, т. к. в результате реакции с серной кислотой образовался растворимый сульфат меди (II).
Взаимодействие с кислотами – это общие свойство, которым обладают растворимые и нерастворимые основания.Практическая работа №8
Задание 1
вариант 1
Осуществите реакции, характеризующие химические свойства:
соляной кислоты.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах. Реакцию с металлом рассмотрите как окислительно−восстановительную.Ответ:
Взаимодействие с металлами, стоящими в электрохимическом ряду до водорода с образованием соли и выделением газообразного водорода.
$Mg + 2HCl = MgCl_{2} + H_{2}↑$
$Mg + 2H^{+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + H_{2}↑$
$Mg + 2H^{+} = Mg^{2+} + H_{2}↑$
+1 восст-е 0
H + 2 e- → H2 | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Mg — 2e- → Mg | 2 | | 1 восстановитель
Взаимодействие с основными оксидами с образованием растворимой соли и воды.
$MgO + 2HCl = MgCl_{2} + H_{2}O$
$MgO + 2H^{+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + H_{2}O $
$MgO + 2H^{+} = Mg^{2+} + H_{2}O $
Взаимодействие с щелочамис образованием растворимой соли и воды.
$NaOH + HCl = NaCl + H_{2}O$
$Na^{+} + OH^{-} + H^{+} + Cl^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O $
Взаимодействие с нерастворимыми основаниями
$Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} + 3Cl^{-} = Fe^{3+} + 3Cl^{-} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
Взаимодействие с солями, если выпадает осадок или выделяется газ
$AgNO_{3} + HCl = HNO_{3} + AgCl↓ $
$Ag^{+} + NO^{3-} + H^{+} + Cl^{-} = H^{+} + NO^{3-} + AgCl↓$
$Ag^{+} + Cl^{-} = AgCl↓ $
Сильные кислоты вытесняют более слабые из их солей
$KNO_{2} + HCl= KCl + HNO_{2}$
$K^{+} + NO_{2}^{-} + H^{+} + Cl^{+} = K^{+} + Cl^{-} + HNO_{2}$
$H^{+} + NO_{2}^{-} = HNO_{2}$вариант 2
Осуществите реакции, характеризующие химические свойства:
раствора серной кислоты.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах. Реакцию с металлом рассмотрите как окислительно−восстановительную.Ответ:
Взаимодействие с металлами, стоящими в электрохимическом ряду до водорода с образованием соли и выделением газообразного водорода.
$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}↑ $
$2Al + 6H^{+} + 3SO_{4}^{2-} = 2Al^{3+} + 3SO_{4}^{2-} + 3H_{2}↑ $
$2Al + 6H^{+} = 2Al^{3+} + 3H_{2}↑$
+1 восст-е 0
H + 2 e- → H2 | 2 | | 3 окислитель
0 окисление +3 | | 6 |
Al — 3e- → Al | 3 | | 2 восстановитель
Взаимодействие с основными оксидами с образованием растворимой соли и воды.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O $
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O $
$CuO + 2H^{+} = Cu^{2+} + H_{2}O $
Взаимодействие с основаниями с образованием растворимой соли и воды.
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O $
$Cu(OH)_{2} + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O $
Взаимодействие с солями, если выпадает осадок или выделяется газ.
$BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO4↓$
$Ba^{2+} + 2Cl^{-} + 2H^{+} + SO_{4}^{2-} = 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓ $
Сильные кислоты вытесняют более слабые из их солей.
$2NaNO_{2} + H_{2}SO_{4} = Na_{2}SO_{4} + 2HNO_{2} $
$2Na^{+} + 2NO_{2}^{-} + 2H^{+} + SO_{4}^{2-}=2Na^{+} + SO_{4}^{2-} + 2HNO_{2} $
$H^{+} + NO_{2}^{-} = HNO_{2}$Задание 2
вариант 1
Проделайте реакции, характеризующие химические свойства раствора гидроксида натрия.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формахОтвет:
Взаимодействие с кислотными оксидами
$SO_{2} + 2NaOH = Na_{2}SO_{3} + H_{2}O$
$SO_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{3}^{2-} + H_{2}O$
$SO_{2} + 2OH^{-} = SO_{3}^{2-} + H_{2}O$
Взаимодействие с кислотами
$HCl + NaOH = NaCl + H_{2}O $
$H^{+} + Cl^{-} + Na^{+} + OH^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓ $
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓$вариант 2
Получите гидроксид железа (III) реакцией обмена и осуществите реакции, характеризующие его химические свойства.
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах.Ответ:
Получение гидроксида железа (III) реакцией обмена.
$FeCl_{3} + 3NaOH = NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
Разложение гидроксида железа (III) при нагревании.
$2Fe(OH)_{3} \overset{t}{=} Fe_{2}O_{3} + 3H_{2}O $
Взаимодействие с кислотами.
$Fe(OH)_{3} + 3HCl = FeCl_{3} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} + 3Cl^{-} = Fe^{3+} + 3Cl^{-} + 3H_{2}O$
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$Задание 3
вариант 1
Получите оксид серы (IV) и проделайте реакции, характеризующие его химические свойства.
Запишите уравнения реакций в молекулярной и ионной формах, если это возможно.Ответ:
Получение оксида серы (IV):
− сжигание серы на воздухе:
$S + O_{2 }= SO_{2} $
− горение сульфидов и сероводорода:
$2H_{2}S + 3O_{2} = 2SO_{2} + 2H_{2}O$
− взаимодействие сульфитов с более сильными кислотами:
$Na_{2}SO_{3} + 2HNO_{3}= 2NaNO_{3} + SO_{2}↑ + H_{2}O$
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + 2 NO_{3}^{-} = 2 Na^{+} + 2 NO_{3}^{-} + SO_{2}↑ + H_{2}O$
$2H^{+} + SO_{3}^{2-} = SO_{2}↑ + H_{2}O$
Растворяется в воде с образованием слабой и неустойчивой сернистой кислоты.
$H_{2}O + SO_{2} ⇄ H_{2}SO_{3} $
Взаимодействует с основными оксидами.
$K_{2}O + SO_{2} = K_{2}SO_{3} $
Взаимодействует с щелочами.
$2NaOH + SO_{2} = Na_{2}SO_{3} + H_{2}O $
$2Na^{+} + 2OH^{-} + SO_{2} = 2Na^{+} + SO_{3}^{2-} + H_{2}O $
$2OH^{-} + SO_{2} = SO_{3}^{2-} + H_{2}O $вариант 2
Проделайте реакции, характеризующие химические свойства оксида кальция.
Запишите уравнения реакций в молекулярной и ионной формах, если это возможно.Ответ:
Взаимодействует с водой:
$CaO + H_{2}O = Ca(OH)_{2}$
Взаимодействует с кислотными оксидами:
$CaO + CO_{2} = CaCO_{3} $
Взаимодействует с кислотами с образованием соли и воды.
$CaO + 2HCl = CaCl_{2} + H_{2}O$
$CaO + 2H^{+} + 2Cl^{-} = Ca^{2+} + 2Cl^{-} + H_{2}O$
$CaO + 2H^{+} = Ca^{2+} + H_{2}O$Задание 4
вариант 1
Проделайте реакции, характеризующие химические свойства:
хлорида железа (II).
Запишите уравнения реакций в молекулярной и ионной формах. Реакции с участием металла рассмотрите как окислительно−восстановительные.Ответ:
Взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов левее железа.
t
Mg + FeCl2 → MgCl2 + Fe↓
+2 восст-е 0
Fe + 2 e- → Fe | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Mg — 2e- → Mg | 2 | | 1 восстановитель
Взаимодействует с щелочами.
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓ $
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + 2Cl^{-} + Fe(OH)2↓$
$Fe^{2+} + 2OH^{-} = Fe(OH)2↓ $
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
$FeCl_{2} + Na_{2}S = 2NaCl + FeS↓ $
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + S^{2-} = 2Na^{+} + 2Cl^{-} + FeS↓$
$Fe^{2+} + S^{2-} = FeS↓$вариант 2
Проделайте реакции, характеризующие химические свойства:
хлорида меди (II).
Запишите уравнения реакций в молекулярной и ионной формах. Реакции с участием металла рассмотрите как окислительно−восстановительные.Ответ:
Взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов левее меди.
$Fe + CuCl_{2} \overset{t}{→} FeCl_{2} + Cu↓$
+2 восст-е 0
Cu + 2 e- → Cu | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Fe — 2e- → Fe | 2 | | 1 восстановитель
Взаимодействует с щелочами.
$CuCl_{2} + 2NaOH = 2NaCl + Cu(OH)_{2}↓ $
$Cu^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + 2Cl^{-} + Cu(OH)_{2}↓ $
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}↓ $
Взаимодействие с растворами солей, если выпадает осадок или выделяется газ.
$CuCl_{2} + Na_{2}S = 2NaCl + CuS↓ $
$Cu^{2+} + 2Cl^{-} + 2Na^{+} + S^{2-} = 2Na^{+} + 2Cl^{-} + CuS↓ $
$Cu^{2+} + S^{2-} = CuS↓$Практическая работа №9
1. Налейте в пробирку 1 − 2 мл концентрированного раствора серной кислоты и опустите в неё гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
Ответ:
Серная кислота реагирует с цинком с образованием газа водорода, цинк при этом растворяется.
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
$Zn + 2H^{+} + SO_{4}^{2-} = Zn^{2+} + SO_{4}^{2-} + H_{2}↑ $
$Zn + 2H^{+} = Zn^{2+} + H_{2}↑$
+ восст-е 0
2H + 2 e- → H2 | 2 | | 1 окислитель
0 окисление +2 | | 2 |
Zn — 2e- → Zn | 2 | | 1 восстановитель2. В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы:
а) гидроксид натрия;
б) сульфат калия;
в) карбонат натрия;
г) нитрат цинка;
д) фосфат калия;
е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.Ответ:
а) $MgCl_{2} + 2NaOH = 2NaCl + Mg(OH)_{2}↓ $
$Mg^{2+} + 2Cl^{-} + 2Na+ 2OH^{-} = 2Na+ + 2Cl^{-} + Mg(OH)_{2}↓ $
$Mg^{2+} + 2OH^{-} = Mg(OH)_{2}↓ $
б) $MgCl_{2} + K_{2}SO_{4}$ ⇸
реакция не идет, т. к. не образуется осадок или газ.
в) $MgCl_{2} + Na_{2}CO_{3} = 2NaCl + MgCO_{3}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} = 2Na^{+} + 2Cl^{-} + MgCO_{3}↓ $
$Mg^{2+} + CO_{3}^{2-} = MgCO_{3}↓ $
г) $MgCl_{2} + Zn(NO_{3})_{2}$ ⇸ реакция не идет, т. к. не образуется осадок или газ.
д) $3MgCl_{2} + 2K_{3}PO_{4} = 6KCl + Mg_{3}(PO_{4})_{2}↓$
$3Mg^{2+} + 6Cl^{-} + 6K^{+} + 2PO_{4}^{3-} = 6K^{+} + 6Cl^{-} + Mg_{3}(PO_{4})_{2}↓ $
$3Mg^{2+} + 2PO_{4}^{3-} = Mg_{3}(PO_{4})_{2}↓ $
е) $MgCl_{2} + Na_{2}S = 2NaCl + MgS↓ $
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + S^{2-} = 2Na^{+} + 2Cl^{-} + MgS↓ $
$Mg^{2+} + S^{2-} = MgS↓$3. Даны растворы:
а) карбоната калия и соляной кислоты;
б) сульфида натрия и серной кислоты;
в) хлорида цинка и азотной кислоты;
г) сульфита натрия и серной кислоты;
д) сульфата меди (II) и азотной кислоты.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения соответствующих реакций в молекулярном и ионном виде.Ответ:
а) $K_{2}CO_{3} + 2HCl= 2KCl + H_{2}O + CO_{2}↑ $
$2K^{+} + CO_{3}^{2-} + 2H^{+} + 2Cl^{-} = 2K^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑ $
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}↑ $
Реакция идет до конца, т. к. выделяется газ, не имеющий запаха.
б) $Na_{2}S + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}S↑ $
$2Na^{+} + S^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}S↑$
$2H^{+} + S^{2-} = H_{2}S↑ $
Реакция идет до конца, т. к. выделяется газ, имеющий запах тухлых яиц.
в) $ZnCl_{2} + HNO_{3}$ ⇸ реакция не идет, т. к. не образуется осадок или газ.
г) $Na_{2}SO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}O + SO_{2}↑$
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}O + SO_{2}↑ $
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑ $
Реакция идет до конца, т. к. выделяется газ, имеющий запах загорающейся спички.
д) $CuSO_{4} + 2HNO_{3} $⇸ реакция не идет, т. к. не образуется осадок или газ.4. Осуществите реакции, схемы которых:
а) $Ba^{2+} + CO^{2-}_{3} ⟶ BaCO_{3}↓$;
б) $2H^{+} + CO^{2-}_{3}⟶ CO_{2}↑ + H_{2}O$;
в) $H^{+} + OH^{-} ⟶ H_{2}O$;
г) $Fe^{0} ⟶ Fe^{2+}$;
д) $CuO ⟶ Cu^{2+}$;
е) $Pb^{2+} + S^{2-} ⟶ PbS↓$.Ответ:
а) $Ba^{2+} + CO^{2-}_{3} ⟶ BaCO_{3}↓$;
$BaCl_{2} + Na_{2}CO_{3} = 2NaCl + BaCO_{3}↓ $
б) $2H^{+} + CO^{2-}_{3}⟶ CO_{2}↑ + H_{2}O$;
$2HCl + K_{2}CO_{3} = 2KCl + CO_{2}↑ + H_{2}O $
в) $H^{+} + OH^{-} ⟶ H_{2}O$;
$HCl + NaOH = NaCl + H_{2}O $
г) $Fe^{0} ⟶ Fe^{2+}$;
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}↑ $
д) $CuO ⟶ Cu^{2+}$;
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O $
е) $Pb^{2+} + S^{2-} ⟶ PbS↓$.
$Pb(NO_{3})_{2} + Na_{2}S = 2NaNO_{3} + PbS↓$5. Проделайте реакции между следующими веществами:
а) сероводородной и хлорной водой;
б) раствором иодида калия и хлорной водой;
в) соляной кислотой и алюминием;
г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что − восстановителем?Ответ:
а) а) $H_{2}S + Cl_{2} = S + 2HCl $
0 восст-е -
Cl2 + 2 е- → 2Cl | 2 | 2 | 1 окислитель
-2 окисление 0
S — 2e- → S | 2 | | 1 восстановитель
б) б) $2KI + Cl_{2} = 2KCl + I_{2} $
0 восст-е -
Cl2 + 2 е- → 2Cl | 2 | 2 | 1 окислитель
- окисление 0
2I — 2e- → I2 | 2 | | 1 восстановитель
в) в) $2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑ $
+ восст-е 0
H + 2 е- → H2 | 2 | 6 | 3 окислитель
0 окисление +3
Al — 3e- → Al | 2 | | 2 восстановитель
г) г) $Cu + 2H_{2}SO_{4(конц.)} ⟶ CuSO_{4} + SO_{2}↑ + 2H{2}O $
+6 восст-е +4
S + 2 е- → S | 2 | 2 | 1 окислитель
0 окисление +2
Cu — 2e- → Cu | 2 | | 1 восстановитель6. Пользуясь растворами и веществами, находящимися на столе, получите:
а) гидроксид железа (III);
б) сульфид меди (II);
в) оксид серы (IV);
г) карбонат магния;
д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.Ответ:
а) $FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} = 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} = Fe(OH)_{3}↓ $
б) $ CuSO_{4} + Na_{2}S = Na_{2}SO_{4} + CuS↓ $
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + S^{2-} = 2Na^{+} + SO_{4}^{2-} + CuS↓ $
$Cu^{2+} + S^{2-} = CuS↓ $
в) $Na_{2}SO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}O + SO_{2}↑ $
$2Na^{+} + SO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}O + SO_{2}↑ $
$2H^{+} + SO_{3}^{2-} = H_{2}O + SO_{2}↑ $
г) $MgCl_{2} + Na_{2}CO_{3} = 2NaCl + MgCO_{3}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} = 2Na^{+} + 2Cl^{-} + MgCO_{3}↓$
$Mg^{2+} + CO_{3}^{2-} = MgCO_{3}↓ $
д) $Zn + Pb(NO_{3})_{2} = Zn(NO_{3})_{2} + Pb↓ $
$Zn+ Pb^{2+} + 2NO_{3}^{2-} = Zn^{2+} + 2NO_{3}^{2-} + Pb↓ $
$Zn + Pb^{2+} = Zn^{2+} + Pb↓$


