 В этой статье речь пойдет о весьма удивительном школьном предмете, о Химии. И заметьте, мы совершенно без иронии говорим об этом по двум причинам. Первая, предмет сам по себе интересный и весьма полезный в нашей каждодневной жизни, ведь практически все отрасли, сферы и ниши вокруг нас так или иначе связаны с химией, будь то газировка в вашей бутылке или лак для маникюра опять же на ваших ногтях... Мы уж не говорим про что-то действительно важное, вроде значимого производства, где десятки, а может и сотни технологических процессов связанных с химией. И вот второе, это то, что при все том, предмет как правило не особо популярен у школьников, не востребован и зачастую малопонимаем;)
В этой статье речь пойдет о весьма удивительном школьном предмете, о Химии. И заметьте, мы совершенно без иронии говорим об этом по двум причинам. Первая, предмет сам по себе интересный и весьма полезный в нашей каждодневной жизни, ведь практически все отрасли, сферы и ниши вокруг нас так или иначе связаны с химией, будь то газировка в вашей бутылке или лак для маникюра опять же на ваших ногтях... Мы уж не говорим про что-то действительно важное, вроде значимого производства, где десятки, а может и сотни технологических процессов связанных с химией. И вот второе, это то, что при все том, предмет как правило не особо популярен у школьников, не востребован и зачастую малопонимаем;)
Так вот, чтобы хоть как-то сблизить школьников и предмет, мы и создали очередную статью ГДЗ на нашем сайте. Здесь речь пойдет о ГДЗ по химии для учебника за 9 класс, автора Габриелян.
Выбираем интересующую вас вкладку и смотрим ответы.
Ответы к учебнику химия 9 класс Габриелян:
Кликайте по вкладкам с номерами параграфов, чтобы найти свое задание с ответами.
§1
-
ГЛАВА ПЕРВАЯ. Общая характеристика элементов и химических реакций
§1. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Химическая энциклопедия Онлайн".
2) Сайт "Prime Chemical Group".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Характеристика калия:
1) Калий имеет порядковый номер в Периодической системе Z = 19 и массовое число A = 39. Соответственно, заряд ядра его атома +19 (число протонов). Следовательно, число нейтронов в ядре:
N = A − Z = 39 − 19 = 20.
Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19.
Элемент калий находится в 4−м периоде Периодической системы, значит, все электроны атома располагаются на четырех энергетических уровнях. Строение электронной оболочки атома калия можно отразить с помощью следующей схемы:
$_ {19}K$ 2е; 8е; 8е; 1е.
Исходя из строения атома, можно предсказать и степень окисления калия в его соединениях. В химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он получает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия (элементы ІА группы), что связано с увеличением радиусов атомов при переходе от Na к K и Rb. Соответственно в ряду: Na → K → Rb один внешний электрон всё более удаляется от ядра, ослабевает его связь с ядром, и он всё легче покидают атом, который при этом переходит в ион.
2) Для калия − простого вещества − характерна металлическая кристаллическая решётка и металлическая химическая связь, а отсюда и все типичные для металлов свойства:
$4K + O_{2} = 2K_{2}O$
$2K + 2H_{2}O = 2KOH + H_{2}$
$6K + N_{2} = 2K_{3}N$
3) Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что объясняется ростом радиуса атома в ряду:
Na → K → Rb.
4) Металлические свойства у калия выражены сильнее, чем у кальция, что связано с увеличением числа валентных электронов в ряду:
K → Ca → Ga.
5) Оксид калия $K_{2}O$ является основным оксидом и проявляет все типичные свойства основных оксидов:
$K_{2}O + H_{2}O = 2KOH$
$K_{2}O + 2HCl = 2KCl + H_{2}O$
$K_{2}O + SO_{3} = K_{2}SO_{4}$
6) В качестве гидроксида калию соответствует основание KOH, которое проявляет все характерные свойства оснований:
$2KOH + H_{2}SO_{4} = K_{2}SO_{4} + 2H_{2}O$
$6KOH + P_{2}O_{5} = 2K_{3}PO_{4} + 3H_{2}O$
$2KOH + ZnCl_{2} = Zn(OH)_{2} + 2KCl$
7) Летучего водородного соединения калий не образует.?
1. Дайте характеристику элементов: а) фосфора; б) калия.
Ответ:
а) Характеристика фосфора
1) Фосфор имеет порядковый номер в Периодической системе Z = 15 и массовое число А = 31. Соответственно, заряд ядра его атома +15 (число протонов). Следовательно, число нейтронов в ядре:
N = А − Z = 31 − 15 = 16.
Так как атом электронейтрален, то число электронов, содержащихся в атоме фосфора, тоже равно 15.
Элемент фосфор находится в 3−м периоде Периодической системы, значит, все электроны атома располагаются на трёх энергетических уровнях. Строение электронной оболочки атома фосфора можно отразить с помощью следующей схемы:
$_ {15}P$ 2е; 8е; 5е.
2) Фосфор − простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии.
3) Неметаллические свойства у фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка, что объясняется ростом радиуса атома в ряду:
N → P → As.
4) Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее чем у серы, что связано с увеличением числа валентных электронов в ряду:
Si → P → S.
5) Высший оксид имеет формулу − $P_{2}O_{5}$. Проявляет все свойства кислотных оксидов:
$P_{2}O_{5} + 6NaOH = 2Na_{3}PO_{4} + 3H_{2}O$
$P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
$P_{2}O_{5} + 3Na_{2}O = 2Na_{3}PO_{4}$
6) В качестве гидроксида фосфору соответствует кислота $H_{3}PO_{4}$, которая проявляет все характерные свойства кислот.
$H_{3}PO_{4} + 3KOH = K_{3}PO_{4} + 3H_{2}O$
$2H_{3}PO_{4} + 3ZnO = Zn_{3}(PO_{4})_ {2} + 3H_{2}O$
$2H_{3}PO_{4} + 3K_{2}CO_{3} = 2K_{3}PO_{4} + 3H_{2}O + 3CO_{2}$
7) Формула летучего соединения − $PH_{3}$.б) Характеристика калия
1) Калий имеет порядковый номер в Периодической системе Z = 19 и массовое число А = 39. Соответственно, заряд ядра его атома +19 (число протонов). Следовательно, число нейтронов в ядре:
N = А − Z = 39 − 19 = 20.
Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19.
Элемент калий находится в 4−м периоде Периодической системы, значит, все электроны атома располагаются на четырех энергетических уровнях. Строение электронной оболочки атома калия можно отразить с помощью следующей схемы:
$_ {19}K$ 2е; 8е; 8е; 1е.
Исходя из строения атома, можно предсказать и степень окисления калия в его соединениях. В химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он получает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия (элементы ІА группы), что связано с увеличением радиусов атомов при переходе от Na к K и Rb. Соответственно в ряду:
Na → K → Rb
один внешний электрон всё более удаляется от ядра, ослабевает его связь с ядром, и он всё легче покидают атом, который при этом переходит в ион.
2) Для калия − простого вещества − характерна металлическая кристаллическая решётка и металлическая химическая связь, а отсюда и все типичные для металлов свойства.
$4K + O_{2} = 2K_{2}O$
$2K + 2H_{2}O = 2KOH + H_{2}$
$6K + N_{2} = 2K_{3}N$
3) Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что объясняется ростом радиуса атома в ряду:
Na → K → Rb.
4) Металлические свойства у калия выражены сильнее, чем у кальция, что связано с увеличением числа валентных электронов в ряду:
K → Ca → Ga.
5) Оксид калия $K_{2}O$ является основным оксидом и проявляет все типичные свойства основных оксидов.
$K_{2}O + H_{2}O = 2KOH$
$K_{2}O + 2HCl = 2KCl + H_{2}O$
$K_{2}O + SO_{3} = K_{2}SO_{4}$
6) В качестве гидроксида калию соответствует основание KOH, которое проявляет все характерные свойства оснований.
$2KOH + H_{2}SO_{4} = K_{2}SO_{4} + 2H_{2}O$
$6KOH + P_{2}O_{5} = 2K_{3}PO_{4} + 3H_{2}O$
$2KOH + ZnCl_{2} = Zn(OH)_{2} + 2KCl$
7) Летучего водородного соединения калий не образует.2. Запишите уравнения химических реакций, характеризующие свойства: а) $MgO$ и $SO_{3}$; б) $Mg(OH)_{2}$ и $H_{2}SO_{4}$. Уравнения реакций с участием электролитов запишите также в ионной форме.
Ответ:
а) $MgO$ − основный оксид, который реагирует с кислотами, водой и кислотными оксидами.
1) $MgO + 2HCl = MgCl_{2} + H_{2}O$
$MgO + 2H^{+} + 2Cl^{-} = Mg^{2+} + 2Cl^{-} + H_{2}O$
$MgO + 2H^{+} = Mg^{2+} + H_{2}O$
2) $MgO + H_{2}O = Mg(OH)_{2}$
3) $MgO + SO_{3} = MgSO_{4}$
$SO_{3}$ − кислотный оксид, который реагирует с щелочами, водой и основными оксидами.
1) $SO_{3} + 2NaOH = Na_{2}SO_{4} + H_{2}O$
$SO_{3} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO^{2-}_{4} + H_{2}O$
$SO_{3} + 2OH^{-} = SO^{2-}_{4} + H_{2}O$
2) $SO_{3} + H_{2}O = H_{2}SO_{4}$
3) $SO_{3} + Na_{2}O = Na_{2}SO$б) $Mg(OH)_{2}$ − основание, которое реагирует с кислотами и разлагается.
1) $Mg(OH)_{2} = MgO + H_{2}O$
2) $MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O$
$MgO + 2H^{+} + SO^{2-}_{4} = Mg^{2+} + SO^{2-}_{4} + H_{2}O$
$MgO + 2H^{+} = Mg^{2+} + H_{2}O$
$H_{2}SO_{4}$ − кислота, которая реагирует с металлами, щелочами, солями и основными оксидами.
1) $H_{2}SO_{4} + Ca = CaSO_{4} + H_{2}$
$2H^{+} + SO^{2-}_{4} + Ca = Ca^{2+} + SO^{2-}_{4} + H_{2}$
$2H^{+} + Ca = Ca^{2+} + H_{2}$
2) $2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$
$Na^{+} + OH^{-} + 2H^{+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + H_{2}O$
$OH^{-} + H^{+} = H_{2}O$
3) $H_{2}SO_{4} + BaCl_{2} = BaSO_{4} + 2HCl$
$2H_{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = BaSO_{4} + 2H^{+} + 2Cl^{-}$
$SO_{4}^{2-} + Ba^{2+} = BaSO_{4}$
4) $H_{2}SO_{4} + K_{2}O = K_{2}SO_{4} + H_{2}O$
$2H^{+} + SO^{2-}_{4} + K_{2}O = 2K^{+} + SO^{2-}_{4} + H_{2}O$
$2H^{+} + K_{2}O = 2K^{+} + H_{2}O$3. Дайте характеристику магния – простого вещества. Какой тип связи наблюдается в нём? Какие физические свойства имеет металл магний? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором $Cl_{2}$; в) серой; г) азотом $N_{2}$; д) соляной кислотой. Рассмотрите их с позиций процессов окисления−восстановления.
Ответ:
Характеристика магния:
1) Магний имеет порядковый номер в Периодической системе Z = 12 и массовое число A = 24. Соответственно заряд ядра его атома +12 (число протонов). Следовательно, число нейтронов в ядре равно N = A − Z = 12.
Так как атом электронейтрален, то число электронов, содержащихся в атоме магния, тоже равно 12.
Магний – металл серебристо−белого цвета, обладает металлическим блеском, электропроводностью, пластичен.
Элемент магний находится в 3−м периоде Периодической системы, значит, все электроны атома располагаются на трёх энергетических уровнях. Строение электронной оболочки атома магния можно отразить с помощью следующей схемы:
$_ {12}Mg$ 2e; 8e; 2е.
Исходя из строения атома, можно предсказать и степень окисления магния в его соединениях. В химических реакциях атом магния отдает два внешних электрона, проявляя восстановительные свойства, следовательно, он получает степень окисления +2.
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция, что связано с увеличением радиусов атомов при переходе от Ве к Mg и Са. Соответственно, в ряду Be − Mg − Са два внешних электрона всё более удаляются от ядра, ослабевает их связь с ядром, и они всё легче покидают атом, который при этом переходит в ион.
2) Для магния − простого вещества − характерна металлическая кристаллическая решётка и металлическая химическая связь, а отсюда и все типичные для металлов свойства.
3) Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция.
4) Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия.
5) Оксид магния является основным оксидом и проявляет все типичные свойства основных оксидов.
6) В качестве гидроксида магнию соответствует основание $Mg(OH)_{2}$, которое проявляет все характерные свойства оснований.
7) Летучего водородного соединения магний не образует.а) Уравнение реакции магния с кислородом:
$2Mg^{0} + O^{0}_{2} = 2Mg^{+2}O^{-2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
б) Уравнение реакции магния с хлором $Cl_{2}$:
$Mg^{0} + Cl^{0}_{2} = Mg^{+2}Cl^{-1}_{2}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-1}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
в) Уравнение реакции магния с серой:
$Mg^{0} + S^{0} = MgS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
г) Уравнение реакции магния с азотом $N_{2}$:
$3Mg^{0} + N^{0}_{2} = Mg^{+2}_{3}N^{-3}_{2}$
$N_{2}^{0} + 6ē ⟶ 2N^{-3}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
д) Уравнение реакции магния с соляной кислотой:
$Mg^{0} + 2H^{+1}Cl = Mg^{+2}Cl_{2} + H^{0}_{2}$
$2H^{+1} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель4. Что такое аллотропия? Какой тип химической связи реализуется в молекулах состава: а) $S_{8}$; б) $H_{2}S$? Какие физические свойства имеет наиболее устойчивая модификация серы – ромбическая сера? Запишите уравнения реакций серы со следующими веществами: а) натрием; б) кальцием; в) алюминием; г) кислородом; д) водородом; е) фтором $F_{2}$. Рассмотрите их с позиций процессов окисления−восстановления.
Ответ:
Аллотропия − это способность химического элемента существовать в виде двух или нескольких простых веществ.
а) В молекуле состава $S_{8}$ реализуется ковалентная неполярная связь, так как соединение образовано атомами одного химического элемента.
б) В молекуле состава $H_{2}S$ реализуется ковалентная полярная связь, так как соединение образовано атомами разных химических элементов.
Наиболее устойчивая модификация серы – ромбическая сера − вещество желтого цвета, которое нерастворимо в воде.
Уравнения реакций серы:
а) в натрием:
$2Na + S = Na_{2}S$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Na^{0} - 1ē ⟶ Na^{+}$ − восстановитель
б) с кальцием:
$Ca + S = CaS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
в) с алюминием:
$2Al + 3S = Al_{2}S_{3}$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Al^{0} - 3ē ⟶ Al^{+3}$ − восстановитель
г) с кислородом:
$S + O_{2} = SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель
д) с водородом:
$H_{2} + S = H_{2}S$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$H_{2}^{0} - 2ē ⟶ 2H^{+}$ − восстановитель
е) с фтором $F_{2}$:
$S + 3F_{2} = SF_{6}$
$F_{2}^{0} + 2ē ⟶ 2F^{-}$ − окислитель
$S^{0} - 6ē ⟶ S^{+6}$ − восстановитель5. Сравните свойства простого вещества кремния со свойствами простых веществ, образованных химическими элементами – соседями кремния по периоду.
Ответ:
Восстановительные свойства кремния выражены слабее, чем у алюминия, но сильнее, чем у фосфора.
Окислительные свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.6. У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора; б) фосфора или серы?
Ответ:
а) У высшего оксида азота наиболее выражены кислотные свойства, чем у оксида фосфора, так как в группе сверху вниз основные свойства усиливаются, а кислотные уменьшаются.
б) У высшего оксида серы наиболее выражены кислотные свойства, чем у оксида фосфора, так как в периоде слева направо кислотные свойства усиливаются, а основные уменьшаются.
7. Вычислите объём воздуха (примите объёмную долю кислорода в нём равной 0,2), который потребуется для сжигания 120 мг образца магния, содержащего 2% негорючих примесей.
Ответ:
Дано:
m ($Mg_{техн}$) = 120 мг
ω (примесей) = 2%
φ ($O_{2}$) = 0,2
Найти:
V (воздуха) − ?
Решение:
$2Mg + O_{2} = 2MgO$
ω (чистого в−ва) = 100% − ω (примесей) = 100% − 2% = 98%
m (Mg) = m ($Mg_{техн}$) * ω (чистого в−ва) = 120 мг * 0,98 = 117,6 мг
n (Mg) = m : M = 117,6 : 24 = 5 моль
n ($O_{2}$) = n (Mg) : 2 = 5 : 2 = 2,5 моль
V ($O_{2}$) = n ($O_{2}$) * $V_{m}$ = 2,5 моль * 22,4 л/моль = 55 мл
V (воздуха) = V ($O_{2}$) : φ ($O_{2}$) = 55 мл : 0,2 = 275 мл
Ответ: V (воздуха) = 275 мл.8. Вычислите объём оксида серы (IV) (н. у.), который может быть получен при сжигании 1,6 кг серы, если выход продукта составляет 80% от теоретически возможного.
Указание. Сначала по уравнению реакции рассчитайте объём оксида серы (IV) – это теоретический объём $V_{теор}$, затем найдите практический объём $V_{практ}$, исходя из известного выхода продукта W:
W = $V_{практ}$ : $V_{теор}$, отсюда $V_{практ}$ = W * $V_{теор}$
Аналогично можно найти массу продукта реакции, используя формулу:
W = $m_{практ}$ : $m_{теор}$, отсюда $m_{практ}$ = W * $m_{теор}$Ответ:
Дано:
m (S) = 1,6 кг = 1600 г
η = 80%
Найти:
$V_{практ}$ ($SO_{2}$) − ?
Решение:
$S + O_{2} = SO_{2}$
n (S) = m : M = 1600 г : 32 г/моль = 50 моль
n ($SO_{2}$) = n (S) = 50 моль
$V_{теор}$ ($SO_{2}$) = n ($SO_{2}$) * $V_{m}$ = 50 моль * 22,4 л/моль = 1120 л
$V_{практ}$ ($SO_{2}$) = η : $V_{теор}$ ($SO_{2}$) = 0,8 * 1120 = 896 л
Ответ: $V_{практ}$ ($SO_{2}$) = 896 л.9. Можно ли утверждать, что высшему оксиду серы $SO_{3}$ соответствует сернистая кислота $H_{2}SO_{3}$? Почему?
Ответ:
Нельзя утверждать, что высшему оксиду серы $SO_{3}$ соответствует сернистая кислота $H_{2}SO_{3}$, так как степень окисления серы в данном оксиде равна +6, а в кислоте степень окисления равняется +4.
10. Используя метод электронного баланса, определите коэффициенты в схемах химических реакций:
а) $Mg + CO_{2} ⟶ MgO + C$;
б) $S + KClO_{3} ⟶ KCl + SO_{2}$.Ответ:
а) $2Mg + CO_{2} = 2MgO + C$
$C^{+4} + 4ē ⟶ C^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановительб) $3S + 2KClO_{3} = 2KCl + 3SO_{2}$
$Cl^{+5} + 6ē ⟶ Cl^{-}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель §2
-
§2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Лабораторный опыт №1
Получение гидроксида цинка и исследование его свойств
В две пробирки налейте по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), затем добавьте в каждую с помощью пипетки по 5 капель раствора щелочи (гидроксида натрия или калия). Что наблюдаете? Прилейте к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к другой − раствор щелочи. Что наблюдаете? О каком свойстве гидроксида цинка свидетельствует вторая часть опыта? Запишите уравнения проделанных реакций в молекулярной и ионной формах.Ответ:
Получение гидроксида цинка и исследование его свойств
В две пробирки налили по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), затем добавили в каждую с помощью пипетки по 5 капель раствора щелочи (гидроксида натрия или калия).
$ZnCl_{2} + 2NaOH = Zn(OH)_{2} + 2NaCl$
$Zn^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = Zn(OH)_{2} + 2Na^{+} + 2Cl^{-}$
$Zn^{2+} + 2OH^{-} = Zn(OH)_ {2}$
Наблюдаем выпадение белого осадка.
Прилили к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к содержимому другой − раствор щелочи.
1) $Zn(OH)_{2} + 2HCl = ZnCl_{2} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} + 2Cl^{-} = Zn^{2+} + 2Cl^{-} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} = Zn^{2+} + 2H_{2}O$
2) $Zn(OH)_{2} + 2NaOH = Na_{2}[Zn(OH)_{4}]$
$Zn(OH)_{2} + 2Na^{+} + 2OH^{-} = 2Na^{+} + [Zn(OH)_{4}]^{2-}$
$Zn(OH)_{2} + 2OH^{-} = [Zn(OH)_{4}]^{2-}$
В первой пробирке наблюдаем растворение осадка в кислоте.
Во второй пробирке также растворяется осадок.
Вторая часть опыта свидетельствует об амфотерных свойствах гидроксида цинка, так как он реагирует и с кислотами, и с щелочами.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Химическая энциклопедия Онлайн".
2) Сайт "Chem".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Амфотерность
Амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы, так как амфотерные соединения в зависимости от условий могут проявлять как кислотные, так и основные свойства. Как правило, металлы проявляют основные свойства, а неметаллы − кислотные.
Например, цинк − амфотерный металл, который может вступать в реакции как с кислотами, так и с щелочами:
$Zn + 2NaOH + 2H_{2}O = Na_{2}[Zn(OH)_{4}] + H_{2}$
$Zn + 2HCl = ZnCl_{2} + H_{2}$?
1. Почему для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям?
Ответ:
Для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям, так как амфотерный гидроксид может прореагировать со щелочью, если она будет в избытке. Тогда образуется комплексная соль.
2. Запишите уравнения реакций для следующих превращений:
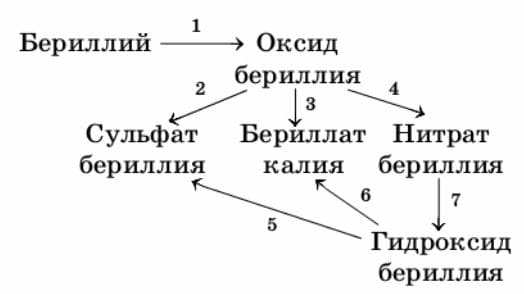
Первую реакцию рассмотрите с позиций окисления−восстановления.Ответ:
1) $2Be + O_{2} = 2BeO$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Be^{0} - 2ē ⟶ Be^{+2}$ − восстановитель
2) $BeO + H_{2}SO_{4} = BeSO_{4} + H_{2}O$
3) $BeO + K_{2}O = K2BeO2$
4) $BeO + 2HNO_{3} = Be(NO_{3})_{2} + H_{2}O$
5) $Be(OH)_{2} + H_{2}SO_{4} = BeSO_{4} + H_{2}O$
6) $Be(OH)_{2} + 2KOH = K_{2}BeO_{2} + 2H_{2}O$
7) $Be(NO_{3})_{2} + 2NaOH = 2NaNO_{3} + Be(OH)_{2}↓$3. Приведите по два молекулярных уравнения реакций, соответствующих сокращённым ионным уравнениям:
а) $Be(OH)_{2} + 2H^{+} ⟶ Be^{2+} + 2H_{2}O$;
б) $Be(OH)_{2} + 2OH^{-} ⟶ BeO_{2}^{2-} + 2H_{2}O$.Ответ:
а) $Be(OH)_{2} + 2H^{+} ⟶ Be^{2+} + 2H_{2}O$
$Be(OH)_{2} + 2HCl = BeCl_{2} + 2H_{2}O$
$Be(OH)_{2} + H_{2}SO_{4} = BeSO_{4} + 2H_{2}O$б) $Be(OH)_{2} + 2OH^{-} ⟶ BeO_{2}^{2-} + 2H_{2}O$
$Be(OH)_{2} + 2KOH = K_{2}BeO_{2} + 2H_{2}O$
$Be(OH)_{2} + 2NaOH = Na_{2}BeO_{2} + 2H_{2}O$4. Докажите, что амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы.
Ответ:
Амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы, так как амфотерные соединения в зависимости от условий могут проявлять как кислотные, так и основные свойства. Как правило, металлы проявляют основные свойства, а неметаллы − кислотные.
§3
-
§3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Лабораторный опыт №2
Моделирование построения Периодической системы Д. И. Менделеева
Смоделируйте построение Периодической системы д. И. Менделеева. Для этого подготовьте 20 карточек размером 6 × 10 см для элементов с порядковыми номерами с 1−го по 20−й. На каждой карточке укажите следующие сведения об элементе: химический символ, название, относительную атомную массу, формулу высшего оксида, гидроксида (в скобках укажите их характер основный, кислотный или амфотерный), формулу летучего водородного соединения (для неметаллов).
Перемещайте карточки, а затем расположите их в ряд по возрастанию относительных атомных масс элементов. Сходные элементы с 1−го по 18−й расположите друг под другом: водород над литием и калий под натрием, соответственно кальций под магнием, гелий под неоном. Сформулируйте выявленную вами закономерность в виде закона. Обратите внимание на несоответствие относительных атомных масс аргона и калия их расположению по общности свойств элементов. Обьясните причину этого явления.Ответ:
Периодический закон: свойства элементов и образованных ими веществ находятся в периодической зависимости относительной атомной массы.
В периодической таблице Менделеева элементы расположены не по возрастанию атомных масс, а по возрастанию количества протонов в ядре. Аргон имеет порядковый номер 18, значит у него 18 протонов в ядре; калий − порядковый номер 19, поэтому у него 19 протонов в ядре. Сделаем вывод, что аргон должен стоять перед калием.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Infourok".
2) Сайт "Multiurok".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Периодический закон и Периодическая система Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы. Эти два важнейших значения Периодического закона и Периодической системы дополняет ещё одно, которое заключается в возможности прогнозировать, т. е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: "Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений, находятся в периодической зависимости от величины зарядов ядер их атомов".?
1. Докажите, что Периодический закон Д. И. Менделеева, как и любой другой закон природы, выполняет объясняющую, обобщающую и предсказательную функции. Приведите примеры, иллюстрирующие эти функции у других законов, известных вам из курсов химии, физики и биологии.
Ответ:
Периодический закон и Периодическая система Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы. Эти два важнейших значения Периодического закона и Периодической системы дополняет ещё одно, которое заключается в возможности прогнозировать, т. е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
Пример закона из курса физики: закон Гука.
Пример закона из курса биологии: закон Менделя.2. Назовите химический элемент, в атоме которого электроны располагаются по уровням согласно ряду чисел: 2, 5. Какое простое вещество образует этот элемент? Какую формулу имеет его водородное соединение и как оно называется? Какую формулу имеет высший оксид этого элемента, каков его характер? Запишите уравнения реакций, характеризующих свойства этого оксида.
Ответ:
Химический элемент, в атоме которого электроны располагаются по уровням согласно ряду чисел: 2, 5 − азот.
Элемент азот образует простое вещество $N_{2}$.
Азот имеет водородное соединение – аммиак $NH_{3}$.
Высший оксид азота $N_{2}O_{5}$ − кислотный оксид.
Взаимодействует с водой:
$N_{2}O_{5} + H_{2}O = 2HNO_{3}$
Взаимодействует с основными оксидами:
$N_{2}O_{5} + K_{2}O = 2KNO_{3}$
Взаимодействует со щелочами:
$N_{2}O_{5} + 2KOH = 2KNO_{3} + H_{2}O$3. Бериллий раньше относили к элементам III группы, и его относительная атомная масса считалась равной 13,5. Почему Д. И. Менделеев перенёс его во II группу и исправил атомную массу бериллия с 13,5 на 9?
Ответ:
Когда бериллий имел относительную атомную массу 13,5, он располагался между углеродом и азотом. В этом случае нарушалась закономерность изменения свойств. Поэтому бериллий перенесли во вторую группу, основываясь на его химических свойствах. Д. И. Менделеев принял решение расположить берилий между литием и бором, а атомную массу исправил на 9 (среднее значение атомных масс лития и бора: $\frac{7\;+\;11}{2}$ = 9).
4. Напишите уравнения реакций между простым веществом, образованным химическим элементом, в атоме которого электроны распределены по энергетическим уровням согласно ряду чисел: 2, 8, 8, 2, и простыми веществами, образованными элементами №7 и №8 в Периодической системе. Каков тип химической связи в продуктах реакции? Какое кристаллическое строение имеют исходные простые вещества и продукты их взаимодействия?
Ответ:
Простое вещество, образованное химическим элементом, в атоме которого электроны распределены по энергетическим уровням согласно ряду чисел: 2, 8, 8, 2 − кальций.
Простое вещество, образованное элементом №7 − азот.
$Ca + N_{2} ⟶ Ca_{3}N_{2}$
Исходные вещества:
Между атомами кальция возникает металлическая связь.
Кальций имеет металлическую кристаллическую решетку.
Молекулы азота образованы ковалентной неполярной связью.
Азот имеют молекулярную кристаллическую решетку.
Продукты реакции:
Молекулы нитрида кальция образованы ионной связью.
Нитрид кальция имеет ионную кристаллическую решетку
Простое вещество, образованное элементом №8 − кислород.
$2Ca + O_{2} ⟶ 2CaO$
Исходные вещества:
Между атомами кальция возникает металлическая связь.
Кальций имеет металлическую кристаллическую решетку.
Молекулы кислорода образованы ковалентной неполярной связью.
Кислород имеет молекулярную кристаллическую решетку.
Продукты реакции:
Молекулы оксида кальция образованы ионной связью.
Оксид кальция имеет ионную кристаллическую решетку.5. Расположите в порядке усиления металлических свойств следующие элементы: As, Sb, N, P, Bi. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
Ответ:
Расположим элементы в порядке усиления металлических свойств:
1) N
2) P
3) As
4) Sb
5) Bi
Эти элементы располагаются в одной группе. В группах сверху вниз усиливаются металлические свойства.6. Расположите в порядке усиления неметаллических свойств следующие элементы: Si, Al, P, S, Cl, Mg, Na. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
Ответ:
Расположим элементы в порядке усиления неметаллических свойств:
1) Na
2) Mg
3) Al
4) Si
5) P
6) S
7) Cl
Эти элементы располагаются в одном периоде. В периоде слева направо усиливаются неметаллические свойства.7. Расположите в порядке ослабления кислотных свойств оксиды, формулы которых: $SiO_{2}, P_{2}O_{5}, Al_{2}O_{3}$, $Na_{2}O, MgO, Cl_{2}O_{7}$. Обоснуйте полученный ряд. Запишите формулы гидроксидов, соответствующих этим оксидам. Как изменяется их кислотный характер в предложенном вами ряду?
Ответ:
Расположим оксиды в порядке ослабления кислотных свойств:
1) $Cl_{2}O_{7}$
2) $P_{2}O_{5}$
3) $SiO_{2}$
4) $Al_{2}O_{3}$
5) MgO
6) $Na_{2}O$
Обоснуем полученный ряд:
$Cl_{2}O_{7}, P_{2}O_{5}, SiO_{2}$ − проявляют кислотные свойства;
$Al_{2}O_{3}$ – проявляет амфотерные свойства;
$MgO, Na_{2}O$ – проявляют основные свойства.
Соответствующие гидроксиды: $HClO_{4}, H_{3}PO_{4}, H_{2}SiO_{3}, Al(OH)_{3}, Mn(OH)_{2}, NaOH$.
В данном ряду гидроксидов кислотный характер ослабевает.8. Напишите формулы оксидов бора, бериллия и лития и расположите их в порядке возрастания основных свойств. Запишите формулы гидроксидов, соответствующих этим оксидам. Каков их химический характер?
Ответ:
Расположим в порядке возрастания основных свойств:
1) $B_{2}O_{3}$
2) BeO
3) $Li_{2}O$Основный оксид Соответствующий гидроксид
$B_{2}O_{3}$ $H_{3}BO_{3}$ (кислотный)
BeO $Be(OH)_{2}$ (амфотерный)
$Li_{2}O$ LiOH (основный)9. Что такое изотопы? Как открытие изотопов способствовало становлению Периодического закона?
Ответ:
Изотопы − это атомы одного химического элемента, имеющие одинаковое число протонов и электронов, но разное число нейтронов.
Открытие изотопов привело к новой формулировки Периодического закона: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.10. Почему заряды атомных ядер элементов в Периодической системе Д. И. Менделеева изменяются монотонно, т.е. заряд ядра каждого последующего элемента возрастает на единицу по сравнению с зарядом атомного ядра предыдущего элемента, а свойства элементов и образуемых ими веществ изменяются периодически?
Ответ:
Заряд атомных ядер возрастают монотонно, так как увеличивается и количество электронов.
Но свойства элементов и образуемых ими веществ изменяются периодически, потому что свойства зависят от количества валентных электронов, которые равны номеру группы.11. Приведите три формулировки Периодического закона, в которых за основу систематизации химических элементов взяты относительная атомная масса, заряд атомного ядра и строение внешних энергетических уровней в электронной оболочке атома.
Ответ:
Первая формулировка Периодического закона: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Вторая формулировка Периодического закона: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Третья формулировка Периодического закона: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних энергетических уровней в электронной оболочке атома. §4
-
§4. Химические реакции. Скорость химической реакции
Лабораторный опыт №3
Замещение железом меди в растворе сульфата меди (II)
Налейте в пробирку 2 мл раствора сульфата меди (II) и поместите в него канцелярскую кнопку или скрепку. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах. Рассмотрите окислительно−восстановительные процессы. На основе молекулярного уравнения отнесите эту реакцию к той или иной группе реакций на основании следующих признаков:
• «число и состав исходных веществ и продуктов реакции» (как вы наверняка помните, по этому признаку различают реакции соединения, разложения, замещения и обмена, в том числе реакции нейтрализации);
• «направление» (напомним, что по этому признаку реакции делят на две группы: обратимые и необратимые);
• «тепловой эффект» (различают реакции эндо−экзотермические, в том числе реакции горения);
• «изменение степеней окисления элементов, образующих вещества, участвующие в реакции» (окислительно−восстановительные и без изменения степеней окисления):
• «агрегатное состояние реагирующих веществ»
(гомогенные и гетерогенные);
• «участие катализатора» (некаталитические и каталитические, в том числе ферментативные).
Теперь проверьте себя.
$CuSO_{4} + Fe = FeSO_{4} + Cu$.
1) Это реакция замещения, так как из исходных простого и сложного веществ образуются новое простое и новое сложное вещества.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Эта реакция, вероятно, экзотермическая, т.е. протекает с незначительным выделением теплоты (такой вывод вы можете сделать на основании того, что для протекания этой реакции не требуется непрерывного нагревания содержимого пробирки).
4) Это окислительно восстановительная реакция, так как свои степени окисления изменили медь и железо:
(окислитель) $Cu^{2+}$ + 2е → $С^{0}$ (восстановление);
(восстановитель) $Fe^{0}$ → 2é $Fe^{2+}$ (окисление).
5) Эта реакция гетерогенная, так как протекает между твёрдым веществом и раствором.
6) Реакция протекает без участия катализатора − некаталитическая.
(Вспомните из курса 8 класса, какие вещества называются катализаторами. Верно, это вещества, которые ускоряют химическую реакцию.)Ответ:
Замещение железом меди в растворе сульфата меди (II)
$CuSO_{4} + Fe = FeSO_{4} + Cu$.
1) Это реакция замещения, так как из исходных простого и сложного веществ образуются новое простое и новое сложное вещества.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Эта реакция, вероятно, экзотермическая, т.е. протекает с незначительным выделением теплоты (такой вывод вы можете сделать на основании того, что для протекания этой реакции не требуется непрерывного нагревания содержимого пробирки).
4) Это окислительно восстановительная реакция, так как свои степени окисления изменили медь и железо:
(окислитель) $Cu^{2+}$ + 2е → $С^{0}$ (восстановление);
(восстановитель) $Fe^{0}$ → 2é $Fe^{2+}$ (окисление).
5) Эта реакция гетерогенная, так как протекает между твёрдым веществом и раствором.
6) Реакция протекает без участия катализатора − некаталитическая.Лабораторный опыт №4
Зависимость скорости химической реакции от природы реагирующих веществ на примере взаимодействия кислот с металлами
Поместите в одну пробирку гранулу цинка, а в другую − кусочек железа такого же размера и налейте в обе пробирки по 1−2 мл соляной кислоты. Природа какого реагента оказывает влияние на скорость взаимодействия кислоты с металлом? Почему? Запишите уравнения реакций в молекулярной и ионной формах.
Рассмотрите их с позиции окисления−восстановления.
Далее поместите в две другие пробирки по одинаковой грануле цинка и прилейте к ним растворы кислот одинаковой концентрации: в 1−ю − соляной кислоты, во 2−ю − уксусной. Природа какого реагента оказывает влияние на скорость взаимодействия кислоты с металлом? Почему? Зацишите уравнения реакций в молекулярной и ионной формах. Рассмотрите их с позиции окисления восстановления.Ответ:
Зависимость скорости химической реакции от природы реагирующих веществ на примере взаимодействия кислот с металлами
Поместили в одну пробирку гранулу цинка, а в другую − кусочек железа такого же размера и налили в обе пробирки по 1−2 мл соляной кислоты.
Быстрее реакция протекает в пробирке с цинком, так как цинк − более активный металл, чем железо.
$2HCl + Zn = ZnCl_{2} + H_{2}↑$
$2H^{+} + 2Cl^{-} + Zn = Zn^{2+} + 2Cl^{-} + H_{2}↑$
$2H^{+} + Zn = Zn^{2+} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
$2HCl + Fe = FeCl_{2} + H_{2}↑$
$2H^{+} + 2Cl^{-} + Fe = Fe^{2+} + 2Cl^{-} + H_{2}↑$
$2H^{+} + Fe = Fe^{2+} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
Далее поместили в две другие пробирки по одинаковой грануле цинка и прилили к ним растворы кислот одинаковой концентрации: в 1−ю − соляной кислоты, во 2−ю − уксусной.
Быстрее реакция протекает в пробирке с соляной кислотой, так как соляная кислота − более сильная, чем уксусная.
$2HCl + Zn = ZnCl_{2} + H_{2}↑$
$2H^{+} + 2Cl^{-} + Zn = Zn^{2+} + 2Cl^{-} + H_{2}↑$
$2H^{+} + Zn = Zn^{2+} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
$2CH_{3}COOH + Zn = (CH_{3}COO)_{2}Zn + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановительЛабораторный опыт №5
Зависимость скорости химической реакции от концентрации реагирующих веществ на примере взаимодействия цинка с соляной кислотой различной концентрации
Налейте в три пробирки соляную кислоту: в 1−ю пробирку 3 мл, во 2−ю − 2 мл, в 3−ю − 1 мл. Затем добавьте во 2−ю пробирку 1 мл воды, а и 3−ю − 2 мл. Следовательно, в пробирках одинаковые объёмы раствора кислоты, которые, однако, будут отличаться концентрацией. В какой из пробирок концентрация кислоты
выше, а в какой ниже? Поместите в каждую пробирку по грануле цинка. В какой из пробирок выделение водорода происходит интенсивнее? Почему?Ответ:
Зависимость скорости химической реакции от концентрации реагирующих веществ на примере взаимодействия цинка с соляной кислотой различной концентрации
Налили в три пробирки соляную кислоту: в 1−ю пробирку 3 мл, во 2−ю − 2 мл, в 3−ю − 1 мл. Затем добавили во 2−ю пробирку 1 мл воды, а и 3−ю − 2 мл. Следовательно, в пробирках одинаковые объёмы раствора кислоты, которые, однако, будут отличаться концентрацией.
Концентрация кислоты выше в той пробирке, куда не приливалась вода, а ниже там, куда прилили 2 мл воды.
Поместили в каждую пробирку по грануле цинка.
В первой пробирке выделение водорода происходит интенсивнее, так как в этой пробирке концентрация кислоты наивысшая.Лабораторный опыт №6
Зависимость скорости химической реакции от площади соприкосновения реагирующих веществ
Поместите в одну пробирку гранулу цинка (или кусочек мрамора), а в другую порошок цинка (или мраморную крошку) и налейте в обе пробирки по 1 мл соляной кислоты. В какой из пробирок скорость выделения газа выше? Почему?Ответ:
Зависимость скорости химической реакции от площади соприкосновения реагирующих веществ
Поместили в одну пробирку гранулу цинка (или кусочек мрамора), а в другую порошок цинка (или мраморную крошку) и налили в обе пробирки по 1 мл соляной кислоты.
Скорость выделения газа будет выше в пробирке с порошком цинка (или мраморной крошкой), так как площадь соприкосновения реагирующих веществ будет больше.Лабораторный опыт №7
Моделирование «кипящего слоя»
Смоделируйте «кипящий слой». Для этого на кольце лабораторного штатива закрепите кусочек сетчатой ткани. Насыпьте на неё 1− 2 столовые ложки манной крупы. Снизу осторожно продувайте воздух с помощью резиновой груши или насоса. Что наблюдаете?Ответ:
Моделирование «кипящего слоя»
Смоделировали «кипящий слой». Для этого на кольце лабораторного штатива закрепили кусочек сетчатой ткани. Насыпали на неё 1− 2 столовые ложки манной крупы. Снизу осторожно продували воздух с помощью резиновой груши или насоса.
Наблюдаем подпрыгивание частиц крупы.Лабораторный опыт №8
Зависимость скорости химической реакции от температуры реагирующих веществ на примере взаимодействия оксида меди (II) с раствором серной кислоты различной температуры
В две пробирки с помощью шпателя насыпьте немного чёрного порошка оксида меди (II) и налейте в каждую по 3−4 мл раствора серной кислоты. Одну пробирку поместите в стакан с горячей водой, другую нагрейте на пламени спиртовки (используйте пробиркодержатель). Что наблюдаете? Объясните результаты наблюдений. Запишите уравнение реакции в молекулярной и ионной формах.Ответ:
Зависимость скорости химической реакции от температуры реагирующих веществ на примере взаимодействия оксида меди (II) с раствором серной кислоты различной температуры
В две пробирки с помощью шпателя насыпали немного чёрного порошка оксида меди (II) и налили в каждую по 3−4 мл раствора серной кислоты. Одну пробирку поместили в стакан с горячей водой, другую нагрели на пламени спиртовки.
Заметили, что в пробирке нагретой на пламени спиртовки растворение порошка оксида меди (II) произошло быстрее, чем в пробирке с горячей водой.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} ⟶ Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} ⟶ Cu^{2+} + H_{2}O$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Infourok".
2) Сайт "Multiurok".
3) Сайт "Foxford".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Классификация химической реакции
Химические реакции классифицируют по нескольким признакам:
1) число и состав исходных веществ и продуктов реакции;
2) направление;
3) тепловой эффект;
4) изменение степеней окисления элементов, образующих вещества, участвующие в реакции;
5) агрегатное состояние реагирующих веществ;
6) участие катализатора.
Приведем пример:
$4P + 5O_{2} = 2P_{2}O_{5}$
1) Это реакция соединения, так как из двух исходных веществ образуется одно сложное вещество.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Это реакция экзотермическая, то есть протекает с незначительным выделением теплоты.
4) Это окислительно−восстановительная реакция, так как свои степени окисления изменили фосфор и кислород.
$P^{0} - 5ē ⟶ P^{+5}$
$O_{2} - 4ē ⟶ 2O^{-2}$
5) Эта реакция гетерогенная, так как протекает между твердым веществом и газом.
6) Реакция протекает без участия катализатора − некаталитическая.?
1. Что такое химическая реакция? В чём суть химических процессов?
Ответ:
Химическая реакция − это ответное действие веществ на воздействие других веществ и физических факторов.
В результате химической реакции разрушаются старые химические связи, а возникают новые и, как следствие, из исходных веществ образуются новые вещества.2.Дайте полную классификационную характеристику следующих химических процессов:
а) горению фосфора;
б) взаимодействию раствора серной кислоты с алюминием;
в) реакции нейтрализации;
г) образованию оксида азота (IV) из оксида азота (II) и кислорода.Ответ:
а) $4P + 5O_{2} = 2P_{2}O_{5}$
1) Это реакция соединения, так как из двух исходных веществ образуется одно сложное вещество.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Это реакция экзотермическая, то есть протекает с незначительным выделением теплоты.
4) Это окислительно−восстановительная реакция, так как свои степени окисления изменили фосфор и кислород.
$P^{0} - 5ē ⟶ P^{+5}$
$O_{2} - 4ē ⟶ 2O^{-2}$
5) Эта реакция гетерогенная, так как протекает между твердым веществом и газом.
6) Реакция протекает без участия катализатора − некаталитическая.б) $2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}$
1) Это реакция замещения, так как из исходных простого и сложного веществ образуются новое простое и новое сложное вещества.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Это реакция экзотермическая, то есть протекает с незначительным выделением теплоты.
4) Это окислительно−восстановительная реакция, так как свои степени окисления изменили алюминий и водород.
$Al^{0} - 3ē ⟶ Al^{+3}$
$2H^{+} - 2ē ⟶ H_{2}^{0}$
5) Эта реакция гетерогенная, так как протекает между твердым веществом и раствором.
6) Реакция протекает без участия катализатора − некаталитическая.в) $HCl + KOH = KCl + H_{2}O$
1) Это реакция обмена, так как из исходных сложных веществ образуются новые сложные вещества.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Это реакция экзотермическая, то есть протекает с незначительным выделением теплоты.
4) Это не окислительно−восстановительная реакция, так как степени окисления не изменяются.
5) Эта реакция гетерогенная, так как протекает между твердым веществом и раствором.
6) Реакция протекает без участия катализатора − некаталитическая.г) $2NO + O_{2} = 2NO_{2}$
1) Это реакция соединения, так как из двух исходных веществ образуется новое сложное вещество.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Это реакция экзотермическая, то есть протекает с незначительным выделением теплоты.
4) Это окислительно−восстановительная реакция, так как свои степени окисления изменили азот и кислород.
$N^{+2} - 2ē ⟶ N^{+4}$
$O_{2} - 4ē ⟶ 2O^{-2}$
5) Эта реакция гомогенная, так как протекает между двумя газообразными веществами.
6) Реакция протекает без участия катализатора − некаталитическая.
3. На основе личного опыта приведите примеры химических реакций, протекающих с различной скоростью.Ответ:
Реакция образования ржавчины протекает с небольшой скоростью:
$4Fe + 3O_{2} + 6H_{2}O = 4Fe(OH)_ {3}$
Реакция взаимодействие водорода и азота протекает с большой скоростью:
$N_{2} + 3H_{2} = 2NH_{3}$4. Что такое скорость химической реакции? От каких факторов она зависит?
Ответ:
Скорость химической реакции − это изменение концентрации реагирующих веществ в единицу времени.
Скорость химической реакции зависит от:
1) природы реагирующих веществ;
2) концентрации реагирующих веществ;
3) площади соприкосновения реагирующих веществ;
4) температуры;
5) наличия катализатора.5. Приведите примеры влияния различных факторов на биохимические и производственные химические процессы.
Ответ:
Концентрацию газообразных веществ для гомогенных производственных процессов повышают, увеличивая давление. Например, так поступают при производстве серной кислоты, аммиака, этилового спирта.
Фактор зависимости скорости химической реакции от концентрации реагирующих веществ учитывается не только на производстве, но и в других областях жизнедеятельности человека, например, в медицине. Больным с заболеваниями легких, у которых скорость взаимодействия гемоглобина крови с кислородом воздуха низкая, облегчают дыхание с помощью кислородных подушек.6. На основе личного опыта приведите примеры влияния различных факторов на химические реакции, протекающие в повседневной жизни.
Ответ:
Природа реагирующих веществ: ртуть не растворяется в соляной кислоте, в отличие алюминия.
Концентрация реагирующих веществ: гидрокарбонат натрия быстрее реагирует с 9% уксусом, чем с 3%.
Площадь соприкосновения реагирующих веществ: медный порошок быстрее реагирует с кислородом, чем гранула меди.
Температура: для ускорения дрожжевого брожения повышают температуру.7. Почему продукты питания хранят в холодильнике?
Ответ:
Продукты питания хранят в холодильнике, так как там низкая температура, поэтому продукты питания дольше хранятся. Высокие температуры ускоряют процесс брожения, из−за которого продукты портятся.
8. Химическую реакцию начали проводить при температуре 100°C, затем подняли до 150°C. Температурный коэффициент этой реакции равен 2. Во сколько раз возрастёт скорость химической реакции?
Ответ:
Дано:
$t_{1}$ = 100°C
$t_{2}$ = 150°C
γ = 2
Найти:
$\frac{v_{2}}{v_{1}}$ = ?
Решение:
По закону Вант−Гоффа при повышении температуры на каждые 10°С скорость химической реакции возрастает в 2−4 раза (эта величина называется температурным коэффициентом).
$v_{2}$ = $v_{1}$ * $γ^{\frac{t_{2}-t_{1}}{10}}$
$\frac{v_{2}}{v_{1}}$ = $2^{\frac{150 - 100}{10}}$ = $2^{5}$ = 32.
Ответ: скорость химической реакции возрастет в 32 раза. §5
-
§5. Катализаторы и катализ
Лабораторный опыт №9
Разложение пероксида водорода с помощью оксида марганца (IV)
Налейте в пробирку 3−4 мл раствора пероксида водорода. Отверстием стеклянной трубочки наберите немного порошка оксида марганца (IV), осторожно высыпьте его в пробирку. Что наблюдаете? Внесите в верхнюю часть пробирки тлеющую лучинку. Что наблюдаете? Дайте характеристику проделанной реакции по всем известным вам признакам классификации химических реакций. Какой катализ вы наблюдали в ходе этого эксперимента?Ответ:
Разложение пероксида водорода с помощью оксида марганца (IV)
Налили в пробирку 3−4 мл раствора пероксида водорода. Отверстием стеклянной трубочки набрали немного порошка оксида марганца (IV), осторожно высыпали его в пробирку.
Наблюдаем бурное выделение газа.
Внесли в верхнюю часть пробирки тлеющую лучинку.
Наблюдаем вспыхивание тлеющей лучинки.
$2H_{2}O_{2} = 2H_{2}O + O_{2}$
1) Это реакция разложения, так как из одного исходного вещества образуются новое простое и новое сложное вещества.
2) Эта реакция необратимая, так как протекает только в одном направлении.
3) Это реакция экзотермическая, то есть протекает с незначительным выделением теплоты.
4) Это окислительно−восстановительная реакция, так как свои степени окисления изменили кислород и водород.
5) Эта реакция гетерогенная.
6) Реакция протекает с участием катализатора − каталитическая.
Вид катализа − гетерогенный.Лабораторный опыт №10
Обнаружение каталазы в пищевых продуктах
Исследуем некоторые пищевые продукты на наличие в них фермента каталазы (эксперимент лучше выполнять в группе). В шесть пробирок налейте по 3−4 мл раствора пероксида водорода и поместите в них кусочки: сырого и варёного картофеля, сыра, дрожжей, сырой и варёной печени. Почему в одних случаях наблюдалось выделение кислорода, а в других − нет? Если в пробирку с раствором пероксида водорода добавить несколько капель свежеполученного морковного или картофельного сока, то наблюдается характерное вскипание из−за выделяющегося кислорода. Какой вид катализа вы наблюдали в ходе этого эксперимента?Ответ:
Обнаружение каталазы в пищевых продуктах
Исследуем некоторые пищевые продукты на наличие в них фермента каталазы. В шесть пробирок налили по 3−4 мл раствора пероксида водорода и поместили в них кусочки: сырого и варёного картофеля, сыра, дрожжей, сырой и варёной печени.
В одних случаях наблюдалось выделение кислорода, а в других − нет, так как с продуктами прошедшие температурную обработку разложение пероксида водорода не наблюдалось, так как под действием температуры фермент разрушается.
Если в пробирку с раствором пероксида водорода добавить несколько капель свежеполученного морковного или картофельного сока, то наблюдается характерное вскипание из−за выделяющегося кислорода.
Вид катализа − ферментативный.Лабораторный опыт №11
Ингибирование взаимодействия кислот с металлами уротропином
Поместите в две пробирки по небольшому гвоздю (грануле цинка), налейте в них раствор серной или соляной кислоты. Добавьте в одну пробирку немного уротропина. Что наблюдаете? Объясните результаты наблюдений.Ответ:
Ингибирование взаимодействия кислот с металлами уротропином
Поместили в две пробирки по небольшому гвоздю (грануле цинка), налили в них раствор серной или соляной кислоты. Добавили в одну пробирку немного уротропина. Так как уротропин является ингибитором, т.е. замедляет протекает химической реакции, то в пробирках с уротропином не наблюдается выделение выделение пузырьков газа.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Studopedia".
2) Сайт "Multiurok".
3) Сайт "School−science".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Катализаторы
Катализаторы − это вещества, изменяющие скорость химической реакции или путь, по которому она протекает.
В химических реакциях катализаторы понижают энергию активации, соединяясь с одним из реагирующих веществ и проводя его вдоль "энергетической горы" на встречу с другим веществом с меньшими затратами энергии. Поэтому в присутствии катализатора химические реакции протекают не только быстрее, но и при более низкой температуре.?
1. Что такое катализаторы? Какую роль они играют в химических реакциях? Почему катализаторы ускоряют течение химических реакций?
Ответ:
Катализаторы − это вещества, изменяющие скорость химической реакции или путь, по которому она протекает.
В химических реакциях катализаторы понижают энергию активации, соединяясь с одним из реагирующих веществ и проводя его вдоль "энергетической горы" на встречу с другим веществом с меньшими затратами энергии. Поэтому в присутствии катализатора химические реакции протекают не только быстрее, но и при более низкой температуре.2. Какую роль в истории человеческой цивилизации сыграл ферментативный катализ?
Ответ:
Благодаря ферментативному расщеплению органических веществ человек научился печь хлеб, варить пиво, изготавливать вино и сыр.
3. Подготовьте сообщение о роли катализаторов в современном производстве.
Ответ:
Роль катализаторов в современном производстве
Катализаторы играют важную роль в промышленности, поскольку они ускоряют химические реакции, снижают температуру и давление, необходимые для проведения реакции, улучшают качество конечного продукта.
Кроме того, катализаторы позволяют проводить реакции при низких температурах, что позволяет сэкономить энергию и снизить затраты на оборудование.4. Подготовьте сообщение о роли ингибиторов в современном производстве.
Ответ:
Роль ингибиторов в современном производстве
Ингибиторы помогают замедлять коррозию металла, поскольку металлические конструкции на производствах подвергаются воздействию агрессивных сред.
В пищевой промышленности ингибиторы входят в состав соков и других напитков, содержащих сахар. Это предотвращает появление бактерий и замедляет процесс брожения.5. Подготовьте сообщение о роли антиоксидантов в медицине и пищевой промышленности.
Ответ:
Роль антиоксидантов в медицине и пищевой промышленности
Антиоксиданты − вещества, которые обладают способностью вступать во взаимодействие с различными окислителями, активными формами кислорода, другими свободными радикалами. Лекарственные препараты, обладающие антиоксидантной активностью, широко применяются в медицине.
Антиоксиданты используются в качестве пищевых добавок с целью уменьшения порчи пищевых продуктов. Воздействие кислорода и солнечного света являются двумя основными факторами при окислении пищи.Темы для дискуссии
1. Докажите относительность деления оксидов и гидроксидов на основные и кислотные.
Ответ:
Деление оксидов и гидроксидов на основные и кислотные имеет относительный характер, так как есть понятие амфотерность. Например, цинк − амфотерный металл, оксид которого реагирует и с кислотами, и с щелочами, то есть является амфотерным.
2. Существует ли зависимость между кислотно−основными свойствами оксидов и гидроксидов металлов и значениями их степеней окисления? Подтвердите свое мнение примерами.
Ответ:
Свойства оксидов и гидроксидов металлов зависят от степени окисления металла. Чем выше степень окисления металла, тем сильнее выражены его кислотные свойства.
Например: оксид хрома (II) и гидроксид хрома (II) проявляют основные свойства, а оксид хрома (VI) является кислотным.3. Установите аналогию между становлением и развитием Периодического закона Д. И. Менделеева и какой−либо основополагающей физической или биологической теорией.
Ответ:
Периодический закон
Периодический закон был открыт Д. И. Менделеевым в ходе работы над текстом учебника «Основы химии», когда он столкнулся с трудностями систематизации фактического материала. К середине февраля 1869 г., обдумывая структуру учебника, учёный постепенно пришёл к выводу, что свойства простых веществ и атомные массы элементов связывает некая закономерность. Так появился Периодический закон Д. И. Менделеева.
Теория Опарина
Это гипотеза о происхождении жизни, предложенная русским ученым Александром Опариным в 1924 году. Эта теория постулирует, что вся жизнь возникла самопроизвольно из неодушевленных материалов, таких как метан, водяной пар и водород. Согласно этой теории, также называемой гипотезой Опарина−Холдейна, происхождение жизни на Земле было результатом медленного и постепенного процесса химической эволюции, который, вероятно, произошел около 3,8 миллиардов лет назад. §6
-
ГЛАВА ВТОРАЯ. Металлы
§6. Положение металлов в Периодической системе Д.И.Менделеева и строение их атомов
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Pandia".
2) Сайт "Studopedia".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Восстановительные свойства металлов
Восстановительные свойства атомов металлов определяются способностью отдавать внешние электроны. Чем дальше от ядра располагается электрон, тем легче атом его отдает.
Восстановительные свойства металлов – это способность металлов восстанавливаться в свою первоначальную форму после изменения своей структуры. Они являются важным фактором при проектировании и использовании металлических конструкций, так как позволяют предотвратить поломку и повреждение материала.
Одним из примеров восстановительных свойств металлов является способность жаропрочных сталей восстанавливаться после деформации при высоких температурах. Это обеспечивает длительный срок эксплуатации стальных конструкций при высоких температурах.?
1. Какие особенности строения атомов металлов определяют их восстановительные свойства?
Ответ:
Восстановительные свойства атомов металлов определяются способностью отдавать внешние электроны. Чем дальше от ядра располагается электрон, тем легче атом его отдает.
2. Назовите химический элемент, образующий простое вещество – самый активный металл. Обоснуйте свой выбор.
Ответ:
Франций (Fr) − самый активный металл, так как атом франция имеет самый большой радиус, а значит легче отдает внешние электроны.
3. Как согласуется утверждение о том, что металлы проявляют только восстановительные свойства и, следовательно, при этом окисляются, с процессом, который можно отразить с помощью уравнения $Cu^{+2} + 2ē ⟶ Cu^{0}$? Назовите этот процесс. В каких формах существования химического элемента выступает медь? Для какой формы существования химических элементов справедливо указанное выше утверждение?
Ответ:
Металлы проявляют восстановительные свойства, то есть являются восстановителями.
$Cu^{+2} + 2e = Cu^{0}$
$Cu^{+2}$ − окислитель, процесс – восстановление; +2 – максимальная степень окисления для меди.
Химический элемент Cu может существовать как в виде простого вещества – металла меди, так и в форме иона $Cu^{+2}$.
Таким образом, $Cu^{+2}$ может либо не изменять свою степень окисления, либо понижать её. §7
-
§7. Физические свойства металлов
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Pandia".
2) Сайт "Studmed".
3) Сайт "Elar".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Физические свойства металлов
Важнейшими характерными физическими свойствами металлов являются высокие электро− и теплопроводность, пластичность, металлический блеск. Общие свойства металлов обусловлены металлической связью и строением их кристаллических решёток. Такие свойства металлов, как твёрдость, плотность, температура плавления изменяются в широких пределах.
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
В технике используют такие свойства металлов, как электропроводность, температура плавления, металлический блеск.?
1. Назовите самый легкоплавкий металл.
Ответ:
Самым легкоплавким металлом является ртуть.
2. Какие физические свойства металлов используют в технике?
Ответ:
В технике используют такие свойства металлов, как электропроводность, температура плавления, металлический блеск.
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
Ответ:
Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия, так как щелочные металлы легко отдают свой единственный валентный электрон.
Явление фотоэффекта находит применение в фотоэлементах.4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
Ответ:
Тугоплавкость и прочность − эти физические свойства вольфрама лежат в основе его применения в лампах накаливания.
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
Ответ:
В основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи» лежат такие свойства металлов, как металлический блеск и серебристый цвет.
§8
-
§8. Сплавы
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Scientificrussia".
2) Сайт "Elit−material".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Сплавы и их классификация
Сплавом считается соединение нескольких металлов, как сплавы железа или алюминия, либо соединение одного металла, как железо, с несколькими другими неметаллическими добавками, элементами двух или более.
Широкое применение среди всевозможных сплавов нашли различные стали, чугун, сплавы на основе меди, свинца, алюминия, магния, а также легкие сплавы.
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2−4%. Стали и чугуны содержат легирующие добавки: стали– Cr, V, Ni, а чугун – Si.
Существует несколько способов классификации сплавов:
1) по способу изготовления (литые и порошковые сплавы);
2) по составу (гомогенные и гетерогенные сплавы);
3) по числу компонентов (двойные, тройные и т.д.);
4) по характерным свойствам (тугоплавкие, легкоплавкие, высокопрочные, жаропрочные, твердые, антифрикционные, коррозионностойкие и др.).?
1. Какой период в истории человечества называют бронзовым веком? Почему?
Ответ:
Бронзовый век − это исторический период, примерно с 3300 по 1200 год до нашей эры, который характеризовался использованием бронзы.
Период в истории человечества называют бронзовым веком, потому что люди начали использовать не чистую медную руду, а руду, содержащую одновременно и медь, и олово. В результате была получена бронза, по своим характеристикам гораздо твёрже предыдущих компонентов.2. Вычислите количества веществ меди и никеля, которые нужно взять для производства 25 кг мельхиора.
Ответ:
Дано:
ω (Cu) = 80%
ω (Ni) = 20%
m (мельхиора) = 25 кг
Найти:
n (Cu) − ?
n (Ni) − ?
Решение:
m (Cu) = m (мельхиора) * ω (Cu) = 25 кг * 0,8 = 20 кг = 20000 г
n (Cu) = $\frac{m}{M}$ = $\frac{20000}{64}$ = 312,5 моль
m (Ni) = m (мельхиора) * ω (Ni) = 25 кг * 0,2 = 5 кг = 5000 г
n (Ni) = $\frac{m}{M}$ = $\frac{5000}{59}$ = 84,8 моль
Ответ: n (Cu) = 312,5 моль; n (Ni) = 84,8 моль.3. Что объединяет два выражения: «легирующие элементы стали» и «привилегированное положение в обществе»?
Ответ:
Два выражения: «легирующие элементы стали» и «привилегированное положение в обществе» объединяет то, что в стали содержание легирующих элементов небольшое, так же как и привилегированное положение имеет небольшое количество людей.
4. Вычислите объём водорода (н. у.), который образуется при растворении 100 г латуни, содержащей 13% цинка, в соляной кислоте.
Ответ:
Дано:
m (латуни) = 100 г
ω (Zn) = 13%
Найти:
V ($H_{2}$) − ?
Решение:
$Zn + 2HCl = ZnCl_{2} + H_{2}$
m (Zn) = m (латуни) * ω (Zn) = 100 * 0,13 = 13 г
n (Zn) = $\frac{m}{M}$ = $\frac{13}{65}$ = 0,2 моль
n ($H_{2}$) = n (Zn) = 0,2 моль
V ($H_{2}$) = n * $V_{m}$ = 0,2 * 22,4 = 4,48 л
Ответ: V ($H_{2}$) = 4,48 л. §9
-
§9. Химические свойства металлов
Лабораторный опыт №12
Взаимодействие растворов кислот и солей с металлами
Налейте в две пробирки по 2 мл растворов серной и соляной кислот, поместите в каждую по кусочку магния или цинка. Что наблюдаете? Выпишите уравнения реакций в молекулярной и ионной формах. Рассмотрите окислительно восстановительные процессы.
Налейте в две пробирки по 2 мл раствора сульфата меди (II), поместите в одну кусочек железа, в другую гранулу цинка. Что наблодаете? Выпишите уравнения реакций в молекулярной и ионной формах. Рассмотрите окислительно восстановительные процессы.Ответ:
Взаимодействие растворов кислот и солей с металлами
Налили в две пробирки по 2 мл растворов серной и соляной кислот, поместили в каждую по кусочку цинка.
Наблюдаем выделение пузырьков газа − водорода.
$Zn + 2HCl = ZnCl_{2} + H_{2}↑$
$Zn + 2H^{+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + H_{2}↑$
$Zn + 2H^{+} ⟶ Zn^{2+} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
Налили в две пробирки по 2 мл раствора сульфата меди (II), поместили в одну кусочек железа, в другую гранулу цинка.
Наблюдаем покрытие кусочка железа медным налетом.
$Fe + CuSO_{4} = FeSO_{4} + Cu$
$Fe + Cu^{2+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + Cu$
$Fe + Cu^{2+} ⟶ Fe^{2+} + Cu$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановительi
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Skysmart".
2) Сайт "Solverbook".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Восстановительные свойства металлов
Восстановительные свойства атомов металлов определяются способностью отдавать внешние электроны. Чем дальше от ядра располагается элекрон, тем легче атом его отдает.
Восстановительные свойства металлов – это способность металлов восстанавливаться в свою первоначальную форму после изменения своей структуры. Они являются важным фактором при проектировании и использовании металлических конструкций, так как позволяют предотвратить поломку и повреждение материала.
Одним из примеров восстановительных свойств металлов является способность жаропрочных сталей восстанавливаться после деформации при высоких температурах. Это обеспечивает длительный срок эксплуатации стальных конструкций при высоких температурах.?
1. Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины.
Ответ:
$3Fe + 4H_{2}O = FeO * Fe_{2}O_{3} + 4H_{2}↑$
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
$2Fe^{0} - 6ē ⟶ 2Fe^{+3}$ − восстановитель
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
Три атома железа отдают молекуле воды в реакции образования железной окалины 8 электронов.2. Вычислите объём воздуха (н. у.), который потребуется для сжигания 36 г магния (напоминаем, что объёмная доля кислорода в воздухе равна 0,21.)
Ответ:
Дано:
m (Mg) = 36 г
φ = 0,21
Найти:
V (воздуха) − ?
Решение:
$2Mg + O_{2} = 2MgO$
n (Mg) = $\frac{m}{M}$ = $\frac{36}{24}$ = 1,5 моль
n ($O_{2}$) = $\frac{n (Mg)}{2}$ = $\frac{1,5}{2}$ = 0,75 моль
V ($O_{2}$) = $V_{m}$ * n = 22,4 * 0,75 = 16,8 л
V (воздуха) = $\frac{V (O_{2})}{φ}$ = $\frac{16,8}{0,21}$ = 80 л
Ответ: V (воздуха) = 80 л.3. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80% от теоретически возможного.
Ответ:
Дано:
m (Ca) = 120 мг = 0,12 г
η = 80%
Найти:
$V_{практ}$ ($H_{2}$) − ?
Решение:
$Ca + H_{2}O = CaO + H_{2}$
n (Ca) = $\frac{m}{M}$ = $\frac{0,12}{40}$ = 0,003 моль
n ($H_{2}$) = n (Ca) = 0,003 моль
$V_{практ}$ ($H_{2}$) = n ($H_{2}$) * $V_{m}$ = 0,003 моль * 22,4 л/моль = 0,0672 л
Ответ: $V_{практ}$ ($H_{2}$) = 0,0672 л.4. Почему щелочные и щёлочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?
Ответ:
Щелочные и щёлочноземельные металлы хранят под керосином, так как это очень активные металлы, которые реагируют с кислородом.
Литий, в отличие от натрия и калия, хранят в вазелине, так как литий имеет очень малую плотность, поэтому в керосине литий всплывает на поверхность.5. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого:
$Ca + HNO_{3} ⟶ Ca(NO_{3})_{2} + N_{2}↑ + H_{2}O$.
Какой ион проявляет в этой реакции окислительные свойства?Ответ:
$5Ca + 12HNO_{3} = 5Ca(NO_{3})_{2} + N_{2}↑ + 6H_{2}O$
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
$2N^{+5} + 10ē ⟶ N_{2}^{0}$ − окислитель
Ион $N^{+5}$ проявляет в этой реакции окислительные свойства.6. Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?
Ответ:
Получить водород при взаимодействии свинца с раствором серной кислоты нельзя, так как в ряду напряжений Pb стоит правее водорода, поэтому свинец не сможет вытеснить водород из раствора кислоты.
7. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которой:
$Zn + H_{2}SO_{4} (конц.) ⟶ ZnSO_{4} + H_{2}S↑ + H_{2}O$.
Какое вещество проявляет в этой реакции восстановительные свойства?Ответ:
$4Zn + 5H_{2}SO_{4}(конц.) = 4ZnSO_{4} + H_{2}S↑ + 4H_{2}O$
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
$S^{+6} + 8ē ⟶ S^{-2}$ − окислитель
Цинк проявляет в этой реакции восстановительные свойства. §10
-
§10. Получение металлов
Лабораторный опыт №13
Ознакомление с рудами железа
Рассмотрите образцы красного, бурого и магнитного железняка. Отметьте цвет каждой руды. Испытайте их на магнитные свойства (поднесите к каждому образцу магнит). Зафиксируйте результаты опыта в тетради. Проведите образцами каждой руды полоски по поверхности фарфоровой ступки или обратной стороне кафельной плитки. Отметьте цвет руд.Ответ:
Таблица ознакомление с рудами железа
Красный Бурый Магнитный
железняк железняк железняк
Цвет Красный Бурый Темной−серый
Магнитные
свойства Слабые Нет Сильные
Цвет
полоски Бурый Бурый Серыйi
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Sfu−kras".
2) Сайт "Your systeme education".
3) Сайт "Science for you".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Самородные металлы
Металлы находятся в природе как в свободном виде − самородные металлы, так и в виде различных соединений. В свободном состоянии в природе встречаются такие металлы, которые трудно окисляются кислородом воздуха, например платина, золото, серебро, значительно реже ртуть, медь и др.
Самородные металлы обычно содержатся в небольших количествах в виде зерен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов самородки. Например, самый крупный самородок меди весил 420 т, серебра − 13,5 т, а золота − 112 кг.?
1. В работе немецкого учёного в области металлургии и врача Г. Агриколы (XVI в.) «Трактат «О горном деле и металлургии» сказано: «Подвергая руду нагреванию, обжигу и прокаливанию, удаляют этим часть веществ, примешанных к металлу...» и далее «...плавка необходима, так как только посредством её горные породы и затвердевшие соки (рассолы) отделяются от металлов, которые приобретают свойственный им цвет, очищаются и становятся во многих отношениях полезны человеку». О каких видах металлургии писал Агрикола? Проиллюстрируйте его высказывание примерами уравнений химических реакций.
Ответ:
Агрикола писал о пирометаллургии.
Пример реакции обжига:
$2ZnS + 3O_{2} = 2ZnO + 2SO_{2}↑$
Пример реакции плавки:
$2CuO + C = 2Cu + CO_{2}↑$2. Какой метод получения меди – с помощью серной кислоты или бактериальный – экологически более безопасен?
Ответ:
Бактериальный метод получения меди экологически более безопасен, так как серная кислота является вредным веществом для окружающей среды.
3. Почему щелочные и щёлочноземельные металлы нельзя получить гидрометаллургическим методом?
Ответ:
Щелочные и щёлочноземельные металлы нельзя получить гидрометаллургическим методом, так как щелочные и щёлочноземельные металлы реагируют с водой:
$2Na + 2H_{2}O = 2NaOH + H_{2}$
$2K + 2H_{2}O = 2KOH + H_{2}$4. Предложите технологическую цепочку производства свинца из минерала галенита PbS. Запишите уравнения реакций.
Ответ:
Технологическая цепочка производства свинца из минерала галенита PbS:
$PbS + H_{2} ⟶ Pb + H_{2}S↑$5. Как можно получить из пирита $FeS_{2}$ железо и серную кислоту? Запишите уравнения реакций.
Ответ:
Получение железа:
$FeS_{2} + 2H_{2} ⟶ 2Fe + H_{2}S↑$
Получение серной кислоты:
$FeS_{2} + 2H_{2} ⟶ 2Fe + H_{2}S↑$
$2H_{2}S + 3O_{2} ⟶ 2SO_{2} + 2H_{2}O$
$2SO_{2} + O_{2} ⟶ 2SO_{3}$
$SO_{3} + H_{2}O ⟶ H_{2}SO_{4}$6. Сколько килограммов меди получается из 120 т обогащённой горной породы, содержащей 20% сульфида меди (I), если выход меди составляет 90% от теоретически возможного?
Ответ:
Дано:
m (горной породы) = 120 т
ω ($Cu_{2}S$) = 20%
η = 90%
Найти:
$m_{практ}$ (Cu) − ?
Решение:
m ($CuS$) = m (горной породы) * ω ($Cu_{2}S$) = 120 * 0,2 = 24 т
ω (Cu) = $\frac{2 `* A_{r} (Cu)}{M_{r}(Cu_{2}S)}$ * 100% = $\frac{2 * 64}{160}$ * 100% = 80%
$m_{теор}$ (Cu) = ω (Cu) * m ($Cu_{2}S$) = 0,8 * 24 = 19 т
$m_{практ}$ (Cu) = $m_{теор}$ (Cu) * η = 19 * 0,9 = 17,1 т
Ответ: $m_{практ}$ (Cu) = 17,1 т. §11
-
§11. Коррозия металлов
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Blasting service".
2) Сайт "Ivgpu".
3) Сайт "Portal sibadi".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Способы борьбы с коррозией:
1) Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башню в Париже.
Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов − это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.
2) Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Лёгкие нержавеющие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса», облицованный пластинками из титанового сплава. На его блестящей поверхности нет ни одного пятнышка ржавчины.
3) Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды.
Такие вещества называют ингибиторами коррозии. Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4) Создание контакта с более активным металлом протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк. На суше металлические конструкции линии электропередачи (ЛЭП) и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.?
1. Медь на воздухе покрывается тонким слоем оксида, придающим ей тёмную окраску, но во влажном воздухе и в присутствии углекислого газа на её поверхности образуются соединения зелёного цвета ($(CuOH)_{2}CO_{3}$). Напишите уравнения реакций коррозии меди.
Ответ:
Напишем уравнения реакций коррозии меди:
$2Cu + O_{2} = 2CuO$
$2CuO + H_{2}O + CO_{2} = (CuOH)_{2}CO_{3}$2. Щелочные и щёлочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. Напишите уравнения возможных реакций, сопровождающих коррозию этих металлов.
Ответ:
Вспомним составные части воздуха: $N_{2}, CO_{2},O_{2}, H_{2}O$.
Напишем уравнения возможных реакций, сопровождающих коррозию этих металлов.
$2Na + 2H_{2}O = 2NaOH + H_{2}↑$
$2NaOH + CO_{2} = Na_{2}CO_{3} + H_{2}O$
$2Ca + O_{2} = 2CaO$
$CaO + CO_{2} = CaCO_{3}$3. Что такое ингибиторы коррозии? Что такое протекторы? Чем отличается механизм их действия при защите металлов от коррозии?
Ответ:
Ингибиторы коррозии – вещества, замедляющие скорость коррозии.
Протекторы – это более активный металл, который находится в контакте с менее активным металлом, который надо защитить.
Различие механизмов защиты металлов от коррозии состоит в том, что ингибиторы уменьшают скорость химической коррозии металлов, а протекторы сами подвергаются химической коррозии.4. Лужёное железо, покрытое защитной оловянной плёнкой, поцарапали. Что будет происходить с изделием?
Ответ:
Лужёное железо, покрытое защитной оловянной плёнкой, поцарапали.
Так как железо более активный металл, чем олово, то железо будет подвергаться коррозии, а олово − нет. Поэтому сама царапина будет подвергаться коррозии, а вот луженое железо − нет.5. О каком материале строка В. В. Маяковского: «По крыше выложили жесть...»?
Ответ:
Строка В. В. Маяковского «По крыше выложили жесть...» о стали с нанесённым защитным покрытием. Это покрытие может быть сделано из олова, хрома.
6. В начале XX в из нью−йоркского порта вышла в открытый океан красавица яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус яхты был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклёпками. Это было красиво – сверкающий серебристым блеском корабль, усеянный золотистыми головками заклёпок! Однако через несколько дней обшивка корпуса начала расходиться и яхта быстро пошла ко дну. Почему?
Ответ:
Обшивка корпуса начала расходиться и яхта быстро пошла ко дну, так как произошла коррозия алюминия. Так как алюминий − металл активнее, чем медь, поэтому металл постепенно коррозирует.
§12
-
§12. Щелочные металлы
Лабораторный опыт №14
Окрашивание пламени солями щелочных металлов
Возьмите лучинку, закрепите на ней петельку или спираль из нихромовой проволоки. Обмакните петельку в соляную кислоту и прокалите в пламени спиртовки (пламя должно быть бесцветным). Затем погрузите петельку в раствор или сухую соль натрия и внесите её в пламя. В какой цвет оно окрашивается?
Повторите все операции и для соли калия. Для наблюдения цвета пламени, окрашенного солями калия, желательно использовать синий светофильтр, поглощающий жёлтый цвет. Если в кабинете химии имеются соли лития, повторите опыт и для этих соединений.Ответ:
Окрашивание пламени солями щелочных металлов
Взяли лучинку, закрепили на ней петельку или спираль из нихромовой проволоки. Обмакнули петельку в соляную кислоту и прокалили в пламени спиртовки (пламя должно быть бесцветным). Затем погрузили петельку в раствор или сухую соль натрия и внесли её в пламя.
Соли натрия окрашивают пламя в желтый цвет, калия – в фиолетовый, лития – в карминово−красный.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Chem ege".
2) Сайт "Prime Chemical Group".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атомов щелочных металлов
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра. У всех щелочных металлов имеется только 1 электрон на внешнем энергетическом уровне. Поэтому металлические свойства у них выражены наиболее ярко.?
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а)
б)
Ответ:
а)
1) $4Li + O_{2} = 2Li_{2}O$
2) $Li_{2}O + H_{2}O = 2LiOH$
3) $LiOH + HCl = LiCl + H_{2}O$
4) $2Li + 2H_{2}O = 2LiOH + H_{2}↑$
5) $Li_{2}O + 2HCl = 2LiCl + H_{2}O$б)
1) $2Na + O_{2} = Na_{2}O_{2}$
2) $Na_{2}O_{2} + 2Na = 2Na_{2}O$
3) $Na_{2}O + H_{2}O = 2NaOH$
4) $2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$
5) $Na_{2}O + 2HNO_{3} = 2NaNO_{3} + H_{2}O$2. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного.
Ответ:
Дано:
$m_{техн}$ (Na) = 11,5 г
ω (примесей) = 2%
η = 95%
Найти:
$V_{практ}$ ($H_{2}$) − ?
Решение:
$2Na + 2H_{2}O = NaOH + H_{2}$
$ω_{чист}$ (Na) = 100 − ω (примесей) = 100% − 2% = 98%
m (Na) = $m_{техн}$ (Na) * $ω_{чист}$ (Na) = 11,5 * 0,98 = 11,27 г
n (Na) = $\frac{m}{M}$ = $\frac{11,27}{23}$ = 0,5 моль
n ($H_{2}$) = $\frac{n (Na)}{2}$ = $\frac{0,5}{2}$ = 0,25 моль
$V_{теор}$ ($H_{2}$) = n * $V_{m}$ = 0,25 * 22,4 = 5,6 л
$V_{практ}$ ($H_{2}$) = $V_{теор}$ ($H_{2}$) * η = 5,6 * 0,95 = 5,32 л
Ответ: $V_{практ}$ ($H_{2}$) = 5,32 л.3. Прочитайте сочинение, написанное ученицей 9 класса 531−й школы Москвы Наташей Фроловой (1991).
Добрый Литий
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий – самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую "шубу", так как был очень лёгким и всплывал в керосине.
Но всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из−за этих−то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона – каждому атому по одному. Остальные электроны они припрятывали до поры до времени.
$2Na + O_{2} = Na_{2}O_{2}$
Литий же был честен – отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития – четыре электрона.
$4Li + O_{2} = 2Li_{2}O$
Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие – при нагревании. И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких−либо скрытых выгод? Спрашивает Натрий: "Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? Не лучше ли делать так, как мы?" Отвечал Литий: "Я всегда рад помочь другим, не то что вы – жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления −2, не то что −1 в ваших странных, ни на что не похожих пероксидах". Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава $M_{2}O$ дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия – нагреют пероксид ($Na_{2}O_{2}$) с таким же металлом – "жадиной" (Na)". Какие химические понятия использовала в художественной форме Наташа?Ответ:
Наташа использовала в художественной форме такие химичсекие понятия:
1) Семиэтажный дом: Наташа имела в виду Периодическую таблицу Д. И. Менделеева;
2) Подъезд щелочных металлов: Наташа имела в виду IА группа в Периодической таблице;
3) Вазелиновая "шуба": Наташа имела в виду то, что литий хранится в толще вазелина.4. Напишите сочинение о щелочных металлах, положив в основу сюжета превращения этих металлов или один из химических процессов.
Ответ:
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра. У всех щелочных металлов имеется только 1 электрон на внешнем энергетическом уровне. Отдавая его, атомы щелочных металлов превращаются в положительно заряженные ионы − катионы с зарядом +1.5. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
Ответ:
Дано:
m (кураги) = 100 г
m (K) = 2,034 г
$m_{суточ}$ (K) = 2,5 г
Найти:
$m_{суточ}$ (кураги) − ?
Решение:
Составим пропорцию:
100 г кураги − 2,034 г K
$m_{суточ}$ (кураги) − 2,5 г суточная норма калия
$m_{суточ}$ (кураги) = $\frac{100\;*\;2,5}{2,034}$ = 123 г
Ответ: $m_{суточ}$ (кураги) = 123 г. §13
-
§13. Бериллий, магний и щелочноземельные металлы
Лабораторный опыт №15
Получение гидроксида кальция и исследование его свойств
Небольшой кусочек или немного порошка оксида кальция поместите в стаканчик, прилейте в 5 раз больше воды. Размешайте содержимое с помощью стеклянной палочки и дайте постоять 2−3 мин. Отфильтруйте по 1−2 мл содержимого стаканчика в две пробирки. С помощью стеклянной трубочки осторожно продувайте выдыхаемый воздух через раствор в 1−й пробирке. Что наблюдаете? Как называется реакция? Запишите уравнение. К раствору во 2−й пробирке добавьте 2−3 капли спиртового раствора фенолфталеина. Что наблюдаете? Что можно утверждать на основании опыта о растворимости гидроксида кальция?Ответ:
Получение гидроксида кальция и исследование его свойств
Небольшой кусочек или немного порошка оксида кальция поместили в стаканчик, прилили в 5 раз больше воды. Размешали содержимое с помощью стеклянной палочки и дали постоять 2−3 мин. Отфильтровали по 1−2 мл содержимого стаканчика в две пробирки. С помощью стеклянной трубочки осторожно продували выдыхаемый воздух через раствор в 1−й пробирке.
Наблюдаем помутнение раствора:
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
К раствору во 2−й пробирке добавили 2−3 капли спиртового раствора фенолфталеина. Наблюдаем изменение окраски раствора на малиновую.
Можно сделать вывод, что гидроксид кальция малорастворим в воде.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Xumuk".
2) Сайт "Prime Chemical Group".
3) Сайт "Химия и жизнь".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение и свойства атомов берилия, магния и щелочноземельных металлов:
Бериллий Be, магний Mg и щелочноземельные металлы: кальций Са, стронций Sr, барий Ва и радий Ra − элементы главной подгруппы II группы (IIА−группы) Периодической системы Д. И. Менделеева. Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях и поэтому являются сильнейшими восстановителями.
Во всех соединениях они имеют степень окисления +2. С увеличением порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий − радиоактивный элемент, содержание его в природе невелико.?
1. Массовая доля костей человека составляет 20% от общей массы организма. На долю фосфата кальция, входящего в состав костей, приходится также 20% от массы костей. Зная массу своего тела, рассчитайте, сколько килограммов фосфата кальция содержится в вашем организме. Сколько килограммов кальция содержится в нём?
Ответ:
Дано:
ω (костей) = 20%
ω ($Ca_{3}(PO_{4})_{2}$) = 20%
m (тела) = 50 кг
Найти:
m ($Ca_{3}(PO_{4})_{2}$) − ?
m (Ca) − ?
Решение:
m (костей) = m (тела) * ω (костей) = 50 * 0,2 = 10 кг
m ($Ca_{3}(PO_{4})_{2}$) = m (костей) * ω ($Ca_{3}(PO_{4})_{2}$) = 10 * 0,2 = 2 кг
m (Ca) = m ($Ca_{3}(PO_{4})_{2}$) * ω (Ca)
ω (Ca) = $\frac{3 * A_{r} (Ca)}{M_{r}}$ * 100% = $\frac{3 * 40}{310}$ * 100% = 35%
m (Ca) = 2 * 0,35 = 0,7 кг
Ответ: m ($Ca_{3}(PO_{4})_{2}$) = 2 кг; m (Ca) = 0,7 кг.2. Вспомните из курса анатомии, что такое гемофилия, почему гемофиликам вводят при кровотечениях раствор хлорида кальция?
Ответ:
Гемофилия − это наследственное заболевание, связанное с нарушением свертывания крови.
Гемофиликам вводят при кровотечениях раствор хлорида кальция, так как ионы кальция способствуют свертыванию крови, тем самым останавливая кровотечение.3. Вычислите количество вещества гашёной извести, которое может быть получено из 2 т известняка, содержащего 25% примесей.
Ответ:
Дано:
m ($CaCO_{3}$) = 2 т = 2000 кг
ω (примесей) = 25%
Найти:
n ($Ca(OH)_{2}$) − ?
Решение:
$CaCO_{3} = CaO + CO_{2}$
$CaO + H_{2}O = Ca(OH)_{2}$
m (примесей) = m ($CaCO_{3}$) * ω (примесей) = 2000 * 0,25 = 500 кг
m ($CaCO_{3}$) = m ($CaCO_{3}$) − m (примесей) = 2000 − 500 = 1500 кг
n ($CaCO_{3}$) = $\frac{m}{M}$ = $\frac{1500}{100}$ = 15 кмоль
n ($Ca(OH)_{2}$) = n (CaO) = n ($CaCO_{3}$) = 15 кмоль
Ответ: n ($Ca(OH)_{2}$) = 15 кмоль.4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
$MCO_{3}$ $\overset{1}{⟶}$ MO $\overset{2}{⟶}$ $M(OH)_{2}$ $\overset{3}{⟶}$ $MSO_{3}$ $\overset{4}{⟶}$ $MSO_{4}$
Какие металлы главной подгруппы II группы (IIА группы) Периодической системы Д. И. Менделеева могут быть использованы для этих превращений, а какие – нет? Почему?Ответ:
$MCO_{3}$ $\overset{1}{⟶}$ MO $\overset{2}{⟶}$ $M(OH)_{2}$ $\overset{3}{⟶}$ $MSO_{3}$ $\overset{4}{⟶}$ $MSO_{4}$
1) $MCO_{3}$ ⟶ MO + $CO_{2}↑$
2) $MO + H_{2}O ⟶ M(OH)_{2}$
3) $M(OH)_{2} + SO_{2} ⟶ MSO_{3} + H_{2}O$
4) $MSO_{3} + H_{2}SO_{4} ⟶ MSO_{4} + H_{2}O + SO_{2}↑$
Кальций, сронций и барий − металлы главной подгруппы II группы (IIА группы) Периодической системы Д. И. Менделеева могут быть использованы для этих превращений, магний и бериллий − не могут быть использованы, так как оксиды магния и бериллия не реагируют с водой.5. Напишите уравнения реакций для осуществления превращений.
Уравнение последней реакции запишите также в ионной форме.Ответ:
1) $Ca + H_{2} = CaH_{2}$
2) $CaH_{2} + 2H_{2}O = Ca(OH)_{2} + 2H_{2}$
3) $Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
4) $CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}↑$
5) $3CaCl_{2} + 2Na_{3}PO_{4} = 6NaCl + Ca_{3}(PO_{4})_{2}↓$
$3Ca^{2+} + 6Cl^{-} + 6Na^{+} + 2PO_{4}^{3-}$ → $6Na^{+} + 6Cl^{-} + Ca_{3}(PO_{4})_{2}↓$
$3Ca^{2+} + 2PO_{4}^{3-} → Ca_{3}(PO_{4})_{2}↓$
6) $2Ca + O_{2} = 2CaO$
7) $CaO + H_{2}O = Ca(OH)_{2}$
8) $CaCO_{3} = CaO + CO_{2}↑$
9) $CaO + 2HCl = CaCl_{2} + H_{2}O$
10) $Ca + 2H_{2}O = Ca(OH)_{2} + H_{2}↑$6. Используя в качестве примера приведенное в предыдущем параграфе сочинение ученицы, напишите свое сочинение о химическом веществе или процессе, посвященное химии щелочноземельных металлов.
Ответ:
Добрый кальций
В большом семиэтажном доме, в подъезде щелочноземельных металлов, на четвертом этаже жил Кальций – металл. Он, как и все щелочноземельные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой.
Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам.
Кальций отдавал молекуле Кислорода два электрона:
$2Ca + O_{2} = 2CaO$
Оксид Кальция был добрым и с водой давал гидроксид:
$CaO + H_{2}O = Ca(OH)_{2}$.
Только Стронций и Барий поддерживали в этом Кальций, оксид Магния не дружил с водой.7. Почему в медицине для гипсовых повязок используют не гипс $CaSO_{4} * 2H_{2}O$, а алебастр $2CaSO_{4} * H_{2}O$? Какой процесс происходит при наложении такой повязки?
Ответ:
В медицине для гипсовых повязок используют не гипс $CaSO_{4} * 2H_{2}O$, а алебастр $2CaSO_{4} * H_{2}O$, так как алебастр быстрее сохнет. Происходит процесс кристаллизации:
$2CaSO_{4} * H_{2}O + 3H_{2}O ⟶ 2CaSO_{4} * 4H_{2}O$ §14
-
§14. Алюминий
Лабораторный опыт №16
Получение гидроксида алюминия и исследование его свойств
В две пробирки налейте по 1 мл раствора соли алюминия (хлорида или сульфата), а затем добавьте в каждую с помощью пипетки по 5 капель раствора щёлочи (гидроксида натрия или калия). Что наблюдаете? Прилейте к содержимому каждой пробирки раствор кислоты (соляной, серной или азотной). Что наблюдаете? О каком свойстве гидроксида алюминия свидетельствует вторая часть опыта? Запишите уравнения проделанных реакций в молекулярной и ионной формах.Ответ:
Получение гидроксида алюминия и исследование его свойств
В две пробирки налили по 1 мл раствора соли алюминия (хлорида или сульфата), а затем добавили в каждую с помощью пипетки по 5 капель раствора щёлочи (гидроксида натрия или калия).
Наблюдаем выпадение осадка белого цвета:
$AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_ {3}↓$
Прилили к содержимому каждой пробирки раствор кислоты (соляной, серной или азотной).
Наблюдаем растворение осадка:
$Al(OH)_{3} + 3HCl = AlCl_{3} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} + 3Cl^{-} ⟶ Al^{3+} + 3Cl^{-} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} ⟶ Al^{3+} + 3H_{2}O$
Вторая часть опыта свидетельствует об основных свойствах гидроксида алюминия.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Moluch".
2) Сайт "Prime Chemical Group".
3) Сайт "Eduherald".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома алюминия
Алюминий Al − элемент главной подгруппы III группы 3−то периода Периодической системы Д. И. Менделеева. Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдаёт при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия − бора − радиус атома меньше (у бора он равен 0,080 нм, у алюминия − 0,143 нм). Кроме того, у атома алюминия появляется один промежуточный восьмиэлектронный слой (2е; 8е: 3е), который препятствует притяжению внешних электронов к ядру.
Поэтому у атомов алюминия восстановительные свойства выражены гораздо сильнее, чем у атомов бора, который проявляет неметаллические свойства.
Почти во всех своих соединениях алюминий имеет степень окисления +3.?
1. Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?
Ответ:
В алюминиевой посуде нельзя хранить щелочные или кислые растворы, потому что алюминий − амфотерный металл, поэтому реагирует как с растворами кислот, так и с растворами щелочей.
2. Какое соединение алюминия могло послужить материалом для гиперболоида из романа А. Толстого «Гиперболоид инженера Гарина»?
Ответ:
$Al_{2}O_{3}$ − это соединение алюминия могло послужить материалом для гиперболоида из романа А. Толстого «Гиперболоид инженера Гарина».
Гиперболоид – это аппарат, испускающий тепловой луч огромной мощности, способный разрушить любые преграды (по типу лазеров). В лазерах в качестве активной среды используются синтетические рубины, которые состоят из оксида алюминия.3. Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
Ответ:
В основу рассказа «Бенгальские огни» его автор Н. Носов положил реакцию образования сульфида алюминия:
$2Al + 3S = Al_{2}S_{3}$.4. На каких физических и химических свойствах основано применение в технике алюминия и его сплавов?
Ответ:
Применение алюминия в технике основано на следующих физических свойствах: легкость, пластичность, металлический блеск, электро− и теплопроводность.
5. Напишите в ионном виде уравнения реакций между растворами сульфата алюминия и гидроксида калия при недостатке и избытке последнего.
Ответ:
Уравнение реакции между растворами сульфата алюминия и недостатком щелочи:
$Al_{2}(SO_{4})_{3} + 6KOH = 3K_{2}SO_{4} + 2Al(OH)_{3}↓$
$2Al^{3+} + 3SO_{4}^{2-} + 6K^{+} + 6OH^{-} ⟶ 6K^{+} + 3SO_{4}^{2-} + 2Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
Уравнение реакции между растворами сульфата алюминия и избытком щелочи:
$Al_{2}(SO_{4})_{3} + 8KOH = 2K[Al(OH)_{4}] + 3K_{2}SO_{4}$
$2Al^{3+} + 3SO_{4}^{2-} + 8K^{+} + 8OH^{-}$ ⟶ $2K^{+} + 2[Al(OH)_{4}]^{-} + 6K^{+} + 3SO_{4}^{2-}$
$Al^{3+} + 4OH^{-} ⟶ [Al(OH)_{4}]^{-}$6. Напишите уравнения реакций следующих превращений:
Al $\overset{1}{⟶}$ $AlCl_{3}$ $\overset{2}{⟶}$ $Al(OH)_{3}$ $\overset{3}{⟶}$ $Al_{2}O_{3}$ $\overset{4}{⟶}$ $Na[Al(OH)_{4}]$ $\overset{5}{⟶}$ $Al_{2}(SO_{4})_{3}$ $\overset{6}{⟶}$ $Al(OH)_{3}$ $\overset{7}{⟶}$ $AlCl_{3}$ $\overset{8}{⟶}$ $Na[Al(OH)_{4}]$.
Реакции, идущие с участием электролитов, запишите в ионной форме. Первую реакцию рассмотрите как окислительно−восстановительный процесс.Ответ:
Al $\overset{1}{⟶}$ $AlCl_{3}$ $\overset{2}{⟶}$ $Al(OH)_{3}$ $\overset{3}{⟶}$ $Al_{2}O_{3}$ $\overset{4}{⟶}$ $Na[Al(OH)_{4}]$ $\overset{5}{⟶}$ $Al_{2}(SO_{4})_{3}$ $\overset{6}{⟶}$ $Al(OH)_{3}$ $\overset{7}{⟶}$ $AlCl_{3}$ $\overset{8}{⟶}$ $Na[Al(OH)_{4}]$
1) $2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Al^{0} - 3ē ⟶ Al^{+3}$ − восстановитель
2) $AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
3) $2Al(OH)_{3} = Al_{2}O_{3} + 3H_{2}O$
4) $Al_{2}O_{3} + 2NaOH + 3H_{2}O = 2Na[Al(OH)_{4}]$
$Al_{2}O_{3} + 2Na^{+} + 2OH^{-} + 3H_{2}O ⟶ 2Na^{+} + 2[Al(OH)_{4}]^{-}$
$Al_{2}O_{3} + 2OH^{-} + 3H_{2}O ⟶ 2[Al(OH)_{4}]^{-}$
5) $2Na[Al(OH)_{4}] + 4H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + Na_{2}SO_{4} + 8H_{2}O$
$2Na^{+} + 2[Al(OH)_{4}]^{-} + 8H^{+} + 4SO_{4}^{2-}$ ⟶ $2Al^{3+} + 3SO_{4}^{2-} + 2Na^{+} + SO_{4}^{2-} + 8H_{2}O$
$[Al(OH)_{4}]^{-} + 4H^{+} ⟶ Al^{3+} + 4H_{2}O$
6) $Al_{2}(SO_{4})_{3} + 6NaOH = 3Na_{2}SO_{4} + 2Al(OH)_{3}↓$
$2Al^{3+} + 3SO_{4}^{2-} + 6Na^{+} + 6OH^{-}$ ⟶ $6Na^{+} + 3SO_{4}^{2-} + 2Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
7) $Al(OH)_{3} + 3HCl = AlCl_{3} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} + 3Cl_{-} ⟶ Al^{3+} + 3Cl^{-} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} ⟶ Al^{3+} + 3H_{2}O$
8) $AlCl_{3} + 4NaOH(изб.) = Na[Al(OH)_{4}] + 3NaCl$
$Al^{3+} + 3Cl^{-} + 4Na^{+} + 4OH^{-}$ ⟶ $Na^{+} + [Al(OH)_{4}]^{-} + 3Na^{+} + 3Cl^{-}$
$Al^{3+} + 4OH^{-} ⟶ [Al(OH)_{4}]^{-}$7. Вычислите объём водорода (н. у.), который может быть получен при растворении в едком натре 270 мг сплава алюминия, содержащего 5% меди. Выход водорода примите равным 85% от теоретически возможного.
Ответ:
Дано:
m (сплава) = 270 мг
ω (Cu) = 5%
η = 85%
Найти:
$V_{практ}$ ($H_{2}$) − ?
Решение:
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$
m (Cu) = m (сплава) * ω (Cu) = 270 * 0,05 = 13,5 мг
m (Al) = m (сплава) − m (Cu) = 270 − 13,5 = 256,5 мг
n (Al) = $\frac{m}{M}$ = $\frac{256,5}{27}$ = 14,25 моль
$V_{теор}$ ($H_{2}$) = n * $V_{m}$ = 14,25 * 22,4 = 319,2 мл
$V_{практ}$ ($H_{2}$) = $V_{теор}$ ($H_{2}$) * η = 319,2 * 0,85 = 271 мл
Ответ: $V_{практ}$ ($H_{2}$) = 271 мл.8. Напишите сочинение на тему "Художественный образ вещества или химического процесса", используя свои знания по химии алюминия.
Ответ:
Художественный образ алюминия
Алюминий − серебристо−белый лёгкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами лёгкие и прочные сплавы.
Алюминий − очень активный металл. В ряду напряжений он находится сразу же после щелочных и щёлочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой пленкой оксида, которая защищает металл от взаимодействия с компонентами воздуха и воды.
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем.
Алюминий, как и все металлы, легко реагирует с неметаллами, особенно в порошкообразном состоянии.
Для того чтобы началась реакция, необходимо первоначальное нагревание (за исключением реакций с галогенами − хлором и бромом), зато потом все реакции алюминия с неметаллами идут очень бурно и сопровождаются выделением большого количества теплоты. §15
-
§15. Железо
Лабораторный опыт №17
Взаимодействие железа с соляной кислотой
В пробирку поместите немного порошка восстановленного железа и прилейте 2−3 мл соляной кислоты. Что наблюдаете? Докажите, что в результате реакции образуются хлорид железа (II) и водород. Выпишите уравнение реакции и рассмотрите окислительно−восстановительные процессы.Ответ:
Взаимодействие железа с соляной кислотой
В пробирку поместили немного порошка восстановленного железа и прилили 2−3 мл соляной кислоты.
Наблюдаем выделение газа:
$Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
Докажем выделение водорода можно с помощью нагретой медной проволоки покрытой черным оксидом меди (II). Водород восстановит медь из оксида, образуется красный налет на проволоке.
$CuO + H_{2} = Cu + H_{2}O$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
Доказать наличие двухвалентного железа можно с помощью красной кровяной соли, в результате реакции выпадает осадок гексацианоферрата (III) калия−железа (II) темно−синего цвета:
$FeCl_{2} + K_{3}[Fe(CN)_{6}] = KFe[Fe(CN)_{6}]↓ + 2KCl$.Лабораторный опыт №18
Получение гидроксидов железа (II) и (III) и изучение их свойств
Налейте в две пробирки по 2 мл растворов сульфата (или хлорида) железа (II) и (III). Добавьте в каждую по 1−2 мл раствора щёлочи. Что наблюдаете? Как изменяется цвет осадка в пробирке, в которой находился раствор соли железа (II)? Почему? Добавьте к полученным осадкам раствор серной кислоты до их полного растворения. Запишите уравнение проделанных реакций в молекулярной и ионной формах. Докажите, что полученные растворы содержат катионы $Fe^{2+}$ и $Fe^{3+}$.Ответ:
Получение гидроксидов железа (II) и (III) и изучение их свойств
Налили в две пробирки по 2 мл растворов сульфата (или хлорида) железа (II) и (III). Добавили в каждую по 1−2 мл раствора щёлочи.
В первой пробирке наблюдаем образование осадка серо−зеленого цвета:
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-}$ ⟶ $2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
Во второй пробирке наблюдаем образования осадка бурого цвета:
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 2Cl^{-} + 3Na^{+} + 3OH^{-}$ ⟶ $3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
Добавили к полученным осадкам раствор серной кислоты до их полного растворения:
$Fe(OH)_{2} + H_{2}SO_{4} = FeSO_{4} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} ⟶ Fe^{2+} + 2H_{2}O$
$2Fe(OH)_{3} + 3H_{2}SO_{4} = Fe_{2}(SO_{4})_{3} + 6H_{2}O$
$2Fe(OH)_{3} + 6H^{+} + 3SO_{4}^{2-} ⟶ 2Fe^{3+} + 3SO_{4}^{2-} + 6H_{2}O$
$Fe(OH)_{3} + 3H^{+} ⟶ Fe^{3+} + 3H_{2}O$
Доказать наличие $Fe^{2+}$ можно с помощью красной кровяной соли, в результате реакции выпадает осадок темно−синего цвета:
$FeSO_{4} + K_{3}[Fe(CN)_{6}] = K_{2}SO_{4} + KFe[Fe(CN)_{6}]↓$
Доказать наличие $Fe^{3+}$ можно с помощью желтой кровяной соли, в результате реакции выпадает осадок темно−синего цвета:
$Fe_{2}(SO_{4})_{3} + 2K_{4}[Fe(CN)_{6}] = 3K_{2}SO_{4} + 2KFe[Fe(CN)_{6}]↓$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Chemege".
2) Сайт "Chem".
3) Сайт "100urokov".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома железа
Железо Fe − элемент побочной подгруппы VIII группы 4−го периода Периодической системы Д. И. Менделеева.
Строение электронной оболочки атомов железа несколько отличается от строения электронных оболочек атомов элементов главных подгрупп. Как и положено элементу 4−го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 алектронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах желева таково:
$_{26}Fe$ 2e; 8e; 14e; 2e.
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но часто и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.?
1. Напишите уравнения реакций, иллюстрирующих генетические ряды соединений $Fe^{2+}$ и $Fe^{3+}$. Первые реакции каждого ряда охарактеризуйте с позиций окисления−восстановления, а реакции с участием электролитов запишите также в ионном виде.
Ответ:
$Fe ⟶ FeCl_{2} ⟶ Fe(OH)_{2} ⟶ FeO$
$Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
$Fe(OH)_{2} = FeO + H_{2}O$
$Fe ⟶ FeCl_{3} ⟶ Fe(OH)_{3} ⟶ Fe_{2}O_{3}$
$2Fe + 3Cl_{2} = 2FeCl_{3}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель
$FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
$2Fe(OH)_{3} = Fe_{2}O_{3} + 3H_{2}O$2. Напишите по два молекулярных уравнения, соответствующих следующим сокращённым ионным уравнениям:
а) $K^{+} + Fe^{2+} + [Fe(CN)_{6}]^{3-} ⟶ KFe[Fe(CN)_{6}]↓$;
б) $K^{+} + Fe^{3+} + [Fe(CN)_{6}]^{4-} ⟶ KFe[Fe(CN)_{6}]↓$;
в) $Fe^{3+} + SCN^{-} ⇄ FeSCN^{2+}$.
Как называют эти реакции? Напишите названия реактивов.Ответ:
а) $K^{+} + Fe^{2+} + [Fe(CN)_{6}]^{3-} ⟶ KFe[Fe(CN)_{6}]↓$
1) $3FeSO_{4} + 2K_{3}[Fe(CN)_{6}] = 3K_{2}SO_{4} + KFe[Fe(CN)_{6}]↓$
2) $FeCl_{2} + K_{3}[Fe(CN)_{6}] = 2KCl + KFe[Fe(CN)_{6}]↓$б) $K^{+} + Fe^{3+} + [Fe(CN)_{6}]^{4-} ⟶ KFe[Fe(CN)_{6}]↓$
1) $Fe(NO_{3})_{3} + K_{4}[Fe(CN)_{6}] = 3KNO_{3} + KFe[Fe(CN)_{6}]↓$
2) $FeBr_{3} + K_{4}[Fe(CN)_{6}] = 3KBr + KFe[Fe(CN)_{6}]↓$в) $Fe^{3+} + SCN^{-} ⇄ FeSCN^{2+}$
1) $Fe_{2}(SO_{4})_{3} + 6KSCN ⇄ 3K_{2}SO_{4} + 2Fe(SCN)_{3}$
2) $FeCl_{3} + 3KSCN ⇄ 3KCl + Fe(SCN)_{3}$3. Используя дополнительную литературу (словари русского языка, химические словари и др.), подготовьте рассказ о происхождении названий реактивов и продуктов качественных реакций на $Fe^{2+}$ и $Fe^{3+}$.
Ответ:
Происхождение названий реактивов и продуктов качественных реакций на $Fe^{2+}$ и $Fe^{3+}$
Красная кровяная соль является реактивом для проведения качественной реакции на $Fe^{2+}$. Продуктом этой реакции является соль ярко−синего цвета $KFe[Fe(CN)_ {6}]$.
Происхождение названия желтой кровяной соли началось с того, что ее применяли для окраски тканей. При этом для получения данной соли использовали кровь скота и другие отходы со скотобоен, отсюда и название «кровяная». А поскольку ее кристаллы желтого цвета – то «желтая» кровяная соль.
Желтая кровяная соль является реактивом для проведения качественной реакции на $Fe^{3+}$. Продуктом этой реакции является соль ярко−синего цвета $KFe[Fe(CN)_ {6}]$.
Красная кровяная соль была получена в 1822 году. Немецкий химик Л. Гмелин провел реакцию между желтой кровяной солью и хлором, в результате которой получил соль, представленную кристаллами красного цвета: $K_{3}[Fe(CN)_ {6}]$ . По аналогии с исходным реагентом, продукт реакции также назвали «кровяной» солью, а по цвету – «красной».4. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:

Рассмотрите два превращения (по выбору) с позиций окисления−восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах.Ответ:
1) $Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}$
3) $4Fe(OH)_{2} + O_{2} + 2H_{2}O = 4Fe(OH)_{3}$
$O_{2}^{0} + 4ē ⟶ 2O^{2-}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель
4) $2Fe(OH)_{3} = Fe_{2}O_{3} + 3H_{2}O$
5) $Fe_{2}O_{3} + 3CO = 2Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{+2} - 2ē ⟶ C^{+4}$ − восстановитель
6) $Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} + 6Cl^{-} ⟶ 2Fe^{3+} + 6Cl^{-} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} ⟶ 2Fe^{3+} + 3H_{2}O$
7) $FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
8) $2FeCl_{3} + 3Zn = 3ZnCl_{2} + 2Fe$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель5. Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно $N_{2}, NO, NH_{4}NO_{3}$. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель и этих реакциях.
Ответ:
1) $5Fe + 12HNO_{3} = 5Fe(NO_{3})_{2} + N_{2}↑ + 6H_{2}O$
$2N^{+5} + 10ē ⟶ N_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $Fe + 4HNO_{3} = Fe(NO_{3})_{3} + NO↑ + 2H_{2}O$
$N^{+5} + 3ē ⟶ N^{+2}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель
3) $8Fe + 30HNO_{3} = 8Fe(NO_{3})_{3} + 3NH_{4}NO_{3} + 9H_{2}O$
$N^{+5} + 8ē ⟶ N^{-3}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель6. Вычислите объём оксида углерода (II) (н. у.), который потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы. Вычислите количество вещества железа, которое при этом получится, если выход его составляет 80% от теоретически возможного.
Ответ:
Дано:
m (магнетита) = 2,32 т = 2320 кг
ω (примесей) = 5%
η (Fe) = 80%
Найти:
V (CO) − ?
$n_{практ}$ (Fe) − ?
Решение:
$Fe_{3}O_{4} + 4CO = 3Fe + 4CO_{2}$
ω ($Fe_{3}O_{4}$) = 100% − ω (примесей) = 100% − 5% = 95%
m ($Fe_{3}O_{4}$) = m (магнетита) * ω ($Fe_{3}O_{4}$) = 2320 * 0,95 = 2204 кг
n ($Fe_{3}O_{4}$) = $\frac{m}{M}$ = $\frac{2204}{232}$ = 9,5 кмоль
n (CO) = 4 * n ($Fe_{3}O_{4}$) = 4 * 9,5 = 38 кмоль
V (CO) = n * $V_{m}$ = 38 * 22,4 = 851,2 $м^{3}$
$n_{теор}$ (Fe) = 3 * n ($Fe_{3}O_{4}$) = 3 * 9,5 = 28,5 кмоль
$n_{практ}$ (Fe) = $n_{теор}$ (Fe) * η (Fe) = 28,5 кмоль * 0,8 = 22,8 кмоль
Ответ: V (CO) = 851,2 $м^{3}$; $n_{практ}$ (Fe) = 22,8 кмоль.7. Используя свои знания по химии железа, напишите сочинение на тему «Художественный образ вещества или химического процесса».
Ответ:
Художественный образ железа
Железо − серебристо−белый блестящий металл с температурой плавления 1539 °С.
Очень пластичный, поэтому легко обрабатывается, куётся, прокатывается, штампуется. Железо обладает способностыо намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твёрдость методами термического и механического воздействия, например с помощью закалки и прокатки.
Различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, оно содержит 0,02−0,04% углерода, а кислорода, серы, азота и фосфора − ещё меньше. Химически чистое железо содержит менее 0,01% примесей.
Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии.
Первые образцы железа, попавшего в руки человека, по−видимому, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа.Темы для дискуссии
1. Сплав − это химическое соединение или смесь веществ? Обоснуйте свою точку зрения на конкретных примерах.
Ответ:
Сплав − это материалы с металлической кристаллической решеткой, обладающие характерными свойствами и состоящие из двух и более компонентов. Таким образом, сплав − это смесь веществ.
Например: чугун − это сплав на основе железа, содержащий от 2 до 4,5% углерода, а также марганец, кремний, фосфор и серу.2. Какие металлы и сплавы вы предложили бы использовать в искусстве и архитектуре и почему?
Ответ:
В искусстве и архитектуре я бы предложила использовать мельхиор и бронзу, так как они обладают нужными для этого характеристиками.
Мельхиор − это сплав, содержащий около 80% меди и 20% никеля, похож по внешнему виду на серебро. Используется для изготовления художественных изделий.
Бронза − сплав на основе меди с добавлением олова. Используется в художественном литье.3. Выберите из известных вам или предложите альтернативный и при этом наиболее эффективный способ защиты металлов от коррозии.
Ответ:
Способы борьбы с коррозией:
1) Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башню в Париже.
Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов − это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.
2) Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Лёгкие нержавещие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса», облицованный пластинками из титанового сплава. На его блестящей поверхности нет ни одного пятнышка ржавчины.
3) Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды.
Такие вещества называют ингибиторами коррозии. Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4) Создание контакта с более активным металлом протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк. На суше металлические конструкции линии электропередачи (ЛЭП) и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.ХИМИЧЕСКИЙ ПРАКТИКУМ №1. Свойства металлов и их соединений
Практическая работа №1
Вариант 1
Осуществление цепочки и химических
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам). Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.
$MgCO_{3} ⟶ MgCl_{2} ⟶ Mg(OH)_{2} ⟶ MgSO_{4}$Ответ:
$MgCO_{3} ⟶ MgCl_{2} ⟶ Mg(OH)_{2} ⟶ MgSO_{4}$
1) $MgCO_{3} + 2HCl = MgCl_{2} + H_{2}O + CO_{2}↑$
$MgCO_{3} + 2H^{+} + 2Cl^{-} ⟶ Mg^{2+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$MgCO_{3} + 2H^{+} ⟶ Mg^{2+} + H_{2}O + CO_{2}↑$
2) $MgCl_{2} + 2NaOH = 2NaCl + Mg(OH)_{2}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Mg(OH)_{2}↓$
$Mg^{2+} + 2OH^{-} ⟶ Mg(OH)_{2}↓$
3) $Mg(OH)_{2} + H_{2}SO_{4} = MgSO_{4} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Mg^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} ⟶ Mg^{2+} + 2H_{2}O$Вариант 2
Осуществление цепочки и химических
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам). Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.
$CuSO_{4} ⟶ Cu(OH)_{2} ⟶ CuO ⟶ Cu$Ответ:
$CuSO_{4} ⟶ Cu(OH)_{2} ⟶ CuO ⟶ Cu$
1) $CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓$
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-}$ ⟶ $2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓$
$Cu^{2+} + 2OH^{-} ⟶ Cu(OH)_{2}↓$
2) $Cu(OH)_{2} = CuO + H_{2}O$
3) $CuO + H_{2} = Cu + H_{2}O$Вариант 3
Осуществление цепочки и химических
Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам). Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.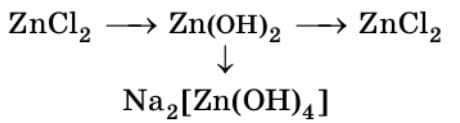
Ответ:
1) $ZnCl_{2} + 2NaOH = 2NaCl + Zn(OH)_{2}↓$
$Zn^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Zn(OH)_{2}↓$
$Zn^{2+} + 2OH^{-} ⟶ Zn(OH)_{2}↓$
2) $Zn(OH)_{2} + 2HCl = ZnCl_{2} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + 2H_{2}O$
$Zn(OH)_{2} + 2H^{+} ⟶ Zn^{2+} + 2H_{2}O$
3) $Zn(OH)_{2} + 2NaOH = Na_{2}[Zn(OH)_{4}]$
$Zn(OH)_{2} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + [Zn(OH)_{4}]^{2-}$
$Zn(OH)_{2} + 2OH^{-} ⟶ [Zn(OH)_{4}]^{2-}$Практическая работа №2
Задание 1
В математике действует правило — «от перемены мест слагаемых сумма не меняется». Справедливо ли оно для химии? Проверьте это на примере следующего опыта.
Получите гидроксид алюминия по реакции обмена и докажите его амфотерный характер. Для этого вы можете использовать следующую реакцию:
$AlCl_{3} + 3NaOH ⟶ Al(OH)_{3}↓ + 3NaCl$.
Проведите эту реакцию в двух вариантах, используя в каждом варианте одинаковые объёмы исходных веществ: сначала к раствору одного из исходных веществ (реагенту) прибавляйте по каплям раствор другого реагента, затем поменяйте последовательность введения в реакцию реагентов. Наблюдайте, в каком случае выпадет осадок, а в каком – нет.
Объясните результаты и запишите уравнения проведённых реакций в молекулярной и ионной формах.Ответ:
В математике действует правило — «от перемены мест слагаемых сумма не меняется». Однако, для химии оно неверное. Проверим это на примере следующего опыта.
Получили гидроксид алюминия по реакции обмена и докажем его амфотерный характер. Для этого мы использовали следующую реакцию:
$AlCl_{3} + 3NaOH = Al(OH)_{3}↓ + 3NaCl$.
При добавлении раствора щелочи в раствор хлорида алюминия образуется белый осадок гидроксида алюминия, так как щелочь в недостатке:
$AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
При добавлении раствора хлорида алюминия в раствор щелочи осадок не образуется, так как щелочь в избытке, поэтому она вступает в реакцию с гидроксидом алюминия:
$4NaOH + AlCl_{3} = 3NaCl + Na[Al(OH)_{4}]$
$4Na^{+} + 4OH^{-} + Al3^{+} + 3Cl^{-} ⟶ 3Na^{+} + 3Cl^{-} + Na^{+} + [Al(OH)_{4}]^{-}$
$Al^{3+} + 4OH^{-} ⟶ [Al(OH)_{4}]^{-}$
Докажем амфотерный характер гидроксида алюминия: он реагирует и с кислотами, и с щелочами.
С щелочами:
$Al(OH)_{3} + NaOH = Na[Al(OH)_{4}]$
$Al(OH)_{3} + Na^{+} + OH^{-} ⟶ Na^{+} + [Al(OH)_{4}]^{-}$
$Al(OH)_{3} + OH^{-} ⟶ [Al(OH)_{4}]^{-}$
С кислотами:
$Al(OH)_{3} + 3HCl = AlCl_{3} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} + 3Cl^{-} ⟶ Al^{3+} + 3Cl^{-} + 3H_{2}O$
$Al(OH)_{3} + 3H^{+} ⟶ Al^{3+} + 3H_{2}O$Задание 2
Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.
Ответ:
Качественной реакцией на катион кальция $Ca^{2+}$ является реакция с карбонатом:
$CaCl_{2} + Na_{2}CO_{3} = 2NaCl + CaCO_{3}↓$
$Ca^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + CaCO_{3}↓$
$Ca^{2+} + CO_{3}^{2-} ⟶ CaCO_{3}↓$
Качественной реакцией на анион хлора $Cl^{-}$ является реакция с солью серебра:
$CaCl_{2} + 2AgNO_{3} = Ca(NO_{3})_{2} + 2AgCl↓$
$Ca^{2+} + 2Cl^{-} + 2Ag^{+} + 2NO_{3}^{-} ⟶ Ca^{2+} + 2NO_{3}^{-} + 2AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$Задание 3
Осуществите превращения согласно следующей схеме:
$Fe ⟶ FeCl_{2} ⟶ FeCl_{3}$.
Напишите уравнения соответствующих реакций и рассмотрите их с позиций окисления−восстановления. Проведите качественные реакции, подтверждающие наличие продуктов реакций. Запишите уравнения реакций в молекулярной и ионной формах.Ответ:
$Fe ⟶ FeCl_{2} ⟶ FeCl_{3}$:
1) $Fe + 2HCl = FeCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $2FeCl_{2} + Cl_{2} = 2FeCl_{3}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель
Качественные реакции:
1) На ион $Fe^{2+}$ проведем реакцию с красной кровяной солью:
$3FeCl_{2} + 2K_{3}[Fe(CN)_{6}] = 6KCl + Fe_{3}[Fe(CN)_{6}]_{2}↓$
$3Fe^{2+} + 6Cl^{-} + 6K^{+} + [Fe(CN)_{6}]^{3-}$ ⟶ $6K^{+} + 6Cl^{-} + Fe_{3}[Fe(CN)_{6}]_{2}↓$
$3Fe^{2+} + [Fe(CN)_{6}]^{3-} = Fe_{3}[Fe(CN)_{6}]_{2}↓$
2) На ион $Fe^{3+}$ проведем реакцию с желтой кровяной солью:
$4FeCl_{3} + 3K_{4}[Fe(CN)_{6}] = 12KCl + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + 12Cl^{-} + 12K^{+} + [Fe(CN)_{6}]^{4-}$ ⟶ $12K^{+} + 12Cl^{-} + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + [Fe(CN)_{6}]^{4-} = Fe_{4}[Fe(CN)_{6}]_{3}↓$Задание 4
Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в ионной и молекулярной формах, а реакции замещения рассмотрите с позиций окисления−восстановления.
Ответ:
1 способ:
$CuSO_{4} + Fe = FeSO_{4} + Cu$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2 способ:
$FeO + H_{2}SO_{4} = FeSO_{4} + H_{2}O$
$FeO + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + H_{2}O$
$FeO + 2H^{+} ⟶ Fe^{2+} + H_{2}O$
3 способ:
$Fe(OH)_{2} + H_{2}SO_{4} = FeSO_{4} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} ⟶ Fe^{2+} + 2H_{2}O$Задание 5
Проведите реакции, подтверждающие качественный состав сульфата железа (II). Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
Ответ:
Качественной реакцией на катион железа $Fe^{2+}$ является реакция с основанием:
$FeSO_{4} + 2NaOH = Na_{2}SO_{4} + Fe(OH)_{2}↓$
$Fe^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
Качественной реакцией на анион $SO_{4}^{2-}$ является реакция с солью бария:
$FeSO_{4} + BaCl_{2} = FeCl_{2} + BaSO_{4}↓$
$Fe^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-}$ ⟶ $Fe^{2+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$Практическая работа №3
Вариант 1
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) гидроксид натрия;
б) карбонат калия;
в) хлорид бария.
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.Ответ:
Распознаем вещества с помощью серной килоты:
а) $2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$
$2Na^{+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} ⟶ 2Na^{+} + SO_{4}^{2-} + 2H_{2}O$
$2Na^{+} + SO_{4}^{2-} ⟶ H_{2}O$
В результате реакции нет видимых изменений.
б) $K_{2}CO_{3} + H_{2}SO_{4} = K_{2}SO_{4} + H_{2}O + CO_{2}↑$
$2K^{+} + CO_{3}^{2-} + 2H^{+} + SO_{4}^{2-} ⟶ 2K^{+} + SO_{4}^{2-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} ⟶ H_{2}O + CO_{2}↑$
В результате реакции выделяется бесцветный газ.
в) $BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO_{4}↓$
$Ba^{2+} + 2Cl^{-} + 2H^{+} + SO_{4}^{2-} ⟶ 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В результате реакции выпадает осадок белого цвета.Вариант 2
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) карбонат кальция;
б) сульфат натрия;
в) хлорид калия.
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.Ответ:
а) Карбонат кальция отличим с помощью воды, это соль нерастворимая в воде.
Получим растворы сульфата натрия и хлорида калия:
б) Сульфат отличим с помощью соли бария.
$Na_{2}SO_{4} + BaNO_{3} = 2NaNO_{3} + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + NO_{3}^{-} ⟶ 2Na^{+} + 2NO_{3}^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В результате реакци выпадает осадок белого цвета.
в) $KCl + BaNO_{3}$ ≠
Реакция не идет.Вариант 3
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) нитрат бария;
б) сульфат натрия;
в) карбонат кальция.
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.Ответ:
а) $BaNO_{3} + BaCl_{2}$ ≠
Реакция не идет.
б) Сульфат отличим с помощью соли бария.
$Na_{2}SO_{4} + BaCl_{2} ⟶ 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В результате реакци выпадает осадок белого цвета.
в) Карбонат кальция отличим с помощью воды, это соль нерастворимая в воде. Получим растворы сульфата натрия и нитрата калия.Вариант 4
В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
а) хлорид натрия;
б) хлорид алюминия;
в) хлорид железа (III).
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.Ответ:
а) Распознаем вещества с помощью гидроксида натрия:
$NaCl + NaOH$ ≠
Реакция не идет.
б) $AlCl_{3} + 3NaOH ⟶ 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
В результате реакции выпал серо−зеленый осадок.
в) $FeCl_{3} + 3NaOH ⟶ 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
В результате реакции выпал бурый осадок.Задача 1
Докажите опытным путём, что железный купорос, образец которого вам выдан, содержит примесь сульфата железа (III). Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Ответ:
Для распознавания ионов железа $Fe^{3+}$ используем желтую кровяную соль:
$2Fe_{2}(SO_{4})_{3} + 3K_{4}[Fe(CN)_{6}] = 6K_{2}SO_{4} + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + 6SO_{4}^{2-} + 12K^{+} + 3[Fe(CN)_{6}]^{4-}$ ⟶ $12K^{+} + 6SO_{4}^{2-} + Fe_{4}[Fe(CN)_{6}]_{3}↓$
$4Fe^{3+} + 3[Fe(CN)_{6}]^{4-} ⟶ Fe_{4}[Fe(CN)_{6}]_{3}↓$Задача 2
Получите оксид железа (III), исходя из хлорида железа (III). Напишите уравнения соответствующих реакций, а уравнение реакции с участием электролита и в ионном виде.
Ответ:
Получим оксид железа (III), исходя из хлорида железа (III). Сначала получим гидроксид железа, а затем в реакции разложения получим нужный оксид.
1) $FeCl_{3} + 3NaOH = 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$
2) $2Fe(OH)_{3} = Fe_{2}O_{3} + 3H_{2}O$Задача 3
Получите раствор алюмината натрия, исходя из хлорида алюминия. Запишите уравнения проделанных реакций в молекулярном и ионном виде.
Ответ:
Получим раствор алюмината натрия, исходя из хлорида алюминия.
Сначала получим гидроксид алюминия, а затем в реакции с гидроксидом натрия получим нужную соль.
1) $AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}↓$
$Al^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Al(OH)_{3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}↓$
2) $Al(OH)_{3} + NaOH = Na[Al(OH)_{4}]$
$Al(OH)_{3} + Na^{+} + OH^{-} ⟶ Na^{+} + [Al(OH)_{4}]^{-}$
$Al(OH)_{3} + OH^{-} ⟶ [Al(OH)_{4}]^{-}$Задача 4
Получите сульфат железа (II), исходя из железа. Запишите уравнения проделанных реакций и разберите окислительно−восстановительные процессы.
Ответ:
Получим сульфат железа (II), исходя из железа.
$CuSO_{4} + Fe = FeSO_{4} + Cu$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель §16
-
ГЛАВА ТРЕТЬЯ. Неметаллы
§16. Неметаллы: атомы и простые вещества. Кислород, озон, воздух
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Pandia".
2) Сайт "Prime Chemical Group".
3) Сайт "Chem ege".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Элементы−металлы и элементы−неметаллы
Все химические элементы в зависимости от строения и свойств атомов разделяют на металлы, неметаллы и благородные газы. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
Само слово «неметаллы» указывает, что свойства элементов−неметаллов и соответствующих им простых веществ противоположны свойствам металлов.
Если для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов (1−3) на внешнем уровне, то атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют маленький радиус). Отсюда и стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные свойства, а для атомов неметаллов − стремление к приёму недостающих до заветной восьмёрки электронов, т.е. окислительные свойства. Эти свойства характеризуются положением неметаллов в ряду электроотрицательности.?
1. Определите, во сколько раз тяжелее (легче) воздуха кислород, углекислый газ, водород, т.е. определите относительную плотность этих газов по воздуху ($D_{возд}$.).
Ответ:
Дано:
$O_{2}$
$CO_{2}$
$H_{2}$
Найти:
$D_{возд}$ ($O_{2}$) − ?
$D_{возд}$ ($CO_{2}$) − ?
$D_{возд}$ ($H_{2}$) − ?
Решение:
$D_{возд}$ ($O_{2}$) = $\frac{M(O_{2})}{M (возд)}$ = $\frac{32}{29}$ = 1,104
$D_{возд}$ ($CO_{2}$) = $\frac{M(CO_{2})}{M (возд)}$ = $\frac{44}{29}$ = 1,517
$D_{возд}$ ($H_{2}$) = $\frac{M(H_{2})}{M (возд)}$ = $\frac{2}{29}$ = 0,069
Ответ: $D_{возд}$ ($O_{2}$) = 1,104; $D_{возд}$ ($CO_{2}$) =1,517; $D_{возд}$ ($H_{2}$) = 0,069.2. Зная объёмный состав воздуха, найдите количество вещества каждого газа: азота и кислорода в 100 л воздуха при н. у.
Ответ:
Дано:
V (воздуха) = 100 л
φ ($N_{2}$) = 78,08%
φ ($O_{2}$) = 20,95%
Найти:
n ($N_{2}$) − ?
n ($O_{2}$) − ?
Решение:
V ($N_{2}$) = V (воздуха) * φ ($N_{2}$) = 100 * 0,7808 = 78,08 л
n ($N_{2}$) = $\frac{V}{V_{m}}$ = $\frac{78,08}{22,4}$ = 3,49 моль
V ($O_{2}$) = V (воздуха) * φ ($O_{2}$) = 100 * 0,2095 = 20,95 л
n ($O_{2}$) = $\frac{V}{V_{m}}$ = $\frac{20,95}{22,4}$ = 0,94 моль
Ответ: n ($N_{2}$) = 3,49 моль; n ($O_{2}$) = 0,94 моль.3. Определите число молекул: а) кислорода; б) азота, содержащихся в 22,4 л воздуха при н. у.
Ответ:
а) Дано:
V (воздуха) = 22,4 л
φ ($N_{2}$) = 78,08%
φ ($O_{2}$) = 20,95%
Найти:
N ($N_{2}$) − ?
Решение:
V ($N_{2}$) = V (воздуха) * φ ($N_{2}$) = 22,4 * 0,7808 = 17,49 л
n ($N_{2}$) = $\frac{V}{V_{m}}$ = $\frac{17,49}{22,4}$ = 0,78 моль
N ($N_{2}$) = n * $N_{a}$ = 0,78 * 6,022 = 4,702 молекул
Ответ: N ($N_{2}$) = 4,702 молекул.б) Дано:
V (воздуха) = 22,4 л
φ ($N_{2}$) = 78,08%
φ ($O_{2}$) = 20,95%
Найти:
N ($O_{2}$) − ?
Решение:
V ($O_{2}$) = V (воздуха) * φ ($O_{2}$) = 22,4 * 0,2095 = 4,69 л
n ($O_{2}$) = $\frac{V}{V_{m}}$ = $\frac{4,693}{22,4}$ = 0,2094 моль
N ($N_{2}$) = n * $N_{a}$ = 0,2094 * 6,022 = 1,261 молекул
Ответ: N ($O_{2}$) = 1,261 молекул.4. Вычислите объём воздуха (н. у.), который потребуется для сжигания 20 $м^{3}$ сероводорода, если при атом образуются вода и оксид серы (IV). Вычислите массу этого воздуха.
Ответ:
Дано:
V ($H_{2}S$) = 20 $м^{3}$
φ ($O_{2}$) = 20,95% − содержание кислорода в воздухе
Найти:
V (воздуха) − ?
m (воздуха) − ?
Решение:
$2H_{2}S + 3O_{2} = 2H_{2}O + 2SO_{2}$
V ($O_{2}$) = $\frac{3}{2}$ * V ($H_{2}S$) = $\frac{3}{2}$ * 20 = 30 $м^{3}$
V (воздуха) = V ($O_{2}$) * φ ($O_{2}$) = 30 * 0,2095 = 143 $м^{3}$
m (воздуха) = $\frac{V}{M}$ = $\frac{143,2}{29}$ = 4,94 кг
Ответ: V (воздуха) = 143 $м^{3}$; m (воздуха) = 4,94 кг.5. Подготовьте сообщение о применении кислорода.
Ответ:
Применение кислорода
Кислород широко применяется в медицине, при обеспечении жизнедеятельности в подводных и космических аппаратах, при осуществлении процессов дыхания, горения и гниения, для создания высоких температур в производственных процессах, в производстве химических веществ, в качестве окислителя топлива в различных агрегатах.
Также кислород применяют в металлургической и химической промышленности для ускорения производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавильном производстве намного ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, например при газовой сварке и резке металлов. Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.6. Что такое озоновые дыры? Как предупредить их появление?
Ответ:
Озоновые дыры – явление локального падения концентрации озона в озоновом слое Земли.
Чтобы предупредить появление озоновых дыр необходимо уменьшить количество запусков сверхзвуковых самолётов и ракет, уменьшить выхлоп автомобилей, прекратить использование фреонов в холодильниках. §17
-
§17. Водород
Лабораторный опыт №19
Получение и распознавание водорода
В пробирку налейте 2 мл раствора серной кислоты и поместите в неё две гранулы цинка. Что наблюдаете? Закройте отверстие пробирки большим пальцем на несколько секунд, пока не почувствуете давление газа на палец. Направьте пробирку на пламя спиртовки и уберите палец (Внимание! Горлышко пробирки не направлять на себя!) Что наблюдаете? Какой водород вы собрали в пробирке: чистый или в смеси с воздухом? Запишите уравнения реакций и рассмотрите окислительно−восстановительные процессы.Ответ:
Получение и распознавание водорода
В пробирку налили 2 мл раствора серной кислоты и поместили в неё две гранулы цинка.
Наблюдали выделение газа:
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
Закрыли отверстие пробирки большим пальцем на несколько секунд, пока не почувствовали давление газа на палец. Направили пробирку на пламя спиртовки и убрали палец.
Наблюдаем горение водорода с характерным звуком, следовательно, водород был в смеси с воздухом:
$2H_{2} + O_{2} = 2H_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$H_{2}^{0} - 2ē ⟶ 2H^{+}$ − восстановительi
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Pandia".
2) Сайт "Elar".
3) Сайт "Stud med".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Двойственное положение водорода в Периодической таблице Д.И. Менделеева
Каждому элементу в Периодической системе Д. И. Менделеева отводится одно, строго определённое место. Совсем другое дело химический элемент водород. Это единственный элемент, для которого химики отводят в Периодической системе Д. И. Менделеева два места − да каких! Его записывают в две резко противоположные по свойствам группы химических элементов: в главную подгруппу І группы − подгруппу щелочных металлов, а также в главную подгруппу VII группы. Подобно атомам щелочных металлов, атом водорода содержит на внешнем и единственном энергетическом уровне один электрон, поэтому легко отдаёт его и проявляет восстановительные свойства, образуя при этом соединения в степени окисления +1. Эти особенности сближают водород с щелочными металлами.
Но, подобно атомам галогенов, атому водорода до завершения внешнего энергетического уровня не хватает одного электрона (атом благородного газа 1−го периода, гелия, содержит на первом и единственном завершённом уровне два электрона), поэтому водород способен проявлять окислительные свойства в реакциях с металлами, принимая у них этот электрон и получая в результате степень окисления −1.
Молекулы водорода, как и молекулы галогенов, двухатомны и образованы за счёт неполярной ковалентной химической связи.?
1. Водород образует три изотопа: $^{1}_{1}H$ – протий, $^{2}_{1}H$ или $^{2}_{1}D$ – дейтерий и $^{3}_{1}H$ или $^{3}_{1}T$ – тритий. Запишите все возможные формулы воды, которые образуют эти изотопы водорода с одним из изотопов кислорода, например $^{16}_{8}O$. В какой из молекул содержание водорода наименьшее? Рассчитайте его.
Ответ:
Все возможные формулы воды из приведенных изотопов:
$^{1}_{1}H_{2}$ $^{16}_{8}O$ , $^{2}_{1}H_{2}$ $^{16}_{8}O$, $^{3}_{1}H_{2}$ $^{16}_{8}O$.
В молекуле с протием содержание водорода наименьшее.
Дано:
$^{1}_{1}H_{2}$ $^{16}_{8}O$
Найти:
ω (H) − ?
Решение:
$M_{r}$ ($H_{2}O$) = 2 * 1 + 16 = 18
ω (H) = $\frac{2 * A_{r} (H)}{M_{r} (H_{2}O)}$ * 100% = $\frac{2 * 1}{18}$ * 100% = 11,1%
Ответ: ω (H) = 11,1%.2. В лаборатории водород можно получить, как вы знаете, взаимодействием щелочного или щёлочноземельного металла с водой, а также по реакции:
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$.
В каком случае объём водорода наибольший, если для получения водорода используются одинаковые количества веществ металлов?Ответ:
Напишем уравненения реакций:
$2Na + 2H_{2}O = 2NaOH + H_{2}$
$2Ca + 4H_{2}O = 2Ca(OH)_{2} + 2H_{2}$
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$
По уравнениям можем сделать вывод, что наибольший объем водорода выделяется в реакции алюминия с раствором щелочи.3. Вычислите объём водорода (н. у.), который потребуется для восстановления 928 кг оксида вольфрама (VI), содержащего 25% примесей. Вычислите количество вещества металла, которое получится при этом.
Ответ:
Дано:
$m_{техн}$ ($WO_{3}$) = 928 кг
ω (примесей) = 25%
Найти:
V ($H_{2}$) − ?
n (W) − ?
Решение:
$WO_{3} + 3H_{2} = W + 3H_{2}O$
m (примесей) = $m_{техн}$ ($WO_{3}$) * ω (примесей) = 928 * 0,25 = 232 кг
m ($WO_{3}$) = $m_{техн}$ ($WO_{3}$) − m (примесей) = 928 − 232 = 696 кг
n ($WO_{3}$) = $\frac{m}{M}$ = $\frac{696}{232}$ = 3 кмоль
n ($H_{2}$) = 3 * n ($WO_{3}$) = 3 * 3 = 9 кмоль
V ($H_{2}$) = n * $V_{m}$ = 9 * 22,4 = 201,6 $м^{3}$
n (W) = n ($WO_{3}$) = 3 кмоль
Ответ: V ($H_{2}$) = 201,6 $м^{3}$; n (W) = 3 кмоль.4. Запишите уравнения реакций для следующих переходов:
Ответ:
1) $H_{2} + 2Na = 2NaH$
2) $NaH + H_{2}O = NaOH + H_{2}$
3) $H_{2} + Cl_{2} = 2HCl$
4) $NaH + H_{2}O = NaOH + H_{2}$
5) $2NaOH + 2Al + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}$5. В стеклянном толстостенном сосуде (эвдиометре) взорвали смесь 4 мл водорода и 3 мл кислорода. Найдите массу продукта реакции и объём непрореагировавшего газа.
Ответ:
Дано:
V ($H_{2}$) = 4 мл
V ($O_{2}$) = 3 мл
Найти:
m ($H_{2}O$) − ?
$V_{непрор}$ (газа) − ?
Решение:
$2H_{2} + O_{2} = 2H_{2}O$
$V_{прор}$ ($O_{2}$) = $\frac{V (H_{2})}{2}$ = $\frac{4}{2}$ = 2 мл
$V_{непрор}$ ($O_{2}$) = V ($O_{2}$) − $V_{прор}$ ($O_{2}$) = 3 − 2 = 1 мл
n ($H_{2}$) = $\frac{V}{V_{m}}$ = $\frac{4}{22,4}$ = 0,179 ммоль
n ($H_{2}O$) = n ($H_{2}$) = 0,179 ммоль
m ($H_{2}O$) = n * M = 0,179 * 18 = 3,22 мг
Ответ: $V_{непрор}$ ($O_{2}$) = 1 мл; m ($H_{2}O$) = 3,22 мг. §18
-
§18. Вода
Лабораторный опыт №20
Исследование поверхностного натяжения воды
Осторожно положите на поверхность воды небольшую швейную иголку (Если один конец иглы расположить под наклоном, она окажется на дне. Выньте её из воды, вытрите насухо и повторите опыт.)
Проделайте аналогичные действия, используя воду, в которой предварительно растворили немного стирального порошка.
Почему тяжёлая иголка не тонет в воде в первом случае, а во втором – тонет? Вспомните из курса физики, что такое поверхностное натяжение. Как влияет стиральный порошок на поверхностное натяжение воды?Ответ:
Исследование поверхностного натяжения воды
Осторожно положили на поверхность воды небольшую швейную иголку.
Проделали аналогичные действия, используя воду, в которой предварительно растворили немного стирального порошка.
Тяжёлая иголка не тонет в воде в первом случае, а во втором – тонет, так как поверхностное натяжение в первом случае больше, чем во втором. Стиральный порошок уменьшает поверхностное натяжение.
Поверхностное натяжение − явление молекулярного давления на жидкость.Лабораторный опыт №21
Растворение перманганата калия или медного купороса в воде
Возьмите шпателем или ложечкой несколько кристалликов перманганата калия или медного купороса, добавьте их в стакан с водой и перемешайте палочкой (по часовой стрелке) в течение 5−10 с, обращая внимание на скорость растворения.
Почему кристаллики соли оказываются в центре «воронки», образуя малиновый или голубой «смерч», исчезающий через некоторое время после перемешивания? Какой физико−химический процесс вы наблюдаете?
Запишите уравнение диссоциации перманганата калия $KMnO_{4}$ или сульфата меди (II). Какие кислоты соответствуют этим солям?
В свою очередь, какие оксиды соответствуют каждой кислоте?
Сделайте вывод о том, какие элементы (металлы и неметаллы) образуют кислородсодержащие кислоты.Ответ:
Растворение перманганата калия или медного купороса в воде
Взяли шпателем или ложечкой несколько кристалликов перманганата калия или медного купороса, добавили их в стакан с водой и перемешали палочкой (по часовой стрелке) в течение 5−10 с, обращая внимание на скорость растворения.
Кристаллики соли оказываются в центре «воронки», образуя малиновый или голубой «смерч», исчезающий через некоторое время после перемешивания, так как действуют центростремительные силы.
Процесс растворения и диссоциации веществ:
$KMnO_{4} ⟶ K^{+} + MnO_{4}^{-}$
$CuSO_{4} ⟶ Cu^{2+} + SO_{4}^{2-}$
Перманганату калию соответствует марганцовая кислота $HMnO_{4}$, ей соответствует оксид марганца (VII) $Mn_{2}O_{7}$.
Сульфату меди (II) соответствует серная кислота $H_{2}SO_{4}$, ей соответствует оксид серы (VI) $SO_{3}$.
Кислородсодержащие кислоты образуют неметаллы и d−элементы в высшей степени окисления.Лабораторный опыт №22
Гидратация обезвоженного сульфата меди (II)
Поместите в пробирку немного (на кончике шпателя) обезвоженного сульфата меди (II), а затем прилейте в неё 2−3 мл воды. Что наблюдаете? Как отличаются друг от друга гидратированные и негидратированные катионы меди (II)?Ответ:
Гидратация обезвоженного сульфата меди (II)
Поместили в пробирку немного (на кончике шпателя) обезвоженного сульфата меди (II), а затем прилили в неё 2−3 мл воды.
$CuSO_{4} + 5H_{2}O = CuSO_{4} * 5H_{2}O$
Наблюдаем изменение окраски раствора на голубой.
Гидратированные и негидратированные катионы меди (II) отличаются друг от друга цветом, первые − белые; вторые − голубые.Лабораторный опыт №23
Изготовление гипсового отпечатка
В фарфоровую чашечку насыпьте 2 г полуводного гипса – алебастра $2CaSO_{4} * H_{2}O$. Добавьте немного воды и перемешайте смесь, чтобы получилась тестообразная масса. Вдавите в неё монету или брелок, предварительно смазав их вазелином. Если удалить их, то в твёрдой массе останется отпечаток этих предметов, почему? Как этот процесс используется в медицине, производстве гипсовых статуэток?Ответ:
Изготовление гипсового отпечатка
В фарфоровую чашечку насыпали 2 г полуводного гипса – алебастра $2CaSO_{4} * H_{2}O$. Добавили немного воды и перемешали смесь, чтобы получилась тестообразная масса. Вдавили в неё монету или брелок, предварительно смазав их вазелином. Если удалить их, то в твёрдой массе останется отпечаток этих предметов, так как тестообразная масса при высыхании образует затвердевший гипс.
В медицине этот процесс используется при наложении гипса, в производстве − при изготовлении гипсовых статуэток по формам.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Pandia".
2) Сайт "Moluch".
3) Сайт "Cyber leninka".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение молекулы воды
Молекула воды имеет угловое строение: входящие в её состав атомы образуют равнобедренный треугольник, в основании которого находятся два атома водорода, а в вершине − атом кислорода. Межъядерные расстояния O−H близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями H−O−H равен 101,5°. Из восьми электронов внешнего слоя атома кислорода в молекуле воды четыре электрона задействованы в образовании ковалентных связей O−H, остальные составляют две неподеленные электронные пары.
Связи O−H являются полярными за счет более высокой электроотрицательности кислорода, на атомах которого возникает частичный отрицательный заряд. На атомах водорода, напротив, возникает частичный положительный заряд.
В целом молекула $H_{2}O$ является полярной молекулой, т.е. диполем.?
1. Какое строение имеет молекула воды? За счёт какой химической связи она образуется? Какие другие типы химических связей вы знаете?
Ответ:
Молекула воды имеет угловое строение, она образуется за счет ковалентной полярной химической связи.
Мы знаем 4 типа химической связи:
1) Ковалентная полярная.
2) Ковалентная неполярная.
3) Ионная.
4) Металлическая.2. Какая связь называется водородной? Как она определяет физические свойства воды?
Ответ:
Водородная связь − это химическая связь между атомами водорода одной молекулы и атомами наиболее электроотрицательных элементов.
За счет водородной связи вода имеет высокую температуру кипения.3. Какие аномалии физических свойств воды вы знаете? Какую роль они играют в природе?
Ответ:
Вода имеет аномально высокие значения ее температур плавления и кипения, поэтому вода имеет 3 агрегатных состояния.
Вода способна расширяться при замерзании и имеет максимальную плотность при температуре +4, поэтому в природе лед плавает на поверхности воды.
Вода обладает высокимм значениями температуры кипения и температуры парообразования.4. Растворение называют физико−химическим процессом. Как растворимость характеризует свойства воды? Как по этому признаку делятся вещества? Для ответа на вопрос обратитесь к таблице растворимости.
Ответ:
Вода – важнейший растворитель в живой и неживой природе.
По растворимости в воде вещества делятся на растворимые (NaOH, $K_{2}SO_{4}$), малорастворимые ($Ca(OH)_{2}$) и нерастворимые ($Cu(OH)_{2}, BaSO_{4}$).5. Какие вещества называются гидрофильными, а какие – гидрофобными? Приведите примеры.
Ответ:
Гидрофильные вещества хорошо растворимы в воде. К ним относятся многие соли, спирты, кислоты, глюкоза и др.
Гидрофобные, плохо растворимые в воде вещества − это жиры, пластмассы, сложные эфиры, жирные кислоты и др.6. Перечислите химические свойства воды, иллюстрируя их уравнениями соответствующих реакций. Какую роль играют эти свойства в природе?
Ответ:
Вода − основной поставщик кислорода в атмосферу Земли, так как важнейшая реакция на Земле − фотосинтез:
$6CO_{2} + 6H_{2}O = C_{6}H_{12}O_{6} + 6O_{2}$
Из глюкозы в ходе дальнейших превращений возникает поразительное многообразие органических соединений.
Вода взаимодействует с щелочными и щёлочноземельными металлами:
$2Na + 2H_{2}O = 2NaOH + H_{2}↑$
$Ca + 2H_{2}O = Ca(OH)_{2} + H_{2}↑$
Вода соединяется с основными и кислотными оксидами, если образуется растворимый гидроксид – щёлочь или кислородсодержащая кислота:
$H_{2}O + Na_{2}O = 2NaOH$
$H_{2}O + SO_{3} = H_{2}SO_{4}$
Вода разлагается под действием света, электрического тока или высоких температур (свыше 1500°C):
$2H_{2}O = 2H_{2} + O_{2}$
Вода разлагает некоторые неорганические и многие органические вещества. Необратимому гидролизу подвергаются некоторые бинарные соединения, например соли летучих бескислородных кислот и нерастворимых оснований:
$Al_{2}S_{3} + 6H_{2}O = 2Al(OH)_{3} + 3H_{2}S↑$.7. В 80 мл воды растворили 80 г медного купороса $CuSO_{4} * 5H_{2}O$. Какой стала массовая доля сульфата меди (II) в полученном растворе?
Ответ:
Дано:
V ($H_{2}O$) = 80 мл
m ($CuSO_{4} * 5H_{2}O$) = 80 г
Найти:
ω ($CuSO_{4}$) − ?
Решение:
m ($H_{2}O$) = ρ * V = 1 * 80 = 80 г
n ($CuSO_{4} * 5H_{2}O$) = $\frac{m}{M}$ = $\frac{80}{250}$ = 0,32 моль
n ($CuSO_{4}$) = ($CuSO_{4} * 5H_{2}O$) = 0,32 моль
m ($CuSO_{4}$) = n * M = 0,32 * 160 = 51 г
m (р−ра) = m ($H_{2}O$) + m ($CuSO_{4} * 5H_{2}O$) = 80 + 80 = 160 г
ω ($CuSO_{4}$) = $\frac{m (CuSO_{4})}{m (р-ра)}$ = $\frac{51}{160}$ = 32%
Ответ: ω ($CuSO_{4}$) = 32%.8. Для наложения гипсовой повязки хирург использовал 290 г алебастра. Какое количество вещества воды было израсходовано в результате превращения алебастра в гипс? Какова масса гипса?
Ответ:
Дано:
m ($CaSO_{4} * 0,5H_{2}O$) = 290 г
Найти:
n ($H_{2}O$) − ?
m ($CaSO_{4} * 2H_{2}O$) − ?
Решение:
$CaSO_{4} * 0,5H_{2}O + 1,5H_{2}O = CaSO_{4} * 2H_{2}O$
n ($CaSO_{4} * 0,5H_{2}O$) = $\frac{m}{M}$ = $\frac{290}{145}$ = 2 моль
$n_{израс}$ ($H_{2}O$) = 1,5 * n ($CaSO_{4} * 0,5H_{2}O$) = 1,5 * 2 = 3 моль
$m_{израс}$ ($H_{2}O$) = n * M = 3 * 18 = 54 г
m ($CaSO_{4} * 2H_{2}O$) = m ($CaSO_{4} * 0,5H_{2}O$) + $m_{израс}$ ($H_{2}O$) = 290 + 54 = 344 г
Ответ: n ($H_{2}O$) = 3 моль; m ($CaSO_{4} * 2H_{2}O$) = 344 г. §19
-
§19. Вода в жизни человека
Лабораторный опыт №24
Ознакомление с коллекцией бытовых фильтров
Изучите инструкцию к бытовому фильтру, который вы используете дома. Каков принцип его работы? Каков ресурс этого фильтра? Четко ли вы соблюдаете временной норматив работы вашего фильтра?Ответ:
Ознакомление с коллекцией бытовых фильтров
Изучили инструкцию к бытовому фильтру, который мы используем дома.
Я дома использую фильтр − кувшин. Кувшинный фильтр представляет собой пластиковый кувшин, разделенный на две части. В верхней части расположена емкость, в которую заливается вода для фильтрации. Проходя через картридж, заполненный фильтрующим элементом, вода очищается от вредных примесей и попадает в нижнюю емкость, откуда ее легко слить. Картридж имеет ресурс 100−500 л. Необходимо соблюдать временной норматив работы вашего фильтра!Лабораторный опыт №25
Ознакомление с составом минеральной воды
Ознакомьтесь с этикеткой на бутылке с минеральной водой. К какому типу относится рассматриваемая вода? Почему? Какие ионы входят в состав этой воды? Как их обнаружить? Запишите уравнения соответствующих реакций в молекулярной и ионной формах.Ответ:
Ознакомление с составом минеральной воды
Ознакомились с этикеткой на бутылке с минеральной водой.
Химический состав ($мг/дм^{3}$):
$HCO_{3}^{-}$ 3500−5000
$SO_{4}^{2-}$ <10
$Сl^{-}$ 250−500
$Ca^{2+}$ 20−150
$Mg^{2+}$ 20−150
$Na^{+}$ 1000−2000
$K^{-}$ 15−45
$SO_{4}^{2-}$ можно обнаружить в реакции с хлоридом бария, при этом выпадает белый осадок:
$Na_{2}SO_{4} + BaCl_{2} = BaSO_{4} + 2NaCl$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = BaSO_{4} + 2Na^{+} + 2Cl^{-}$
$SO_{4}^{2-} + Ba^{2+} = BaSO_{4}$
$Mg^{2+}$ и $Ca^{2+}$ можно определить в реакции с карбонатом натрия, при этом выпадает белый осадок:
$Na_{2}CO_{3} + MgCl_{2} = MgCO_{3} + 2NaCl$
$2Na^{+} + CO^{2-}_{3} + Mg^{2+} + 2Cl^{-} = MgCO_{3} + 2Na^{+} + 2Cl^{-}$
$CO^{2-}_{3} + Mg^{2+} = MgCO_{3}$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Elar".
2) Сайт "Prime Chemical Group".
3) Сайт "Xumuk".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Круговорот воды в природе
Большой круг: из океанов, морей, рек и других открытых водоёмов вода испаряется в атмосферу, конденсируется в облака и дождём выпадает на землю, а затем реками выносится обратно в моря и океаны. Таким образом, Мировой океан и сушу связывает непрерывный круговорот воды.
Малый круг: растение всасывает воду из земли, с растительной пищей она попадает в тело животных и человека, откуда снова с дыханием и выделениями возвращается в воздух и в землю.?
1. Охарактеризуйте малый и большой круги оборота воды в природе.
Ответ:
Большой круг: из океанов, морей, рек и других открытых водоёмов вода испаряется в атмосферу, конденсируется в облака и дождём выпадает на землю, а затем реками выносится обратно в моря и океаны. Таким образом, Мировой океан и сушу связывает непрерывный круговорот воды.
Малый круг: растение всасывает воду из земли, с растительной пищей она попадает в тело животных и человека, откуда снова с дыханием и выделениями возвращается в воздух и в землю.2. Почему академик В. И. Вернадский утверждал, что «вода и живое вещество — генетически связанные части организованности земной коры»?
Ответ:
В. И. Вернадский утверждал, что «вода и живое вещество — генетически связанные части организованности земной коры», так как вода связывает живую и неживую природу в единое целое благодаря круговороту воды в природе.
3. Подготовьте сообщение "Саяно−Шушенская ГЭС: боль и надежда России".
Ответ:
Саяно−Шушенская ГЭС: боль и надежда России
Саяно−Шушенская ГЭС – наиболее мощная электростанция России и 8−я – среди ныне действующих ГЭС в мире. Это самое уникальное по размерам и сложности возведения гидротехническое сооружение. Станция имеет самую высокую в России и одну из высочайших плотин в мире, которая перекрывает одну из рек России – Енисей.
Однако строительство ГЭС шло крайне медленными темпами, постоянно требуя колоссальное количество финансирования и ресурсов, а также приводя к разрушению экосистем. Несоответствие реальных трудозатрат и сроков с запланированными, приводило к постоянным исправлениям плана проекта, что замедляло строительство.4. Какие этапы очистки проходит вода на пути к крану вашего дома? Охарактеризуйте их.
Ответ:
Водоочистка проводится в несколько этапов:
1) Механический — предварительная очистка. Здесь проводится задержание нерастворимых примесей.
2) Биологический — переработка органических загрязнителей микроорганизмами.
3) Физико−химический — осаждение растворенных примесей.
4) Дезинфекция сточных вод — хлорирование или озонирование воды и целью обеззараживания.5. Что такое аэрация воды? С какой целью её проводят?
Ответ:
Аэрация воды − это процесс обогащения воды кислородом воздуха, который проводится в сооружениях биологической очистки сточных вод и обеспечивает жизнедеятельность микроорганизмов.
6. Какой тип бытового фильтра используется у вас дома? Охарактеризуйте принцип работы вашего фильтра.
Ответ:
Я дома использую фильтр − кувшин. Кувшинный фильтр представляет собой пластиковый кувшин, разделенный на две части. В верхней части расположена емкость, в которую заливается вода для фильтрации. Проходя через картридж, заполненный фильтрующим элементом, вода очищается от вредных примесей и попадает в нижнюю емкость, откуда ее легко слить.
7. В чём заключается принцип работы дистиллятора? Где используется дистиллированная вода?
Ответ:
Принцип работы дистиллятора: воду нагревают в перегонном кубе до кипячения, образовавшиеся пары путём непрерывного отвода конденсируются в холодильнике, а соли и механические примеси, содержащиеся в воде, остаются в перегонном кубе.
Как мы помним из курса 8 класса, дистиллированная вода практически не содержит примесей и посторонних включений. Мы также помним, что ее получают перегонкой в специальных аппаратах — дистилляторах. Такую воду используют для приготовления растворов в химии и медицине, в процессе безопасной эксплуатации автомобильных аккумуляторов, для промывки систем охлаждения автомобиля, в цветной фотографии, а также в быту (например, для добавления в паровые утюги), так как дистиллированная вода полностью исключает появление в них накипи.
В дистиллированной воде, в отличие от обычной, полностью отсутствуют микрозлементы и минеральные соли. Благодаря этому она отлично растворяет лекарства. Однако дистиллированная вода абсолютно непригодна для употребления внутрь.8. Почему дистиллированную воду заливают в утюги и автомобильные радиаторы?
Ответ:
Дистиллированную воду заливают в утюги и автомобильные радиаторы, так как она является хорошим растворителем, она не содержит солей и, следовательно, не оставит пятен.
9. Почему длительное использование дистиллированной воды вредно для здоровья?
Ответ:
При продолжительном употреблении дистиллированная вода вредна, так как вымывает из организма человека полезные соли, необходимые для нормальной жизнедеятельности.
§20
-
§20. Галогены
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Elar".
2) Сайт "Cyber leninka".
3) Сайт "Xumuk".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Галогены − простые вещества
Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалентной неполярной химической связью между атомами. В твёрдом состоянии имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.
Как можно заметить, с увеличением молекулярной массы галогенов повышаются их температуры плавления и кипения, возрастает плотность: фтор и хлор − газы, бром − жидкость, йод − твёрдое вешество. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.?
1. Рассчитайте массу 1 л фтора и хлора при н. у. Найдите их относительную плотность по водороду и воздуху.
Ответ:
Дано:
V ($F_{2}$) = 1 л
V ($Cl_{2}$) = 1 л
Найти:
m ($F_{2}$) − ?
$D_{H_{2}}$ ($F_{2}$) − ?
$D_{возд}$ ($F_{2}$) − ?
m ($Cl_{2}$) − ?
$D_{H_{2}}$ ($Cl_{2}$) − ?
$D_{возд}$ ($Cl_{2}$) − ?
Решение:
n ($F_{2}$) = $\frac{V}{V_{m}}$ = $\frac{1}{22,4}$ = 0,0446 моль
m ($F_{2}$) = n * M = 0,0446 * 38 = 1,7 г
$D_{H_{2}}$ ($F_{2}$) = $\frac{M (F_{2})}{M (H_{2})}$ = $\frac{38}{2}$ = 19
$D_{возд}$ ($F_{2}$) = $\frac{M (F_{2})}{M (возд)}$ = $\frac{38}{29}$ = 1,31
n ($Cl_{2}$) = $\frac{V}{V_{m}}$ = $\frac{1}{22,4}$ = 0,0446 моль
m ($Cl_{2}$) = n * M = 0,0446 * 71 = 3,17 г
$D_{H_{2}}$ ($Cl_{2}$) = $\frac{M (Cl_{2})}{M (H_{2})}$ = $\frac{71}{2}$ = 35,5
$D_{возд}$ ($Cl_{2}$) = $\frac{M (Cl_{2})}{M (возд)}$ = $\frac{71}{29}$ = 2,45
Ответ: m ($F_{2}$) = 1,7 г ; $D_{H_{2}}$ ($F_{2}$) = 19; $D_{возд}$ ($F_{2}$) = 1,31; m ($Cl_{2}$) = 3,17 г; $D_{H_{2}}$ ($Cl_{2}$) = 35,5; $D_{возд}$ ($Cl_{2}$) = 2,45.2. Растворы хлора, брома и иода в воде соответственно называют хлорной, бромной и иодной водой. Почему нет фторной воды?
Ответ:
Растворы хлора, брома и иода в воде соответственно называют хлорной, бромной и иодной водой. Фторной воды нет, так как фтор − самый активный галоген, он полностью реагирует с водой:
$2F_{2} + 2H_{2}O = 4HF + O_{2}↑$.3. Проведите аналогию между реакциями щелочных металлов и фтора с растворами солей.
Ответ:
Для реакции щелочного металла с солью, он сначала реагирует с водой, а затем образовавшаяся щелочью взаимодействует с солью:
$2Na + 2H_{2}O = 2NaOH + H_{2}↑$
$2NaOH + CuSO_{4} = Na_{2}SO_{4} + Cu(OH)_ {2}↓$
Для реакции фтора с солью, он сначала реагирует с водой, а затем образовавшаяся кислота взаимодействует с солью:
$2F_{2} + 2H_{2}O = 4HF + O_{2}↑$
$2HF + Na_{2}CO_{3} = 2NaF + H_{2}O + CO_{2}↑$4. Рассчитайте степени окисления атомов химических элементов в следующих соединениях: $KClO_{3}$ (бертолетова соль), HClO (хлорноватистая кислота), $HClO_{4}$ (хлорная кислота). Напишите формулы оксидов, соответствующих кислотам.
Ответ:
Рассчитаем степени окисления атомов химических элементов:
$K^{+1}Cl^{+5}O^{-2}_{3}$
$H^{+1}Cl^{+1}O^{-2}$
$H^{+1}Cl^{+7}O^{-2}_{4}$
1) Кислоте $K^{+1}Cl^{+5}O^{-2}_ {3}$ соответствует оксид $Cl_{2}O_{5}$.
2) Кислоте $H^{+1}Cl^{+1}O^{-2}$ соответствует оксид $Cl_{2}O$.
3) Кислоте $H^{+1}Cl^{+7}O^{-2}_ {4}$ соответствует оксид $Cl_{2}O_{7}$.5. Вычислите объём хлора (н. у.), который потребуется для вытеснения всего иода из 300 г 15%−го раствора иодида калия. Вычислите количество вещества новой соли, которое при этом образуется.
Ответ:
Дано:
$m_{р-ра}$ = 300 г
ω (KI) = 15%
Найти:
V ($Cl_{2}$) − ?
n (KI) − ?
Решение:
$2KI + Cl_{2} = 2KCl + I_{2}$
m (KI) = $m_{р-ра}$ * ω (KI) = 300 * 0,15 = 45 г
n (KI) = $\frac{m}{M}$ = $\frac{45}{166}$ = 0,271 моль
n (KCl) = n (KI) = 0,271 моль
n ($Cl_{2}$) = $\frac{n (KI)}{2}$ = $\frac{0,271}{2}$ = 0,136 моль
V ($Cl_{2}$) = n * $V_{m}$ = 0,136 * 22,4 = 3 л
Ответ: V ($Cl_{2}$) = 3 л; n (KI) = 0,271 моль.6. Вычислите объём хлороводорода, который образуется при взаимодействии 150 л хлора с 200 л водорода. Какой газ взят в избытке? Вычислите объём, который займёт избыток этого газа.
Ответ:
Дано:
V ($Cl_{2}$) = 150 л
V ($H_{2}$) = 200 л
Найти:
V (HCl) − ?
$V_{непрор}$ (газа) − ?
где $V_{непрор}$ (газа) − объем непрореагировавшего газа.
Решение:
$H_{2} + Cl_{2} = 2HCl$
Так как объем водорода больше, то есть водород в избытке, расчет ведем по кислороду.
По закону объмных соотношений:
V (HCl) = V ($Cl_{2}$) = 150 л
$V_{непрор}$ (газа) = V ($H_{2}$) − V ($Cl_{2}$) = 200 − 150 = 50 л
Ответ:V (HCl) = 150 л; $V_{непрор}$ (газа) = 50 л.7. Во многих странах фтор носит другое название – флюор, что в переводе с латинского означает "текучий". Найдите объяснение этого названия, используя химические словари и другую литературу.
Ответ:
Во многих странах фтор носит другое название – флюор, что в переводе с латинского означает "текучий". Такое название произошло от названия минерала флюорита $CaF_{2}$.
§21
-
§21. Соединения галогенов
Лабораторный опыт №26
Качественная реакция на галогенид−ионы
Налейте в три пробирки растворы солей натрия или калия: в 1−ю – хлорида, во 2−ю – бромида, в 3−ю – иодида. Затем в каждую пробирку добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Можно ли по цвету образовавшегося продукта реакции определить галогенид−ионы? Запишите уравнения реакций в молекулярной и ионной форме.Ответ:
Качественная реакция на галогенид−ионы
Налили в три пробирки растворы солей натрия или калия: в 1−ю – хлорида, во 2−ю – бромида, в 3−ю – иодида. Затем в каждую пробирку добавили с помощью пипетки несколько капель раствора нитрата серебра.
В первой пробирке наблюдаем выпадение осадка белого цвета:
$KCl + AgNO_{3} = KNO_{3} + AgCl↓$
$K^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} ⟶ K^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + NO_{3}^{-} ⟶ AgCl↓$
Во второй пробирке наблюдаем выпадение осадка светло−желтого цвета:
$NaBr + AgNO_{3} = NaNO_{3} + AgBr↓$
$Na^{+} + Br^{-} + Ag^{+} + NO_{3}^{-} ⟶ Na^{+} + NO_{3}^{-} + AgBr↓$
$Ag^{+} + Br^{-} ⟶ AgBr↓$
В третьей пробирке наблюдаем выпадение осадка желтого цвета:
$KI + AgNO_{3} = KNO_{3} + AgI↓$
$K^{+} + I^{-} + Ag^{+} + NO_{3}^{-} ⟶ K^{+} + NO_{3}^{-} + AgI↓$
$Ag^{+} + I^{-} ⟶ AgI↓$
Можно сделать вывод, что по цвету образовавшегося продукта реакции можно определить галогенид−ионыi
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Student bank".
2) Сайт "Prime Chemical Group".
3) Сайт "Studarium".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Галогены в природе
Галогены в природе существуют только в связанном состоянии. Среди них наиболее распространены хлор (0,19% от массы земной коры) и фтор (0,08%).
Важнейшее природное соединение хлора − галит NaCI. Галит добывают путём разработки залежей каменной соли − твёрдого хлорида натрия.
Кроме галита, встречается природный хлорид калия KCI. Это минералы сильвии и сильвинит.
Природный минерал фтора − это флюорит.
Бром и иод − рассеянные элементы и своих минералов не образуют. Эти элементы концентрируются в водах океанов и морей, в водах буровых скважин, а также в водорослях.?
1. Докажите зависимость степени электролитической диссоциации от природы электролита на примере галогеноводородных кислот.
Ответ:
Способность галогеноводородных кислот к электролитической диссоциации с образованием катионов водорода увеличивается от HF к HI.
Самая сильная из галогеноводородных кислот иодоводородная, а самая слабая – фтороводородная. Большая прочность химической связи (поэтому фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответственно малым расстоянием между ядрами атомов водорода и фтора. С увеличением радиуса атома от F к I растёт и расстояние H – Г, прочность молекул уменьшается и соответственно способность к электролитической диссоциации увеличивается.2. В четырёх пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Как распознать эти вещества с помощью одного реактива?
Ответ:
В четырёх пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Распознать эти вещества сможем с помощью нитрата серебра.
1) $NaF + AgNO_{3} = NaNO_{3} + AgF$
В результате данной реакции не наблюдаем образование осадка.
2) $NaCl + AgNO_{3} = NaNO_{3} + AgCl$
В результате данной реакции наблюдаем образование белого творожистого осадка.
3) $NaBr + AgNO_{3} = NaNO_{3} + AgBr$
В результате данной реакции наблюдаем образование светло−желтого осадка.
4) $NaI + AgNO_{3} = NaNO_{3} + AgI$
В результате данной реакции не наблюдаем образование желтого осадка.3. Напишите не менее четырёх−пяти уравнений реакций получения хлорида магния. Там, где это имеет место, запишите и ионные уравнения и рассмотрите окислительно−восстановительные процессы.
Ответ:
Способы получения хлорида магния:
1) $Mg + Cl_{2} ⟶ MgCl_{2}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
2) $Mg + 2HCl ⟶ MgCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
3) $MgO + 2HCl ⟶ MgCl_{2} + H_{2}O$
$MgO + 2H^{+} + 2Cl^{-} ⟶ Mg^{2+} + 2Cl^{-} + H_{2}O$
$MgO + 2H^{+} ⟶ Mg^{2+} + H_{2}O$
4) $Mg(OH)_{2} + 2HCl ⟶ MgCl_{2} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} + 2Cl^{-} ⟶ Mg^{2+} + 2Cl^{-} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} ⟶ Mg^{2+} + 2H_{2}O$
5) $MgCO_{3} + 2HCl ⟶ MgCl_{2} + H_{2}O + CO_{2}↑$
$MgCO_{3} + 2H^{+} + 2Cl^{-} ⟶ Mg^{2+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$MgCO_{3} + 2H^{+} ⟶ Mg^{2+} + H_{2}O + CO_{2}↑$4. Напишите уравнения химических реакций, иллюстрирующие следующие превращения:
$Cl_{2}$ $\overset{1}{⟶}$ HCl $\overset{2}{⟶}$ $CuCl_{2}$ $\overset{3}{⟶}$ $ZnCl_{2}$ $\overset{4}{⟶}$ AgCl
Укажите окислительно−восстановительные реакции и разберите их. Уравнения реакций с участием электролитов запишите также в ионной форме.Ответ:
$Cl_{2}$ $\overset{1}{⟶}$ HCl $\overset{2}{⟶}$ $CuCl_{2}$ $\overset{3}{⟶}$ $ZnCl_{2}$ $\overset{4}{⟶}$ AgCl
1) $H_{2} + Cl_{2} = 2HCl$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$H_{2}^{0} - 2ē ⟶ 2H^{+}$ − восстановитель
2) $Cu(OH)_{2} + 2HCl = CuCl_{2} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + 2Cl^{-} ⟶ Cu^{2+} + 2Cl^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} ⟶ Cu^{2+} + 2H_{2}O$
3) CuCl{2} + Zn = ZnCl{2} + Cu
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
4) $ZnCl_{2} + 2AgNO_{3} = Zn(NO_{3})_{2} + 2AgCl↓$
$Zn^{2+} + 2Cl^{-} + 2Ag^{+} + 2NO_{3}^{-} ⟶ Zn^{2+} + 2NO_{3}^{-} + 2AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$ §22
-
§22. Получение галогенов. Биологическое значение и применение галогенов и их соединений
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Student bank".
2) Сайт "Solver Book".
3) Сайт "Chem ege".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Получение галогенов
В промышленности фтор и хлор получают электролизом расплавов или растворов их солей. Например, процесс электролиза расплава хлорида натрия можно отразить уравнением:
$2NaCl = 2Na + Cl_{2}$.
При получении хлора электролизом раствора хлорида натрия кроме хлора образуются также водород и гидроксид натрия:
$2NaCl + 2H_{2}O = H_{2} + Cl_{2} + 2NaOH$.
Но если водород можно получить другими, более удобными и дешёвыми способами, например из природного газа, то гидроксид натрия, как и хлор, получают почти исключительно электролизом раствора поваренной соли.
В лаборатории хлор получают взаимодействием соляной кислоты с оксидом марганца (IV):
$MnO_{2} + HCl = MnCl_{2} + Cl_{2} + H_{2}O$.
Бром и иод получают в промышленности по реакции вытеснения их хлором соответственно из бромидов и иодидов.?
1. Вычислите объём хлора (н. у.) и массу натрия, которые можно получить при электролизе 585 г хлорида натрия, содержащего 2% примесей.
Ответ:
Дано:
m (соли) = 585 г
ω (примесей) = 2%
Найти:
V ($Cl_{2}$) − ?
m (Na) − ?
Решение:
$2NaCl = 2Na + Cl_{2}$
ω (NaCl) = 100% − ω (примесей) = 100% − 2% = 98%
m (NaCl) = m (соли) * ω (NaCl) = 585 * 0,98 = 573 г
n (NaCl) = $\frac{m}{M}$ = $\frac{573,3}{58,5}$ = 9,8 моль
n (Na) = n (NaCl) = 9,8 моль
m (Na) = n * M = 9,8 * 23 = 225,4 г
n ($Cl_{2}$) = $\frac{n (NaCl)}{2}$ = $\frac{9,8}{2}$ = 4,9 моль
V ($Cl_{2}$) = n * $V_{m}$ = 4,9 * 22,4 = 109,8 л
Ответ: V ($Cl_{2}$) = 109,8 л; m (Na) = 225,4 г.2. Рассчитайте, сколько граммов 40%−го раствора щёлочи можно получить из натрия, массу которого вы определили в предыдущей задаче.
Ответ:
Дано:
m (Na) = 225,4 г
ω (NaOH) = 40%
Найти:
m (р−ра) − ?
Решение:
$2Na + 2H_{2}O = 2NaOH + H_{2}$
n (Na) = $\frac{m}{M}$ = $\frac{225,4}{23}$ = 9,8 моль
n (NaOH) = n (Na) = 9,8 моль
m (NaOH) = n * M = 9,8 * 40 = 392 г
m (р−ра) = $\frac{m (NaOH)}{ω (NaOH)}$
ω (NaOH) = 40% = 0,4
m (р−ра) = $\frac{n (NaCl)}{ω (NaOH)}$ = $\frac{392}{0,4}$ = 980 г
Ответ: m (р−ра) = 980 г.3. Французский химик К. Шееле получил хлор по реакции оксида марганца (IV) с соляной кислотой. В результате этой реакции образуются также хлорид марганца (II) и вода. Составьте уравнение этой реакции, рассмотрите окислительно−восстановительные процессы и рассчитайте массу оксида марганца (IV) и количество хлороводорода, необходимых для получения 100 л хлора (н. у.), если выход его составляет 95% от теоретически возможного.
Ответ:
$MnO_{2} + 4HCl = MnCl_{2} + Cl_{2} + 2H_{2}O$
$Mn^{+4} + 2e = Mn^{+2}$ − окислитель
$2Cl^{-} - 2e = Cl_{2}^{0}$ − восстановитель
Дано:
$V_{практ}$ ($Cl_{2}$) = 100 л
η ($Cl_{2}$) = 95%
Найти:
m ($MnO_{2}$) − ?
n (HCl) − ?
Решение:
$MnO_{2} + 4HCl = MnCl_{2} + Cl_{2} + 2H_{2}O$
$V_{теор}$ ($Cl_{2}$) = $V_{практ}$ ($Cl_{2}$) : η ($Cl_{2}$) = 100 : 0,95 = 105,3 л
n ($Cl_{2}$) = $\frac{V}{V_{m}}$ = $\frac{105,3}{22,4}$ = 4,7 моль
n (HCl) = 4 * n ($Cl_{2}$) = 4 * 4,7 = 18,8 моль
n ($MnO_{2}$) = n ($Cl_{2}$) = 4,7 моль
m ($MnO_{2}$) = n * M = 4,7 * 87 = 409 г
Ответ: m ($MnO_{2}$) = 409 г; n (HCl) = 18,8 моль.4. Подготовьте сообщение о положительном и отрицательном значении галогенов и их соединений в жизни человека.
Ответ:
Положительное и отрицательное значение галогенов и их соединений в жизни человека
Фтор
Благодаря этому важному компоненту, участвующему в построении зубной эмали и костей, предотвращается такое заболевание, как кариес зубов.
Кроме того, фтор является необходимым элементом в процессах обмена веществ в железах, мышцах и нервных клетках.
Хлор
Один из химических элементов, без которых немыслимо существование живых организмов. Основная форма его поступления в организм − это хлорид натрия, который стимулирует обмен веществ, рост волос, придаёт бодрость и силу. Больше всего хлорида натрия содержится в плазме крови.
Особую роль в пищеварении играет соляная кислота, которая входит в состав желудочного сока. Без 0,2%−й соляной кислоты практически прекращается процесс переваривания пищи. И хотя почти все пищевые продукты содержат некоторое количество поваренной соли, человек вынужден добавлять к пище ежедневно около 20 г соли.
Хлор содержится в очень опасном для жизни и здоровья веществе − диоксине. Летучие соединения хлора − одна из причин разрушения озонового слоя Земли.
Бром
Соединения этого элемента регулируют процессы возбуждения и торможения центральной нервной системы, поэтому для лечения нервных болезней (бессонницы, истерии, неврастении и т. д.) врачи прописывают бромсодержащие препараты.
Йод
Последний из рассматриваемых нами галогенов йод — элемент, без которого человек не может жить: недостаток его в воде и пище снижает выработку
гормонов щитовидной железы и приводит к заболеванию эндемическим зобом. Гормоны щитовидной железы регулируют мышечную деятельность, работу сердца и мозга, а также аппетит, пищеварение.
Йод поступает в организм вместе с водой, воздухом и пищей: хлебом, яйцами, молоком, водой, морской капустой.5. Извечная заповедь медицины: "Малые дозы – лекарство, а большие – яд". Докажите её на примерах из химии галогенов.
Ответ:
Извечная заповедь медицины: "Малые дозы – лекарство, а большие – яд". Докажим её на примерах из химии галогенов, например, фтор в малых дозах необходим для профилактики кариеса, а в больших дозах стимулирует образование опухолей.
6. Английский поэт Уилфред Оуэн, погибший в сражениях Первой мировой войны, написал такие строки:
Газ! Газ! Скорей! – неловкие движенья,
Напяливание масок в едкой мгле!
Один замешкался, давясь и спотыкаясь,
Барахтаясь, как в огненной смоле,
В просветах мутного зелёного тумана.
Бессильный, как во сне, вмешаться и помочь,
Я видел только – вот он зашатался,
Рванулся и поник – бороться уж невмочь.
Какое событие описывает поэт? Какой галоген выступает в страшной роли убийцы? Какие его свойства упоминаются в стихотворении?Ответ:
Английский поэт Уилфред Оуэн описывает боевые действие, в которых галоген − хлор − применяется в качестве химического оружия.
В стихотворении упоминаются следующие свойства хлора: едкий запах, бледно−зеленый цвет, удушливый газ.7. Используя свои знания по химии галогенов, напишите сочинение на тему «Художественный образ вещества или процесса». Для того чтобы иметь представление, как это делают другие ученики, прочитайте сочинение ученика 9 класса 531−й школы Москам Ильи Горшкова (1990).
Самый сильный окислитель
Жил−был Кислород. И был он таким сильным, что, с кем ни встретится, сразу окислит. И назвали Кислород окислителем, а вещества, получающиеся в реакции с Кислородом, − оксидами, сам процесс − окислением. Ходит Кислород по таблице Менделеева и со всеми в реакцию вступает. Стал он хвастливым, заносчивым и решил, будто в химическом мире нет никого сильнее его. И всё же Кислород ошибся. Как−то раз встретил он в таблице Фтор. Решил Кислород окислить Фтор. Позвал он на помощь Водород и, образовав в соединении с ним воду, пошел в наступление на Фтор. И произошло чудо. Вода, которой тушат пожары, сама загорелась во Фторе. Кислород, считавшийся окислителем, в этой реакции стал восстановителем. Так Фтор превзошёл Кислород и оказался самым сильным из окислителей.
Какие химические понятия осветил Илья в своём сочинении? Выпишите их и дайте их определения.Ответ:
Добрый кальций
В большом семиэтажном доме, в подъезде щелочноземельных металлов, на четвертом этаже жил Кальций – металл. Он, как и все щелочноземельные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой.
Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам.
Кальций отдавал молекуле Кислорода два электрона:
$2Ca + O_{2} = 2CaO$
Оксид Кальция был добрым и с водой давал гидроксид:
$CaO + H_{2}O = Ca(OH)_{2}$.
Только Стронций и Барий поддерживали в этом Кальций, оксид Магния не дружил с водой.
Илья осветил в своем сочинение такие понятия:
Окислитель − это вещество, которое принимает электроны.
Восстановитель − это вещество, которое отдает электроны.
Окисление − это процесс, в результате которого происходит потеря электронов атомом вещества.
Оксиды − это сложные вещества, состоящие из двух элементов, одним из которых является кислород. §23
-
§23. Кислород
Лабораторный опыт №27
Получение и распознавание кислорода
Повторите опыт получения кислорода, который вы проделывали в начале года. В две колбы объёмом 50 мл налейте по 5−10 мл раствора пероксида водорода. В первую колбу добавьте на кончике шпателя оксид марганца (IV), во вторую – свеженатёртую морковь или картофель. Что наблюдаете? Как вы докажете наличие кислорода в сосудах? Почему кислород какое−то время не улетучивается из колб? Какую роль играет в этой реакции оксид марганца (IV)? Как называется фермент, содержащийся в овощном соке?Ответ:
Получение и распознавание кислорода
Повторили опыт получения кислорода, который мы проделывали в начале года. В две колбы объёмом 50 мл налили по 5−10 мл раствора пероксида водорода. В первую колбу добавили на кончике шпателя оксид марганца (IV), во вторую – свеженатёртую морковь или картофель.
$2H_{2}O_{2} ⟶ 2H_{2}O + O_{2}↑$
$2H_{2}O_{2} ⟶ 2H_{2}O + O_{2}↑$
Наблюдаем выделение газа − кислорода. Доказать наличие кислорода можно с помощью тлеющей лучины, она вспыхнет при внесении в колбу с кислородом. Кислород какое−то время не улетучивается из колб, так как он тяжелее воздуха. Оксид марганца (IV) в данной реакции является катализатором. Фермент, содержащийся в овощном соке − каталаза.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Student bank".
2) Сайт "Elar".
3) Сайт "Science for you".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Кислород в природе
Кислород − самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), которая покрывает $\frac{2}{3}$ поверхности земного шара, образуя его водную оболочку − гидросферу. Кислород − вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли − атмосферы, где на его долю приходится 20,95% по объёму и 23,15% по массе. Кислород входит в состав многочисленных минералов твердой оболочки земной коры − литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Как вы уже знаете, кислород существует в форме $O_{2}$. Это газ без цвета, запаха. В жидком состоянии имеет светло−голубую окраску, в твёрдом − синюю. В воде газообразный кислород растворим лучше, чем азот и водород.?
1. Напишите уравнения реакций кислорода с металлами, о которых говорится в параграфе. Рассмотрите окислительно−восстановительные процессы.
Ответ:
Уравнения реакций кислорода с металлами, о которых говорится в параграфе:
1) $4Li + O_{2} = 2Li_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Li^{0} - 1ē ⟶ Li^{+}$ − восстановитель
2) $2Na + O_{2} = Na_{2}O_{2}$
$O_{2}^{0} + 2ē ⟶ 2O^{-}$ − окислитель
$Na^{0} - 1ē ⟶ Na^{+}$ − восстановитель
3) $3Fe + 2O_{2} = Fe_{3}O_{4}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
$2Fe^{0} - 6ē ⟶ 2Fe^{+3}$2. Напишите уравнения реакций кислорода с неметаллами, о которых говорится в параграфе. Рассмотрите окислительно−восстановительные процессы.
Ответ:
Уравнения реакций кислорода с неметаллами, о которых говорится в параграфе:
1) $S + O_{2} = SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель
2) $C + O_{2} = CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
3) $4P + 5O_{2} = 2P_{2}O_{5}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$P^{0} - 5ē ⟶ P^{+5}$ − восстановитель3. Какие вещества называются катализаторами? Какая реакция, применяемая для получения кислорода, осуществляется в присутствии оксида марганца (IV)? Напишите уравнение этой реакции.
Ответ:
Катализаторы – это вещества, изменяющие скорость химической реакции или путь, по которому она протекает, но остающиеся неизменёнными качественно и количественно по окончании реакции.
Реакция, применяемая для получения кислорода, осуществляется в присутствии оксида марганца (IV):
$2H_{2}O_{2} ⟶ 2H_{2}O + O_{2}↑$4. Английский химик Дж. Пристли получил кислород разложением оксида ртути (II). Напишите уравнение этой реакции. Придумайте и решите задачу, в условии которой были бы указаны масса исходного вещества и доля в нём примесей, а требовалось бы найти объём кислорода при известном выходе его от теоретически возможного.
Ответ:
$2HgO = 2Hg + O_{2}$
Найдите объем кислорода, выделившегося при разложении 120 г оксида ртути, содержащего 12% примесей, если выход газа составляет 95%.
Дано:
$m_{техн}$ (HgO) = 120 г
ω (примесей) = 12%
η = 95%
Найти:
$V_{практ}$ ($O_{2}$) − ?
Решение:
$2HgO = 2Hg + O_{2}$
ω (HgO) = 100% − 12% = 88%
$m_{чист}$ (HgO) = 120 * 0,88 = 105,6 г
n (HgO) = $\frac{m}{M}$ = $\frac{105,6}{217}$ = 0,49 моль
n ($O_{2}$) = $\frac{1}{2}$ * n (HgO) = $\frac{1}{2}$ * 0,49 = 0,245 моль
$V_{теор}$ ($O_{2}$) = n * $V_{m}$ = 0,245 * 22,4 = 5,49 л
$V_{практ}$ ($O_{2}$) = $V_{теор}$ ($O_{2}$) * η = 5,49 * 0,95 = 5,2 л
Ответ: $V_{практ}$ ($O_{2}$) = 5,2 л.5. Укажите признаки сходства и различия в процессах дыхания и горения.
Ответ:
Сходства в процессах дыхания и горения:
1) Кислород является окислителем.
2) Это экзотермические процессы.
3) Продукты реакций − оксиды.
Различия в процессах дыхания и горения:
Горение − это быстрая реакция, а дыхание − медленная.6. Сравните процессы дыхания и фотосинтеза.
Ответ:
Сравнение процессов дыхания и фотосинтеза:
1) В процессе фотосинтеза поглощается углекислый газ $CO_{2}$ и выделяется кислород $O_{2}$, а в процессе дыхания наоборот – поглощается кислород $O_{2}$ и выделяется углекислый газ $CO_{2}$.
2) Процесс фотосинтеза относится к эндотермическим реакциям, а дыхание – экзотермическим.7. Используя свои знания по химии кислорода, напишите сочинение на тему "Художественный образ вещества или процесса".
Ответ:
Художественный образ кислорода
Кислород − элемент − неметалл. Кислород был тружеником, он работал окислителем. Он трудился и на воздухе, и в почве, и в воде, и в живой и неживой природе. Особое внимание он уделял органическим веществам. В реакции с Кислородом они превращались в углекислый газ и воду. Только в одном случае Кислород мог отдохнуть, побыть восстановителем − в реакции со фтором.8. Напишите уравнение реакции фтора с водой. В какой роли здесь выступает кислород? Рассмотрите окислительно−восстановительный процесс, определите окислитель и восстановитель.
Ответ:
$2F_{2} + 2H_{2}O = 4HF + O_{2}↑$
$F_{2}^{0} + 2ē ⟶ 2F^{-}$ − окислитель
$2O^{-2} - 4ē ⟶ O_{2}^{0}$ − восстановитель §24
-
§24. Сера
Лабораторный опыт №28
Горение серы на воздухе и в кислороде
Наберите в ложечку для сжигания веществ немного серы, подожгите её. Каков характер пламени горящей серы? Как изменится пламя, если ложечку с горящей серой внести в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV))? Какой запах имеет образовавшийся продукт? Запишите уравнение реакции, рассмотрите окислительно−восстановительные процессы.Ответ:
Горение серы на воздухе и в кислороде
Набрали в ложечку для сжигания веществ немного серы, подожгли её.
Пламя горения серы имеет голубой цвет.
$S + O_{2} = SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{0} - 4ē ⟶ S^{+2}$ − восстановитель
При внесении горящей серы в кислород, пламя становится ослепительно−ярким. Оксид серы (IV) имеет резкий запах, похожий на запах загорающейся спички.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Cyber leninka".
2) Сайт "Chem".
3) Сайт "Химия и жизнь".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение и свойства атомов серы
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы Периодической системы Д. И, Менделеева, содержат на внешнем энергетическом уровне шесть электронов, из которых два электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, менышее значение электроотрицательности, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее электроотрицательным элементам (водороду) сера проявляет окислительные свойства и приобретает степень окисления − 2.?
1. Вычислите объём сернистого газа (н. у.), который образуется при обжиге 485 кг цинковой обманки, содержащей в качестве примеси 20% оксида кремния (IV).
Ответ:
Дано:
$m_{техн}$ (ZnS) = 485 кг
ω (примесей) = 20%
Найти:
V ($SO_{2}$) − ?
Решение:
$2ZnS + 3O_{2} = 2ZnO + 2SO_{2}$
ω (ZnS) = 100% − 20% = 80%, или 0,8
m (ZnS) = $m_{техн}$ (ZnS) * ω (ZnS) = 485 * 0,8 = 388 кг
n (ZnS) = $\frac{m}{M}$ = $\frac{388}{97}$ = 4 кмоль
n ($SO_{2}$) = n (ZnS) = 4 кмоль
V ($SO_{2}$) = n * $V_{m}$ = 4 * 22,4 = 89,6 $м^{3}$
Ответ: V ($SO_{2}$) = 89,6 $м^{3}$.2. Составьте уравнение реакции взаимодействия серы с бертолетовой солью $KClO_{3}$, зная, что в результате её образуется хлорид калия и сернистый газ (при уравнивании используйте метод электронного баланса). Рассмотрите эту реакцию как окислительно−восстановительный процесс.
Ответ:
Составим уравнение реакции взаимодействия серы с бертолетовой солью $KClO_{3}$, зная, что в результате её образуется хлорид калия и сернистый газ:
$3S + 2KClO_{3} = 2KCl + 3SO_{2}$
$Cl^{+5} + 6ē ⟶ Cl^{-}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель3. Запишите уравнения реакций, с помощью которых можно осуществить превращения:
S $\overset{1}{⟶}$ HgS $\overset{2}{⟶}$ $SO_{2}$ $\overset{3}{⟶}$ $Na_{2}SO_{3}$ $\overset{4}{⟶}$ $SO_{2}$ $\overset{5}{⟶}$ $SO_{3}$ $\overset{6}{⟶}$ $H_{2}SO_{4}$
Укажите среди этих реакций окислительно−восстановительные, определите окислители и восстановители.Ответ:
S $\overset{1}{⟶}$ HgS $\overset{2}{⟶}$ $SO_{2}$ $\overset{3}{⟶}$ $Na_{2}SO_{3}$ $\overset{4}{⟶}$ $SO_{2}$ $\overset{5}{⟶}$ $SO_{3}$ $\overset{6}{⟶}$ $H_{2}SO_{4}$
1) $Hg + S = HgS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Hg^{0} - 2ē ⟶ Hg^{+2}$ − восстановитель
2) $2HgS + 3O_{2} = 2HgO + 2SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{-2} - 6ē ⟶ S^{+4}$ − восстановитель
3) $SO_{2} + 2NaOH = Na_{2}SO_{3} + H_{2}O$
4) $Na_{2}SO_{3} + 2HCl = 2NaCl + H_{2}O + SO_{2}↑$
5) $2SO_{2} + O_{2} ⇄ 2SO_{3}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{+4} - 2ē ⟶ S^{+6}$ − восстановитель
6) $SO_{3} + H_{2}O = H_{2}SO_{4}$4. Выдающийся естествоиспытатель древности Плиний Старший погиб в 70 г. н.э. при извержении вулкана. Его племянник в письме историку Тациту писал: «...Вдруг раздались раскаты грома, и от горного пламени покатились вниз чёрные серные пары. Все разбежались. Плиний... упал и задохся».
Какими свойствами обладают соединения, входящие в состав вулканических газов?Ответ:
Соединения, входящие в состав вулканических газов, обладают удушающими свойствами.
5. Почему процесс обеззараживания помещений от пролитой ртути называют демеркуризацией?
Ответ:
Процесс обеззараживания помещений от пролитой ртути называют демеркуризацией, так как ртуть являлась символом планеты Меркурий, а приставка де− означает отсутствие.
§25
-
§25. Соединения серы
Лабораторный опыт №29
1. Свойства разбавленной серной кислоты
Проделайте опыты, доказывающие, что серная кислота проявляет типичные свойства кислот.
Поместите в одну пробирку гранулу цинка, а в другую − кусочек меди и налейте в обе пробирки по 2 мл раствора серной кислоты. Что наблюдаете? Почему результат этого эксперимента именно таков? Запишите молекулярное и сокращенное ионное уравнения, рассмотрите окислительно−восстановительные процессы.Ответ:
Свойства разбавленной серной кислоты
Поместили в одну пробирку гранулу цинка, а в другую − кусочек меди и налили в обе пробирки по 2 мл раствора серной кислоты.
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}$
$Zn + 2H^{+} + SO^{2-}_{4} = Zn^{2+} + SO^{2-}_{4} + H_{2}$
$Zn + 2H^{+} = Zn^{2+} + H_{2}$
$Cu + H_{2}SO_{4}$ ≠
В первой пробирке наблюдаем выделение газа, во второй − нет видимых признаков реакции. Результат этого эксперимента именно таков, так как медь − металл после водорода в ряду напряжения металлов, поэтому она не реагирует с кислотами.2. Свойства разбавленной серной кислоты
Поместите в пробирку немного чёрного порошка или одну гранулу оксида меди (II), прилейте в неё 1−2 мл раствора серной кислоты. Закрепите пробирку в держателе и подогрейте на пламени спиртовки. Что наблюдаете? Вапишите молекулярное и ионные уравнения.Ответ:
Свойства разбавленной серной кислоты
Поместили в пробирку немного чёрного порошка или одну гранулу оксида меди (II), прилили в неё 1−2 мл раствора серной кислоты. Закрепили пробирку в держателе и подогрели на пламени спиртовки.
$CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
Наблюдаем растворение черного порошка оксида меди.3. Свойства разбавленной серной кислоты
Налейте в пробирку 1−2 мл раствора щёлочи, добавьте 2−4 капли раствора фенолфталенна. Что наблюдаете? Добавьте к этому раствору разбавленную серную кислоту до исчезновения окраски. Как называется эта реакция? Запишите соответствующие молекулярное и ионные уравнения.Ответ:
Свойства разбавленной серной кислоты
Налили в пробирку 1−2 мл раствора щёлочи, добавили 2−4 капли раствора фенолфталенна.
Наблюдаем изменение окраски раствора на малиновую.
Добавили к этому раствору разбавленную серную кислоту до исчезновения окраски. Это реакция называется реакцией нейтрализации.
$2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O$
$2Na^{+} + 2OH^{-} + 2H^{+} + SO^{2-}_{4} = 2Na^{+} + SO^{2-}_{4} + 2H_{2}O$
$OH^{-} + H^{+} = H_{2}O$4. Свойства разбавленной серной кислоты
Налейте в пробирку 1 мл раствора медного купороса и прилейте 1−2 мл раствора щёлочи. Что наблюдаете? Добавляйте к содержимому пробирки разбавленную серную кислоту до исчезновения осадка.
Запишите молекулярные и ионные уравнения проведённых реакций.Ответ:
Свойства разбавленной серной кислоты
Налили в пробирку 1 мл раствора медного купороса и прилили 1−2 мл раствора щёлочи.
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓$
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-}$ ⟶ $2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓$
$Cu^{2+} + 2OH^{-} ⟶ Cu(OH)_{2}↓$
Наблюдаем образование голубого осадка.
Добавляли к содержимому пробирки разбавленную серную кислоту до исчезновения осадка.
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Cu^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} ⟶ Cu^{2+} + 2H_{2}O$5. Свойства разбавленной серной кислоты
В пробирку налейте 1−2 мл раствора сульфата натрия или калия, прилейте 1 мл раствора хлорида кальция. Что наблюдаете? Объясните результат с помощью таблицы растворимости. Почему вместо хлорида бария, который является реактивом на серную кислоту и ее соли, вам было предложено воспользоваться хлоридом кальция? В чем достоинства и недостатки этого реактива? Запишите молекулярное и ионные уравнения.Ответ:
Свойства разбавленной серной кислоты
В пробирку налили 1−2 мл раствора сульфата натрия, прилили 1 мл раствора хлорида кальция.
$CaCl_{2} + Na_{2}SO_{4} = 2NaCl + CaSO_{4}↓$
$Ca^{2+} + 2Cl^{-} + 2Na^{+} + SO_{4}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + CaSO_{4}↓$
$Ca^{2+} + SO_{4}^{2-} ⟶ CaSO_{4}↓$
Наблюдаем образование осадка белого цвета.
Достоинством хлорида кальция является его дешевизна и хорошая растворимость, а недостатком − то, что он вызывает коррозию стального оборудования.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Disser cat".
2) Сайт "Chem 21".
3) Сайт "Cyber leninka".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Сероводород и сульфиды
Сероводород − бесцветный газ с резким запахом. Очень ядовит, вызывает отравление даже при незначительном содержании в воздухе (около 0,01%). Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом гемоглобина крови, что может привести к обморочному состоянию и смерти от кислородного голодания. В присутствии паров органических веществ токсичность $H_{2}S$ резко возрастает.
Вместе с тем сероводород является составной частью некоторых минеральных вод (Пятигорск, Серноводск, Мацеста), применяемых с лечебной целью.
Сероводород содержится в вулканических газах и постоянно образуется на дне Черного моря. До верхних слоёв сероводород не доходит, так как на глубине 150 м взаимодействует с проникающим сверху кислородом и окисляется им до серы. Сероводород образуется при гниении белка, поэтому, например, тухлые яйца пахнут сероводородом.
При растворении сероводорода в воде образуется слабая сероводородная кислота, соли которой называют сульфидами. Сульфиды щелочных и щёлочноземель ных металлов, а также сульфид аммония хорошо растворяются в воде, сульфиды остальных металлов нерастворимы и окрашены в различные цвета, например: ZnS − белый, PbS − чёрный, MnS − розовый.?
1. Какое из соединений серы проявляет только восстановительные, только окислительные или и окислительные, и восстановительные свойства: сера, сероводород, оксид серы (IV), серная кислота? Почему? Подтвердите свой ответ уравнениями соответствующих реакций.
Ответ:
Сера:
Проявляет и окислительные, и восстановительные свойства, т.к. сера находится в промежуточной степени окисления 0, то есть может повышать и понижать свою степень окисления.
$S + O_{2} = SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4 }$ − восстановитель
$Mg + S = MgS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
Сероводород:
Проявляет только восстановительные свойства, т.к. сера находится в минимальной степени окисления −2, то есть сера может только повышать свою степень окисления.
$2H_{2}S + 3O_{2} = 2H_{2}O + 2SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{-2} - 6ē ⟶ S^{+4}$ − восстановитель
Оксид серы (IV):
Проявляет и окислительные, и восстановительные свойства, т.к. сера находится в промежуточной степени окисления +4, то есть сера может повышать и понижать свою степень окисления.
$2SO_{2} + 2NO = N_{2} + 2SO_{3}$
$2N^{+2} + 4ē ⟶ N_{2}^{0}$ − окислитель
$S^{+4} - 2ē ⟶ S^{+6}$ − восстановитель
$SO_{2} + C = S + CO_{2}$
$S^{+4} + 4ē ⟶ S^{0}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
Серная кислота
Проявляет только окислительные свойства, т.к. сера находится в максимальной степени окисления +6, то есть сера может только понижать свою степень окисления.
$2H_{2}SO_{4}(конц.) + Cu = CuSO_{4} + SO_{2} + 2H_{2}O$
$S^{+6} + 2ē ⟶ S^{+4}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель2. Охарактеризуйте: а) сернистый газ; б) оксид серы (VI) по плану: получение, свойства, применение. Напишите уравнения соответствующих реакций.
Ответ:
а) Характеристика сернистого газа
Получение:
В промышленности – сжигание серы или обжиг пирита:
$S + O_{2} ⟶ SO_{2}$
$2FeS_{2} + 5O_{2} ⟶ 2FeO + 4SO_{2}$
В лаборатории – воздействием сильных кислот на сульфиты:
$Na_{2}SO_{3} + H_{2}SO_{4} ⟶ Na_{2}SO_{4} + H_{2}O + SO_{2}↑$
Свойства:
Взаимодействует с щелочами:
$SO_{2} + 2NaOH = Na_{2}SO_{3} + H_{2}O$
Взаимодействует с водой:
$SO_{2} + H_{2}O = H_{2}SO_{3}$
Взаимодействует с основными оксидами:
$SO_{2} + Na_{2}O = Na_{2}SO_{3}$
Применение:
Сернистый газ используют для отбеливания шерсти, шелка, бумаги и соломы, а также в качестве консервирующих средств для сохранения свежих плодов и фруктов.б) Характеристика оксида серы (VI)
Получение:
В промышленности – окисление оксида серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5):
2SO2 + O2 ⟶ 2SO3
Свойства:
Взаимодействует с щелочами:
$SO_{3} + 2NaOH = Na_{2}SO_{4} + H_{2}O$
Взаимодействует с водой:
$SO_{3} + H_{2}O = H_{2}SO_{4}$
Взаимодействует с основными оксидами:
$SO_{3} + Na_{2}O = Na_{2}SO_{4}$
Применение:
Оксид серы (IV) используют в основном для производства серной кислоты.3. Напишите уравнения реакций, характеризующих свойства разбавленной серной кислоты как электролита. Какое свойство является окислительно−восстановительным процессом? Какие реакции можно отнести к реакциям ионного обмена? Рассмотрите их с точки зрения теории электролитической диссоциации.
Ответ:
Разбавленная серная кислота проявляет все характерные свойства кислот: взаимодействует с металлами, стоящими в ряду напряжений до водорода, с выделением $H_{2}$, с оксидами металлов (основными и амфотерными), с основаниями, с амфотерными гидроксидами и солями.
1) $H_{2}SO_{4} + Mg = MgSO_{4} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
2) $MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O$
$MgO + 2H^{+} + SO_{4}^{2-} ⟶ Mg^{2+} + SO_{4}^{2-} + H_{2}O$
$MgO + 2H^{+} ⟶ Mg^{2+} + H_{2}O$
3) $Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$Cu(OH)_{2} + 2H^{+} ⟶ Cu^{2+} + H_{2}O$
4) $BaCl_{2} + H_{2}SO_{4} = 2HCl + BaSO_{4}↓$
$Ba^{2+} + 2Cl^{-} + 2H^{+} + SO_{4}^{2-} ⟶ 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$4. Напишите уравнения реакций, лежащих в основе получения серной кислоты, согласно приведённой в параграфе схеме.
Ответ:
Напишем уравнения реакций, лежащих в основе получения серной кислоты, согласно приведённой в параграфе схеме:
1) $S + O_{2} = SO_{2}$
$4FeS_{2} + 11O_{2} ⟶ 2Fe_{2}O_{3} + 8SO_{2}$
$2H_{2}S + 3O_{2} ⟶ 2H_{2}O + 2SO_{2}$
2) $2SO_{2} + O_{2} = 2SO_{3}$
3) $SO_{3} + H_{2}O = H_{2}SO_{4}$5. В 400 мл воды растворили 40 г оксида серы (VI) (н. у.). Вычислите массовую долю серной кислоты в полученном растворе.
Ответ:
Дано:
V ($H_{2}O$) = 400 мл
m ($SO_{3}$) = 40 г
Найти:
ω ($H_{2}SO_{4}$) − ?
Решение:
$SO_{3} + H_{2}O = H_{2}SO_{4}$
m ($H_{2}O$) = ρ * V = 1 * 400 = 400 г
n ($SO_{3}$) = $\frac{m}{M}$ = $\frac{40}{80}$ = 2 моль
n ($H_{2}SO_{4}$) = n ($SO_{3}$) = 2 моль
m (р−ра) = m ($SO_{3}$) + m ($H_{2}O$) = 40 + 400 = 440 г
ω ($H_{2}SO_{4}$) = $\frac{m}{m (р-ра)}$ * 100% = 11,1%
Ответ: ω ($H_{2}SO_{4}$) = 11,1%.6. Дайте характеристику реакции синтеза оксида серы (VI), используя все изученные вами классификации реакций.
Ответ:
Напишем уравнение реакции:
$2SO_{2} + O_{2} = 2SO_{3}$
Характеристика реакции:
1) Реакция соединения.
2) Реакция обратимая.
3) Каталитическая.
4) Эндотермическая.
5) Гомогенная.
6) Окислительно−восстановительная.7. В 5 л воды растворили 500 г медного купороса. Вычислите массовую долю сульфата меди (II) в полученном растворе.
Ответ:
Дано:
V ($H_{2}O$) = 5 л = 5000 мл
m ($CuSO_{4} * 5H_{2}O$) = 500 г
Найти:
ω ($CuSO_{4}$) − ?
Решение:
m ($H_{2}O$) = ρ * V = 1 * 5000 = 5000 г
m (р−ра) = m ($H_{2}O$) + m ($CuSO_{4} * 5H_{2}O$) = 5000 + 500 = 5500 г
n ($CuSO_{4} * 5H_{2}O$) = $\frac{m}{M}$ = $\frac{500}{250}$ = 2 моль
n ($CuSO_{4}$) = n ($CuSO_{4} * 5H_{2}O$) = 2 моль
m ($CuSO_{4}$) = n * M = 2 * 160 = 320 г
ω ($CuSO_{4}$) = $\frac{m (CuSO_{4}}{m (р-ра)}$ * 100% = 5,8%
Ответ: ω ($CuSO_{4}$) = 5,8%.8. Почему серную кислоту называют «хлебом химической промышленности»?
Ответ:
Серную кислоту называют «хлебом химической промышленности», так как она применяется во многих областях: производство минеральных удобрений, металлургия, очистка нефтепродуктов.
§26
-
§26. Азот
i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Disser cat".
2) Сайт "Science journals".
3) Сайт "Cyber leninka".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение и свойства атомов азота
Элемент азот − первый представитель главной подгруппы V группы Периодической системы Д. И. Менделеева. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три электрона неспаренные. Отсюда следует, что атомы этого элемента могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степень окисления −3, например, в соединениях с водородом − аммиаке и с металлами − нитридах.?
1. Напишите уравнения реакций азота с магнием, кальцием, алюминием. Рассмотрите эти окислительно−восстановительные процессы. Как называют продукты реакций? Каков тип химической связи и кристаллической решётки в них? Какими свойствами должны обладать продукты реакций?
Ответ:
$3Mg + N_{2} = Mg_{3}N_{2}$ − нитрид магния
$Mg^{0} − 2ē ⟶ Mg^{+2}$ − восстановитель
$N_{2}^{0} + 6ē ⟶ 2N^{-3}$ − окислитель
$3Ca + N_{2} = Ca_{3}N_{2}$ − нитрид кальция
$Ca^{0} − 2ē ⟶ Ca^{+2}$ − восстановитель
$N_{2}^{0} + 6ē ⟶ 2N^{-3}$ − окислитель
$2Al + N_{2} = 2AlN$ − нидрид алюминия
$Al^{0} − 3ē ⟶ Al^{+3}$ − восстановитель
$N_{2}^{0} + 6ē ⟶ 2N^{-3}$ − окислитель
Нитриды металлов образованы ионной связью, и обладают ионной кристаллической решеткой.
Нитриды металлов разлагаются водой и кислотами:
$Mg_{3}N_{2} + 6H_{2}O = 3Mg(OH)_{2} + 2NH_{3}$
$Mg_{3}N_{2} + 6HCl = 3MgCl_{2} + 2NH_{3}$2. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
$N_{2}$ $\overset{1}{⟶}$ $Li_{3}N$ $\overset{2}{⟶}$ $NH_{3}$ $\overset{3}{⟶}$ NO $\overset{4}{⟶}$ $NO_{2}$ $\overset{5}{⟶}$ $HNO_{3}$.
Рассмотрите первую реакцию как окислительно−восстановительную.Ответ:
$N_{2}$ $\overset{1}{⟶}$ $Li_{3}N$ $\overset{2}{⟶}$ $NH_{3}$ $\overset{3}{⟶}$ NO $\overset{4}{⟶}$ $NO_{2}$ $\overset{5}{⟶}$ $HNO_{3}$
1) $6Li + N_{2} = 2Li_{3}N$
$N_{2}^{0} + 6ē ⟶ 2N{-3}$ − окислитель
$Li^{0} - 1ē ⟶ Li^{+}$ − восстановитель
2) $Li_{3}N + 3H_{2}O = 3LiOH + NH_{3}$
3) $3NH_{3} + 5O_{2} = 4NO + 6H_{2}O$
4) $2NO + O_{2} = 2NO_{2}$
5) $2NO_{2} + H_{2}O = HNO_{3} + HNO_{2}$3. Дайте характеристику реакции по всем изученным вами признакам:
$2NO + O_{2} = 2NO_{2}$ + Q.Ответ:
Характеристика реакции $2NO + O_{2} = 2NO_{2}$ + Q:
1) Реакция соединения.
2) Обратимая реакция.
3) Некаталитическая реакция.
4) Экзотермическая реакция.
5) Гомогенная реакция.
6) Окислительно−восстановительная.4. Определите, используя метод электронного баланса, коэффициенты в уравнениях реакций, соответствующих следующим схемам:
а) $NH_{3} + O_{2}$ $\overset{t, кат}{⟶}$ $NO + H_{2}O$;
б) $NH_{3} + O_{2} ⟶ N_{2} + H_{2}O$.Ответ:
а) $4NH_{3} + 5O_{2} = 4NO + 6H_{2}O$
$O_{2}^{0} + 4ē = 2O^{-2}$ − окислитель
$N^{-3} - 5ē = N^{+2}$ − восстановительб) $4NH_{3} + 3O_{2} = 2N_{2} + 6H_{2}O$
$O_{2}^{0} + 4ē = 2O^{-2}$ − окислитель
$2N^{-3} - 6ē = N_{2}^{0}$ − восстановитель5. В лаборатории азот получают разложением нитрита аммония:
$NH_{4}NO_{2} ⟶ N_{2} + 2H_{2}O$.
Придумайте и решите задачу, в условии которой была бы указана масса исходного вещества и массовая доля в нем примесей, а требовалось бы найти объём одного продукта и число молекул другого получаемого вещества.Ответ:
Задача: Найдите объем водорода и число молекул воды, которые образовались при разложении 120 г нитрита аммония, содержащего 12% примесей.
Дано:
$m_{техн}$ ($NH_{4}NO_{2}$) = 120 г
ω = 12%, или 0,12
Найти:
V ($N_{2}$) − ?
N ($H_{2}O$) − ?
Решение:
$NH_{4}NO_{2} ⟶ N_{2} + 2H_{2}O$
m (примесей) = $m_{техн}$ ($NH_{4}NO_{2}$) * ω = 120 * 0,12 = 14,4 г
m ($NH_{4}NO_{2}$) = $m_{техн}$ ($NH_{4}NO_{2}$) − m (примесей) = 120 − 14,4 = 105,6 г
n ($NH_{4}NO_{2}$) = $\frac{m}{M}$ = $\frac{105,6}{64}$ = 1,65 моль
n ($N_{2}$) = n ($NH_{4}NO_{2}$) = 1,65 моль
V ($N_{2}$) = n * $V_{m}$ = 1,65 * 22,4 = 37 л
n ($H_{2}O$) = 2 * n ($NH_{4}NO_{2}$) = 2 * 1,65 = 3,3 моль
N ($H_{2}O$) = n * $N_{a}$ = 3,3 * 6,02 * $10^{23}$ = 19,9 * $10^{23}$ молекул
Ответ: V ($N_{2}$) = n * $V_{m}$ = 37 л; N ($H_{2}O$) = 19,9 * $10^{23}$ молекул. §27
-
§27. Аммиак
Лабораторный опыт №30
Изучение свойств аммиака
Соблюдая правила техники безопасности, вскройте ампулу с нашатырным спиртом и вылейте её содержимое в пробирку. Каким запахом обладает аммиак?
Добавьте к раствору аммиака 1−2 мл воды, а затем – 2 капли раствора фенолфталеина. Что наблюдаете? Что можно сказать о растворимости аммиака в воде? Подогрейте содержимое пробирки. Что наблюдаете? Объясните результаты проведённого эксперимента.Ответ:
Изучение свойств аммиака
Соблюдая правила техники безопасности, вскрыли ампулу с нашатырным спиртом и вылили её содержимое в пробирку.
Аммиак обладает резким характерным запахом.
Добавили к раствору аммиака 1−2 мл воды, а затем – 2 капли раствора фенолфталеина.
Наблюдаем изменение окраски индикатора, он приобретает малиновый цвет.
Про растворимость аммиака можно сказать, что он растворим в воде.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Disser cat".
2) Сайт "Science journals".
3) Сайт "School science".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение молекулы аммиака
Рассмотрим строение молекулы аммиака. На внешнем энергетическом уровне атомы азота содержат пять электронов, на которых три электрона неспаренные. Именно они и участвуют в формировании трёх ковалентных связей с тремя атомами водорода при образовании молекулы аммиака.
Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а так как молекула аммиака имеет форму треугольной пирамиды, то в результате смещения электронных пар возникает диполь, т.е. молекула с двумя полосами.
Молекулы аммиака (в жидком аммиаке) взаимодействуют, связываясь друг с другом.?
1. Каково электронное и пространственное строение молекулы аммиака?
Ответ:
На внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона − неспаренные. Именно они и участвуют в образовании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака.
Молекула аммиака имеет форму треугольной пирамиды.2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
Ответ:
Аммиак и его соли широко используют в промышленности и технике, в сельском хозяйстве, быту, для получения взрывчатых веществ.
В медицине аммиак применяют, так как он обладает резким запахом; в холодильных установках, так как этот газ легко сжижается при обычном давлении.3. Какую химическую связь называют водородной? В чём особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
Ответ:
Водородная связь – химическая связь между частично положительно заряженным атомом водорода одной молекулы и частично отрицательно заряженным атомом другой молекулы.
Особенность водородной связи заключается в высокой электроотрицательности атомов, контактирующих с водородом.
Благодаря водородным связям некоторые низкомолекулярные вещества имеют повышенные температуры плавления и кипения, это характерно для воды, спиртов, фтороводорода, аммиака.
Водородная связь играет огромную роль в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
Ответ:
Примеры веществ, между молекулами которых образуются водородные связи: аммиак, спирты, вода. Благодаря водородной связи вещества имеют высокую температуру кипения и плавления.
5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно−акцепторному механизму.
Является ли связь, образованная по донорно−акцепторному механизму, особым типом химической связи? Объясните почему.Ответ:
И водный раствор аммиака, и соли аммония содержат особый ион − катион аммония, играющий роль катиона металла. Ион аммония образуется в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару, и катионом водорода, который переходит к аммиаку от молекул кислот или воды.
При образовании иона аммония донором свободной электроной пары служит атом азота в аммиаке, а акцептором − катион водорода кислоты или воды.
Связь, образованная по донорно−акцепторному механизму, не является особым типом химической связи потому, что она образуется благодаря неподеленной электронной паре донора.6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.
Ответ:
При добавлении фенолфталеина к нашатырному спирту цвет индикатора изменится на малиновый.
$NH_{3} + H_{2}O ⇄ NH_{4}OH$
$NH_{4}OH ⇄ NH^{4+} + OH^{-}$7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?
Ответ:
а) В аммиаке азот имеет степень окисления −3:
$N^{-3}H_{3}$.б) В хлориде аммония азот имеет степень окисления −3:
$N^{-3}H_{4}Cl$.в) В нитрате аммония азот имеет степень окисления −3 и +5:
$N^{-3}H_{4}N^{+5}O_{3}$.г) В сульфате аммония азот имеет степень окисления −3:
$(N^{-3}H_{4})_{2}SO_{4}$.8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции:
$CuO + NH_{3} ⟶ N_{2} + Cu + H_{2}O$.Ответ:
$3CuO + 2NH_{3} = N_{2} + 3Cu + 3H_{2}O$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$2N^{-3} - 6ē ⟶ N_{2}^{0}$ − восстановитель9. Почему азот в аммиаке проявляет только восстановительные свойства?
Ответ:
Азот в аммиаке проявляет только восстановительные свойства, так как он находится в минимальной степени окисления −3, то есть он может только повысить ее.
10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?
Ответ:
а) В промышленности аммиак получают с помощью прямого взаимодействия водорода и азота:
$N_{2} + 3H_{2} = 2NH_{3}$б) В лабораторных условиях аммиак получают действием гашеной извести на соли аммония:
$Ca(OH)_{2} + 2NH_{2}Cl = CaCl_{2} + 2NH_{3} + 2H_{2}O$ §28
-
§28. Соли аммония
Лабораторный опыт №31
Распознавание солей аммония
Налейте в одну пробирку раствор хлорида натрия, а в другую – раствор хлорида аммония (1−2 мл). Затем добавьте в каждую пробирку по 1−2 мл раствора щёлочи и подогрейте содержимое пробирок на спиртовке (используйте держатель). Поднесите к отверстию пробирок влажную красную лакмусовую бумажку или влажную полоску универсального индикатора. Что наблюдаете? Как называется подобная реакция? Как ещё можно обнаружить выделяющийся в результате подобной реакции аммиак? Запишите уравнения реакций.Ответ:
Распознавание солей аммония
Налили в одну пробирку раствор хлорида натрия, а в другую – раствор хлорида аммония (1−2 мл). Затем добавили в каждую пробирку по 1−2 мл раствора щёлочи и подогрели содержимое пробирок на спиртовке. Поднесли к отверстию пробирок влажную красную лакмусовую бумажку или влажную полоску универсального индикатора.
Наблюдаем изменение цвета лакмусовой бумажки на синий. Подобная реакция называется качественной. Ещё аммиак можно обнаружить выделяющийся в результате подобной реакции аммиак с помощью хлороводорода, с ним в реакции выделяется белый дым.
$NH_{4}Cl + NaOH = NaCl + NH_{3} + H_{2}O$
$NH_{3} + HCl = NH_{4}Cl$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Disser cat".
2) Сайт "Science journals".
3) Сайт "Chem ege".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Соли аммония
Все соли аммония − твердые кристаллические вещества, хорошо растворимые в воде. По ряду свойств они похожи на соли щелочных металлов, и в первую очередь на соли калия, так как радиусы ионов калия и ионов аммония приблизительно равны.
Соли аммония получают взаимодействием аммиака с водным раствором кислот.
$NH_{3} + HCl = NH_{4}Cl$
Они обладают всеми свойствами солей, обусловленными наличием кислотных остатков. Например, хлорид или сульфат аммония реагируют соответственно с нитратом серебра или хлоридом бария, образуя при этом характерные осадки.
$NH_{4}Cl + AgNO_{3} = AgCl + NH_{4}NO_{3}$
$(NH_{4})_{2}SO_{4} + BaCl_{2} = BaSO_{4} + 2NH_{4}Cl$
Карбонат аммония взаимодействует с кислотами, так как в результате реакции образуется углекислый газ.
$(NH_{4})_{2}CO_{3} + 2HCl = 2NH_{4}Cl + CO_{2} + H_{2}O$.?
1. Напишите уравнения реакций (в молекулярной и ионной формах) между растворами веществ: а) сульфат аммония и хлорид бария; б) хлорид аммония и нитрат серебра.
Ответ:
а) Уравнение реакции (в молекулярной и ионной формах) между растворами сульфата аммония и хлорида бария:
$(NH_{4})_{2}SO_{4} + BaCl_{2} = 2NH_{4}Cl + BaSO_{4}↓$
$2NH_{4}^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-}$ ⟶ $2NH_{4}^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO4↓$б) Уравнение реакции (в молекулярной и ионной формах) между растворами хлорида аммония и нитрата серебра:
$NH_{4}Cl + AgNO_{3} = NH_{4}NO_{3} + AgCl↓$
$NH_{4}^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} ⟶ NH_{4}^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$2. Напишите уравнения реакций, характеризующих свойства карбоната аммония: взаимодействия с кислотой, щёлочью, солью; реакции разложения. Первые три уравнения запишите также в ионной форме.
Ответ:
1) Уравнение взаимодействия карбоната аммония с кислотой:
$(NH_{4})_{2}CO_{3} + 2HCl = 2NH_{4}Cl + H_{2}O + CO_{2}↑$
$(NH_{4})_{2}CO_{3} + 2H^{+} + 2Cl^{-} ⟶ 2NH_{4}^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$(NH_{4})_{2}CO_{3} + 2H^{+} ⟶ 2NH_{4}^{+} + H_{2}O + CO_{2}↑$
2) Уравнение взаимодействия карбоната аммония с щёлочью:
$(NH_{4})_{2}CO_{3} + 2KOH = K_{2}CO_{3} + 2NH_{3}↑ + 2H_{2}O$
$(NH_{4})_{2}CO_{3} + 2K^{+} + 2OH^{-}$ ⟶ $2K^{+} + CO_{3}^{2-} + 2NH_{3}↑ + 2H_{2}O$
$(NH_{4})_{2}CO_{3} + 2OH^{-} ⟶ CO_{3}^{2-} + 2NH_{3}↑ + 2H_{2}O$
3) Уравнение взаимодействия карбоната аммония с солью:
$(NH_{4})_{2}CO_{3} + CaCl_{2} = 2NH_{4}Cl + CaCO_{3}↓$
$(NH_{4})_{2}CO_{3} + Ca^{2+} + 2Cl^{-} ⟶ 2NH_{4}^{+} + 2Cl^{-} + CaCO_{3}↓$
$(NH_{4})_{2}CO_{3} + Ca^{2+} ⟶ 2NH_{4}^{+} + CaCO_{3}↓$
4) Уравнение разложения карбоната аммония:
$(NH_{4})_{2}CO_{3} ⟶ 2NH_{3}↑ + H_{2}O + CO_{2}↑$3. С многоосновными кислотами аммиак образует не только средние, но и кислые соли. Напишите формулы кислых солей, которые он может дать при взаимодействии с фосфорной кислотой. Назовите их и напишите уравнения диссоциации этих солей.
Ответ:
Формулы кислых солей, которые аммиак может дать при взаимодействии с фосфорной кислотой:
$(NH_{4})_{3}PO_{4}$ – фосфат аммония
$(NH_{4})_{2}HPO_{4}$ – гидрофосфат аммония
$NH_{4}H_{2}PO_{4}$ – дигидрофосфат аммония
Уравнения диссоциации этих солей:
$NH_{4}H_{2}PO_{4} ⇄ NH^{4+} + 2H^{+} + PO_{4}^{3-}$
$(NH_{4})_{3}PO_{4} ⇄ 3NH_{4}^{+} + PO_{4}^{3-}$
$(NH_{4})_{2}HPO_{4} ⇄ 2NH_{4}^{+} + H^{+} + PO_{4}^{3-}$4. Составьте молекулярные и, где это возможно, ионные уравнения реакций, с помощью которых можно осуществить следующие переходы:
$N_{2}$ $\overset{1}{⟶}$ $NH_{3}$ $\overset{2}{⟶}$ $(NH_{4})_{2}HPO_{4}$ $\overset{3}{⟶}$ $NH_{4}Cl$ $\overset{4}{⟶}$ $NH_{4}NO_{3}$.Ответ:
$N_{2}$ $\overset{1}{⟶}$ $NH_{3}$ $\overset{2}{⟶}$ $(NH_{4})_{2}HPO_{4}$ $\overset{3}{⟶}$ $NH_{4}Cl$ $\overset{4}{⟶}$ $NH_{4}NO_{3}$
1) $N_{2} + 3H_{2} = 2NH_{3}$
2) $2NH_{3} + H_{3}PO_{4} = (NH_{4})_{2}HPO_{4}$
$2NH_{3} + 3H^{+} + PO_{4}^{3-} ⟶ 2NH_{4}^{+} + H^{+} + PO_{4}^{3-}$
$NH_{3} + H^{+}⟶ NH_{4}^{+}$
3) $(NH_{4})_{2}HPO_{4} + BaCl_{2} = 2NH_{4}Cl + BaHPO_{4}↓$
$2NH_{4}^{+} + HPO_{4}^{3-} + Ba^{2+} + 2Cl^{-}$ ⟶ $2NH_{4}^{+} + 2Cl^{-} + BaHPO_{4}↓$
$Ba^{2+} + HPO_{4}^{3-} ⟶ BaHPO_{4}↓$
4) $NH_{4}Cl + AgNO_{3} = NH_{4}NO_{3} + AgCl↓$
$NH_{4}^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} ⟶ NH_{4}^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$5. Определите количество вещества, объём (н. у.) и массу аммиака, необходимого для получения 250 кг сульфата аммония, используемого в качестве удобрения.
Ответ:
Дано:
m ($(NH_{2})_{2}SO_{4}$) = 250 кг
Найти:
n ($NH_{3}$) − ?
V ($NH_{3}$) − ?
m ($NH_{3}$) − ?
Решение:
$2NH_{3} + H_{2}SO_{4} = (NH_{4})_{2}SO_{4}$
n ($(NH_{2})_{2}SO_{4}$) = $\frac{m}{M}$ = $\frac{250}{132}$ = 1,9 кмоль
n($NH_{3}$) = 2 * n ($(NH_{2})_{2}SO_{4}$) = 2 * 1,9 кмоль = 3,8 кмоль
m($NH_{3}$) = n * M = 3,8 * 17 = 64,6 кг
V ($NH_{3}$) = n * $V_{m}$ = 3,8 * 22,4 = 84,8 $м^{3}$
Ответ: n($NH_{3}$) = 3,8 кмоль; m($NH_{3}$) = 64 кг; V ($NH_{3}$) = 84,8 $м^{3}$. §29
-
§29. Кислородные соединения азота
Лабораторный опыт №32
1. Свойства разбавленной азотной кислоты
Проделайте опыты, доказывающие, что азотная кислота проявляет типичные свойства кислот.
1. Поместите в пробирку немного чёрного порошка или одну гранулу оксида меди (II), прилейте в неё 1−2 мл раствора азотной кислоты. Закрепите пробирку в держателе и подогрейте на пламени спиртовки.
Что наблюдаете? Запишите молекулярное и ионное уравнения.
2. Прилейте в пробирку 1−2 мл раствора щелочи, добавьте 2−3 капли раствора фенолфталеина. Что наблюдаете? Добавьте к содержимому пробирки раствор азотной кислоты до исчезновения окраски. Как называется эта реакция? Запишите ее молекулярное и ионное уравнения.
3. Налейте в пробирку 1 мл раствора медного купороса, прилейте 1−2 мл раствора щёлочи. Что наблюдаете? Добавьте к содержимому пробирки раствор азотной кислоты до исчезновения осадка. Запишите молекулярные и ионные уравнения проведенных реакций.Ответ:
Свойства разбавленной азотной кислоты
1. Поместили в пробирку немного чёрного порошка или одну гранулу оксида меди (II), прилили в неё 1−2 мл раствора азотной кислоты. Закрепили пробирку в держателе и подогрели на пламени спиртовки.
Наблюдаем растоврение порошка оксида меди (II).
$CuO + 2HNO_{3} = Cu(NO_{3})_{2} + H_{2}O$
$CuO + 2H^{+} + 2NO_{3}^{-} = Cu^{2+} + 2NO_{3}^{-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
2. Прилили в пробирку 1−2 мл раствора щелочи, добавили 2−3 капли раствора фенолфталеина.
Наблюдаем образование изменение окраски раствора на малиновую.
Добавили к содержимому пробирки раствор азотной кислоты до исчезновения окраски. Эта реакция называется реакцией нейтрализации.
$NaOH + HNO_{3} = NaNO_{3} + H_{2}O$
$Na^{+} + OH^{-} + H^{+} + NO^{-}_{3} = Na^{+} + NO^{-}_{3} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
3. Налили в пробирку 1 мл раствора медного купороса, прилили 1−2 мл раствора щёлочи.
Наблюдаем образование осадка голубого цвета.
Добавили к содержимому пробирки раствор азотной кислоты до исчезновения осадка.
$Cu(OH)_{2} + 2HNO_{3} = Cu(NO_{3})_{2} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + 2NO_{3}^{-} = Cu^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$2. Свойства разбавленной азотной кислоты
Прилейте в пробирку 1—2 мл раствора щёлочи, добавьте 2—3 капли раствора фенолфталеина. Что наблюдаете? Добавьте к содержимому пробирки раствор азотной кислоты до исчезновения окраски. Как называется эта реакция? Запишите её молекулярное и ионное уравнения.Ответ:
Свойства разбавленной азотной кислоты
Прилили в пробирку 1—2 мл раствора щёлочи, добавили 2—3 капли раствора фенолфталеина.
Наблюдаем изменение окраски раствора на малиновую.
Добавили к содержимому пробирки раствор азотной кислоты до исчезновения окраски.
Реакция называется реакцией нейтрализации.
$2NaOH + 2HNO_{3} = 2NaNO_{3} + 2H_{2}O$
$2Na^{+} + 2OH^{-} + 2H^{+} + 2NO_{3}^{-} ⟶ 2Na^{+} + NO_{3}^{-} + 2H_{2}O$
$H^{+} + OH^{-} ⟶ H_{2}O$3. Свойства разбавленной азотной кислоты
Налейте в пробирку 1 мл раствора медного купороса, прилейте 1—2 мл раствора щёлочи. Что наблюдаете? Добавьте к содержимому пробирки раствор азотной кислоты до исчезновения осадка. Запишите молекулярные и ионные уравнения проведённых реакций.Ответ:
Свойства разбавленной азотной кислоты
Налили в пробирку 1 мл раствора медного купороса, прилили 1—2 мл раствора щёлочи.
Наблюдаем образование голубого осадка.
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}↓$
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-}$ ⟶ $2Na^{+} + SO_{4}^{2-} + Cu(OH)_{2}↓$
$Cu^{2+} + 2OH^{-} ⟶ Cu(OH)_{2}↓$
Добавили к содержимому пробирки раствор азотной кислоты до исчезновения осадка.
Наблюдаем ратсворение осадка.
$Cu(OH)_{2} + 2HNO_{3} = Cu(NO_{3})_{2} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + 2NO_{3}^{-} ⟶ Cu^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} ⟶ Cu^{2+} + 2H_{2}O$Лабораторный опыт №33
Взаимодействие концентрированной азотной кислоты с медью
Осторожно налейте в пробирку 1 мл концентрированной азотной кислоты. Кончиком стеклянной трубочки зачерпните чуть−чуть порошка меди и высыпьте его в пробирку с кислотой. Что наблюдаете? Почему реакция протекает без нагревания? Почему этот вариант проведения опыта не требует использования вытяжного шкафа? Если площадь соприкосновения меди с азотной кислотой будет меньше предложенного варианта проведения эксперимента, то какие условия необходимо соблюдать?
После проведения эксперимента немедленно поместите пробирки с содержимым в вытяжной шкаф. Запишите уравнение реакции и рассмотрите окислительно−восстановительные процессы.Ответ:
Взаимодействие концентрированной азотной кислоты с медью
Осторожно налили в пробирку 1 мл концентрированной азотной кислоты. Кончиком стеклянной трубочки зачерпнули чуть−чуть порошка меди и высыпали его в пробирку с кислотой.
$4HNO_{3} + Cu = Cu(NO_{3})_{2} + 2NO_{2}↑ + 2H_{2}O$
$N^{+5} + 1ē ⟶ N^{+4}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель
Наблюдаем растворение меди и выделение газа. Реакция протекает без нагревания, так как кислота концентрированная. Так как реакция протекает без нагревания, необходимости в вытяжном шкафу нет.
Если площадь соприкосновения меди с азотной кислотой будет меньше предложенного варианта проведения эксперимента, то необходимо нагревание и использование вытяжного шкафа.
После проведения эксперимента немедленно поместили пробирки с содержимым в вытяжной шкаф.i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Химия и жизнь".
2) Сайт "Science journals".
3) Сайт "Chem 21".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Оксид азота (IV)
Оксид азота (IV) − бурый, очень ядовитый газ.
Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота (II):
$2NO + O_{2} = 2NO_{2}$.
Способы получения:
1) Оксид азота (IV) образуется при окислении оксида азота (II) кислородом или озоном:
$2NO + O_{2} = 2NO_{2}$
2) Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
$4HNO_{3} + Cu = Cu(NO_{3})_{2} + 2NO_{2} + 2H_{2}O$
3) Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
$2AgNO_{3} = 2Ag + 2NO_{2} + O_{2}$
Применение:
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.?
1. Почему азотная кислота не образует кислых солей?
Ответ:
Азотная кислота не образует кислых солей, так как это одноосновная кислота, у которой один атом водорода.
2. Напишите молекулярные и ионные уравнения реакций азотной кислоты с гидроксидом меди (II), оксидом железа (III) и карбонатом натрия.
Ответ:
Уравнение реакций азотной кислоты с гидроксидом меди (II):
$Cu(OH)_{2} + 2HNO_{3} = Cu(NO_{3})_{2} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + 2NO_{3}^{-} ⟶ Cu^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} ⟶ Cu^{2+} + 2H_{2}O$
Уравнение реакций азотной кислоты с оксидом железа (III):
$Fe_{2}O_{3} + 6HNO_{3} = 2Fe(NO_{3})_{3} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} + 6NO_{3}^{-} ⟶ 2Fe^{3+} + 6NO_{3}^{-} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} ⟶ 2Fe^{3+} + 3H_{2}O$
Уравнение реакций азотной кислоты с карбонатом натрия:
$Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + CO_{2}↑$
$2Na^{+} + CO_{3}^{2-} + 2H^{+} + 2NO_{3}^{-}$ ⟶ $2Na^{+} + 2NO_{3}^{-} + H_{2}O + CO_{2}↑$
$CO_{3}^{2-} + 2H^{+} ⟶ H_{2}O + CO_{2}↑$3. Большинство солей азотной кислоты растворимы в воде, тем не менее предложите уравнение реакции $HNO_{3}$ с солью, в результате которой образуется осадок. Напишите ионное уравнение этой реакции.
Ответ:
Уравнение реакции $HNO_{3}$ с солью, в результате которой образуется осадок:
$2HNO_{3} + Na_{2}SiO_{3} = 2NaNO_{3} + H_{2}SiO_{3}↓$
$2H^{+} + 2NO_{3}^{-} + 2Na^{+} + SiO_{3}^{2-}$ ⟶ $2Na^{+} + 2NO_{3}^{-} + H_{2}SiO_{3}↓$
$2H^{+} + SiO_{3}^{2-} ⟶ H_{2}SiO_{3}↓$4. Рассмотрите уравнения реакций разбавленной и концентрированной азотной кислоты с медью с точки зрения процессов окисления−восстановления.
Ответ:
Уравнение реакции разбавленной азотной кислоты с медью:
$3Cu + 8HNO_{3} = 3Cu(NO_{3})_{2} + 2NO↑ + 4H_{2}O$
$N^{+5} + 3ē ⟶ N^{+2}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель
Уравнение реакции концентрированной азотной кислоты с медью:
$Cu + 4HNO_{3} = Cu(NO_{3})_{2} + 2NO_{2}↑ + 2H_{2}O$
$N^{+5} + 1ē ⟶ N^{+4}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель5. Предложите две цепочки превращений, приводящих к получению азотной кислоты, исходя из азота и аммиака. Опишите окислительно−восстановительные реакции, используя метод электронного баланса.
Ответ:
Две цепочки превращений, приводящих к получению азотной кислоты, исходя из азота и аммиака:
1 цепочка
$N_{2}$ $\overset{1}{⟶}$ $NO$ $\overset{2}{⟶}$ $NO_{2}$ $\overset{3}{⟶}$ $HNO_{3}$
1) $N_{2} + O_{2} = 2NO$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N_{2}^{0} - 4ē ⟶ 2N^{+2}$ − восстановитель
2) $2NO + O_{2} = 2NO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N^{+2} - 2ē ⟶ N^{+4}$ − восстановитель
3) $2NO_{2} + H_{2}O = HNO_{3} + HNO_{2}$
$N^{+4} + 1ē ⟶ N^{+3}$ − окислитель
$N^{+4} - 1ē ⟶ N^{+5}$ − восстановитель
2 цепочка
$NH_{3}$ $\overset{1}{⟶}$ $NO$ $\overset{2}{⟶}$ $NO_{2}$ $\overset{3}{⟶}$ $HNO_{3}$
1) $4NH_{3} + 5O_{2} = 4NO + 6H_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N^{-3} - 5ē ⟶ N^{+2}$ − восстановитель
2) $2NO + O_{2} = 2NO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N^{+2} - 2ē ⟶ N^{+4}$ − восстановитель
3) $2NO_{2} + H_{2}O = HNO_{3} + HNO_{2}$
$N^{+4} + 1ē ⟶ N^{+3}$ − окислитель
$N^{+4} - 1ē ⟶ N^{+5}$ − восстановитель6. Сколько килограммов 68%−й азотной кислоты можно получить из 276 кг (н. у.) оксида азота (IV)?
Ответ:
Дано:
m ($NO_{2}$) = 276 кг
ω ($HNO_{3}$) = 68%
Найти:
m (р−ра) − ?
Дано:
$4NO_{2} + O_{2} + 2H_{2}O = 4HNO_{3}$
n ($NO_{2}$) = $\frac{m}{M}$ = $\frac{276}{46}$ = 6 кмоль
n ($HNO_{3}$) = n ($NO_{2}$) = 6 кмоль
m ($HNO_{3}$) = n * M = 6 * 63 = 378 кг
m (р−ра) = $\frac{m (HNO_{3})}{ω}$ = $\frac{378}{0,68}$ = 556 кг
Ответ: m (р−ра) = 556 кг.7. При прокаливании 340 г натриевой селитры получили 33,6 л (н. у.) кислорода. Рассчитайте массовую долю примесей в селитре.
Ответ:
Дано:
$m_{техн}$ ($NaNO_{3}$) = 340 г
V ($O_{2}$) = 33,6 л
Найти:
ω (примесей) − ?
Дано:
$2NaNO_{3} = 2NaNO_{2} + O_{2}$
n ($O_{2}$) = $\frac{V}{V_{m}}$ = $\frac{33,6}{22,4}$ = 1,5 моль
n ($NaNO_{3}$) = 2 * n ($O_{2}$) = 2 * 1,5 = 3 моль
m ($NaNO_{3}$) = n * M = 3 * 85 = 255 г
m (примесей) = $m_{техн}$ ($NaNO_{3}$) − m ($NaNO_{3}$) = 340 − 255 = 85 г
ω (примесей) = $\frac{m (примесей)}{m_{техн} (NaNO_{3})}$ * 100% = $\frac{85}{340}$ * 100% = 25%
Ответ: ω (примесей) = 25%. §30
-
§30. Фосфор и его соединения
Лабораторный опыт №34
Горение фосфора на воздухе и в кислороде
Наберите в ложечку для сжигания веществ немного красного фосфора и подожгите его. Каков характер пламени? Как изменится пламя, если ложечку с горящим фосфором внести в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV))? Запишите уравнение реакции, рассмотрите окислительно−восстановительные процессы.Ответ:
Горение фосфора на воздухе и в кислороде
Набрали в ложечку для сжигания веществ немного красного фосфора и подожгли его. Красный фосфор горит ярко−желтым пламенем, с выделением белого дыма.
Если ложечку с горящим фосфором внести в колбу с кислородом, то фосфор будет гореть ослепительно ярким пламенем.
$4P + 5O_{2} = 2P_{2}O_{5}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$P^{0} - 5ē ⟶ P^{+5}$ − восстановительЛабораторный опыт №35
Распознавание фосфатов
Налейте в пробирку 1−2 мл раствора фосфата натрия или калия. С помощью пипетки добавьте к нему несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения. Можно ли считать эту реакцию качественной на фосфат−ион? Добавьте к содержимому пробирки азотную кислоту до растворения осадка. Почему это происходит?Ответ:
Распознавание фосфатов
Налили в пробирку 1−2 мл раствора фосфата натрия. С помощью пипетки добавили к нему несколько капель раствора нитрата серебра.
Наблюдаем образование осадка желтого цвета.
$Na_{3}PO_{4} + 3AgNO_{3} ⟶ 3NaNO_{3} + Ag_{3}PO_{4}↓$
$3Na^{+} + PO_{4}^{3-} + 3Ag^{+} + 3NO_{3}^{-}$ ⟶ $3Na^{+} + 3NO_{3}^{-} + Ag_{3}PO_{4}↓$
$3Ag^{+} + PO_{4}^{3-} ⟶ Ag_{3}PO_{4}↓$
Эту реакцию можно считать качественной на фосфат−ион.
Добавили к содержимому пробирки азотную кислоту до растворения осадка. Это происходит, так как азотная кислота сильнее фосфорной.
$Ag_{3}PO_{4} + 3HNO_{3} ⟶ 3AgNO_{3} + H_{3}PO_{4}$
$Ag_{3}PO_{4} + 3H^{+} + 3NO_{3}^{-} ⟶ 3Ag^{+} + 3NO_{3}^{-} + H^{+} + H_{2}PO_{4}^{-}$
$Ag_{3}PO_{4} + 2H^{+} ⟶ 3Ag^{+} + H_{2}PO_{4}^{-}$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Химическая энциклопедия онлайн".
2) Сайт "Science journals".
3) Сайт "Химия и жизнь".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома фосфора
Фосфор − представитель главной подгруппы V группы Периодической системы Д. И. Менделеева элемент−неметалл. Атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства. Соединения со степенью окисления −3 атома фосфора встречаются реже, чем у азота (только в фосфидах − соединениях фосфора с металлами). Чаще фосфор проявляет в соединениях степень окисления +5. А в его соединении с водородом − ковалентная связь между атомами разных элементов малополярна в силу того, что значения электроотрицательности фосфора и водорода почти одинаковы.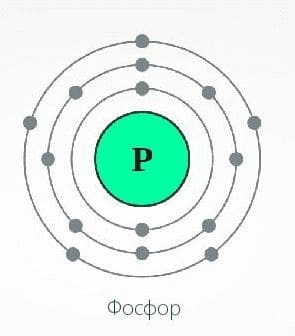
?
1. Напишите формулы трёх видов солей натрия и фосфорной кислоты, назовите их и запишите уравнения их диссоциации.
Ответ:
$Na_{3}PO_{4}$ – фосфат натрия
$Na_{3}PO_{4}$ = $3Na^{+} + PO_{4}^{3-}$
$Na_{2}HPO_{4}$ – гидрофосфат натрия
$Na_{2}HPO_{4}$ = $2Na^{+} + H^{+} + PO_{4}^{3-}$
$NaH_{2}PO_{4}$ – дигидрофосфат натрия
$NaH_{2}PO_{4} = Na^{+} + 2H^{+} + PO_{4}^{3-}$2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$P$ $\overset{1}{⟶}$ $Mg_{3}P_{2}$ $\overset{2}{⟶}$ $PH_{3}$ $\overset{3}{⟶}$ $H_{3}PO_{4}$ $\overset{4}{⟶}$ $Na_{3}PO_{4}$ $\overset{5}{⟶}$ $Ca_{3}(PO_{4})_{3}$.
Рассмотрите окислительно−восстановительные процессы там, где они имеют место.Ответ:
$P$ $\overset{1}{⟶}$ $Mg_{3}P_{2}$ $\overset{2}{⟶}$ $PH_{3}$ $\overset{3}{⟶}$ $H_{3}PO_{4}$ $\overset{4}{⟶}$ $Na_{3}PO_{4}$ $\overset{5}{⟶}$ $Ca_{3}(PO_{4})_{3}$
1) $3Mg + 2P = Mg_{3}P_{2}$
$P^{0} + 3ē ⟶ P^{-3}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
2) $Mg_{3}P_{2} + 6H_{2}O = 3Mg(OH)_{2} + 2PH_{3}$↑
3) $PH_{3} + 2O_{2} = H_{3}PO_{4}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$P^{-3} - 8ē ⟶ P^{+5}$ − восстановитель
4) $H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$
5) $2Na_{3}PO_{4} + 3CaCl_{2} = 6NaCl + Ca_{3}(PO_{4})_{2}↓$3. Используя метод электронного баланса, составьте уравнение реакции, протекающей по схеме:
$P + HNO_{3} + H_{2}O ⟶ H_{3}PO_{4} + NO↑$Ответ:
$3P + 5HNO_{3} + 2H_{2}O = 3H_{3}PO_{4} + 5NO↑$
$N^{+5} + 3ē ⟶ N^{+2}$ − окислитель
$P^{0} - 5ē ⟶ P^{+5}$ − восстановитель4. В промышленности фосфор получают прокаливанием смеси фосфата кальция с песком и коксом согласно уравнению:
$Ca_{3}(PO_{4})_{2} + 3SiO_{2} + 5C ⟶ 3CaSiO_{3} + 2P + 5CO↑$.
Рассмотрите окислительно−восстановительные процессы. Придумайте и решите задачу на определение массы фосфора при известном выходе его от теоретически возможного, в условии задачи укажите массу исходного фосфата кальция и долю примесей в нём.Ответ:
$Ca_{3}(PO_{4})_{2} + 3SiO_{2} + 5C ⟶ 3CaSiO_{3} + 2P + 5CO↑$
$P^{+5} + 5ē ⟶ P^{0}$ − окислитель
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
Задача: Определите массу фосфора, который образовался в результате разложения 140 г фосфата кальция, содержащего 13% примесей, если выход продукта составил 90% от теоретически возможного.
Дано:
$m_{техн}$ ($Ca_{3}(PO_{4})_ {2}$) = 120 г
ω (примесей) = 13%, или 0,13
η = 90%
Найти:
m (P) − ?
Решение:
$Ca_{3}(PO_{4})_ {2} + 3SiO_{2} + 5C ⟶ 3CaSiO_{3} + 2P + 5CO↑$
m (примесей) = $m_{техн}$ ($Ca_{3}(PO_{4})_ {2}$) * ω (примесей) = 120 г * 0,13 = 15,6 г
m ($Ca_{3}(PO_{4})_{2}$) = $m_{техн}$ ($Ca_{3}(PO_{4})_ {2}$) − m (примесей) = 120 − 15,6 = 104,4 г
n ($Ca_{3}(PO_{4})_ {2}$) = $\frac{m}{M}$ = $\frac{104,4}{310}$ = 0,34 моль
n (P) = 2 * n ($Ca_{3}(PO_{4})_{2}$) = 2 * 0,34 = 0,68 моль
$m_{теор}$ (P) = n * M = 0,68 * 31 = 21,08 г
$m_{практ}$ (P) = $m_{теор}$ (P) * η = 21,08 * 0,9 = 19 г
Ответ: $m_{практ}$ (P) = 19 г.5. Расчитайте массу 80%−й фосфорной кислоты, которую можно получить из 31 кг фосфора, содержащего 5% примесей?
Ответ:
Дано:
ω ($H_{3}PO_{4}$) = 80%
$m_{техн}$ (P) = 31 кг
ω (примесей) = 5%
Найти:
m ($H_{3}PO_{4}$) − ?
Решение:
m (примесей) = $m_{техн}$ (P) * ω (примесей) = 31 * 0,05 = 1,55 кг
m (P) = $m_{техн}$ (P) − m (примесей) = 31 − 1,55 = 29,45 кг
n (P) = $\frac{m}{M}$ = $\frac{29,45}{31}$ = 0,95 кмоль
n ($H_{3}PO_{4}$) = n (P) = 0,95 кмоль
m ($H_{3}PO_{4}$) = n * M = 0,95 * 98 = 93 кг
$m_{р-ра}$ = m ($H_{3}PO_{4}$) : ω ($H_{3}PO_{4}$) = 93 : 0,8 = 116 кг
Ответ: m ($H_{3}PO_{4}$) = 116 кг.6. В 980 г 5%−го раствора фосфорной кислоты растворили 152 г оксида фосфора (V). Вычислите массовую долю фосфорной кислоты в полученном растворе.
Ответ:
Дано:
m (р−ра) = 980 г
ω = 5%
m ($P_{2}O_{5}$) = 152 г
Найти:
$ω_{1}$ ($H_{3}PO_{4}$) − ?
Решение:
$P_{2}O_{5} + 2H_{2}O = 2H_{3}PO_{4}$
n ($P_{2}O_{5}$) = $\frac{m}{M}$ = $\frac{152}{142}$ = 1,07 моль
n ($H_{3}PO_{4}$) = 2 * n ($P_{2}O_{5}$) = 2 * 1,07 = 2,14 моль
$m_{обр}$ ($H_{3}PO_{4}$) = n * M = 2,14 * 98 = 210 г
$m_{1}$ ($H_{3}PO_{4}$) m (р−ра) * ω = 980 * 0,05 = 49 г
$m_{1}$ ($H_{3}PO_{4}$) = $m_{обр}$ ($H_{3}PO_{4}$) + $m_{1}$ ($H_{3}PO_{4}$) = 210 + 49 = 259 г
$m_{2}$ (р−ра) = m (р−ра) + m ($P_{2}O_{5}$) = 980 + 152 = 1132 г
$ω_{1}$ ($H_{3}PO_{4}$) = $m_{1}$ ($H_{3}PO_{4}$) : $m_{2}$ (р−ра) * 100% = 259 : 1132 * 100% = 23%
Ответ: $ω_{1}$ ($H_{3}PO_{4}$) = 23%.7. "…Да! Это была собака, огромная, чёрная, как смоль. Но такой собаки ещё никто из нас, смертных, не видывал. Из её отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку мерцал переливающийся огонь. Ни в чьём воспалённом мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пёс, величиной с молодую львицу. Его огромная пасть всё ещё светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.
– Фосфор, – сказал я".
В этом отрывке из повести "Собака Баскервилей" Л. Конан Дойл допустил существенную химическую ошибку. Назовите её.Ответ:
Ошибка заключается в том, что светится может только белый фосфор, однако белый фосфор при контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
§31
-
§31. Углерод
Лабораторный опыт №36
Горение угля в кислороде
Поместите в ложечку для сжигания веществ кусочек древесного угля и раскалите его на пламени спиртовки. Внесите ложечку с раскалённым углём в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV)). Каков характер пламени горящего угля? Запишите уравнение реакции, рассмотрите окислительно−восстановительные процессы.Ответ:
Горение угля в кислороде
Поместили в ложечку для сжигания веществ кусочек древесного угля и раскалили его на пламени спиртовки. Внесли ложечку с раскалённым углём в колбу с кислородом (с этой целью получите его из пероксида водорода, используя оксид марганца (IV)). Уголь горит ярким пламенем.
$C + O_{2} = CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановительi
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "School science".
2) Сайт "Science journals".
3) Сайт "Chem ege".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Строение атома углерода
Углерод С − первый элемент главной подгруппы IV группы Периодической системы Д. И. Менделеева. Его атомы содержат на внешнем энергетическом уровне четыре электрона, поэтому они могут принимать четыре электрона, приобретая при этом степень окисления −4, т. е. проявлять окислительные свойства и отдавать свои электроны более электроотрицательным элементам, т. е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.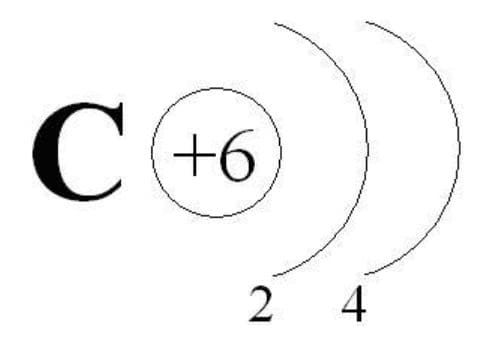
?
1. Сравните строение алмаза и графита и их физические свойства: твёрдость, оптические свойства, электропроводность.
Ответ:
Таблица Сравнение строения алмаза и графита и их физических свойств
Алмаз Графит
Твердость Очень
твердый Мягкий
Оптические
свойства Имеет Имеет
большой металлический
показатель блеск,
преломления непрозрачный
Электро-
провод-
ность Не проводит Хороший
ток проводник2. Напишите уравнения реакций с участием углерода, которые характеризуют отдельно его восстановительные и окислительные свойства. Рассмотрите окислительно−восстановительные процессы для них.
Ответ:
Реакция, где углерод − окислитель:
$Ca + 2C ⟶ CaC_{2}$
$C^{0} + 1ē ⟶ C^{-2}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
Реакция, где углерод − восстановитель:
$C + O_{2} ⟶ CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель3. Вспомните из курса биологии, какой период в истории Земли носит название каменноугольного, или карбона. Каково происхождение каменного угля?
Ответ:
Каменноугольный период получил свое название из−за сильного углеобразования в это время. Каменный уголь образуется из продуктов разложения органических остатков растений.
4. Почему в домашние холодильники рекомендуют помещать по нескольку таблеток карболена?
Ответ:
В домашние холодильники рекомендуют помещать по нескольку таблеток карболена, так как они обладают хорошими адсорбирующими свойствами, что препятствуют появлению запахов.
5. Напишите уравнения реакций взаимодействия угля с оксидом железа (III) и оксидом олова (IV). Рассмотрите окислительно−восстановительные процессы.
Ответ:
Уравнение реакции взаимодействия угля с оксидом железа (III):
$2Fe_{2}O_{3} + 4C = 4Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
Уравнение реакции взаимодействия угля оксидом олова (IV):
$SnO_{2} + C = Sn + CO_{2}$
$Sn^{+4} + 4ē ⟶ Sn^{0}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель6. При сжигании 8 г угля было получено 10,64 л (н. у.) углекислого газа, что составляет 95% от теоретически возможного. Вычислите массовую долю примесей в угле.
Ответ:
Дано:
$m_{техн}$ (C) = 8 г
$V_{практ}$ ($CO_{2}$) = 10,64 л
η = 95%
Найти:
ω (примесей) − ?
Решение:
$C + O_{2} = CO_{2}$
$V_{теор}$ ($CO_{2}$) = $\frac{V_{практ}}{η}$ = $\frac{10,64}{0,95}$ = 11,2 л
n ($CO_{2}$) = $\frac{m}{M}$ = $\frac{11,2}{22,4}$ = 0,5 моль
n (C) = n ($CO_{2}$) = 0,5 моль
m (C) = n * M = 0,5 * 12 = 6 г
m (примесей) = $m_{техн}$ − m (C) = 8 − 6 = 2 г
ω (примесей) = $\frac{m (примеси)}{m_{техн}}$ * 100% = $\frac{2}{8}$ * 100% = 25%
Ответ: ω (примесей) = 25%.7. При недостатке кислорода углерод взаимодействует с углекислым газом согласно уравнению:
$C + CO_{2} = 2CO$.
Какая форма существования элемента углерода проявляет в этой реакции окислительные свойства, а какая – восстановительные?Ответ:
$C + CO_{2} = 2CO$
$C^{+4} + 2ē ⟶ C^{+2}$ − окислитель
Данная форма углерода проявляет в этой реакции окислительные свойства.
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
Данная форма углерода проявляет в этой реакции восстановительные свойства.8. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C $\overset{1}{⟶}$ $CaC_{2}$ $\overset{2}{⟶}$ $C_{2}H_{2}$ $\overset{3}{⟶}$ $CO_{2}$ $\overset{4}{⟶}$ CO.
Рассмотрите окислительно−восстановительные процессы.Ответ:
C $\overset{1}{⟶}$ $CaC_{2}$ $\overset{2}{⟶}$ $C_{2}H_{2}$ $\overset{3}{⟶}$ $CO_{2}$ $\overset{4}{⟶}$ CO
1) $Ca + 2C ⟶ CaC_{2}$
$C^{0} + 1ē ⟶ C^{-2}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
2) $CaC_{2} + 2H_{2}O ⟶ Ca(OH)_{2} + C_{2}H_{2}↑$
3) $2C_{2}H_{2} + 5O_{2} ⟶ 2H_{2}O + 4CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{-1} - 5ē ⟶ C^{+4}$ − восстановитель
4) $C + CO_{2} ⟶ 2CO$
$C^{+4} + 2ē ⟶ C^{+2}$ − окислитель
Данная форма углерода проявляет в этой реакции окислительные свойства.
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
Данная форма углерода проявляет в этой реакции окислительные свойства. §32
-
§32. Кислородные соединения углерода
Лабораторный опыт №37
Получение угольной кислоты и изучение её свойств
Соберите прибор для получения газов. Проверьте его на герметичность. Поместите в пробирку кусочек мрамора и прилейте в неё 2 мл соляной кислоты. Что наблюдаете? Пропустите газ через воду в другой пробирке, предварительно добавив в неё немного лакмуса. Что наблюдаете? Оставьте окрашенный раствор в открытой пробирке на некоторое время. Что наблюдаете? Почему красная окраска вновь сменилась на фиолетовую? Как данный опыт характеризует угольную кислоту? Запишите уравнения проделанных реакций.Ответ:
Получение угольной кислоты и изучение её свойств
Собрали прибор для получения газов. Проверили его на герметичность. Поместили в пробирку кусочек мрамора и прилили в неё 2 мл соляной кислоты. Наблюдаем выделение газа.
$CaCO_{3} + 2HCl ⟶ CaCl_{2} + H_{2}O + CO_{2}$↑
Пропустили газ через воду в другой пробирке, предварительно добавив в неё немного лакмуса. Наблюдаем окрашивание лакмусовой бумажки в красный цвет.
Оставили окрашенный раствор в открытой пробирке на некоторое время.
Наблюдаем изменение окраски обратно на фиолетовую, так как процесс образования угольной кислоты является обратимым. Можно сделать вывод, что угольная кислота − нестабильная.Лабораторный опыт №38
Переход карбонатов в гидрокарбонаты
Пропустите углекислый газ через прозрачный раствор известковой воды. Что наблюдаете? Продолжайте пропускать углекислый газ через образовавшуюся взвесь. Что наблюдаете? Почему? Как отличаются по растворимости карбонат и гидрокарбонат кальция? Запишите уравнения проделанных реакций.Ответ:
Переход карбонатов в гидрокарбонаты
Пропустили углекислый газ через прозрачный раствор известковой воды. Наблюдаем выпадение осадка:
$CO_{2} + Ca(OH)_{2} = CaCO_{3}↓ + H_{2}O$
Продолжали пропускать углекислый газ через образовавшуюся взвесь. Наблюдаем растворение осадка, так как гидрокарбонат кальция − растворимая соль, а вот карбонат кальция − нерастворимая.
$CO_{2} + H_{2}O + CaCO_{3} = Ca(HCO_{3})_{2}$Лабораторный опыт №39
Разложение гидрокарбоната натрия
Поместите немного пекарского порошка, в состав которого входит гидрокарбонат натрия, в пробирку прибора для получения газов. Закройте её пробкой с газоотводной трубкой и закрепите в лапке штатива. Кончик газоотводной трубки опустите в колбу (50 мл). Нагревайте содержимое пробирки 2−3 мин. Подожгите лучинку и внесите её в колбу. Что наблюдаете? О каком свойстве углекислого газа свидетельствует последняя часть опыта? Запишите уравнение проделанной реакции.Ответ:
Разложение гидрокарбоната натрия
Поместили немного пекарского порошка, в состав которого входит гидрокарбонат натрия, в пробирку прибора для получения газов. Закрыли её пробкой с газоотводной трубкой и закрепили в лапке штатива. Кончик газоотводной трубки опустили в колбу (50 мл). Нагревали содержимое пробирки 2−3 мин. Подожгли лучинку и внесли её в колбу. Наблюдаем то, что лучинка потухла, так как углекислый газ не поддерживает горение.
$2NaHCO_{3} ⟶ Na_{2}CO_{3} + H_{2}O + CO_{2}↑$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Cyber leninka".
2) Сайт "Science journals".
3) Сайт "Science for you".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Получение, свойства и применение углекислого газа
Оксид углерода (IV) − бесцветный, не имеющий запаха газ, широко известный под названием углекислый газ. Он примерно в полтора раза тяжелее воздуха.
При обычных условиях в одном объёме воды растворяется один объём углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твёрдую снегообразную массу, которую в промышленности прессуют, − это «сухой лёд», который применяют для хранения пищевых продуктов. Твёрдый углекислый газ имеет молекулярную решётку и способен к возгонке.
Углекислый газ $CO_{2}$, как типичный кислотный оксид, взаимодействует с щелочами, с основными оксидами и водой. Он не горит и не поддерживает горения и потому применяется для тушения пожаров.
Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
$CO_{2} + 2Mg = 2MgO + C$.
Углекислый газ получают, действуя на соли угольной кислоты − карбонаты − растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии соляной кислоты на мел или мрамор:
$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$.
В промышленности углекислый газ получают обжигом известняка:
$CaCO_{2} = CaO + CO_{2}$.
Углекислый таз используют также для изготовления шипучих напитков и получения соды.?
1. Рассмотрите реакцию восстановления оксида железа (III) оксидом углерода (II) как окислительно−восстановительный процесс.
Ответ:
Уравнение реакции восстановления оксида железа (III) оксидом углерода (II):
$Fe_{2}O_{3} + 3CO ⟶ 2Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{+2} - 2ē ⟶ C^{+4}$ − восстановитель2. Какие несолеобразующие оксиды вам ещё известны, кроме оксида углерода (II)? Верно ли с химической точки зрения другое синонимическое название их – безразличные, или индифферентные, оксиды?
Ответ:
Несолеобразующие оксиды: оксид азота (I) $N_{2}O$, оксид азота (II) NO, оксид кремния (II) SiO.
С химической точки зрения другое синонимическое название их – безразличные, или индифферентные, оксиды неверно, так как такие оксиды безразличны к щелочам и кислотам, но они могут реагировать с другими веществами.3. Напишите уравнения реакций, характеризующие свойства оксида углерода (IV). Рассмотрите взаимодействие оксида углерода (IV) с магнием как окислительно−восстановительный процесс.
Ответ:
Уравнение реакции взаимодействия оксида углерода (IV) с магнием:
$CO_{2} + 2Mg = 2MgO + C$
$C^{+4} + 4ē ⟶ C^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
Оксид углерода (IV) взаимодействует с основными оксидами:
$CO_{2} + CaO = CaCO_{3}$
Оксид углерода (IV) реагирует с водой:
$CO_{2} + H_{2}O ⇄ H_{2}CO_{3}$
Оксид углерода (IV) реагирует со щёлочами:
$CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$4. Почему раствор углекислого газа окрашивает лакмус в красный цвет? Почему при длительном хранении этого раствора лакмус снова приобретает фиолетовую окраску?
Ответ:
Раствор углекислого газа окрашивает лакмус в красный цвет, так как имеет кислую среду.
При длительном хранении этого раствора лакмус снова приобретает фиолетовую окраску, так как образование угольной кислоты − обратимый процесс.5. Напишите формулы следующих солей: карбоната меди (II), гидрокарбоната меди (II), гидроксокарбоната меди (II). К какой группе солей относится каждая соль? Как ещё называют последнюю соль?
Ответ:
$CuCO_{3}$ − карбонат меди (II) − средняя соль.
$Cu(HCO_{3})_ {2}$ − гидрокарбонат меди (II) − кислая соль.
$(CuOH)_{2}CO_{3}$ − гидроксокарбонат меди (II), малахит − основная соль.6. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
а) $CaCO_{3}$ $\overset{1}{⟶}$ CaO $\overset{2}{⟶}$ $Ca(OH)_{2}$ $\overset{3}{⟶}$ $CaCO_{3}$ $\overset{4}{⟶}$ $Ca(HCO_{3})_{2}$ $\overset{5}{⟶}$ $CaCO_{3}$;
б) C $\overset{1}{⟶}$ $CO_{2}$ $\overset{2}{⟶}$ CO $\overset{3}{⟶}$ $CO_{2}$ $\overset{4}{⟶}$ C.
Рассмотрите процессы окисления−восстановления.Ответ:
а) $CaCO_{3}$ $\overset{1}{⟶}$ CaO $\overset{2}{⟶}$ $Ca(OH)_{2}$ $\overset{3}{⟶}$ $CaCO_{3}$ $\overset{4}{⟶}$ $Ca(HCO_{3})_{2}$ $\overset{5}{⟶}$ $CaCO_{3}$
1) $CaCO_{3} = CaO + CO_{2}↑$
2) $CaO + H_{2}O = Ca(OH)_{2}$
3) $Ca(OH)_{2} + CO_{2} = CaCO_{3}↓ + H_{2}O$
4) $CaCO_{3} + H_{2}O + CO_{2} = Ca(HCO_{3})_{2}$
5) $Ca(HCO_{3})_{2} = CaCO_{3} + H_{2}O + CO_{2}↑$б) C $\overset{1}{⟶}$ $CO_{2}$ $\overset{2}{⟶}$ CO $\overset{3}{⟶}$ $CO_{2}$ $\overset{4}{⟶}$ C
1) $C + O_{2} = CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
2) $CO_{2} + C = 2CO$
$C^{+4} + 2ē ⟶ C^{+2}$ − окислитель
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
3) $Fe_{2}O_{3} + 3CO = 2Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{+2} - 2ē ⟶ C^{+4}$ − восстановитель
4) $CO_{2} + 2Mg = 2MgO + C$
$C^{+4} + 4ē ⟶ C^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель7. В 1060 г 2%−го раствора карбоната натрия растворили 14,3 г кристаллической соды ($Na_{2}CO_{3} * 10H_{2}O$). Вычислите массовую долю соли в полученном растворе. Вычислите объем углекислого газа (н. у.), который образуется при взаимодействии полученного раствора с избытком соляной кислоты.
Ответ:
Дано:
$m_{р-ра}$ ($Na_{2}CO_{3}$) = 1060 г
$ω_{1}$ ($Na_{2}CO_{3}$) = 0,02
m ($Na_{2}CO_{3} * 10H_{2}O$) = 14,3 г
Найти:
$ω_{2}$ ($Na_{2}CO_{3}$) − ?
V ($CO_{2}$) − ?
Решение:
m ($Na_{2}CO_{3}$) = $ω_{1}$ ($Na_{2}CO_{3}$) * $m_{р-ра}$ ($Na_{2}CO_{3}$) = 0,02 * 1060 = 21,2 г
m ($Na_{2}CO_{3}$) = m ($Na_{2}CO_{3} * 10H_{2}O$) * M ($Na_{2}CO_{3}$) : M ($Na_{2}CO_{3} * 10H_{2}O$) = 14,3 · 106 : 286 = 5,3 г
$ω_{2}$ ($Na_{2}CO_{3}$) = m : m (р−ра) * 100% = (5,3 + 21,2) : (1060 + 14,3) * 100% = 26,5 : 1074,3 * 100% = 2,46 %
$m_{общ}$ ($Na_{2}CO_{3}$) = 5,3 + 21,2 = 26,5 г
$Na_{2}CO_{3} + 2HCl = 2NaCl + H_{2}O + CO_{2}↑$
Составим пропорцию и решим ее:
26,5 г $Na_{2}CO_{3}$ − x л $CO_{2}$
106 г/моль $Na_{2}CO_{3}$ − 22,4 л/моль $CO_{2}$
V ($CO_{2}$) = x = 26,5 · 22,4 : 106 = 5,6 л
Ответ: $ω_{2}$ ($Na_{2}CO_{3}$) = 2,46%; V (CO2) = 5,6 л. §33
-
§33. Кремний и его соединения
Лабораторный опыт №40
Получение кремниевой кислоты и изучение её свойств
Получите углекислый газ способом, который вы использовали на прошлом уроке, и пропускайте его через раствор силиката натрия. Для приготовления такого раствора можно взять обычный канцелярский клей и разбавить его водой (к 1 мл клея прилейте 2−3 мл воды). Что наблюдаете? Сравните силу угольной и кремниевой кислот.
Закрепите пробирку с полученным загустевшим студнем в держателе, прилейте к нему концентрированный раствор щёлочи и нагревайте на пламени спиртовки. Что наблюдаете? Запишите уравнения проделанных реакций.Ответ:
Получение кремниевой кислоты и изучение её свойств
Получили углекислый газ способом, который мы использовали на прошлом уроке, и пропустили его через раствор силиката натрия.
На прошлом уроке мы получали углекислый газ путем реакции мрамора с соляной кислотой:
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2} + H_{2}O$
Для приготовления такого раствора можно взять обычный канцелярский клей и разбавить его водой (к 1 мл клея прилейте 2−3 мл воды). Наблюдаем образование белого осадка. Угольная кислота сильнее, чем кремниевая.
$CO_{2} + H_{2}O + Na_{2}SiO_{3} = Na_{2}CO_{3} + H_{2}SiO_{3}↓$
Закрепили пробирку с полученным загустевшим студнем в держателе, прилили к нему концентрированный раствор щёлочи и нагревали на пламени спиртовки. Наблюдаем растворение осадка.
$H_{2}SiO_{3} + 2NaOH = Na_{2}SiO_{3} + 2H_{2}O$i
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
Электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных:
1) Сайт "Bibliofond".
2) Сайт "Studentbank".
3) Сайт компании "Revolution".2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Кремний
Второй представитель элементов главной подгруппы IV группы (IVА−группы) Периодической системы Д.И. Менделеева − кремний Si.
В природе кремний второй по распространённости после кислорода химический элемент. Земная кора более чем на четверть состоит из его соединений. Наиболее распространённым соединением кремния является оксид кремния (IV) $SiO_{2}$, другое его название − кремнезём. В природе он образует минерал кварц, многие разновидности которого горный хрусталь и его знаменитая лиловая форма − аметист, а также агат, опал, яшма, халщедон, сердолик известны как поделочные и полудрагоценные камни.?
1. Укажите сходство и различие оксида углерода (IV) и оксида кремния (IV) по строению и свойствам. Напишите уравнения реакций.
Ответ:
Строение:
Оксид кремния (IV) имеет атомную кристаллическую решетку, а оксид углерода (IV) − молекулярную кристаллическую решетку.
Свойства:
1) Взаимодействие с водой:
Оксид углерода (IV) взаимодействует с водой, образуя угольную кислоту. Оксид кремния не реагирует с водой.
$CO_{2} + H_{2}O = H_{2}CO_{3}$
2) Взаимодействие с основными оксидами:
И оксид углерода (IV), и оксид углерода (IV) реагируют с основными оксидами, образуя соли.
$CO_{2} + CaO = CaCO_{3}$
$SiO_{2} + CaO = CaSiO_{3}$
3) Взаимодействие с щелочами:
И оксид углерода (IV), и оксид углерода (IV) реагируют с щелочами, образуя соль и воду.
$CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
$SiO_{2} + Ca(OH)_{2} = CaSiO_{3} + H_{2}O$2. Почему углерод называют основным элементом живой природы, а кремний – основным элементом неживой природы?
Ответ:
Углерод называют основным элементом живой природы, так как углерод является основным компонентом органических веществ, а кремний – основным элементом неживой природы, так как это основной компонент земной коры.
3. При взаимодействии избытка раствора гидроксида натрия с 16 г кремния было получено 22,4 л водорода (н. у.). Вычислите массовую долю кремния во взятом образце. Сколько граммов оксида кремния (IV) содержалось в нём? Сколько граммов 60%−го раствора щёлочи потребовалось для реакции?
Ответ:
Дано:
$m_{техн}$ (Si) = 16 г
V ($H_{2}$) = 22,4 л
ω (NaOH) = 60%
Найти:
ω (Si) − ?
m ($SiO_{2}$) − ?
$m_{р-ра}$ (NaOH) − ?
Решение:
$Si + 2NaOH + H_{2}O = Na_{2}SiO_{3} + 2H_{2}$
n ($H_{2}$) = $\frac{V}{V_{m}}$ = $\frac{22,4}{22,4}$ = 1 моль
n (Si) = 0,5 * n ($H_{2}$) = 0,5 * 1 = 0,5 моль
m (Si) = n * M = 0,5 * 28 = 14 г
ω (Si) = m (Si) : $m_{техн}$ (Si) * 100% = 14 : 16 * 100% = 88%
m ($SiO_{2}$) = $m_{техн}$ (Si) − m (Si) = 16 − 14 = 2 г
n (NaOH) = n ($H_{2}$) = 1 моль
m (NaOH) = n * M = 1 * 40 = 40 г
$m_{р-ра}$ (NaOH) = $\frac{m}{ω}$ = $\frac{40}{0,6}$ = 67 г
Ответ: ω (Si) = 88%; m ($SiO_{2}$) = 2 г; $m_{р-ра}$ (NaOH) = 67 г.4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $SiO_{2}$ $\overset{1}{⟶}$ $Si$ $\overset{2}{⟶}$ $Ca_{2}Si$ $\overset{3}{⟶}$ $SiH_{4}$ $\overset{4}{⟶}$ $SiO_{2}$ $\overset{5}{⟶}$ Si;
б) Si $\overset{1}{⟶}$ $SiO_{2}$ $\overset{2}{⟶}$ $Na_{2}SiO_{3}$ $\overset{3}{⟶}$ $H_{2}SiO_{3}$ $\overset{4}{⟶}$ $SiO_{2}$ $\overset{5}{⟶}$ Si.
Рассмотрите процессы окисления−восстановления.Ответ:
а) $SiO_{2}$ $\overset{1}{⟶}$ $Si$ $\overset{2}{⟶}$ $Ca_{2}Si$ $\overset{3}{⟶}$ $SiH_{4}$ $\overset{4}{⟶}$ $SiO_{2}$ $\overset{5}{⟶}$ Si
1) $SiO_{2} + 2Mg = 2MgO + Si$
$Si^{+4} + 4ē ⟶ Si^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановитель
2) $Si + 2Ca = Ca_{2}Si$
$Si^{0} + 4ē ⟶ Si^{-4}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
3) $Ca_{2}Si + H_{2}O = Ca(OH)_{2} + SiH_{4}↑$
4) $SiH_{4} + 2O_{2} = SiO_{2} + 2H_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Si^{-4} - 8ē ⟶ Si^{+4}$ − восстановитель
5) $SiO_{2} + 2Mg = 2MgO + Si$
$Si^{+4} + 4ē ⟶ Si^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановительб) Si $\overset{1}{⟶}$ $SiO_{2}$ $\overset{2}{⟶}$ $Na_{2}SiO_{3}$ $\overset{3}{⟶}$ $H_{2}SiO_{3}$ $\overset{4}{⟶}$ $SiO_{2}$ $\overset{5}{⟶}$ Si
1) $Si + O_{2} = SiO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Si^{0} - 4ē ⟶ Si^{+4}$ − восстановитель
2) $SiO_{2} + 2NaOH = Na_{2}SiO_{3} + H_{2}O$
3) $Na_{2}SiO_{3} + 2HCl = 2NaCl + H_{2}SiO_{3}↓$
4) $H_{2}SiO_{3} = H_{2}O + SiO_{2}$
5) $SiO_{2} + 2Mg = 2MgO + Si$
$Si^{+4} + 4ē ⟶ Si^{0}$ − окислитель
$Mg^{0} - 2ē ⟶ Mg^{+2}$ − восстановительТемы для дискуссии
1. На соискание Нобелевской премии в 1903 г. были выдвинуты кандидатуры А. Муассана и Д. И. Менделеева. Шведская академия наук присудила премию А. Муассану. Какому из кандидатов вы бы отдали предпочтение?
Ответ:
Я бы отдала предпочтение А. Муассану, так как это первый химик, который изолировал чистый фтор.
Помимо этого у ученого много других достижений.
Муассан смог получить в газообразном состоянии такие вещества, как цирконий, молибден, марганец, хром, торий, вольфрам, платину, уран, титан и ванадий. Он обнаружил, что при очень высоких температурах углерод, бор и кремний, которые не проявляют активности при обычных температурах, реагируют со многими элементами и образуют соответственно карбиды, бориды и силициды. Он также получил карбид кремния — знаменитый карборунд.
Также химик решил создать химическую посуду из флюорита и проводить в ней электролиз жидкого чистого фтороводорода, охлажденного до отрицательных температур при помощи платиноиридиевых электродов.2. На классификацию оксида азота (IV) существуют две точки зрения: его относят либо к несолеобразующим, либо к кислотным оксидам. Какую точку зрения поддерживаете вы и почему?
Ответ:
Я отношу оксид азота (IV) к кислотным оксидам, так как он проявляет все свойства кислотных оксидов.
1) Реагирует с щелочью:
$2NO_{2} + 2NaOH = NaNO_{2} + NaNO_{3} + H_{2}O$
2) Реагирует с водой:
$2NO_{2} + H_{2}O = HNO_{2} + HNO_{3}$
3) Реагирует с основными оксидами:
$2NO_{2} + Na_{2}O = NaNO_{2} + NaNO_{3}$3. Углерод образует два простых вещества: алмаз и графит. Однако в XIX в. выделяли ещё одну модификацию аморфный углерод нескольких сортов (сажа, кокс, древесный уголь). Почему в современной химии этой модификации нет?
Ответ:
Углерод образует два простых вещества: алмаз и графит. Однако в XIX в. выделяли ещё одну модификацию аморфный углерод нескольких сортов (сажа, кокс, древесный уголь). В современной химии этой модификации нет, так как уголь, кокс и сажа − это на 85−90% смесь органических веществ, чистого углерода в них почти нет.
Кокс − это серое, твердое и пористое топливо на основе угля с высоким содержанием углерода и небольшим количеством примесей.
Сажа − аморфный углерод, продукт неполного сгорания или термического разложения углеводородов в неконтролируемых условиях.
Древесный уголь − микропористый высокоуглеродистый продукт, образующийся при пиролизе древесины без доступа воздуха.ХИМИЧЕСКИЙ ПРАКТИКУМ №2. Свойства неметаллов и их соединений
Практическая работа №4
Задача 1
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
Ответ:
Качественной реакцией на сульфат−ионы является реакция с солями бария:
$H_{2}SO_{4} + BaCl_{2} = 2HCl + BaSO_{4}$↓Задача 2
В пробирку поместите 1−2 гранулы цинка и прилейте в неё около 1 мл разбавленной серной кислоты. Что вы наблюдаете? Напишите уравнение реакции и рассмотрите окислительно−восстановительные процессы.
Ответ:
В пробирку поместили 1−2 гранулы цинка и прилили в неё около 1 мл разбавленной серной кислоты.
Наблюдаем выделение газа − водорода.
$Zn + H_{2}SO_{4} ⟶ ZnSO_{4} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановительЗадача 3
Налейте в две пробирки по 1−2 мл раствора сульфида натрия. Прилейте в одну из них такой же объём хлорной воды, а в другую – бромной воды. Что вы наблюдаете? Объясните свои наблюдения. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Ответ:
Налили в две пробирки по 1−2 мл раствора сульфида натрия. Прилили в одну из них такой же объём хлорной воды, а в другую – бромной воды.
В первой пробирке наблюдаем обесцвечивание хлорной воды и выпадение светло−желтого осадка из−за вытеснения хлором серы из сульфида натрия, так как хлор является более электроотрицательным элементом, чем сера:
$Na_{2}S + Cl_{2} ⟶ 2NaCl + S↓$
$2Na^{+} + S^{2-} + Cl_{2} ⟶ 2Na^{+} + 2Cl^{-} + S↓$
$S^{2-} + Cl_{2} ⟶ 2Cl^{-} + S↓$
Во второй пробирке наблюдаем обесцвечивание бромной воды и выпадение светло−желтого осадка из−за вытеснения бромом серы из сульфида натрия, так как бром является более электроотрицательным элементом, чем сера:
$Na_{2}S + Br_{2} ⟶ 2NaBr + S↓$
$2Na^{+} + S^{2-} + Br_{2} ⟶ 2Na^{+} + 2Br^{-} + S↓$
$S^{2-} + Br_{2} ⟶ 2Br^{-} + S$↓Задача 4
Вам даны три пробирки с растворами. Определите, в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Ответ:
Распознать данные вещества можно с помощью индикатора, например фенолфталеина.
В пробирке с гидроксидом натрия окраска изменится на малиновую, так как присутствуют $OH^{-}$.
Соляную кислоту от серной можно отличить с помощью хлорида бария.
В пробирке с серной кислотой выпадет белый осадок.
$H_{2}SO_{4} + BaCl_{2} ⟶ 2HCl + BaSO_{4}↓$
$2H^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2H^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$Задача 5
Определите, содержит ли поваренная соль примесь сульфатов. Напишите уравнения реакций в молекулярном и ионном виде.
Ответ:
Определим содержание сульфат ионов с помощью хлорида бария:
$Na_{2}SO_{4} + BaCl_{2} ⟶ 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$Задача 6
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Ответ:
Качественной реакцией на сульфат−ионы является реакция с солями бария:
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba2+ + SO42- ⟶ BaSO4↓$
Качественной реакцией на йодид−ионы является реакция с солями серебра:
$NaI + AgNO_{3} = NaNO_{3} + AgI↓$
$Na^{+} + I^{-} + Ag^{+} + NO_{3}^{-} ⟶ Na^{+} + NO_{3}^{-} + AgI↓$
$Ag^{+} + I^{-} ⟶ AgI↓$
Качественной реакцией на хлорид−ионы является реакция с солями серебра:
$NaCl + AgNO_{3} = NaNO_{3} + AgCl↓$
$Na^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} ⟶ Na^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$Задача 7
Исходя из оксида меди (II), получите раствор сульфата меди (II) и выделите из него кристаллический медный купорос. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Ответ:
Исходя из оксида меди (II), получили раствор сульфата меди (II):
$CuO + H_{2}SO_{4} ⟶ CuSO_{4} + H_{2}O$
$CuO + 2H^{+} + SO_{4}^{2-} ⟶ Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$CuO + 2H^{+} ⟶ Cu^{2+} + H_{2}O$
Выпарили данный раствор и получили кристаллы медного купороса $CuSO_{4} * 5H_{2}O$.Задача 8
Вам даны три пробирки с растворами сульфата, сульфита и сульфида натрия. Определите с помощью только одного реактива, в какой пробирке находится каждое из веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном виде.
Ответ:
Распознаем вещества с помощью соляной кислоты.
Сульфат натрия не реагирует с соляной кислотой:
$Na_{2}SO_{4} + 2HCl$ ≠
С сульфитом натрия появился резкий запах:
$Na_{2}SO_{3} + 2HCl ⟶ 2NaCl + H_{2}O + SO_{2}↑$
С сульфидом натрия появился запах тухлых яиц:
$Na_{2}S + 2HCl ⟶ 2NaCl + H_{2}S↑$Практическая работа №5
Задача 1
Проведите реакции, с помощью которых можно доказать, что выданное вам в закрытых сосудах вещество является:
а) хлоридом аммония;
б) карбонатом натрия;
в) нитратом аммония;
г) нашатырным спиртом;
д) карбонатом кальция;
е) силикатом натрия.
Напишите уравнения проведённых реакций в молекулярном и ионном виде.Ответ:
а) Уравнение реакции, с помощью которой можно доказать, что выданное в закрытом сосуде вещество является хлоридом аммония:
$NH_{4}Cl + AgNO_{3} ⟶ NH_{4}NO_{3} + AgCl↓$
$NH^{4+} + Cl^{-} + Ag^{+} + NO_{3}^{-} ⟶ NH^{4+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$б) Уравнение реакции, с помощью которой можно доказать, что выданное в закрытом сосуде вещество является карбонатом натрия:
$Na_{2}CO_{3} + 2HCl ⟶ 2NaCl + H_{2}O + CO_{2}↑$
$2Na^{+} + CO_{3}^{2-} + 2H^{+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} ⟶ H_{2}O + CO_{2}↑$в) Уравнение реакции, с помощью которой можно доказать, что выданное в закрытом сосуде вещество является нитратом аммония:
$2NH_{4}NO_{3} + Ca(OH)_{2} ⟶ Ca(NO_{3})_{2} + 2NH_{3}↑ + 2H_{2}O$
$2NH^{4+} + 2NO_{3}^{-} + Ca^{2+} + 2OH^{-} ⟶ Ca^{2+} + 2NO_{3}^{-} + 2NH_{3}↑ + 2H_{2}O$
$NH^{4+} + OH^{-} ⟶ NH_{3}↑ + H_{2}O$г) Уравнение реакции, с помощью которой можно доказать, что выданное в закрытом сосуде вещество является нашатырным спиртом:
$NH_{3} + HCl ⟶ NH_{4}Cl$д) Уравнение реакции, с помощью которой можно доказать, что выданное в закрытом сосуде вещество является карбонатом кальция:
$CaCO_{3} + H_{2}O + CO_{2} ⟶ Ca(HCO_{3})_{2}$
$CaCO_{3} + H_{2}O + CO_{2} ⟶ Ca^{2+} + 2HCO_{3}^{-}$е) Уравнение реакции, с помощью которой можно доказать, что выданное в закрытом сосуде вещество является силикатом натрия:
$Na_{2}SiO_{3} + 2HCl ⟶ 2NaCl + H_{2}SiO_{3}↓$
$2Na^{+} + SiO_{3}^{2-} + 2H^{+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + H_{2}SiO_{3}↓$
$2H^{+} + SiO_{3}^{2-} ⟶ H_{2}SiO_{3}↓$Задача 2
Докажите опытным путём, что сульфат аммония и нитрат аммония нельзя смешивать с известью перед внесением этих удобрений в почву, и объясните почему. Напишите уравнения реакций.
Ответ:
Сульфат аммония и нитрат аммония нельзя смешивать с известью перед внесением этих удобрений в почву, так как в результате реакции образуется аммиак, который улетучивается из почвы.
$(NH_{4})_{2}SO_{4} + Ca(OH)_{2} ⟶ CaSO_{4}↓ + 2NH_{3}↑ + 2H_{2}O$
$2NH_{4}NO)_{3} + Ca(OH)_{2} ⟶ Ca(NO_{3})_{2} + 2NH_{3}↑ + 2H_{2}O$Задача 3
Докажите опытным путём, что:
а) в состав хлорида аммония входят ионы $NH_{4}^{+}$ и $Cl^{-}$;
б) в состав сульфата аммония входят ионы $NH_{4}^{+}$ и $SO_{4}^{2-}$.
Напишите уравнения проведённых реакций в молекулярном и ионном виде.Ответ:
а) Качественной реакцией на ион аммония является гидроксид ион:
$NH_{4}Cl + NaOH ⟶ NaCl + NH_{3}↑ + H_{2}O$
$NH_{4}^{+} + Cl^{-} + Na^{+} + OH^{-} ⟶ Na^{+} + Cl^{-} + NH_{3}↑ + H_{2}O$
$NH_{4}^{+} + OH^{-} ⟶ NH_{3}↑ + H_{2}O$
Качественной реакцией на хлорид ион является ион серебра:
$NH_{4}Cl + AgNO_{3} ⟶ NH_{4}NO_{3} + AgCl↓$
$NH_{4}^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} ⟶ NH_{4}^{+} + NO_{3}^{-} + AgCl↓$
$Ag^{+} + Cl^{-} ⟶ AgCl↓$б) Качественной реакцией на ион аммония является гидроксид ион:
$(NH_{4})_{2}SO_{4} + 2NaOH ⟶ Na_{2}SO_{4} + 2NH_{3}↑ + 2H_{2}O$
$2NH^{4+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + 2NH_{3}↑ + 2H_{2}O$
$NH_{4}^{+} + OH^{-} ⟶ NH_{3}↑ + H_{2}O$
Качественной реакцией на сульфат ион является ион бария:
$(NH_{4})_{2}SO_{4} + BaCl_{2} ⟶ 2NH_{4}Cl + BaSO_{4}↓$
$2NH_{4}^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2NH_{4}^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$Задача 4
Получите аммиак из следующих солей: а) хлорида аммония; б) сульфата аммония; в) нитрата аммония. Напишите уравнения проведённых реакций в молекулярном и ионном виде.
Ответ:
а) Получение аммиака из хлорида аммония:
$NH_{4}Cl = NH_{3} + HCl$
$NH_{4}^{+} + Cl^{-} = NH_{3} + H^{+} + Cl^{-}$
$ NH_{4}^{+} = NH_{3} + H^{+}$б) Получение аммиака из сульфата аммония:
$(NH_{4})_{2}SO_{4} = 2NH_{3} + H_{2}SO_{4}$
$2NH_{4}^{+} + SO_{4}^{2-} = 2NH_{3} + 2H^{+} + SO_{4}^{2-}$
$NH_{4}^{+} = NH_{3} + H^{+}$в) Получение аммиака из нитрата аммония:
$NH_{4}NO_{3} = NH_{3} + HNO_{3}$
$NH_{4}^{+} + NO_{3}^{-} = NH_{3} + H^{+} + NO_{3}^{-}$
$NH_{4}^{+} = NH_{3} + H^{+}$Задача 5
Проведите реакции, которые выражаются сокращёнными ионными уравнениями:
а) $H^{+} + OH^{-} = H_{2}O$;
б) $2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}$↑;
в) $2H^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}$↓.
Напишите уравнения проведённых реакций в молекулярном и ионном виде.Ответ:
а) Уравнение реакции, которая выражается сокращённым ионным уравнением $H^{+} + OH^{-} = H_{2}O$:
$HCl + NaOH = NaCl + H_{2}O$
$H^{+} + Cl^{-} + Na^{+} + OH^{-} ⟶ Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} ⟶ H_{2}O$б) Уравнение реакции, которая выражается сокращённым ионным уравнением $2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}$↑:
$2HCl + Na_{2}CO_{3} = 2NaCl + H_{2}O + CO_{2}↑$
$2H^{+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} ⟶ H_{2}O + CO_{2}↑$в) Уравнение реакции, которая выражается сокращённым ионным уравнением $2H^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}$↓:
$2HCl + Na_{2}SiO_{3} = 2NaCl + H_{2}SiO_{3}↓$
$2H^{+} + 2Cl^{-} + 2Na^{+} + SiO_{3}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + H_{2}SiO_{3}↓$
$2H^{+} + SiO_{3}^{2-} ⟶ H_{2}SiO_{3}↓$Задача 6
В четырёх пробирках вам даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, в какой пробирке находится каждое из веществ. Составьте уравнения реакций в молекулярном и ионном виде.
Ответ:
Распознаем вещества с помощью соляной кислоты.
В реакции с карбонатом калия выделится газ:
$K_{2}CO_{3} + 2HCl = 2KCl + H_{2}O + CO_{2}↑$
$2K^{+} + CO_{3}^{2-} + 2H^{+} + 2Cl^{-} ⟶ 2K^{+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} ⟶ H_{2}O + CO_{2}↑$
В реакции с силикатом натрия выпадет студенистый осадок:
$Na_{2}SiO_{3} + 2HCl = 2NaCl + H_{2}SiO_{3}↓$
$2Na^{+} + SiO_{3}^{2-} + 2H^{+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + H_{2}SiO_{3}↓$
$2H^{+} + SiO_{3}^{2-} ⟶ H_{2}SiO_{3}↓$
Сульфат натрия отличим с помощью хлорида бария − выпадет белый осадок:
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
В последней пробирке − хлорид цинка. Проверить может с помощью нитрата серебра:
$ZnCl_{2} + 2AgNO_{3} = 2AgCl + Zn(NO_{3})_{2}$
$Zn^{2+} + 2Cl^{-} + 2Ag^{+} + 2NO^{-}_{3} = 2AgCl + Zn^{2+} + 2NO_{3}^{-}$
$Cl^{-} + Ag^{+} = AgCl$Практическая работа №6
Вариант 1
Опыт 1
1. Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в неё 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 63) и наденьте на кончик трубки ещё одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесите отверстием к горящей спиртовке. Если в пробирке находится чистый водород, то раздастся глухой хлопок, если «лающий» звук — водород собран в смеси с воздухом, т.е. в пробирке собран «гремучий газ».
Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.Ответ:
Получение, собирание и распознавание водорода
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1−2 гранулы цинка и прилили в неё 1−2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки ещё одну пробирку. Подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом. Сняли пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесли отверстием к горящей спиртовке. Услышали глухой хлопок, значит в пробирке собран чистый водород.
При взаимодействии цинка с соляной кислотой выделяется газ − водород:
$Zn + 2HCl = ZnCl_{2} + H_{2}↑$
Характеристика реакции:
1) Реакция замещения.
2) Экзотермическая.
3) Необратимая.
4) Реакция гетерогенная.
5) Некаталитическая.
6) Окислительно−восстановительная реакция.2. Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в неё 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 63) и наденьте на кончик трубки ещё одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесите отверстием к горящей спиртовке. Если в пробирке находится чистый водород, то раздастся глухой хлопок, если «лающий» звук — водород собран в смеси с воздухом, т.е. в пробирке собран «гремучий газ».
Рассмотрите записанную реакцию с точки зрения процессов окисления−восстановления.Ответ:
$Zn + 2HCl = ZnCl_{2} + H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель3. Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в неё 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 63) и наденьте на кончик трубки ещё одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесите отверстием к горящей спиртовке. Если в пробирке находится чистый водород, то раздастся глухой хлопок, если «лающий» звук — водород собран в смеси с воздухом, т.е. в пробирке собран «гремучий газ».
Рассмотрите записанную реакцию с точки зрения процессов окисления−восстановления.
Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.Ответ:
Водород – газ без цвета и запаха. Водород легче воздуха.
4. Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в неё 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 63) и наденьте на кончик трубки ещё одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесите отверстием к горящей спиртовке. Если в пробирке находится чистый водород, то раздастся глухой хлопок, если «лающий» звук — водород собран в смеси с воздухом, т.е. в пробирке собран «гремучий газ».
Рассмотрите записанную реакцию с точки зрения процессов окисления−восстановления.
Опишите, как можно распознать водород.Ответ:
Разпознать водород можно по характерному хлопку.
Опыт 2
1. Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 154, и проверьте его на герметичность.
Рис. 154 Получение аммиака и его собирание методом вытеснения воздуха
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объёмом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте её пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Сначала 2−3 движениями пламени прогрейте всю пробирку со смесью хлорида аммония и гидроксида кальция, а затем нагревайте только в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем, погрузите пробирку отверстием вниз в сосуд с водой и освободите отверстие пробирки. Что вы наблюдаете? Почему вода в пробирке поднялась? Закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Переверните пробирку и добавьте в неё 2−3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щёлочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.Ответ:
Получение, собирание и распознавание аммиака
Собрали прибор, как показано на рисунке, и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объёмом по одной ложечке для сжигания веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли её пробкой и укрепили в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку надели сухую пробирку для собирания аммиака. Сначала 2−3 движениями пламени прогрели всю пробирку со смесью хлорида аммония и гидроксида кальция, а затем нагревали только в том месте, где находится смесь. Для обнаружения аммиака поднесли к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку. Прекратили нагревание смеси. Пробирку, в которой собран аммиак, сняли с газоотводной трубки. Конец газоотводной трубки сразу же закрыли кусочком мокрой ваты. Немедленно закрыли отверстие снятой пробирки большим пальцем, погрузили пробирку отверстием вниз в сосуд с водой и освободили отверстие пробирки.
Наблюдаем выделение газа − аммиака. Вода в пробирке поднялась, так как аммиак легче воздуха, хорошо растворяется в воде.
Закрыли пальцем отверстие пробирки под водой и вынули её из сосуда. Перевернули пробирку и добавили в неё 2−3 капли раствора фенолфталеина.
Наблюдаем изменение окраски фенолфталеина на малиновую.
Провели аналогичную реакцию между растворами щёлочи и соли аммония при нагревании. Поднесли к отверстию пробирки влажную индикаторную бумажку. Наблюдаем изменение окраски бумажки.2. Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 154, и проверьте его на герметичность.
Рис. 154 Получение аммиака и его собирание методом вытеснения воздуха
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объёмом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте её пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Сначала 2−3 движениями пламени прогрейте всю пробирку со смесью хлорида аммония и гидроксида кальция, а затем нагревайте только в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем, погрузите пробирку отверстием вниз в сосуд с водой и освободите отверстие пробирки. Что вы наблюдаете? Почему вода в пробирке поднялась? Закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Переверните пробирку и добавьте в неё 2−3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щёлочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.Ответ:
Аммиак − гаообразное вещество, обладающее резким запахом.
3. Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 154, и проверьте его на герметичность.
Рис. 154. Получение аммиака и его собирание методом вытеснения воздуха
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объёмом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте её пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Сначала 2−3 движениями пламени прогрейте всю пробирку со смесью хлорида аммония и гидроксида кальция, а затем нагревайте только в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем, погрузите пробирку отверстием вниз в сосуд с водой и освободите отверстие пробирки. Что вы наблюдаете? Почему вода в пробирке поднялась? Закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Переверните пробирку и добавьте в неё 2−3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щёлочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Опишите не менее двух способов распознавания аммиака.Ответ:
Аммиак можно распознать по запаху, так как он имеет едкий запах.
Также аммиак можно распознать с помощью лакмусовой красная бумаги, которая синеет.Вариант 2
Опыт 1
1. Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 96, и проверьте его на герметичность.
Рис. 96. Получение кислорода в лаборатории разложение перманганата калия и собирание его методом вытесния воздуха
Пробирку примерно на ¼ объёма заполните перманганатом калия $KMnO_{4}$, у отверстия пробирки расположите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода. Сначала 2−3 движениями пламени прогрейте всю пробирку с $KMnO_{4}$, а затем нагревайте только в том месте, где находится вещество.
Наличие кислорода в сосуде проверяйте тлеющей лучинкой.
Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.Ответ:
Получение, собирание и распознавание кислорода
Собрали прибор, как показано на рисунке 96, и проверили его на герметичность. Пробирку примерно на ¼ объёма заполнили перманганатом калия $KMnO_{4}$, у отверстия пробирки расположили рыхлый комочек ваты. Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода. Сначала 2−3 движениями пламени прогрели всю пробирку с $KMnO_{4}$, а затем нагревайте только в том месте, где находится вещество.
Наличие кислорода в сосуде проверяли тлеющей лучинкой.
При нагревании перманганата калия он разлагается с образованием кислорода: $2KMnO_{4} ⟶ K_{2}MnO_{4} + MnO_{2} + O_{2}$↑
Характеристика реакции:
1) Реакция разложения.
2) Эндотермическая.
3) Необратимая.
4) Реакция гетерогенная.
5) Некаталитическая.
6) Окислительно−восстановительная реакция.2. Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 96, и проверьте его на герметичность.
Рис. 96 Получение кислорода в лаборатории разложение перманганата калия и собирание его методом вытесния воздуха
Пробирку примерно на ¼ объёма заполните перманганатом калия $KMnO_{4}$, у отверстия пробирки расположите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода. Сначала 2−3 движениями пламени прогрейте всю пробирку с $KMnO_{4}$, а затем нагревайте только в том месте, где находится вещество.
Наличие кислорода в сосуде проверяйте тлеющей лучинкой.
Рассмотрите записанную реакцию с точки зрения процессов окисления−восстановления.Ответ:
Уравнение реакции разложения перманганата калия:
$2KMnO_{4} = K_{2}MnO_{4} + MnO_{2} + O_{2}↑$
$Mn^{+7} + 3ē ⟶ Mn^{+4}$ − окислитель
$Mn^{+7} + 1ē ⟶ Mn^{+6}$ − окислитель
$2O^{-2} - 4ē ⟶ O_{2}^{0}$ − восстановитель3. Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 96, и проверьте его на герметичность.
Рис. 96 Получение кислорода в лаборатории разложение перманганата калия и собирание его методом вытесния воздуха
Пробирку примерно на ¼ объёма заполните перманганатом калия $KMnO_{4}$, у отверстия пробирки расположите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода. Сначала 2−3 движениями пламени прогрейте всю пробирку с $KMnO_{4}$, а затем нагревайте только в том месте, где находится вещество.
Наличие кислорода в сосуде проверяйте тлеющей лучинкой.
Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.Ответ:
Кислород – газ без цвета и запаха, который тяжелее воздуха.
4. Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 96, и проверьте его на герметичность.
Рис. 96. Получение кислорода в лаборатории разложение перманганата калия и собирание его методом вытесния воздуха
Пробирку примерно на ¼ объёма заполните перманганатом калия $KMnO_{4}$, у отверстия пробирки расположите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода. Сначала 2−3 движениями пламени прогрейте всю пробирку с $KMnO_{4}$, а затем нагревайте только в том месте, где находится вещество.
Наличие кислорода в сосуде проверяйте тлеющей лучинкой.
Опишите, как вы распознавали кислород.Ответ:
Кислород распознавали с помощью тлеющей лучины, которая вспыхивает в кислороде.
Опыт 2
1. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1−2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с 2−3 мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.Ответ:
Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместили несколько кусочков мела или мрамора и прилили 1−2 мл разбавленной соляной кислоты. Быстро закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку с 2−3 мл известковой воды. Несколько минут наблюдали, как через известковую воду проходят пузырьки газа.
При взаимодействии мела с соляной кислотой выделяется углекислый газ:
$CaCO_{3} + 2HCl ⟶ CaCl_{2} + H_{2}O + CO_{2}↑$
Характеристика реакции:
1) Реакция обмена.
2) Экзотермическая.
3) Необратимая.
4) Реакция гетерогенная.
5) Некаталитическая.
6) Не окислительно−восстановительная.2. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1−2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с 2−3 мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Рассмотрите проведённую реакцию в свете теории электролитической диссоциации.Ответ:
$CaCO_{3} + 2H^{+} + 2Cl^{-} ⟶ Ca^{2+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$CaCO_{3} + 2H_{+} ⟶ Ca^{2+} + H_{2}O + CO_{2}↑$3. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1−2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с 2−3 мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.Ответ:
Оксид углерода (IV) − газообразное вещество без цвета и запаха, которое тяжелее воздуха.
4. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1−2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с 2−3 мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Опишите, каким способом вы распознавали оксид углерода (IV).Ответ:
В этом опыте мы распознали оксид углерода (IV) с помощью известковой воды − в результате реакции образовался осадок белого цвета:
$CO_{2} + Ca(OH)_{2} ⟶ CaCO_{3} + H_{2}O$. §34
-
ГЛАВА ЧЕТВЕРТАЯ. Начальные сведения об органических соединениях
§34. Углеводороды
i
1. Используя ресурсы Интернета, подготовьте сообщение об областях применения метана.
Ответ:
Области применения метана
Метан используется в качестве топлива для печей, водонагревателей, автомобилей, турбин и др. Метан является топливом автомобилей.
Сейчас метан всё чаще используется, как топливо в автомобилях. Также метан используется для сварки и резки металлов. $CH_{4}$ − основная составляющая природного газа, а, значит, и большая часть того, что используется в газовых плитах и других подобных конструкциях. Используется в качестве продукта хлорирования в огнетушителях. Он нашёл применение и в медицине. Газ в целом безвреден для человеческого организма, но оказывает на индивидуума усыпляющие действие.2. Используя ресурсы Интернета, подготовьте сообщение об областях применения этилена.
Ответ:
Области применения этилена
Этилен используют в качестве мономера, из которого построены большие углеродные цепи. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще полиэтилен применяют для производства тары, труб, деталей технической аппаратуры, предметов домашнего обихода.3. Используя ресурсы Интернета, подготовьте сообщение об отраслях промышленности, где используется уголь и продукты и его переработки.
Ответ:
Отрасли промышленности, где используется уголь и продукты и его переработки
Перечислим основные сферы применения каменного угля: для отопления, удобрения почвы, получения жидкого топлива. Основное применение каменного угля – это отопление зданий и помещений. Его используют и для печного отопления частных домов, и для промышленных котельных. Уголь используют в качестве топлива, в металлургии, в химической промышленности. Также используется в медицине. Оказывает энтеросорбирующее, дезинтоксикационное и противодиарейное действие.?
1. Запишите электронные формулы молекул этана и этилена.
Ответ:
Электронная формула этана $C_{2}H_{6}$:
Электронная формула этилена $C_{2}H_{4}$:
2. Назовите области применения полиэтилена. В случае затруднения обратитесь к Интернету.
Ответ:
Полиэтилен применяется для производства пленок: сельскохозяйственных, строительных, пищевых. Полиэтилен также находит широкое применение для производства различных емкостей.
3. Рассчитайте массовые доли углерода в молекулах этана и этилена. Как массовая доля углерода в этих соединениях влияет на характер пламени их горения?
Ответ:
Дано:
1) $C_{2}H_{6}$ − этан
2) $C_{2}H_{4}$ − этилен
Найти:
$ω_{1}$ (C) − ?
$ω_{2}$ (C) − ?
Решение:
$ω_{1}$ (C) = $\frac{2 * A_{r} (C)}{M_{r}}$ * 100% = $\frac{2 * 12}{30}$ * 100% = 80%
$ω_{2}$ (C) = $\frac{2 * A_{r} (C)}{M_{r}}$ * 100% = $\frac{2 * 12}{28}$ * 100% = 85,7%
Ответ: $ω_{1}$ (C) = 80%; $ω_{2}$ (C) = 85,7%.
Этан горит бесцветным пламенем, этилен − светящимся пламенем.4. Как распознать газообразные этан и этилен? Назовите два способа.
Ответ:
Этилен имеет кратную связь, поэтому его можно отличить от этана двумя способами с помощью:
1) бромной воды;
2) перманганата калия.
Этилен обесцвечивает и бромную воду, и раствор перманганата калия.5. Почему метан и этан горят горят бесцветным пламенем, а этилен − светящимся?
Ответ:
Метан и этан горят горят бесцветным пламенем, а этилен − светящимся, так как в молекуле этилена содержание углерода больше, чем в молекуле этана и метана.
6. Подготовьте сообщение о способах транспортировки углеводородного сырья и его значении для международной кооперации.
Ответ:
Способы транспортировки:
1) Автомобильный транспорт нефти;
2) Водный транспорт нефти;
3) Железнодорожный транспорт нефти;
4) Трубопроводный транспорт нефти.
Транспортировка углеводородного сырья на нефтеперерабатывающих и нефтехимических предприятиях осуществляется с помощью трубопроводных систем. Принимая во внимание тот факт, что технологические трубопроводы являются транспортерами взрыво − и пожароопасных сред, эксплуатация таких систем создает угрозу безопасному функционированию предприятий. Недостаток свободных оборотных средств не позволяет своевременно обновлять существующие трубопроводные системы, повышая тем самым риск возникновения аварий.
Международная производственная кооперация − это устойчивый обмен между странами на производимую ими продукцию наиболее экономически эффективным способом, основанный на международной специализации производства.
Большое разнообразие способов транспортировки углеводородного сырья позволяет осущаствлять экспорт. §35
-
§35. Кислородосодержащие органические соединения
Лабораторный опыт №41
Качественная реакция на глицерин
К 2 мл раствора щелочи в пробирке прильем раствор медного купороса. Выпадает студенистый осадок голубого цвета гидроксид меди (II). К полученному осадку прибавим по каплям глицерин и смесь перемешаем. Осадок растворится, а раствор приобретет ярко−синий цвет за счет образования глицерата меди.Ответ:
Качественная реакция на глицерин
К 2 мл раствора щелочи в пробирке прилили раствор медного купороса. Выпадает студенистый осадок голубого цвета гидроксид меди (II). К полученному осадку прибавили по каплям глицерин и смесь перемешали. Осадок растворится, а раствор приобретет ярко−синий цвет за счет образования глицерата меди.Лабораторный опыт №42
Качественная реакция на углеводы
В пробирку с 2 мл раствора щёлочи прильём раствор медного купороса. К полученному студенистому осадку голубого цвета гидроксида меди (II) прильём раствор глюкозы. Осадок растворился, а раствор приобрел ярко−синий цвет. Мы видим качественную реакцию на многоатомные спирты. Следовательно, исследуемое вещество − глюкоза относится к многоатомным спиртам. Продолжим опыт. Нагреем пробирку на пламени спиртовки. Вновь выпал осадок, но уже кирпично−красного цвета. Следовательно, глюкоза, помимо нескольких гидроксильных групп, содержит ещё одну функциональную группу. Вторая реакция является качественной на альдегидную группу.Ответ:
Качественная реакция на углеводы
В пробирку с 2 мл раствора щёлочи прилили раствор медного купороса. К полученному студенистому осадку голубого цвета гидроксида меди (II) прилили раствор глюкозы. Осадок растворился, а раствор приобрел ярко−синий цвет. Мы видим качественную реакцию на многоатомные спирты. Следовательно, исследуемое вещество − глюкоза относится к многоатомным спиртам. Продолжим опыт. Нагрели пробирку на пламени спиртовки. Вновь выпал осадок, но уже кирпично−красного цвета. Следовательно, глюкоза, помимо нескольких гидроксильных групп, содержит ещё одну функциональную группу. Вторая реакция является качественной на альдегидную группу.i
1. Используя ресурсы Интернета, подготовьте презентацию о промышленном способе получения и применении метанола.
Ответ:
Презентация "Промышленный способ получения и применение метанола"
Слайд 1
Метанол был найден в древесном спирте в 1661 году, а в 1834 году был получен сухой перегонкой древесины, установлена его химическая формула: $CH_{3}-OH$.
Слайд 2
Характеристика метанола:
Метанол (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) − простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол − это первый представитель гомологического ряда одноатомных спиртов.
Слайд 3
В промышленности метанол получают из синтез газа:
$CO + 2H_{2} = CH_{3}OH$
Слайд 4
Метанол используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол. Большие объемы метанола используют при добыче и транспорте природного газа.
Слайд 5
Отравление метиловым спиртом − это острая интоксикация, спровоцированная приемом метанола внутрь.
Основные симптомы: повторная рвота, тошнота, головокружение.
2. Используя ресурсы Интернета, подготовьте презентацию о промышленном способе получения и применении этанола.
Ответ:
Презентация "Промышленный способ получения и применение этанола"
Слайд 1
Этанол (этиловый спирт, метилкарбинол, винный спирт) — одноатомный спирт с формулой $C_{2}H_{5}OH$, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость.
Слайд 2
В промышленности используют гидратацию этилена:
$CH_{2} = CH_{2} + H_{2}O → C_{2}H_{5}OH$
Слайд 3
Отравление этилсодержащими продуктами представляет собой острую интоксикацию, возникшую в результате чрезмерного и неконтролируемого употребления алкогольных напитков, с нарушением координации, функции памяти, мышления.
Слайд 4
Этанол применяется в медицине как антисептик, посушивающее средство, растворитель для лекарственных веществ, консервант. В пищевой промышленности используется как компонент спиртных напитков.
Слайд 5
Из этилового спирта получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы, а также спирт применяется в качестве топлива.
3. Используя ресурсы Интернета, подготовьте презентацию о промышленном способе получения и применении глицерина.
Ответ:
Презентация "Промышленный способ получения и применение глицерина"
Слайд 1
Многоатомными называются спирты, спирты, содержащие две и более гидроксильные группы в составе молекулы. Среди многоатомных спиртов наиболее известны этиленгликоль и глицерин.
Слайд 2
Глицерин − органическое соединение, простейший представитель трёхатомных спиртов с формулой $C_{3}H_{5}(OH)_{3}$. Представляет собой вязкую прозрачную жидкость со сладким вкусом.
Слайд 3
Промышленный способ получения глицерина – это гидролиз жиров, так как жиры являются сложными эфирами глицерина и высших карбоновых кислот.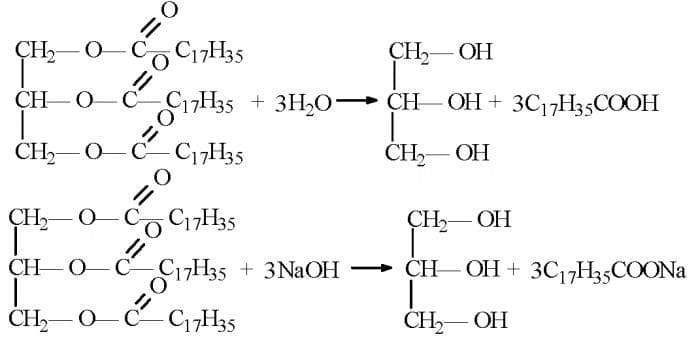
Слайд 4
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Слайд 5
Небольшое количество растительного глицерина, используемого в пищевых продуктах, вряд ли вызовет побочные эффекты. Однако он классифицируется как сахарный спирт и, в свою очередь, может иметь слабительный эффект при потреблении в больших количествах. Таким образом, это может привести к диарее, чрезмерному мочеиспусканию и обезвоживанию, при его чрезмерном употреблении.
?
1. Какими свойствами атомов углерода обусловлено многообразие органических веществ?
Ответ:
Многообразие органических веществ обусловлено тем, что атомы углерода − четырёхвалентны и способны соединяться в цепочки неограниченной длины.
2. Напишите уравнения реакций горения метилового и этилового спиртов.
Ответ:
Уравнения реакций горения метилового и этилового спиртов:
1) $2CH_{3}OH + 3O_{2} = 2CO_{2} + 4H_{2}O$
2) $C_{2}H_{5}OH + 3O_{2} = 2CO_{2} + 3H_{2}O$.3. Какие свойства метилового и этилового спиртов находят практическое применение?
Ответ:
Метиловый и этиловый спирты − хорошие растворители, окисляются до альдегидов, поэтому их используют в синтезе.
4. Напишите уравнение реакции спиртового брожения глюкозы, зная, что в результате ее образуются этиловый спирт и углекислый газ.
Ответ:
Уравнение реакции спиртового брожения глюкозы:
$C_{6}H_{12}O_{6} = 2C_{2}H_{5}OH + 2CO_{2}$.5. Подготовьте сообщение об алкоголизме и его профилактике.
Ответ:
Алкоголизм и его профилактика
Алкоголизм − это психическое заболевание, которое может длиться годами.
Личность формируется с детского возраста, поэтому профилактика алкоголизма начинается с раннего возраста.
Под профилактикой алкоголизма подразумеваются психологические приемы, направленные на формирование отрицательного отношения к алкоголю. Задача методов состоит в создании образа жизни без алкоголя. Основные методы такой организации − это разъяснительная работа по отрицательному влиянию алкоголя на организм.
По данным Всемирной организации здравоохранения, по причинам, связанным с употреблением алкоголя, в мире ежегодно умирают около 2,5 млн. человек. §36
-
§36. Карбоновые кислоты и жиры
i
1. Используя ресурсы Интернета, подготовьте презентацию о практическом применении реакции этерификации.
Ответ:
Презентация "Практическое применение реакции этерификации"
Слайд 1
Этерификация − реакция образования сложного эфира из спирта и кислоты.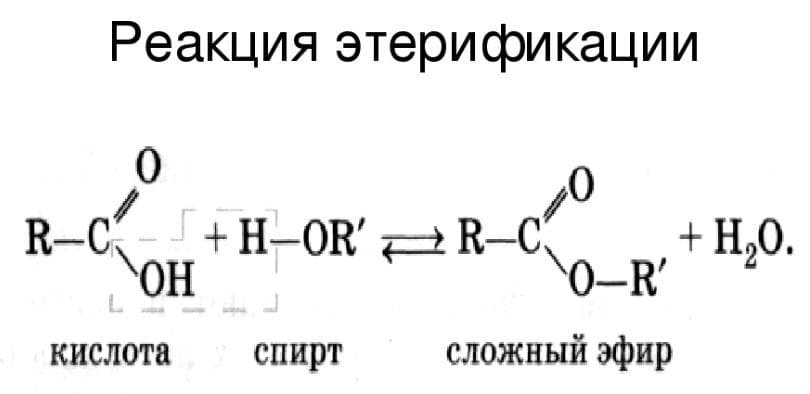
Слайд 2
Реакцию этерификации применяют в промышленности для синтеза пигментов, лекарств и других полезных химических соединений. В ней органическая карбоновая кислота объединяется со спиртом, при этом образуется сложный эфир и вода.
Слайд 3
Примеры реакций:
$CH_{3}COOH + CH_{3}OH = CH_{3}COOCH_{3} + H_{2}O$
$CH_{3}CH_{2}COOH + CH_{3}OH = CH_{3}CH_{2}COOCH_{3} + H_{2}O$
$CH_{3}COOH + CH_{3}CH_{2}OH = CH_{3}COOCH_{2}CH_{3} + H_{2}O$2. Используя ресурсы Интернета, подготовьте презентацию о функциях жиров в организме.
Ответ:
Презентация "Функции жиров в организме"
Слайд 1
Жиры − природные органические соединения, представляющие собой полные сложные эфиры трёхатомного спирта глицерина и одноосновных высших или средних жирных (предельных) кислот.
Слайд 2
В основе классификации жиров лежит несколько признаков.
По происхождению: животные и растительные.
По агрегатному состоянию: жидкие, твердые, полужидкие.
По химическому строению: предельные, непредельные, смешанные.
Слайд 3
Биологические функции жиров:
Входят в состав клеточных мембран. Клеточная мембрана − это биологическая мембрана, которая разделяет внутреннюю среду клетки и внешнюю среду. Она состоит из двух слоев фосфолипидов, в которые встроены белки и гликолипиды. Клеточная мембрана состоит из двух слоев фосфолипидов, гидрофильные «головки» которых обращены наружу, а гидрофобные «хвосты» направлены друг к другу. В мембрану встроены белки, гликолипиды и холестерин.
Слайд 4
Защитная роль − предохраняют внутренние органы от сотрясений.
Слайд 5
Также жиры выполняют такие функции: регуляторная функция; теплоизоляционная; энергетическая функция.
?
1. Запишите формулы ацетатов: а) калия; б) железа (II). Запишите уравнения диссоциации этих солей.
Ответ:
а) Ацетат калия: $CH_{3}COOK$.
Уравнение диссоциации ацетата калия:
$CH_{3}COOK = CH_{3}COO^{-} + K^{+}$.б) Ацетат железа (II): $(CH_{3}COO)_ {2}Fe$.
Уравнение диссоциации ацетата железа (II):
$(CH_{3}COO)_{2}Fe$ = $2CH_{3}COO^{-} + Fe^{2+}$.2. Запишите уравнения реакций уксусной кислоты с оксидом, гидроксидом, хлоридом и карбонатом бария в молекулярном и ионном виде.
Ответ:
Реакция уксусной кислоты и оксида бария:
$2CH_{3}COOH + BaO = (CH_{3}COO)_{2}Ba + H_{2}O$
$2CH_{3}COO^{-} + 2H^{+} + BaO$ = $2CH_{3}COO^{-} + Ba^{2+} + H_{2}O$
$2H^{+} + BaO = Ba^{2+} + H_{2}O$
Реакция уксусной кислоты и гидроксида бария:
$2CH_{3}COOH + Ba(OH)_{2} = (CH_{3}COO)_{2}Ba + 2H_{2}O$
$2CH_{3}COO^{-} + 2H^{+} + Ba^{2+} + 2OH^{-}$ = $2CH_{3}COO^{-} + Ba^{2+} + 2H_{2}O$
$H^{+} + OH^{-}$ = H_{2}O
Реакция уксусной кислоты и хлорида бария:
$2CH_{3}COOH + BaCl_{2}$ ≠
Реакция уксусной кислоты и карбоната бария:
$2CH_{3}COOH + BaCO_{3}$ = $(CH_{3}COO)_{2}Ba + CO_{2} + H_{2}O$
$2CH_{3}COO^{-} + H^{+} + BaCO_{3}$ = $2CH_{3}COO^{-} + Ba^{2+} + CO_{2} + H_{2}O$
$H^{+} + BaCO_{3} = Ba^{2+} + CO_{2} + H_{2}O$3. Наличие каких связей отличает стеариновую кислоту от олеиновой? Как сказывается наличие остатков этих кислот на физических свойствах образованных ими жиров?
Ответ:
Стеариновую кислоту от олеиновой кислоты отличает наличие кратных связей.
Жиры образованные остатками непредельных кислот (стеариновой кислотой), имеют жидкую консистенцию, а жиры, образованные остатками предельных кислот, имеют твёрдую консистенцию.4. Вспомните из курса биологии жировой обмен в клетках и тканях и расскажите о нем с точки зрения химии.
Ответ:
В органах пищеварения во время подготовительной стадии обмена жиры распадаются на глицерин и жирные кислоты. В эпителии кишечника синтезируется жир, характерный для организма, и через лимфатическую систему направляется в жировые депо и клетки, где он используется как запасное вещество и строительный материал.
5. Назовите биологические функции жиров.
Ответ:
Биологические функции жиров:
1) Входят в состав клеточных мембран;
2) Защитная роль, предохраняют внутренние органы от сотрясений;
3) Регуляторная функция;
4) Теплоизоляционная;
5) Энергетическая функция. §37
-
§37. Азотосодержащие органические соединения
Лабораторный опыт №43
Качественные реакции на белок
Биуретовая реакция. Если к раствору белка (например, яичного) прилить немного щелочи и добавить несколько капель раствора меди (II), то появится фиолетовое окрашивание (рис. 161).
Рис. 161. Биуретовая реакция
Ксантопротеиновая реакция. При нагревании раствора белка с концентрированной азотной кислотой появится желтое окрашивание, которое переходит в оранжевое при добавлении раствора аммиака (рис.162).
Рис. 162. Ксантопротеиновая реакцияОтвет:
Качественные реакции на белок
Биуретовая реакция. Если к раствору белка (например, яичного) прилить немного щелочи и добавить несколько капель раствора меди (II), то появится фиолетовое окрашивание (рис. 161).
Ксантопротеиновая реакция. При нагревании раствора белка с концентрированной азотной кислотой появится желтое окрашивание, которое переходит в оранжевое при добавлении раствора аммиака (рис.162).Лабораторный опыт №44
Денатурация белка
Если в пробирку с раствором яичного белка добавить несколько капель раствора соли тяжелого металла, например нитрата свинца (II), образуется белый осадок − белок денатурирует.
Проделайте тот же опыт, прилив к раствору белка немного этилового спирта.Ответ:
Денатурация белка
Если в пробирку с раствором яичного белка добавить несколько капель раствора соли тяжелого металла, например нитрата свинца (II), образуется белый осадок − белок денатурирует.
Проделали этот же опыт, прилив к раствору белка немного этилового спирта. Наблюдаем помутнение раствора.i
1. Используя свои знания по биологии, а также ресурсы Интернета, подготовьте презентацию о функции белков в живом организме.
Ответ:
Презентация "Функции белков в живом организме"
Слайд 1
Белки – это высокомолекулярные органические соединения, которые состоят из углерода, водорода, кислорода, серы и азота. В состав некоторых белков входит фосфор, а также катионы металлов. Белки являются биополимерами, которые состоят из мономеров аминокислот.
Слайд 2
Функции белков:
Белки являются ферментами и катализаторами. Катализаторы − это химические вещества, ускоряющие реакции.
Слайд 3
Принимают участие в свёртывании крови.
Участвуют в транспортировке газов. Газы траспортируются белком гемоглобином, который содержится в эритроцитах.
Слайд 4
Также белки выполняют структурно−пластическую и опорную функции. Белки входят в состав мембран.
Слайд 5
Энергетическая функция.
2. Используя ресурсы Интернета, подготовьте презентацию о значении денатурации белков для живых организмов.
Ответ:
Презентация "Значение денатурации белков для живых организмов"
Слайд 1
Белки – это высокомолекулярные органические соединения, которые состоят из углерода, водорода, кислорода, серы и азота. В состав некоторых белков входит фосфор, а также катионы металлов. Белки являются биополимерами, которые состоят из мономеров аминокислот.
Слайд 2
Структуры белков:
1) Первичная структура — последовательность аминокислотных звеньев в полипептидной цепи.
2) Вторичная структура – спиральная структура полипептидной цепи, закрепленная водородными связями между группами N−H и С=О.
3) Третичная структура – определенная форма спирали в пространстве, образованная с помощью дисульфидных мостиков −S−S−, водородных связей и других взаимодействий.
4) Четвертичной структурой обладают белки, состоящие из нескольких полипептидных цепей, ковалентно не связанных друг с другом. Их называют олигомерными белками.
Слайд 3
Денатурация — это разрушение характерной для данного белка четвертичной, третичной и вторичной структуры, в результате чего в денатурированном состоянии полипептидные цепи белков образуют случайные и беспорядочные клубки и петли.
Слайд 4
Денатурация заключается в лишении естественных свойств белка.
Слайд 5
Значение белков
Белок является важным компонентом каждой клетки в организме. Также белок используется организмом для создания и восстановления тканей, производства ферментов, гормонов и других химических веществ, необходимых для нормальной жизнедеятельности организма.
?
1. Какие функциональные группы вы знаете? Принадлежность к каким классам органических веществ определяют эти функциональные группы? Какие функциональные группы содержатся в молекулах аминокислот?
Ответ:
Функциональные группы:
1) Карбоксильная: $-COOH$
2) Амино группа: $-NH_{2}$
Карбоксильнпя группа определяет карбоновые кислоты, амино группа − амины.
В молекулах аминокислот содержится и карбоксильная, и амино группы.2. Охарактеризуйте биологические функции белков на основе знаний из курса биологии.
Ответ:
Функции белков:
1) Ферменты;
2) Принимают участие в свёртывании крови;
3) Участвуют в транспортировке газов;
4) Структурно−пластическая функция;
5) Опорная функция;
6) Энергетическая функция.3. Как доказать, что грива игрушечного льва или лошадки не натуральная, а синтетическая? Как можно обнаружить наличие белка в рыбном или мясном бульоне?
Ответ:
В натуральном волосе содержится белок.
Содержание белка и волосе, и в бульоне можно обнаружить с помощью биуретовой или ксантопротеиновой реакции.
Биуретовая реакция. Если к раствору белка (например, яичного) прилить немного щелочи и добавить несколько капель раствора меди (II), то появится фиолетовое окрашивание.
Ксантопротеиновая реакция. При нагревании раствора белка с концентрированной азотной кислотой появится желтое окрашивание, которое переходит в оранжевое при добавлении раствора аммиака.4. Описывая внешность Шерлока Холмса, А. Конан Дойл упоминает «чёрные пятна от азотной кислоты» на пальцах знаменитого сыщика. Какую химическую ошибку допустил писатель?
Ответ:
Ошибка писателя заключается в том, что от азотной кислоты появляются желтые, а не черные пятна.
5. Охарактеризуйте белковый обмен в клетках и тканях, опираясь на знания из курса биологии.
Ответ:
Пищевые белки в ходе подготовительной стадии обмена расщепляются сначала в желудке пепсином, а затем в двенадцатиперстной кишке ферментом поджелудочной железы трипсином до аминокислот. Аминокислоты через кровеносные капилляры ворсинок поступают в печень. Здесь избыточные аминокислоты теряют свой азот и превращаются в жиры и углеводы. В клетках из аминокислот строятся белки тела.
§38
-
§38. Химическое загрязнение окружающей среды и его последствия
i
1. Используя ресурсы Интернета, подготовьте презентацию об основных источниках химического загрязнения окружающей среды.
Ответ:
Основные источники загрязнения окружающей среды

Химия разрабатывает и внедряет методы и технологии защиты окружающей среды от отрицательных последствий химического производства. Уже сейчас широко используются упаковки из «умных» полимеров, которые под действием влаги и воздуха разлагаются на нетоксичные продукты, создаются эффективные технологии очистки производственных стоков и выбросов, а промышленные отходы перерабатываются.
Чтобы минимизировать загрязнение атмосферы, учёными, технологами, экологами разрабатываются мероприятия, включающие:
1) очистку выбросов в атмосферу от твердых и газообразных загрязняющих веществ с помощью электрофильтров, жидких и твердых поглотителей: использование экологически чистых видов энергии (энергия Солнца, ветра, мореких приливов);
2) применение малоотходных и безотходных промышленных технологий;
3) уменьшение токсичности автомобильных выхлопных газов путём совершенствования конструкции.
2. Используя ресурсы Интернета, подготовьте презентацию о способах предотвращения глобального потепления климата Земли.
Ответ:
Презентация "Способы предотвращения глобального потепления климата Земли"
Слайд 1
Снизить количество выбрасываемых в атмосферу вредных веществ
Слайд 2
Перейти на виды топлива, являющиеся экологически чистыми
Слайд 3
Замена автомобилей, работающих на бензине, электромобилями
Слайд 4
Сократить использование АЭС и ГЭС при помощи ветряных мельниц и солнечных батарей
Слайд 5
Сохранение и приумножение лесных массивов
?
1. Что такое парниковый эффект? Почему он возникает? Перечислите парниковые газы.
Ответ:
Суть парникового эффекта состоит в том, что накопление в атмосфере парниковых газов: оксида углерода (IV), оксидов азота, метана, паров воды, фреонов (хладагентов), способных пропускать солнечные лучи и задерживать тепловое излучение от поверхности Земли, приводит к накоплению избыточной теплоты в приземном слое воздуха, нарушая тем самым тепловой баланс планеты.
2. Что такое озоновый слой? Какова его биологическая роль?
Ответ:
Озоновый слой защищает Землю от ультрафиолетового излучения Солнца. Его более точно и значимо называют озоновым щитом планеты.
Озон образуется в стратосфере под влиянием ультрафиолетового излучения Солнца.3. Назовите причины разрушения озонового щита планеты. Каковы его последствия? Как их избежать?
Ответ:
Главная причина разрушения озонового слоя – это деятельность человека. Основной вредитель защиты всего живого от ультрафиолета – это фреоны. Эти вещества применяются для производства хладагентов, аэрозолей, растворителей.
Озон задерживает значительную часть вредного и убийственного ультрафиолета, поступающего от Солнца. При этом страдает все живое на планете.
Последствия разрушения озонового слоя катастрофичны. Резкое снижение количества озона или его полное отсутствие сделали бы жизнь на планете невозможной.
Способы защиты озонового слоя:
1) отказ от применения фреонов;
2) разработка озонобезопасных технологий в холодильной промышленности;
3) искусственное создание или получение озона и заполнение образовавшихся дыр.4. Перечислите акты международного сотрудничества в сфере охраны окружающей среды.
Ответ:
В 1985 г была принята Венская конвекция об охране озонового слоя; а в 1987 г − Монреальский протокол, определяющий список самых опасных веществ, разрушающих озоновый слой.
5. Назовите источники химического загрязнения в вашей местности и предложите меры по минимизации ущерба природе.
Ответ:
Химия разрабатывает и внедряет методы и технологии защиты окружающей среды от отрицательных последствий химического производства. Уже сейчас широко используются упаковки из «умных» полимеров, которые под действием влаги и воздуха разлагаются на нетоксичные продукты, создаются эффективные технологии очистки производственных стоков и выбросов, а промышленные отходы перерабатываются.
Чтобы минимизировать загрязнение атмосферы, учёными, технологами, экологами разрабатываются мероприятия, включающие:
1) очистку выбросов в атмосферу от твердых и газообразных загрязняющих веществ с помощью электрофильтров, жидких и твердых поглотителей: использование экологически чистых видов энергии (энергия Солнца, ветра, морских приливов);
2) применение малоотходных и безотходных промышленных технологий;
3) уменьшение токсичности автомобильных выхлопных газов путём совершенствования конструкции.Темы для дискуссии
1. В чём сходство и различия между природными, искусственными и синтетическими органическими веществами?
Ответ:
Природные органические соединения − это продукты жизнедеятельности живых организмов. Это такие соединения, как белки, жиры, углеводы, витамины.
Искусственные органические вещества − это продукты химической модификации природных органических соединений, в результате которой происходит изменение состава и строения исходного вещества с целью придания ему требуемых свойств.
Синтетические органические соединения получают синтетическим путём с помощью химических превращений. К ним относятся синтетические каучуки, пластмассы, лекарственные препараты.
Различия:
1) Природные полимеры − это полимерные соединения, которые встречаются в нашей окружающей среде, а синтетические полимеры − это полимерные соединения, которые отсутствуют в природе и производятся искусственно.
2) Синтетические полимеры представляют собой полимерные соединения, которые производятся путем синтеза. В этом основное отличие натуральных полимеров от синтетических.
Сходство:
Все полимеры благодаря ценным свойствам, применяются в машиностроении, текстильной промышленности, сельском хозяйстве, медицине, судостроении, авиастроении и в быту.2. Докажите исключительную роль органических веществ в возникновении жизни и функционировании живых организмов.
Ответ:
Органические вещества играют огромую роль в происхождении живых организмов. Эти вещества могли быть созданы на ранних стадиях Земли, когда атмосфера была богата метаном, аммиаком и водяным паром. Согласно одной из гипотез, жизнь могла возникнуть благодаря химической эволюции. Она предполагает, что органические молекулы начали соединятся и образовывать все более сложные структуры, пока не появились первые живые организмы.
Органические вещества выполняют важные функции в организме: участвуют в построении клеток и тел организмов; являются запасными веществами, например, жиры; участвуют в транспорте газов, например, белок гемоглобин; регулируют функции организма (гормоны).3. Укажите положительный эффект и возможные отрицательные последствия использования альтернативных видов топлива.
Ответ:
Преимущества использования альтернативных видов топлива:
1) Снижение выбросов углекислого газа.
2) Сохранение запасов ископаемого топлива.
3) Такие виды топлива биоразлагаемы.
4) Такие виды топлива экономичны.
Недостатки использования альтернативных видов топлива:
1) Загрязняющие вещества.
2) Воздействие на пищу. Поскольку они производятся во многих случаях из зерна, которое также используется в пищевом производстве.
3) Вырубка деревьев. Вырубка лесов может быть одним из эффектов, вызванных этим видом топлива. §39
-
ГЛАВА ПЯТАЯ. Обобщение знаний по химии за курс основной школы
§39. Периодическая система Д.И.Менделеева и строение атома
?
1. Номер периода в Периодической системе Д. И. Менделеева соответствует
1) числу энергетических уровней в атоме
2) числу валентных электронов в атоме
3) числу неспаренных электронов в атоме
4) общему числу электронов в атомеОтвет:
Номер периода в Периодической системе Д. И. Менделеева соответствует
1) числу энергетических уровней в атоме
2) числу валентных электронов в атоме
3) числу неспаренных электронов в атоме
4) общему числу электронов в атоме
Ответ: 1.
Номер периода в Периодической системе Д. И. Менделеева соответствует числу энергетических уровней в атоме.2. Число электронов в электронной оболочке атома определяется
1) числом протонов
2) числом нейтронов
3) числом энергетических уровней
4) величиной относительной атомной массыОтвет:
Число электронов в электронной оболочке атома определяется
1) числом протонов
2) числом нейтронов
3) числом энергетических уровней
4) величиной относительной атомной массы
Ответ: 1.
Число электронов в электронной оболочке атома определяется числом протонов.3. В ряду химических элементов кремний ⟶ фосфор ⟶ сера уменьшается:
1) способность атома принимать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атомаОтвет:
В ряду химических элементов кремний ⟶ фосфор ⟶ сера уменьшается:
1) способность атома принимать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
Ответ: 4.
В ряду химических элементов кремний ⟶ фосфор ⟶ сера уменьшается радиус атома.4. У элементов А групп с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательностьОтвет:
У элементов А групп с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
Ответ: 4.
У элементов А групп с увеличением атомного номера уменьшается электроотрицательность.5. В главных подгруппах Периодической системы Д. И. Менделеева снизу вверх основные свойства гидроксидов металлов
1) увеличиваются
2) уменьшаются
3) не изменяются
4) изменяются периодическиОтвет:
В главных подгруппах Периодической системы Д. И. Менделеева снизу вверх основные свойства гидроксидов металлов
1) увеличиваются
2) уменьшаются
3) не изменяются
4) изменяются периодически
Ответ: 2.
В главных подгруппах Периодической системы Д. И. Менделеева снизу вверх основные свойства гидроксидов металлов уменьшаются.6. Среди элементов IVА группы максимальный радиус атома имеет
1) германий
2) углерод
3) олово
4) кремнийОтвет:
Среди элементов IVА группы максимальный радиус атома имеет
1) германий
2) углерод
3) олово
4) кремний
Ответ: 3.
Среди элементов IVА группы максимальный радиус атома имеет олово.7. Наиболее выражены металлические свойства у элемента
1) Na
2) Mg
3) K
4) CaОтвет:
Наиболее выражены металлические свойства у элемента
1) Na
2) Mg
3) K
4) Ca
Ответ: 3.
Наиболее выражены металлические свойства у элемента K.8. Менее выраженные неметаллические свойства, чем кремний, имеет элемент
1) углерод
2) германий
3) фосфор
4) азотОтвет:
Менее выраженные неметаллические свойства, чем кремний, имеет элемент
1) углерод
2) германий
3) фосфор
4) азот
Ответ: 2.
Менее выраженные неметаллические свойства, чем кремний, имеет элемент германий.9. Наиболее сильное основание соответствует элементу
1) Mg
2) K
3) Li
4) BaОтвет:
Наиболее сильное основание соответствует элементу
1) Mg
2) K
3) Li
4) Ba
Ответ: 2.
Наиболее сильное основание соответствует элементу K.10. Кислотные свойства оксидов в ряду
$N_{2}O_{5}$ ⟶ $P_{2}O_{5}$ ⟶ $As_{2}O_{5}$ ⟶ $Sb_{2}O_{5}$
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодическиОтвет:
Кислотные свойства оксидов в ряду
$N_{2}O_{5}$ ⟶ $P_{2}O_{5}$ ⟶ $As_{2}O_{5}$ ⟶ $Sb_{2}O_{5}$
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
Ответ: 1.
Кислотные свойства оксидов в ряду
$N_{2}O_{5}$ ⟶ $P_{2}O_{5}$ ⟶ $As_{2}O_{5}$ ⟶ $Sb_{2}O_{5}$ ослабевают. §40
-
§40. Электроотрицательность. Степень окисления. Строение вещества
?
1. Степень окисления +5 азот проявляет в соединении, формула которого
1) $N_{2}O_{5}$
2) NO
3) $N_{2}O_{4}$
4) $N_{2}O$Ответ:
Степень окисления +5 азот проявляет в соединении, формула которого
1) $N_{2}O_{5}$
2) NO
3) $N_{2}O_{4}$
4) $N_{2}O$
Ответ: 1.
Степень окисления +5 азот проявляет в соединении, формула которого $N_{2}O_{5}$.2. Степень окисления хрома в соединении, формула которого $(NH_{4})_{2}Cr_{2}O_{7}$, равна
1) +7
2) +2
3) +6
4) +5Ответ:
Степень окисления хрома в соединении, формула которого $(NH_{4})_{2}Cr_{2}O_{7}$, равна
1) +7
2) +2
3) +6
4) +5
Ответ: 3.
Степень окисления хрома в соединении, формула которого $(NH_{4})_{2}Cr_{2}O_{7}$, равна +6.3. Степень окисления азота уменьшается в ряду веществ, формулы которых
1) $NH_{3}, NO_{2}, КNO_{3}$
2) $N_{2}O_{4}, KNO_{2}, NH_{4}Cl$
3) $N_{2}, N_{2}O, NH_{3}$
4) $HNO_{3}, HNO_{2}, NO_{2}$Ответ:
Степень окисления азота уменьшается в ряду веществ, формулы которых
1) $NH_{3}, NO_{2}, КNO_{3}$
2) $N_{2}O_{4}, KNO_{2}, NH_{4}Cl$
3) $N_{2}, N_{2}O, NH_{3}$
4) $HNO_{3}, HNO_{2}, NO_{2}$
Ответ: 2.
Степень окисления азота уменьшается в ряду веществ, формулы которых $N_{2}O_{4}, KNO_{2}, NH_{4}Cl$.
1) $N^{-3}H_{3}, N^{+4}O_{2}, КN^{+5}O_{3}$
2) $N^{+4}_{2}O_{4}, KN^{+4}O_{2}, N^{-3}H_{4}Cl$
3) $N^{0}_{2}, N^{+1}_{2}O, N^{-3}H_{3}$
4) $HN^{+5}O_{3}, HN^{+3}O_{2}, N^{+4}O_{2}$4. Степень окисления хлора увеличивается в ряду веществ, формулы которых
1) $HClO, HClO_{4}, KClO_{3}$
2) $Cl_{2}, Cl_{2}O_{7}, KClO_{3}$
3) $Ca(ClO)_{2}, KClO_{3}, HClO_{4}$
4) $KCl, KClO_{3}, KClO$Ответ:
Степень окисления хлора увеличивается в ряду веществ, формулы которых
1) $HClO, HClO_{4}, KClO_{3}$
2) $Cl_{2}, Cl_{2}O_{7}, KClO_{3}$
3) $Ca(ClO)_{2}, KClO_{3}, HClO_{4}$
4) $KCl, KClO_{3}, KClO$
Ответ: 3.
Степень окисления хлора увеличивается в ряду веществ, формулы которых
$Ca(ClO)_{2}, KClO_{3}, HClO_{4}$.
1) $HCl^{+1}O, HCl^{+3}O_{4}, KCl^{+5}O_{3}$
2) $Cl^{0}_{2}, Cl^{+7}_{2}O_{7}, KCl^{+5}O_{3}$
3) $Ca(Cl^{+1}O)_{2}, KCl^{+5}O_{3}, HCl^{+7}O_{4}$
4) $KCl^{-1}, KCl^{+5}O_{3}, KCl^{+1}O$5. Наиболее полярна химическая связь в молекуле
1) аммиака
2) сероводорода
3) бромоводорода
4) фтороводородаОтвет:
Наиболее полярна химическая связь в молекуле
1) аммиака
2) сероводорода
3) бромоводорода
4) фтороводорода
Ответ: 4.
Наиболее полярна химическая связь в молекуле фтороводорода.6. Вещество с ковалентной неполярной связью
1) белый фосфор
2) фосфид алюминия
3) хлорид фосфора (V)
4) фосфат кальцияОтвет:
Вещество с ковалентной неполярной связью
1) белый фосфор
2) фосфид алюминия
3) хлорид фосфора (V)
4) фосфат кальция
Ответ: 1.
Вещество с ковалентной неполярной связью белый фосфор.7. Формулы веществ только с ионной связью записаны в ряду
1) хлорид натрия, хлорид фосфора (V), фосфат натрия
2) оксид натрия, гидроксид натрия, пероксид натрия
3) сероуглерод, карбид кальция, оксид кальция
4) фторид кальция, оксид кальция, хлорид кальцияОтвет:
Формулы веществ только с ионной связью записаны в ряду
1) хлорид натрия, хлорид фосфора (V), фосфат натрия
2) оксид натрия, гидроксид натрия, пероксид натрия
3) сероуглерод, карбид кальция, оксид кальция
4) фторид кальция, оксид кальция, хлорид кальция
Ответ: 4.
Формулы веществ только с ионной связью записаны в ряду фторид кальция, оксид кальция, хлорид кальция.
1) хлорид фосфора (V) имеет ковалентную связь;
2) гидроксид натрия и пероксид натрия содержат ковалентную связь;
3) сероуглерод имеет ковалентную связь;
4) все вещества только с ионной связью.8. Атомную кристаллическую решётку имеет
1) оксид натрия
2) оксид кальция
3) оксид серы (IV)
4) оксид алюминияОтвет:
Атомную кристаллическую решётку имеет
1) оксид натрия
2) оксид кальция
3) оксид серы (IV)
4) оксид алюминия
Ответ: 4.
Атомную кристаллическую решётку имеет оксид алюминия.9. Соединение с ионной кристаллической решёткой образуется при взаимодействии хлора с
1) фосфором
2) барием
3) водородом
4) серойОтвет:
Соединение с ионной кристаллической решёткой образуется при взаимодействии хлора с
1) фосфором
2) барием
3) водородом
4) серой
Ответ: 2.
Соединение с ионной кристаллической решёткой образуется при взаимодействии хлора с барием.10. Верны ли следующие суждения о хлориде аммония?
А. Хлорид аммония – вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей.
Б. Хлорид аммония – вещество ионного строения, а потому твёрдое, тугоплавкое и нелетучее.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны.Ответ:
Верны ли следующие суждения о хлориде аммония?
А. Хлорид аммония – вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей.
Б. Хлорид аммония – вещество ионного строения, а потому твёрдое, тугоплавкое и нелетучее.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны.
Ответ: 1.
Хлорид аммония – вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей. §41
-
§41. Классификация химических реакций. Скорость химической реакции
?
1. Взаимодействие алюминия с оксидом хрома (III) – это реакция
1) замещения
2) присоединения
3) разложения
4) обменаОтвет:
Взаимодействие алюминия с оксидом хрома (III) – это реакция
1) замещения
2) присоединения
3) разложения
4) обмена
Ответ: 1.
Взаимодействие алюминия с оксидом хрома (III) – это реакция замещения:
$2Al + Cr_{2}O_{3} = 2Cr + Al_{2}O_{3}$2. При сливании растворов иодида калия и нитрата свинца (II) протекает реакция
1) замещения
2) присоединения
3) разложения
4) обменаОтвет:
При сливании растворов иодида калия и нитрата свинца (II) протекает реакция
1) замещения
2) присоединения
3) разложения
4) обмена
Ответ: 4.
При сливании растворов иодида калия и нитрата свинца (II) протекает реакция обмена:
$Pb(NO_{3})_{2} + 2KI = PbI_{2} + 2KNO_{3}$.3. Хлор вступает в реакцию замещения с
1) хлоридом железа (II)
2) бромидом калия
3) оксидом углерода (II)
4) гидроксидом натрияОтвет:
Хлор вступает в реакцию замещения с
1) хлоридом железа (II)
2) бромидом калия
3) оксидом углерода (II)
4) гидроксидом натрия
Ответ: 2.
Хлор вступает в реакцию замещения с бромидом калия:
$2KBr + Cl_{2} = 2KCl + Br_{2}$4. Не является окислительно−восстановительной реакция, схема которой
1) $(CuOH)_{2}CO_{2} ⟶ CuO + H_{2}O + CO_{2}↑$
2) $KMnO_{4} ⟶ K_{2}MnO_{4} + O_{2}↑ + MnO_{2}$
3) $KClO_{3} ⟶ KCl + O_{2}↑$
4) $NH_{4}NO_{2} ⟶ N_{2}O + H_{2}O$Ответ:
Не является окислительно−восстановительной реакция, схема которой
1) $(CuOH)_{2}CO_{2} ⟶ CuO + H_{2}O + CO_{2}↑$
2) $KMnO_{4} ⟶ K_{2}MnO_{4} + O_{2}↑ + MnO_{2}$
3) $KClO_{3} ⟶ KCl + O_{2}↑$
4) $NH_{4}NO_{2} ⟶ N_{2}O + H_{2}O$
Ответ: 1.
Не является окислительно−восстановительной реакция, схема которой
$(CuOH)_{2}CO_{2} ⟶ CuO + H_{2}O + CO_{2}↑$5. Окислительно−восстановительная реакция лежит в основе получения
1) сульфата аммония из аммиака и серной кислоты
2) кислорода разложением пероксида водорода
3) оксида бария разложением карбоната бария
4) гидроксида кальция из оксида кальцияОтвет:
Окислительно−восстановительная реакция лежит в основе получения
1) сульфата аммония из аммиака и серной кислоты
2) кислорода разложением пероксида водорода
3) оксида бария разложением карбоната бария
4) гидроксида кальция из оксида кальция
Ответ: 2.
Окислительно−восстановительная реакция лежит в основе получения кислорода разложением пероксида водорода.6. Эндотермическим процессом является
1) нейтрализация серной кислоты гидроксидом натрия
2) горение серы
3) разложение гидроксида кальция
4) взаимодействие алюминия с бромомОтвет:
Эндотермическим процессом является
1) нейтрализация серной кислоты гидроксидом натрия
2) горение серы
3) разложение гидроксида кальция
4) взаимодействие алюминия с бромом
Ответ: 3.
Эндотермическим процессом является разложение гидроксида кальция.7. К реакциям обмена относится взаимодействие между
1) оксидом меди (II) и соляной кислотой
2) оксидом натрия и водой
3) оксидом углерода (IV) и магнием
4) оксидом серы (VI) и оксидом цинкаОтвет:
К реакциям обмена относится взаимодействие между
1) оксидом меди (II) и соляной кислотой
2) оксидом натрия и водой
3) оксидом углерода (IV) и магнием
4) оксидом серы (VI) и оксидом цинка
Ответ: 1.
К реакциям обмена относится взаимодействие между оксидом меди (II) и соляной кислотой:
$CuO + 2HCl = CuCl_{2} + H_{2}O$8. Окислительно−восстановительной является реакция, схема которой
1) $CuO + H_{2}SO_{4} ⟶ CuSO_{4} + H_{2}O$
2) $FeO + HNO_{3} ⟶ Fe(NO_{3})_{3} + NO + H_{2}O$
3) $NaHSO_{4} + NaOH ⟶ Na_{2}SO_{4} + H_{2}O$
4) $NH_{4}HCO_{3} ⟶ NH_{3} + CO_{2} + H_{2}O$Ответ:
Окислительно−восстановительной является реакция, схема которой
1) $CuO + H_{2}SO_{4} ⟶ CuSO_{4} + H_{2}O$
2) $FeO + HNO_{3} ⟶ Fe(NO_{3})_{3} + NO + H_{2}O$
3) $NaHSO_{4} + NaOH ⟶ Na_{2}SO_{4} + H_{2}O$
4) $NH_{4}HCO_{3} ⟶ NH_{3} + CO_{2} + H_{2}O$
Ответ: 2.
Окислительно−восстановительной является реакция, схема которой
$FeO + HNO_{3} ⟶ Fe(NO_{3})_{3} + NO + H_{2}O$9. Скорость реакции разложения пероксида водорода увеличится при
1) разбавлении раствора
2) увеличении давления
3) внесении катализатора
4) охлаждении раствораОтвет:
Скорость реакции разложения пероксида водорода увеличится при
1) разбавлении раствора
2) увеличении давления
3) внесении катализатора
4) охлаждении раствора
Ответ: 3.
Скорость реакции разложения пероксида водорода увеличится при внесении катализатора.10. Ингибитор — это вещество, которое
1) ускоряет химическую реакцию
2) замедляет химическую реакцию
3) усиливает действие катализатора
4) нейтрализует каталитические ядыОтвет:
Ингибитор — это вещество, которое
1) ускоряет химическую реакцию
2) замедляет химическую реакцию
3) усиливает действие катализатора
4) нейтрализует каталитические яды
Ответ: 2.
Ингибитор — это вещество, которое замедляет химическую реакцию. §42
-
§42. Диссоциация электролитов в водных растворах. Ионные уравнения реакций
?
1. К сильным электролитам относится кислота
1) угольная
2) серная
3) сернистая
4) фосфорнаяОтвет:
К сильным электролитам относится кислота
1) угольная
2) серная
3) сернистая
4) фосфорная
Ответ: 2.
К сильным электролитам относится серная кислота.2. Только сильные электролиты перечислены в ряду
1) гидроксид натрия, азотная кислота, хлорид магния
2) оксид серы (IV), серная кислота, сульфат аммония
3) гидроксид калия, азотистая кислота, нитрат алюминия
4) гидрат аммиака, соляная кислота, иодид калияОтвет:
Только сильные электролиты перечислены в ряду
1) гидроксид натрия, азотная кислота, хлорид магния
2) оксид серы (IV), серная кислота, сульфат аммония
3) гидроксид калия, азотистая кислота, нитрат алюминия
4) гидрат аммиака, соляная кислота, иодид калия
Ответ: 1.
Только сильные электролиты перечислены в ряду: гидроксид натрия, азотная кислота, хлорид магния.
2) оксид серы (IV) − слабый электролит
3) азотистая кислота − слабый электролит
4) гидрат аммиака − слабый электролит3. Наибольшее количество хлорид−ионов образуется при диссоциации 1 моль
1) соляной кислоты
2) хлорида калия
3) хлорида цинка
4) хлорида алюминияОтвет:
Наибольшее количество хлорид−ионов образуется при диссоциации 1 моль
1) соляной кислоты
2) хлорида калия
3) хлорида цинка
4) хлорида алюминия
Ответ: 4.
Наибольшее количество хлорид−ионов образуется при диссоциации 1 моль хлорида алюминия.4. Сокращённому ионному уравнению $Cu^{2+} + 2OH^{-} = Cu(OH)_{2}$ соответствует взаимодействие
1) нитрата меди (II) с гидроксидом магния
2) оксида меди (II) с гидроксидом калия
3) хлорида меди (II) с гидроксидом натрия
4) гидроксокарбоната меди (II) с гидроксидом натрияОтвет:
Сокращённому ионному уравнению $Cu^{2+} + 2OH^{-} = Cu(OH)_{2}$ соответствует взаимодействие
1) нитрата меди (II) с гидроксидом магния
2) оксида меди (II) с гидроксидом калия
3) хлорида меди (II) с гидроксидом натрия
4) гидроксокарбоната меди (II) с гидроксидом натрия
Ответ: 3.
Сокращённому ионному уравнению $Cu^{2+} + 2OH^{-} = Cu(OH)_{2}$ соответствует взаимодействие хлорида меди (II) с гидроксидом натрия.5. В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого
1) $NH_{4}NO_{3}$
2) $CH_{3}COOH$
3) $KHSO_{4}$
4) $NH_{4}H_{2}PO_{4}$Ответ:
В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого
1) $NH_{4}NO_{3}$
2) $CH_{3}COOH$
3) $KHSO_{4}$
4) $NH_{4}H_{2}PO_{4}$
Ответ: 2.
В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого $CH_{3}COOH$.6. Наибольшее число ионов в растворе образуется при диссоциации 1 моль
1) хлорида железа (III)
2) сульфата алюминия
3) нитрата цинка
4) хлорида аммонияОтвет:
Наибольшее число ионов в растворе образуется при диссоциации 1 моль
1) хлорида железа (III)
2) сульфата алюминия
3) нитрата цинка
4) хлорида аммония
Ответ: 2.
Наибольшее число ионов в растворе образуется при диссоциации 1 моль сульфата алюминия.7. Взаимодействию гидроксида железа (III) с соляной кислотой соответствует ионная реакция
1) $Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
2) $Fe_{2}O_{3} + 6H^{+} = 2Fe^{3+} + 3H_{2}O$
3) $2Fe + 6H^{+} = 2Fe^{3+} + 3H_{2}$
4) $Fe^{3+} 3OH^{-} = Fe(OH)_{3}$Ответ:
Взаимодействию гидроксида железа (III) с соляной кислотой соответствует ионная реакция
1) $Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$
2) $Fe_{2}O_{3} + 6H^{+} = 2Fe^{3+} + 3H_{2}O$
3) $2Fe + 6H^{+} = 2Fe^{3+} + 3H_{2}$
4) $Fe^{3+} 3OH^{-} = Fe(OH)_ {3}$
Ответ: 1.
Взаимодействию гидроксида железа (III) с соляной кислотой соответствует ионная реакция:
$Fe(OH)_{3} + 3H^{+} = Fe^{3+} + 3H_{2}O$.8. Ионному уравнению $Ca^{2+} + 2OH^{-} + CO_{2} = CaCO_{3} + H_{2}O$ соответствует взаимодействие
1) раствора гидроксида кальции с угарным газом
2) оксида кальция с углекислым газом
3) кальция с углекислым газом
4) раствора гидроксида кальция с углекислым газомОтвет:
Ионному уравнению $Ca^{2+} + 2OH^{-} + CO_{2} = CaCO_{3} + H_{2}O$ соответствует взаимодействие
1) раствора гидроксида кальции с угарным газом
2) оксида кальция с углекислым газом
3) кальция с углекислым газом
4) раствора гидроксида кальция с углекислым газом
Ответ: 4.
Ионному уравнению $Ca^{2+} + 2OH^{-} + CO_{2} = CaCO_{3} + H_{2}O$ соответствует взаимодействие раствора гидроксида кальция с углекислым газом.9. Осадок образуется при сливании водных растворов
1) гидроксида натрия и хлорида лития
2) сульфата меди (II) и азотной кислоты
3) хлорида железа (III) и нитрат цинка
4) сульфата никеля и нитрата калияОтвет:
Нет правильного ответа. Так как осадка не образуется ни в одной реакции, реакции не осуществимы.
1) $NaOH + LiCl$ ≠
2) $CuSO_{4} + HNO_{3}$ ≠
3) $FeCl_{3} + Zn(NO_{3})_{2}$ ≠
4) $NiSO_{4} + KNO_{3}$ ≠10. Выделение газа происходит при взаимодействии веществ, формулы которых
1) $BaCO_{3}$ и HCl
2) $Ca(OH)_{2}$ и $Na_{2}CO_{3}$
3) CuO и $H_{2}SO_{4}$
4) $Al(OH)_{3}$ и KOHОтвет:
Выделение газа происходит при взаимодействии веществ, формулы которых
1) $BaCO_{3}$ и HCl
2) $Ca(OH)_{2}$ и $Na_{2}CO_{3}$
3) CuO и $H_{2}SO_{4}$
4) $Al(OH)_{3}$ и KOH
Ответ: 1.
Выделение газа происходит при взаимодействии веществ, формулы которых $BaCO_{3}$ и HCl.
$BaCO_{3} + 2HCl = BaCl_{2} + CO_{2} + H_{2}O$ §43
-
§43. Окислительно-восстановительные реакции
?
1. Не является окислительно−восстановительной реакция, схема которой
1) $NaHSO_{3} + NaOH ⟶ Na_{2}SO_{3} + H_{2}O$
2) $H_{2}S + H_{2}SO_{4} ⟶ SO_{2} + S + H_{2}O$
3) $NaBr + NaBrO_{3} + H_{2}SO_{4} ⟶ Na_{2}SO_{4} + Br_{2} + H_{2}O$
4) $H_{2}S + HNO_{3} ⟶ H_{2}SO_{4} + NO + H_{2}O$Ответ:
Не является окислительно−восстановительной реакция, схема которой
1) $NaHSO_{3} + NaOH ⟶ Na_{2}SO_{3} + H_{2}O$
2) $H_{2}S + H_{2}SO_{4} ⟶ SO_{2} + S + H_{2}O$
3) $NaBr + NaBrO_{3} + H_{2}SO_{4} ⟶ Na_{2}SO_{4} + Br_{2} + H_{2}O$
4) $H_{2}S + HNO_{3} ⟶ H_{2}SO_{4} + NO + H_{2}O$
Ответ: 1.
Не является окислительно−восстановительной реакция, схема которой:
$NaHSO_{3} + NaOH ⟶ Na_{2}SO_{3} + H_{2}O$.2. Только восстановительные свойства проявляет вещество, формула которого
1) $SO_{2}$
2) HCl
3) $H_{2}$
4) $Na_{2}S$Ответ:
Только восстановительные свойства проявляет вещество, формула которого
1) $SO_{2}$
2) HCl
3) $H_{2}$
4) $Na_{2}S$
Ответ: 4.
Только восстановительные свойства проявляет вещество, формула которого $Na_{2}S$.3. Только окислительные свойства проявляет вещество, формула которого
1) $I_{2}$
2) $F_{2}$
3) $H_{2}$
4) $N_{2}$Ответ:
Только окислительные свойства проявляет вещество, формула которого
1) $I_{2}$
2) $F_{2}$
3) $H_{2}$
4) $N_{2}$
Ответ: 2.
Только окислительные свойства проявляет вещество, формула которого $F_{2}$.4. Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
1) $2HCl + Zn = ZnCl_{2} + H_{2}$
2) $2Na_{2}S + Na_{2}SO_{3} + 6HCl = 6NaCl + 3S + 3H_{2}O$
3) $6HCl + 2Al = 2AlCl_{3} + 3H_{2}$
4) $4HCl + MnO_{2} = MnCl_{2} + Cl_{2} + 2H_{2}O$Ответ:
Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
1) $2HCl + Zn = ZnCl_{2} + H_{2}$
2) $2Na_{2}S + Na_{2}SO_{3} + 6HCl = 6NaCl + 3S + 3H_{2}O$
3) $6HCl + 2Al = 2AlCl_{3} + 3H_{2}$
4) $4HCl + MnO_{2} = MnCl_{2} + Cl_{2} + 2H_{2}O$
Ответ: 4.
Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
$4HCl + MnO_{2} = MnCl_{2} + Cl_{2} + 2H_{2}O$.5. Процессу последовательного восстановления соответствует цепочка
1) $(NH_{4})_{2}CrO_{4}$ ⟶ $(NH_{4})_{2}Cr_{2}O_{7}$ ⟶ $Cr_{2}O_{3}$
2) $HNO_{3}$ ⟶ NO ⟶ $NO_{2}$
3) $CO_{2}$ ⟶ CO ⟶ $CH_{4}$
4) HBr ⟶ $Br_{2}$ ⟶ $KBrO_{3}$Ответ:
Процессу последовательного восстановления соответствует цепочка
1) $(NH_{4})_{2}CrO_{4}$ ⟶ $(NH_{4})_{2}Cr_{2}O_{7}$ ⟶ $Cr_{2}O_{3}$
2) $HNO_{3}$ ⟶ NO ⟶ $NO_{2}$
3) $CO_{2}$ ⟶ CO ⟶ $CH_{4}$
4) HBr ⟶ $Br_{2}$ ⟶ $KBrO_{3}$
Ответ: 3.
Процессу последовательного восстановления соответствует цепочка $CO_{2}$ ⟶ CO ⟶ $CH_{4}$.6. Пероксид водорода проявляет окислительные свойства в реакции, схема которой
1) $H_{2}O_{2} + KClO_{3} ⟶ KCl + H_{2}O + O_{2}$
2) $H_{2}O_{2} + Ag_{2}O ⟶ Ag + O_{2} + H_{2}O$
3) $H_{2}O_{2} + Cl_{2} ⟶ HCl + O_{2}$
4) $H_{2}O_{2} + Fe(OH)_{2} ⟶ FeO(OH) + H_{2}O$Ответ:
Пероксид водорода проявляет окислительные свойства в реакции, схема которой
1) $H_{2}O_{2} + KClO_{3} ⟶ KCl + H_{2}O + O_{2}$
2) $H_{2}O_{2} + Ag_{2}O ⟶ Ag + O_{2} + H_{2}O$
3) $H_{2}O_{2} + Cl_{2} ⟶ HCl + O_{2}$
4) $H_{2}O_{2} + Fe(OH)_{2} ⟶ FeO(OH) + H_{2}O$
Ответ: 4.
Пероксид водорода проявляет окислительные свойства в реакции, схема которой
$H_{2}O_{2} + Fe(OH)_{2} ⟶ FeO(OH) + H_{2}O$.7. Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нем (правый столбец).
А) AlP
Б) $(NH_{4})_{2}HPO_{3}$
А) $Na_{4}P_{2}O_{7}$
Г) $H_{3}PO_{4}$
⇅
1) −3
2) 0
3) +1
4) +3
5) +5
6) +7Ответ:
А Б В Г
1 5 5 4
А) AlP − степень окисления фосфора: −3.
Б) $(NH_{4})_{2}HPO_{3}$ − степень окисления фосфора: +5.
В) $Na_{4}P_{2}O_{7}$ − степень окисления фосфора: +5.
Г) $H_{3}PO_{4}$ − степень окисления фосфора: +3.8. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
А) $MnO_{2} + H_{2}SO_{4} ⟶ MnSO_{4} + O_{2} + H_{2}O$
Б) $Mn(OH)_{2} + O_{2} ⟶ MnO_{2} + H_{2}O$
В) $KMnO_{4} + K_{2}SO_{3} + KOH ⟶ K_{2}MnO_{4} + K_{2}SO_{4} + H_{2}O$
Г) $KMnO_{4} + H_{2}O_{2} ⟶ MnO_{2} + O_{2} + KOH + H_{2}O$
⇅
1) $Mn^{+7} ⟶ Mn^{+4}$
2) $Mn^{+2} ⟶ Mn^{+4}$
3) $O_{2}^{0} ⟶ 2O^{-2}$
4) $2O^{-1} ⟶ O_{2}^{0}$
5) $Mn^{+7} ⟶ Mn^{+6}$
6) $Mn^{+4} ⟶ Mn^{+2}$Ответ:
А Б В Г
6 3 5 1
А) $Mn^{+4} ⟶ Mn^{+2}$
Б) $O_{2}^{0} ⟶ 2O^{-2}$
В) $Mn^{+7} ⟶ Mn^{+6}$
Г) $Mn^{+7} ⟶ Mn^{+4}$9. Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).
А) $Cl^{+4} ⟶ Cl^{+3}$
Б) $Cl^{+1} ⟶ Cl^{-1}$
В) $Cl^{+5} ⟶ Cl^{-1}$
Г) $Cl^{-1} ⟶ Cl^{0}$
↓↑
1) $Cl_{2} + Al_{4}C_{3} ⟶ AlCl_{3} + CCl_{4}$
2) $HCl + MnO_{2} ⟶ MnCl_{2} + Cl_{2} + H_{2}O$
3) $KClO_{3} + P ⟶ KCl + P_{2}O_{5}$
4) $ClO_{2} + H_{2}O_{2} ⟶ HClO_{2} + O_{2}$
5) $KClO_{4} ⟶ KCl + O_{}2$
6) $HClO + HCl ⟶ HCl + I_{2} + H_{2}O$Ответ:
А Б В Г
4 6 3 2
А) $ClO_{2} + H_{2}O_{2} ⟶ HClO_{2} + O_{2}$
Б) $HClO + HCl ⟶ HCl + I_{2} + H_{2}O$
В) $KClO_{3} + P ⟶ KCl + P_{2}O_{5}$
Г) $HCl + MnO_{2} ⟶ MnCl_{2} + Cl_{2} + H_{2}O$10. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).
А) $C + Cl_{2} + Cr_{2}O_{3} ⟶ CrCl_{3} + CO$
Б) $CO + Na_{2}O_{2} ⟶ Na_{2}CO_{3}$
В) $CH_{4} + O_{2} ⟶ CO_{2} + H_{2}O$
Г) $CO_{2} + C ⟶ CO$
⇅
1) $C^{-2} ⟶ C^{+4}$
2) $C^{-4} ⟶ C^{+4}$
3) $C^{0} ⟶ C^{+4}$
4) $C^{+2} ⟶ C^{+4}$
5) $C^{0} ⟶ C^{+2}$
6) $C^{+4} ⟶ C^{+2}$Ответ:
Ответ:
А Б В Г
5 4 2 5
А) $C^{0} ⟶ C^{+2}$
Б) $C^{+2} ⟶ C^{+4}$
В) $C^{-4} ⟶ C^{+4}$
Г) $C^{0} ⟶ C^{+2}$ §44
-
§44. Неорганические вещества, их номенклатура и классификация
?
1. В перечне веществ
А) $N_{2}O$
Б) $N_{2}O_{5}$
В) $N_{2}O_{3}$
Г) $CO_{2}$
Д) NO
Е) CO
к несолеобразующим оксидам относятся
1) АГЕ
2) ВДЕ
3) АДЕ
4) ГДЕОтвет:
В перечне веществ
А) $N_{2}O$
Б) $N_{2}O_{5}$
В) $N_{2}O_{3}$
Г) $CO_{2}$
Д) NO
Е) CO
к несолеобразующим оксидам относятся
1) АГЕ
2) ВДЕ
3) АДЕ
4) ГДЕ
Ответ: 3.
Несолеобразующие оксиды: $N_{2}O$, NO, CO.2. Амфотерным оксидом является каждое из двух веществ
1) оксид серы (IV) и оксид железа (III)
2) оксид цинка и оксид кальция
3) оксид хрома (III) и оксид бериллия
4) оксид алюминия (III) и оксид магнияОтвет:
Амфотерным оксидом является каждое из двух веществ
1) оксид серы (IV) и оксид железа (III)
2) оксид цинка и оксид кальция
3) оксид хрома (III) и оксид бериллия
4) оксид алюминия (III) и оксид магния
Ответ: 3.
Амфотерным оксидом является каждое из двух веществ оксид хрома (III) и оксид бериллия.3. Основным оксидом является каждое из двух веществ
1) оксид кальция и оксид хрома (II)
2) оксид калия и оксид олова (IV)
3) оксид меди (I) и оксид алюминия
4) оксид бериллия и оксид железа (II)Ответ:
Основным оксидом является каждое из двух веществ
1) оксид кальция и оксид хрома (II)
2) оксид калия и оксид олова (IV)
3) оксид меди (I) и оксид алюминия
4) оксид бериллия и оксид железа (II)
Ответ: 1.
Основным оксидом является каждое из двух веществ оксид кальция и оксид хрома (II).4. Содержит все три типа гидроксидов ряд веществ
1) $H_{3}AlO_{3}, Fe(OH)_{3}, H_{2}SO_{4}$
2) $H_{2}ZnO_{2}, H_{3}PO_{4,} Ba(OH)_{2}$
3) $H_{2}BeO_{2}, HCl, Cu(OH)_{2}$
4) $H_{2}CO_{3}, H_{2}CrO_{4}, NaOH$Ответ:
Содержит все три типа гидроксидов ряд веществ
1) $H_{3}AlO_{3}, Fe(OH)_{3}, H_{2}SO_{4}$
2) $H_{2}ZnO_{2}, H_{3}PO_{4,} Ba(OH)_{2}$
3) $H_{2}BeO_{2}, HCl, Cu(OH)_{2}$
4) $H_{2}CO_{3}, H_{2}CrO_{4}, NaOH$
Ответ: 2.
Содержит все три типа гидроксидов ряд веществ $H_{2}ZnO_{2}, H_{3}PO_{4}, Ba(OH)_{2}$.
$H_{2}ZnO_{2}$ − нерастворимое основание,
$H_{3}PO_{4}$ − кислота,
$Ba(OH)_{2}$ − щелочь.5. Формулы только основных солей записаны в ряду
1) $(CaOH)_{2}SO_{4}, Ca(OH)_{2}, CaOHCl$
2) $Fe(OH)_{3}, Fe(OH)_{2}NO_{3}, [Fe(OH)_{2}]SO_{4}$
3) $MnOHNO_{3}, CuOHCl_{2}, Mg(OH)_{2}$
4) $FeOHCl_{2}, FeOHCl, [Fe(OH)_{2}]_{2}SO_{4}$Ответ:
Формулы только основных солей записаны в ряду
1) $(CaOH)_{2}SO_{4}, Ca(OH)_{2}, CaOHCl$
2) $Fe(OH)_{3}, Fe(OH)_{2}NO_{3}, [Fe(OH)_{2}]SO_{4}$
3) $MnOHNO_{3}, CuOHCl_{2}, Mg(OH)_{2}$
4) $FeOHCl_{2}, FeOHCl, [Fe(OH)_{2}]_{2}SO_{4}$
Ответ: 4.
Формулы только основных солей записаны в ряду $FeOHCl_{2}, FeOHCl, [Fe(OH)_{2}]_{2}SO_{4}$.6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) $Mg(OH)_{2}$
2) $NH_{3}$
3) NaOH
4) $Ba(OH)_{2}$Ответ:
Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) $Mg(OH)_{2}$
2) $NH_{3}$
3) NaOH
4) $Ba(OH)_ {2}$
Ответ: 4.
Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу $Ba(OH)_{2}$.7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) $Na_{2}SO_{4}, Be(OH)_{2}, Fe(OH)Cl_{2}$
2) $K_{2}CO_{3}, H_{3}AlO_{3}, Cu(OH)NO_{3}$
3) $NaHSO_{3}, H_{3}CrO_{3}, Fe(OH)SO_{4}$
4) $ZnSO_{4}, H_{3}PO_{4}, Cr(OH)Cl_{2}$Ответ:
Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) $Na_{2}SO_{4}, Be(OH)_{2}, Fe(OH)Cl_{2}$
2) $K_{2}CO_{3}, H_{3}AlO_{3}, Cu(OH)NO_{3}$
3) $NaHSO_{3}, H_{3}CrO_{3}, Fe(OH)SO_{4}$
4) $ZnSO_{4}, H_{3}PO_{4}, Cr(OH)Cl_{2}$
Ответ: 3.
Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду $NaHSO_{3}, H_{3}CrO_{3}, Fe(OH)SO_{4}$.8. Установите соответствие между названиями веществ (левый столбец) и классами (группами) неорганических соединений (правый столбец), к которым они принадлежат
А) сульфид натрия, оксид калия
Б) гидроксид алюминия, гидросульфит калия
В) оксид цинка, перманганат калия
Г) оксид серы (VI), сульфат железа (III)
⇅
1) амфотерный оксид, средняя соль
2) кислотный оксид, средняя соль
3) основный оксид, кислая соль
4) средняя соль, основный оксид
5) амфотерный гидроксид, кислая соль
6) кислотный оксид, кислая сольОтвет:
А Б В Г
4 5 1 2
А) Сульфид натрия − средняя соль; оксид калия − основный оксид.
Б) Гидроксид алюминия − амфотерный гидроксид; гидросульфит калия − кислая соль.
В) Оксид цинка − амфотерный оксид; перманганат калия − средняя соль.
Г) Оксид серы (VI) − кислотный оксид; сульфат железа (III) − средняя соль.9. Установите соответствие между тривиальными названиями (левый столбец) и формулами неорганических веществ (правый столбец).
А) поваренная соль
Б) пищевая сода
В) марганцовка
Г) мел
⇅
1) $MnSO_{4}$
2) $NaHCO_{3}$
3) NaCl
4) $KMnO_{4}$
5) $Na_{2}CO_{3}$
6) $CaCO_{3}$Ответ:
А Б В Г
3 2 4 6
А) Поваренная соль − $NaCl$
Б) Пищевая сода − $NaHCO_{3}$
В) Марганцовка − $KMnO_{4}$
Г) Мел − $CaCO_{3}$10. Массовая доля кислорода в перманганате калия равна
1) 50,8%
2) 39,7%
3) 22,2%
4) 40,5%Ответ:
Массовая доля кислорода в перманганате калия равна
1) 50,8%
2) 39,7%
3) 22,2%
4) 40,5%
Ответ: 4.
Перманганат калия − $KMnO_{4}$.
ω (O) = $\frac{4\;*\;A_{r} (O)}{M_{r}}$ * 100% = $\frac{4\; * \;16}{158}$ * 100% = 40,5%
Массовая доля кислорода в перманганате калия равна 40,5%. §45
-
§45. Характерные химические свойства неорганических веществ
?
1. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калияОтвет:
Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
Ответ: 4.
Водород можно получить при взаимодействии алюминия с концентрированным раствором гидроксида калия.2. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислородОтвет:
При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
Ответ: 2.
При термическом разложении нитрата серебра образуются серебро, оксид азота (IV) и кислород.
$2AgNO_{3} = 2Ag + 2NO_{2} + O_{2}$3. С раствором щёлочи не реагирует
1) Mg
2) Zn
3) Al
4) BeОтвет:
С раствором щёлочи не реагирует
1) Mg
2) Zn
3) Al
4) Be
Ответ: 1.
С раствором щёлочи не реагирует Mg.4. С раствором сульфата меди (II) взаимодействует
1) Pb
2) Hg
3) Fe
4) AgОтвет:
С раствором сульфата меди (II) взаимодействует
1) Pb
2) Hg
3) Fe
4) Ag
Ответ: 3.
С раствором сульфата меди (II) взаимодействует Fe.5. Взаимодействием соответствующего оксида с водой нельзя получить
1) $Cu(OH)_{2}$
2) $Ba(OH)_{2}$
3) $H_{2}SO_{4}$
4) NaOHОтвет:
Взаимодействием соответствующего оксида с водой нельзя получить
1) $Cu(OH)_{2}$
2) $Ba(OH)_{2}$
3) $H_{2}SO_{4}$
4) NaOH
Ответ: 1.
Взаимодействием соответствующего оксида с водой нельзя получить $Cu(OH)_{2}$.6. Медь из раствора сульфата меди (II) вытесняет каждый из металлов ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, AuОтвет:
Медь из раствора сульфата меди (II) вытесняет каждый из металлов ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
Ответ: 3.
Медь из раствора сульфата меди (II) вытесняет каждый из металлов ряда Fe, Zn, Al.
1) Na − не вытесняет
2) Cu − не вытесняет
4) Au − не вытесняет7. И с соляной кислотой, и с водой реагирует
1) аммиак
2) хлор
3) никель
4) карбонат кальцияОтвет:
И с соляной кислотой, и с водой реагирует
1) аммиак
2) хлор
3) никель
4) карбонат кальция
Ответ: 1.
И с соляной кислотой, и с водой реагирует аммиак.8. В схеме превращений
$SO_{2}$ $\overset{X_{1}}{⟶}$ $SO_{3}$ $\overset{X_{2}}{⟶}$ $H_{2}SO_{4}$ $\overset{X_{3}}{⟶}$ $(NH_{4})_{2}SO_{4}$
веществами $X_{1}, X_{2}$ и $X_{3}$ являются соответственно
1) $O_{2}, H_{2}O, NH_{3}$
2) $NO_{2}, H_{2}, NH_{3}$
3) $O_{2}, H_{2}O, N_{2}$
4) $O_{2}, H_{2}, NH_{3} * H_{2}O$Ответ:
В схеме превращений
$SO_{2}$ $\overset{X_{1}}{⟶}$ $SO_{3}$ $\overset{X_{2}}{⟶}$ $H_{2}SO_{4}$ $\overset{X_{3}}{⟶}$ $(NH_{4})_{2}SO_{4}$
веществами $X_{1}, X_{2}$ и $X_{3}$ являются соответственно
1) $O_{2}, H_{2}O, NH_{3}$
2) $NO_{2}, H_{2}, NH_{3}$
3) $O_{2}, H_{2}O, N_{2}$
4) $O_{2}, H_{2}, NH_{3} * H_{2}O$
Ответ: 1.
В схеме превращений
$SO_{2}$ $\overset{X_{1}}{⟶}$ $SO_{3}$ $\overset{X_{2}}{⟶}$ $H_{2}SO_{4}$ $\overset{X_{3}}{⟶}$ $(NH_{4})_{2}SO_{4}$
веществами $X_{1}, X_{2}$ и $X_{3}$ являются соответственно $O_{2}, H_{2}O, NH_{3}$.9. Установите соответствие между названием оксида (левый столбец) и формулами веществ, с которыми он может взаимодействовать (правый столбец).
А) оксид цинка
Б) оксид кремния (IV)
В) оксид натрия
Г) оксид фосфора (V)
↓↑
1) $K_{2}O, P, H_{2}O$
2) $NaOH, H_{2}SO_{4}, KCl$
3) $KOH, HCl, Li_{2}O$
4) $CO_{2}, H_{2}O, HNO_{3}$
5) $Na_{2}CO_{3}, HF, NaOH$
6) $SO_{3}, HCl, Na_{2}SO_{4}$Ответ:
А Б В Г
3 5 4 1
А) Оксид цинка может реагировать с $KOH, HCl, Li_{2}O$.
Б) Оксид кремния (IV) может реагировать с $Na_{2}CO_{3}, HF, NaOH$.
В) Оксид натрия может реагировать с $CO_{2}, H_{2}O, HNO_{3}$.
Г) Оксид фосфора (V) может реагировать с $K_{2}O, P, H_{2}O$.10. Установите соответствие между названием соли (левый столбец) и формулами веществ, с которыми она может взаимодействовать в водном растворе (правый столбец).
А) сульфат натрия
Б) хлорид железа (II)
В) нитрат меди (II)
Г) сульфид калия
↓↑
1) $Pb(NO_{3})_{2}, HCl$
2) $Cl_{2}, NaOH$
3) KOH, NaCl
4) Fe, KOH
5) $HCl, KNO_{3}$
6) $Ba(OH)_{2}, SrCl_{2}$Ответ:
А Б В Г
6 2 4 1
А) Сульфат натрия может реагировать с $Ba(OH)_{2}, SrCl_{2}$.
Б) Хлорид железа (II) может реагировать с $Cl_{2}, NaOH$.
В) Нитрат меди (II) может реагировать с Fe, KOH
Г) Сульфид калия может реагировать с $Pb(NO_{3})_{2}, HCl$. §46
-
§46. Начальные сведения об органических соединениях
?
1. Для этанола верны следующие утверждения:
1) молекула содержит два атома углерода, пять атомов водорода и один атом кислорода
2) молекула содержит два атома углерода, шесть атомов водорода и один атом кислорода
3) это соединение относится к многоатомныем спиртам
4) это соединение относится к одноатомным спиртам
5) плохо растворимо и водеОтвет:
Для этанола верны следующие утверждения:
1) молекула содержит два атома углерода, пять атомов водорода и один атом кислорода
2) молекула содержит два атома углерода, шесть атомов водорода и один атом кислорода
3) это соединение относится к многоатомныем спиртам
4) это соединение относится к одноатомным спиртам
5) плохо растворимо и воде
Ответ: 2, 4.
Молекула этанола содержит два атома углерода, шесть атомов водорода и один атом кислорода и это соединение относится к одноатомным спиртам.2. Кислородсодержащими органическими соединениями являются
1) метан
2) этан
3) глицерин
4) хлорметан
5) этанолОтвет:
Кислородсодержащими органическими соединениями являются
1) метан
2) этан
3) глицерин
4) хлорметан
5) этанол
Ответ: 3, 5.
Кислородсодержащими органическими соединениями являются глицерин и этанол.3. Для этилена верны следующие утверждения:
1) вступает в реакции полимеризации
2) вступает в реакции замещения
3) гидролизуется
4) вступает в реакции присоединения
5) дает качественную реакцию со свежеполученным $Ca(OH)_{2}$Ответ:
Для этилена верны следующие утверждения:
1) вступает в реакции полимеризации
2) вступает в реакции замещения
3) гидролизуется
4) вступает в реакции присоединения
5) дает качественную реакцию со свежеполученным $Ca(OH)_{2}$
Ответ: 1, 4.
Этилен вступает в реакции полимеризации и вступает в реакции присоединения.4. Две и более функциональные группы содержат молекулы:
1) этилена
2) глицерина
3) глицина
4) этана
5) этанолаОтвет:
Две и более функциональные группы содержат молекулы:
1) этилена
2) глицерина
3) глицина
4) этана
5) этанола
Ответ: 2, 3.
Две и более функциональные группы содержат молекулы глицерина и глицина.5. Раствор $KMnO_{4}$, обесцвечивают
1) оливковое масло
2) этан
3) уксусная кислота
4) этиловый спирт
5) этиленОтвет:
Раствор $KMnO_{4}$, обесцвечивают
1) оливковое масло
2) этан
3) уксусная кислота
4) этиловый спирт
5) этилен
Ответ: 1, 5.
Раствор $KMnO_{4}$, обесцвечивают оливковое масло, этилен.6. Гидролизу подвергаются
1) жиры
2) глюкоза
3) уксусная кислота
4) глицерин
5) белкиОтвет:
Гидролизу подвергаются
1) жиры
2) глюкоза
3) уксусная кислота
4) глицерин
5) белки
Ответ: 1, 5.
Гидролизу подвергаются жиры и белки.7. Реакции полимеризации относится к реакциям
1) горения
2) присоединения
3) замещения
4) обмена
5) соединенияОтвет:
Реакции полимеризации относится к реакциям
1) горения
2) присоединения
3) замещения
4) обмена
5) соединения
Ответ: 2, 5.
Реакции полимеризации относится к реакциям присоединения, соединения.8. Степени окисления и валентности атомов химических элементов численно равны в молекулах
1) этилена
2) этана
3) метана
4) хлорметана
5) углекислого газаОтвет:
Степени окисления и валентности атомов химических элементов численно равны в молекулах
1) этилена
2) этана
3) метана
4) хлорметана
5) углекислого газа
Ответ: 3, 4, 5.
Степени окисления и валентности атомов химических элементов численно равны в молекулах метана, хлорметана, углекислого газа.9. И соляная, и уксусная кислоты взаимодействуют
1) с медью, магнием и цинком
2) с оксидом, гидроксидом и карбонатом кальция
3) с водородом, кислородом и хлором
4) с водой, спиртом, щелочью
5) с гидроксидом натрия, магния и алюминияОтвет:
И соляная, и уксусная кислоты взаимодействуют
1) с медью, магнием и цинком
2) с оксидом, гидроксидом и карбонатом кальция
3) с водородом, кислородом и хлором
4) с водой, спиртом, щелочью
5) с гидроксидом натрия, магния и алюминия
Ответ: 2, 5.
И соляная, и уксусная кислоты взаимодействуют с оксидом, гидроксидом и карбонатом кальция и с гидроксидом натрия, магния и алюминия.10. Для белков верны следующие утверждения:
1) гидролизуются с образованием молекул углекислого газа и воды
2) гидролизуются с образованием молекул аминокислот
3) являются природными полимерами, образованными взаимодействием множества молекул карбоновых кислот
4) являются природными полимерами, образованными взаимодействием множества молекул аминокислот
5) горят с образованием углекислого газа и водыОтвет:
Для белков верны следующие утверждения:
1) гидролизуются с образованием молекул углекислого газа и воды
2) гидролизуются с образованием молекул аминокислот
3) являются природными полимерами, образованными взаимодействием множества молекул карбоновых кислот
4) являются природными полимерами, образованными взаимодействием множества молекул аминокислот
5) горят с образованием углекислого газа и воды
Ответ: 2, 4.
Белки гидролизуются с образованием молекул аминокислот и являются природными полимерами, образованными взаимодействием множества молекул аминокислот.ПРОЕКТНАЯ ДЕЯТЕЛЬНОСТЬ
1. Периодический закон и Периодическая система в учебниках различных стран.
Ответ:
Тема проекта: Периодический закон и Периодическая система в учебниках различных стран.
Цель: изучить Периодический закон и Периодическую систему в учебниках различных стран и выяснить сходства и различия.
Задачи:
1) Выяснить, что такое Периодический закон.
2) Изучить Периодические системы в учебниках разных стран.
Гипотеза исследования: Периодический закон и Периодическая система в учебниках различных стран отличаются друг от друга.
План исследования:
1) Что такое таблица Д. И. Менделеева.
2) Периодический закон.
3) Периодическая система химических элементов в России.
4) Периодическая система химических элементов в США.
Исследование:
Таблица Д. И. Менделеева демонстрирует, что все химические элементы, образующие вещества окружающего нас мира, взаимосвязаны и подчиняются закономерностям, т.е. представляют собой единую систему химических элементов. Поэтому в современной науке таблицу Д. И. Менделеева называют Периодической системой химических элементов. Используется понятие «периодическая», так как общие закономерности в изменении свойств атомов, простых и сложных веществ, образованных химическими элементами, повторяются в этой системе через определённые интервалы − периоды.
Таким образом, все существующие в мире химические элементы подчиняются единому, объективно действующему в природе Периодическому закону, графическим отображением которого и является Периодическая система элементов. Этот закон и система носят имя великого русского химика Д. И. Менделеева.
Д. И. Менделеев пришёл к открытию Периодического закона, проведя сопоставление свойств и относительных атомных массе химических элементов. Для этого Д. И. Менделеев для каждого химического элемента на карточке записал: символ элемента, значение относительной атомной массы (во времена Д. И. Менделеева эту величину назвали атомным весом), формулы и характер высшего оксида и гидроксида. Он расположил 63 известных к тому времени химических элемента в одну цепочку в порядке возрастания их относительных атомных масс и проанализировал эту совокупность элементов.
Периодическая система химических элементов Д. И. Менделеева в России:
Периодическая система химических элементов Д. И. Менделеева в США:
Выводы: Периодический закон и Периодическая система Д. И. Менделеева в учебниках разных стран одинакова, различия лишь в оформлении и языке.
Список литературы:
1) Сайт "Инфоурок".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.2. «Периодическому закону будущее не грозит разрушением...»
Ответ:
Тема проекта: «Периодическому закону будущее не грозит разрушением...»
Цель: изучить Периодический закон и рассмотреть его развитие в будущем.
Задачи:
1) Выяснить, что такое Периодический закон.
2) Выяснить значение Периодического закона.
Гипотеза исследования: Периодический закон играет огромную роль в развитии химии.
План исследования:
1) Таблица Д. И. Менделеева.
2) Периодический закон.
3) Значение ПСХЭ Д. И. Менделеева.
4) Значение Периодического закона.
Исследование:
Все существующие в мире химические элементы подчиняются единому, объективно действующему в природе Периодическому закону, графическим отображением которого и является Периодическая система элементов. Этот закон и система носят имя великого русского химика Д. И. Менделеева.
Д. И. Менделеев пришёл к открытию Периодического закона, проведя сопоставление свойств и относительных атомных масе химических элементов. Для этого Д. И. Менделеев для каждого химического элемента на карточке записал: символ элемента, значение относительной атомной массы (во времена Д. И. Менделеева эту величину назвали атомным весом), формулы и характер высшего оксида и гидроксида. Он расположил 63 известных к тому времени химических элемента в одну цепочку в порядке возрастания их относительных атомных масс и проанализировал эту совокупность элементов, пытаясь найти в ней определенную закономерности. В результате напряженного творческого труда он обнаружил, что в этой цепочке имеются интервалы − периоды, в котоых свойства элементов и образованных ими веществ изменяются сходным образом.
Систематизируя химические элементы на основе их относительных атомных масс, Д. И. Менделеев уделял большое внимание также свойствам элементов и образованных ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы − группы. Иногда в нарушение выявленной им закономерности он ставил более тяжелые элементы перед элементами с меньшими значениями относительных атомных масс.
Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, аргон − перед калием.
Такой порядок расположения Д. И. Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов.
Так, в частности, щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон − в группу щелочных металлов
Благодаря Периодической системе Д.И.Менделеева:
1) сложилось современное понятие о химическом элементе;
2) были уточнены представления о простых веществах и соединениях;
3) появление Периодической системы открыло новую, научную эру в истории химии и ряде смежных наук, появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть;
4) подтвердились наиболее общие законы развития природы;
5) данные легли в основу решения современных задач химической науки и промышленности;
6) она стала основой для естествознания и для многих других наук.
Периодический закон:
1) обобщил большое число природных закономерностей;
2) в таблицу, графически представляющую закон, включаются не только все известные элементы, но и те, которые открывают до сих пор;
3) все новые открытия не повлияли на актуальность закона и таблицы;
4) таблица совершенствуется и изменяется, но ее суть осталась неизменной;
5) позволил уточнить атомные веса и другие характеристики некоторых элементов, предсказать существование новых элементов;
6) химики получили надежную подсказку, как и где искать новые элементы − это послужило научной базой прогнозирования в химии;
7) позволяет с высокой долей вероятности заранее определять свойства еще неоткрытых элементов;
8) сыграл огромную роль в развитии неорганической химии в 19−м веке;
9) основа современной химии. Химия стала единой целостной наукой. Перестала быть описательной наукой;
10) его открытие дало мощнейший толчок в развитии физических и химических знаний;
11) были разработаны теории строения атома и химической связи.
Выводы: Периодический закон имеет огромное значение в мире химии, поэтому со времен его актуальность не теряется.
Список литературы:
1) Сайт "School science".
2) Сайт "Pandia".
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.3. Аллотропия металлов.
Ответ:
Тема проекта: Аллотропия металлов.
Цель: изучить понятие аллотропии.
Задачи:
1) Выяснить, что такое аллотропия.
2) Выяснить значение аллотропии.
Гипотеза исследования: для некоторых металлов характерна аллотропия.
План исследования:
1) Понятие аллотропии.
2) Аллотропия металлов.
3) Пример аллотропии олова.
Исследование:
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы: железо, олово, титан и др.
Характерным примером является аллотропия олова. При температуре ниже 18 °С устойчива модификация α−олова (Snα), называемая серым оловом, а выше 18 °С – модификация β−олова (Snβ), называемая белым оловом.
Решетка белого олова более компактна, чем серого олова, и превращение Snβ → Snα идет со значительным увеличением объема. Поэтому при образовании на белом олове бугорка серого олова последнее, вследствие больших объемных изменений, рассыпается в порошок. Это явление получило название «оловянной чумы», превращение необратимо.
Выводы: Основной причиной полиморфных или аллотропических превращений является стремление любого вещества обладать минимальным запасом свободной энергии. Если у металла при достижении какой−то определенной температуры изменение типа кристаллической решетки обеспечивает уменьшение запаса свободной энергии, то такой металл претерпевает полиморфное превращение.
Список литературы:
1) Сайт "Stud files".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.4. Аморфные вещества и материалы в природе, технике и быту.
Ответ:
Тема проекта: Аморфные вещества и материалы в природе, технике и быту.
Цель: изучить применение аморфных веществ и материалов в природе, технике и быту.
Задачи:
1) Выяснить, что такое аморфные вещества.
2) Рассмотреть сферы применения аморфных веществ.
Гипотеза исследования: Аморфные вещества и материалы имеют огромный спектр применения.
План исследования:
1) Аморфные и твердые вещества.
2) Использование аморфных тел в медицине.
3) Аморфные тела в метрологии.
4) Полимеры.
Основная часть:
Твердые тела можно разделить на две группы, которые существенно отличаются по своим свойствам. Одну группу образуют кристаллические тела, другую – аморфные. В природе аморфные тела встречаются значительно реже по сравнению с кристаллическими. Некоторые вещества при одних условиях можно получить в аморфном состоянии, при других – в кристаллическом. Например, расплавлением кристаллов кварца и последующим их охлаждением можно легко добыть аморфное кварцевое стекло. Степень упорядоченности аморфного тела во многом зависит от технологии его образования.
Использование аморфных веществ наиболее активно осуществляется в области медицины. Многие люди получили возможность самостоятельно передвигаться после тяжелых травм. Дело в том, что вещество аморфной структуры является отличным биоматериалом для имплантации в кости. Полученные специальные винты, пластины, штифты, штифты вставляются в случае серьезных переломов. Ранее в хирургии для таких целей использовались сталь и титан. Только позже было замечено, что аморфные вещества очень медленно разлагаются в организме, и это удивительное свойство позволяет восстановить костную ткань. Впоследствии вещество заменяется костью.
Точная механика основана именно на точности, и поэтому ее так и называют. Особенно важную роль в этой отрасли, а также в метрологии играют ультраточные индикаторы измерительных приборов, которые могут быть достигнуты при использовании аморфных тел в приборах. Благодаря точным измерениям в институтах в области механики и физики проводятся лабораторные и научные исследования, получены новые лекарства и улучшены научные знания.
Другим примером использования аморфных веществ являются полимеры. Они могут медленно переходить из твердого состояния в жидкость, в то время как кристаллические полимеры характеризуются температурой плавления, а не температурой размягчения. Каково физическое состояние аморфных полимеров? Если эти вещества обеспечить низкой температурой, можно заметить, что они будут в стеклообразном состоянии и будут проявлять свойства твердых веществ. Постепенный нагрев помогает полимерам начать переходить в состояние повышенной упругости.
Выводы: Аморфные вещества, благодаря их уникальным свойствам, имеют широкое применение в различных сферах жизнедеятельности.
Список литературы:
1) Золотухин И. В. Физические свойства аморфных металлических материалов. М.: Металлургия, 1986. 176 с.
2) Б. В.Некрасов, Основы общей химии, М.:Химия, 1973.
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.5. Минералы и горные породы как основа литосферы.
Ответ:
Тема проекта: Минералы и горные породы как основа литосферы.
Цель: изучить минералы и горные породы.
Задачи:
1) Выяснить, что такое минералы и горные породы.
2) Рассмотреть строение литосферы.
Гипотеза исследования: Минералы и горные породы входят в состав литосферы.
План исследования:
1) Что такое геосфера.
2) Понятие литосферы.
3) Строение литосферы.
4) Горные породы.
Исследование:
Геосферы − географические концентрические оболочки (сплошные или прерывистые), из которых состоит планета Земля.
Выделяются следующие геосферы: атмосфера, гидросфера, литосфера, земная кора, мантия и ядро Земли. Ядро Земли делится на внешнее ядро (жидкое) и центральное − субъядро (твёрдое).
Литосферой называют твердую земную оболочку, которая полностью покрывает планету, защищая ее от достигающей 60000 °С температуры раскаленного ядра. Литосфера расположена между атмосферой и гидросферой сверху и астеносферой снизу. Толщина твердой оболочки Земли не однородна, и на различных участках составляет от десятков до нескольких сотен километров.
К литосфере относятся: земная кора, переходный слой и самый верхний, вязкий слой мантии. Литосфера, о которой мы ведем сейчас речь — это всего лишь около 1% от радиуса земли, но именно этот 1% позволяет существовать жизни на планете.
Земная кора — самый верхний слой литосферы. В неоднородности земной коры можно убедиться, стоя на берегу и глядя на обрыв скромной реки, где слои различных пород находятся друг над другом. Найденные при раскопках полезные ископаемые (нефть, газ, железная руда, алмазы) рассказывают ученым о процессах, происходящих на планете миллионы лет назад. Земная кора — не только самый верхний слой литосферы, но и самый тонкий — ее размер составляет от 80 километров на горных участках планеты до 30 км на равнинных. По типу земная кора делится на океаническую и материковую. Такое деление характерно только для Земли, на остальных планетах такого разделения нет, если верить показаниям космических зондов и планетоходов. В коре материкового типа выделяют три слоя пород: осадочный — сформирован породами осадочного и вулканического происхождения; гранитный — сформирован породами метаморфического горного происхождения, которые представлен кварцем и полевым шпатом; базальтовый — в формировании участвовали магматические породы. Океаническая кора состоит из осадочного и базальтового слоев. Под земной корой, в точности повторяя ее очертания, и отделяя ее от мантии, расположен пограничный слой.
Расположение горных пород в земной коре зависят от их происхождения. По происхождению различают магматические, метаморфические и осадочные породы.
Магматические горные породы – это породы, образовавшиеся из магмы при её остывании и затвердевании.
Осадочные породы – это породы, образующиеся при осаждении и отложении различного обломочного материала.
Метаморфические породы образуются из магматических или осадочных при существенном изменении их минерального состава и структуры под воздействием высоких температур, большого давления и высокотемпературных водных растворов.
Выводы: Согласно научным исследованиям, учёным удалось установить, что литосфера состоит из:
Кислорода – 49%;
Кремния – 26%;
Алюминия – 7%;
Железа – 5%;
Кальция – 4%
В состав литосферы входит немало минералов, самые распространённые – шпат и кварц.
Список литературы:
1) Сайт "Ros uhebnik".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.6. Исследование жёсткости воды и способы её устранения.
Ответ:
Тема проекта: Жесткость воды и способы ее устранить.
Цель: исследовать жесткость воды и способы ее устранения.
Задачи:
1) Выяснить, что такое жесткость воды.
2) Рассмотреть способы устранения жесткости воды.
Гипотеза исследования: Жесткость воды можно регулировать.
План исследования:
1) Мягкая и жесткая вода.
2) Временная и постоянная жесткость воды.
3) Мыла.
4) Способы изменение жесткости воды.
Исследование:
Вода, прежде чем попасть в колодец или водопроводную сеть, просачивается сквозь почву и насыщается в ней растворимыми солями.
Природные воды содержат сульфаты и бикарбонаты кальция и магния, т.е. катионы $Ca^{2+}$ и $Mg^{2+}$, анионы $SO_{4}^{2-}$ и $HCO_{3}^{-}$. Вода, в которой содержание ионов $Ca^{2+}$ и $Mg^{2+}$ незначительно, называется мягкой, вода с повышенным содержанием их − жесткой.
При кипячении жесткой воды бикарбонаты разлагаются, образуя нерастворимые карбонаты, например:
$Ca^{2+} + 2HCO_{3}^{-} = CaCO_{3}↓ + H_{2}O + CO_{2}↑$
Карбонаты осаждаются, и жесткость воды уменьшается. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Широко известно, что в жесткой воде мыло плохо мылится. Изучим это явление на опыте, взяв в качестве искусственной жесткой воды, например, раствор гипса. Нальем в бюретку разбавленный раствор мыла и будем приливать его понемногу, порция за порцией, к жесткой воде, сильно встряхивая после каждого приливания стакан с жесткой водой. Первые порции мыла будут затрачиваться на образование хлопьевидного осадка, и пены при встряхивании получаться не будет. Только после того, как прекратится образование осадка, появится пена.
Мыла − это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R − кислотный остаток. Анионы R− образуют с катионами кальция и магния нерастворимые соли $CaR_{2}$ и $MgR_{2}$. На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жесткость воды, общее содержание в ней ионов кальция и магния.
Для хозяйственно−бытовых нужд требуется вода с незначительной жесткостью. При кипячении жесткой воды образуется накипь. В жесткой воде плохо развариваются мясо, овощи, крупа. При стирке тканей жесткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
При питании паровых котлов жесткой водой образуется накипь. Накипь затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла.
Для понижения жесткости воды применяют различные методы. Перед направлением в паровой котел воду предварительно нагревают, чем устраняют временную жесткость. Для питания котлов высокого давления в настоящее время часто применяют перегнанную (дистиллированную) воду. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты.
Карбонатную жесткость устраняют добавлением известкового молока:
$Ca(HCO_{3})_{2} + Ca(OH)_{2} = 2CaCO_{3}↓ + 2H_{2}O$
Некарбонатная жесткость устраняется добавкой соды:
$CaSO_{4} + Na_{2}CO_{3} = CaCO_{3}↓ + Na_{2}SO_{4}$
Природную воду, содержащую ионы кальция $Ca^{2+}$ и магния $Mg^{2+}$, можно смягчить, освободить от этих ионов, заменив их, например, ионами натрия, при помощи ионообмена. Для этого воду на станциях водоочистки пропускают через ионнообменную колонку с катионитом, содержащим подвижные ионы $Na^{+}$.
Выводы: Жёсткую воду перед употреблением целесообразно умягчить. Наша вода, применяемая для питья, легко умягчается кипячением.
Вода, поступающая в стиральные, посудомоечные машины, в газовые котлы для отопления, обязательно должна умягчаться специальными химическими фильтрами.
При стирке белья в стиральной машине необходимо добавлять в стиральный порошок средства для умягчения воды.
Список литературы:
1) В. И. Аксенов, Химия воды; Аналитическое обеспечение лабораторного практикума, 2014 г, 142
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.с.7. Оксиды и соли как строительные материалы.
Ответ:
Тема проекта: Оксиды и соли как строительные материалы.
Цель: изучить оксиды и соли и их применение в качестве строительных материалов.
Задачи:
1) Выяснить, что такое оксиды и соли.
2) Рассмотреть способы их использования в строительстве.
Гипотеза исследования: оксиды и соли обладают свойствами исключительно важными в строительстве.
План исследования:
1) Что такое соли.
2) Что такое оксиды.
3) Строительные материалы.
Исследование:
Соли − это сложные вещества, молекулы которых состоят из атомов металла и кислотного остатка.
Карбонат кальция не растворим в воде, и является основой всех природных камней, в частности известняка и мрамора. Сульфат кальция, или гипс, и сульфат магния являются прекрасными вяжущими веществами. Однако при контакте с кислотами они превращаются в легко растворимые в воде соли, что может привести к существенным проблемам, таким как откалывание или намывание материала.
Оксиды − это сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
Оксид кремния (IV) $SiO_{2}$ в виде кварцевого песка используется в производстве стекла и бетона. Вместе с оксидом свинца (II) PbO он применяется для изготовления полудрагоценных камней и украшений ( «кристаллы Сваровски»). Оксид кальция CaO под названием «негашеная известь» применяют при изготовлении различных строительных материалов. Оксиды некоторых других металлов находят применение в производстве красок.
К строительным материалам, которые создаются на основе природных оксидов и солей, относятся:
1) керамические материалы
2) вяжущие строительные матералы
3) стекло.
Вяжущие строительные материалы представляют собой вещества или смеси веществ, способные при смешивании с водой образовывать вязкую массу.
Выводы: Оксиды и соли обладают вяжущими, сцепляющими свойвами, что важно в строительстве.
Список литературы:
1) Сайт "Impoled".
2) Сайт "Infourok".
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.8. Многоликий карбонат кальция: в природе, промышленности и быту.
Ответ:
Тема проекта: Многоликий карбонат кальция: в природе, промышленности и быту.
Цель: изучить применение карбоната кальция.
Задачи:
1) Рассмотреть особенности карбоната кальция.
2) Рассмотреть способы его применения.
Гипотеза исследования: карбонат кальция имеет широкий спектр применения.
План исследования:
1) Физические свойства карбоната кальция.
2) Карбонат кальция в быту.
3) Применение в пищевой промышленности.
4) Карбонат кальция в сельском хозяйстве.
Исследование:
Карбонат кальция (обычное название − кальцит) состоит из солей угольной кислоты и кальция.
Производители и любители домашнего вина используют $CaCO_{3}$ в критических ситуациях, когда сусло или конечный продукт слишком кислые и непригодны для употребления. После добавления небольшого количества карбоната кальция вино приобретает свой отчетливый естественный вкус.
В пищевой промышленности карбонат кальция известен как добавка Е170. Среди прочего, используется для приготовления кондитерских изделий, жевательных резинок, некоторых видов хлебобулочных изделий, чипсов и печенья.
Реакция получения карбоната кальция относительно проста, быстра и экономична, поэтому $CaCO_{3}$ также находит применение в косметической промышленности. Белый сухой порошок используют для изготовления пудр, присыпок, теней для век или косметических основ. Ввиду своего отбеливающего эффекта карбонат кальция также является очень распространенным ингредиентом зубных паст.
Карбонат кальция широко используют в сельском хозяйстве и животноводстве − известковое удобрение удобряет бесплодную почву, а смеси с добавлением Calcium Carbonate прекрасно дополняют рацион животных. Содержание карбоната кальция в почве − это показатель, который многое говорит о качестве почвы − чем меньше в ней содержится карбоната кальция, тем менее плодороден и стабилен грунт.
Выводы: Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
Список литературы:
1) Сайт "Studwork".
2) Общая и неорганическая химия: учебное пособие / Под ред. Денисова В.В., Таланова В.М.. − Рн/Д: Феникс, 2018. − 144 c.
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.9. Виртуальное моделирование различных химических производств.
Ответ:
Тема проекта: Виртуальное моделирование различных химических производств.
Цель: Рассмотреть виртуальное моделирование в химическом производстве.
Задачи:
1) Рассмотреть принцип химического производства.
2) Представить модель химического производства.
Гипотеза исследования: Виртуальное моделирование быстро развивается и дает новые возможности для развития химии.
План исследования:
1) Развитие цифровых технологий.
2) Цифровой двойник.
3) Типы цифровых двойников.
Исследование:
B настояшее время, когда интенсивно развиваются цифровые технологии, растет степень использования компьютерных разработок на существующих промышленных предприятиях и производствах.
Цифровой двойник − это динамическая виртуальная копия физической сущности или процесса в реальном времени, которая используется для понимания, изучения и обновления процессов производства.
В настоящее время единого определения термина «Цифровой двойник»
нет. Однако, чаще всего так именуют цифровую копию живой или неживой физической сущности, представляющей собой динамическую модель в виртуальном мире, которая идентична своему физическому объекту в реальном мире, с возможностью моделирования и пародирования всего жизненного цикла, своиств и производительности.
Существует несколько типов цифровых двойников, три основных из них
приведены ниже:
1) Модель содержит информационные наборы, необходимые для описания и создания физической версии. Эти цифровые наборы включают в себя, но не ограничиваются требованиями, спецификациями процессов и услуг, регламентом.
2) Двойник описывает конкретный физический объект, с которым он напрямую связан, на протяжении всего срока службы продукта. Этот тип двойника может содержать в зависимости от способов использования следующие наборы данных: 3D модели, описывающие геометрию и физические свойства объектов, список операций, выполненных при создании этого физического объекта, вместе с результатами измерений или испытаний над экземпляром, а также рабочее состояние, полученное с помощью датчиков.
3) К этому типу относят объединение ранее указанных типов двойников. Он имеет доступ ко всем прототипам и может запрашивать информацию обо всех объектах. Также данный цифровой двойник постоянно мониторит показания датчиков и сопоставляет данные показания с теми, которые зафиксировал во время сбоя.
Создаваемое нами виртуальное пространство цифрового двойника, есть ничто иное, как 3D модель описывающая технологию и все основные процессы в химическом производстве. Цифровой двойник, разрабатывается путем выполнения большого числа операций, благодаря которым удается создать копию химического производства с учетом технологических норм, регламента и спецификации.
Выводы: При помощи подобных виртуальных тренажеров, базирующихся на
основе цифровых реальных производств, сотрудники могут полностью освоить сущность всех протекающих процессов, ознакомиться с технологией, а также приобрести соответствующую квалификацию, без угрозы при этом для исправности оборудования и здоровья сотрудников.
Список литературы:
1) Сайт "School science".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.10. Исследование туалетного мыла различных торговых марок.
Ответ:
Тема проекта: Исследование туалетного мыла различных торговых марок.
Цель: изучить состав и применение мыла.
Задачи:
1) Выяснить, что входит в состав мыла.
2) Рассмотреть мыла разных торговых марок.
Гипотеза исследования: мыла разных торговых марок имеют различный состав.
План исследования:
1) Что в ходит в состав мыла.
2) Способ применения мыла.
3) Получение мыла.
4) Состав мыла разных торговых марок.
Основная часть:
В химическом отношении основным компонентом твердого мыла является смесь растворимых солей высших жирных кислот. Обычно это натриевые, реже − калиевые и аммониевые соли таких кислот, как стеариновая, пальмитиновая, миристиновая, лауриновая и олеиновая.
Дополнительно в составе мыла могут быть и другие вещества, обладающие моющим действием, а также ароматизаторы, красители и порошки. Также в мыло часто добавляют бактерициды (антибиотики). Они помогают убить микробов, однако получается так, что эти соединения в составе мыла часто приносят больше вреда, чем пользы.
Например, триклозан убивает не всех микробов, «выживают» при действии бактерицида, как правило, самые устойчивые бактерии, которые оказываются способными вызвать у человека различные заболевания.
Для того чтобы сделать руки по−настоящему стерильными, следует использовать теплую воду и хозяйственное мыло, а не бактерициды. В качестве сырья для получения основного компонента мыла могут использоваться животные и растительные жиры, жирозаменители (синтетические жирные кислоты, канифоль, нафтеновые кислоты, талловое масло).
Получение мыла основано на реакции омыления − гидролиза сложных эфиров жирных кислот (в частности жиров) со щелочами, в результате которого образуются соли щелочных металлов и спирты.
В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щелочью (обычно гидроксидом натрия). В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении, − мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея, составляет обычно 40−60 %. Такой продукт называется «клеевое мыло».
Химический состав туалетного мыла «Весна»:
1) натриевые соли жирных кислот пищевых жиров, пальмового и кокосового масел;
2) вода;
3) парфюмерная композиция;
4) хлорид натрия;
5) гидроксид натрия;
6) антал П−2;
7) диоксид титана;
8) синтетический краситель красного цвета.
Химический состав туалетного мыла Дивный сад «Лимон»:
1) натриевые соли жирных кислот животных жиров и растительных масел;
2) вода;
3) парфюмерная композиция;
4) диоксид титана;
5) динатриевая соль ЭДТА;
6) диэтиленгликоль;
7) борная кислота;
8) бензойная кислота;
9) лимонная кислота;
10) триэтаноламин;
11) хлорид натрия.
Выводы: Рассмотрев составы мыла различных торговых марок, мы можем сделать вывод, что мыла разных торговых марок имеют различные составы.
Список литературы:
1) Сайт "Pandia".
2) Сайт "Him 1sept".
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.11. Исследование факторов окружающей среды, влияющих на коррозию металлов; способы защиты от коррозии.
Ответ:
Тема проекта: Исследование факторов окружающей среды, влияющих на коррозию металлов; способы защиты от коррозии.
Цель: изучить факторы, влияющие на коррозию, рассмотреть способы защиты от коррозии.
Задачи:
1) Рассмотреть способы защиты от коррозии.
2) Рассмотреть факторы коррозии.
Гипотеза исследования: факторы, влияющие на коррозию, могут как ускорять ее, так и замедлять.
План исследования:
1) Что такое коррозия.
2) Способы борьбы с коррозией.
Исследование:
Коррозией называют самопроизвольное разрушение изделий из металла и сплавов под влиянием окружающей среды.
При контакте железа с более активным цинком последний, разрушаясь, защищает железо от коррозии.
Если же разрушение металлов происходит в результате только химического взаимодействия с веществами окружающей среды, то происходит химическая коррозия. Так, например, корродируют щелочные и щёлочноземельные металлы, поэтому их хранят под слоем керосина, а литий − под вазелиновым маслом.
Для борьбы с коррозией существует много способов.
Некоторые из них:
1) Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башно в Париже.
Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов − это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.
2) Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Лёгкие нержавеющие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса», облицованный пластинками из титанового сплава. На его блестящей поверхности нет ни одного пятнышка ржавчины.
3) Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды.
Такие вещества называют ингибиторами коррозии.
Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4) Создание контакта с более активным металлом протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
На суше металлические конструкции линии электропередачи (ЛЭП) и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.
Выводы: В природе химическая коррозия распространена практически повсеместно. Может возникать как на открытом воздухе, так и под землей, в водоемах и близи них. Мы выяснили, что коррозия зависит от множества факторов, которые могут ее как ускорять, так и замедлять.
Список литературы:
1) Воробьева Г. Я. Коррозионная стойкость материалов в агрессивных средах химических производств. Изд. 2−е пер. и доп. М, «Химия», 1975. 816 с.
2) Малахов А.И., Жуков А.П. Основы металловедения и теории коррозии: Учебник для машиностроительных техникумов — М.: Высшая школа, 1978. — 192 с., ил.
3) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
4) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.12. Благородные не значит инертные.
Ответ:
Тема проекта: Благородные не значит инертные.
Цель: изучить благородные газы.
Задачи:
1) Рассмотреть расположение благородных газов в таблице Д.И. Менделеева.
2) Рассмотреть строение атомов благородных газов.
Гипотеза исследования: благородные газы способны вступать в химичсекие реакции.
План исследования:
1) Понятие инертности.
2) Благородные газы.
3) Свойства благородных газов.
4) Благородные не значит инертные.
Исследование:
Слово "инертный" имеет значение "неактивный, пассивный" или "безынициативный", если мы говорим о человеке.
Благородные газы были ранее известны как инертные из−за предполагаемого отсутствия участия в каких−либо химических реакциях. Причина этого заключается в том, что их крайняя электронная оболочка (валентная оболочка) полностью заполнена.
Благородные газы − группа элементов в таблице Менделеева, обладающих однотипными свойствами. Все эти вещества − одноатомные газы, с большим трудом взаимодействующие с другими веществами. К благородным газам относятся: гелий Не, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn. Они относятся к VIII группе, главной подгруппе Периодической системы химических элементов Д. И. Менделеева.
Благородные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся: гелий ярко−жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно−красным светом, так как самые яркие его линии лежат в красной части спектра.
Благородные газы могут вступать в химические реакции при определенных условиях.
Первое синтезированное соединение благородных газов − гексафтороплатинат ксенона:
$Xe[PtF_{6}]$.
$Xe + PtF_{6} = Xe[PtF_{6}]$.
Только с фтором могут взаимодействовать криптон, ксенон и радон, причём их химическая активность возрастает от криптона к радону.
Прямым взаимодействием криптона, ксенона и радона с фтором при и нагревании или в электрическом разряде получены фториды:
$KrF_{2}, XeF_{2}, KrF_{4}, XeF_{4}, RnF_{4}$.
$Kr + F_{2} = KrF_{2}$
$Xe + F_{2} = XeF_{2}$
$Kr + 2F_{2} = KrF_{4}$
$Xe + 2F_{2} = XeF_{4}$
$Rn + 2F_{2} = RnF_{4}$
Выводы: Благородные газы не справедливо связывать с понятием "инертный", потому что могут создавать химические связи, хотя для этого и требуются экстремальные условия, поскольку эти атомы или соединения состоят из самых внешних оболочек, которые полностью заполнены электронами.
Список литературы:
1) Сайт "PC group".
2) Барагузина В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.13. Металлы как материал для производства произведений искусства.
Ответ:
Тема проекта: Металлы как материал для производства произведений искусства.
Цель: изучить металлы как материал для производства произведений искусства.
Задачи:
1) Рассмотреть химические свойства металлов.
2) Рассмотреть способы применения металлов.
Гипотеза исследования: металлы используют как материал для производства произведений искусства.
План исследования:
1) Значение металлов.
2) Применение железа.
3) Применение олова.
4) Применение меди.
Исследование:
Различные металлы использовались в искусстве с давних времен. Они создавались как для практических, так и для эстетических целей. В основном, использовались такие металлы и сплавы, как бронза, серебро, золото, олово, медь, свинец, латунь и железо. Большинство сокровищ и артефактов в Древнем Египте − это разновидности металлических работ. Они включают статуи, украшения и монеты. Великолепные скульптуры, сохранившиеся сегодня в Греции и Риме, были сделаны из бронзы, а древние американские цивилизации, инки, майя и ацтеки, делали топоры и церемониальные орудия из меди.
Железо использовалось еще древними мастерами и в настоящее время не утратило своей привлекательности. Все виды железных работ основаны на использовании трех его видов:
1) Чугун. В основном используется для декоративных каминов и облицовок, принадлежностей для каминов и традиционных печей.
2) Сталь. Используется для изысканных столовых приборов, лестничных перил, декоративного оборудования и украшений.
3) Кованое железо. Используется для изготовления садовой мебели, наружных украшений, садовых скульптур, каминных накладок, перил и балюстрады.
Олово применяется для создания фигурных скульптур, подвесных украшений, бюстов, декоративных значков, водных сосудов, декоративных ваз и подсвечников.
Медь используется как для декоративно−прикладного искусства, так и для повышения прочности и долговечности изделий. Из меди изготавливают статуэтки, скульптуры, вазы и урны, пьедесталы, часы и многое другое. Ювелиры объединяют медь с серебром или золотом, чтобы закрепить их для изготовления ювелирных изделий.
Бронзовые произведения искусства включают в себя древние греческие бюсты, статуэтки, религиозные суда, скульптуры, статуэтки, маски и монументальные отливки.
Изделия из латуни охватывают широкий спектр направлений в искусстве. Это ювелирные изделия, музыкальные инструменты, латунные штамповки, статуи и скульптуры, мебель и фурнитура.
Выводы: Различные металлы нашли широкое применение во всех отраслях жизни человека. И большую область среди них занимает искусство, которое подразделяется на несколько разных направлений.
Список литературы:
1) Сайт "Krugosvet".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.14. Роль металлов в истории человеческой цивилизации.
Ответ:
Тема проекта: Роль металлов в истории человеческой цивилизации.
Цель: изучить роль металлов в истории человеческой цивилизации.
Задачи:
1) Рассмотреть химические свойства металлов.
2) Рассмотреть способы применения металлов.
Гипотеза исследования: металлы играют огромную роль в истории человеческой цивилизации.
План исследования:
1) Значение сплавов.
2) Стали.
3) Бронза.
4) Латунь.
5) Мельхиор.
6) Дюралюминий.
Исследование:
Металлы были известны человеку с древних времен, однако, их они не нашли применения, пока их не научились обрабатывать.
Железо встречается в природе в самородном состоянии крайне редко, в отличие от меди. Слово «железо» в переводе с древнегреческого означает «звездный». В чистом виде железо в природе встречается в составе осколков метеоритов. Медь можно легко получить из медной руды.
Ещё в глубокой древности люди заметили, что сплавы металлов обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы. У бронзы, например, прочность выше, чем у составляющих её меди и олова. Сталь и чугун прочнее технически чистого железа. Поэтому в чистом виде металлы используют редко. Значительно чаще применяют их сплавы. Известно немногим более 80 металлов, но из них получены десятки тысяч различных сплавов.
Сплавам присущи свойства, которых нет у чистых металлов. Примерами могут служить получаемая на основе железа нержавеющая сталь − материал с высокой жаропрочностью и коррозионной стойкостью даже в агрессивных средах, магнитные материалы и сплавы с высоким электрическим сопротивлением и др.
Сплавы − это материалы с металлической кристаллической решёткой, обладающие характерными свойствами и состоящие из двух и более компонентов.
Компонентами сплавов могут быть и неметаллы, и соединения. По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными.
Помимо большей прочности многие сплавы обладают большей коррозионной стойкостью и твердостью, лучшими литейными свойствами. Так, чистая медь очень плохо поддаётся литью, а оловянная бронза − сплав меди и олова − имеет прекрасные литейные свойства: из неё отливают художественные изделия, требующие тонкой проработки деталей. Чугун − сплав железа с углеродом − также великолепный литейный материал. Чистый алюминий − очень мягкий металл, сравнительно непрочный на разрыв. Но сплав, состоящий из алюминия, магния, марганца, меди и никеля, называемый дюралюминием, в четыре раза прочнее алюминия на разрыв.
Сплавы классифицируют по−разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Стали − это основа современного машиностроения, оборонной промышленности, ракетостроения и других отраслей промышленности.
Из цветных сплавов отметим бронзу, латунь, мельхиор, дюралюминий.
Бронза − сплав на основе меди с добавлением (до 20%) олова. Бронза хорошо отливается, поэтому её используют в машиностроении для изготовления подшипников, поршневых колец, клапанов, арматуры и т. д. Используют бронзу также и для художественного литья.
Латунь − медный сплав, содержащий от 10 до 50% цинка. Применяют в моторостроении, для изготовления мебельной фурнитуры.
Мельхиор − сплав, содержащий около 80% меди и 20% никеля, похож по внешнему виду на серебро. Используют его для изготовления сравнительно недорогих столовых приборов и художественных изделий.
Дюралюминий (дюраль, дуралюмин) − сплав на основе алюминия, содержащий медь, магний, марганец и никель. Имеет хорошие механические свойства, его применяют в самолёто− и машиностроении.
Выводы: Различные металлы нашли широкое применение во всех отраслях жизни человека. Использование человеком металлов можно считать условием, предопределившим становление цивилизации.
Список литературы:
1) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
2) Сайт "Chem ege".
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.15. Региональное силикатное производство.
Ответ:
Тема проекта: Региональное силикатное производство.
Цель: изучить силикатное производство.
Задачи:
1) Рассмотреть способы получения силикатов.
2) Рассмотреть способы применения силикатов.
Гипотеза исследования: Роль силикатной промышленности в регионах огромна.
План исследования:
1) Физические свойства кремния.
2) Силикатная промышленность.
3) Стекло − продукт силикатного производства.
4) Цемент.
Исследование:
Кремний – твёрдый элемент тёмно−серого цвета с металлическим блеском. Проявляет свойства полупроводника. В природе находится в составе песка, кварца, глины.
В реакциях с металлами кремний выполняет функцию окислителя (принимает электроны), с неметаллами – восстановителя (отдаёт электроны). При обычных условиях кремний реагирует только с фтором. С остальными веществами взаимодействует при нагревании.
Кремний используют в составе песка, глины и других природных материалов для изготовления прочных материалов – цемента, стекла, керамики.
Промышленность, которая занимается производством различных строительных материалов, стекла и керамики из природных силикатов называется силикатной и включает в себя три основных направления: производство стекла, производство цемента и производство керамики.
Силикатная промышленность является важным сектором экономики, связанным с производством материалов на основе силиката, таких как стекло, керамика, цемент и другие строительные материалы. Этот сектор играет ключевую роль в развитии инфраструктуры и строительной отрасли.
Стекло − один из наиболее распространенных продуктов силикатной промышленности. Его используют в окнах, зеркалах, автомобильных стеклах и многих других приложениях. Керамические изделия, такие как плитка и кафель, также широко используются в строительстве и декоративных приложениях. Цемент является необходимым компонентом для строительства зданий, мостов, дорог и других инфраструктурных объектов.
В современном мире силикатная промышленность сталкивается с множеством вызовов. Например, уменьшение запасов природных ресурсов, повышение требований к энергоэффективности и соблюдению стандартов экологической безопасности. Однако благодаря техническому прогрессу и инновациям, силикатная промышленность продолжает развиваться и производить новые материалы.
Выводы: Силикатная промышленность остается важным сектором экономики и продолжает играть ключевую роль в развитии строительной отрасли и инфраструктур.
Список литературы:
1) Сайт "Art talant".
2) Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. − М.: ИЦ РИОР, 2017. − 272 c.
3) Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. − М.: Альфа−М, НИЦ ИНФРА−М, 2016. − 336 c.


