 У нас появился еще один повод для еще одной статьи на нашем сайте. Во-первых, речь пойдет о рабочей тетради, во-вторых, о химии... Что можно сказать о химии? Предмет этот относится к естественным наукам, то есть к тем самым, где мир познается путем "общения" с ним, путем собирательства и эксперимента. Само собой после полученных результатов проводится аналитическая работа, делаются выводы и заключения, участвующие в формировании наших выводов, знаний, в построении неких догм и лемм, участвующих в последующих опытах и заключениях. Практичность науки химия тоже не обсуждается. В нашем мире множество производств, начиная от технических и заканчивая пищевыми, где без химии никуда.
У нас появился еще один повод для еще одной статьи на нашем сайте. Во-первых, речь пойдет о рабочей тетради, во-вторых, о химии... Что можно сказать о химии? Предмет этот относится к естественным наукам, то есть к тем самым, где мир познается путем "общения" с ним, путем собирательства и эксперимента. Само собой после полученных результатов проводится аналитическая работа, делаются выводы и заключения, участвующие в формировании наших выводов, знаний, в построении неких догм и лемм, участвующих в последующих опытах и заключениях. Практичность науки химия тоже не обсуждается. В нашем мире множество производств, начиная от технических и заканчивая пищевыми, где без химии никуда.
Итак, собственно речь пойдет об ответах к рабочей тетради по химии за 7 класс, о ГДЗ, для авторов Габриелян, Шипарева.
Теперь более подробно о контенте нашей статьи.
ГДЗ по химии для рабочей тетради за 7 класс, автор Габриелян, Шипарева
Выбирайте интересующий вас раздел учебника, находите параграф, страницу, задание и смотрите ответы.
Страница 4
-
Химия как часть естествознания. Предмет химии. Номер №1 стр. 4
Выберите правильное продолжение фразы: "Химия − это наука о ...":
а) живой природе;
б) взаимоотношениях живых организмов друг с другом;
в) законах движения;
г) веществах, их свойствах и превращениях.
Решение
Химия − это наука о веществах, их свойствах и превращениях.
Ответ: г.
Номер №2
Заполните таблицу 1.
Науки о природеНауки о природе Предмет изучения Биология География Физика Экология Химия Решение
Науки о природеНауки о природе Предмет изучения Биология живые организмы География природа и население земли Физика материя Экология отношения между живыми организмами Химия химические вещества
Номер №3
Сформулируйте определение понятия.
Вещество − это _
Решение
Вещество − это то, из чего состоят физические тела. 5
-
Номер №4
Подчеркните названия веществ:
свеча, парафин, алюминий, кастрюля, пробирка, снежинка, железо, вода, дерево, крахмал, золото, лампа, спирт.
Решение
свеча, парафин, алюминий, кастрюля, пробирка, снежинка, железо, вода, дерево, крахмал, золото, лампа, спирт.
Остальное − физические тела.
Номер №5
Подчеркните "лишнее" слово в каждой группе:
а) Проволока, ложка, алюминий, фольга;
б) железо, серебро, золото, кольцо;
в) пылинки, кислород, азот, углекислый газ.
Решение
а) Проволока, ложка, алюминий, фольга (алюминий − это вещество, остальное − физические тела);
б) железо, серебро, золото, кольцо (кольцо − это тело, а остальное − вещества);
в) пылинки, кислород, азот, углекислый газ (пылинки − тела, остальное − вещества).
Номер №6
Запишите названия 2−3 тел (предметов), которые изготовлены:
а) из золота − _
б) из пластмассы − _
Решение
Изготовлены:
а) из золота − серьга, брошь, цепочка;
б) из пластмассы − лейка, расческа, лампа.
Номер №7
Запишите названия 2−3 веществ, из которых могут быть сделаны следующие тела:
а) кастрюля − _
б) стол − _
Решение
Названия веществ, из которых могут быть сделаны:
а) кастрюля − алюминий, чугун;
б) стол − древесина, стекло,
Номер №8
С давних времен для письма использовали карандаши. Из кусочков мягкого минерала − графита изготавливали палочки. Их обертывали в различный материал, чтобы не пачкать руки. Подпишите названия веществ, из которых изготовлен карандаш.
Решение
Карандаш изготовлен из следующих веществ: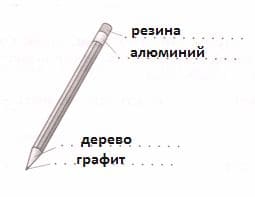
6
-
Номер №9
Заполните таблицу 2, используя собственные наблюдения и справочные данные приложения 2.
Физические свойства меди, сахара, углекислого газаСвойства веществ Медь Сахар Углекислый газ Агрегатное состояние Цвет Запах Растворимость в воде Пластичность Температура плавления Температура кипения Плотность Теплопроводность Электропроводность
Решение
Физические свойства меди, сахара, углекислого газаСвойства веществ Медь Сахар Углекислый газ Агрегатное состояние твердое вещество твердое вещество газ Цвет оранжево−красный белый нет Блеск нет нет нет Запах нет нет нет Растворимость в воде нерастворима растворим растворим Пластичность пластичная нет нет Температура плавления 1083℃ 170℃ −78℃ Температура кипения 2600℃ 188℃ −78℃ Плотность 8900 кг/м3 1600 кг/м3 1,98 кг/м3 Теплопроводность высокая небольшая нет Электропроводность высокая нет нет
Номер №10
Заполните пропуски таким образом, чтобы получилась логическая последовательность: название вещества − свойство − область применения.
Пример. Алюминий − электропроводность − изготовление проводов.
а) Гелий − _ − наполнение воздушных шаров;
б) ртуть − _ − использование при изготовлении термометров;
в) стекло − _ − изготовление химической посуды.
Решение
а) Гелий − плотность − наполнение воздушных шаров;
б) ртуть − теплопроводность − использование при изготовлении термометров;
в) стекло − прозрачность − изготовление химической посуды. 7
-
Наблюдение и эксперимент как методы изучения естествознания и химии. Номер №1
Заполните пропуски в предложениях.
_ _ _ _ _ _ _ _ _ _ − это концентрация внимания на познаваемых объектах с целью их изучения.
_ _ _ _ _ _ _ _ _ _ _ − это научное воспроизведение какого−либо явления с целью его исследования, испытания в определенных условиях.
Решение
Наблюдение − это концентрация внимания на познаваемых объектах с целью их изучения.
Эксперимент − это научное воспроизведение какого−либо явления с целью его исследования, испытания в определенных условиях.
Номер №2
Известно, что основные "инструменты" наблюдения окружающего мира − это органы чувств. Запишите их.
1) _
2) _
3) _
4) _
5) _
Решение
Основные "инструменты" наблюдения окружающего мира − это органы чувств:
1) Зрение
2) Слух
3) Обоняние
4) Осязание
5) Вкус
Номер №3
Дополните предложение.
Для того чтобы наблюдение было результативным, необходимо:
а) определить _
б) сформулировать _
в) составить _
Решение
Для того чтобы наблюдение было результативным, необходимо:
а) определить объект наблюдения;
б) сформулировать цель;
в) составить план. 8
-
Номер №4
Определите правильную последовательность действий, которые необходимо выполнить при проведении исследования. Впишите в прямоугольники цифры необходимых действий.
1) Объяснение полученный результатов.
2) Ведение дневника наблюдений.
3) Определение цели наблюдений.
4) Описание результатов наблюдений.
5) Наблюдение за исследуемым явлением или объектом.
6) Получение количественных характеристик наблюдаемого явления или объекта.
7) Формулировка выводов.
8) Зарисовка или фотографирование наблюдаемого явления или объекта.
_ → _ → _ → _ → _ → _ → _ → _
Решение
3 → 8 → 5 → 2 → 6 → 4 → 1 → 7
Практическая работа №1. Цель. Номер №1
Цель: _
Знакомство с лабораторным штативом
Устройство лабораторного штатива
Штатив (рис. 1) служит для укрепления частей химических установок при выполнении опытов. Он состоит из подставки (1), в которую ввинчен стержень (2). На стержне при помощи муфт (3) укрепляют лапку (4) или кольцо (5). Муфту с укрепленной в ней лапкой или кольцом можно перемещать вдоль стержня и закреплять в нужном положении.
Объясните, почему подставка штатива изготавливается массивной.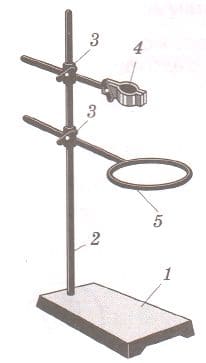 Рис.1. Лабораторный штатив с лапкой и кольцом
Рис.1. Лабораторный штатив с лапкой и кольцом
Решение
Цель: изучить основные виды химической посуды, лабораторного оборудования и правила работы с ними.
Подставка штатива изготавливается массивной для лучшей его устойчивости.
Задание 1. Номер №1
Знакомство с устройством штатива.
Снимите с установленного на столе штатива лапку и кольцо. Для этого ослабьте винт крепления муфты со стержнем и, поднимая муфту с лапкой с лапкой или кольцом вверх, снимите ее со стержня штатива. Освободите лапку и кольцо от муфты: поверните против часовой стрелки винт, удерживающий лапку и кольцо, и выньте их из муфты. Рассмотрите устройство муфты. Наденьте муфту на стержень штатива так, чтобы винт, закрепляющий ее, был слева от стержня, а стержни лапки или кольца укреплялись бы таким образом, чтобы их поддерживал не только винт, но и муфта.
Почему стержни лапок и колец располагаются сверху муфты?
Решение
Стержни лапок и колец располагаются сверху муфты, так как она является опорой для них. 13-14
-
Задание 2. Номер №1
Пользование штативом.
Закрепите в муфте штатива лапку. Укрепите в лапке штатива в вертикальном положении пробирку. Отверстие пробирки должно быть направлено вверх. Пробирку в лапке закрепляют около отверстия. Пробирка укреплена правильно, если ее можно повернуть в лапке без больших усилий. Слишком крепко зажатая пробирка может лопнуть, особенно при нагревании. Поверните пробирку в горизонтальное положение, винт лапки при этом должен быть сверху. Закрепите в муфте кольцо. Установите в нем фарфоровую чашку. Снимите чашку, поместите на кольцо медную сетку, а на нее поставьте химический стакан.
Почему закрепленная в лапке пробирка должна сравнительно свободно поворачиваться?
Решение
Закрепленная в лапке пробирка должна сравнительно свободно поворачиваться, так как от излишнего давления пробирка может лопнуть.
Задание 2. Номер №2
Заполните таблицу 3.
Химическая посудаРешение
Химическая посудаНазвание Рисунок Материал Назначение Мерный цилиндр 
Стекло Для отмеривания определенного объема жидкости Реторта 
Стекло Для перегонки жидкостей Круглодонная колба 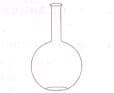
Стекло Для проведения химических реакций без нагревания Коническая колба (колба Эрленмейера) 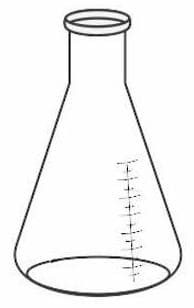
Стекло Для жидкостей Пробирка 
Стекло Для проведения реакций с небольшим количеством реактивов Химический стакан 
Стекло Для жидкостей Конусная воронка 
Стекло Для переливания жидкостей Ступка с пестиком 
Фарфор Для выпаривания растворов 15
-
Номер №3
Как вы думаете, почему для изготовления химической посуды наиболее часто используется стекло?
Решение
Для изготовления химической посуды наиболее часто используется стекло, так как оно наиболее устойчиво и не взаимодействует с химическими реактивами.
Номер №4
Назовите лабораторное оборудование.
а)
б)
в)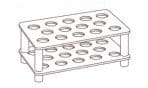
Решение
а) держатель для пробирок
б) тигельные щипцы
в) подставка для пробирок
Практическая работа №2. Цель. Номер №2
Цель: _
Решение
Цель: научиться описывать результаты наблюдений. 16
-
Задание 1. Номер №1
Свои наблюдения оформите в виде небольшого сочинения. Нарисуйте пламя свечи.
Решение
Свеча изготовлена из парафина, который плавится при горении. Появляется специфический запах. Наибольшая температура пламени − в верхней зоне.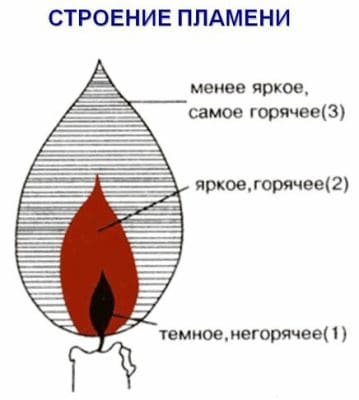
Задание 2. Номер №1
Пламя, как вы уже знаете, имеет три зоны. Какие? При исследовании нижней части пламени внесите в него при помощи тигельных щипцов конец стеклянной трубки, держа под углом 45−50°. К другому концу трубки поднесите горящую лучину. Что наблюдаете?
Решение
Пламя имеет три зоны: нижняя, средняя, верхняя. Самая горячая это самая верхняя зона.
При внесении в нижнюю часть пламени стеклянной трубки и лучины наблюдается горение лучины из−за выделения теплоты в результате горения. 17
-
Задание 2. Номер №2
С целью изучения средней части пламени, самой яркой, внесите в нее (помощью тигельных щипцов) на 2−3 с фарфоровую чашку. Что обнаружили?
Решение
При внесении в среднюю часть пламени на 2−3 с фарфоровой чашки наблюдается образование копоти на ней.
Задание 2. Номер №3
При исследовании состава верхней части пламени внесите в нее на 2−3 с опрокинутый, смоченный известковой водой химический стакан так, чтобы пламя оказалось в середине стакана. Что наблюдаете?
Решение
При внесении в верхнюю часть пламени на 2−3 с опрокинутого смоченного известковой водой химического стакана наблюдается помутнение воды.
Задание 2. Номер №4
Для установления разницы температуры в разных частях пламени внесите на 2−3 с лучинку в нижнюю часть пламени (чтобы она пересекала все его части по горизонтали). Что наблюдаете?
Решение
При внесении на 2−3 с лучинки в нижнюю часть пламени наблюдаем, что верхняя часть лучинки сгорает быстрее.
Задание 2. Номер №5
Оформите отчет, заполнив таблицу 4.
Таблица 4№ п/п Ход работы Наблюдения Выводы 1 2 3 4
Решение
Таблица 4№ п/п Ход работы Наблюдения Выводы 1 Исследование внутренней части пламени Лучинка загорается Нижняя часть пламени представляет собой газообразный парафин 2 Исследование средней части пламени Образование копоти на дне чашки Средняя часть содержит углерод 3 Исследование верхней части пламени Помутнение воды Выделяется углекислый газ 4 Исследование разницы температуры Лучинка быстрее сгорает в верхней части Самая высокая температура в верхней части пламени 18
-
Задание 3. Номер №1
Зажгите свечу и накройте ее банкой объемом 0,5 л. Определите время, в течение которого горит свеча.
Проведите подобные действия, используя банки других объемов.
Заполните таблицу 5.
Таблица 5Продолжительность горения свечи в зависимости от объема воздуха
Объем банки, л Время горения свечи, с 0,5 0,8 1 3
Решение
Таблица 5
Продолжительность горения свечи в зависимости от объема воздухаОбъем банки, л Время горения свечи, с 0,5 20 0,8 33 1 38 3 115 5 160
Номер №2
Изобразите график зависимости продолжительности горения свечи от объема банки (воздуха). Определите по нему время, через которое погаснет свеча, накрытая банкой объемом 10 л.
Решение
График зависимости продолжительности горения свечи от объема банки (воздуха):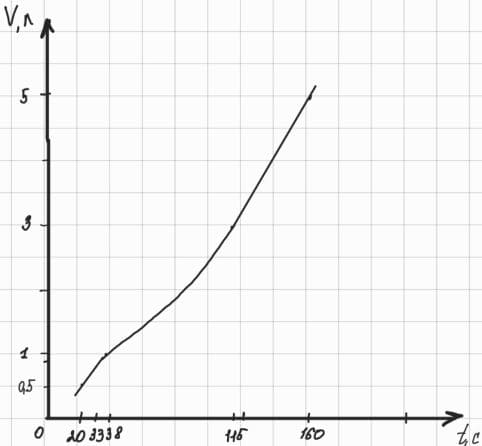
Номер №3
Рассчитайте время, в течение которого будет гореть свеча в закрытом школьном кабинете.
Длина школьного кабинета химии (a) равна _ м, ширина (b) равна _ м, высота (c) − _ м.
Объем школьного кабинета химии равен _ м3 или _ л. Время, в течение которого будет гореть свеча с учетом того, что в помещение не поступает воздух и весь кислород расходуется на горение свечи, _ с или _ ч.
Решение
Длина школьного кабинета химии (a) равна 10 м, ширина (b) равна 5 м, высота (c) − 3 м.
Объем школьного кабинета химии равен 150 м3 или 150000 л. Время, в течение которого будет гореть свеча с учетом того, что в помещение не поступает воздух и весь кислород расходуется на горение свечи, 4800000 с или 1333 ч.
Вычисления:
V = 10 м * 5 м * 3 м = 150 м3
Из предыдущего задания имеем: 5 л горит 160 с. Значит, составим пропорцию:
5 л − 160 с
150000 л − х
х = 150000 л * 160 с : 5 л = 4800000 с 19
-
Задание 4. Номер №1
Рассмотрите рисунок 2 и напишите название каждой части спиртовки. Необходимую информацию вы найдете на с. 23 учебного пособия.
1 − _
2 − _
3 − _
4 − _а) Почему при зажигании спиртовки спичку подносят сбоку?
б) Почему нельзя зажигать спиртовку от другой горящей спиртовки?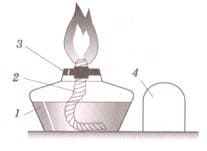
Рис. 2 Устройство спиртовки
Решение
1 − спирт
2 − фитиль
3 − держатель фитиля
4 − колпачока) При зажигании спиртовки спичку подносят сбоку, так как при поднесении спички сверху можно обжечь руку, потому что верхняя часть пламени спиртовки самая горячая.
б) Нельзя зажигать спиртовку от другой горящей спиртовки, так как спирт может разлиться, а он хорошо поддерживает горение. Спирт сразу вспыхнет, что может быть опасно. 20
-
Номер №2
Пользуясь имеющимся на вашем столе оборудованием, вскипятите воду в пробирке.
На рисунке показано, сколько воды должно быть в пробирке, как правильно закрепить ее в держателе или в лапке штатива и в какую часть пламени нужно внести пробирку.
а) Сколько воды необходимо налить в пробирку?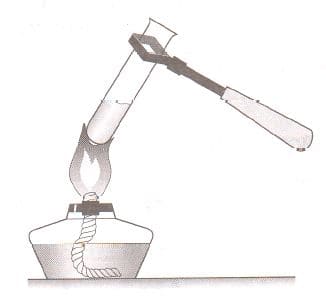
Рис. 3 Пробирка в держателе
б) Как держать пробирку над пламенем спиртовки?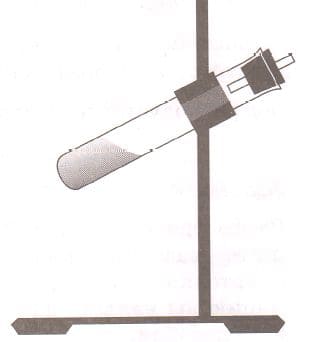
Рис. 4 Пробирка в лапке штатива
Решение а
Надо налить не более 2/3 пробирки воды.
Решение б
Пробирку надо дерзать под углом 40−45℃ в противоположную сторону от себя.
Моделирование. Номер №1
В пустые прямоугольники впишите цифры, указывающие правильную последовательность слов в предложении.
Моделирование − это _
_ − реально существующих
_ − конструируемых объектов
_ − исследование
_ − предметов
_ − и изучения
_ − явлений и
_ − путем построения
_ − их моделей
Решение
Моделирование − это исследование реально существующих явлений и предметов и изучения их моделей путем построения констатируемых объектов.
2 − реально существующих
8 − констатируемых объектов
1 − исследование
4 − предметов
5 − и изучения
3 − явлений и
7 − путем построения
6 − их моделей 21
-
Номер №2
Назовите модель, о которой идет речь в загадке.
Дороги есть − ехать нельзя, земля есть − пахать нельзя, луга есть − косить нельзя, моря есть − плавать нельзя.
Ответ: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Решение
Ответ: географическая карта.
Номер №3
"Кроссворд − наоборот". Все слова в кроссворде уже вписаны. Дайте каждому из слов как можно более точное определение.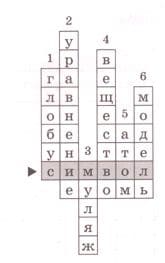
Ключевое слово − _
1 − _
2 − _
3 − _
4 − _
5 − _
6 − _
Решение
Ключевое слово − обозначение с помощью знака или буквы.
1 − модель земного шара.
2 − равенство, содержащее неизвестное.
3 − точное воспроизведение предмета.
4 − то, из чего состоит физическое тело.
5 − наименьшая химически неделимая частица вещества.
6 − материальный или мысленно представленный объект. 22
-
Химические знаки и формулы. Номер №1
Закончите предложение.
Химический элемент − _
Решение
Химический элемент − это определенный вид атомов.
Номер №2
Заполните таблицу 6.
Таблица 6
Химические символы и названия некоторых элементов.Латинское название Химический символ Русское название Carboneum Oxygenium Zincum Phosphorus Nitrogenium Ferrum Sulfur Kalium Решение
Таблица 6
Химические символы и названия некоторых элементов.Латинское название Химический символ Русское название Carboneum C Углерод Oxygenium O Кислород Zincum Zn Цинк Phosphorus P Фосфор Nitrogenium N Азот Ferrum Fe Железо Sulfur S Сера Kalium K Калий
Номер №3
Напишите, какой химический элемент, по вашему мнению, входит в состав веществ, называемых:
сульфаты − _;
гидриды − _;
фосфаты − _;
сульфиды − _;
нитраты − _;
оксиды − _;
карбонаты − _;
силикаты − _.
Решение
Элементы, которые входят в состав веществ, называемых:
сульфаты − S, O;
гидриды − H;
фосфаты − P, O;
сульфиды − S;
нитраты − N, O;
оксиды − O;
карбонаты − C, O;
силикаты − Si, O. 23
-
Номер №4
Соедините линией название химического элемента с соответствующим химическим символом.
Решение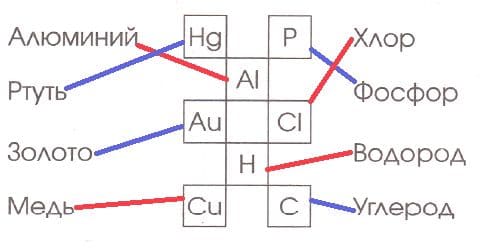
Номер №5
Рассмотрите рисунок 5. Постройте столбчатую диаграмму, отражающую содержание некоторых элементов в организме человека по массе. Над соответствующими столбиками напишите символы и русские названия химических элементов, содержащихся в организме человека.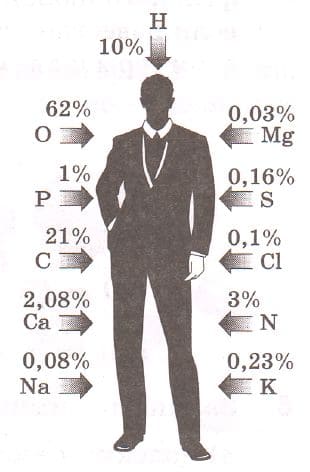
Рис. 5. Содержание некоторых химических элементов в организме человека, % по массе
Решение
Столбчатую диаграмму, отражающую содержание некоторых элементов в организме человека по массе: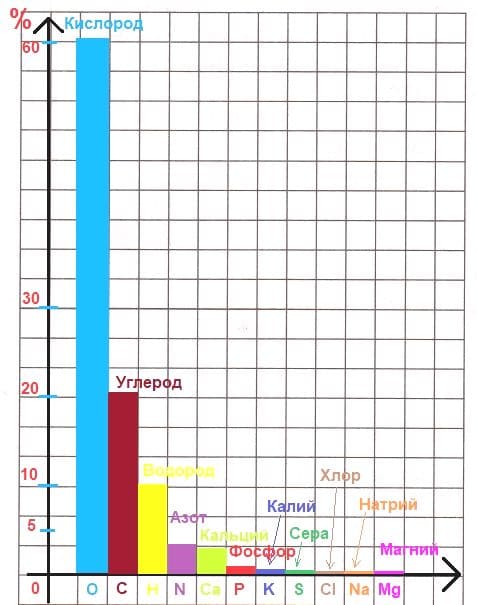
24
-
Номер №6
Закончите предложения.
а) Химическая формула показывает _
б) Индекс показывает _
Решение а
Химическая формула показывает:
1) индивидуальное вещество;
2) тип вещества (простое или сложное);
3) одну молекулу вещества;
4) качественный состав вещества, то есть какие химические элементы входят в его состав;
5) количественный состав вещества, то есть число атомов каждого химического элемента в составе его одной формульной единицы.
Решение б
Индекс показывает количество атомов в молекуле, а коэффициенты указывают на количество молекул, участвующих в химической реакции.
Номер №7
Сернистый газ используют в пищевой промышленности в качестве отбеливающего средства, предохраняющего разрезанные плоды и овощи от потемнения (применяется при производстве джемов, желе, мармелада, повидла, сухого картофельного пюре). Укажите модель молекулы этого вещества, если известно, что в состав данного соединения входит один атом серы и два атома кислорода.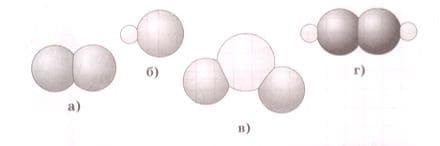
Решение
Ответ: в).
Номер №8
Запишите химическую формулу:
а) молекулы азота, которая состоит из двух атомов азота _ ;
б) молекулы озона, которая состоит из трех атомов кислорода _ ;
в) молекулы угольной кислоты, которая состоит из двух атомов водорода, одного атома углерода и трех атомов кислорода _ ;
г) молекулы аммиака, которая состоит из одного атома азота и трех атомов водорода _ ;
д) пяти молекул воды, каждая из которых состоит из двух атомов водорода и одного атома кислорода _ ;
е) трех молекул сернистой кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и трех атомов кислорода _ ;
ж) четырех молекул сероводорода, каждая из которых состоит из двух атомов водорода и одного атома серы _ ;
з) двух молекул метана, каждая из которых состоит из одного атома углерода и четырех атомов водорода _ .
Решение
Химическая формула:
а) молекулы азота, которая состоит из двух атомов азота N2;
б) молекулы озона, которая состоит из трех атомов кислорода O3;
в) молекулы угольной кислоты, которая состоит из двух атомов водорода, одного атома углерода и трех атомов кислорода H2CO3;
г) молекулы аммиака, которая состоит из одного атома азота и трех атомов водорода NH3;
д) пяти молекул воды, каждая из которых состоит из двух атомов водорода и одного атома кислорода 5H2O;
е) трех молекул сернистой кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и трех атомов кислорода 3H2SO3;
ж) четырех молекул сероводорода, каждая из которых состоит из двух атомов водорода и одного атома серы 4H2S;
з) двух молекул метана, каждая из которых состоит из одного атома углерода и четырех атомов водорода 2CH4. 25
-
Номер №9
На рисунке изображены модели молекул некоторых веществ. Укажите, где показаны простые вещества, где − сложные вещества.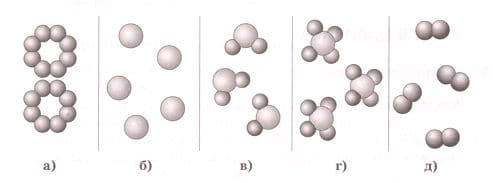
Простые вещества: _
Сложные вещества: _
Решение
Простые вещества: а, б, д.
Сложные вещества: в, г. 26
-
Номер №10
Заполните пропуски в таблице 7.
Таблица 7
Названия и формулы некоторых веществНазвание вещества Химическая формула Чтение формулы Классификация вещества (простое или сложное) 1. Углекислый газ $CO_{2}$ Це−о−два Сложное 2. Вода 3. $O_{2}$ 4. Сернистый газ Эс−о−два 5. Хлор $Cl_{2}$ 6. $H_{2}SO_{4}$ 7. Глюкоза Це−шесть−аш−двенадцать−о−шесть 8. NaOH
Решение
Таблица 7
Названия и формулы некоторых веществНазвание вещества Химическая формула Чтение формулы Классификация вещества (простое или сложное) 1. Углекислый газ $CO_{2}$ Це−о−два Сложное 2. Вода $H_{2}O$ Аш−два−о Сложное 3. $O_{2}$ О−два Простое 4. Сернистый газ $SO_{2}$ Эс−о−два Сложное 5. Хлор $Cl_{2}$ Хлор−два Простое 6. $H_{2}SO_{4}$ Аш−два−с−о−четыре Сложное 7. Глюкоза $C_{6}H_{12}O_{6}$ Це−шесть−аш−двенадцать−о−шесть Сложное 8. NaOH Натрий−о−аш Сложное Химия и физика. Номер №1
Дайте определения.
Молекула − это _
Атом − это _
Ионы − это _
Решение
Молекула − это мельчайшая частица вещества.
Атом − это положительно заряженная неделимая частица.
Ионы − это положительно или отрицательно заряженные частицы, которые образуются из атомов или групп атомов. 27
-
Номер №2
Вставьте пропущенные слова − атом, молекула, ионы.
а) _ иода I2 состоит из двух _ иода.
б) Когда мы пишем простым карандашом, _ углерода остаются на листе бумаги.
в) При растворении поваренной соли в воде _ натрия и _ хлора равномерно распределяются между _ воды.
г) При квашении капусты молочнокислые бактерии превращают _ сахара в _ молочной кислоты.
д) Поваренная соль, сода, перманганат калия − это вещества, состоящие из _.
Решение
а) Молекула иода (I2) состоит из двух атомов иода.
б) Когда мы пишем простым карандашом, атомы углерода остаются на листе бумаги.
в) При растворении поваренной соли в воде ионы натрия и ионы хлора равномерно распределяются между молекулами воды.
г) При квашении капусты молочнокислые бактерии превращают молекулы сахара в молекулы молочной кислоты.
д) Поваренная соль, сода, перманганат калия − это вещества, состоящие из ионов.
Номер №3
Подчеркните лишнее слова в каждой группе.
а) Частицы, молекулы, атомы, ионы;
б) кварц, галит, алмаз, рубин;
в) углекислый газ, вода, сахар, алмаз;
г) флюорит, сода, сапфир, галит.
Решение
а) Частицы, молекулы, атомы, ионы (так как частицы − это молекулы, атомы и ионы)
б) кварц, галит, алмаз, рубин (так как галит − это соль в отличие от остального)
в) углекислый газ, вода, сахар, алмаз (так как алмаз − простое вещество в отличие от остального)
г) флюорит, сода, сапфир, галит (так как сапфир − оксид, остальное − соли)
Номер №4
Подчеркните верные утверждения.
а) Доказательством того, что многие вещества состоят из атомов, может служить явление диффузии;
б) Беспорядочное движение мельчайших частиц в жидкой или газообразной среде называется броуновским;
в) Расположение частиц в пространстве в строго определенном порядке называется кристаллической решеткой;
г) Большинство твердых веществ находятся в кристаллическом состоянии.
Решение
а) Доказательством того, что многие вещества состоят из атомов, может служить явление диффузии;
б) Беспорядочное движение мельчайших частиц в жидкой или газообразной среде называется броуновским;
в) Расположение частиц в пространстве в строго определенном порядке называется кристаллической решеткой;
г) Большинство твердых веществ находятся в кристаллическом состоянии.
Номер №5
Домашний опыт. Диффузия сахара в воде
Правила техники безопасности
Реактивы и оборудование: сахар, вода; стакан.
1) Составьте инструкцию по выполнению данного опыта и отчет о выполненной работе.
Гипотеза эксперимента _
Опишите опыт, который вы будете выполнять.
2) Сравните продолжительность диффузии сахара в горячей и холодной воде.
Вывод. _
Решение
Инструкция по выполнению данного опыта:
1) В стакан наливаем воду.
2) Добавляем столовую ложку сахара.
3) Перемешиваем до растворения.Гипотеза эксперимента: сахар растворится в воде.
В стакан налью 100 мл воды, добавлю столовую ложку сахар. Буду перемешивать до полного растворения.
Вывод: в горячей воде сахар растворяется быстрее. 28-29
-
Номер №6
Домашний опыт. Диффузия перманганата калия (сульфата меди (II)) в желатине
Реактивы и оборудование: желатин пищевой, перманганат калия (марганцовка), сульфат меди (II) (Медный купорос), вода; кастрюля, чайная ложка для перемешивания, электрическая (газовая) плита, пинцет, два прозрачных пузырька.
Ход работы. Чайную ложку желатина опустите в стакан с холодной водой и оставьте на час−другой, чтобы порошок успел набухнуть. Перелейте смесь в маленькую кастрюлю. Ничего опасного в этом нет, потому что желатин − пищевой продукт. Нагревайте смесь на слабом огне, следите, чтобы она ни в коем случае не закипела! Размешивайте содержимое кастрюли до тех пор, пока желатин полностью не растворится.
Горячий раствор перелейте в два пузырька. Когда он застынет, в середину первого пузырька быстрым и осторожным движением введите пинцет, в котором зажат кристаллик марганцовки. Слегка разожмите пинцет и так же быстро выньте его. В другой пузырек внесите кристаллик медного купороса. Несколько часов подряд вы сможете наблюдать очень интересную картину: вокруг кристаллика будет расти окрашенный шар.
Измеряйте высоту окрашенного столба желатина. Результаты измерений запишите в таблицу 8.
Таблица 8
Высота окрашенного столба желатина в зависимости от времени
Время, мин Высота окрашенного столба желатина, см
Решение
Таблица 8
Высота окрашенного столба желатина в зависимости от времениВремя, мин Высота окрашенного столба желатина, см 1 0,5 2 1 3 1,5 4 2 5 2,5 6 3 30
-
Агрегатные состояния веществ. Номер №1
Подчеркните верные утверждения.
а) Железо может быть жидким.
б) Кислород может быть твердым.
в) Уксусная кислота может быть газообразной.
Решение
а) Железо может быть жидким.
б) Кислород может быть твердым.
в) Уксусная кислота может быть газообразной.
Ответ: а, в.
Номер №2
Дополните предложения.
В каком агрегатном состоянии находится вещество, если:
а) оно не сохраняет форму, но сохраняет объем − _;
б) тело из него сохраняет свою форму и объем − _;
в) оно принимает форму того сосуда, в котором находится − _.
Решение
В каком агрегатном состоянии находится вещество, если:
а) оно не сохраняет форму, но сохраняет объем − газ;
б) тело из него сохраняет свою форму и объем − твердое;
в) оно принимает форму того сосуда, в котором находится − жидкое.
Номер №3
Подчеркните "лишнее" слово в каждой группе.
а) кислород, углекислый газ, серебро;
б) уксусная кислота, лимонная кислота, спирт;
в) вода, мел, графит;
г) ртуть, вода, кислород;
д) неон, железо, сахар;
е) мел, угарный газ, сероводород.
Решение
а) кислород, углекислый газ, серебро, так как серебро − твердое вещество
б) уксусная кислота, лимонная кислота, спирт, так как не относится к классу кислот
в) вода, мел, графит, так как вода − жидкое вещество
г) ртуть, вода, кислород, так как вода − сложное вещество
д) неон, железо, сахар, так как сахар − сложное органическое вещество
е) мел, угарный газ, сероводород, так как мел − твердое вещество
Номер №4
Ответьте на вопрос.
Чем отличаются твердые кристаллические вещества от твердых аморфных?
Решение
Твердые кристаллические вещества имеют кристаллическую решетку. А в твёрдых аморфных телах расположение частиц не упорядочено. 31
-
Номер №5
Заполните таблицу 9.
Таблица 9
Характеристика свойств веществ в различных агрегатных состоянияхПризнак сравнения Газообразное Жидкое Твердое Примеры веществ (при температурах 0−100℃) Свойства веществ Собственная форма Собственный объем Расстояния между частицами Силы взаимодействия между частицами Характер движения частиц
Решение
Таблица 9
Характеристика свойств веществ в различных агрегатных состоянияхПризнак сравнения Газообразное Жидкое Твердое Примеры веществ (при температурах 0−100℃) Кислород Вода Медь Свойства веществ Бесцветный газ, не имеющий запаха и вкуса Хороший растворитель Электропроводна Собственная форма нет нет да Собственный объем да да нет Расстояния между частицами большое среднее маленькое Силы взаимодействия между частицами слабые межмолекулярные электростатические Характер движения частиц хаотичное движение колебательные движения колебательные движения
Номер №6
Заполните пропуск в предложении.
Явления, при которых изменяются агрегатное состояние вещества, форма или размеры тел, но сохраняется его химический состав, называются _ _ _ _ _ _ _ _ _ _ _ _.
Решение
Явления, при которых изменяются агрегатное состояние вещества, форма или размеры тел, но сохраняется его химический состав, называются физическими
Номер №7
Назовите 2−3 синонима слова "явление" − _
Решение
Назовите 2−3 синонима слова "явление" − случай, событие, феномен. 32
-
Номер №8
Запишите 2−3 пословицы или поговорки, в которых идет речь о физических явлениях.
Решение
Пословицы или поговорки, в которых идет речь о физических явлениях:
1) Без дождя и трава не растет.
2) Хороший снежок урожай сбережет.
3) Как ни гремит гром, а всё замолчит.
Номер №9
Домашний опыт. Опыты с пустой закрытой пластиковой бутылкой.
Оборудование: пластиковая бутылка с крышкой, холодильник.
Ход работы. Пустую пластиковую бутылку закройте крышкой и поставьте холодильник. Через минуту вы увидите, что стенки бутылки втянулись вовнутрь, будто кто−то откачал из нее часть воздуха. Почему так произошло? _
Примет ли бутылка прежнюю форму, если ее вынуть из холодильника? Почему? _
Решение
• Стенки бутылки втянулись вовнутрь, будто кто−то откачал из нее часть воздуха, так как при охлаждении воздух сжимается.
• Если бутылку вынуть из холодильника, она примет прежнюю форму, так как температура повысится и воздух вернется в прежнее состояние.
Химия и география. Номер №1
Составьте "визитную карточку планеты Земля", заполнив пропуски в предложениях.
Внутреннее ядро имеет диаметр _, состоит из _ и _. Эта часть ядра _. Внешнее _ ядро имеет толщину около _. Температура веществ достигает _℃.
Мантия в переводе с латинского означает _, состоит из веществ, образованных главным образом _ элементами: _. Мантия имеет температуру около _℃.
За мантией располагается _ или _. Толщина океанической земной коры _ км, а континентальной − до _ км на равнине и до _ км в горных районах.
Решение
Внутреннее ядро имеет диаметр 2400 км, состоит из железа и никеля. Эта часть ядра внутренняя. Внешнее расплавленное ядро имеет толщину около 2300 км. Температура веществ достигает 5000−6600℃.
Мантия в переводе с латинского означает "покрывало", состоит из веществ, образованных главным образом тремя элементами: Si, Mg, Fe. Мантия имеет температуру около 2000−2500℃.
За мантией располагается земная кора или литосфера. Толщина океанической земной коры 5−10 км, а континентальной − до 35 км на равнине и до 75 км в горных районах. 33
-
Номер №2
Изобразите столбчатую диаграмму химического состава земной коры, в которой символами обозначены все указанные химические элементы, приведенные в таблице 10.
Содержание химических элементов в литосфереНазвание химического элемента Содержание в земной коре, % по массе Кислород 47,0 Кремний 27,6 Алюминий 8,8 Железо 4,65 Кальций 3,38 Магний 2,35 Натрий 2,64 Калий 2,41 Титан 0,57 Другие элементы 0,6 Решение
Столбчатая диаграмма химического состава земной коры: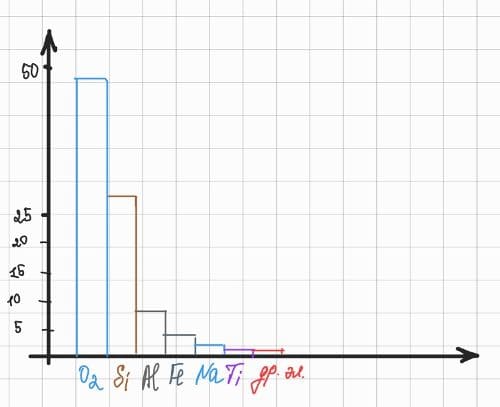
34
-
Номер №3
Распределите вещества по двум группам в соответствии с найденной закономерностью.
Лазурит, гранит, торф, галит, корунд, мел, каменный уголь, флюорит, халькопирит.
а) _
б) _
Решение
а) лазурит, корунд, халькопирит, гранит, флюорит, галит − минералы
б) торф, мел, каменный уголь − полезные ископаемые
Номер №4
Лабораторный опыт. Изучение гранита с помощью увеличительного стекла.
Реактивы и оборудование: кусочек гранита, увеличительное стекло или лупа.
Ход работы. Рассмотрите при помощи увеличительного стекла или лупа кусочек гранита. Что наблюдаете? _
Из каких составных частей состоит гранит? _
Решение
Наблюдаем, что в составе гранита содержатся крупные кристаллы минералов.
Гранит состоит из трех составляющих: полевой шпат, кварц, слюда 35
-
Химия и биология. Номер №1
Вставьте пропущенные слова − молекулы, атомы, клетки.
Пример. Слова "ткань", "нить" и "волокно" можно использовать в следующем предложении.
Ткань состоит из нитей, которые сделаны из волокна.
_ состоят из _, в состав которых входят _.
Решение
Клетки состоят из молекул, в состав которых входят атомы.
Номер №2
Подпишите на рисунках 6, 7 органоиды растительной и животной клеток.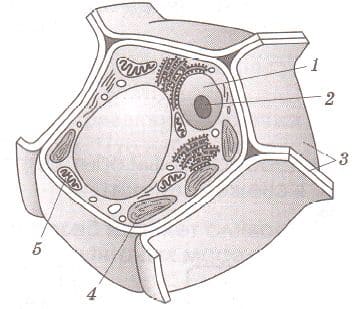
Рис. 6. Растительная клетка
1 − _
2 − _
3 − _
4 − _
5 − _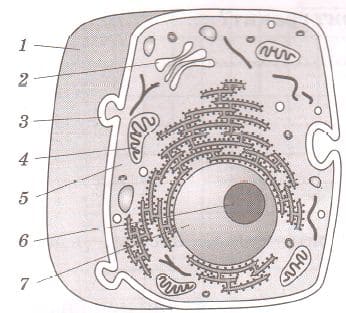
Рис. 7. Животная клетка
1 − _
2 − _
3 − _
4 − _
5 − _
6 − _
7 − _
Решение
Растительная клетка:
1 − ядро
2 − ядрышко
3 − клеточная стенка
4 − хлоропласт
5 − митохондрия
Животная клетка:
1 − клеточная оболочка
2 − аппарат Гольджи
3 − вакуоль
4 − митохондрий
5 − цитоплазма
6 − ядрышко
7 − ядро 36
-
Номер №3
Какие две группы веществ входят в состав растительных и животных клеток?
Решение
В состав растительных и животных клеток входят органические и неорганические вещества.
Номер №4
Лабораторный опыт. Определение содержания воды в свежей зелени.
Правила техники безопасности
Реактивы и оборудование: стебли комнатных растений (или семена фасоли); пробирка, лабораторный штатив, спиртовка, спички, вата, фильтровальная бумага.
Ход работы.
Способ 1. Положите в пробирку небольшой стебель комнатного растения (несколько семян фасоли). Поместите у отверстия пробирки кусочек ваты. Закрепите пробирку в штативе под углом таким образом, чтобы дно было ниже отверстия. Не забудьте, что пробирку закрепляют в верхней части! Нагревайте пробирку (сначала всю, затем − дно) в течение нескольких минут. Что наблюдаете?
Способ 2. Между листов фильтровальной бумаги поместите стебель растения и надавите до промокания фильтровальной бумаги. Что наблюдаете?
Решение
Способ 1. На стенках пробирки образуются капельки воды.
Способ 2. На бумаге остается жирный след. 37
-
Номер №5
Лабораторный опыт. Обнаружение жира в семенах подсолнечника и грецкого ореха.
Реактивы и оборудование: семена подсолнечника, ядро грецкого ореха; лист бумаги.
Ход работы. Для обнаружения жира раздавите семечки (без кожуры), ядро ореха на листе бумаги. Что наблюдаете?
Решение
На листе бумаге образуется жирный след, так как семена подсолнечника, ядро грецкого ореха содержат жиры.
Номер №6
Лабораторный опыт. Обнаружение эфирных масел в апельсиновой корке.
Реактивы и оборудование: апельсиновая корка; лист бумаги, спиртовка, спички.
Ход работы. Выжмите апельсиновую корку над листом бумаги. Что наблюдаете?
Если выжмете кожуру около пламени спиртовки, то брызги масла образуют маленький сноп огня. Очень красиво!
Решение
При выжимании апельсиновой корки на листе бумаги образуются желтые пятна. 38
-
Номер №7
Лабораторный опыт. Обнаружение крахмала в пшеничной муке.
Реактивы и оборудование: иод, пшеничная мука, вода; стакан, чашка Петри, пипетка, марля, шпатель.
Ход работы. Из муки (3−4 шпателя) и небольшого количества воды замесите в чашке Петри немного теста. Поместите кусочек теста в марлю и тщательно промойте его в стакане воды. К полученной мутной воде добавьте несколько капель иода. О чем свидетельствует появление сине−фиолетового окрашивания?
Решение
Появление сине−фиолетового окрашивания свидетельствует о содержании крахмала в муке.
Номер №8
Ответьте на вопрос.
Чем отличаются физические явления от химических реакций?
Решение
При физических явлениях не наблюдается выделение теплоты, света, образование осадка или газ, появление запаха.
Номер №9
Домашний опыт. Взаимодействие аскорбиновой кислоты с йодом (определение витамина С в различных соках)
Реактивы и оборудование: йод, крахмальный клейстер, вода, таблетка аскорбиновой кислоты, различные соки (не яркоокрашенные); стакан, пол−литровая банка, пипетка, мерный стакан, чайная ложка.
Ход работы. Приготовьте раствор крахмала: разведите 1/2 чайной ложки крахмала в 1/2 стакана холодной воды, добавьте в стакан кипятка и оставьте на одну минуту.
Прежде чем приступить у анализу соков, потренируйтесь на чистой аскорбиновой кислоте.
Возьмите 0,5 г аптечной аскорбиновой кислоты, растворите ее в 500 мл воды и отберите с помощью мерного стакана 25 мл раствора. Раствор поместите в поллитровую банку. Добавьте примерно полстакана воды (точное ее количество значения не имеет) и еще чайную ложку крахмального клейстера. Теперь осторожно, по каплям, прибавляйте из аптечной пипетки йод, постоянно взбалтывая содержимое. Внимательно считайте капли и следите за цветом раствора. Как только йод окислит всю аскорбиновую кислоту, следующая же его капля, прореагировав с крахмалом, окрасит раствор в синий цвет.
Но как узнать, сколько израсходовано йода? Капли − не единицы измерения... С помощью той же пипетки посчитайте, сколько капель содержится в аптечной склянке с йодом (она вмещает обычно 10 мл). Не пугайтесь − вся работа займет несколько минут. Зная объем одной капли, можно довольно точно определить объем раствора йода, израсходованного на взаимодействие с аскорбиновой кислотой. Можно проверить, сколько в таблетке было аскорбиновой кислоты. А можно решить и обратную задачу: зная количество кислоты, определить концентрацию йода − действительно ли его раствор пятипроцентный?
Этот несложный способ химического анализа часто используют для определения йода в других веществах. Его называют аскорбинометрией.
Теперь приступайте к решению основной задачи − определению количества витамина С в различных соках. Определение витамина С в соках проводите точно так же, как и в случае с аскорбиновой кислотой, только вместо раствора аскорбиновой кислоты возьмите сок. (1 мл сока соответствует 35 мг аскорбиновой кислоты.)Задание 1. Содержание витамина С в соках.
Определите объем одной капли йода. 10 мл йода содержится _ капель. 1 капля йода − _ мл.
Определите содержание витамина С в двух (трех) любых соках. Оформите отчет, заполнив таблицу 11.
Содержание витамина С в сокахНазвание сока Объем йода, капли Объем йода, мл Количество аскорбиновой кислоты, мг
Задание 2. Влияние железа на сок.
Иногда говорят, что железным ножом нельзя резать фрукты − от этого витамин С разрушается. Проверьте, так ли это, подержав сок в железной посуде. Заполнив таблицу 12.
Влияние железа на сок№ пробы Объем йода, капли Объем йода, мл Количество аскорбиновой кислоты, мг Проба 1. Сок без воздействия железа Проба 2. Сок, который подержали в железной посуде Задание 3. Изменение содержания витамина С в соке при нагревании.
Установите, как меняется содержание витамина С в соке при его нагревании в течение 1 мин, 5 мин, получаса, и сделайте выводы. Запишите данные в таблицу 13.
На содержание витамина С в различных продуктах влияет температурный режим их обработки. Доказано, что при термической обработке продуктов содержание витамина С резко уменьшается.
Изменение содержания витамина С в соке при нагревании№ пробы Объем йода, капли Объем йода, мл Количество аскорбиновой кислоты, мг Проба 1. Сок (время нагревания 1 мин) Проба 2. Сок (время нагревания 5 мин) Проба 3. Сок (время нагревания 30 мин)
Решение
Задание 1. Содержание витамина С в соках.
Определите объем одной капли йода. 10 мл йода содержится _ капель. 1 капля йода − _ мл.
Определите содержание витамина С в двух (трех) любых соках. Оформите отчет, заполнив таблицу 11.
Содержание витамина С в сокахНазвание сока Объем йода, капли Объем йода, мл Количество аскорбиновой кислоты, мг Апельсиновый сок 12 0,6 21 Яблочный сок 4 0,2 7
Задание 2. Влияние железа на сок.
Иногда говорят, что железным ножом нельзя резать фрукты − от этого витамин С разрушается. Проверьте, так ли это, подержав сок в железной посуде. Заполнив таблицу 12.
Влияние железа на сок№ пробы Объем йода, капли Объем йода, мл Количество аскорбиновой кислоты, мг Проба 1. Сок без воздействия железа 7 0,35 12 Проба 2. Сок, который подержали в железной посуде 5 0,25 9
Задание 3. Изменение содержания витамина С в соке при нагревании.
Установите, как меняется содержание витамина С в соке при его нагревании в течение 1 мин, 5 мин, получаса, и сделайте выводы. Запишите данные в таблицу 13.
На содержание витамина С в различных продуктах влияет температурный режим их обработки. Доказано, что при термической обработке продуктов содержание витамина С резко уменьшается.
Изменение содержания витамина С в соке при нагревании№ пробы Объем йода, капли Объем йода, мл Количество аскорбиновой кислоты, мг Проба 1. Сок (время нагревания 1 мин) 4 0,2 7 Проба 2. Сок (время нагревания 5 мин) 2 0,1 3,5 Проба 3. Сок (время нагревания 30 мин) 1 0,05 1,7 41
-
Качественные реакции в химии. Номер №1
Составьте определение понятия "качественные реакции", используя слова: признаками, распознавание, с помощью которых, это химические, сопровождающиеся, проводят, веществ, превращения, характерными.
Ответ: _
Решение
Ответ: Качественные реакции − это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Номер №2
Напишите определение понятия.
Аналитический сигнал − это _
Решение
Аналитический сигнал − это изменение окраски, выпадение осадка или выделение газа (явления) при проведении качественных реакций. 42
-
Номер №3
Лабораторный опыт. Пропускание выдыхаемого воздуха через известковую воду.
Реактивы и оборудование: известковая вода; пробирка, стеклянная палочка (соломинка для коктейля).
Ход работы. Налейте в пробирку 2 мл известковой воды. Через соломинку для коктейля пропустите выдыхаемый воздух в пробирку с известковой водой. Что наблюдаете?
Решение
Наблюдаем помутнение раствора:
Ca(OH)2 + CO2 = CaCO3 + H2O
Номер №4
Лабораторный опыт. Обнаружение пробирки с известковой водой среди различных веществ.
Реактивы и оборудование: известковая вода, 10%−е растворы хлорида натрия, сахарозы, дистиллированная вода; четыре пробирки с номерами, стеклянная палочка (соломинка для коктейля).
Ход работы. В пронумерованных пробирках находятся известковая вода, раствор хлорида натрия, раствор сахарозы, дистиллированная вода. Определите, в какой из пробирок находятся известковая вода, пропуская через жидкости выдыхаемый воздух через соломинку для коктейля.
Вывод. Известковая вода находится в пробирке № _
Решение
Вывод. Известковая вода находится в пробирке, в которой произойдет помутнение раствора: Ca(OH)2 + CO2 = CaCO3 + H2O 43
-
Номер №5
Домашний опыт. Обнаружение крахмала в продуктах питания.
Реактивы и оборудование: иод, хлеб, мука, макаронные изделия, чипсы, неспелое яблоко, маргарин; пипетка, кастрюля, пузырек из−под лекарств, электрическая (газовая) плита.
Ход работы. Вы уже знаете, что крахмал в пищевых продуктах можно обнаружить с помощью иода. Докажите, что различные продукты хлеб, мука, чипсы, макаронные изделия) содержат крахмал. Определите, содержится ли крахмал в яблоках.
Нагрейте в маленькой кастрюле на небольшом огне немного маргарина. Водный слой, образующийся под слоем маргарина, отберите с помощью пипетки и поместите в пузырек. Добавьте примерно такой же объем горячей воды. После остывания добавьте каплю иода.
Сделайте выводы о содержании крахмала в различных продуктах питания, для этого заполните таблицу 14.
Таблица 14
Содержание крахмала в различных продуктах питания
Решение
Таблица 14
Содержание крахмала в различных продуктах питанияПродукт Вывод Мука высокое содержание Чипсы высокое содержание Картофель высокое содержание Макароны высокое содержание Неспелое яблоко повышенное содержание Выпечка низкое содержание Маргарин низкое содержание 44
-
Относительная атомная и молекулярная массы. Номер №1
Заполните пропуски в предложениях.
Абсолютная атомная масса показывает _ , измеряется в следующих единицах: _ .
Относительная атомная масса показывает _ .
Единицы измерения: _ .
Решение
Абсолютная атомная масса во сколько раз масса данного элемента больше одной двенадцатой части атомной массы углерода, измеряется в следующих единицах: г, гк, мг, т.
Относительная атомная масса показывает, во сколько раз масса данного вещества элемента больше массы атома водорода.
Единицы измерения: нет.
Номер №2
Запишите с помощью обозначений округленное до целого числа значение:
а) относительной атомной массы кислорода − _:
б) относительной атомной массы натрия − _;
в) относительной атомной массы меди − _.
Решение
Округленное до целого числа значение:
а) относительной атомной массы кислорода − 16:
б) относительной атомной массы натрия − 23;
в) относительной атомной массы меди − 64.
Номер №3
Приведены названия химических элементов: ртуть, фосфор, водород, сера, углерод, кислород, калий, азот. В пустые клеточки впишите символы элементов таким образом, чтобы получился ряд, в котором относительная атомная масса увеличивается.
Решение
Ряд, в котором относительная атомная масса увеличивается: H, C, N, O, P, S, K, HgСимвол химического элемента Название $A_{r}$ H Водород 1 C Углерод 12 N Азот 14 O Кислород 16 P Фосфор 31 S Сера 32 K Калий 39 Hg Ртуть 201 45
-
Номер №4
Подчеркните верные утверждения.
а) Масса десяти атомов кислорода равна массе двух атомов брома.
б) Масса пяти атомов углерода больше массы трех атомов серы.
в) Масса семи атомов кислорода меньше массы пяти атомов магния.
Решение
а) Масса десяти атомов кислорода равна массе двух атомов брома.
б) Масса пяти атомов углерода больше массы трех атомов серы.
в) Масса семи атомов кислорода меньше массы пяти атомов магния.
Ответ: а.
Номер №5
Заполните схему.
Решение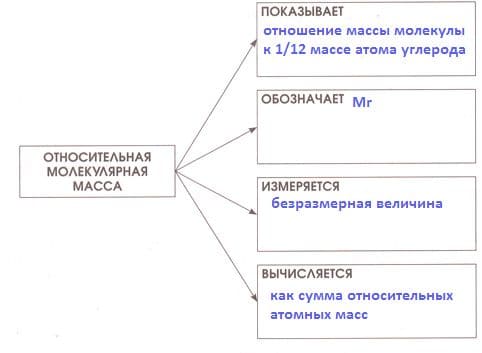
Номер №6
Рассчитайте относительные молекулярные массы веществ по их формулам:
а) Mr ($N_{2}$) = _
б) Mr ($CH_{4}$) = _
в) Mr ($CaCO_{3}$) = _
г) Mr ($NH_{4}Cl$) = _
д) Mr ($H_{3}PO_{4}$) = _
Решение
а) $M_{r}$ ($N_{2}$) = 14 * 2 = 28
б) $M_{r}$ ($CH_{4}$) = 12 + 1 * 4 = 16
в) $M_{r}$ ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100
г) $M_{r}$ ($NH_{4}Cl$) = 14 + 1 * 4 + 35,5 = 53,5
д) $M_{r}$ ($H_{3}PO_{4}$) = 1 * 3 + 31 + 16 * 4 = 98 46
-
Номер №7
Перед вами пирамида, "строительными камнями" которой являются формулы химических соединений. Найдите такой путь с вершины пирамиды к ее основанию, чтобы сумма относительных молекулярных масс соединений была минимальной. При выборе каждого следующего "камня" нужно учитывать, что можно выбирать лишь тот, который непосредственно прилегает к предыдущему.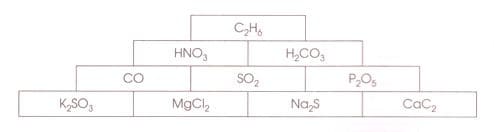
В ответе запишите формулы веществ выигрышного пути.
Ответ: $C_{2}H_{6}$ − _ − _ − _
Решение
Ответ: $C_{2}H_{6}$ − $H_{2}CO_{3}$ − $SO_{2}$ − $Na_{2}S$
$M_{r}$ ($C_{2}H_{6}$) = 12 * 2 + 1 * 6 = 30
$M_{r}$ ($H_{2}CO_{3}$) = 1 * 2 + 12 + 16 * 3 = 62
$M_{r}$ ($SO_{2}$) = 32 + 16 * 2 = 64
$M_{r}$ ($Na_{2}S$) = 23 * 2 + 32 = 78
Номер №8
Лимонная кислота содержится не только в лимонах, но также в незрелых яблоках, смородине, вишне и т.п. Лимонную кислоту используют в кулинарии, в домашнем хозяйстве (например, для выведения ржавых пятен с ткани). Молекула этого вещества состоит из 6 атомов углерода, 8 атомов водорода, 7 атомов кислорода.
Отметьте верное утверждение:
а) относительная молекулярная масса этого вещества равна 185;
б) относительная молекулярная масса этого вещества равна 29;
в) относительная молекулярная масса этого вещества равна 192.
Решение
Формула лимонной кислоты: $C_{6}H_{8}O_{7}$
$M_{r}$ ($C_{6}H_{8}O_{7}$) = 12 * 6 + 1 * 8 + 16 * 7 =192
Отметьте верное утверждение:
а) относительная молекулярная масса этого вещества равна 185;
б) относительная молекулярная масса этого вещества равна 29;
в) относительная молекулярная масса этого вещества равна 192. 47
-
Ответ: в).
Массовая доля химического элемента в сложном веществе. Номер №1
Заполните пропуски в предложениях.
а) В математике "доля" − это отношения части к целому. Для расчета массовой доли элемента нужно его относительную _ _ _ _ _ _ _ _ _ _ _ _ умножить на _ _ _ _ _ _ _ _ _ _ _ _ данного элемента в формуле и разделить на относительную молекулярную массу вещества.
б) Сумма массовых долей всех элементов, входящих в состав вещества, равна _ или _ _ _ %.
Решение
а) В математике "доля" − это отношенеи части к целому. Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
б) Сумма массовых долей всех элементов, входящих в состав вещества, равна 1 или 100%. 48
-
Номер №2
Запишите математические формулы для нахождения массовых долей элементов, если:
а) формула вещества − $P_{2}O_{5}$,
$M_{r}$ = _ * _ _ + _ * _ _ = _ _ _
ω(P) = _ * 100% = _ _ %
ω(O) = _ * 100% = _ _ % или ω(O) = 100 − _ _ = _ _ .
б) формула вещества − $A_{x}B_{y}$
ω(A) = _ * 100%
ω(B) = _ * 100%
Решение а
формула вещества − $P_{2}O_{5}$,
$M_{r}$ = 2 * 31 + 5 * 16 = 142
ω(P) = 2 * 31 : 142 * 100% = 44 %
ω(O) = 5 * 16 : 142 * 100% = 56% или ω(O) = 100 − 44% = 56%.
Решение б
формула вещества − $A_{x}B_{y}$
ω(A) = $\frac{A_{r} (A)\;* \;x}{M_{r}(A_{x}B_{y})}$ * 100%
ω(B) = $\frac{A_{r} (B)\;*\;y}{M_{r}(A_{x}B_{y})}$ * 100%
Номер №3
Рассчитайте массовые доли элементов:
а) в метане ($CH_{4}$);
Дано:
$CH_{4}$
Найти:
ω (C) − ?
ω (H) − ?
Решение:
1) Рассчитаем относительную молекулярную массу метана:
$M_{r}$ ($CH_{4}$) = $A_{r}$ (C) + 4 * $A_{r}$ (H) = _
2) Найдем массовые доли углерода и водорода в соединении:
ω(C) = $\frac{A_{r}(C)\;*\;1}{M_{r}(CH_{4})}$ : * 100% = _ * 100% = _
ω(H) = $\frac{Ar (H) * 4}{Mr (CH_{4})}$ * 100% = _ * 100% = _
Ответ: _
б) в карбонате натрия ($Na_{2}CO_{3}$).
Дано:
$Na_{2}CO_{3}$
Найти:
ω (Na) − ?
ω (C) − ?
ω (O) − ?
Решение: _
Ответ: _
Решение а
Дано:
$CH_{4}$
Найти:
ω (C) − ?
ω (H) − ?
Решение:
1) Рассчитаем относительную молекулярную массу метана:
$M_{r}$ ($CH_{4}$) = $A_{r}$ (C) + 4 * $A_{r}$ (H) = 12 + 4 * 1 = 16
2) Найдем массовые доли углерода и водорода в соединении:
ω(C) = $\frac{Ar (C) * 1}{Mr (CH_{4})}$ * 100% = $\frac{12 * 1}{16}$ * 100% = 75%
ω(H) = $\frac{Ar (H) * 4 }{Mr (CH_{4})}$ * 100% = $\frac{1 * 4}{16}$ * 100% = 25%
Ответ: ω(C) = 75%; ω(H) = 25%
Решение б
Дано:
$Na_{2}CO_{3}$
Найти:
ω (Na) − ?
ω (C) − ?
ω (O) − ?
Решение:
1) Рассчитаем относительную молекулярную массу карбоната натрия:
$M_{r}$ ($Na_{2}CO_{3}$) = 2 * $A_{r}$ (Na) + $A_{r}$ (C) + 3 * $A_{r}$ (O) = 2 * 23 + 12 + 3 * 16 = 106
2) Найдем массовые доли углерода и водорода в соединении:
ω(Na) = $\frac{Ar (Na) * 2}{Mr (Na_{2}CO_{3})}$ * 100% = $\frac{23 * 2}{106}$ * 100% = 43%
ω(C) = $\frac{Ar (C)}{Mr (Na_{2}CO_{3}) }$ * 100% = $\frac{12}{106}$ * 100% = 11%
ω(O) = $\frac{Ar (O) * 3}{Mr (Na_{2}CO_{3})}$ * 100% = $\frac{16 * 3}{106}$ * 100% = 46%
Ответ: ω(Na) = 43%; ω(C) = 11%; ω(O) = 46%
Номер №4
Сравните массовые доли указанных элементов в веществах и поставьте знак <, > или =
а) ω $(S)_{SO_{3}}$ _ ω $(S)_{SO_{2}}$
б) ω $(O)_{CO_{2}}$ _ ω $(O)_{SiO_{2}}$
в) ω $(Cl)_{CaCl_{2}}$ _ ω $(Cl)_{HCl}$
Решение
а) ω $(S)_{SO_{3}}$ < ω $(S)_{SO_{2}}$
б) ω $(O)_{CO_{2}}$ > ω $(O)_{SiO_{2}}$
в) ω $(Cl)_{CaCl_{2}}$ < ω $(Cl)_{HCl}$
Вычисления:
ω = $\frac{A_{r} * n}{M_{r}}$, где n − индекс
а) $M_{r}$ ($SO_{3}$) = 32 + 16 * 3 = 80
ω (S) = $\frac{32}{80}$ * 100% = 40%
$M_{r}$ ($SO_{2}$) = 32 + 16 * 2 = 64
ω (S) = $\frac{32}{64}$ * 100% = 50%
б) $M_{r}$ ($CO_{2}$) = 12 + 16 * 2 = 44
ω (O) = $\frac{16 * 2}{44}$ * 100% = 73%
$M_{r}$ ($SiO_{2}$) = 28 + 16 * 2 = 60
ω (O) = $\frac{16 * 2}{60}$ * 100% = 53%
в) $M_{r}$ ($CaCl_{2}$) = 40 + 35,5 * 2 = 111
ω (Cl) = $\frac{35,5 * 2}{111}$ * 100% = 64%
$M_{r}$ ($HCl$) = 1 + 35,5 = 36,5
ω (Cl) = $\frac{35,5}{36,5}$ * 100% = 97% 48-49
-
Номер №5
В соединении кремния с водородом массовая доля кремния равна 87,5%, водорода 12,5%. Относительная молекулярная масса вещества равна 32. Определите формулу этого соединения.
Дано:
$Si_{x}H_{y}$
ω (Si) = 87,5% = 0,875
ω (H) = 12,5% = 0,125
$M_{r}(Si_{x}H_{y})$ = 32
Найти:
$Si_{x}H_{y}$ − ?
Решение:
1) Выразим массовые доли кремния и водорода в соединении:
ω (Si) = $\frac{A_{r}(Si)\;* \;x}{M_{r}(Si_{x}H_{y})}$;
ω (H) = $\frac{A_{r}(H)\;*\;y}{M_{r}(Si_{x}H_{y})}$.
2) Из этих формул выразим неизвестные x и y:
x = _
y = _
3) Подставим в формулы все данные и найдем значения x и y:
x = _
y = _
4) Вместо x и y в формуле соединения запишем найденные значения Si _ H _
Ответ: _
Решение
Дано:
$Si_{x}H_{y}$
ω (Si) = 87,5% = 0,875
ω (H) = 12,5% = 0,125
$M_{r}(Si_{x}H_{y})$ = 32
Найти:
$Si_{x}H_{y}$ − ?
Решение:
1) Выразим массовые доли кремния и водорода в соединении:
ω (Si) = $\frac{A_{r}(Si)\;* \;x}{M_{r}(Si_{x}H_{y})}$;
ω (H) = $\frac{A_{r}(H)\;*\;y}{M_{r}(Si_{x}H_{y})}$.
2) Из этих формул выразим неизвестные x и y:
x = ω (Si) * $M_{r}(Si_{x}H_{y})\;:\;A_{r} (Si)$
y = ω (H) * $M_{r}(Si_{x}H_{y})\;:\;A_{r}(H)$
3) Подставим в формулы все данные и найдем значения x и y:
x = 0,875 * 32 : 28 = 1
y = 0,125 * 32 : 1 = 4
4) Вместо x и y в формуле соединения запишем найденные значения $SiH_{4}$.
Ответ: $SiH_{4}$. 50
-
Номер №6
Массовые доли элементов в соединении отражены в диаграмме.
Определите формулу этого вещества, если известно, что его относительная молекулярная масса равна 100.
Решение
Дано:
ω (Ca) = 40%
ω (C) = 12%
ω (O) = 48%
$M_{r}(Ca_{x}C_{y}O_{z})$ = 100
Найти:
формула − ?
Решение:
n = ω : $A_{r}$, где n − индекс
x = 40% : 40 = 1
y = 12% : 12 = 1
z = 48% : 16 = 3
$CaCO_{3}$ − формула
$M_{r}$ ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100, следовательно, молекулярная формула выведена верно.
Ответ: $CaCO_{3}$
Номер №7
Этилен является природным стимулятором созревания плодов: его накопление в плодах ускоряет их созревание. Чем раньше начинается накопление этилена, тем раньше созревают плоды. Поэтому этилен используют для искусственного ускорения созревания плодов. Выведите формулу этилена, если известно, что массовая доля углерода составляет 85,7%, массовая доля водорода − 14,3%. Относительная молекулярная масса этого вещества равна 28.
Решение
Дано:
ω (C) = 85,7%
ω (H) = 14,3%
$M_{r}(C_{x}H_{y})$ = 28
Найти:
Формула − ?
Решение:
n = ω : $A_{r}$, где n − индекс
x = 85,7% : 12 = 7
y = 14,3% : 1 = 14
x : y = 7 : 14 = 1 : 2
$CH_{2}$ − простейшая формула
$M_{r1} (CH_{2})$ = 12 + 1 * 2 = 14
$M_{r} (C_{x}H_{y})$ : $M_{r1}(CH_{2})$ = 28 : 14 = 2
$C_{2}H_{4}$ − истинная формула
Ответ: $C_{2}H_{4}$.
Номер №8
Выведите химическую формулу вещества, если известно, что
а) ω(Ca) = 36%, ω(Cl) = 64%;
б) ω(Na) 29,1%, ω(S) = 40,5%, ω(O) = 30,4%.
Решение а
Дано:
ω (Ca) = 36%
ω (Cl) = 64%
Найти:
Формула − ?
Решение:
n = ω : $A_{r}$, где n − индекс
n (Ca) = 36% : 40 = 0,9 = 1
n (Cl) = 64% : 35,5 = 1,8 = 2
$CaCl_{2}$ − формула
Ответ: $CaCl_{2}$.
Решение б
Дано:
ω (Na) = 29,1%
ω (S) = 40,5%
ω (O) = 30,4%
Найти:
Формула − ?
Решение:
n = ω : $A_{r}$, где n − индекс
n (Na) = 29,1% : 23 = 1,27
n (S) = 40,5% : 32 = 1,27
n (O) = 30,4% : 16 = 1,9
n (Na) : n (S) : n (O) = 1,27 : 1,27 : 1,9 = 1 : 1 : 1,5 = 2 : 2 : 3
$Na_{2}S_{2}O_{3}$ − формула
Ответ: $Na_{2}S_{2}O_{3}$.
Номер №9
Ляпис обладает противомикробными свойствами. Раньше его применяли для прижигания бородавок. В небольших концентрациях он действует как противовоспалительное и вяжущее средство, но может вызвать ожоги. Выведите формулу ляписа, если известно, что в его состав входит 63,53% серебра, 8,24% азота, 28,23% кислорода.
Решение
Дано:
ω (Ag) = 63,53%
ω (N) = 8,24%
ω (O) = 28,23%
Найти:
формула − ?
Решение:
n = ω : $A_{r}$, где n − индекс
n (Ag) = 63,53% : 108 = 0,588
n (N) = 8,24% : 14 = 0,588
n (O) = 28,23% : 16 = 1,76
n (Ag) : n (N) : n (O) = 0,588 : 0,588 : 1,76 = 1 : 1 : 3
$AgNO_{3}$ − формула.
Ответ: $AgNO_{3}$. 52
-
Чистые вещества и смеси. Номер №1
Запишите определение.
Смеси − это _
Решение
Смеси − это система, состоящая из двух или более веществ.
Номер №2
Заполните пропуски в предложениях.
_ _ _ _ _ _ _ _ _ _ _ _ _ называются смеси, в которых частички составляющих их веществ видны невооруженным глазом или под микроскопом.
_ _ _ _ _ _ _ _ _ _ _ называются смеси, в которых частички составляющих их веществ нельзя увидеть даже с помощью увеличительных приборов.
Решение
Гетерогенные называются смеси, в которых частички составляющих их веществ видны невооруженным глазом или под микроскопом.
Гомогенные называются смеси, в которых частички составляющих их веществ нельзя увидеть даже с помощью увеличительных приборов.
Номер №3
Подчеркните названия смесей.
Мрамор, сталь, поваренная соль, резина, кислород, молоко, зубная паста, речная вода, метан, воздух, апельсиновый сок, кровь.
Решение
Мрамор, сталь, поваренная соль, резина, кислород, молоко, зубная паста, речная вода, метан, воздух, апельсиновый сок, кровь. 53
-
Номер №4
Подчеркните "лишнее" слово в каждой группе.
а) бензин, спирт, сок, молоко;
б) медь, алюминий, цемент, сера;
в) воздух, уксус, морская вода, песок;
г) бензин, молоко, гранит, поливитамины.
Решение
а) бензин, спирт, сок, молоко, (так как спирт − это чистое вещество);
б) медь, алюминий, цемент, сера, (так как цемент − это смесь веществ);
в) воздух, уксус, морская вода, песок, (так как песок − твердое вещество);
г) бензин, молоко, гранит, поливитамины, (так как поливитамины − смесь биологически активных веществ).
Номер №5
Приведите примеры смесей, использующихся:
а) в быту − _;
б) в косметической промышленности − _;
в) в организме человека − _ .
Решение
Примеры смесей, использующихся:
а) в быту − раствор поваренной соли, сахарный раствор;
б) в косметической промышленности − шампунь, крем;
в) в организме человека − кровь, пот.
Номер №6
Заполните таблицу 15.
Таблица 15
Примеры смесей, компоненты которых находятся в различных агрегатных состоянияхАгрегатное состояние веществ в смеси Примеры смесей Вид смеси (однородная, неоднородная) Твердое−твердое Жидкое−твердое Жидкое−жидкое Газообразное−жидкое Газообразное−твердое Газообразное−твердое
Решение
Таблица 15
Примеры смесей, компоненты которых находятся в различных агрегатных состоянияхАгрегатное состояние веществ в смеси Примеры смесей Вид смеси (однородная, неоднородная) Твердое−твердое Латунь Однородная Жидкое−твердое Минеральная вода Однородная Жидкое−жидкое Столовый уксус Однородная Газообразное−жидкое Туман Неоднородная Газообразное−твердое Дым от пожара Неоднородная Газообразное−твердое Воздух Однородная 54
-
Объемная доля газа в смеси. Номер №1
Перед вами диаграммы вдыхаемого и выдыхаемого воздуха.
Рис. 8. Диаграмма вдыхаемого воздуха
Рис. 9. Диаграмма выдыхаемого воздуха
Подпишите на диаграммах компоненты вдыхаемого и выдыхаемого воздуха.
Решение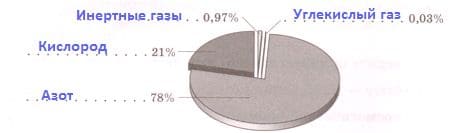
Рис. 8. Диаграмма вдыхаемого воздуха
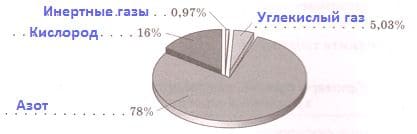
Рис. 9. Диаграмма выдыхаемого воздуха
Номер №2
Составьте определение, используя следующие слова: к общему объему, смеси, объема газа, отношение, объемная, газа, в смеси, доля.
Решение
Объемной долей газа в смеси называют отношение объема данного газа к общему объему смеси.
Номер №3
Запишите формулу составленного определения.
Решение
φ = V (газа) : V (смеси) * 100%
Номер №4
Составьте формулу для нахождения объема газа в смеси по объемной доле газа в смеси и общему объему смеси.
Решение
V (газа) = V (смеси) * φ
Номер №5
В качестве анестезирующего средства раньше использовали смесь "веселящего газа" ($N_{2}O$) и кислорода. Вычислите объемные доли каждого газа в смеси, применяемой для анестезии, если смешали 160л "веселящего газа" и 40л кислорода.
Решение
Дано:
V ($N_{2}O$) = 160 л
V ($O_{2}$) = 40 л
Найти:
φ ($N_{2}O$) − ?
φ ($O_{2}$) − ?
Решение:
φ = V (газа) : V (смеси) * 100%
V (смеси) = 160 л + 40 л = 200 л
φ ($N_{2}O$) = 160 л : 200 л * 100% = 80%
φ ($O_{2}$) = 40 л : 200 л * 100% = 20%
Ответ: φ ($N_{2}O$) = 80%; φ ($O_{2}$) = 20%
Номер №6
Объемная доля кислорода в атмосферном воздухе 21%. Какой объем воздуха необходим для получения 14 л кислорода?
Решение
Дано:
φ ($O_{2}$) = 21%
V ($O_{2}$) = 14 л
Найти:
V (воздуха) − ?
Решение:
φ = V (газа) : V (воздуха) * 100%
V (воздуха) = V (газа) : φ
V (воздуха) = 14 л : 0,21 = 66,67 л
Ответ: V (воздуха) = 66,67 л
Номер №7
Карбоген − смесь углекислого газа с кислородом − средство для возбуждения дыхательного центра. Его применяют в медицине в случае резкого угнетения дыхания. Рассчитайте объем кислорода в 150 л карбогена, если объемная доля углекисилого газа ($CO_{2}$) в этой смеси равна 5%.
Решение
Дано:
φ ($CO_{2}$) = 5%
V (смеси) = 150 л
Найти:
V ($O_{2}$) − ?
Решение:
φ = V (газа) : V (смеси) * 100%
V ($O_{2}$) = V (смеси) * φ
φ ($O_{2}$) = 100% − φ ($CO_{2}$) = 100% − 5% = 95%
V ($O_{2}$) = 150 л * 0,95 = 143 л
Ответ: V ($O_{2}$) = 143 л 56
-
Массовая доля вещества в растворе. Номер №1
Заполните пропуски.
а) Раствор = _ + _ ;
б) m (раствора) = m ( _ ) + m ( _ ).
Решение
а) Раствор = растворенное вещество + растворитель;
б) m (раствора) = m (в−ва) + m (р−ля).
Номер №2
Составьте определение, используя следующие слова: массовая доля, вещества, массы, раствора, к массе, отношение, в растворе, вещества, растворенного.
Решение
Массовая доля вещества в растворе − это отношение массы растворенного вещества к массе раствора.
Номер №3
Составьте формулы, используя обозначения величин.m $m_{р-ра}$ V ρ w $m_{в-ва}$ Решение
1) m = V * ρ
2) $m_{р-ра} = m_{в-ва}$ * w
3) V = $m_{в-ва}$ * w 57
-
Номер №4
Какова массовая доля растворенного вещества, если известно, что в 80 г раствора содержится 20 г соли?
Решение
Дано:
$m_{р-ра}$ = 80 г
$m_{в-ва}$ = 20 г
Найти:
w − ?
Решение:
w = $m_{в-ва}$ : $m_{р-ра}$ * 100%
w = 20 г : 80 г * 100% = 25%
Ответ: w = 25%
Номер №5
Определите массы соли и воды, которые потребуются для приготовления 300 г раствора с массовой долей соли 20%.
Решение
Дано:
$m_{р-ра}$ = 300 г
w = 20%
Найти:
$m_{в-ва}$ − ?
$m_{воды}$ − ?
Решение:
w = $m_{в-ва}$ : $m_{р-ра}$ * 100%
$m_{в-ва}$ = $m_{р-ра}$ * w
$m_{в-ва}$ = 300 г * 0,2 = 60 г
$m_{воды}$ = $m_{р-ра}$ − $m_{в-ва}$
$m_{воды}$ = 300 г − 60 г = 240 г
Ответ: $m_{в-ва}$ = 60 г; $m_{воды}$ = 240 г
Номер №6
Вычислите массу воды, необходимую для приготовления 60 г 10%−го растора соли.
Решение
Дано:
$m_{р-ра}$ = 60 г
w = 10%
Найти:
$m_{воды}$ − ?
Решение:
w = $m_{в-ва}$ : $m_{р-ра}$ * 100%
$m_{в-ва}$ = $m_{р-ра}$ * w
$m_{в-ва}$ = 60 г * 0,1 = 6 г
$m_{воды}$ = $m_{р-ра}$ − $m_{в-ва}$
$m_{воды}$ = 60 г − 6 г = 54 г
Ответ: $m_{воды}$ = 54 г 58
-
Номер №7
В аптеке продается порошок "Регидрон", который используют при обезвоживании организма. Один пакет порошка содержит 3,5 г хлорида натрия (NaCl), 2,5 г хлорида калия (KCl), 2,9 г цитрата натрия ($Na_{3}C_{6}H_{5}O_{7}$) и 10 г глюкозы ($C_{6}H_{12}O_{6}$). Содержимое пакета растворяют в 1 л воды. Определите массовые доли всех компонентов порошка "Регидрон" в полученном растворе.
Решение
Дано:
m (NaCl) = 3,5 г
m (KCl) = 2,5 г
m ($Na_{3}C_{6}H_{5}O_{7}$) = 2,9 г
m ($C_{6}H_{12}O_{6}$) = 10 г
V ($H_{2}O$) = 1л
Найти:
w (компонентов) − ?
Решение:
1 л воды = 1000 г воды
$m_{р-ра}$ = 1000 г + 3,5 г + 2,5 г + 2,9 г + 10 г = 1018,9 г
w = $m_{в-ва}$ : $m_{р-ра}$ * 100%
w (NaCl) = 3,5 г : 1018,9 г * 100% = 0,34%
w (KCl) = 2,5 г : 1018,9 г * 100% = 0,25%
w ($Na_{3}C_{6}H_{5}O_{7}$) = 2,9 г : 1018,9 г * 100% = 0,28%
w ($C_{6}H_{12}O_{6}$) = 10 г : 1018,9 г * 100% = 0,98%
Ответ: w (NaCl) = 0,34%; w (KCl) = 0,25%; w ($Na_{3}C_{6}H_{5}O_{7}$) = 0,28%; w ($C_{6}H_{12}O_{6}$) = 0,98%
Номер №8
К 500 г 20%−го раствора глюкозы добавили 300 г воды. Рассчитайте массовую долю глюкозы в новом растворе.
Решение
Дано:
$m_{р-ра}$ = 500 г
w = 20%
$m_{воды}$ = 300 г
Найти:
$w_{1}$ − ?
Решение:
$w_{1}$ = $\frac{m (в-ва)}{m (р-ра) + m (воды)}$ * 100%
$m_{в-ва}$ = $m_{р-ра}$ * w
$m_{в-ва}$ = 500 г * 0,2 = 100 г
$w_{1}$ = $\frac{100 г}{500 г + 300 г}$ * 100% = 12,5%
Ответ: $w_{1}$ = 12,5%
Номер №9
К 400 г 5%−го раствора поваренной соли добавили 50 г соли. Рассчитайте массовую долю хлорида натрия в новом растворе.
Решение
Дано:
$m_{р-ра}$ = 400 г
w = 5%
$m_{соли}$ = 50 г
Найти:
$w_{1}$ − ?
Решение:
$w_{1}$ = $\frac{m (в-ва) + m (соли)}{m (р-ра) + m (соли)}$ * 100%
$m_{в-ва}$ = $m_{р-ра}$ * w
$m_{в-ва}$ = 400 г * 0,05 = 20 г
$w_{1}$ = $\frac{20 г + 50 г}{400 г + 50 г}$ * 100% = 15,6%
Ответ: $w_{1}$ = 15,6% 59
-
Номер №10
Слили два раствора соли: 100 г 20%−го и 450г 10%−го. Рассчитайте массовую долю соли в новом растворе.
Решение
Дано:
$m_{1}$ (р−ра) = 100 г
$w_{1}$ = 20%
$m_{2}$ (р−ра) = 450 г
$w_{2}$ = 10%
Найти:
$w_{1}$ − ?
Решение:
$w_{1}$ = $\frac{m_{1} (в-ва) + m_{2} (в-ва)}{m_{1} (р-ра) + m_{2} (р-ра)}$ * 100%
$m_{в-ва}$ = $m_{р-ра}$ * w
$m_{1}$ (в−ва) = 100 г * 0,2 = 20 г
$m_{2}$ (в−ва) = 450 г * 0,1 = 45 г
$w_{1}$ = $\frac{20 г + 45 г}{100 г + 450 г}$ * 100% = 11,8%
Ответ: $w_{1}$ = 11,8%
Практическая работа №3. Цель. Номер №1
Цель: _
Реактивы и оборудование: растворяемое вещество (поваренная соль, сахар, лимонная кислота, натриевая селитра), вода; весы с разновесами, стакан, мерный цилиндр, стеклянная палочка, фильтрованная бумага.
Решение
Цель: приготовление раствора с заданной массовой долей путем растворения рассчитанной массы твердого вещества в определенном объеме воды.
Реактивы и оборудование: растворяемое вещество (поваренная соль, сахар, лимонная кислота, натриевая селитра), вода; весы с разновесами, стакан, мерный цилиндр, стеклянная палочка, фильтрованная бумага.
Задание 1. Номер №1
Прочитайте инструкцию в практической работе №3 на с.77 учебника.
Решение
Прочитайте инструкцию в практической работе №3 на с.77 учебника. 61
-
Задание 2. Номер №1
Рассчитайте массу растворенного вещества и объем воды, необходимые для приготовления раствора.
Решение
Дано:
m (р−ра) = 80 г
w = 10%
Найти:
$m_{р.в.}$ − ?
V ($H_{2}O$) − ?
Решение:
$m_{р.в.}$ = m (р−ра) * w = 80 г * 0,1 = 8 г
m ($H_{2}O$) = m (р−ра) − $m_{р.в.}$ = 80 г − 8 г = 72 г
V ($H_{2}O$) = m ($H_{2}O$) * ρ = 72 г * 1г/мл = 72 мл
Ответ: $m_{р.в.}$ = 8 г; V ($H_{2}O$) = 72 мл
Задание 2. Номер №2
Взвесьте растворяемое вещество в соответствии с рассчитанной массой.
Решение
Правила взвешивания
1) Проверьте, находятся ли весы в равновесии, и если нет, уравновесьте их с помощью кусочков бумаги.
2) Не кладите вещества на чашу весов! Взвешивайте его обязательно на листе фильтровальной бумаги.
3) Располагая на весах взвешиваемый предмет или разновесы, придерживайте чашу весов (не стрелку), чтобы избежать резких колебаний чаши и не испортить весы.
4) Разновесы кладите только пинцетом, чтобы не изменить их массу.
5) При взвешивании разновесы размещайте на правой чаше весов, а взвешиваемое вещество − на левой (для левшей − наоборот).
6) Разновесы ставьте на чашу весов всегда в определенном поядке: начните с более тяжелого разновеса. Если он слишком тяжел, то снимите его и положите следующий, более легкий. Если масса разновесов мала, то не снимая их, дополните более тяжелыми.
7) Масса взвешиваемого вещества не должна превышать максимальную массу, на которую рассчитаны весы.
8) По оканчании взвешивания чаши весов необходимо протереть.
Задание 2. Номер №3
Отмерьте вычисленный вами объем воды. Воду в мерный цилиндр наливают так, чтобы нижний край мениска находился на уровне необходимого деления цилиндра. Соблюдайте правильное положение цилиндра относительно глаз (рис.10) при наполнении его жидкостью!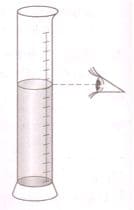
Рис. 10. Отмеривание воды с помощью мерного цилиндра
Решение
Отмерили вычисленный объем воды и налили в цилиндр.
Задание 2. Номер №4
Пересыпьте вещество в химический стакан, добавьте отмеренный объем воды. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
Решение
Пересыпали вещество в химический стакан, добавили отмеренный объем воды. Перемешивая содержимое стакана стеклянной палочкой, добились полного растворения вещества в воде.
Задание 2. Номер №5
Приготовленный раствор покажите учителю и затем перелейте его в склянку с соответствующей этикеткой.
Решение
Приготовленный раствор показали учителю и затем перелили его в склянку с соответствующей этикеткой.
Задание 3. Номер №1
Объясните, что означает фраза: определите массовую долю вещества в растворе.
Решение
Фраза: определите массовую долю вещества в растворе означает найти отношение массы вещества к массе раствора. 62
-
Задание 3. Номер №2
В плодах томатов содержится 94% воды. Рассчитайте, сколько воды поступит в организм, есть съесть один помидор. (Масса одного среднего по величине помидора равна 150 г.)
Решение
Дано:
w ($H_{2}O$) = 94%
m (помидора) = 150 г
Найти:
m ($H_{2}O$) − ?
Решение:
m ($H_{2}O$) = m (помидора) * w ($H_{2}O$) = 150 г * 0,94 = 141 г
Ответ: m ($H_{2}O$) = 141 г 63
-
Массовая доля примесей. Номер №1
Запишите в прямоугольниках названия компонентов технического образца.
Технический образец = _ + _
Решение
Технический образец = чистое вещество + примеси
Массовая доля примесей. Номер №2
В пустые прямоугольники впишите цифры, указывающие правильную последовательность слов в предложении.
Массовая доля примесей − это _
_ − образца
_ − массы
_ − примесей
_ − отношение
_ − к массе
Решение
5 − образца
2 − массы
3 − примесей
1 − отношение
4 − к массе
Массовая доля примесей − это отношение массы примесей к массе образца.
Массовая доля примесей. Номер №3
На этикетках реактивов используется маркировка : "ос.ч." − особо чистые − используют для изготовления электроники, космической техники; "х.ч." − химически чистые − научно−исследовательские и лабораторные работы; "ч.д.а." − чистые для анализа − для анализа технических продуктов; "ч." − чистые − используют в промышленности; "т." − технические. Проранжируйте реактивы с различной маркировкой по уменьшению процентного содержания в них примесей:
_ "ч.д.а.", _ "ос.ч.", _ "ч.", _ "х.ч.", _ "т.".
Решение
На этикетках реактивов используется маркировка : "ос.ч." − особо чистые − используют для изготовления электроники, космической техники; "х.ч." − химически чистые − научно−исследовательские и лабораторные работы; "ч.д.а." − чистые для анализа − для анализа технических продуктов; "ч." − чистые − используют в промышленности; "т." − технические. Проранжируйте реактивы с различной маркировкой по уменьшению процентного содержания в них примесей:
3 "ч.д.а.", 5 "ос.ч.", 2 "ч.", 4 "х.ч.", 1 "т.".
Массовая доля примесей. Номер №4
При очистке 560 г технического известняка было получено 28 г примесей. Рассчитайте массовую долю примесей в известняке.
Решение
Дано:
$m_{техн}$ = 560 г
$m_{прим}$ = 28 г
Найти:
$w_{прим}$ − ?
Решение:
$w_{прим}$ = $m_{прим}$ : $m_{техн.}$ * 100% = 28 г : 560 г * 100% = 5%
Ответ: $w_{прим}$ = 5% 64
-
Массовая доля примесей. Номер №5
Основным компонентом природного газа является метан. Но в природном газе присутствуют примеси, например ядовитый газ − сероводород. Сероводород вызывает головокружеие, тошноту и рвоту, а при дыхании в большом количестве − поражение мышцы сердца и судороги, вплоть до смертельного исхода. Рассчитайте массовую долю примеси сероводорода, если известно, что на 1 кг природного газа приходится не более 50 г этого ядовитого газа.
Решение
Дано:
$m_{техн}$ = 1 кг
$m_{прим}$ = 50 г
Найти:
$w_{прим}$ − ?
Решение:
$w_{прим}$ = $m_{прим}$ : $m_{техн}$ * 100% = 50 г : 1000 г * 100% = 5%
Ответ: $w_{прим}$ = 5%
Массовая доля примесей. Номер №6
При химическом анализе старинного кольца массой 5,34 г было выяснено, что оно на 92,5% состоит из золота, остальное − примеси других месталлов. Рассчитайте массу примесей в кольце.
Решение
Дано:
$m_{техн}$ = 5,34 г
$w_{чист}$ = 92,5%
Найти:
$m_{прим}$ − ?
Решение:
$w_{прим}$ = 100% − 92,5% = 7,5%
$m_{прим}$ = $m_{техн}$ * $w_{прим}$ = 5,34 г * 0,075 = 0,4 г
Ответ: $m_{прим}$ = 0,4 г 65
-
Готовимся к контрольной работе. Номер №1
Рассчитайте относительную молекулярную массу веществ.
$M_{r}$ ($AlPO_{4}$) = _
$M_{r}$ ($CaSiO_{3}$) = _
$M_{r}$ ($Na_{2}SO_{4}$) = _
Решение
$M_{r}$ ($AlPO_{4}$) = 27 + 31 + 16 * 4 = 122
$M_{r}$ ($CaSiO_{3}$) = 40 + 28 + 16 * 3 = 116
$M_{r}$ ($Na_{2}SO_{4}$) = 23 * 2 + 32 + 16 * 4 = 142
Номер №2
Найдите массовые доли элементов в соединении, формула которого $MgSO_{4}$.
Решение
Дано:
$MgSO_{4}$
Найти:
ω (Mg) − ?
ω (S) − ?
ω (O) − ?
Решение:
ω = $\frac{n * A_{r}}{M_{r}}$ * 100%, где n − индекс
$M_{r}$ ($MgSO_{4}$) = 24 + 32 + 16 * 4 = 120
ω (Mg) = $\frac{1 * 24}{120}$ * 100% = 20%
ω (S) = $\frac{1 * 32}{120}$ * 100% = 27%
ω (O) = $\frac{4 * 16}{120}$ * 100% = 53%
Ответ: ω (Mg) = 20%; ω (S) = 27%; ω (O) = 53%
Номер №3
Массовая доля кальция в соединении равна 40%, углерода − 12%, кислорода − 48%. Выведите формулу данного соединения.
Решение
Дано:
ω (Ca) = 40%
ω (C) = 12%
ω (O) = 48%
Найти:
формула − ?
Решение:
n = $\frac{ω}{A_{r}}$, где n − индекс
$\frac{ω (Ca)}{A_{r} (Ca)}$ : $\frac{ω (C)}{A_{r} (C)}$ : $\frac{ω (O)}{A_{r} (O)}$ = $\frac{40}{40}$ : $\frac{12}{12}$ : $\frac{48}{16}$ = 1 : 1 : 3
$CaCO_{3}$ − формула соединения
Ответ: $CaCO_{3}$ 66
-
Номер №4
Смешали 3 л кислорода и 9 л азота. Найдите объемную долю каждого газа в полученной смеси.
Решение
Дано:
V ($O_{2}$) = 3 л
V ($N_{2}$) = 9 л
Найти:
φ ($O_{2}$) − ?
φ ($N_{2}$) − ?
Решение:
φ (газа) = V (газа) : V (смеси) * 100%
V (смеси) = 3 л + 9 л = 12 л
φ ($O_{2}$) = 3 л : 12 л * 100% = 25%
φ ($N_{2}$) = 9 л : 12 л * 100% = 75%
Ответ: φ ($O_{2}$) = 25%; φ ($N_{2}$) = 75%
Номер №5
Объемная доля кислорода в воздухе равна 21%. Какой объем воздуха необходим для получения 35 л кислорода?
Решение
Дано:
φ ($O_{2}$) = 21%
V ($O_{2}$) = 35 л
Найти:
V (воздуха) − ?
Решение:
φ ($O_{2}$) = V ($O_{2}$) : V (воздуха) * 100%
V (воздуха) = V ($O_{2}$) : φ ($O_{2}$)
V (воздуха) = 35 л : 0,21 = 166,67 л
Ответ: V (воздуха) = 166,67 л
Номер №6
В 180 г воды растворили 20 г сахара. Определите массовую долю сахара в полученном растворе.
Решение
Дано:
m ($H_{2}O$) = 180 г
m (сахара) = 20 г
Найти:
ω (сахара) − ?
Решение:
ω = $m_{в-ва}$ : $m_{р-ра}$ * 100%
$m_{р-ра}$ = m ($H_{2}O$) + m (сахара) = 180 г + 20 г = 200 г
ω (сахара) = 20 г : 200 г * 100% = 10%
Ответ: ω (сахара) = 10% 67
-
Номер №7
При выпаривании 80 г раствора получили 4 г соли. Определите массовую долю вещества в исходном растворе.
Решение
Дано:
$m_{р-ра}$ = 80 г
m (соли) = 4 г
Найти:
ω (соли) − ?
Решение:
ω = $m_{в-ва}$ : $m_{р-ра}$ * 100%
ω (соли) = 4 г : 80 г * 100% = 5%
Ответ: ω (соли) = 5%
Номер №8
Массовая доля примесей в известняке составляет 8%. Найдите массу примесей в 350 г известняка.
Решение
Дано:
ω (примесей) = 8%
m (известняка) = 350 г
Найти:
m (примесей) − ?
Решение:
m (примесей) = m (известняка) * ω (примесей) = 350 г * 0,08 = 28 г
Ответ: m (примесей) = 28 г 68
-
Разделение смесей. Номер №1
Заполните пропуски в тексте, используя слова: компоненты, различиях, двух, физических.
Смесь может быть приготовлена путем смешивания как минимум _ веществ. Смеси могут быть разделены на отдельные _ с помощью _ методов, основанных на _ физических свойствах компонентов.
Решение
Смесь может быть приготовлена путем смешивания как минимум двух веществ. Смеси могут быть разделены на отдельные компоненты с помощью физических методов, основанных на различиях физических свойствах компонентов.
Номер №2
Допишите предложения.
а) Метод отстаивания основан на _ .
б) Метод центрифугирования основан на _ .
в) Метод фильтрования основан на _ .
Решение
а) Метод отстаивания основан на различной плотности компонентов.
б) Метод центрифугирования основан на различной массе компонентов.
в) Метод фильтрования основан на различной растворимости компонентов. 69
-
Номер №3
Вставьте пропущенное слово:
а) мука и сахарный песок − сито; сера и железные опилки − _ .
б) вода и подсолнечное масло − делительная воронка; вода и речной песок − _ .
в) воздух и пыль − респиратор; воздух и ядовитый газ − _ .
Решение
а) мука и сахарный песок − сито; сера и железные опилки − магнит.
б) вода и подсолнечное масло − делительная воронка; вода и речной песок − фильтр.
в) воздух и пыль − респиратор; воздух и ядовитый газ − адсорбент.
Номер №4
Составьте перечень необходимого оборудования для фильтрования.
а) _
б) _
в) _
г) _
д) _
е) _
Решение
Перечень необходимого оборудования для фильтрования:
а) бумажный фильтр
б) воронка
в) раствор для фильтрования
г) химический стакан
д) стеклянная палочка
е) штатив
Номер №5
Лабораторный опыт. Изготовление обычного и складчатого фильтров из фильтровальной бумаги или бумажной салфетки.
Изготовление обычного фильтра
Из фильтровальной бумаги вырежьте квадрат, сложите его пополам, обрежьте ножницами открытые концы фильтра по пунктирной линии, как показано на рисунке 11. Раскройте фильтр, придав ему форму конуса, и поместите в воронку. Края фильтра не должны доходить до края воронки примерно на 5 мм.
Рис. 11. Изготовление обычного фильтра
Изготовление складчатого фильтра
Изготовьте складчатый фильтр, используя для этого рисунок 12.
Рис. 12. Изготовление складчатого фильтра
Как вы считаете, через какой фильтр раствор будет проходить быстрее − обычный или складчатый? Почему?
Решение
Раствор будет проходить быстрее через складчатый фильтр, так как его площадь больше, а значит площадь соприкосновения раствора и фильтра будет больше. 70
-
Разделение смесей. Номер №6
Предложите способы разделения смесей, указанных в таблице 16.
Таблица 16
Способы разделения некоторых смесейКомпоненты смеси Свойства веществ, позволяющие разделить смесь Способы разделения Древесные и железные опилки Вода и нефть Речной и сахарный песок
Решение
Таблица 16
Способы разделения некоторых смесейКомпоненты смеси Свойства веществ, позволяющие разделить смесь Способы разделения Древесные и железные опилки Железные опилки обладают магнитными свойствами в отличии от древесных С помощью магнита Вода и нефть Нерастворимость компонентов друг в друге С помощью делительной воронки Речной и сахарный песок Сахарный песок растворим в воде в отличии от речного Растворение, фильтрование, выпаривание 71
-
Номер №7
Домашний опыт. Адсорбция активированным углем красящих веществ пепси−колы.
Реактивы и оборудование: газированный напиток (пепси−кола или любой другой газированный напиток, желательно ярко окрашенный напиток), активированный уголь; кастрюля, воронка (можно самодельная), фильтровальная бумага (марля), электрическая (газовая) плита.
Ход работы. Налейте в кастрюлю полстакана (100 мл) газированного напитка. Добавьте туда же 5 таблеток активированного угля. Нагревайте кастрюлю в течение 10 мин на электрической (газовой) плите. Отфильтруйте уголь. Объясните результаты опыта.
Решение
При кипячении раствор обесцветился, так как активированный уголь поглотил красящие вещества. При фильтровании на фильтре останутся частицы угля.
Номер №8
Домашний опыт. Адсорбция кукурузными палочками паров пахучих веществ
Реактивы и оборудование: кукурузные палочки, духи или одеколон; 2 одинаковые стеклянные банки с крышками.
Ход работы. В две стеклянные банки капните по капле духов. В одну из банок положите 4−5 кукурузных палочек. Обе банки закройте крышками. Банку, в которой находятся кукурузные палочки, немного потрясите. Для чего? _
Откройте обе банки. Объясните результаты опыта. _
Решение
Банку необходимо немного потрясти для увеличения скорости адсорбции.
В банке, где были кукурузные палочки, нет запаха духов. Это объясняется адсорбцией, то есть поглощением запаха кукурузными палочками.
Дистилляция, или перегонка. Номер №1
В пустые прямоугольники впишите цифры, указывающие правильную последовательность слов в предложении.
Дистилляция − это _
_ испарение
_ конденсация
_ нагревание
_ кипение
Решение
Дистилляция − это перегонка, испарение жидкости с последующим охлаждением и конденсацией паров.
3 испарение
4 конденсация
1 нагревание
2 кипение 72
-
Номер №2
Ответьте на вопрос.
Почему в море вода горько−соленая, а дождь, который льется над тем же морем, представляет собой пресную воду?
Решение
Пресная вода испаряется из морской, то есть испаряется только вода, а соль остается в морской воде. Для выпаривания соли требуются более высокие температуры.
Номер №3
Разгадайте головоломку, в которой зашифрован один из способов разделения смесей.
Ответ: _
На чем основан этот способ разделения смесей?
Решение
Ответ: кристаллизация.
Этот метод основан на различии составов жидкой (паровой) и твердой фаз, образующихся при частичной кристаллизации раствора.
Номер №4
Подчеркните "лишнее" слово в каждой группе.
а) Керосин, бензин, вода;
б) бензол, толуол, лигроин;
в) озокерит, церезин, газойль.
Решение
а) Керосин, бензин, вода, так как керосин и бензин − это углеводороды, а вода − это вещество, состоящее из атомов водорода и кислорода;
б) бензол, толуол, лигроин, так как лигроин − это смесь углеводородов, остальное − углеводороды;
в) озокерит, церезин, газойль, так как газойль − это продукт переработки нефти, а остальное − углеводороды. 73
-
Номер №5
Кислородная компания производит чистый кислород, аргон и азот из воздуха. Воздух охлаждают до жидкого состояния, а затем перегоняют, постепенно увеличивая температуру, и собирают каждое вещество по мере его закипания. Расположите указанные составные части воздуха в соответствии с порядком закипания.Название компонента воздуха Температура кипения, ℃ Номер по порядку Аргон −186 Кислород −183 Азот −196
РешениеНазвание компонента воздуха Температура кипения, ℃ Номер по порядку Аргон −186 2 Кислород −183 3 Азот −196 1
Номер №6
Домашний опыт. Очистка воды.
Оборудование: чайник, кружка (любая), тарелка, электрическая (газовая) плита, полотенце или тряпка.
Ход работы. Нагрейте воду в чайнике. Когда вода закипит и будет выходить пар, к носику чайника поднесите тарелку и подержите несколько минут.
Внимание!
Будьте внимательны при появлении пара из чайника! Руку, в которой будете держать тарелку, оберните полотенцем или тряпкой.
Воду, собранную в кружку (дистиллированную), можно попробовать на вкус.
Перегонку, или дистилляцию, воды можно произвести следующим образом.
74
-
Вопросы и задания
1) Можно ли считать, что после дистилляции вода будет чистой? Ответ обоснуйте.
2) Возьмите маленькое зеркало (или стеклянную бутылку), согрейте его в руках и сразу подышите на него. Дайте зеркалу охладиться и снова подышите. Прокомментируйте наблюдения.
3) Придумайте и зарисуйте установку, отличную от указанных в описании данного опыта, с помощью которой можно получить дистиллированную воду в домашних условиях.
Решение
1) Да, такую воду воду можно считать чистой, так как испаряется и конденсируется только вода, то есть без примесей.
2) В первом случае видимых изменений не будет, а во втором будет наблюдаться запотевания. Это будет происходить из−за разницы температуры выдыхаемого воздуха и поверхности зеркала.
3) Необходимо взять стакан и накрыть его, например, крышкой.
75
-
Практическая работа №4. Цель. Номер №1
Выращивание кристаллов соли (домашний опыт)
Цель: _
Решение
Цель: вырастить кристалл из поваренной соли.
Практическая работа №4. Вопросы и задания. Номер №1
Сколько дней вы выращивали кристалл?
Решение
Я выращивал кристалл 5 дней.
Номер №2
Запишите свои наблюдения за ростом кристаллов. Сфотографируйте или зарисуйте их.
Таблица 17
Дневник наблюдений за ростом кристаллов
Дата Наблюдения Фото или рисунок
Решение
Таблица 17
Дневник наблюдений за ростом кристалловДата Наблюдения Фото или рисунок 5.11 Размер кристалла 0,5 х 0,5 6.11 Размер кристалла 1,3 х 1,7 7.11 Размер кристалла 1,8 х 2,7 8.11 Размер кристалла 2,5 х 3,5 9.11 Размер кристалла 3 х 4
Номер №3
Размеры выращенного вами кристалла:
высота _ ; ширина _ ; толщина _ .
Решение
Размер моего кристалла: высота 3 см; ширина 4 см; толщина 2 см. 79
-
Практическая работа №5. Цель. Номер №1
Очистка поваренной соли
Цель: _
Решение
Цель: очистить загрязненную поваренную соль.
Практическая работа №5. Задание 1. Номер №1
Прочитайте инструкцию к проведению практического задания на с.96 учебника.
Решение
Прочитайте инструкцию к проведению практического задания на с.96 учебника.
Задание 2. Номер №2
Рассмотрите выданную вам загрязненную поваренную соль. Какие примеси она содержит?
Решение
Загрязненная поваренная соль содержит песок.
Задание 3. Номер №3
Составьте план работы. Вспомните правила техники безопасности. Проверьте предлагаемую вами последовательность с той, которая указана в таблице 18.
Для фильтрования пользуйтесь складчатым фильтром, а не гладким. Почему? 80
-
Таблица 18
Отчет о проведенной работеЭтап работы Рисунок Наблюдения Выводы 1) Растворение смеси в воде 2) Фильтрование 3) Выпаривание
Решение
Через складчатый фильтр раствор будет проходить быстрее, так как площадь поверхности такого фильтра больше.
Таблица 18
Отчет о проведенной работеЭтап работы Рисунок Наблюдения Выводы 1) Растворение смеси в воде 
Соль растворяется в воде Поваренная соль растворима в воде 2) Фильтрование 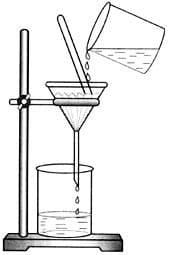
Песок остается на фильтре При растворении песок не переходит в раствор 3) Выпаривание 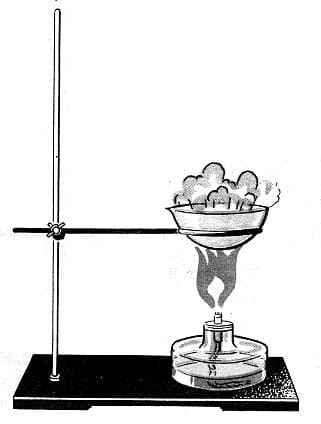
Вода испаряется, кристаллы соли остаются в стакане При выпаривании испаряется только вода 81
-
Химические реакции. Условия протекания и прекращения химических реакций. Номер №1
Укажите, к физическим или химическим относятся явления, изображенные на рисунках.
Решение
Физические явления: рис. 13; рис. 14; рис. 16
Химические явления: рис. 15; рис. 17
Номер №2
Установите соответствие.
Примеры химических реакций:
I. взаимодействие мрамора с соляной кислотой;
II. взаимодействие железа с серой;
III. разложение пероксида водорода;
IV. взаимодействие углекислого газа с известковой водой.
Условия протекания химических реакций:
а) соприкосновение веществ;
б) нагревание;
в) использование катализатора.
Ответ: I _ , II _ , III _ , IV _
Решение
Ответ: I − а , II − а, б, III − в , IV − а. 82
-
Номер №3
Заполните схему 2.
Решение
Номер №4
"Кроссворд − наоборот". Все слова в кроссворде уже вписаны. Дайте каждому из слов как можно более точное определение.
1 − _
2 − _
3 − _
4 − _
5 − _
6 − _
7 − _
Решение
1 − одно из агрегатных состояний веществ
2 − образование твердого вещества в результате химической реакции
3 − условие протекания химической реакции между железом и серой
4 − устройство для тушения пожаров
5 − процесс повышения температуры
6 − вещество, ускоряющее химическую реакцию
7 − влияние веществ друг на друга
Номер №5
Домашний опыт. Изготовление самодельного огнетушителя.
Реактивы и оборудование: питьевая сода, уксус, стиральный порошок; пластмассовый флакон из−под шампуня, кусочек резинового шланга, длина которого на 3−4 см больше высоты флакона, пузырек из−под пенициллина, бумажный тампон, неплотно закрывающий этот пузырек, старая чайная ложка (старая для того, чтобы не портить новую), стакан (250 мл).
Ход работы. Сначала приготовьте насыщенный раствор соды: для этого налейте полстакана воды и растворяйте соду до тех пор, пока она растворяется. Налейте во флакон из−под шампуня приготовленный раствор. Добавьте в раствор немного (половину чайной ложки) стирального порошка. Хорошо перемешайте раствор.
В пузырек из−под пенициллина налейте уксус (до $\frac{1}{3}$ объема) и закройте бумажным тампоном. Вставьте в крышку отверстия флакона гибкий (резиновый) шланг, чтобы он плотно входил в нее. Осторожно опустите пузырек с кислотой в раствор соды. Завинтите крышку со шлангом таким образом, чтобы шланг доходил до дна флакона.
Если теперь резко повернуть флакон вверх дном, то кислота вступит в реакцию с раствором соды. Образуется углекислый газ, который будет вместе с пеной выходить через шланг.
Решение
Сначала приготовили насыщенный раствор соды: для этого налили полстакана воды и растворили соду до тех пор, пока она растворяется. Налили во флакон из−под шампуня приготовленный раствор. Добавили в раствор немного (половину чайной ложки) стирального порошка. Хорошо перемешали раствор.
В пузырек из−под пенициллина налили уксус (до $\frac{1}{3}$ объема) и закрыли бумажным тампоном. Вставили в крышку отверстия флакона гибкий (резиновый) шланг, чтобы он плотно входил в нее. Осторожно опустили пузырек с кислотой в раствор соды. Завинтили крышку со шлангом таким образом, чтобы шланг доходил до дна флакона.
Резко повернули флакон вверх дном, кислота вступила в реакцию с раствором соды. Образовался углекислый газ, который будет вместе с пеной выходить через шланг. 84
-
Признаки химических реакций. Номер №1
Лабораторный опыт. Взаимодействие уксусной кислоты с питьевой содой (гидрокарбонатом натрия)
Реактивы и оборудование: раствор уксусной кислоты (7%−й), гидрокарбонат натрия; пробирка, шпатель.
Ход работы. Уксус (раствор уксусной кислоты) и питьевую соду используют в хлебопечении. При добавлении в тесто этих веществ изделия становятся пышными, хорошо пропекаются.
Поместите в пробирку немного (на кончике шпателя) питьевой соды. Добавьте к питьевой соде 1−2 мл раствора уксусной кислоты. Определите признак, сопровождающий этот процесс. Запишите свои наблюдения (заполните пропуски в предложениях).
Наблюдения. При добавлении к питьевой соде раствора уксусной кислоты наблюдается бурное образование _ с шипением.
Вывод. Это _ явление.
Решение
Наблюдения. При добавлении к питьевой соде раствора уксусной кислоты наблюдается бурное образование газа с шипением.
Вывод. Это химическое явление. 85
-
Номер №2
Лабораторный опыт. Удаление пятен с помощью йодной настойки
Реактивы и оборудование: йод, раствор тиосульфата натрия (10%−й); пипетка, кусочек ткани.
Ход работы. Нанесите на кусочек ткани каплю иода. Капните раствор тиосульфата натрия на пятно, нанесенное на ткань. Запишите свои наблюдения (заполните пропуски в предложениях).
Наблюдения. При нанесении раствора тиосульфата натрия на пятно йодной настойки оно _ . Признак этого явления − изменение _ .
Вывод. Это _ явление.
Решение
Наблюдения. При нанесении раствора тиосульфата натрия на пятно йодной настойки оно обесцвечивается. Признак этого явления − изменение окраски.
Вывод. Это химическое явление.
Номер №3
Заполните пропуски в предложениях.
Вещества, вступающие в химическую реакцию, т.е. исходные вещества, называются _ _ _ _ _ _ _ _ _ _ . Вещества, образующиеся в результате реакции называются _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Решение
Вещества, вступающие в химическую реакцию, т.е. исходные вещества, называются реагентами. Вещества, образующиеся в результате реакции называются продуктами реакции.
Номер №4
Классифицируйте вещества на реагенты и продукты, заполните таблицу 19. Укажите также признаки, сопровождающие указанные реакции.
Таблица 19
Признаки химических реакцийПримеры химических реакций Исходные вещества Продукты Признаки реакции 1. Взаимодействие железных опилок и порошка серы 2. Взаимодействие мрамора с соляной кислотой 3. Разложение пероксида водорода 4. Горение древесины
Решение
Таблица 19
Признаки химических реакций
Признаки химических реакцийПримеры химических реакций Исходные вещества Продукты Признаки реакции 1. Взаимодействие железных опилок и порошка серы Железо, сера Сульфид железа Образование черной соли 2. Взаимодействие мрамора с соляной кислотой Карбонат кальция, соляная кислота Хлорид кальция, углекислый газ и вода Выделение газа 3. Разложение пероксида водорода Пероксид водорода Кислород, вода Выделение газа 4. Горение древесины Древесина, кислород Углекислый газ, вода Выделение газа 86
-
Номер №5
Заполните пропуски в логических цепочках следующим образом: реагенты → название химической реакции → продукты реакции → признаки химической реакции.
а) Пропан и кислород → горение → _ → _ ;
б) _ → фотосинтез → _ → _ ;
в) железо и кислород → коррозия → ржавчина → _ ;
г) питьевая сода и уксус → _ → ацетат натрия, углекислый газ и вода → _.
Решение
а) Пропан и кислород → горение → $CO_{2}, H_{2}O$ → выделение теплоты;
б) $CO_{2}, H_{2}O$ → фотосинтез → глюкоза и кислород → поглощение тепла;
в) железо и кислород → коррозия → ржавчина → изменение цвета;
г) питьевая сода и уксус → нейтрализация → ацетат натрия, углекислый газ и вода → выделение газа. 87-89
-
Номер №6
Домашний опыт. Приготовление лимонада
Реактивы и оборудование: лимонная кислота, питьевая сода, сахарный песок; 2 стакана, чайная ложка.
Ход работы. Насыпьте в чистый сухой стакан по 1 чайной ложке порошков лимонной кислоты и питьевой соды и 3 чайные ложки сахарного песка. Какого цвета исходные вещества?
Чайной ложкой перемешайте эту смесь. Можете ли вы по внешнему виду отличить кристаллы сахара от кристаллов лимонной кислоты? _
Каким еще способом легче всего различить эти вещества? По каким признакам? _
Возьмите 1 чайную ложку этой смеси и поместите в другой чистый стакан, залейте водой. Лимонад готов!Вопросы и задания
1) Что менялось в опыте, а что было постоянным? _
2) Какие бывают виды смесей? Приведите примеры. Какую смесь вы приготовили? _
3) В стакане массой 100 г смешали 15 г сахара, 5 г лимонной кислоты, 5 г питьевой соды. Добавили 200 г воды. Масса стакана после проведенного опыта: а) равна 325 г; б) меньше 325 г; в) больше 325 г. Объясните почему. _
Решение
Чайной ложкой перемешайте эту смесь. Можете ли вы по внешнему виду отличить кристаллы сахара от кристаллов лимонной кислоты? По внешнему виду отличить кристаллы сахара от кристаллов лимонной кислоты нельзя.
Каким еще способом легче всего различить эти вещества? По каким признакам? Их можно легко различить по химическим свойствам: лимонная кислота − это кислота, сахар − органическое вещество (углевод).Вопросы и задания
1) В опыте были одинаковые реагенты − присутствовал сахар. В результате химической реакции образовались другие вещества − продукты реакции.
2) Смеси бывают однородные (солевой раствор) и неоднородные (смесь воды и масла). Мы приготовили однородную смесь.
3) Масса раствора будет меньше 325 г, так как в результате реакции выделится газ − углекислый газ.
Практическая работа №6. Цель. Номер №1
Изучение процесса коррозии железа (домашний опыт)
Цель: _
Решение
Цель: выяснить, как влияют внешние условия на скорость коррозии железа.
Практическая работа №6. Вопросы и задания. Номер №1
Что такое коррозия?
Решение
Коррозия − это самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды.
Номер №2
Укажите, в каких растворах наблюдались, а в каких не наблюдались признаки коррозии. Отчет оформите в виде таблицы.
Таблица 20
Дневник наблюдений за процессом коррозии
№ пузырька Реагент Признаки коррозии
Решение
Таблица 20
Дневник наблюдений за процессом коррозии№ пузырька Реагент Признаки коррозии 1 Нашатырный спирт ржавчина не образуется 2 Уксусная кислота образование ржавчины − бурого осадка 3 Поваренная соль образование ржавчины − бурого осадка 4 Питьевая сода ржавчина не образуется 5 Вода образование ржавчины − бурого осадка
Номер №3
Удалось ли вам установить какие−либо закономерности при проведении опыта? Каковы они? Как можно объяснить эти закономерности?
Решение
Гвозди ржавеют при наличии кислорода и влаги. Протекает химическая реакция: $4Fe(OH)_{2} + O_{2} + 2H_{2}O = 4Fe(OH)_{3}$ 90
-
Номер №4
Заметили ли вы разницу в том, как протекает коррозия на поверхности, шляпке, остром кончике гвоздя?
Решение
Быстрее коррозия протекает на шляпке и поверхности гвоздя, так как к кончику площадь соприкосновения гвоздя с кислородом уменьшается.
Номер №5
Почему гвозди подолгу не ржавеют на складе, но быстро покрываются ржавчиной, если опустить их в воду?
Решение
Гвозди подолгу не ржавеют на складе, но быстро покрываются ржавчиной, если опустить их в воду, так как для процесса ржавления необходим кислород и влага.
Номер №6
Сделайте фотография различных этапов эксперимента, например фотографию гвоздей до начала и спустя сутки после начала эксперимента, фото через неделю и т.д. Вклейте фотографии в рабочую тетрадь и сделайте подписи к ним.Фото 1 Фото 2 Фото 3 Фото 4
РешениеФото 1 Гвоздь до начала опыта

Фото 2 Гвоздь спустя сутки

Фото 3 Гвоздь спустя неделю

Фото 4 Гвоздь через 1,5 недели

91
-
Готовимся к контрольной работе. Номер №1
Составьте не менее пяти предложений, начинающихся со слова "смеси".
Смеси _
Смеси _
Смеси _
Смеси _
Смеси _
Решение
1) Смеси − это системы, состоящие из двух или более компонентов.
2) Смеси бывают однородными и неоднородными.
3) Смеси можно разделить, например, фильтрованием или другими способами.
4) Смеси часто содержат примеси.
5) Смеси имеют непостоянный состав.
Номер №2
Подчеркните название "лишнего" вещества: гранит, кровь, молоко, медь, морская вода.
"Лишнее" вещество выбрано на основании того, что _
Решение
Гранит, кровь, молоко, медь, морская вода.
"Лишнее" вещество выбрано на основании того, что медь − это простое вещество, а не смесь.
Номер №3
Вам нужно рассказать учащимся 3 класса о способах разделения смесей. Составьте план рассказа. Отметьте, какие опыты и как вы будете показывать.
Решение
План рассказа:
1) Что такое смеси.
2) Какие бывают смеси.
3) Способы разделения смесей.
Опыты:
1) Разделение железных и древесных опилок.
2) Отделение речного песка от раствора.
3) Выпаривание соли из солевого раствора. 92
-
Номер №4
Дайте определение химической реакции. Какие условия необходимы для протекания химических реакций?
Чем отличаются химические реакции от физических явлений?
Решение
Химическая реакция − процесс превращения одних веществ в другие.
Условия для протекания химических реакций:
1) соприкосновение веществ;
2) нагревание;
3) использование катализатора (не всегда).
В химических реакциях образуется новое вещество, происходит изменение окраски раствора, выпадение осадка, выделение газа.
Номер №5
Подчеркните правильный ответ.
1. Воду от растворенных в ней примесей можно отделить с помощью: а) дистилляции; б) отстаивания; в) фильтрования; г) центрифугирования.
Фильтрованием можно отделить нерастворимые вещества от: а) жидкости; б) газа; в) раствора; г) других нерастворимых веществ.
2. Для разделения смеси вода − машинное масло может быть использовано различие веществ по: а) магнитным свойствам; б) плотности; в) цвету; г) температурам кипения.
Химическое явление: а) замерзание воды; б) выпадение кристаллов медного купороса при охлаждении раствора; в) выделение пузырьков газа при открывании бутылки газированной воды; г) горение безина.
Решение
1. Воду от растворенных в ней примесей можно отделить с помощью: а) дистилляции; б) отстаивания; в) фильтрования; г) центрифугирования.
Фильтрованием можно отделить нерастворимые вещества от: а) жидкости; б) газа; в) раствора; г) других нерастворимых веществ.
2. Для разделения смеси вода − машинное масло может быть использовано различие веществ по: а) магнитным свойствам; б) плотности; в) цвету; г) температурам кипения.
Химическое явление: а) замерзание воды; б) выпадение кристаллов медного купороса при охлаждении раствора; в) выделение пузырьков газа при открывании бутылки газированной воды; г) горение безина.
Номер №6
Найдите ошибки в утверждениях.
а) Растворение сахара в воде − химическое явление, так как при этом у воды появляется сладкий вкус. Ошибка заключается в следующем: _ .
б) Известно, что поливать цветы рекомендуется отстоянной водопроводной водой. Через 2−3 недели на дне сосуда, в котором отстаивается вода, появляется бурый налет, свидетельствующий об образовании нового вещества. Следовательно, отстаивание − это химический процесс. Ошибка заключается в следующем: _
Решение
а) Растворение сахара в воде − химическое явление, так как при этом у воды появляется сладкий вкус. Ошибка заключается в следующем: Растворение сахара в воде − физическое явление, так как не происходит образование нового вещества.
б) Известно, что поливать цветы рекомендуется отстоянной водопроводной водой. Через 2−3 недели на дне сосуда, в котором отстаивается вода, появляется бурый налет, свидетельствующий об образовании нового вещества. Следовательно, отстаивание − это химический процесс. Ошибка заключается в следующем: отстаивание − это физический процесс, так как не происходит образование нового вещества. 93
-
Номер №7
Укажите признаки химических реакций.
а) Взаимодействие углекислого газа с известковой водой − _ ;
б) взаимодействие мрамора с соляной кислотой − _ .
Решение
а) Взаимодействие углексилого газа с известковой водой − образование белого осадка:
$CO_{2} + Ca(OH)_{2} = CaCO_{3} + H_{2}O$ ;
б) взаимодействие мрамора с соляной кислотой − выделение газа:
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2} + H_{2}O$ .
"Выдающиеся русские ученые-химики". Номер №1
Тема доклада: _
Ключевая идея, которую я хочу донести до слушателей: _
Для выступления мне понадобится: _
Развернутый план моего выступления: _
Таблица 21
Работа с информацией
Источник информации Заметки
Решение
Тема доклада: Вклад Ломоносова в развитие химии
Ключевая идея, которую я хочу донести до слушателей: Ломоносов М.В. внес большой вклад в развитие химии
Для выступления мне понадобится: планшет, проектор, доклад.
Развернутый план моего выступления:
1. М.В. Ломоносов (19 ноября 1711 – 15 апреля 1765 гг.) является основоположником атомно−молекулярного учения, он изложил свои взгляды в работе. Его имя стало символом служения науке и родной стране, стремления к знаниям.
2. Он утверждал, что тела состоят из молекул, состоящих из неделимых элементов − атомов. Михаил Васильевич объяснил многообразие веществ соединением разных атомов в молекулах и различным расположением атомов в них.
3. Избран почетным членом Шведской АН (1760), Болонской АН (1764), почетным членом С.−Петербургской Академии художеств (1763). Обсуждался вопрос о его избрании в Парижскую академию.
Таблица 21
Работа с информациейИсточник информации Заметки Интернет 19 ноября 1711 года Интернет Является основоположником атомно−молекулярного учения Интернет Утверждал, что тела состоят из молекул, состоящих из атомов
"Мое любимое химическое вещество". Номер №1
Подготовка сообщения к конкурсу "Мое любимое химическое вещество"
Название вещества: _
Из истории открытия вещества: _
Отличительные особенности (свойства) вещества: _
Получение: _
Применение: _
Таблица 22
Литература, используемая для подготовки сообщения о веществе
Автор Название книги/статьи Место и год издания
Решение
Подготовка сообщения к конкурсу "Мое любимое химическое вещество"
Название вещества: хлорид натрия
Из истории открытия вещества: Хлорид натрия имеет тривиальное название «поваренная соль» (синонимы: пищевая, столовая соль).
Отличительные особенности (свойства) вещества: NaCl имеет ионное строение. Вступает в реакции с кислотами, щелочами и другими растворимыми солями.
Получение: В лабораторных условиях хлорид натрия получают взаимодействием хлора и натрия.
Применение: В кулинарии соль используют не только как вкусовую добавку, но и как консервант. Поваренная соль является важнейшим сырьём химической промышленности. Из неё получают соду, хлор, хлороводород, гидроксид натрия, металлический натрий.Таблица 22
Литература, используемая для подготовки сообщения о веществеАвтор Название книги/статьи Место и год издания Кузнецова Н.Е. Учебник по химии 8 класс Москва, 2019 Григовович А.В. Учебник по химии 8 класс Москва, 2016
Дневник проектной деятельности. Номер №1
Дневник проектной деятельности для подготовки к конкурсу ученических проектов
Тема проекта: _
Консультация проекта: _
Проблема проекта: _
Цель: _
Задачи
1) _
2) _
3) _
Таблица 23
График работы над проектом
Сроки Содержание работы Отметка о выполнении работы Заметки
Решение
Тема проекта: "Типы химических реакций в неорганической химии"
Консультация проекта: 21.11.2022.
Проблема проекта: По каким критериям можно классифицировать реакции.
Цель: Изучить типы химических реакций в неорганической химии.
Задачи
1) Классифицировать реакции по составу реагентов и продуктов.
2) Классифицировать реакции по наличию катализатора.
3) Классифицировать реакции по тепловому эффекту.Таблица 23
График работы над проектомСроки Содержание работы Отметка о выполнении работы Заметки 1.11 − 7.11 Введение 7.11 − 14.11 Глава 1 14.11 − 21.11 Глава 2 21.11 − 28.11 Заключение
Консультация. Номер №1
Консультация
Мои вопросы _
Заметки _
Таблица 24
Работа с информациейВопрос Источник информации Заметки
Полученный продукт: _
Мои выводы по оценке продукта: _
Решение
Мои вопросы _
Заметки _
Таблица 24
Работа с информациейВопрос Источник информации Заметки Полученный продукт: Проект на тему "Химические реакции в неорганической химии"
Мои выводы по оценке продукта: _
Презентация проекта. Номер №1
Презентация проекта
Моя цель во время презентации: _
Идея, которую я хочу донести до слушателей: _
Для презентации мне понадобится: _
Развернутый план выступления: _
Решение
Презентация проекта
Моя цель во время презентации: рассказать о классификации неорганических реакций
Идея, которую я хочу донести до слушателей: неорганические реакции можно классифицировать по ряду признаков
Для презентации мне понадобится: планшет, доклад, проекторРазвернутый план выступления:
1) Введение
2) Краткий рассказ основной части
3) Заключение


