В этой статье наш сайт предложит вам ответы для рабочей тетради по химии, так называемые ГДЗ. Ответы будут для тетради для 7 класса, авторов  Габриелян, Сладков, Остроумов. В этой рабочей тетради будет много таблиц и определений, но не бойтесь этих сложностей, ведь наш сайт поможет вам с этим.
Габриелян, Сладков, Остроумов. В этой рабочей тетради будет много таблиц и определений, но не бойтесь этих сложностей, ведь наш сайт поможет вам с этим.
Итак, далее знакомимся с ответами к рабочей тетради за 7 класс по химии.
Ответы (ГДЗ) к рабочей тетради по химии за 7 класс, Габриелян:
§1
-
Предмет химии и методы ее изучения
§1. Что изучает химия
Часть I
1. Перечислите науки о природе − естественные науки: _
Ответ:
Перечислите науки о природе − естественные науки: биология, химия, география, геология, астрономия, экология.
2. Химия − это наука о:
− _ _ _ _ _ _ _ _ _,
− их _ _ _ _ _ _ _ _ _
− и _ _ _ _ _ _ _ _ _ _ _ _ _ веществ.Ответ:
Химия − это наука о:
− веществах,
− их свойствах
− и превращении веществ.3. Все предметы живой и неживой природы − это _ _ _ _ _ _ _ _ _ _ _ _ _ _ , они построены из _ _ _ _ _ _ _.
Ответ:
Все предметы живой и неживой природы − это физические тела , они построены из веществ.
4. Признаки, по которым одни вещества отличаются от других, − это _ _ _ _ _ _ _ _ _ веществ.
Ответ:
Признаки, по которым одни вещества отличаются от других, − это свойства веществ.
5. Применение веществ основано на их _ _ _ _ _ _ _ _ _ _.
Ответ:
Применение веществ основано на их свойствах.
Часть II
1. Химия играет в жизни человека как положительную, так и отрицательную роль. Оформите схему, заполнив ее примерами.
Ответ:
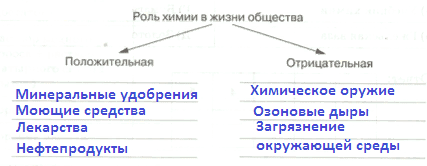
2. Выберите вещество из списка для описания его свойств: поваренная соль, сахар, полиэтилен, вода, спирт, углекислый газ. Опишите выбранное вещество по следующему плану, используя информацию из Интернета:
1) агрегатное состояние при 20℃
2) цвет и блеск
3) запах
4) растворимость в воде
5) температура плавления
6) температура кипенияОтвет:
Мы выбрали поваренную соль:
1) твердое вещество
2) белый цвет, без блеска
3) без запаха
4) хорошо растворима в воде
5) температура плавления = +800,8℃
6) температура кипения = +1465℃3. Для выбранного в задании 2 вещества заполните таблицу. Применение _ (название вещества) на основе его (ее) свойств
Свойство Применение
Ответ:
Применение поваренной соли на основе ее свойств
Свойство Применение Имеет вкус Как пищевая добавка Способность вступать в химические реакции Для получения соляной кислоты Наличие хлорид иона Получение хлоридов Наличие иона натрия Получение каустической соды Консервирующие свойства Для консервации продуктов 4. Соотнесите названия тел и вещества.
Тело Вещество 1) Медаль чемпиона А) Фарфор 2) Чайная ложечка Б) Бронза 3) Царь−колокол В) Сталь 4) Учебник химии Г) Бумага 5) Гжельская ваза Д) Золото
Ответ:1 2 3 4 5
Ответ:
Ответ:
1 2 3 4 5
Д В Б Г А §2
-
§2. Явления, происходящие с веществами
Часть I
1. Изменения, происходящие с телами и веществами, − это _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Ответ:
Изменения, происходящие с телами и веществами, − это химические (физические) явления.
2. Заполните схему.
Ответ:
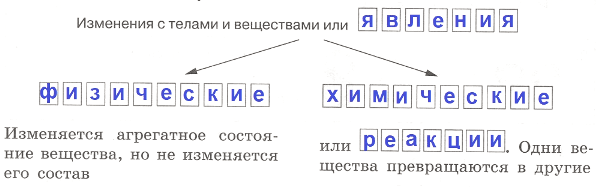
3. Заполните таблицу.
Признаки и условия течения химических реакцийРеагирующие вещества и / или процессы Условия реакции Признаки реакции 1) Раствор соды + фенолфталеин 2) Раствор соды + уксусная кислота 3) Раствор медного купороса + раствор нашатырного спирта (недостаток) 4) Раствор медного купороса + раствор нашатырного спирта (избыток) 5) Горение лучинки 6) Горение шерсти Ответ:
Признаки и условия течения химических реакций
Реагирующие вещества и / или процессы Условия реакции Признаки реакции 1) Раствор соды + фенолфталеин − Малиновый раствор 2) Раствор соды + уксусная кислота − Выделение газа − углекислого газа 3) Раствор медного купороса + раствор нашатырного спирта (недостаток) Раствор нашатрыного спирта добавлять по каплям Голубой осадок − гидроксид меди 4) Раствор медного купороса + раствор нашатырного спирта (избыток) Важен избыток нашатырного спирта Образование ярко−синего раствора 5) Горение лучинки Наличие кислорода Выделение тепла 6) Горение шерсти Наличие кислорода Выделение тепла Часть II
1. Соотнесите схематический рисунок с типом явления.
Рисунок - Тип явления
1) А) Физическое
А) Физическое
2) 4 Б) Химическое
4 Б) Химическое
Ответ:1 2
Условие химической реакции, рассмотренной в данном задании: _ _ _ _ _ _ _ _ _ _ .Ответ:
Ответ:
1 2
А Б
Условие химической реакции, рассмотренной в данном задании: нагревание.2. Для тушения пожаров используют:
1) _
2) _
3) _
4) _
5) _
Средства тушения пожаров нарушают такое условие протекания реакции горения, как _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .Ответ:
Для тушения пожаров используют:
1) Огнетушитель
2) Воду
3) Песок
4) Кошма
5) Пожарные щиты
Средства тушения пожаров нарушают такое условие протекания реакции горения, как доступ кислорода, необходимого для горения.3. Соотнесите процессы водоочистки с типом явлений.
Процесс водоочистки Тип явления 1) Отстаивание − освобождение воды от крупных загрязняющих частиц в бассейнах−отстойниках А) Физическое 2) Фильтрование − освобождение воды от мелких загрязняющих частиц при пропускании через слой песка Б) Химическое 3) Умягчение − удаление из воды соединений кальция и магния в виде осадка, образующегося при добавлении негашенной извести В) Биологическое 4) Обеззараживание − уничтожение вредных микроорганизмов путем добавление хлорной извести Ответ:
1 2 3 4
Ответ:
Ответ:
1 2 3 4
А А Б В4. Напишите эссе о явлениях, происходящих во время грозы, с указанием типа явлений.
Ответ:
Гроза – атмосферное природное явление, при котором внутри облаков или между облаками и земной поверхностью возникают электрические разряды — молнии. Электрический разряд сопровождается громом. Напряжение молнии составляет десятки миллионов вольт. Во время грозы может быть попадание молнии в жилые сооружения, деревья. Пораженный разрядом молнии живой организм может умереть из−за остановки дыхания, нарушения электрической активности сердца. Но чаще разрушения наносятся не самой грозой, а сильными порывами ветра, крупным градом, наводнениями из−за интенсивных осадков. Особенно мощные грозовые ячейки вызывают смерчи.
§3
-
§3. Наблюдение и эксперимент в химии
Часть I
1. Концентрация внимания на явлениях, происходящих с веществами, − это _ _ _ _ _ _ _ _ _ _.
Ответ:
Концентрация внимания на явлениях, происходящих с веществами, − это наблюдение.
2. Эксперимент − это _
Ответ:
Эксперимент − это опытное изучение наблюдаемого явления в строго определённых условиях.
3. Подпишите зоны и температуру пламени:
Ответ:
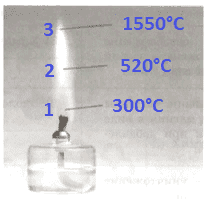
1 − темная зона, нижняя часть пламени
2 − яркая часть пламени
3 − верхняя часть пламени4. Заполните таблицу на основании проделанных опытов.
Сравнение строения пламени спиртовки, свечи и сухого горючегоЧто делали Что наблюдали Выводы
Ответ:
Сравнение строения пламени спиртовки, свечи и сухого горючего
Что делали Что наблюдали Выводы Проткнули язычок пламени спичкой, держа её за головку. Убедились, что спичка сильнее обуглилась в верхней части пламени. Следовательно, пламя там имеет более высокую температуру. 5. Заполните таблицу на основании проделанных опытов.
Продолжительность горения свечи в зависимости от объема воздухаЧто делали Что наблюдали Выводы 1) Накрыли горящую свечу банкой объемом 3л и засекли время 2) Накрыли горящую свечу банкой объемом 1л и засекли время 3) Накрыли горящую свечу банкой объемом 0,5л и засекли время Ответ:
Продолжительность горения свечи в зависимости от объема воздуха
Что делали Что наблюдали Выводы 1) Накрыли горящую свечу банкой объемом 3л и засекли время Свеча горит, а затем тухнет. Банка ограничивает доступ кислорода. 2) Накрыли горящую свечу банкой объемом 1л и засекли время Свеча сгорает быстрее, чем в 3−литровой банке. Банка ограничивает доступ кислорода. 3) Накрыли горящую свечу банкой объемом 0,5л и засекли время Свеча сгорает еще быстрее. Банка ограничивает доступ кислорода. Часть II
1. Заполните таблицу.
Наблюдения естествоиспыталетей, которые привели к открытию законов природыУченый Наблюдение Закон
Ответ:
Наблюдения естествоиспыталетей, которые привели к открытию законов природы
Ученый Наблюдение Закон Галилео Галилей Галилео Галилей установил, что расстояние, пройденное телом, которое свободно высвобождается с определенной высоты, пропорционально квадрату времени, затраченного на его прохождение. Закон падения тел Л. Долло Организм не может вернуться к прежнему состоянию. Закон необратимости эволюции Г. Мендель Гамета диплоидного гибрида может нести один из двух аллелей данного гена. Закон чистоты гамет 2. Исключите лишний предмет для проведения опытов с нагреванием в школьном кабинете / лаборатории химии:
1) газовая зажигалка;
2) спиртовка;
3) газовая горелка;
4) сухое горючее.
Ответ: _Ответ:
Исключите лишний предмет для проведения опытов с нагреванием в школьном кабинете / лаборатории химии:
1) газовая зажигалка;
2) спиртовка;
3) газовая горелка;
4) сухое горючее.
Ответ: 1).3. Порядок действий для проведения нагревания раствора в пробирке в школьном кабинете / лаборатории химии:
1) _
2) _
3) _
4) _Ответ:
Порядок действий для проведения нагревания раствора в пробирке в школьном кабинете/лаборатории химии:
1) Зажечь спиртовку спичкой;
2) Прогреть всю поверхность пробирки;
3) Нагреть пробирку с раствором до нужной температуры;
4) Потушить спиртовку.4. Заполните таблицу.
Отражение в устном народном творчестве наблюдений за физическими явлениями или химическими реакциями, происходящими в природеЖанр Формулировка Явление, положенное в основу Примета Пословица Поговорка Ответ:
Отражение в устном народном творчестве наблюдений за физическими явлениями или химическими реакциями, происходящими в природе
Жанр Формулировка Явление, положенное в основу Примета "Лучина трещит и мечет искры − к ненастью" Увеличиваясь в объеме, пар с треском разрывает древесные волокна Пословица "Что на зеркало кивать, коли рожа кривая" Оптика Поговорка *"Шило в мешке не утаишь" Давление §4
-
Строение и агрегатные состояния веществ
§4. Строение веществ
Часть I
1. Оформите отчет о наблюдении.
Броуновское движениеЧто делали Что наблюдали Выводы
Ответ:
Броуновское движение
Что делали Что наблюдали Выводы Для получения изображения частиц, опустили тубус микроскопа прямо в исследуемую жидкость. Затем медленным перемещением объектива добились наилучшего изображения частиц на экране монитора. Наблюдали за движением броуновских частиц. Наблюдать за броуновским движением удобно, если частицы расположены не очень «густо». 2. Самопроизвольное распространение молекул одного вещества между молекулами другого − это _ _ _ _ _ _ _ _.
Ответ:
Самопроизвольное распространение молекул одного вещества между молекулами другого − это диффузия.
3. Заполните пропуски в цепочке звеньев о строении вещества:
вещества → _ _ _ _ _ _ _ _ → _ _ _ _ _.Ответ:
Заполните пропуски в цепочке звеньев о строении вещества:
вещества → молекулы → атомы.4. Из одноатомных молекул состоят _ _ _ _ _ _ _ _ _ _ _ _ _ _ _, например:
1) _
2) _
3) _Ответ:
Из одноатомных молекул состоят благородные газы, например:
1) Гелий
2) Неон
3) Ксенон5. Атомы − это _
Ответ:
Атомы − это мельчайшие химически неделимые частицы, из которых состоят вещества.
6. Молекулы − это _
Ответ:
Молекулы − это мельчайшие частицы вещества, определяющие его свойства и состоящие из атомов.
7. Основные положения атомно−молекулярного учения:
1) _
2) _
3) _Ответ:
Основные положения атомно−молекулярного учения:
1) Вещества состоят из молекул, которые находятся в непрерывном движении.
2) Молекулы состоят из атомов.
3) При химических реакциях молекулы исходных веществ разрушаются до атомов и из этих атомов образуются молекулы новых веществ — продуктов реакции.8. Ионы − это _
Ответ:
Ионы − это положительно или отрицательно заряженные частицы, которые образуются из атомов.
9. Заполните схему.
Ответ:
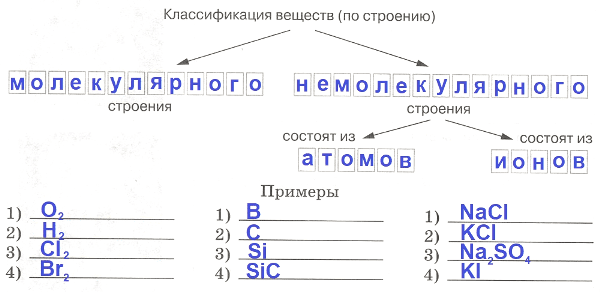
Часть II
1. Оформите отчет о наблюдении за диффузией вещества ионного строения − перманганата калия (марганцовки).
Что делали Что наблюдали Выводы
Ответ:
Что делали Что наблюдали Выводы Растворяли кристаллы перманганата калия в воде. Наблюдаем, что растворение кристаллов в теплой воде протекает быстрее, чем в холодной. Диффузия зависит от температуры. 2. Молекулы состоят из атомов. Как это положение атомно−молекулярного учения соотносится с фактом существования благородных газов? Выразите свое мнение.
Ответ:
Одно из положений атомно−молекулярного учения: "Молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ − из разных". Таким образом, благородные газы состоят из одноименных атомов.
3. Опишите вклад ученого в атомно−молекулярное учение (используйте Интернет) и соотнесите портрет ученого с его именем.
Ученый Вклад в атомно−молекулярное учение Портрет
1) Демокрит А.
2) Михаил Васильевич Ломоносов Б.
3) Джон Дальтон В.
Ответ:1 2 3
Ответ:
Ученый Вклад в атомно−молекулярное учение Портрет 1) Демокрит Демокрит предположил, что все вещества состоят из невидимых человеческим глазом малых частиц − атомов. В. 
2) Михаил Васильевич Ломоносов Ломоносов является основоположником атомно−молекулярного учения, он изложил свои взгляды в работе. Б. 
3) Джон Дальтон По Дальтону простые вещества состоят только из атомов, и лишь сложные вещества − из «сложных атомов». А. 
Ответ:
1 2 3
В Б А4. Заполните таблицу, используя информацию из Интернета.
Вещества различного строения и их применениеЧастицы, из которых состоят вещества Примеры веществ Применение 1) Атомы 2) Молекулы 3) Ионы Ответ:
Вещества различного строения и их применение
Частицы, из которых состоят вещества Примеры веществ Применение 1) Атомы Диоксид кремния − $SiO_{2}$ Стекольная промышленность 2) Молекулы Сахар, уксусная кислота Пищевая промышленность 3) Ионы Хлорид натрия − NaCl Пищевая промышленность §5
-
§5. Агрегатные состояния веществ
Часть I
1. Оформите отчет.
Наблюдение за таянием снегаЧто делали Что наблюдали Выводы
Ответ:
Наблюдение за таянием снега
Что делали Что наблюдали Выводы Наблюдали за таянием снега. Таяние снега зависит от температуры. Чем выше температура, тем таяние снега происходит быстрее. 2. Заполните таблицу.
Агрегатные состояния веществАгрегатное состояние Описание свойств веществ в данном состоянии и их причина Примеры веществ при обычных условиях
Ответ:
Агрегатные состояния веществ
Агрегатное состояние Описание свойств веществ в данном состоянии и их причина Примеры веществ при обычных условиях Газооборазное При охлаждении или повышении давления газы могут сжижаться, т.е. переходить из газообразного состояния в жидкое, а при дальнейшем охлаждении и повышении давления становиться твёрдыми. Газы сжимаемы. Если уменьшить объём газа, его давление возрастёт, поскольку число столкновений частиц со стенками сосуда увеличится. Кислород, водород, азот. Жидкое В жидкостях взаимодействие между молекулами настолько велико, что не позволяет им свободно отрываться друг от друга и удаляться на большие расстояния. Поэтому, в отличие от газов, жидкости практически несжимаемы. Жидкости обладают текучестью, поэтому принимают форму сосуда, в котором находятся. Этиловый спир, серная кислота, ацетон. Твердое Твёрдые тела сохраняют свои форму и объём. Это объясняется тем, что частицы, образующие твёрдое тело, сохраняют своё взаимное положение относительно друг друга и перестают свободно перемещаться, а могут совершать лишь небольшие колебания. Поваренная соль, железо, сахар. 3. Дополните схему.
Взаимные переходы агрегатных состояний веществОтвет:
Взаимные переходы агрегатных состояний веществ
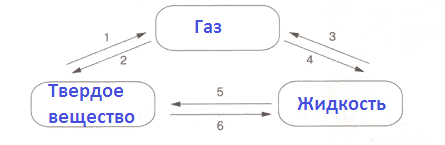
1) Возгонка (сублимация)
2) Десублимация
3) Испарение
4) Конденсация
5) Плавление
6) Кристаллизация4. Оформите отчет опыта "Проверка прибора на герметичность".
Что делали Что наблюдали Выводы
Ответ:
Проверка прибора на герметичность
Что делали Что наблюдали Выводы Проверяли герметичность пробирки с газоотводной трубкой: появление пузырьков воздуха в стакане с водой указывает на то, что пробирка герметична Присутствие пузырьков газа Таким образом, прибор герметичен Часть II
1. Соотнесите вещество и его агрегатное состояние при обычных условиях.
Вещество Агрегатное состояние 1) Аммиак А. Твердое 2) Этиловый спирт Б. Жидкое 3) Нафталин В. Газообразное 4) Медный купорос Ответ:
1 2 3 4
Ответ:
Ответ:
1 2 3 4
В Б А А2. Соотнесите вещество и частицы, из которых оно состоит.
Вещество Частицы 1) Аммиак А. Атомы 2) Этиловый спирт Б. Молекулы 3) Нафталин В. Ионы 4) Медный купорос Ответ:
1 2 3 4
Ответ:
Ответ:
1 2 3 4
Б Б Б В3. Назовите агрегатные состояния углекислого газа и его переходы из одного агрегатного состояния в другое.
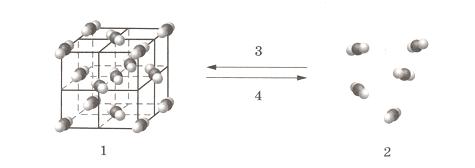
1 − _
2− _
3 − _
4 − _Ответ:
1 − твердое состояние
2 − газообразное состояние
3 − сублимация (или возгонка)
4 − десублимация4. Напишите синквейн о сублимации воды.
Ответ:
Синквейн о сублимации воды
1) Сублимация.
2) Газообразное, твердое.
3) Переходит, изменяется, видоизменяется.
4) Сублимация − это процесс, при котором вода из твердого состояния (лёд) превращается в газообразное (пар) минуя жидкое состояние.
5) Сублимация − это образование кристаллов. §6
-
Смеси веществ и их состав
§6. Чистые вещества и смеси
Часть I
1. Чистые вещества состоят из одинаковых структурных частиц, поэтому их разделяют с помощью _ _ _ _ _ _ _ _ _ _ методов.
Ответ:
Чистые вещества состоят из одинаковых структурных частиц, поэтому их разделяют с помощью физических методов.
2. Заполните схему.
Ответ:
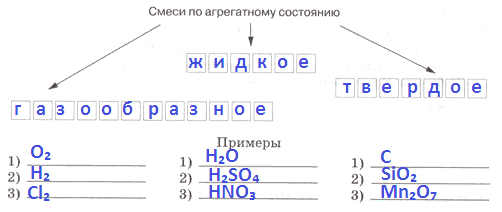
3. Заполните схему.
Ответ:

4. Заполните таблицу.
Смеси и их составСмесь Тип смеси по агрегатному состоянию Тип смеси по размерам частиц Состав
1) Воздух
2) Природный газ
3) Нефть
4) ГранитОтвет:
Смеси и их состав
Смесь Тип смеси по агрегатному состоянию Тип смеси по размерам частиц Состав 1) Воздух Газообразная Гомогенная (однородная) смесь Кислород, азот, озон, аргон, углекислый газ 2) Природный газ Газообразная Гомогенная (однородная) смесь Метан, этан, пропан 3) Нефть Жидкая Гомогенная (однородная) смесь Углеводороды, угль, вода 4) Гранит Твердая Гетерогенная (неоднородная) смесь Кварц, слюда, шпаты Часть II
1. Расположите предложенные примеры в соответствии с логической цепочкой: вещество → материал → изделие.
А) покрышки (1) → качук (2) → резина (3)
Б) ледяная скульптура (1) → вода (2) → лед (3)
В) бронза (1) → медь (2) → медаль (3)
Ответ:
А) _
Б) _
В) _Ответ:
Ответ:
А) 2 → 3 → 1
Б) 2 → 3 → 1
В) 2 → 1 → 32. Заполните таблицу.
Кухонные смеси различного агрегатного состоянияАгрегатное состояние смеси Пример смеси Состав смеси Применение
Газообразование
Жидкое
ТвердоеОтвет:
Кухонные смеси различного агрегатного состояния
Агрегатное состояние смеси Пример смеси Состав смеси Применение Газообразование Бытовой газ Метан и пахучие вещества В газовой плите при приготовлении пищи Жидкое Столовый уксус Вода, уксусная кислота При приготовлении пищи Твердое Приправа для мяса Черный перец, паприка, куркума, хмели сунели При приготовлении мяса 3. Заполните таблицу.
Гомо− и гетерогенные природные смесиТип смеси Состав смеси Примеры
Ответ:
Гомо− и гетерогенные природные смеси
Тип смеси Состав смеси Примеры Газообразная Кислород, азот, озон, аргон, углекислый газ Воздух Твердая Кварц, слюда, шпаты Гранит 4. Назовите порядок действий при ощущении запаха газа на кухне:
1) _
2) _
3) _Ответ:
Порядок действий при ощущении запаха газа на кухне:
1) Перекройте газопроводный кран.
2) Проветрите помещение (устройте сквозняк).
3) Вызовите аварийную службу (звонить нужно из помещения, не наполненного газом, или вообще из другой квартиры) по телефону 04.5. Напишите эссе о необходимости сохранения постоянного состава воздуха.
Ответ:
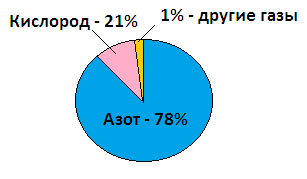
Воздух − газ без цвета, вкуса и запаха. Основные составные части воздуха подразделяются на три группы: постоянные, переменные и случайные. К постоянным относятся: азот − 78% по объему, кислород − 21% по объему, аргоны и другие инертные газы − около 1%. К переменным относятся углекислый газ, водяной пар. Постоянный состав воздуха необходим для всех процессов на земле: фотосинтеза, дыхания. Итак, воздух − это смесь газов.
§7
-
§7. Газы и газовые смеси. Объемная доля компонента газовой смеси
Часть I
1. Заполните таблицу.
Состав воздухаКомпонент Объемная доля (%)
Ответ:
Состав воздуха
Компонент Объемная доля (%) Азот 78% Кислород 21% Углекислый газ 0,03% Другие газы 0,97% 2. Объемная доля компонента газовой смеси (φ) − это _ , которая рассчитывается по формуле _
Ответ:
Объемная доля компонента газовой смеси (φ) − это отношение объёма данного газа к общему объёму смеси, которая рассчитывается по формуле
φ = $V_{(газа)}$ : $V_{(смеси)}$ * 100%3. Чтобы найти объем газовой смеси по известной массовой доле его компонента, используют формулу _
Ответ:
Чтобы найти объем газовой смеси по известной массовой доле его компонента, используют формулу
$V_{(смеси)}$ = $V_{(газа)}$ : φ4. Чтобы найти объем компонента газовой смеси по его известной доле и объему смеси, используют формулу _
Ответ:
Чтобы найти объем компонента газовой смеси по его известной доле и объему смеси, используют формулу:
$V_{(газа)}$ = $V_{(смеси)}$ * φЧасть II
1. Объемный состав природного газа Уренгойского месторождения:
1) метан − 90%;
2) этан − 4%;
3) пропан − 2%;
4) бутан − 1%.
На другие газы приходится _ %.Ответ:
Объемный состав перечисленных компонентов: 90 + 4 + 2 + 1 = 97%.
100 − 97 = 3
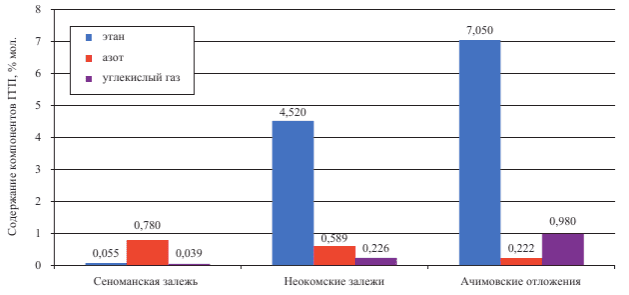
На другие газы приходится 3 %.2. Предложите круговую или столбчатую диаграмму для отображения состава природного газа Уренгойского месторождения.
Ответ:
Содержание компонентов в природном газе Уренгойского месторождения
3. Рассчитайте объем каждого компонента для 500 $м^{3}$ природного газа Уренгойского месторождения.
Ответ:
Дано:
ω (метан) = 90%;
ω (этан) = 4%;
ω (пропан) = 2%;
ω (бутан) = 1%.
V (природного газа) = 500 $м^{3}$
Найти:
V ($CH_{4}$) − ?
V ($C_{2}H_{6}$) − ?
V ($C_{3}H_{8}$) − ?
V ($C_{4}H_{10}$) − ?
Решение:
V (комп.) = V (природного газа) * ω
V ($CH_{4}$) = 500 $м^{3}$ * 0,9 = 450 ($м^{3}$)
V ($C_{2}H_{6}$) = 500 $м^{3}$ * 0,04 = 20 ($м^{3}$)
V ($C_{3}H_{8}$) = 500 $м^{3}$ * 0,02 = 10 ($м^{3}$)
V ($C_{4}H_{10}$) = 500 $м^{3}$ * 0,01 = 5 ($м^{3}$)
Ответ: V ($CH_{4}$) = 450 $м^{3}$; V ($C_{2}H_{4}$) = 20 $м^{3}$; V ($C_{3}H_{8}$) = 10 $м^{3}$; V ($C_{4}H_{10}$) = 5 $м^{3}$.4. Предложите способы поддержания постоянного состава воздуха в кабинете химии на протяжении учебного дня.
Ответ:
В закрытом кабинете во время проведения урока объемная доля углекислого газа увеличится, а кислорода уменьшится, так как для дыхания люди используют кислород, а выдыхают углекислый газ. Для поддержания постоянного состава воздуха кабинет необходимо проветривать.
§8
-
§8. Массовая доля растворенного вещества
Часть I
1. Массовая доля растворенного вещества (ω) − это _ , которая рассчитывается по формуле _
Ответ:
Массовая доля растворенного вещества (ω) − это отношение массы растворённого вещества к массе раствора, которая рассчитывается по формуле
ω = $m_{(в-ва)}$ : $m_{(р-ра)}$ * 100%2. Чтобы найти массу раствора по известной доле растворенного вещества, используют формулу _
Ответ:
Чтобы найти массу раствора по известной доле растворенного вещества, используют формулу
$m_{(р-ра)}$ = $m_{(в-ва)}$ : ω3. Для нахождения массы растворенного вещества по его известной доле и массе раствора используют формулу _
Ответ:
Для нахождения массы растворенного вещества по его известной доле и массе раствора используют формулу:
$m_{в-ва}$ = $m_{р-ра}$ * ω4. Раствор сахара − это (по размерам частиц) _ _ _ _ _ _ _ _ _ _ смесь, состоящая из молекул _ _ _ _ и молекул _ _ _ _ _ _ _ .
Ответ:
Раствор сахара − это (по размерам частиц) однородная смесь, состоящая из молекул воды и молекул сахара.
5. Раствор поваренной соли − это (по размерам частиц) _ _ _ _ _ _ _ _ _ _ смесь, состоящая из молекул _ _ _ _ и _ _ _ _ _ соли.
Ответ:
Раствор поваренной соли − это (по размерам частиц) однородная смесь, состоящая из молекул воды и ионов соли.
6. Найдите массу (г) хлорида натрия и объем (мл) воды, необходимые для приготовления 120 г физиологического раствора − водного раствора хлорида натрия (поваренной соли) с массовой долей 0,9%.
Ответ:
Дано:
$V_{(р-ра)}$ = 120 г
ω = 0,9%
Найти:
$m_{(соли)}$ − ?
$V_{(воды)}$ − ?
Решение:
$m_{(соли)}$ = $m_{(р-ра)}$ * ω
$m_{(соли)}$ = 120 г * 0,009 = 1,08 г
$m_{(воды)}$ = $m_{(р-ра)}$ − $m_{(в-ва)}$
$m_{(воды)}$ = 120 г − 1,08 г = 118,92 г
$V_{(воды)}$ = $m_{(воды)}$ : ρ = 118,92 г : 1 г/мл = 118,92 мл
Ответ: $m_{(соли)}$ = 1,08 г ; $V_{(воды)}$ = 118,92 мл.7. Напишите эссе, характеризующее свойства раствора поваренной соли.
Ответ:
Свойства раствора поваренной соли
NaCl представляет собой кристаллы с кубической ионной решеткой. Кристаллы без цвета и запаха, с четко выраженным соленым вкусом. Хлористый натрий водорастворим, не гигроскопичен. Растворяется в аммиаке, этиловом и метиловом спирте, муравьиной кислоте, глицерине, этиленгликоле. Не растворяется в ацетоне, соляной кислоте, диэтиловом эфире.
Хлорид натрия взаимодействует с кислотами, способен вступать в реакцию обмена со многими солями.
$NaCl + H_{2}SO_{4} = NaHSO_{4} + HCl$
$NaCl + AgNO_{3} = NaNO_{3} + AgCl$Часть II
1. Йодная настойка − это спиртовой раствор с массовой долей йода 3%. Найдите массы спирта и йода, необходимые для приготовления 180 г такой настойки.
Ответ:
Дано:
ω = 3%
$m_{р-ра}$ = 180 г
Найти:
$m_{в-ва}$ − ?
$m_{спирта}$ − ?
Решение:
Вещество − йод (I):
$m_{в-ва}$ = $m_{р-ра}$ * ω = 180 г * 0,03 = 5,4 г
$m_{спирта}$ = $m_{р-ра}$ − $m_{в-ва}$ = 180 г − 5,4 г = 174,6 г
Ответ: $m_{в-ва}$ = 5,4 г; $m_{спирта}$ = 174,6 г.2. К 180 г 3%−ной спиртовой настойки йода добавили 20 г спирта. Какой стала массовая доля йода в полученном растворе?
Ответ:
Дано:
ω = 3%
$m_{р-ра}$ = 180 г
$m_{доб.спирта}$ = 20 г
Найти:
$ω_{1}$ − ?
Решение:
$ω_{1}$ = $\frac{m_{в-ва}}{m_{р-ра}\;+\;m_{доб.спирта}}$
$m_{в-ва}$ = $m_{р-ра}$ * ω = 180 г * 0,03 = 5,4 г
$ω_{1}$ = $\frac{5,4 г\;}{180 г\;+\;20 г}$ * 100% = 2,7%
Ответ: $ω_{1}$ = 2,7%.3. В 180 г 3%−ной спиртовой настойки йода растворили 4 г йода. Какой стала массовая доля йода в полученном растворе?
Ответ:
Дано:
ω = 3%
$m_{р-ра}$ = 180 г
$m_{доб.в-ва}$ = 4 г
Найти:
$ω_{1}$ − ?
Решение:
$ω_{1}$ = $\frac{m_{в-ва}\;+\;m_{доб.в-ва}}{m_{р-ра}\;+\;m_{доб.в-ва}}$
$m_{в-ва}$ = $m_{р-ра}$ * ω = 180 г * 0,03 = 5,4 г
$ω_{1}$ = $\frac{5,4 г\;+\;4 г}{180 г\;+\;4 г}$ * 100% = 5,1%
Ответ: $ω_{1}$ = 5,1%.4. Смешали 180 г 3%−ного раствора и 120 г 5%−ного раствора спиртовой настойки йода. Определите долю йода в полученном растворе.
Ответ:
Дано:
$ω_{1}$ = 3%
$m_{р-ра1}$ = 180 г
$ω_{2}$ = 5%
$m_{р-ра2}$ = 120 г
Найти:
$ω_{3}$ − ?
Решение:
$ω_{3}$ = $\frac{m_{в-ва1} + m_{в-ва2}}{m_{р-ра1} + m_{р-ра2}}$ * 100%
$m_{в-ва1}$ = $m_{р-ра1}$ * ω = 180 г * 0,03 = 5,4 г
$m_{в-ва2}$ = $m_{р-ра2}$ * ω = 120 г * 0,05 = 6 г
$ω_{3}$ = $\frac{5,4 г + 6 г}{180 г + 120 г}$ * 100% = 3,8%
Ответ: $ω_{3}$ = 3,8%.5. В 150 мл этилового спирта плотностью 0,8 г/мл растворили 8 г йода. Какой стала массовая доля спирта в полученном растворе?
Ответ:
Дано:
$V_{(р-ра)}$ = 150 мл
ρ = 0,8 г/мл
$m_{в-ва}$ = 8 г
Найти:
$ω_{1}$ − ?
Решение:
$ω_{1}$ = $\frac{m_{в-ва}}{m_{р-ра}}$
$m_{р-ра}$ = $V_{(р-ра)}$ * ρ = 150 мл * 0,8 г/мл = 120 г
$ω_{1}$ = $\frac{8 г}{120 г}$ * 100% = 6,67%
Ответ: $ω_{1}$ = 6,67%.6. Составьте условие новой задачи с использованием раствора перекиси водорода по образцу задач 1 − 5 и решите ее.
Условие задачи: _Ответ:
Условие задачи: Смешали 280 г 6%−ного раствора и 220 г 10%−ного раствора спиртовой настойки йода. Определите долю йода в полученном растворе.
Дано:
$ω_{1}$ = 6%
$m_{р-ра1}$ = 280 г
$ω_{2}$ = 10%
$m_{р-ра2}$ = 220 г
Найти:
$ω_{3}$ − ?
Решение:
$ω_{3}$ = $\frac{m_{в-ва1} + m_{в-ва2}}{m_{р-ра1} + m_{р-ра2}}$ * 100%
$m_{в-ва1}$ = $m_{р-ра1}$ * ω = 280 г * 0,06 = 16,8 г
$m_{в-ва2}$ = $m_{р-ра2}$ * ω = 220 г * 0,1 = 22 г
$ω_{3}$ = $\frac{16,8 г + 22 г}{280 г + 220 г}$ * 100% = 7,76%
Ответ: $ω_{3}$ = 7,76%. §9
-
§9. Массовая доля примесей
Часть I
1. Технический образец − это _
Ответ:
Технический образец − это смесь основного вещества с примесями.
2. Степень чистоты вещества отражает _ _ _ _ _ _ _ _ _ _ _ _ примесей.
Ответ:
Степень чистоты вещества отражает содержание примесей.
3. Массовая доля примесей (ω) − это _ .
Массовая доля примесей рассчитывается по формуле _Ответ:
Массовая доля примесей (ω) − это отношение массы примесей к массе образца.
Массовая доля примесей рассчитывается по формуле:
ω = $m_{(чистого\;в-ва)}$ : $m_{(образца)}$ * 100%4. Чтобы найти массу примесей по массе технического образца, используют формулу _
Ответ:
Чтобы найти массу примесей по массе технического образца, используют формулу:
$m_{(примесей)}$ = $m_{(техн. в-ва)}$ * $ω_{(примесей)}$5. Чтобы найти массу чистого вещества в техническом образце, нужно _ или в формульном виде _
Ответ:
Чтобы найти массу чистого вещества в техническом образце, нужно массовую долю чистого вещества умножить на масу смеси или в формульном виде:
$m_{(чист.в-ва)}$ = $m_{(смеси)}$ * $ω_{(чист.в-ва)}$6. Найдите массу кальцита в образце массой 250 кг, если массовая доля примесей в нем составляет 5%.
Ответ:
Дано:
$ω_{(примесей)}$ = 5% = 0,05
$m_{(смеси)}$ = 250 кг
Найти:
m ($CaCO_{3}$) − ?
Решение:
$m_{(примесей)}$ = $m_{(известняка)}$ * $ω_{(примесей)}$ = 250 * 0,05 = 12,5 кг
m ($CaCO_{3}$) = 300 − 12,5 = 287,5 кг
Ответ: m ($CaCO_{3}$) = 287,5 кг.Часть II
1. Монетное золото содержит 10% меди. Найдите массу золота, необходимую для изготовления 250 монет, каждая массой 2 г.
Ответ:
Дано:
$ω_{(меди)}$ = 10%
$n_{(монет)}$ = 250
$m_{(монеты)}$ = 2 г
Найти:
$m_{(золота)}$ − ?
Решение:
$m_{(монет)}$ = $m_{(монеты)}$ * $n_{(монет)}$ = 250 * 2 г = 500 г = 0,5 кг
$ω_{(золота)}$ = 100% − 10% = 90%
$m_{(золота)}$ = 0,5 кг : 0,9 = 0,556 кг
Ответ: $m_{(золота)}$ = 0,556 кг.2. Найдите массу свинца, содержащуюся в свинцовом аккумуляторе массой 15 кг, если технический образец содержит 6% сурьмы.
Ответ:
Дано:
$ω_{(сурьмы)}$ = 6%
$m_{(свинц.смесь)}$ = 15 кг
Найти:
$m_{(свинца)}$ − ?
Решение:
$ω_{(свинца)}$ = 100% − 6% = 94%
$m_{(золота)}$ = $m_{(свинц.смесь)}$ : $ω_{(свинца)}$ = 15 кг : 0,94 = 15,96 кг
Ответ: $m_{(золота)}$ = 15 кг : 0,94 = 15,96 кг3. Бронза содержит 92% меди, 6% олова и 2% цинка. Найдите массу меди, содержащуюся в 12 бронзовых медалях, массой 12 г каждая.
Ответ:
Дано:
$ω_{(меди)}$ = 92%
$ω_{(олова)}$ = 6%
$ω_{(цинка)}$ = 2%
$m_{(медали)}$ = 12 г
$n_{(медалей)}$ = 12
Найти:
$m_{(меди)}$ − ?
Решение:
$m_{(медалей)}$ = $m_{(медали)}$ * $n_{(медалей)}$ = 12 г * 12 = 144 г
$m_{(меди)}$ = $m_{(медалей)}$ * $ω_{(меди)}$ = 144 г * 0,92 = 132,48 г
Ответ: $m_{(меди)}$ = 132,48 г.4. Изспользуя информация из Интернета, заполните таблицу.
Классификация химических реактивов по чистотеСтепень чистоты Маркировка Содержание основного вещества Цвет полосы на упаковке Технические "ч." Чистые для анализа более 99% желтый Ответ:
Классификация химических реактивов по чистоте
Степень чистоты Маркировка Содержание основного вещества Цвет полосы на упаковке Технические "т." не менее 95% светло−коричневый Чистые "ч." не менее 98% зеленый Чистые для анализа "ч.д.а." не менее 99% синий Химически чистые "х.ч." более 99% красный Особо чистые более 99,9% "ос.ч." желтый 5. Придумайте и решите задачу для серной кислоты с маркировкой "ч.д.а.".
Условие задачи: _Ответ:
Условие задачи: Найдите массу чистой серной кислоты, если содержание примесей составляет 0,5% в 500 г раствора.
Дано:
$m_{р-ра}$ = 500 г
ω = 0,5%
Найти:
$m_{(чист.в-ва)}$ − ?
Решение:
$m_{(чист.в-ва)}$ = $m_{р-ра}$ * ω = 500 г * 0,005 = 2,5 г
Ответ: $m_{(чист.в-ва)}$ = 2,5 г.6. Придумайте и решите задачу для хлорида натрия с маркировкой "ч.".
Условие задачи: _Ответ:
Условие задачи: Найдите массу чистой азотной кислоты, если содержание примесей составляет 1,5% в 850 г раствора.
Дано:
$m_{р-ра}$ = 850 г
ω = 1,5%
Найти:
$m_{(чист.в-ва)}$ − ?
Решение:
$m_{(чист.в-ва)}$ = $m_{р-ра}$ * ω = 850 г * 0,015 = 12,75 г
Ответ: $m_{(чист.в-ва)}$ = 12,75 г. §10
-
Физические явления в химии
§10. Некоторые способы разделения смесей
Часть I
1. Оформите отчет о лабораторном опыте "Разделение смеси порошков железа и серы".
Что делали Что наблюдали Выводы
Ответ:
Разделение смеси порошков железа и серы
Что делали Что наблюдали Выводы Разделяли смесь порошка железа и серы с помощью магнита Примагничивание порошка железа к магниту Железо обладает магнитными свойствами 2. Оформите отчет о лабораторном опыте "Разделение эмульсии растительного масла в воде".
Что делали Что наблюдали Выводы
Ответ:
Разделение эмульсии растительного масла в воде
Что делали Что наблюдали Выводы Разделяли воду и растительное масло с помощью делительной воронки При разделении смеси в воронке останется растительное масло, а воду сливаем. Масло не растворяется в воде. 3. Отстаивание − это _
Ответ:
Отстаивание − это разделение неоднородной жидкой смеси на компоненты, путём её расслоения с течением времени под действием силы тяжести.
4. Декантация − это _
Ответ:
Декантация − это процесс слития жидкости с остатка.
5. Центрифугирование − это _
Ответ:
Цетрифугирование − это процесс разделения неоднородной смеси, содержащей частицы очень малых размеров, которые невозможно отделить отстаиванием или фильтрованием.
В лабораториях для разделения подобных молоку смесей используют специальное устройство — центрифугу.Часть II
1. Заполните таблицу.
Способы разделения смесей и их применениеСпособ разделения На чем основан Вывод
1. Просеивание
2. Отстаивание
3. ЦентрифугированиеОтвет:
Способы разделения смесей и их применение
Способ разделения На чем основан Вывод 1. Просеивание Различный размер частиц Вещества с различным размером частиц можно разделить просеиванием 2. Отстаивание Различная плотность Вещества с различной плотностью можно разделить отстаиванием 3. Центрифугирование Различная плотность Вещества с различной плотностью можно разделить центрифугированием 2. Проведите домашний эксперимент. В стакан налейте спирт или раствор уксусной кислоты до высоты 0,5 − 1 см. Вырежьте из плотного бумажного полотенца две полосы шириной 1 см. На расстоянии 2 см от края полос нанесите точки: на первой − черным фломастером; на второй − синим или зеленым. Опустите эти полоски в стакан со спиртом так, чтобы их концы с нанесенными точками касались дна стакана, а противоположные концы загните по наружному краю стакана. Оставьте полоски до полного высыхания спирта и подсушивания. Оформите отчет о проделанной работе.
Что делали Что наблюдали Выводы
Черный фломастер
Синий или зеленый фломастер
Данный способ разделения смесей называют бумажной хроматографией. Он был открыт русским ботаником−физиологом и биохимиком Семеновичем Цветом.Ответ:
Что делали Что наблюдали Выводы Черный фломастер Наблюдаем разделение красящих веществ. Такой метод назвается хроматография. Синий или зеленый фломастер Наблюдаем разделение красящих веществ. Такой метод назвается хроматография. 3. Используя информацию из Интернета, опишите кратко основные научные достижения М. С. Цвета.
Ответ:
М. С. Цвет был первым, кому удалось установить, что существуют только две модификации (видоизменения) хлорофилла: хлорофилл А и хлорофилл В. И сделал он это с помощью изобретенного им самим метода. Новый метод разделения сложных веществ на компоненты был назван хроматографией. Раствор смеси веществ, которые желают разделить, пропускают через стеклянную трубку, заполненную веществом, различно адсорбирующим эти вещества. Для многих пигментов, в частности для хлорофилла, наилучшей адсорбирующей средой является свежеосаждённый и тщательно в течение двух часов при 150°С высушенный порошкообразный углекислый кальций. Так же хороша для этой цели сахароза.
4. Где применяется центрифугирование?
В быту _
На производстве _Ответ:
В быту: в стиральных машинах для отжима белья, в пылесосах для отделения частиц пыли, в сепараторах для отделения сливок в молоке.
На производстве: химическая, атомная, пищевая и нефтяная промышленности. §11
-
§11. Фильтрование
Часть I
1. На каком рисунке верно собрана установка для фильтрования?
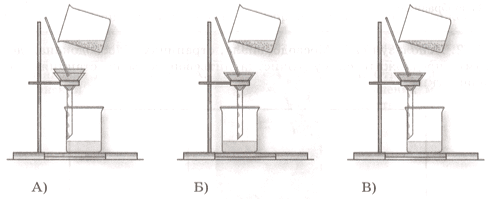
Ответ: _Ответ:
Установка для фильтрования собрана верно на рисунке А, потому что капли фильтрата должны стекать по стенками химического стакана.
Ответ: А.2. Фильтрат − это _
Ответ:
Фильтрат − это раствор полученный в результате фильтрования.
3. Адсорбция − это _
Ответ:
Абсо́рбция − это поглощение частиц поверхностью вещества.
4. Респиратор − это _
Ответ:
Респиратор − это средство индивидуальной защиты органов дыхания от попадания аэрозолей и/или вредных газов.
5. Заполните схему.
Ответ:
Часть II
1. Заполните таблицу.
Фильтрование жидкостей и газов в быту и на производстве.Тип фильтруемых смесей В быту На производстве
Жидкие
ГазообразныеОтвет:
Фильтрование жидкостей и газов в быту и на производстве.
Тип фильтруемых смесей В быту На производстве Жидкие Фильтрование воды Фильтрование азотной кислоты Газообразные Фильтрование воздуха Фильтрование газа в производстве аммиака 2. Используя сайт Мосводоканала, страничку "Мосводоканал детям", предложите схему "Очистка питьевой воды на станциях водоочистки".
Ответ:
В настоящее время московские станции водоподготовки перешли на использование гипохлорита натрия, бактерицидные свойства и механизм действия которого аналогичны хлору. Но, в отличие от хлора, гипохлорит натрия не горюч и не взрывоопасен. При его использовании риск возникновения чрезвычайных ситуаций и их последствий несоизмеримо ниже, чем при использовании жидкого хлора, что особенно актуально для московского мегаполиса, жилые микрорайоны которого все ближе подступают к станциям водоподготовки. Переход на применение гипохлорита натрия не отражается на качестве питьевой воды.
Обеззараживание воды можно производить различными способами: применяя сильные окислители, к которым относится хлор, хлорсодержащие реагенты, озон, диоксид хлора, или же физическими методами, такими, как ультрафиолетовое облучение. Но только хлорирование обеспечивает длительный бактерицидный эффект и позволяет сохранить эпидемическую безопасность воды при ее транспортировке до крана потребителя.
3. В качестве фильтрующих материалов могут быть использованы:
1) ткань;
2) мел;
3) бумага;
4) полиэтилен;
5) галька;
6) каменный уголь − антрацит.
Ответ: _Ответ:
В качестве фильтрующих материалов могут быть использованы:
+1) ткань;
2) мел;
+3) бумага;
4) полиэтилен;
5) галька;
+6) каменный уголь − антрацит.
Ответ: 1); 3); 6).4. Заполните таблицу.
Использование респираторов в профессиональной деятельностиСфера деятельности Профессия Цель использования респираторов
Строительство
Сельское хозяйство
Медицина
Угледобыча
Дезинфекция
КамнеобработкаОтвет:
Использование респираторов в профессиональной деятельности
Сфера деятельности Профессия Цель использования респираторов Строительство Строитель Защита от строительной пыли Сельское хозяйство Ветеринар Защита от паров лекарственных препаратов Медицина Врач Защита от болезнетворных микроорганизмов Угледобыча Шахтер Защита от пыли Дезинфекция Дезинфектор Защита от ядовитых веществ Камнеобработка Каменщик Защита от пыли 5. Соотнесите имя ученого, его портрет и научные достижения.
Ученый Портрет Научное достижение
1) Николай Дмитриевич Зелинский А. I. Открыл закон сохранения массы вещества
I. Открыл закон сохранения массы вещества
2) Михаил Васильевич Ломоносов Б. II. Открыл адсорбцию и создал первый в мире противогаз
II. Открыл адсорбцию и создал первый в мире противогаз
Михаил Семенович Цвет В. III. Открыл бумажную хроматографию
III. Открыл бумажную хроматографию
Ответ:1 2 3
Ответ:
Ученый Портрет Научное достижение 1) Николай Дмитриевич Зелинский Б. 
II. Открыл адсорбцию и создал первый в мире противогаз 2) Михаил Васильевич Ломоносов В. 
I. Открыл закон сохранения массы вещества Михаил Семенович Цвет А. 
III. Открыл бумажную хроматографию Ответ:
1 2 3
Б, II В, I А, III6. Напишите синквейн "Биологические фильтры".
Ответ:
Синквейн "Биологические фильтры"
1) Фильтр.
2) Биологические, очистительные.
3) Фильтруют, очищают, процеживают.
4) С помощью фильтра можно очистить воду.
5) Биология. §12
-
§12. Дистилляция, или перегонка
Часть I
1. Дистилированная вода − это _
Ответ:
Дистиллированная вода − это вода, очищенная от растворённых в ней минеральных солей, органических веществ и других примесей путём дистилляции.
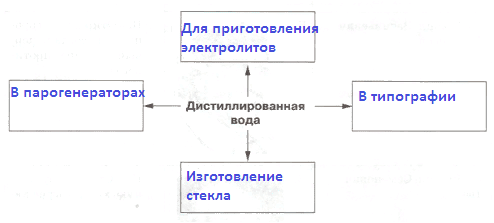
2. Заполните схему.
Применение дистиллированной водыОтвет:
Применение дистиллированной воды
3. Фракции − это _
Ответ:
Фракции − это части, отличающиеся друг от друга пределами выкипания.
4. Аппарат для перегонки нефти − это _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Ответ:
Аппарат для перегонки нефти − это ректификационная колонна.
5. Продукты перегонки нефти (в порядке увеличения плотности):
1) _
2) _
3) _
4) _
5) _Ответ:
Продукты перегонки нефти (в порядке увеличения плотности):
1) Бензин;
2) Лигроин;
3) Керосин;
4) Газойль;
5) Мазут;
6) Гудрон.Часть II
1. При перегонке воды не происходит процесс
1) сублимации;
2) кипения;
3) испарения;
4) конденсации.
Ответ: _Ответ:
При перегонке воды не происходит процесс
1) сублимации;
2) кипения;
3) испарения;
4) конденсации.
Ответ: 1).2. Физические свойства компонентов смеси, на основе которых осуществляется перегонка:
1) _
2) _
3) _Ответ:
Физические свойства компонентов смеси, на основе которых осуществляется перегонка:
1) Кипение;
2) Испарение;
3) Конденсация.3. Кратко опишите устройство ректификационной колонны.
Ответ:
Ректификационная колонна — вертикальный цилиндрический аппарат с корпусом, в котором расположены массо− и теплообменные устройства. В нижней части колонны имеется куб, в котором происходит кипение кубовой жидкости. Нагревание в кубе осуществляется за счет глухого пара, находящегося в змеевике. Неотъемлемой частью ректификационной колонны является дефлегматор, предназначенный для конденсации пара, выходящего из колонны.
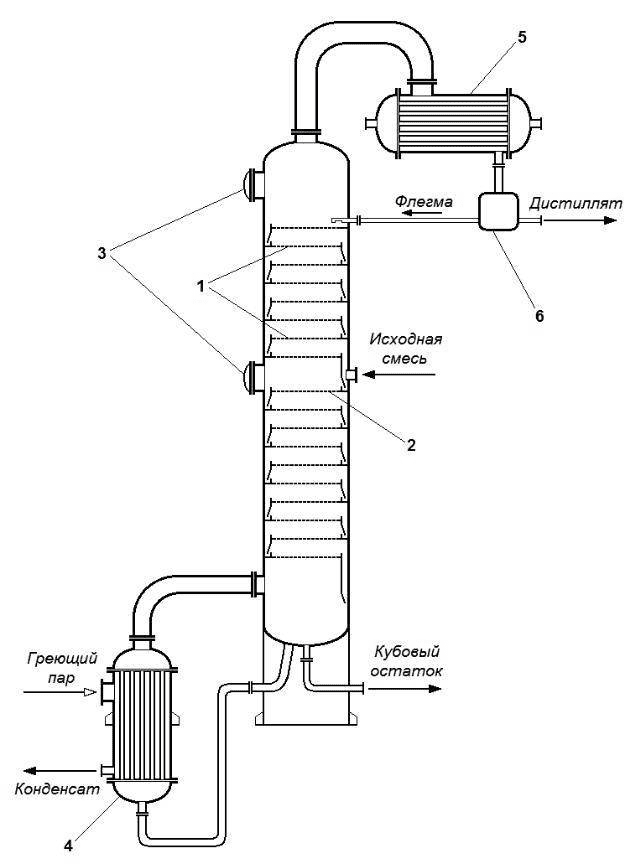
4. Заполните таблицу.
Применение нефтепродуктовНефтепродукты Применение
Бензин
Керосин
Газойль
МазутОтвет:
Применение нефтепродуктов
Нефтепродукты Применение Бензин Авиационное и автомобильное топливо, хороший растворитель. Керосин Горючее для реактивных двигателей. Газойль Дизельное топливо. Мазут Смазочные масла − смазка. 5. Напишите синквейн о дистиллированной воде.
Ответ:
Синквейн о дистиллированной воде:
1) Вода.
2) Чистая, прозрачная, безвкусная.
3) Очищать, фильтровать, процеживать.
4) Дистилированная вода не имеет примесей.
5) Биология. §13
-
Состав веществ. Химические знаки и формулы
§13. Химические элементы. Простые и сложные вещества
Часть I
1. Химический элемент − это _
Ответ:
Химический элемент − это совокупность атомов, имеющих одинаковый заряд ядра и число протонов.
2. Оформите схему.
Ответ:
3. Сделайте подписи на рисунке.
Ответ:
4. Аллотропия − это _ , а данные вещества − это _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .
Ответ:
Аллотропия − это существование двух и более простых веществ одного и того же химического элемента, а данные вещества − это аллотропные модификации.
Часть II
1. Нарисуйте столбчатую диаграмму химического состава земной коры, или _ _ _ _ _ _ _ _ _, или создайте ее в программе Excel и вклейте в тетрадь.
Ответ:
Нарисуйте столбчатую диаграмму химического состава земной коры, или литосферы, или создайте ее в программе Excel и вклейте в тетрадь.
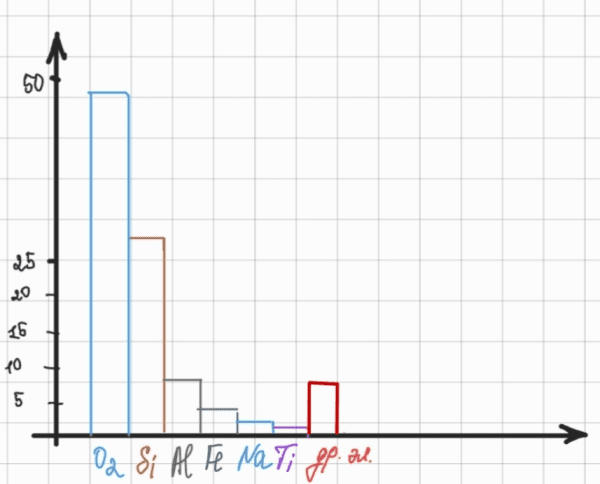
Кислород ($O_{2}$) − 47%
Кремний (Si) − 29%
Алюминий (Al) − 8%
Железо (Fe) − 5%
Натрий (Na) − 2,5%
Титан (Ti) − 0,4%
Другие элементы − 8,1%2. Соотнесите модельные представления с названием частицы.
Модель Частица
1) о А. Молекула кислорода
2) ооо Б. Атом кислорода
3) оо В. Молекула озона
Ответ:1 2 3
Ответ:
1 2 3
Б В А3. Из перечня веществ выпишите в два столбика простые и сложные вещества: водород, кислород, углекислый газ, азот, вода, сероводород.
Простые Сложные
1) 1)
2) 2)
3) 3)Ответ:
Простые Сложные 1) Водород 1) Углекислый газ 2) Кислород 2) Вода 3) Азот 3) Сероводород 4. Вставьте пропущенные слова.
Углекислый газ − это _ _ _ _ _ _ _ вещество, потому что его _ _ _ _ _ _ _ _ состоит из одного _ _ _ _ _ углерода и _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ .Ответ:
Углекислый газ − это сложное вещество, потому что его молекула состоит из одного атома углерода и двух атомов кислорода.
5. Нарисуйте круговую диаграмму химического состава воздушной оболочки Земли, или _ _ _ _ _ _ _ _ _, или создайте ее в программе Excel и вклейте в тетрадь.
Ответ:
Нарисуйте круговую диаграмму химического состава воздушной оболочки Земли, или атмосферы, или создайте ее в программе Excel и вклейте в тетрадь.
6. Соотнесите рисунки моделей с названиями веществ.
Модель Название веществ
1) оОо А. Кислород
2) ооо Б. Озон
3) оо В. Вода
4) •О• Г. Углекислый газ
Ответ:1 2 3 4
Ответ:
1 2 3 4
Г Б А В7. В задании 6 даны:
1) 2 простых и 2 сложных вещества;
2) 1 простое и 3 сложных вещества;
3) 3 сложных и 1 простое вещество.
Ответ: _Ответ:
В задании 6 даны:
1) 2 простых и 2 сложных вещества;
2) 1 простое и 3 сложных вещества;
3) 3 сложных и 1 простое вещество.
Ответ: 1). §14
-
§14. Химические знаки и химические формулы
Часть I
1. Соотнесите произношение химического символа с названием химического элемента.
Произношение Химический элемент
1) Аргентум А. Железо
2) Феррум Б. Кремний
3) Купрум В. Серебро
4) Силициум Г. Ртуть
5) Гидраргирум Д. Медь
Ответ:1 2 3 4 5
Ответ:
1 2 3 4 5
В А Д Б Г2. Соотнесите химический знак с названием элемента.
Химический знак Химический элемент
1) K А) Азот
2) Ca Б) Калий
3) Mn В) Кальциий
4) Mg Г) Натрий
5) Na Д) Магний
6) N Е) Марганец
Ответ:1 2 3 4 5 6
Ответ:
1 2 3 4 5 6
Б В Е Д Г А3. Вертикальные столбцы таблицы Д. И. Менделеева − это _ _ _ _ _ _ , а горизонтальные − это _ _ _ _ _ _ _ .
Ответ:
Вертикальные столбцы таблицы Д. И. Менделеева − это группы , а горизонтальные − это периоды.
4. Соотнесите названия групп элементов с их обозначением.
Название Обозначение
1) Щелочные металлы А. VIIA
2) Благородные газы Б. IA
3) Галогены В. VIIIA
Ответ:1 2 3
Ответ:
1 2 3
Б В А5. Информация, которую несет химический знак или символ:
1) _
2) _Ответ:
Информация, которую несет химический знак или символ:
1) Латинское название конкретного химического элемента.
2) Произношение названия химического элемента.6. Информация, которую несет химическая формула:
1) _
2) _
3) _
4) _Ответ:
Информация, которую несет химическая формула:
1) конкретное вещество и его тип — простое или сложное;
2) одну частицу этого вещества, например одну молекулу его или формульную единицу для веществ немолекулярного строения;
3) качественный состав его, т. е. атомы каких элементов входят в состав данного вещества;
4) количественный состав, т. е. число атомов каждого элемента в составе одной частицы вещества.7. Из перечня веществ: 1) метан, 2) углекислый газ, 3) аммиак, 4) озон, 5) вода − к веществам, содержащим водород, относятся: _ .
Ответ:
Из перечня веществ: 1) метан, 2) углекислый газ, 3) аммиак, 4) озон, 5) вода − к веществам, содержащим водород, относятся: метан, аммиак, вода.
8. Соотношение атомов алюминия, серы, кислорода в составе сульфата алюминия $Al_{2}(SO_{4})_{3}$ составляет:
1) 2 : 1 : 4;
2) 2 : 3 : 4;
3) 2 : 3 : 12;
4) 1 : 3 : 6.
Ответ: _Ответ:
Соотношение атомов алюминия, серы, кислорода в составе сульфата алюминия $Al_{2}(SO_{4})_{3}$ составляет:
1) 2 : 1 : 4;
2) 2 : 3 : 4;
3) 2 : 3 : 12;
4) 1 : 3 : 6.
Ответ: 3.Часть II
1. Положение кальция в таблице Д. И. Менделеева описывается координатами:
1) 3−й период, IIА−группа;
2) 4−й период, IIБ−группа;
3) 4−й период, IА−группа;
4) 4−й период, IБ−группа.
Ответ: _Ответ:
Положение кальция в таблице Д. И. Менделеева описывается координатами:
1) 3−й период, IIА−группа;
2) 4−й период, IIБ−группа;
3) 4−й период, IА−группа;
4) 4−й период, IБ−группа.
Ответ: 1).2. Положение марганца в таблице Д. И. Менделеева описывается координатами:
1) 4−й период, VIIА−группа;
2) 4−й период, VIIБ−группа;
3) 5−й период, VIА−группа;
4) 5−й период, IIБ−группа.
Ответ: _Ответ:
Положение марганца в таблице Д. И. Менделеева описывается координатами:
1) 4−й период, VIIА−группа;
2) 4−й период, VIIБ−группа;
3) 5−й период, VIА−группа;
4) 5−й период, IIБ−группа.
Ответ: 2).3. С московским регионом связаны названия химических элементов (укажите номера), символы которых:
1) Ru;
2) Db;
3) Mc;
4) Md;
5) Fl.
Ответ: _Ответ:
С московским регионом связаны названия химических элементов (укажите номера), символы которых:
1) Ru;
2) Db;
3) Mc;
4) Md;
5) Fl.
Ответ: 2; 3.
Db − Дубний, Mc − Московий.4. Установите соответствие между формулами и моделями молекул веществ.
Формула Модель
1) $H_{2}$ А)
2) $CO_{2}$ Б)
3) $CH_{4}$ В)
4) CO Г)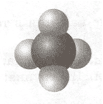
5) $H_{2}CO$ Д)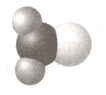
Ответ:1 2 3 4 5
Ответ:
1 2 3 4 5
Б А Г В Д5. Соотнесите имя ученого, его портрет и соответствующий символ химического элемента.
Ученый Портрет Символ химического элемента
1) Дмитрий Иванович Менделеев А) I. Cn
I. Cn
2) Юрий Цолакович Оганесян Б) II. Md
II. Md
3) Николай Коперник В) III. Es
III. Es
4) Мария Склодовская−Кюри Г) IV. Cm
IV. Cm
5) Альберт Эйнштейн Д) V. Og
V. Og
Ответ:1 2 3 4 5
Ответ:
1 2 3 4 5 А, II Г, V Д, I Б, IV В, III 6. Укажите координаты химического элемента, названного в честь России, − рутения:
1) номер элемента _ ;
2) номер и тип периода _ ;
3) номер и тип группы _ .Ответ:
Координаты химического элемента, названного в честь России, − рутения:
1) номер элемента − 44;
2) номер и тип периода − пятый период (большой);
3) номер и тип группы − VIIIБ−группа.7. Напишите эссе об одном из химических элементов, название которого связано с Россией.
Ответ:
Рутений − химический элемент с атомным номером 44. Представляет собой переходный металл платиновой группы серебристого цвета. Используется в электронике, химии, для создания износостойких электрических контактов, резисторах. Добывается из платиновой руды.
Наиболее ценные свойства Рутения — тугоплавкость, твердость, химическая стойкость, способность ускорять некоторые химические реакции. Наиболее характерны соединения с валентностью 3, 4 и 8. Склонен к образованию комплексных соединений. Применяется как катализатор, в сплавах с платиновыми металлами, как материал для острых наконечников, для контактов, электродов и в ювелирном деле.
Элемент был назван в честь России − рутением. Изначально идея названия принадлежала немецкому химику Готфриду Озанну − он дал это имя одному из трех платиновых металлов, полученных им также при анализе уральской платиновой руды в 1928 году.
§15
-
§15. Относительная атомная и относительная молекулярная массы
Часть I
1. Относительная атомная масса − это _
Ответ:
Относительная атомная масса − это величина, показывающая, во сколько раз масса атома данного химического элемента больше массы атома водорода.
2. Относительная молекулярная масса − это _
$M_{r}$ рассчитывается как сумма _Ответ:
Относительная молекулярная масса – это величина, показывающая, во сколько раз масса молекулы данного вещества больше массы атома водорода.
$M_{r}$ рассчитывается как сумма всех $A_{r}$.3. Массовая доля элемента (ω) − это _
Она рассчитывается по формуле _Ответ:
Массовая доля элемента (ω) − это отношение массы, которая приходится на этот элемент, к относительной молекулярной массе вещества, выраженное в долях единицы или процентах.
Она рассчитывается по формуле:
ω = $\frac{A_{r}\;*\;n}{M_{r}}$ * 100%4. $M_{r}$ ($H_{3}PO_{4}$) = _
Ответ:
$M_{r}$ ($H_{3}PO_{4}$) = 3 * 1 + 31 + 16 * 4 = 98
5. $M_{r}$ ($CaCO_{3}$) = _
Ответ:
$M_{r}$ ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100
6. Информация, которую несет формула $C_{6}H_{12}O_{6}$:
1) конкретное химическое вещество _
2) число молекул (формульных единиц) вещества _
3) тип вещества _
4) качественный состав _
5) количественный состав
6) $M_{r}$ _
7) массовая доля элементов:
ω (C) = _
ω (H) = _
ω (O) = _Ответ:
Информация, которую несет формула $C_{6}H_{12}O_{6}$:
1) конкретное химическое вещество − глюкоза
2) число молекул (формульных единиц) вещества − 1
3) тип вещества − сложное вещество
4) качественный состав − углерод, водород, кислород
5) количественный состав − 6 атомов углерода, 12 атомов водорода, 6 атомов кислорода
6) $M_{r}$ = 6 * 12 + 12 * 1 + 6 * 16 = 180
7) массовая доля элементов:
ω (C) = $\frac{6\;* \;12}{180}$ * 100% = 40%
ω (H) = $\frac{12\;* \;1}{180}$ * 100% = 6,67%
ω (O) = $\frac{6\;*\;16}{180}$ * 100% = 53,33%Часть II
1. Одинаковые относительные молекулярные массы имеют вещества:
1) азот $M_{r}$ ($N_{2}$) = _
2) фосфорная кислота $M_{r}$ ($H_{3}PO_{4}$) = _
3) этилен $M_{r}$ ($C_{2}H_{4}$) = _
4) серная кислота $M_{r}$ ($H_{2}SO_{4}$) = _
Ответ: _ _ _ _ _ _ и _ _ _ _ _ _ ; _ _ _ _ _ _ и _ _ _ _ _ _ .Ответ:
Одинаковые относительные молекулярные массы имеют вещества:
1) азот $M_{r}$ ($N_{2}$) = 14 * 2 = 28
2) фосфорная кислота $M_{r}$ ($H_{3}PO_{4}$) = 3 * 1 + 31 + 4 * 16 = 98
3) этилен $M_{r}$ ($C_{2}H_{4}$) = 2 * 12 + 4 * 1 = 28
4) серная кислота $M_{r}$ ($H_{2}SO_{4}$) = 2 * 1 + 32 + 4 * 16 = 98
Ответ: $H_{3}PO_{4}$ и $H_{2}SO_{4}$; $N_{2}$ и $C_{2}H_{4}$.2. Информация, которую несет формула $CaCO_{3}$:
1) название вещества (используйте Интернет) − _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ ;
2) тип вещества − _ _ _ _ _ _ _ ;
3) качественный и количественный состав: _
4) соотношение атомов в составе вещества:
Ca : C : O = _
5) $M_{r}$ ($CaCO_{3}$) = _
6) массовая доля элементов:
ω (Ca) = _
ω (C) = _
ω (O) = _Ответ:
Информация, которую несет формула $CaCO_{3}$:
1) название вещества (используйте Интернет) − карбонат кальция;
2) тип вещества − сложное;
3) качественный и количественный состав: 1 атом кальция, 1 атом углерода и 3 атома кислорода;
4) соотношение атомов в составе вещества:
Ca : C : O = 1 : 1 : 3;
5) $M_{r}$ ($CaCO_{3}$) = 40 + 12 + 16 * 3 = 100
6) массовая доля элементов:
ω (Ca) = $\frac{40}{100}$ * 100% = 40%
ω (C) = $\frac{12}{100}$ * 100% = 12%
ω (O) = $\frac{16\;*\;3}{100}$ * 100% = 48%3. Чему равна масса йодата калия $KIO_{3}$, которая содержит 25 мг йода, необходимых организму взрослого человека?
Ответ:
Дано:
m ($I_{2}$) = 25 мг = 0,025 г
Найти:
m ($KIO_{3}$) − ?
Решение:
$M_{r}$ ($KIO_{3}$) = 39 + 127 + 16 * 3 = 214
ω (I) = $\frac{127}{214}$ * 100% = 59,3%
Составим пропорцию:
25 мг − 59,3%
x мг − 100%
x = $\frac{25\;*\;100}{59,3}$ = 42,16 мг
Ответ: m ($KIO_{3}$) = 42,16 мг.4. Расположите серосодержащие соединения в порядке возрастания массовой доли серы, основываясь на расчетах:
1) серная кислота $H_{2}SO_{4}$;
2) сульфат калия $K_{2}SO_{4}$;
3) сернистый газ $SO_{2}$;
4) сульфат алюминия $Al_{2}(SO_{4})_{3}$.
1) ω (S) = _
2) ω (S) = _
3) ω (S) = _
4) ω (S) = _
Ответ: _Ответ:
1) серная кислота $H_{2}SO_{4}$:
$M_{r}$ ($H_{2}SO_{4}$) = 2 * 1 + 32 + 4 * 16 = 98
2) сульфат калия $K_{2}SO_{4}$:
$M_{r}$ ($K_{2}SO_{4}$) = 2 * 39 + 32 + 4 * 16 = 174
3) сернистый газ $SO_{2}$:
$M_{r}$ ($SO_{2}$) = 32 + 2 * 16 = 64
4) сульфат алюминия $Al_{2}(SO_{4})_ {3}$:
$M_{r}$ ($Al_{2}(SO_{4})_ {3}$) = 27 * 2 + 32 * 3 + 12 * 16 = 342
1) ω (S) = 1 * 32 : 98 * 100% = 32,65%
2) ω (S) = 1 * 32 : 174 * 100% = 18,4%
3) ω (S) = 1 * 32 : 64 * 100% = 50%
4) ω (S) = 3 * 32 : 342 * 100% = 28%
Ответ:
1 − сульфат калия $K _{2}SO_{4}$,
2 − сульфат алюминия $Al_{2}(SO_{4}) _{3}$,
3 − серная кислота $H _{2}SO _{4}$,
4 − сернистый газ $SO _{2}$.5. Расположите вещества из задания 4 в порядке уменьшения массовой доли кислорода в них, основываясь на расчетах:
1) ω (O) = _
2) ω (O) = _
3) ω (O) = _
4) ω (O) = _
Ответ: _Ответ:
1) серная кислота $H_{2}SO_{4}$:
$M_{r}$ ($H_{2}SO_{4}$) = 2 * 1 + 32 + 4 * 16 = 98
2) сульфат калия $K_{2}SO_{4}$:
$M_{r}$ ($K_{2}SO_{4}$) = 2 * 39 + 32 + 4 * 16 = 174
3) сернистый газ $SO_{2}$:
$M_{r}$ ($SO_{2}$) = 32 + 2 * 16 = 64
4) сульфат алюминия $Al_{2}(SO_{4})_ {3}$:
$M_{r}$ ($Al_{2}(SO_{4})_ {3}$) = 27 * 2 + 32 * 3 + 12 * 16 = 342
1) ω (O) = 4 * 16 : 98 * 100% = 65,3%
2) ω (O) = 4 * 16 : 174 * 100% = 36,8%
3) ω (O) = 2 * 16 : 64 * 100% = 50%
4) ω (O) = 12 * 16 : 342 * 100% = 56,1%
Ответ:
1 − серная кислота $H _{2}SO_{4}$,
2 − сульфат алюминия $Al_{2}(SO_{4}) _{3}$,
3 − сернистый газ $SO _{2}$,
4 − сульфат калия $K_{2}SO _{4}$.6. Напишите эссе о взаимосвязи между углеводами: глюкозой, сахарозой и крахмалом − и их значении в жизни природы, используя Интернет.
Ответ:
Углеводы содержатся в любом живом организме, будь то растение или человек. Углеводы являются жизненно важной частью рациона животных и человека. В организме человека крахмал и сахароза превращаются в глюкозу. Она служит источником энергии, так как может расщепляться и использоваться для синтеза АТФ а также используется для роста или восстановления тканей. Углеводы, которые организмы не сразу используют, хранятся для будущего использования в виде гликогена в мышцах и печени животных, а также в виде крахмала в растениях.
§16
-
Простые вещества
§16. Металлы
Часть I
1. Все металлы − это _ _ _ _ _ _ _ (агрегатное состояние) вещества, кроме _ _ _ _ _ (название) _ _ (символ).
Ответ:
Все металлы − это твердые (агрегатное состояние) вещества, кроме ртути (название) Hg (символ).
2. Металлы имеют преимущественно _ _ _ _ _ _ _ _ _ _ − _ _ _ _ _ цвет, но медь _ _ (химический символ) _ _ _ _ _ _ _ _ цвета, а золото _ _ (химический символ) _ _ _ _ _ _ _ цвета.
Ответ:
Металлы имеют преимущественно серебристо − серый цвет, но медь Cu (химический символ) красного цвета, а золото Au (химический символ) желтого цвета.
3. Самые мягкие металлы − это металлы _ группы, _ подгруппы, или _ .
Самый твердый металл − это _ (химический символ), _ (название).Ответ:
Самые мягкие металлы − это металлы I группы, A подгруппы, или щелочные металлы.
Самый твердый металл − это Cr (химический символ), хром (название).4. Металлы электро− и _ _ _ _ _ проводны.
Лучшие проводники тока − это (название и химический символы) _
Худшие проводники − это _Ответ:
Металлы электро− и теплопроводны.
Лучшие проводники тока − это (название и химический символы) серебро (Ag), медь (Cu) и алюминий (Al).
Худшие проводники − это свинец (Pb) и ртуть (Hg).5. Металлы обладают свойством под действием внешних сил принимать определенную форму и сохранять ее, т.е. _ _ _ _ _ _ _ _ _ _ _ _ .
Самые пластичные металлы (название и химические символы) − это _Ответ:
Металлы обладают свойством под действием внешних сил принимать определенную форму и сохранять ее, т.е. обладают ковкостью.
Самые пластичные металлы (название и химические символы) − это золото (Au), серебро (Ag) и медь (Cu).6. Некоторые металлы способны прокатываться в тончайшие (0,002 − 0,1 мм) листы. Название такого листа − _ _ _ _ _ _ .
Ответ:
Некоторые металлы способны прокатываться в тончайшие (0,002 − 0,1 мм) листы. Название такого листа − фольга.
7. Расположите в хронологическом порядке периоды истории человечества:
1) бронзовый век;
2) железный век;
3) каменный век;
4) медный век.
Ответ:1 2 3 4
Ответ:
Расположите в хронологическом порядке периоды истории человечества:
3 − 1) бронзовый век;
4 − 2) железный век;
1 − 3) каменный век;
2 − 4) медный век.
Ответ:
1 2 3 4
3 4 1 2Часть II
1. Сплав меди и олова − это _
Ответ:
Сплав меди и олова − это бронза.
2. Заполните таблицу.
Применение бронзыОбласть применение Свойство бронзы, лежащее в основе применения Примеры
Оружие
Художественное литье
Производство денег
Декоративная отделкаОтвет:
Применение бронзы
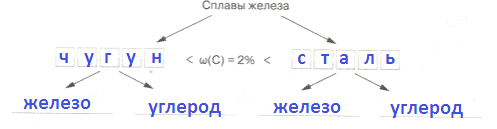
Область применение Свойство бронзы, лежащее в основе применения Примеры Оружие Высокая прочность Пушки, стрелковые оружия Художественное литье Хорошая обрабатываемость Иконы, скульптуры Производство денег Коррозийная стойкость Монеты Декоративная отделка Коррозийная стойкость Рамки, пороги 3. Сплавы железа:
1) _ _ _ _ _ , применяется: _
2) _ _ _ _ _ , применяется: _Ответ:
Сплавы железа:
1) Чугун, применяется: в строительстве и промышленности.
2) Сталь, применяется: делают детали для автомобилей, самолетов и поездов, ее применяют в производстве бытовой техники.4. Предложите список из пяти названий и химических символов металлов, играющих, на ваш взгляд, наибольшую роль в жизни человека.
Название Обоснование
Ответ:
Название Обоснование Алюминий Алюминиевая фольга для упаковки продуктов. Титан Для космических полётов. Серебро и золото Металлы, которым человечество отвело роль денег: из них чеканили монеты. Железо Сплавы железа − чугун и сталь имеют и художественное значение. Так, из чугуна отлит «оград узор чугунный» Санкт−Петербурга, ограды его мостов и решётка Летнего сада. Бронза Знаменитые московские Царь−колокол и Царь−пушка − ещё два примера художественной ценности бронзы. 5. Напишите эссе об одном из металлов вашего списка, используя Интернет.
Ответ:
Алюминий − химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо−белый лёгкий металл.
Внешняя электронная оболочка атома состоит из 3 электронов. В обычных условиях алюминий в соединениях 3−х валентен. Свойством алюминия активно взаимодействовать с кислородом пользуются для восстановления металлов из их окислов. При тёмно−красном калении фтор энергично взаимодействует с алюминием. Хлор и жидкий бром реагируют с алюминием при комнатной температуре, иод − при нагревании. При высокой температуре алюминий соединяется с азотом, углеродом и серой. С водородом алюминий не взаимодействует.
Сочетание физических, механических и химических свойств алюминия определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с другими металлами. В электротехнике алюминий успешно заменяет медь, особенно в производстве массивных проводников, например в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах. Сверхчистый алюминий употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности окисной плёнки алюминия пропускать электрический ток только в одном направлении. Сверхчистый алюминий, очищенный зонной плавкой, применяется для синтеза полупроводниковых соединений типа AIIIBV, применяемых для производства полупроводниковых приборов. Чистый алюминий используют в производстве разного рода зеркал отражателей. Алюминий высокой чистоты применяют для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска). Обладая относительно низким сечением поглощения нейтронов, алюминий применяется как конструкционный материал в ядерных реакторах. §17
-
§17. Представители металлов
Часть I
1. Дайте характеристику железа:
1) химический символ и его произношение _ ;
2) $A_{r}$ _ ;
3) координаты в Периодической таблице:
а) порядковый номер элемента _ ;
б) номер и тип периода _ ;
в) номер и тип группы _ .Ответ:
Характеристика железа:
1) химический символ и его произношение: Fe − феррум;
2) $A_{r}$ = 56;
3) координаты в Периодической таблице:
а) порядковый номер элемента − 26;
б) номер и тип периода − большой, 4;
в) номер и тип группы − VIIIБ.2. Заполните схему.
Ответ:
3. Дайте характеристику алюминия:
1) химический символ и его произношение _ ;
2) $A_{r}$ _ ;
3) координаты в Периодической таблице:
а) порядковый номер элемента _ ;
б) номер и тип периода _ ;
в) номер и тип группы _ .Ответ:
Характеристика алюминия:
1) химический символ и его произношение: Al − алюминий;
2) $A_{r}$ = 27;
3) координаты в Периодической таблице:
а) порядковый номер элемента − 13;
б) номер и тип периода − малый, 3;
в) номер и тип группы − IIIА.4. Дайте характеристику золота:
1) химический символ и его произношение _ ;
2) $A_{r}$ _ ;
3) координаты в Периодической таблице:
а) порядковый номер элемента _ ;
б) номер и тип периода _ ;
в) номер и тип группы _ .Ответ:
Характеристика золота:
1) химический символ и его произношение: Au − аурум;
2) $A_{r}$ = 197;
3) координаты в Периодической таблице:
а) порядковый номер элемента − 79;
б) номер и тип периода − большой, 6;
в) номер и тип группы − IB.5. Дайте характеристику олова:
1) химический символ и его произношение _ ;
2) $A_{r}$ _ ;
3) координаты в Периодической таблице:
а) порядковый номер элемента _ ;
б) номер и тип периода _ ;
в) номер и тип группы _ .Ответ:
Характеристика олова:
1) химический символ и его произношение: Sn − станнум;
2) $A_{r}$ = 119;
3) координаты в Периодической таблице:
а) порядковый номер элемента − 50;
б) номер и тип периода − большой, 5;
в) номер и тип группы − IV Б.6. Аллотропия олова
Ответ:
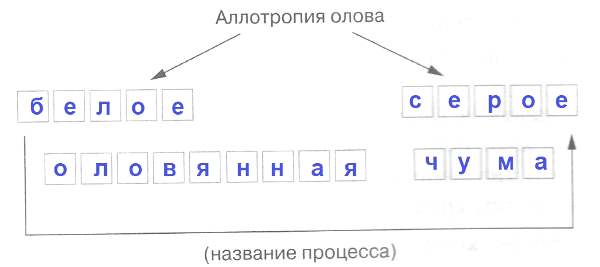
Часть II
1. Заполните таблицу.
Некоторые металлы (сплавы), их свойства и применениеНазвание металла (сплавы) Свойства Применение
1) Сплавы железа: а) чугун; б) сталь
2) Алюминий
3) Золото
4) ОловоОтвет:
Некоторые металлы (сплавы), их свойства и применение
Название металла (сплавы) Свойства Применение 1) Сплавы железа: а) чугун; б) сталь а) Низкая температура плавления, хорошая текучесть, литейность; б) Прочный, хорошая теплопроводность. а) Строительство, промышленность; б) Строительство, пищевая промышленность. 2) Алюминий Теплопроводный, стойкий к коррозии. Изготавливают фольгу и проволоку. 3) Золото Ковкость, пластичность, плотность. Изготовление ювелирных изделий. 4) Олово Ковкий металл, легкий металл. Используется как коррозионностойкое покрытие. 2. Расположите соединения в порядке возрастания массовой доли железа в них:
1) пирит $FeS_{2}$
M ($FeS_{2}$) = _
ω (Fe) = _
2) оксид железа (III) $Fe_{2}O_{3}$
M ($Fe_{2}O_{3}$) = _
ω (Fe) = _
3) сульфат железа (II) $FeSO_{4}$
M ($FeSO_{4}$) = _
ω (Fe) = _
4) гидроксид железа (III) $Fe(OH)_{3}$
M ($Fe(OH)_{3}$) = _
ω (Fe) = _
Ответ: _Ответ:
1) пирит $FeS_{2}$
M ($FeS_{2}$) = 120
ω (Fe) = 56 : 120 * 100% = 46,7%
2) оксид железа (III) $Fe_{2}O_{3}$
M ($Fe_{2}O_{3}$) = 56 * 2 + 16 * 3 = 160
ω (Fe) = 2 * 56 : 160 * 100% = 70%
3) сульфат железа (II) $FeSO_{4}$
M ($FeSO_{4}$) = 56 + 32 + 16 * 4 = 152
ω (Fe) = 56 : 152 * 100% = 36,8%
4) гидроксид железа (III) $Fe(OH)_{3}$
M ($Fe(OH)_{3}$) = 56 + 16 * 3 + 1 * 3 = 107
ω (Fe) = 56 : 107 * 100% = 52,3%
Ответ: 1 − сульфат железа (II) $FeSO_{4}$, 2 − пирит $FeS_{2}$, 3 − гидроксид железа (III) $Fe(OH)_ {3}$, 4 − оксид железа (III) $Fe_{2}O_{3}$.3. В авиастроении применяется сплав алюминия дуралюмин, содержащий 0,5% магния, 0,5% марганца, 5% меди и 94% алюминия. Масса компонентов, необходимых для приготовления 500 кг дуралюмина:
1) m (Al) = _
2) m (Cu) = _
3) m (Mn) = _
4) m (Mg) = _Ответ:
Дано:
ω (Mg) = 0,5%
ω (Mn) = 0,5%
ω (Cu) = 5%
ω (Al) = 94%
$m_{(дурал.)}$ = 500 кг
Найти:
m (Al) − ?
m (Cu) − ?
m (Mn) − ?
m (Mg) − ?
Решение:
m (Al) = ω (Al) * $m_{(дурал.)}$ = 0,94 * 500 кг = 470 кг
m (Cu) = ω (Cu) * $m_{(дурал.)}$ = 0,05 * 500 кг = 25 кг
m (Mn) = ω (Mn) * $m_{(дурал.)}$ = 0,005 * 500 кг = 2,5 кг
m (Mg) = ω (Mg) * $m_{(дурал.)}$ = 0,005 * 500 кг = 2,5 кг
Ответ: m (Al) = 470 кг; m (Cu) = 25 кг; m (Mn) = 2,5 кг; m (Mg) = 2,5 кг.4. Сплав, используемый для изготовления серебряных монет, содержит 90% серебра и 10% меди. Монета массой 3,2 г содержит:
а) m (Ag) = _
б) m (Cu) = _Ответ:
Дано:
ω (Ag) = 90%
ω (Cu) = 10%
m = 3,2 г
Найти:
m (Ag) − ?
m (Cu) − ?
Решение:
m (Ag) = ω (Ag) * m = 0,9 * 3,2 г = 2,88 г
m (Cu) = ω (Cu) * m = 0,1 * 3,2 г = 0,32 г
Ответ: m (Ag) = 2,88 г; m (Cu) = 0,32 г.5. Для чеканки золотых монет используется сплав, содержащий 90% золота и 10% меди. Монета массой 1,6 г содержит:
а) m (Au) = _
б) m (Cu) = _Ответ:
Дано:
ω (Au) = 90%
ω (Cu) = 10%
m = 1,6 г
Найти:
m (Au) − ?
m (Cu) − ?
Решение:
m (Au) = ω (Ag) * m = 0,9 * 1,6 г = 1,44 г
m (Cu) = ω (Cu) * m = 0,1 * 1,6 г = 0,16 г
Ответ: m (Au) = 1,44 г; m (Cu) = 0,16 г.6. Почему золотые или серебряные монеты не изготавливают из чистых металлов?
Ответ:
Золотые или серебряные монеты не изготавливают из чистых металлов, так как эти металлы довольно мягкие в чистом виде, и монеты будут непрочными, мягкими (особенно золотые), будут быстро истираться. ©
7. Напишите синквейн о превращении белого олова в серое.
Ответ:
Синквейн о превращении белого олова в серое.
1) Олово.
2) Белое, серое.
3) Превращается, видоизменяется.
4) Олово имеет несколько аллотропных модификаций.
5) Серое олово имеет меньшую плотность, по сравнению с белым. §18
-
§18. Неметаллы
Часть I
1. Расположите простые вещества, которые при обычных условиях являются газами, в порядке возрастания их $M_{r}$:
1) хлор $Cl_{2}$ _
2) азот $N_{2}$
3) кислород $O_{2}$ _
4) озон $O_{3}$ _
5) гелий He _
Ответ: _Ответ:
$M_{r}$ веществ:
1) хлор $Cl_{2}$: 71
2) азот $N_{2}$: 28
3) кислород $O_{2}$: 32
4) озон $O_{3}$: 48
5) гелий He: 4
Ответ: гелий; азот; кислород; озон; хлор.2. При обычных условиях является жидкостью неметалл (название и химический символ) _
Ответ:
При обычных условиях является жидкостью неметалл (название и химический символ) − бром Br.
3. При обычных условиях твердыми веществами являются, например, неметаллы (название и химический символ):
1) _
2) _
3) _Ответ:
При обычных условиях твердыми веществами являются, например, неметаллы (название и химический символ):
1) Бор − B
2) Йод − $I_{2}$
3) Фосфор − P4. Имеют блеск простые вещества − неметаллы (название и символ):
1) _
2) _Ответ:
Имеют блеск простые вещества − неметаллы (название и символ):
1) Графит − C
2) Йод − $I_{2}$5. Инертные газы называют также _ _ _ _ _ _ _ _ _ _ _ .
Ответ:
Инертные газы называют также благородными.
6. Названия аллотропных модификаций углерода:
1) _
2) _
3) _
4) _Ответ:
Названия аллотропных модификаций углерода:
1) Алмаз;
2) Графит;
3) Фуллерен;
4) Карбин.7. Названия аллотропных модификаций фосфора:
1) фосфор _ _ _ _ _ _ _ ;
2) фосфор _ _ _ _ _ .Ответ:
Названия аллотропных модификаций фосфора:
1) фосфор красный;
2) фосфор белый.Часть II
1. Заполните таблицу.
Аллотропные модификации кислородаОтвет:
Аллотропные модификации кислорода
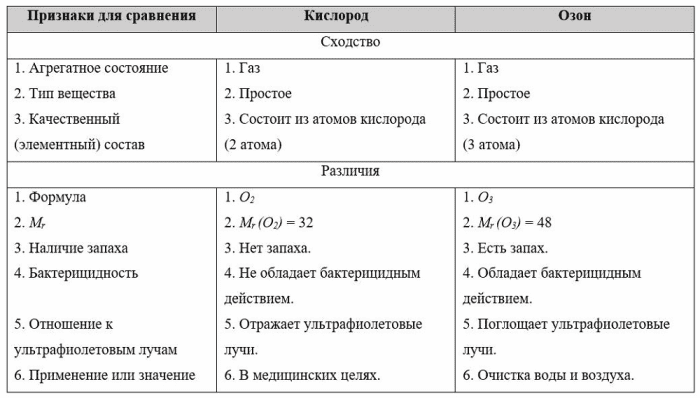
2. Две причины, обуславливающие явление аллотропии:
1) _
Примеры: _
2) _
Примеры: _Ответ:
Две причины, обуславливающие явление аллотропии:
1) различный состав молекул простого вещества.
Примеры: $O_{2}$ и $O_{3}$.
2) способ размещения атомов или молекул в кристаллической решётке.
Примеры: белый фосфор − молекулярная; красный фосфор − атомная.3. Используя Интернет, объясните этимологию названий неметаллов, записав вначале знак и произношение:
1) фосфор _
2) кислород _
3) хлор _
4) бром _
5) йод _Ответ:
1) фосфор: P − пэ
Название происходит от древнегреческого φωσφόρος: φῶς «свет» + φορέω «несу».
2) кислород: O − о
Название происходит от латинского oxygenium, где oxy означает кислый, a genium является производным от genus − «род».
3) хлор: Cl − хлор
Название происходит от древнегреческого χλωρός «зелёный».
4) бром: Br − бром
Название происходит от древнегреческого βρῶμος − «зловонный», также от лат. Bromum.
5) йод: I − йод
Название было заимствовано из французского, в котором iode («иод») восходит к греческому iodes − «фиолетовый».4. Напишите эссе на тему "Инертные или благородные", используя Интернет.
Ответ:
Инертные или благородные ©
Благородные (инертные) газы — химические элементы 18й группы периодической таблицы химических элементов. К ним относятся гелий, неон, аргон, криптон, ксенон, радон. Некоторые ученые причисляют к группе и оганесон. Все эти вещества — одноатомные газы, с большим трудом взаимодействующие с другими веществами. Это объясняется тем, что их внешние атомные оболочки полностью «укомплектованы» (кроме гелия) восемью электронами и являются энергетически стабильными.
На Земле инертные газы содержатся в воздухе, в малых концентрациях есть в горных породах, воде, нефти, других видах природных газов.
Исследования отмечают, что в космосе инертные газы встречаются гораздо чаще, чем на Земле, например, звезды на 25 % состоят из гелия. §19
-
§19. Представители неметаллов
Часть I
1. Дайте характеристику фосфора:
1) химический символ и его произношение: _ ;
2) $A_{r}$ _ ;
3) координаты в Периодической таблице:
а) порядковый номер элемента _ ;
б) номер и тип периода _ ;
в) номер и тип группы _ .Ответ:
Характеристика фосфора:
1) химический символ и его произношение: P − пэ;
2) $A_{r}$ = 31;
3) координаты в Периодической таблице:
а) порядковый номер элемента − 15;
б) номер и тип периода − малый, 3;
в) номер и тип группы − VА.2. Заполните таблицу.
Аллотропные модификации фосфораОтвет:
Аллотропные модификации фосфора

3. Расположите соединения серы в порядке возрастания ее массовой доли:
1) сернистый газ $SO_{2}$
$M_{r}$ ($SO_{2}$) = _
ω (S) = _
2) сульфат кальция $CaSO_{4}$
$M_{r}$ ($CaSO_{4}$) = _
ω (S) = _
3) сульфат алюминия $Al_{2}(SO_{4})_{3}$
$M_{r}$ ($Al_{2}(SO_{4})_{3}$) = _
ω (S) = _
4) серная кислота $H_{2}SO_{4}$
$M_{r}$ ($H_{2}SO_{4}$) = _
ω (S) = _
Ответ: _Ответ:
1) сернистый газ $SO_{2}$
$M_{r}$ ($SO_{2}$) = 32 + 16 * 2 = 64
ω (S) = 32 : 64 * 100% = 50%
2) сульфат кальция $CaSO_{4}$
$M_{r}$ ($CaSO_{4}$) = 40 + 32 + 16 * 4 = 136
ω (S) = 32 : 136 * 100% = 23,5%
3) сульфат алюминия $Al_{2}(SO_{4})_{3}$
$M_{r}$ ($Al_{2}(SO_{4})_{3}$) = 27 * 2 + 32 * 3 + 16 * 4 * 3 = 342
ω (S) = 32 * 3 : 342 * 100% = 28%
4) серная кислота $H_{2}SO_{4}$
$M_{r}$ ($H_{2}SO_{4}$) = 1 * 2 + 32 + 16* 4 = 98
ω (S) = 32 : 98 * 100% = 32,65%
Ответ: 1 − сульфат кальция $CaSO_{4}$, 2 − сульфат алюминия $Al_{2}(SO_{4})_{3}$, 3 − серная кислота (III) $H_{2}SO_{4}$, 4 − сернистый газ $SO_{3}$.4. Заполните таблицу.
Применение серыСвойство серы Применение
1)
2)
3)
4)Ответ:
Применение серы
Свойство серы Применение 1) Вулканизация каучука Получение резины 2) Образование оксидов серы Получение серной кислоты 3) Лечебные свойства Производство лекарственных препаратов 4) Отбеливающие свойства В бумажной промышленности 5. Заполните таблицу.
Аллотропные модификации углеродаОтвет:
Аллотропные модификации углерода
6. Адсорбция − это _
Ответ:
Адсорбция − это способность поглощать газы и растворённые вещества.
7. Области применения активированного угля:
1) _
2) _
3) _Ответ:
Области применения активированного угля:
1) Для очистки воды;
2) В противогазах;
3) В воздушных фильтрах.Часть II
1. Заполните таблицу, используя Интернет.
Свойство серной кислоты Применение
Ответ:
Свойство серной кислоты Применение Наличие сульфат ионов Производство сульфатов 2. Расположите соединения фосфора в порядке возрастания ее массовой доли:
1) оксид фосфора (V) $P_{2}O_{5}$
$M_{r}$ ($P_{2}O_{5}$) = _
ω (P) = _
2) метафосфорная кислота $HPO_{3}$
$M_{r}$ ($HPO_{3}$) = _
ω (P) = _
3) ортофосфорная $H_{3}PO_{4}$
$M_{r}$ ($H_{3}PO_{4}$) = _
ω (P) = _
4) пирофосфорная кислота $H_{4}P_{2}O_{7}$
$M_{r}$ ($H_{4}P_{2}O_{7}$) = _
ω (P) = _
5) фосфат кальция $Ca_{3}(PO_{4})_{2}$
$M_{r}$ ($Ca_{3}(PO_{4})_{2}$) = _
ω (P) = _
Ответ: _Ответ:
1) оксид фосфора (V) $P_{2}O_{5}$
$M_{r}$ ($P_{2}O_{5}$) = 31 * 2 + 16 * 5 = 142
ω (P) = $\frac{31\;*\;2}{142}$ * 100% = 43,7%
2) метафосфорная кислота $HPO_{3}$
$M_{r}$ ($HPO_{3}$) = 1 + 31 + 16 * 3 = 80
ω (P) = $\frac{31}{80}$ * 100% = 38,75%
3) ортофосфорная $H_{3}PO_{4}$
$M_{r}$ ($H_{3}PO_{4}$) = 1 * 3 + 31 + 16 * 4 = 98
ω (P) = $\frac{31}{98}$ * 100% = 31,6%
4) пирофосфорная кислота $H_{4}P_{2}O_{7}$
$M_{r}$ ($H_{4}P_{2}O_{7}$) = 1 * 4 + 31 * 2 + 16 * 7 = 178
ω (P) = $\frac{31 * 2}{178}$ * 100% = 34,8%
5) фосфат кальция $Ca_{3}(PO_{4})_{2}$
$M_{r}$ ($Ca_{3}(PO_{4})_{2}$) = 40 * 3 + 31 * 2 + 16 * 4 * 2 = 310
ω (P) = $\frac{31\;*\;2}{310}$ * 100% = 20%
Ответ: 1) фосфат кальция $Ca_{3}(PO_{4})_{2}$; 2) ортофосфорная $H_{3}PO_{4}$; 3) пирофосфорная кислота $H_{4}P_{2}O_{7}$; 4) метафосфорная кислота $HPO_{3}$; 5) оксид фосфора (V) $P_{2}O_{5}$3. Заполните таблицу.
Применение азотаСвойство азота Применение
Ответ:
Применение азота
Свойство азота Применение Наличие азота в составе Получение мочевины 4. Соотнесите аллотропные модификации углерода и их модели.
Модификация Модель
1) Алмаз А.
2) Графит Б.
3) Фуллерен В.
Ответ:1 2 3
Ответ:
1 2 3
Б В А5. Напишите синквейн об аллотропии углерода.
Ответ:
Синквейн об аллотропии углерода.
1) Углерод.
2) Прозрачный, матово−черный.
3) Находить, добывать, исчислять.
4) Алмаз − аллотропная модификация углерода.
5) Углерод имеет несколько аллотропных модификаций. §20
-
Сложные вещества
§20. Валентность
Часть I
1. Валентность − это _
Ответ:
Валентность − это свойство атомов одного химического элемента соединяться со строго определённым числом атомов другого химического элемента.
2. Химический элемент (по валентности)
Ответ:
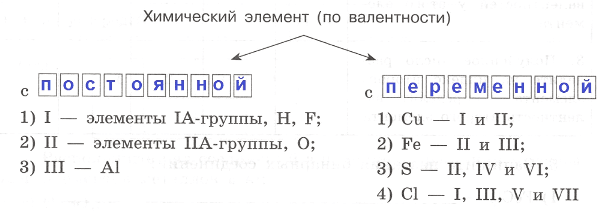
3. Составьте формулы двухэлементных, или _ _ _ _ _ _ _ _ , соединений с серой (III):
а) Na
б) Ca
в) AlДействие Примеры Примеры Примеры 1) Запишите рядом символы элементов а) б) в) 2) Над символами элементов римскими цифрами укажите валентности элементов 3) Найдите наименьшее общее кратное двух числовых значений валентности 4) Определите индексы, разделив наименьшее общее кратное на числовые валентности каждого элемента Ответ:
Действие Примеры Примеры Примеры 1) Запишите рядом символы элементов а) NaS б) CaS в) AlS 2) Над символами римскими цифрами укажите валентности элементов $\overset{I}{Na}$, $\overset{II}{S}$ $\overset{II}{Ca}$, $\overset{II}{S}$ $\overset{III}{Al}$, $\overset{II}{S}$ 3) Найдите наименьшее общее кратное двух числовых значений валентности 2 2 6 4) Определите индексы (т.е. число атомов элемента в молекуле), разделив наименьшее общее кратное на числовые валентности каждого элемента $Na_{2}S$ $CaS$ $Al_{2}S_{3}$ 4. Определите валентность элемента по формуле его соединения.
$Na_{3}N$ CO $CO_{2}$ $P_{2}O_{3}$ $P_{2}O_{5}$
1) Укажите над символом элемента значение валентности, которая постоянна
2) Определите общее число валентностей у этого элемента
3) Полученное число разделите на индекс второго элемента − определите валентность второго элементаОтвет:
$Na_{3}N$ CO $CO_{2}$ $P_{2}O_{3}$ $P_{2}O_{5}$ 1) Укажите над символом элемента с постоянной валентностью ее значение $\overset{I}{Na}$ $\overset{II}{O}$ $\overset{II}{O}$ $\overset{II}{O}$ $\overset{II}{O}$ 2) Определите общее число валентностей у этого элемента 3 2 4 6 10 3) Полученное число разделите на индекс второго элемента, чтобы определить его валентность $\overset{III}{N}$ $\overset{II}{C}$ $\overset{IV}{C}$ $\overset{III}{P}$ $\overset{V}{P}$ 5. Запишите названия бинарных соединений.
1) $FeCl_{3}$ − _
2) $Al_{2}S_{3}$ − _
3) $PbO_{2}$ − _
4) $Cl_{2}O_{7}$ − _Ответ:
Бинарные соединения:
1) $FeCl_{3}$ − хлорид железа (III)
2) $Al_{2}S_{3}$ − сульфид алюминия
3) $PbO_{2}$ − оксид свинца (IV)
4) $Cl_{2}O_{7}$ − оксид хлора (VII)Часть II
1. Формулы бинарных соединений металлов с двухвалентной серой − _ _ _ _ _ _ _ _ (общее название):
1) натрия − _
2) магния − _
3) свинца (IV) − _
4) алюминия − _Ответ:
Формулы бинарных соединений металлов с двухвалентной серой − сульфиды (общее название):
1) натрия − $Na_{2}S$
2) магния − $MgS$
3) свинца (IV) − $PbS$
4) алюминия − $Al_{2}S_{3}$2. Названия бинарных соединений:
1) $Al_{4}C_{3}$ − _
2) $FeCl_{2}$ − _
3) $Cu_{2}O$ − _
4) $N_{2}O_{5}$ − _Ответ:
Названия бинарных соединений:
1) $Al_{4}C_{3}$ − карбид алюминия
2) $FeCl_{2}$ − хлорид железа (II)
3) $Cu_{2}O$ − оксид меди (I)
4) $N_{2}O_{5}$ − оксид азота (V)3. Массовая доля серы
1) в оксиде серы (IV) − _
2) в оксиде серы (VI) − _Ответ:
Массовая доля серы
1) в оксиде серы (IV) − 50%
2) в оксиде серы (VI) − 40%
Вычисления:
1) в оксиде серы (IV) − $SO_{2}$
ω = $\frac{32}{32\;+\;16\;* \;2}$ * 100% = 50%
2) в оксиде серы (VI) − $SO_{3}$
ω = $\frac{32}{32\;+\;16\;*\;3}$ * 100% = 40%4. Установите соотвествие между названием бинарного соединения и его формулой.
Соединение Формула
1) хлорид углерода (IV) а) $CO_{2}$
2) сульфид углерода (IV) б) $CS_{2}$
3) оксид углерода (II) в) $CCl_{4}$
4) оксид улерода (IV) г) CO
Ответ:1 2 3 4
Ответ:
1 2 3 4
в б г а5. Расположите ряд соединений в порядке возрастания массовых долей металлов в них:
1) $CuSO_{4}$;
2) $CaCO_{3}$;
3) $Fe_{2}(SO_{4})_{3}$;
4) $Na_{2}CO_{3}$.
Ответ: _Ответ:
1) $CuSO_{4}$
ω (Cu) = $\frac{64}{64\;+\;32\;+\;16\;* \;4}$ * 100% = 40%
2) $CaCO_{3}$
ω (Ca) = $\frac{40}{40\;+\;12\;+\;16\;* \;3}$ * 100% = 40%
3) $Fe_{2}(SO_{4})_ {3}$
ω (Fe)= $\frac{56\;* \;2}{56\;*\;2\;+\;32\;*\;3\;+\;16\;*\;4\;*\;3}$ * 100% = 28%
4) $Na_{2}CO_{3}$.
ω (Na) = $\frac{23\;* \;2}{23\;*\;2\;+\;12\;+\;16\;*\;3}$ * 100% = 43,4%
Ответ:
1 − 3) сульфат железа (III) − $Fe_{2}(SO_{4})_ {3}$
2 − 1) сульфат меди − $CuSO_{4}$
3 − 2) карбонат кальция − $CaCO_{3}$
4 − 4) карбонат натрия − $Na_{2}CO_{3}$6. Установите соответствие между названиями бинарных соединений и валентностями образующих их элементов.
Соединение Валентность
1) хлорид алюминия а) II и III
2) оксид калия б) III и I
3) сульфид алюминия в) III и II
4) фосфид кальция г) I и II
Ответ:1 2 3 4
Ответ:
1 2 3 4
б г в а §21
-
§21. Оксиды
Часть I
1. Признаки оксидов:
1) тип вещества − _ _ _ _ _ _ _ ;
2) тип соединения − _ _ _ _ _ _ _ _ ;
3) число элементов, образующих оксиды, _ ;
4) обязательный элемент − _ _ _ _ _ _ _ _ .Ответ:
Признаки оксидов:
1) тип вещества − сложное;
2) тип соединения − бинарное;
3) число элементов, образующих оксиды, 2 ;
4) обязательный элемент − кислород.2. Оксиды − это
Ответ:
Оксиды − это сложные вещества, состоящие из двух химических элементов, один из которых — кислород.
3. Общий способ образования названий оксидов:
оксид + название элемента в родительном падеже + римской цифрой валентность, если она переменная.Ответ:
Общий способ образования названий оксидов:
оксид + название элемента в родительном падеже + римской цифрой валентность, если она переменная.
$Na_{2}O$ − оксид натрия
$CO_{2}$ − оксид углерода (IV)4. Названия оксидов азота:
1) NO
2) $N_{2}O$
3) $NO_{2}$
4) $_{2}O_{3}$
5) $N_{2}O_{5}$Ответ:
Названия оксидов азота:
1) NO − оксид азота (II)
2) $N_{2}O$ − оксид азота (I)
3) $NO_{2}$ − оксид азота (IV)
4) $N_{2}O_{3}$ − оксид азота (III)
5) $N_{2}O_{5}$ − оксид азота (V)5. Формулы оксидов:
1) хлора (IV)
2) хлора (I)
3) хлора (VI)
4) хлора (VII)Ответ:
Формулы оксидов:
1) хлора (IV) − $ClO_{2}$
2) хлора (I) − $Cl_{2}O$
3) хлора (VI) − $ClO_{3}$
4) хлора (VII) − $Cl_{2}O_{7}$Часть II
1. Установите соответствие между формулами оксидов марганца и значением валентности марганца в них.
Оксиды Валентность марганца
1) $Mn_{2}O_{7}$ а) II
2) $MnO_{2}$ б) III
3) MnO в) IV
4) $Mn_{2}O_{3}$ г) VII
Ответ:1 2 3 4
Ответ:
1 2 3 4
г в а б2. Расположите оксиды хлора в порядке возрастания его массовой доли:
1) оксид хлора (V)
2) оксид хлора (I)
3) оксид хлора (VII)
4) оксид хлора (III)
Ответ: _Ответ:
1) оксид хлора (V)
ω (Cl) = $\frac{35,5\;* \;2}{151}$ * 100% = 47%
2) оксид хлора (I)
ω (Cl) = $\frac{35,5\;* \;2}{87}$ * 100% = 81,6%
3) оксид хлора (VII)
ω (Cl) = $\frac{35,5\;* \;2}{183}$ * 100% = 38,8%
4) оксид хлора (III)
ω (Cl) = $\frac{35,5\;* \;2}{119}$ * 100% = 59,7%
Ответ:
1 − 3) оксид хлора (VII)
2 − 1) оксид хлора (V)
3 − 4) оксид хлора (III)
4 − 2) оксид хлора (I)3. Массовая доля железа
1) в оксиде железа (III)
2) в оксиде железа (II)Ответ:
Массовая доля железа
1) в оксиде железа (III) − 70%
2) в оксиде железа (II) − 77,8%
Вычисления:
1) в оксиде железа (III) − $Fe_{2}O_{3}$:
ω = $\frac{56\;* \;2}{160}$ * 100% = 70%
2) в оксиде железа (II) − FeO:
ω = $\frac{56}{72}$ * 100% = 77,8%4. Установите соответствие между тривиальным названием оксида и его формулой и приведите систематическое название оксидов.
Название Формула
1) Углекислый газ а) $CO_{2}$
2) Сернистый газ б) $SO_{3}$
3) Угарный газ в) CO
4) Серный ангидрид г) $SO_{2}$
Ответ:1 2 3 4
Ответ:
1 2 3 4
а г в б
$CO_{2}$ − оксид углерода (IV)
$SO_{3}$ − оксид серы (VI)
$CO$ − оксид углерода (II)
$SO_{2}$ − оксид серы (IV)5. Напишите синквейн или эссе о парниковом эффекте.
Ответ:
Синквейн о парниковом эффекте:
1) Эффект.
2) Парниковый, губительный.
3) Существует, угрожает, возрастает.
4) Парниковый эффект губительно сказывается на растительном и животном мире.
5) Парник. §22
-
§22. Представители оксидов
Часть I
1. Дайте характеристику воды:
1) формула _
2) $M_{r}$ ($H_{2}O$) = _
3) ω (H) = _
4) ω (O) = _Ответ:
Характеристика воды:
1) формула − $H_{2}O$
2) $M_{r}$ ($H_{2}O$) = 1 * 2 + 16 = 18
3) ω (H) = $\frac{1\;*\;2}{18}$ * 100% = 11,2%
4) ω (O) = $\frac{16}{18}$ = 88,8%2. Водная оболочка Земли − _ _ _ _ _ _ _ _ _ _ включает
а) _ _ _ _ _ _ _ воду;
б) _ _ _ _ _ _ _ _ _ воду;
в) _ _ _ _ _ _ _ _ _ _ воду;
г) _ _ _ _ _ _ _ воду;
д) _ _ _ _ _ _ _ _ _ _ _ _ _ воду;
е) _ _ _ _ _ _ _ _ _ _ _ _ _ _ воду.Ответ:
Водная оболочка Земли − гидросфера включает
а) морскую воду;
б) подземную воду;
в) ледниковую воду;
г) пресную воду;
д) атмосферную воду;
е) биологическую воду.3. Дайте характеристику углекислого газа:
1) формула _
2) $M_{r}$ ($CO_{2}$) = _
3) ω (C) = _
4) ω (O) = _Ответ:
Характеристика углекислого газа:
1) формула − $CO_{2}$
2) $M_{r}$ ($CO_{2}$) = 12 + 16 * 2 = 44
3) ω (C) = $\frac{12}{44}$ * 100% = 27,3%
4) ω (O) = $\frac{16\;* \; 2}{44}$ * 100% = 72,7%4. Сухой лед − это _
Ответ:
Сухой лед − это твердый углекислый газ.
5. Дайте характеристику оксида кремния (IV):
1) формула _
2) $M_{r}$ ($SiO_{2}$) = _
3) ω (Si) = _
4) ω (O) = _Ответ:
Характеристика оксида кремния (IV):
1) формула − $SiO_{2}$
2) $M_{r}$ ($SiO_{2}$) = 14 + 16 * 2 = 46
3) ω (Si) = $\frac{14}{46}$ * 100% = 30,4%
4) ω (O) = $\frac{16\;* \; 2}{46}$ * 100% = 69,6%Часть II
1. Заполните схему. Выпишите названия процессов.
Взаимопереходы воды
1) _
2) _
3) _
4) _
5) _
6) _Ответ:
Взаимопереходы воды
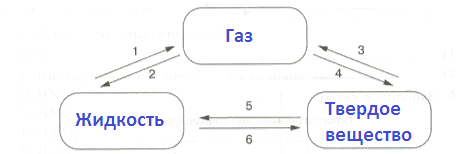
1) Испарение
2) Конденсация
3) Сублимация
4) Десублимация
5) Плавление
6) Кристаллизация2. Нарисуйте схему "Круговорот воды в природе".
Ответ:
Круговорот воды в природе
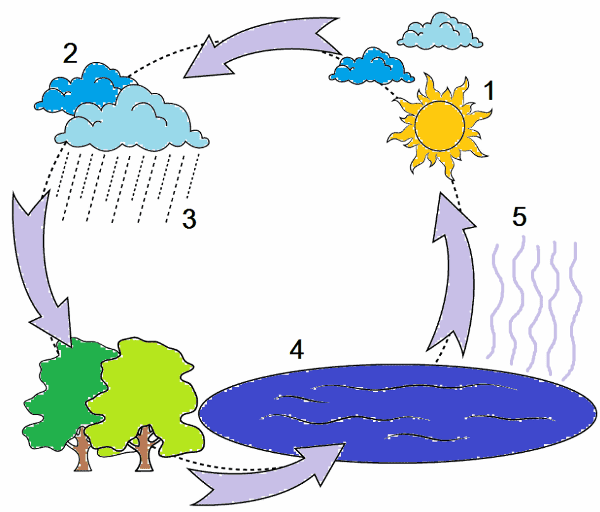
3. Напишите эссе о значении воды в природе и жизни человека.
Ответ:
© 70 % поверхности земного шара покрыто водой. В ней обитают организмы, для которых невозможна жизнь на суше. Но и для всех живых организмов на суше вода так же необходима. В растениях содержится до 98 % воды, вода присутствует во всех тканях животных, в том числе человека, как внутри клеток (более 40% от живой массы животного), так и снаружи – в межклеточной жидкости (её там приблизительно 20–22% от общего веса животного). Вода есть в составе всех органов и тканей, где её доля составляет около 70–80% от веса любого органа. Даже в костной, казалось бы, совсем не жидкой ткани, её присутствует не менее 10%.
Вода является основным веществом, на котором построены все физиологические процессы в организме животных (и людей тоже). Она участвует в пищеварении (все пищеварительные жидкости содержат воду в разных концентрациях), дыхании (легкие должны быть влажными для осуществления газообмена), смазывает суставы в составе синовиальной жидкости, обеспечивает распределение тепла и всех веществ по организму, является средой для всех биохимических реакций в тканях. Вода – универсальный растворитель, с которым поступают извне и выводятся из организма все вещества. Испарение воды с поверхности кожи утилизирует избыточное тепло. Также она выполняет многие другие жизненно важные для организма животного функции.
Без воды невозможно существование жизни на Земле.4. Заполните схему с использованием тривиальных названий.
Взаимопереходы углекислого газа
1) _
2) _Ответ:
Взаимопереходы углекислого газа
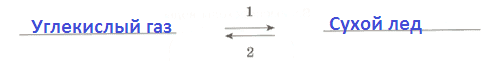
1) Десублимация
2) Сублимация5. Заполните схему.
Области применения углекислого газаОтвет:
Области применения углекислого газа
6. Минералы на основе оксида кремния:
1) _
2) _
3) _
4) _
5) _
6) _Ответ:
Минералы на основе оксида кремния:
1) Хрусталь
2) Кварц
3) Цитрин
4) Кошачий глаз
5) Аметист
6) Яшма7. Напишите синквейн о применении оксида кремния (IV).
Ответ:
Синквейн о применении оксида кремния (IV):
1) Оксид.
2) Стекольные, силикатный.
3) Применяется, изготавливатеся, получается.
4) Оксид кремния применется в стекольной промышленности.
5) Бинарное соединение. §23
-
§23. Кислоты
Часть I
1. Кислоты − это _
Ответ:
Кислоты − это сложные вещества, состоящие из атомов водорода и кислотного остатка.
2. Бескислородные кислоты:
HCl − _Ответ:
Бескислородные кислоты:
HCl − хлороводородная кислота
HBr − бромоводородная кислота
HI − йодоводородная кислота
HF − фтороводородная кислота
$H_{2}S$ − сероводородная кислота3. Кислородные кислоты по основности
1) $HNO_{2}$ − _
2) $HNO_{3}$ − _
3) $H_{2}SO_{4}$ − _
4) $H_{2}SO_{3}$ − _
5) $H_{2}CO_{3}$ − _
6) $H_{2}SiO_{3}$ − _
7) $H_{3}PO_{4}$ − _Ответ:
Кислородные кислоты по основности
1) $HNO_{2}$ − азотистая, одноосновная
2) $HNO_{3}$ − азотная, одноосновная
3) $H_{2}SO_{4}$ − серная, двуосновная
4) $H_{2}SO_{3}$ − сернистая, двуосновная
5) $H_{2}CO_{3}$ − угольная, двуосновная
6) $H_{2}SiO_{3}$ − кремниевая, двуосновная
7) $H_{3}PO_{4}$ − фосфорная, трехосновная4. Индикаторы − это _
Ответ:
Индикаторы − это вещества, дающие характерные (обычно цветные) химические реакции и употребляющиеся при анализе.
5. Заполните таблицу.
Среда \ Индикатор Лакмус Метилоранж
Нейтральная
КислаяОтвет:
Среда \ Индикатор Лакмус Метилоранж Нейтральная фиолетовый оранжевый Кислая красный красный 6. Приведите примеры органических кислот:
1) _
2) _
3) _
4) _
5) _Ответ:
Примеры органических кислот:
1) Лимонная кислота;
2) Яблочная кислота;
3) Щавелевая кислота;
4) Муравьиная кислота;
5) Молочная кислота.7. Зачеркните рисунок, на котором показано неверное разбавление серной кислоты водой.
Ответ:
Часть II
1. Дайте характеристику серной кислоты:
1) формула _
2) $M_{r}$ ( _ ) = _
3) ω (S) = _
ω (H) = _
ω (O) = _Ответ:
Дайте характеристику серной кислоты:
1) формула − $H_{2}SO_{4}$
2) $M_{r}$ ($H_{2}SO_{4}$) = 98
3) ω (S) = $\frac{32}{98}$ * 100% = 32,65%
ω (H) = $\frac{1\;*\;2}{98}$ * 100% = 2%
ω (O) = $\frac{16\;*\;4}{98}$ * 100% = 65,35%2. Заполните схему.
Применение серной кислотыОтвет:
Применение серной кислоты
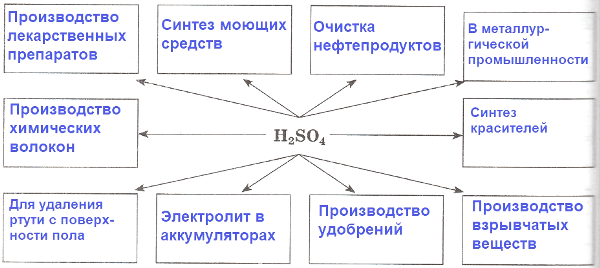
3. Дайте характеристику соляной кислоты:
1) формула _
2) $M_{r}$ ( _ ) = _
3)
ω (Cl) = _
ω (H) = _Ответ:
Дайте характеристику соляной кислоты:
1) формула − $HCl$
2) $M_{r}$ (HCl) = 36,5
3)
ω (Cl) = $\frac{35,5}{36,5}$ * 100% = 97%
ω (H) = $\frac{1}{36,5}$ * 100% = 3%4. Заполните схему.
Значение и применение соляной кислотыОтвет:
Значение и применение соляной кислоты
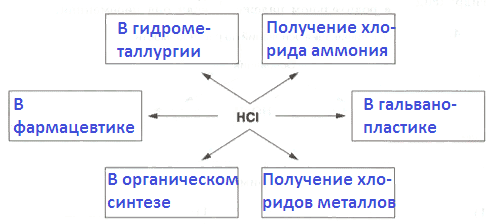
5. Классификационная характеристика фосфорной кислоты:
1) формула _
2) по основности _
3) по растворимости _
4) по стабильности _
5) по летучести _Ответ:
Классификационная характеристика фосфорной кислоты:
1) формула − $H_{3}PO_{4}$
2) по основности − трехосновная
3) по растворимости − растворимая
4) по стабильности − стабильная
5) по летучести − нелетучая6. Напишите синквейн об азотной кислоте.
Ответ:
Синквейн об азотной кислоте:
1) Кислота.
2) Кислая, одноосновная, растворимая.
3) Реагирует, взаимодействует, пассивирует.
4) Кислота реагирует с основными оксидами.
5) Гидроксид. §24
-
§24. Основания
Часть I
1. Основания − это _
Ответ:
Основания − это сложные вещества, состоящие из атомов металла и гидроксогрупп.
2. Общая формула оснований:
_ ( _ ) $_{n}$
где n − _Ответ:
Общая формула оснований:
Ме (OH) $_{n}$
где n − количество гидроксогрупп.3. Общий способ образования названий оснований:
гидроксид + название металла в родительном падеже + римской цифрой валентность, если она переменнаяОтвет:
Общий способ образования названий оснований:
гидроксид + название металла в родительном падеже + римской цифрой валентность, если она переменная
$Ba(OH)_{2}$ − гидроксид бария
$Fe(OH)_{3}$ − гидроксид железа (III)4. Классификация оснований по растворимости
Ответ:
Классификация оснований по растворимости
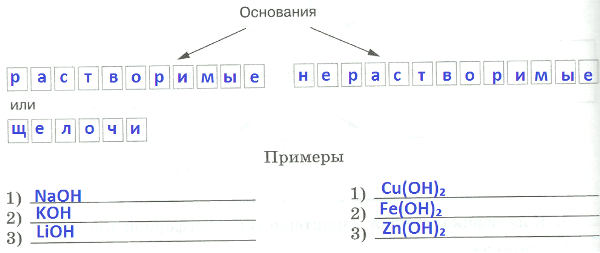
5. Изменение окраски индикаторов в щелочной среде:
1) фиолетовый лакмус − _
2) оранжевый метилоранж − _
3) бесцветный фенолфталеин − _Ответ:
Изменение окраски индикаторов в щелочной среде:
1) фиолетовый лакмус − синий
2) оранжевый метилоранж − желтый
3) бесцветный фенолфталеин − малиновый6. Синоним элементов IA−группы: _ _ _ _ _ _ _ _ металлы.
Ответ:
Синоним элементов IA−группы: щелочные металлы.
7. Общее название элементов IIА−группы (начиная с Ca): _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ металлы.
Ответ:
Общее название элементов IIА−группы (начиная с Ca): щелочноземельные металлы.
8. Качественная реакция на известковую воду:
1) реактив _
2) аналитический эффект _Ответ:
Качественная реакция на известковую воду:
1) реактив − $CO_{2}$
2) аналитический эффект − образование осадка − раствор мутнеет.Часть II
1. Гидроксид натрия − синоним _ _ _ _ _ _ _ _ _ .
Дайте характеристику гидроксида натрия:
1) формула _
2) $M_{r}$ ( _ ) = _
3) ω (Na) = _
ω (H) = _
ω (O) = _Ответ:
Гидроксид натрия − синоним едкий натр.
Характеристика гидроксида натрия:
1) формула − NaOH
2) $M_{r}$ (NaOH) = 40
3) ω (Na) = $\frac{23}{40}$ * 100% = 57,5%
ω (H) = $\frac{1}{40}$ * 100% = 2,5%
ω (O) = $\frac{16}{40}$ * 100% = 40%2. Заполните схему.
Ответ:
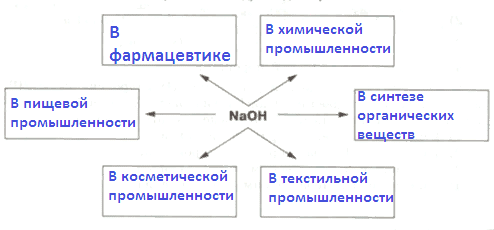
3. Гидроксид калия − синоним _ _ _ _ _ _ _ _ _ .
Дайте характеристику гидроксида калия:
1) формула _
2) $M_{r}$ ( _ ) = _
3) ω (K) = _
ω (H) = _
ω (O) = _Ответ:
Гидроксид калия − синоним едкое кали.
Характеристика гидроксида калия:
1) формула − KOH
2) $M_{r}$ (KOH) = 56
3) ω (K) = $\frac{39}{56}$ * 100% = 69,6%
ω (H) = $\frac{1}{56}$ * 100% = 1,8%
ω (O) = $\frac{16}{56}$ * 100% = 28,6%4. Оформите схему.
Ответ:
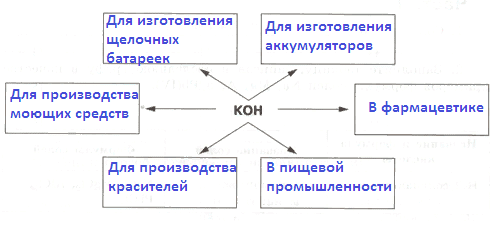
5. Гидроксид кальция − синонимы:
1) _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ (водный раствор);
2) _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ (взвесь);
3) _ _ _ _ _ _ _ _ _ _ _ _ _ _ (хлопья);
4) _ _ _ _ _ _ _ (сухой порошок).Ответ:
Гидроксид кальция − синонимы:
1) известковая вода (водный раствор);
2) известковое молоко (взвесь);
3) гашеная известь (хлопья);
4) пушонка (сухой порошок).6. В списке гидроксидов: гидроксид меди (I), гидроксид железа (II), гидроксид бария, гидроксид меди (II), гидроксид железа (III), гидроксид лития, гидроксид цезия − приведено соответственно:
1) 4 щелочи и 3 нерастворимых гидроксида;
2) 3 щелочи и 4 нерастворимых гидроксида;
3) 2 щелочи и 5 нерастворимых гидроксида;
4) 5 щелочей и 2 нерастворимых гидроксида.
Ответ: _Ответ:
В списке гидроксидов: гидроксид меди (I), гидроксид железа (II), гидроксид бария, гидроксид меди (II), гидроксид железа (III), гидроксид лития, гидроксид цезия − приведено соответственно:
1) 4 щелочи и 3 нерастворимых гидроксида;
2) 3 щелочи и 4 нерастворимых гидроксида;
3) 2 щелочи и 5 нерастворимых гидроксида;
4) 5 щелочей и 2 нерастворимых гидроксида.
Ответ: 2).7. И с помощью индикатора, и с помощью углекислого газа можно распознать раствор
1) соляной кислоты;
2) гидроксида кальция;
3) гидроксида бария;
4) азотной кислоты.
Ответ: _Ответ:
И с помощью индикатора, и с помощью углекислого газа можно распознать раствор
1) соляной кислоты;
2) гидроксида кальция;
3) гидроксида бария;
4) азотной кислоты.
Ответ: 2). §25
-
§25. Соли
Часть I
1. Соли − это _
Ответ:
Соли − это сложные вещества, состоящие из ионов металла и кислотных остатков.
2. Заполните таблицу, записав в последнюю графу в качестве примеров формулы солей Na, Mg, Al иPb (IV).
СолиНазвание и формула кислоты Название солей Формула солей
HCl соляная кислота хлориды $NaCl, MgCl_{2}, AlCl_{3}, PbCl_{4}$
$H_{2}S$
$H_{2}SO_{3}$
$H_{2}SO_{4}$
$HNO_{2}$
$HNO_{3}$
$H_{3}PO_{4}$
$H_{2}CO_{3}$
$H_{2}SiO_{3}$Ответ:
Соли
Название и формула кислоты Название солей Формула солей HCl соляная кислота хлориды $NaCl, MgCl_{2}, AlCl_{3}, PbCl_{4}$ $H_{2}S$ сероводородная кислота сульфиды $Na_{2}S, K_{2}S, MgS$ $H_{2}SO_{3}$ сернистая кислота сульфит $K_{2}SO_{3}, Na_{2}SO_{3}, MgSO_{3}$ $H_{2}SO_{4}$ серная кислота сульфат $K_{2}SO_{4}, Na_{2}SO_{4}, MgSO_{4}$ $HNO_{2}$ азотистая кислота нитрит $KNO_{2}, NaNO_{2}, Mg(NO_{2})_{2}$ $HNO_{3}$ азотная кислота нитрат $KNO_{3}, NaNO_{3}, Mg(NO_{3})_{2}$ $H_{3}PO_{4}$ фосфорная кислота фосфат $Li_{3}PO_{4}, Na_{3}PO_{4}, Ba_{3}(PO_{4})_{2}$ $H_{2}CO_{3}$ угольная кислота карбонат $Na_{2}CO_{3}, K_{2}CO_{3}, BaCO_{3}$ $H_{2}SiO_{3}$ кремниевая кислота силикат $Na_{2}SiO_{3}, K_{2}SiO_{3}$ 3. Оформите схему, используя таблицу растворимости.
Ответ:

4. Общий способ образования названий солей:
название кислотного остатка + название металла в родительном падеже + римской цифрой валентность, если она переменная.Ответ:
Общий способ образования названий солей:
название кислотного остатка + название металла в родительном падеже + римской цифрой валентность, если она переменная.
$Na_{2}SO_{4}$ − сульфат натрия
$Fe(NO_{3})_{3}$ − нитрат желез (III)5. Для формул солей установите соответствующие формулы кислот и оснований, вписав их в прямоугольник.
Ответ:
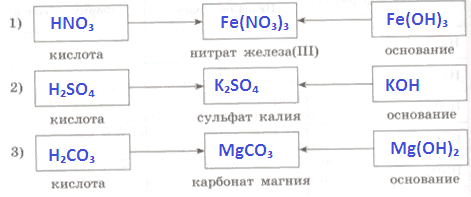
Часть II
1. NaCl − названия:
1) _
2) _
3) _Ответ:
NaCl − названия:
1) Хлорид натрия
2) Хлористый натрий
3) Поваренная соль2. Установите соответствие для формул кислоты, основания и оксида металла:
Ответ:
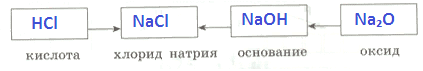
3. Оформите схему.
Области использования хлорида натрияОтвет:
Области использования хлорида натрия
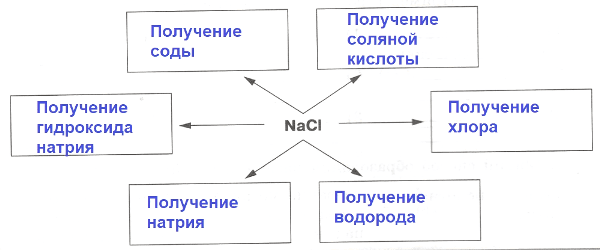
4. Заполните таблицу.
Хлорид натрия в природеМестонахождение в природе Форма (в каком виде находится) Месторождения
Ответ:
Местонахождение в природе Форма (в каком виде находится) Месторождения В пластовых водах Твердое вещество Соль−Илецкое В залежах Твердое вещество Солекамск 5. Дайте характеристику карбоната кальция $CaCO_{3}$:
1) синонимы:
а) _
б) _
2) $M_{r}$ ( _ ) =
3) ω (Ca) = _
ω (C) = _
ω (O) = _Ответ:
Дайте характеристику карбоната кальция $CaCO_{3}$:
1) синонимы:
а) арагонит
б) мел
2) $M_{r}$ ($CaCO_{3}$) = 100
3) ω (Ca) = $\frac{40}{100}$ * 100% = 40%
ω (C) = $\frac{12}{100}$ * 100% = 12%
ω (O) = $\frac{16\;*\;3}{100}$ * 100% = 48%6. Заполните схему.
Карбонат кальция в природеОтвет:
Карбонат кальция в природе
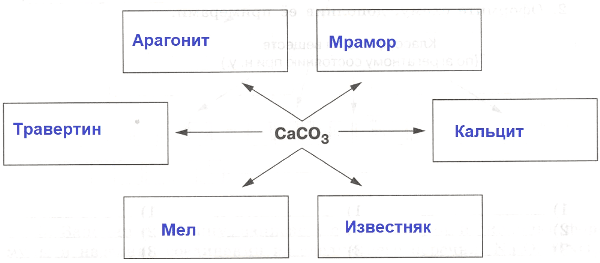
7. Напишите синквейн о мраморе.
Ответ:
Синквейн о мраморе:
1) Мрамор.
2) Цветной, белый.
3) Добывается, не царапает.
4) Мрамор − это горная порода.
5) Мрамор является натуральной горной породой. §26
-
§26. Классификация неорганических веществ
Часть I
1. Оформите схему, проиллюстрировав ее применение.
Ответ:
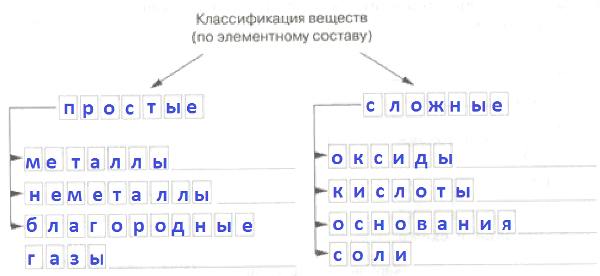
Металлы применяют в автомобильной промышленности ($Al$).
Неметаллы применяют в производстве полупроводников ($Si$).
Благородные газы применяют в медицине ($Ar$).
Оксиды применяют для изготовления краски ($ZnO$).
Кислоты применяют для производства удобрений ($HNO_{3}$).
Основания применяют при изготовлении строительных растворов ($Ca(OH)_{2}$).
Соли употребляют в пищу ($NaCl$).2. Оформите схему, дополнив ее примерами.
Ответ:
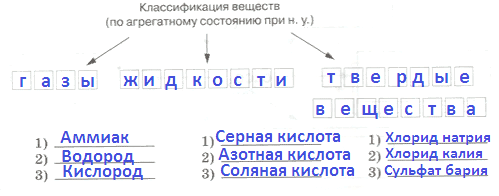
3. Оформите схему, дополнив ее примерами.
Ответ:
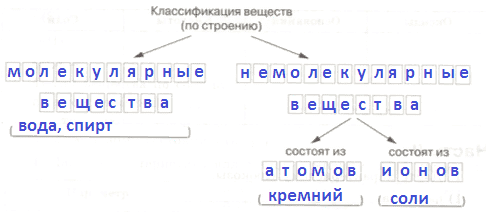
4. Оформите схему, дополнив ее примерами.
Ответ:
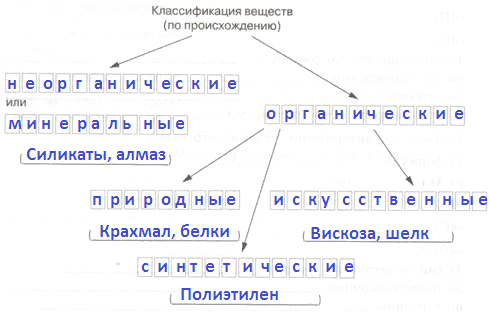
5. Заполните таблицу, записав в соответствующие колонки формулы и названия соединений из следующего перечня: $Na_{2}O, HNO_{2}, CaCl_{2}, KOH, Fe(OH)_{3}, H_{3}PO_{4}, Ca_{3}(PO_{4})_{2}, P_{2}O_{5}, SiO_{2}, H_{2}SO_{4}, Al_{2}(SO_{4})_{3}, KOH$
Оксиды Основания Кислоты Соли
Ответ:
Оксиды Основания Кислоты Соли $Na_{2}O, P_{2}O_{5}, SiO_{2}$ $KOH, Fe(OH)_{3}$ $HNO_{2}, H_{3}PO_{4}, H_{2}SO_{4}$ $CaCl_{2}, Ca_{3}(PO_{4})_{2}, Al_{2}(SO_{4})_{3}$ Часть II
1. Дайте характеристику глюкозы:
1) формула − _
2) $M_{r}$ ( _ ) = _
3) ω (C) = _
ω (H) = _
ω (O) = _
4) тип вещества по составу _
по происхождению _
по строению _
по агрегатному состоянию (н.у.) _Ответ:
Характеристика глюкозы:
1) формула − $C_{6}H_{12}O_{6}$
2) $M_{r}$ ($C_{6}H_{12}O_{6}$) = 180
3) ω (C) = $\frac{12\;*\;6}{180}$ * 100% = 20%
ω (H) = $\frac{12}{180}$ * 100% = 6,67%
ω (O) = $\frac{16\;*\;6}{180}$ * 100% = 53,33%
4) тип вещества по составу − сложное
по происхождению − природное
по строению − молекулярное
по агрегатному состоянию (н.у.) − твердое2. Дайте характеристику углекислого газа:
1) формула − _
2) $M_{r}$ ( _ ) = _
3) ω (C) = _
ω (O) = _
4) тип вещества по составу _
по происхождению _
по строению _
по агрегатному состоянию (н.у.) _Ответ:
Характеристика углекислого газа:
1) формула − $CO_{2}$
2) $M_{r}$ ($CO_{2}$) = 44
3) ω (C) = $\frac{12}{44}$ * 100% = 27,27%
ω (O) = $\frac{16 * 2}{44}$ * 100% = 72,73%
4) тип вещества по составу − сложное
по происхождению − природное
по строению − молекулярное
по агрегатному состоянию (н.у.) − газ3. Дайте характеристику серной кислоты:
1) формула − _
2) $M_{r}$ ( _ ) = _
3) ω (S) = _
ω (H) = _
ω (O) = _
4) тип вещества по составу _
по происхождению _
по строению _
по агрегатному состоянию (н.у.) _Ответ:
Характеристика серной кислоты:
1) формула − $H_{2}SO_{4}$
2) $M_{r}$ ($H_{2}SO_{4}$) = 98
3) ω (S) = $\frac{32}{98}$ * 100% = 32,65%
ω (H) = $\frac{1\;*\;2}{98}$ * 100% = 2%
ω (O) = $\frac{16\;*\;4}{98}$ * 100% = 65,35%
4) тип вещества по составу − сложное
по происхождению − природное
по строению − молекулярное
по агрегатному состоянию (н.у.) − жидкость4. Дайте характеристику аллотропных модификаций кислорода.
Параметр
Формула
$M_{r}$
Тип вещества по составу
Тип вещества по происхождению
Тип вещества по строению
Тип вещества по агрегатному состоянию (н.у.)Ответ:
Характеристика аллотропных модификаций кислорода:
Параметр Кислород Озон Формула $O_{2}$ $O_{3}$ $M_{r}$ 32 48 Тип вещества по составу Простое Простое Тип вещества по происхождению Природное Природное Тип вещества по строению Молекулярное Молекулярное Тип вещества по агрегатному состоянию (н.у.) Газ Газ 5. Напишите эссе "Многообразие мира веществ".
Ответ:
Многообразие мира веществ ©
В мире существует множество веществ. Их можно поделить на простые, состоящие из атомов одного элемента (кислород, азот, железо), и сложные, из двух и нескольких элементов (углекислый газ СО2, соляная кислота HCl), органические (метан) и неорганические (хлорид натрия NaCl - поваренная соль). Вещества могут находиться в разных агрегатных состояниях - твердом, жидком и газообразном. Некоторые вещества, например, вода, может иметь разное агрегатное состояние в зависимости от внешних условий (пар, жидкость, лед) Вещества могут быть природными (нефть, NaCl) или синтетическими, созданными человеком, например, пластмассы.
Превращением веществ друг в друга занимается наука химия.


