 Весьма неординарный школьный предмет относящийся к естественным наукам, где постижение окружающего мира идет через эксперимент, это Химия. В этой статье мы расскажем о ГДЗ к учебнику химии за 9 класс, авторов Габриелян, Остроумов, Сладков. Как нам кажется предмет здесь преподносится прям поверхностно, а спрашивают так словно вы должны все осваивать самостоятельно, при этом у многих конечно же могут возникнуть проблемы с домашним заданием. И именно чтобы домашние задания были верные, правильные, а оценки высокими мы и создали нашу статью, в который вы сможете найти верные ответы на ваши домашние задания.
Весьма неординарный школьный предмет относящийся к естественным наукам, где постижение окружающего мира идет через эксперимент, это Химия. В этой статье мы расскажем о ГДЗ к учебнику химии за 9 класс, авторов Габриелян, Остроумов, Сладков. Как нам кажется предмет здесь преподносится прям поверхностно, а спрашивают так словно вы должны все осваивать самостоятельно, при этом у многих конечно же могут возникнуть проблемы с домашним заданием. И именно чтобы домашние задания были верные, правильные, а оценки высокими мы и создали нашу статью, в который вы сможете найти верные ответы на ваши домашние задания.
ГДЗ разбиты на параграфы точно так же, как и учебник, так что найти ответы не составит труда. Главное - все правильно списать и желательно запомнить.
Ответы к учебнику химии за 9 класс Габриелян, Остроумов:
Кликайте по вкладкам с параграфами, чтобы открыть нужную страницу с ответами.
§1
-
ГДЗ Химия 9 класс Габриелян, Остроумов, Сладков
ГЛАВА I. Обобщение знаний по курсу 8 класса. Химические реакции
§1. Классификация химических соединенийВопрос в начале параграфа✓
В настоящее время известно 118 химических элементов. Эти элементы образуют более 400 простых веществ и более сотни миллионов сложных. Как разобраться в этом огромном многообразии химических веществ, как разделить их на группы, т.е. классифицировать?
Ответ:
Простые вещества делят на металлы и неметаллы.
Сложные вещества подразделяют на три класса: бинарные соединения, гидроксиды и соли.Проверьте свои знания
1. Какие соединения называют бинарными? Какие бинарные соединения называют оксидами? На какие группы подразделяют оксиды? Приведите примеры оксидов каждой группы.
Ответ:
Название группы бинарных соединений указывает на то, что они образованы атомами двух химических элементов. Это могут быть атомы элемента−металла и элемента−неметалла, например: NaH − гидрид натрия, $Mg_{3}P_{2}$ − фосфид магния, $Al_{4}C_{3}$ − карбид алюминия.
Оксиды − это бинарные соединения, один из элементов − кислород.
Солеобразующими оксидами называют оксиды, которые взаимодействуют с кислотами или щелочами с образованием соли и воды.
Примеры: $Na_{2}O, SO_{3}, ZnO$.
Несолеобразующими оксидами называют оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей.
Примеры: $CO, N_{2}O, NO$.2. Какие гидроксиды называют основаниями? Приведите примеры оснований каждой группы.
Ответ:
К основаниям относят гидроксиды металлов IA−группы (щелочных металлов) и IIA−группы (кроме бериллия), а также некоторых других металлов в низших степенях окисления. Примеры оснований − гидроксид натрия NaOH, гидроксид кальция $Ca(OH)_{2}$, гидроксид железа(II) $Fe(OH)_{2}$.
3. На какие группы подразделяют кислоты? Приведите примеры кислот каждой группы.
Ответ:
К гидроксидам относят кислородсодержащие кислоты, которые образуются неметаллами и металлами в высших степенях окисления (+5, +6, +7). Их формулы на первый взгляд не похожи на формулы гидроксидов: $H_{3}BO_{3}, H_{2}CO_{3}, H_{2}CrO_{4}$.
Также выделяют бескислородные кислоты, например: $H_{2}S, HCl, HBr$.4. Какие соединения называют солями? На какие группы разделяют соли? Приведите примеры солей каждой группы.
Ответ:
Соли − это сложные вещества, состоящие из катиона металла и кислотного остатка.
Классификация солей: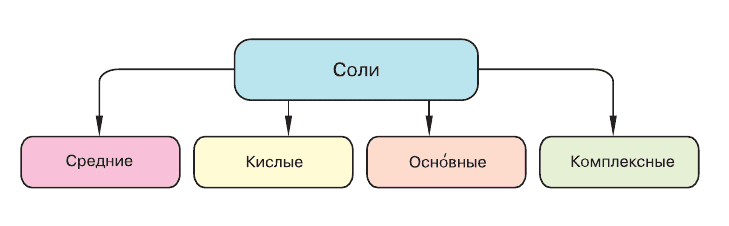
Средние соли: $K_{2}SO_{4}, KCl, Na_{2}SO_{3}$.
Кислые соли: $KHCO_{3}, NaHSO_{4}$.
Основные соли: $MgOHCl, (CuOH)_{2}CO_{3}$.
Комплексные соли: $Na[Al(OH)_{4}], K_{4}[Fe(CN)_{6}], [Ag(NH_{3})_{2}]Cl$.5. Как зависит характер оксидов и гидроксидов химического элемента от значения степени окисления? Приведите примеры.
Ответ:
К основаниям относят гидроксиды металлов IA−группы (щелочных металлов) и IIA−группы (кроме бериллия), а также некоторых других металлов в низших степенях окисления. Примеры оснований — гидроксид натрия NaOH (с.о. = +1), гидроксид кальция $Ca(OH)_{2}$ (с.о. = +2), гидроксид железа(II) $Fe(OH)_{2}$ (с.о. = +3).
Амфотерные гидроксиды характерны для гидроксидов металлов, как правило, в степенях окисления +2, +3, +4. Примеры амфотерных соединений — гидроксид бериллия $Be(OH)_{2}$, гидроксид железа(III) $Fe(OH)_{3}$, гидроксид олова(IV) $Sn(OH)_{4}$.
По своему характеру оксиды подразделяют на основные (c.о. = +1, +2), амфотерные (+2, +3, +4) и кислотные (от +5)Примените свои знания
6. Составьте в электронном виде обобщённую схему классификации веществ по составу, объединив схемы 2—4. Распечатайте полученную схему. Используйте схему для определения принадлежности веществ к тому или иному классу.
Ответ:
Схема классификации веществ по составу:
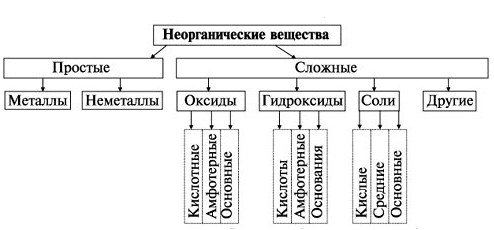
7. Распределите перечисленные ниже формулы веществ на четыре группы: $Na_{2}SO_{4}, HI, V_{2}O_{5}, KMnO_{4}, Co(OH)_{2}, H_{2}CrO_{4}, NiO, CsOH, (NH_{4})_{2}Cr_{2}O_{7}, Ca(OH)_{2}, Cl_{2}O, HCN$. Дайте названия всем веществам.
Ответ:
1 группа − Соли:
$Na_{2}SO_{4}$ − сульфат натрия
$KMnO_{4}$ − перманганат калия
$(NH_{4})_{2}Cr_{2}O_{7}$ − дихромат аммония
2 группа − Бескиcлородные кислоты:
$HI$ − йодоводородная кислота
$HCN$ − синильная кислота
3 группа − Оксиды:
$V_{2}O_{5}$ − оксид ванадия (V)
$NiO$ − оксид никеля
$Cl_{2}O$ − оксид хлора (I)
4 группа − Гидроксиды:
$Co(OH)_{2}$ − гидроксид кобальта
$H_{2}CrO_{4}$ − хромовая кислота
$CsOH$ − гидроксид цезия
$Ca(OH)_{2}$ − гидроксид кальция8. Вместо слов «гидроксид» и «соль» впишите в схемы формулы соответствующих веществ:
а) оксид натрия → гидроксид → соль;
б) оксид цинка → гидроксид → соль;
в) оксид азота (V) → гидроксид → соль.
Укажите характер каждого гидроксида. Назовите соли.Ответ:
а) оксид натрия → NaOH (основный) → NaCl − хлорид натрия
б) оксид цинка → $Zn(OH)_{2}$ (амфотерный)→ $ZnCl_{2}$ − хлорид цинка
в) оксид азота (V) → $HNO_{3}$ (кислотный) → $NaNO_{3}$ − нитрат натрия9. Воспользовавшись схемой, составленной при выполнении задания 1, приведите примеры известных вам соединений каждого класса в различных агрегатных состояниях. Совместно с учителем обсудите, в каждом ли классе веществ есть представители, находящиеся при нормальных условиях в газообразном, жидком и твёрдом состояниях.
Ответ:
КЛАСС СОЕДИНЕНИЙ ГАЗ ЖИДКОСТЬ ТВЕРДОЕ ТЕЛО
Оксиды CO − угарный газ $Mn_{2}O_{7}$ − оксид марганца (VII) CaO − оксид кальция
Щелочи KOH − гидрокисд калия
Нерастворимые основания $Al(OH)_{3}$ − гидрокисд алюминия
Кислоты $HNO_{3}$ − азотная кислота
Соли NaCl − хлорид натрияИспользуйте дополнительную информацию
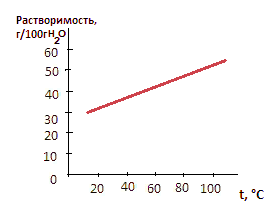
1. Растворимость веществ в воде зависит от температуры. Твёрдые вещества, как правило, при нагревании растворяются лучше, газообразные — наоборот. Данные о зависимости растворимости от температуры можно найти в справочниках. Например, для хлорида калия справочные данные таковы:
t, ℃ 10 20 30 40 50 60 70 80 90
Растворимость, г / 100 г $H_{2}O$ 31,0 34,0 37,0 40,0 42,6 45,5 48,1 51,1 54,0
Постройте график данной зависимости в координатах растворимость — температура, воспользовавшись офисным приложением Excel.Ответ:
График данной зависимости в координатах растворимость — температура:
2. В домашних условиях экспериментально изучите растворимость в воде следующих веществ: соль, сахар, питьевая сода, ванилин, лимонная кислота. Для этого примерно одинаковую массу вещества (например, чайную ложку) пробуйте растворить в определённом объёме воды (например, $\frac{1}{4}$ стакана). Сделайте вывод о растворимости исследуемых веществ.
Ответ:
Ход работы:
1) Взяли чайную ложку соли, размешали в стакане воды. Соль растворилась.
2) Взяли чайную ложку сахара, размешали в стакане воды. Сахар растворился.
3) Взяли чайную ложку соды, размешали в стакане воды. Сода растворилась.
4) Взяли чайную ложку ванилина, размешали в стакане воды. Ванилин не растворился. Нагрели раствор. Ванилин растворился при нагревании.
5) Взяли чайную ложку лимонной кислоты, размешали в стакане воды. Лимонная кислота растворилась.
Вывод: соль, сахар, питьевая сода, лимонная кислота растворимы в воде при обычных условиях, а ванилин растворяется при нагревании. §2
-
§2. Классификация химических соединений
Вопрос в начале параграфа✓
Химические вещества взаимодействуют друг с другом. Как разобраться в огромном многообразии химических превращений? Какие признаки лежат в основе классификации химических реакций?
Ответ:
Классифицировать химические реакции можно по различным признакам: по числу и составу реагентов и образующихся веществ, по тепловому эффекту, по агрегатному состоянию реагирующих веществ, по обратимости процесса, по наличию катализатора.
Лабораторный опыт 1
Одну стеклянную палочку смочите в растворе аммиака, другую — в соляной кислоте. Поднесите палочки друг к другу. Что наблюдаете? Что собой представляет белый дым?
Ответ:
Произойдет реакция:
$NH_{3} + HCl = NH_{4}Cl$
Наблюдаем выделение белого дыма.
Белый дым представляет собой хлорид аммония − $NH_{4}Cl$.Лабораторный опыт 2
Налейте в пробирку 2 мл раствора гидроксида натрия и добавьте 1—2 капли фенолфталеина. Что наблюдаете? В пробирку по каплям добавляйте соляную кислоту и встряхивайте содержимое. После добавления очередной порции окраска раствора исчезает. О чём свидетельствует этот факт? Напишите соответствующее уравнение реакции.
Ответ:
При добавлении 1—2 капли фенолфталеина к гидроксиду натрия раствор окрасится в малиновый цвет, так как имеет щелочную среду: $NaOH = Na^{+} + OH^{-}$
Исчезновение окраски после добавления соляной кислоты свидетельствует о протекании реакции: $NaOH + HCl = NaCl + H_{2}O$Лабораторный опыт 3
В химический стакан налейте 20 мл 10 %−ного раствора серной кислоты. Поместите в стакан термомет измерьте температуру раствора. Добавьте в стакан 20 мл 10 %−ного раствора гидроксида натрия. Перемешивая содержимое стакана, наблюдайте за изменением температуры. Сделайте вывод о тепловом эффекте проведённой реакции.
Ответ:
Произойдет реакция: $H_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2H_{2}O$
Вывод: реакция − экзотермическая, так как происходит выделение теплоты.Лабораторный опыт 4
Налейте в пробирку 3 мл раствора серной кислоты, добавьте на кончике шпателя оксида меди(II). Нагрейте пробирку. Какой признак указывает на протекание химической реакции? К какому типу по признаку агрегатного состояния реагентов относится данная реакция? Напишите её уравнение.
Ответ:
$H_{2}SO_{4} + CuO = CuSO_{4} + H_{2}O$
На протекание реакции указывают следующие признаки: растворение твердого вещества (CuO), образование раствора синего цвета.
По признаку агрегатного состояния реагентов данная реакция − гетерогенная.Лабораторный опыт 5
В пробирку налейте 2—3 мл раствора пероксида водорода. Добавьте в неё немного натёртой сырой моркови или картофеля. Что наблюдаете?
Ответ:
При добавлении сырой моркови или картофеля к пероксиду водорода наблюдается выделение газа при разложении пероксида водорода под действием ферментов: $2H_{2}O_{2} = 2H_{2}O + O_{2}$
Проверьте свои знания
1. Как классифицируют химические реакции по числу и составу исходных веществ и продуктов реакции? Приведите примеры уравнений таких реакций.
Ответ:
По числу и составу исходных веществ и продуктов реакции делятся на:
1) Реакции соединения
$S + O_{2} = SO_{2}$
$2SO_{2} + O_{2} = 2SO_{3}$
2) Реакции разложения
$Cu(OH)_{2} = CuO + H_{2}O$
$H_{2}SiO_{3} = SiO_{2} + H_{2}O$
3) Реакции замещения
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}$↑
$Zn + 2HCl = ZnCl_{2} + H_{2}$↑
4) Реакци обмена
$Na_{2}SO_{4} + BaCl_{2} = BaSO_{4}↓ + 2NaCl$
$MgSO_{4} + BaCl_{2} = BaSO_{4}↓ + MgCl_{2}$2. Как классифицируют химические реакции по тепловому эффекту? Что такое термохимическое уравнение? Приведите примеры уравнений таких реакций.
Ответ:
Классификация химических реакций по тепловому эффекту
При химических реакциях теплота или выделяется, или поглощается. По этому признаку реакции делят на экзотермические (с выделением теплоты) и эндотермические (с поглощением теплоты).
Уравнения химических реакций, в которых указан тепловой эффект, называют термохимическими уравнениями.
Пример:
$H_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2H_{2}O$ + 114 кДж3. Как классифицируют химические реакции по агрегатному состоянию реагентов? Приведите примеры уравнений таких реакций.
Ответ:
По агрегатному состоянию химические реакции делятся на гомогенные и гетерогенные.
Примеры гомогенных реакций:
$2SO_{2}(г.) + O_{2}(г.) = 2SO_{3}(г.)$
Примеры гетерогенных рекций:
$4FeS_{2}(тв.) + 11O_{2}(г.) = 2Fe_{2}O_{3} + 8SO_{2}$4. Как классифицируют химические реакции по обратимости? Приведите примеры уравнений таких реакций.
Ответ:
По обратимости химические реакции делятся на обратимые и необратимые.
Пример обратимой реакции:
$2SO_{2} + O_{2} = 2SO_{3}$
Пример необратимой реакции:
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}$5. Как классифицируют химические реакции по использованию катализатора? Приведите примеры уравнений таких реакций.
Ответ:
По использованию катализатора химические реакции делятся на каталитические и некаталитические.
Пример каталитической реакции:
$2SO_{2} + O_{2} = 2SO_{3}$ (катализатор: оксид ванадия (V) − $V_{2}O_{5}$)
Пример некаталитической реакции:
$SO_{3} + H_{2}O = H_{2}SO_{4}$Примените свои знания
6. Напишите уравнения следующих химических реакций:
а) оксида кальция с водой;
б) железа с раствором серной кислоты;
в) раствора нитрата серебра с раствором хлорида магния.
Определите тип каждой реакции по числу и составу реагентов и продуктов.Ответ:
а) $CaO + H_{2}O = Ca(OH)_{2}$ − реакция соединения
б) $Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}$ = реакция замещения
в) $2AgNO_{3} + MgCl_{2} = 2AgCl + Mg(NO_{3})_{2}$ − реакция обмена7. Разложение карбоната бария представляет собой эндотермический процесс, требующий затрат 267 кДж теплоты на разложение 1 моль соли. Запишите термохимическое уравнение реакции разложения карбоната бария. Напишите уравнение обратной реакции. Как вы думаете, каков её тепловой эффект?
Ответ:
$BaCO_{3} = BaO + CO_{2}$ − 267 кДж
Обратная реакция:
$BaO + CO_{2} = BaCO_{3}$ + 267 кДж8. По термохимическому уравнению реакции горения углерода
C(тв.) + $O_{2}$(г.) = $CO_{2}$(г.) + 410 кДж
рассчитайте:
а) количество теплоты, которое выделится при сгорании 54 г углерода;
б) объём кислорода, израсходованный в реакции горения, если в результате выделилось 2050 кДж теплоты.Ответ:
а) C(тв.) + $O_{2}$(г.) = $CO_{2}$(г.) + 410 кДж
Дано:
m (C) = 54 г
Найти:
Q (по усл.) − ?
Решение:
n = m : M = 54 г : 12 г/моль = 4,5 моль
По условию: 4,5 моль − Q
По уравнению: 1 моль − 410 кДж
Q (по усл.) = 4,5 моль * 410 кДж : 1 моль = 1845 кДж
Ответ: Q (по усл.) = 1845 кДж.
б) C(тв.) + $O_{2}$(г.) = $CO_{2}$(г.) + 410 кДж
Дано:
Q (по усл.) = 2050 кДж
Найти:
V ($O_{2}$) − ?
Решение:
По условию: x моль − 2050 кДж
По уравнению: 1 моль − 410 кДж
x = 2050 кДж * 1 моль : 410 кДж = 5 моль
V ($O_{2}$) = $V_{m}$ * n = 22,4 л/моль* 5 моль = 112 л
Ответ: V ($O_{2}$) = 112 л.9. Закончите уравнения следующих химических реакций:
а) $H_{2} + Cl_{2}$ → …
б) $MgO + H_{2}SO_{4}$ → …
в) $Al + CuCl_{2}$ → …
г) $BaCl_{2} + ZnSO_{4}$ → …
Укажите гетерогенные и гомогенные реакции, а также окислительно−восстановительные реакции. Укажите окислитель и восстановитель, процессы окисления и восстановления.Ответ:
а) $H_{2} + Cl_{2}$ → $2HCl$ − ОВР, гомогенная
$H_{2}^{0} - 2e = 2H^{+1}$ − процесс окисления
$Cl_{2}^{0} + 2e = 2Cl^{-1}$ − процесс восстановления
$H_{2}$ − восстановитель
$Cl_{2}$ − окислитель
б) $MgO + H_{2}SO_{4}$ → $MgSO_{4} + H_{2}O$ − не ОВР, гетерогенная
в) $2Al + 3CuCl_{2}$ → $2AlCl_{3} + 3Cu$ − ОВР, гомогенная
$Al^{0} - 3e = Al^{+3}$ − процесс окисления
$Cu^{+2} + 2e = Cu^{0}$ − процесс восстановления
$Al$ − восстановитель
$CuCl_{2}$ − окислитель
г) $BaCl_{2} + ZnSO_{4}$ → $BaSO_{4} + ZnCl_{2}$ − не ОВР, гетерогеннаяИспользуйте дополнительную информацию
Тепловые эффекты реакций нейтрализации между соляной кислотой и гидроксидом натрия, серной кислотой и гидроксидом калия, азотной кислотой и гидроксидом лития примерно одинаковы. Как вы думаете, почему? Для ответа на вопрос используйте Интернет.
Ответ:
Тепловые эффекты реакций нейтрализации примерно одинаковы, потому что все эти реакции протекают по схеме: $H^{+} + OH^{-} ⟶ H_{2}O$
§3
-
§3. Скорость химических реакций. Катализ
Вопрос в начале параграфа✓
Отношение изменения какой−либо величины ко времени, за которое произошло это изменение, называют скоростью. Какие величины используют для расчёта скорости химической реакции?
Ответ:
Скорость химической реакции рассчитывают по формуле:
v = $\frac{c}{t}$,
где c − изменение концентрации вещества (реагента или продукта); t − промежуток времени, за который произошло данное изменение концентрации.Лабораторный опыт 6
В две пробирки налейте по 2−3 мл раствора тиосульфата натрия. В первую пробирку добавьте несколько капель раствора хлорида бария, во вторую − несколько капель соляной кислоты. Что наблюдаете? В чём различие процессов, происходящих в обеих пробирках?
Ответ:
Напишем уравнения химических реакций:
1) $Na_{2}S_{2}O_{3} + BaCl_{2} ⟶ 2NaCl + BaS_{2}O_{3}$↓
2) $Na_{2}S_{2}O_{3} + 2HCl ⟶ 2NaCl + SO_{2}↑ + S↓ + H_{2}O$
В первом случае наблюдается выпадение мутного осадка, во втором − выпадение желтого осадка и выделение газа.Лабораторный опыт 7
В две пробирки налейте по 2−3 мл 10 %−ной соляной кислоты. В одну пробирку опустите кусочек железа (стальную скрепку), в другую − такой же кусочек магния. В какой из пробирок выделение пузырьков газа интенсивнее? Почему? Запишите уравнения происходящих реакций.
Ответ:
В пробирке с магнием выделение пузырьков газа протекает интенсивнее, чем в пробирке с железом, так как магний является более активным металлом, чем железо (в ряду активности металлов магний стоит левее железа).
Напишем уравнения химических реакций:
$2HCl + Fe = FeCl_{2} + H_{2}$↑
$2HCl + Mg = FeCl_{2} + H_{2}$↑Лабораторный опыт 8
В одну пробирку налейте 2−3 мл соляной кислоты, в другую − 2−3 мл раствора уксусной кислоты такой же концентрации. В каждую из пробирок опустите по одной грануле цинка. В какой из пробирок образование пузырьков газа интенсивнее? Почему?
Ответ:
В пробирке с соляной кислотой наблюдается более интенсивное выделение газа, чем в пробирке с уксусной кислотой, потому что соляная кислота – сильная кислота, а уксусная кислота – слабая кислота.
Напишем уравнения химических реакций:
$2HCl + Zn = ZnCl_{2} + H_{2}$↑
$2CH_{3}COOH + Zn = (CH_{3}COO)_{2}Zn + H_{2}$↑Лабораторный опыт 9
В пробирку налейте 5 мл 5 %−ного раствора серной кислоты и опустите стальную кнопку. Что наблюдаете? Нагревайте содержимое пробирки на пламени спиртовки. Что наблюдаете? Как изменилась скорость реакции?
Ответ:
$H_{2}SO_{4} + Fe = FeSO_{4} + H_{2}$
Наблюдаем выделение пузырьков газа − водорода.
При нагревании скорость реакции возрастает и наблюдается более интенсивное выделение газа.Лабораторный опыт 10
В три пробирки налейте соответственно 1 мл, 3 мл и 5 мл раствора тиосульфата натрия. В первую пробирку добавьте 4 мл воды, во вторую − 2 мл. Во всех трёх пробирках объём растворов одинаков − 5 мл. В какой из пробирок концентрация тиосульфата натрия максимальна, в какой − минимальна? В каждую пробирку добавьте по 2 мл соляной кислоты. Что наблюдаете?
Ответ:
Максимальная концентрация тиосульфата натрия в пробирке, куда не приливалась вода, а минимальная концентрация там, где прилили 4 мл воды к 1 мл раствора тиосульфата натрия. При добавлении соляной кислоты наблюдаем выпадение желтого осадка во всех трех пробирках.
Напишем уравнение реакции:
$Na_{2}S_{2}O_{3} + 2HCl = 2NaCl + SO_{2}↑ + S↓ + H_{2}O$Лабораторный опыт 11
В два химических стакана налейте по 15 мл соляной кислоты. В первый стакан поместите кусочек мрамора величиной с горошину, во второй − такой же кусочек, предварительно измельчённый в ступке. Что наблюдаете?
Ответ:
Напишем уравнения реакции:
$2HCl + CaCO_{3} = CaCl_{2} + H_{2}O + CO_{2}$↑
Во втором стакане скорость реакции выше, так как площадь соприкосновения реагентов больше.Вопрос (стр.22)?
В 1811 г. русский химик Константин Сигизмундович Кирхгоф изучал возможность получения сахаров из крахмала под действием воды. В природе этот процесс происходит в растительных клетках при созревании плодов и прорастании семян. В лабораторных условиях реакция протекала медленно, при длительном кипячении крахмального клейстера. Однажды Кирхгоф добавил в реакционную смесь несколько капель раствора серной кислоты и обнаружил, что реакция завершилась за несколько минут. При этом по окончании реакции количество серной кислоты в растворе не изменилось. Какое открытие совершил учёный? Как бы вы охарактеризовали роль серной кислоты в этой реакции? Предложите своё название наблюдаемому явлению.
Ответ:
Ученый открыл катализатор для реакции получения сахаров из крахмала.
Серная кислота в данной реакции является катализатором.
Катализатором называют вещество, которое при добавлении в незначительном количестве существенно изменяет скорость химической реакции, но не входит в состав продуктов.
Увеличение скорости химической реакции в присутствии катализатора называют катализом.Лабораторный опыт 12
В химический стакан налейте 10 мл раствора пероксида водорода. При комнатной температуре разложение этого вещества происходит очень медленно. Добавьте в стакан на кончике шпателя оксид марганца(IV). Что наблюдаете? Исчез ли чёрный порошок оксид марганца(IV) по окончании реакции?
Ответ:
При добавлении на кончике шпателя оксид марганца(IV) наблюдается увеличение скорости реакции, так как оксид марганца(IV) − катализатор для этой реакции.
Нет, черный порошок оксид марганца(IV) по окончании реакции не исчез, так как катализаторы не принимают участия в химических реакциях.Проверьте свои знания
1. Что называют скоростью химической реакции? Приведите примеры реакций, протекающих с высокой и низкой скоростью.
Ответ:
Скоростью химической реакции называют изменение концентрации вещества в единицу времени.
Реакция, протекающая с высокой скоростью:
$2Na + 2H_{2}O = 2NaOH + H_{2}$.
Реакция, протекающая с низкой сокростью:
$2Cu + O_{2} = 2CuO$.2. Какие факторы влияют на скорость химической реакции? Кратко охарактеризуйте влияние каждого из них на скорость реакции.
Ответ:
На скорость химической реакции влияет:
1) Природа реагирующих веществ.
Скорости реакций могут очень сильно различаться. Одни вещества реагируют так быстро, что их взаимодействие можно считать практически мгновенным. Например, уже в момент сливания растворов кислоты и щёлочи протекает реакция нейтрализации. Для завершения других реакций требуется значительное время. К таким процессам относятся, например, брожение виноградного сока, ржавление железа.
2) Температура.
При повышении температуры скорость реакции увеличивается.
3) Концентрация реагирующих веществ.
Скорость химической реакции пропорциональна концентрации реагирующих веществ.
4) Площадь соприкосновения реагирующих веществ.
В гетерогенных реакциях взаимодействие веществ протекает только на границе их соприкосновения, поэтому чем больше площадь соприкосновения реагентов, тем выше скорость реакции.
5) Наличие катализатора.
Катализатор может не только ускорять химическую реакцию, но и направлять её протекание по другому пути, т. е. продукты каталитической и некаталитической реакций могут различаться. Также следует учитывать, что в случае обратимых реакций катализатор одинаково ускоряет как прямую, так и обратную реакции.Примените свои знания
3. Запишите уравнение реакции цинка с серной кислотой. Предложите способы увеличения скорости этой реакции.
Ответ:
Запишем уравнение реакции:
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}$
Способы увеличения скорости этой реакции:
1) Измельчение цинка.
2) Повышение температуры.
3) Увеличение концентрации серной кислоты.4. Некоторые продукты питания хранят при низких температурах: в холодильниках, погребах, овощехранилищах. Почему? Приведите ещё несколько примеров увеличения или уменьшения скоростей химических реакций из повседневной жизни.
Ответ:
Продукты питания хранят в холдильниках, погребах, овощехранилищах, чтобы замедлить их порчу, так как при низких температурах скорость реакции уменьшается.
Примеры увеличения или уменьшения скоростей химических реакций из повседневной жизни:
1) замедление коррозии металлов с помощью антикоррозионного средства;
2) при приготовлении пищи химические реакции с веществами, входящими в состав еды, ускоряют увеличением температуры и площади контакта.5. В химической реакции, протекающей по уравнению
$2H_{2}S + SO_{2} = 3S↓ + 2H_{2}O$,
концентрация газообразного сероводорода за 2 мин уменьшилась с 0,86 моль/л до 0,26 моль/л. Рассчитайте скорость химической реакции за указанный промежуток времени.Ответ:
$2H_{2}S + SO_{2} = 3S↓ + 2H_{2}O$
Дано:
$c_{1}$ = 0,86 моль/л
$c_{2}$ = 0,26 моль/л
t = 2 мин = 120 с
Найти: v − ?
Решение:
v = $\frac{c}{t}$ = $\frac{0,86-0,26}{120}$ = 0,005 $\frac{моль}{л\;* \;с}$
Ответ: v = 0,005 $\frac{моль}{л\;*\;с}$.Используйте дополнительную информацию
Найдите в Интернете видео опыта каталитической реакции. Запишите уравнение реакции, укажите, какой катализатор был использован для её проведения.
Ответ:
Пример каталитической реакции:
$2KClO_{3} = 2KCl + 3O_{2}$
Катализатор − $MnO_{2}$. §4
-
ГЛАВА II. Химические реакции в растворах
§4. Электролитическая диссоциацияВопрос в начале параграфа✓
В двух химических стаканах без этикеток находятся по 10 г сахарного песка и поваренной соли. Как распознать эти вещества?
Ответ:
Угольные электроды, к клеммам которых присоединены провода, опускают в раствор какого−либо вещества. Включают прибор в электрическую сеть. Лампочка загорается, если раствор проводит электрический ток, и не загорается, если раствор его не проводит. Приготовим растворы сахара и поваренной соли. В растворе поваренной соли лампочка загорается, а в растворе сахара − нет.
Вопрос (стр.26)?
В чём причина электропроводности растворов электролитов?
Ответ:
Для объяснения этого явления шведский химик, лауреат Нобелевской премии Сванте Аррениус предположил, что при растворении в воде электролиты распадаются на ионы (диссоциируют). Образовавшиеся ионы и обеспечивают электропроводность раствора.
Лабораторный опыт 13
В углубление планшетки для эксперимента с малыми количествами веществ капните с помощью пипетки 1−2 капли раствора уксусной кислоты. Соблюдая правила техники безопасности, понюхайте кислоту. Что отмечаете? Изменяется ли интенсивность запаха при добавлении к кислоте 7−10 капель воды?
Ответ:
Уксусная кислота − слабая летучая кислота, обладающая резким запахом. (Летучими называют вещества, которые легко переходят в газообразное состояние.) При разбавлении она как слабый электролит почти не распадается на ионы, и молекулы обуславливают сохранение запаха.
Проверьте свои знания
1. Какие вещества называют электролитами?
Ответ:
Вещества, растворы и расплавы которых проводят электрический ток, называют электролитами.
2. Что называют электролитической диссоциацией?
Ответ:
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы.
3. Что называют степенью электролитической диссоциации? На какие группы делят вещества по степени электролитической диссоциации?
Ответ:
Отношение количества вещества электролита, распавшегося на ионы ($n_{д}$), к общему количеству растворённого вещества ($n_{р}$) называют степенью электролитической диссоциации: α = $\frac{n_{д}}{n_{р}}$.
По степени электролитической диссоциации все электролиты делят на сильные и слабые.4. От каких факторов зависит степень электролитической диссоциации?
Ответ:
В водном растворе степень электролитической диссоциации зависит от природы электролита и от его концентрации.
Примените свои знания
5. Почему кристаллический хлорид натрия не проводит электрический ток, а его раствор электропроводен? Объясните механизм диссоциации этой соли.
Ответ:
Между ионами кристалла электролита и молекулами воды возникнет притяжение, связь между ионами ослабеет, и произойдёт переход ионов из кристалла в раствор. Перешедшие в раствор ионы остаются связанными с присоединившимися к ним молекулами воды, которые образуют гидратную оболочку иона. Такой ион называют гидратированным.
Следовательно, при диссоциации электролитов с ионной кристаллической решёткой последовательно происходят следующие процессы:
1) ориентация молекул воды − диполей − вокруг ионов кристалла;
2) гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Уравнение диссоциации хлорида натрия:
$NaCl = Na^{+} + Cl^{–}$.6. Можно ли говорить о процессе ассоциации в растворах электролитов с ионной ковалентной связью? Почему?
Ответ:
Да, о процессе ассоциации в растворах электролитов с ионной ковалентной связью можно, так как растворы слабых электролитов диссоциируют обратимо. Слабые электролиты лишь частично распадаются на ионы (α → 0). Диссоциируют такие электролиты обратимо, т. е. наряду с процессом распада их молекул на ионы — диссоциацией — происходит процесс соединения ионов в молекулы — ассоциация.
7. Напишите уравнения электролитической диссоциации следующих веществ: хлорида железа(III), сероводородной кислоты, сульфата железа(II), фосфата натрия, гидроксида бария, азотистой кислоты, азотной кислоты. Почему в одних уравнениях вы записываете знак равенства, а в других − знак обратимости?
Ответ:
$FeCl_{3} = Fe^{3+} + 3Cl^{-}$
$H_{2}S ⇄ 2H^{+} + S^{2-}$
$FeSO_{4} = Fe^{2+} + SO_{4}^{2-}$
$Na_{3}PO_{4} = 3Na_{+} + PO_{4}^{3-}$
$Ba(OH)_{2} = Ba^{2+} + 2OH^{-}$
$HNO_{2} ⇄ H^{+} + NO_{2}^{-}$
$HNO_{3} = H^{+} + NO_{3}^{-}$
В одних уравнениях мы записываем знак равенства, а в других − знак обратимости, так как слабые электролиты лишь частично распадаются на ионы.8. Чему равна сумма коэффициентов перед формулами ионов в уравнениях электролитической диссоциации: а) нитрата железа(III); б) хлорида алюминия; в) нитрита калия; г) сульфата аммония?
Ответ:
а) $Fe(NO_{3})_{3} = Fe^{3+} + 3NO_{3}^{-}$
Сумма коэффициентов = 4.
б) $AlCl_{3} = Al^{3+} + 3Cl^{-}$
Сумма коэффициентов = 4.
в) $KNO_{2} = K^{+} + NO_{2}^{-}$
Сумма коэффициентов = 2.
г) $(NH_{4})_{2}SO_{4} = 2NH_{4}^{+} + SO_{4}^{2-}$
Сумма коэффициентов = 3.9. В растворах каких соединений загорится лампочка при испытании их на электропроводность: а) сероводород; б) азотистая кислота; в) гидроксид бария; г) гидрат аммиака; д) серная кислота; е) сульфат магния? Где лампочка будет гореть ярко, а где — слабо? Как можно увеличить интенсивность её свечения?
Ответ:
Лампочка:
а) сероводорода – будет гореть слабо;
б) азотистой кислоты – будет гореть слабо;
в) гидроксида бария – загорится ярко;
д) серной кислоты – загорится ярко;
е) сульфата магния – загорится ярко.
Увеличить интенсивность её свечения можно, разбавив раствор.10. Найдите количество вещества каждого из ионов, содержащихся в 342 г 5 %−ного раствора сульфата алюминия.
Ответ:
Дано:
$m_{р-ра}$ = 342 г
ω = 5%
Найти:
n ($Al^{3+}$) − ?
n ($SO_{4}^{2-}$) − ?
Решение:
$Al_{2}(SO_{4})_{3} = 2Al^{3+} + 3SO_{4}^{2-}$
$m_{в-ва}$ = $m_{р-ра}$ * ω
$m_{в-ва}$ = 342 г * 0,05 = 17,1 г
n = m : M = 17,1 г : 342 г/моль = 0,05 моль
n ($Al^{3+}$) = 2 * n = 2 * 0,05 моль = 0,1 моль
n ($SO_{4}^{2-}$) = 3 * n = 3 * 0,05 моль = 0,15 моль
Ответ: n ($Al^{3+}$) = 0,1 моль; n ($SO_{4}^{2-}$) = 0,15 моль.Используйте дополнительную информацию
1. Подготовьте сообщение о жизни и творчестве С. Аррениуса.
Ответ:
Сванте Август Аррениус
Шведский ученый появился на свет 19 февраля 1859 г. в семье землемера возле старинного города Упсала.
Сванте вступил в Упсальский университет, где изучал математику, физику, химию. В 1878 г. ему присвоили степень бакалавра естественных наук. Но он продолжал изучение физики в этом университете еще три года, однако ему были нужны глубокие знания, поэтому в 1881 г. он выехал в Стокгольм для продолжения исследований в области электричества.
В результате длинных и эффективных исследований он выдвинул предположение, что молекулы некоторых веществ во время растворения в жидкости диссоциируют или распадаются на две или больше долек, которые он назвал ионами. Не смотря на то, что каждая целая молекула электронейтральна, ее составные несут небольшой электрический заряд − положительный или отрицательный, в зависимости от природы частицы. Например, молекулы хлорида натрия в процессе растворения в воде распадаются на положительно заряженные атомы натрия и отрицательно заряженные атомы хлора. Эти заряженные атомы, активные составляющие части молекулы, образовываются только в растворе и делают возможным прохождение электрического тока.2. Подготовьте презентацию по теме «Вклад русских химиков в теорию электролитической диссоциации».
Ответ:
Вклад русских химиков в теорию электролитической диссоциации
Для объяснения этого явления шведский химик, лауреат Нобелевской премии Сванте Аррениус предположил, что при растворении в воде электролиты распадаются на ионы (диссоциируют). Образовавшиеся ионы и обеспечивают электропроводность раствора. Гипотеза Аррениуса получила научное подтверждение, которое превратило её в теорию электролитической диссоциации. Большой вклад в превращение этой гипотезы в теорию внесли ученики Д. И. Менделеева Иван Алексеевич Каблуков и Владимир Александрович Кистяковский. Для объяснения электролитической диссоциации веществ в воде русские химики применили химическую теорию растворов Менделеева. Их дополнения к теории Аррениуса заключались в следующем:
1) Причиной электролитической диссоциации является взаимодействие электролита с молекулами воды, т. е. его гидратация.
2) В растворах электролитов содержатся не свободные ионы, а гидратированные, т. е. «одетые» в оболочку из молекул воды. §5
-
§5. Основные положения теории электролитической диссоциации
Вопрос в начале параграфа✓
Теория (от греч. theoria − наблюдение, исследование) − совокупность научных положений какого−либо учения. Предметом химии являются вещества, а предметом теории электролитической диссоциации − электролиты. Свойства электролитов обусловлены свойствами образующихся при их диссоциации ионов. Как сформулировать основные положения этой теории в соответствии с логической схемой: вещества ⇄ электролиты ⇄ ионы? Почему в данной схеме использованы знаки обратимости?
Ответ:
Изложим основные положения теории электролитической диссоциации в соответствии с предложенной схемой.
1) Все вещества по способности проводить электрический ток в водных растворах или в расплавах делят на электролиты и неэлектролиты.
2) В растворе электролиты диссоциируют, т.е. распадаются на ионы. Причиной диссоциации служит гидратация электролита, т.е. его взаимодействие с водой.
Знаки обратимости, так как диссоциируют некоторые электролиты обратимо, т.е. наряду с процессом распада их молекул на ионы − диссоциацией − происходит процесс соединения ионов в молекулы − ассоциация.Проверьте свои знания
1. Сформулируйте основные положения теории электролитической диссоциации.
Ответ:
Основные положения теории электролитической диссоциации:
1) Все вещества по способности проводить электрический ток в водных растворах или в расплавах делят на электролиты и неэлектролиты.
2) В растворе электролиты диссоциируют, т. е. распадаются на ионы. Причиной диссоциации служит гидратация электролита, т. е. его взаимодействие с водой.2. Дайте определения кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
Ответ:
Электролиты, которые диссоциируют в воде на катионы водорода и анионы кислотного остатка, называют кислотами.
Электролиты, которые диссоциируют в воде на катионы металла (или ионы аммония) и гидроксид−анионы, называют основаниями.
Электролиты, которые диссоциируют в воде на катионы металла (или ионы аммония) и анионы кислотного остатка, называют солями.3. На какие группы делят кислоты, основания и соли?
Ответ:
Кислоты:
По числу атомов водорода, способных замещаться атомами металлов, кислоты подразделяют на три группы:
1) одноосновные (например, $HCl, HNO_{3}, HNO_{2}$);
2) двухосновные (например, $H_{2}SO_{4}, H_{2}CO_{3}, H_{2}S$);
3) трёхосновные (например, $H_{3}PO_{4}$).
По наличию кислорода в кислотном остатке кислоты бывают:
1) кислородсодержащие (например, $H_{2}SiO_{3}, H_{2}SO_{3}, H_{3}PO_{4}$);
2) бескислородные (например, $HCl, H_{2}S, HCN$).
По растворимости в воде кислоты делят на две группы:
1) растворимые (например, $HCl, H_{2}SO_{4}$);
2) нерастворимые (например, $Н_{2}SiO_{3}$).
В зависимости от степени электролитической диссоциации кислоты бывают:
1) сильные (например, $HNO_{3}, HCl, H_{2}SO_{4}$);
2) слабые (например, $H_{2}S, CH_{3}COOH, HNO_{2}$).
Основания:
По числу гидроксильных групп, т. е. кислотности, основания подразделяют на две группы:
1) однокислотные (например, NaOH, LiOH);
2) двухкислотные (например, $Ca(OH)_{2}, Ba(OH)_{2}$).
По растворимости в воде основания делят на две группы:
1) растворимые, или щёлочи (например, $KOH, Ba(OH)_{2}$);
2) нерастворимые (например, $Fe(OH)_{2}$).
В зависимости от степени электролитической диссоциации основания бывают:
1)сильные, к которым относят щёлочи (например, $NaOH, Ca(OH)_{2}, Sr(OH)_{2}$);
2) слабые (например, $NH_{3} * H_{2}O$).
Соли:
В зависимости от растворимости в воде соли, как и вещества других классов, бывают:
1) растворимые (например, $NaCl, KNO_{3}$);
2) малорастворимые (например, $CaSO_{4}, PbCl_{2}$);
3) нерастворимые (например, $AgCl, BaSO_{4}$).4. В чём различие процессов электролитической диссоциации сильных и слабых электролитов? Напишите уравнения электролитической диссоциации азотной и азотистой кислот. В каком уравнении необходимо поставить знак равенства, а в каком — знак обратимости?
Ответ:
Сильные электролиты в растворе полностью распадаются на ионы (α → 1), т. е. диссоциируют необратимо.
Слабые электролиты лишь частично распадаются на ионы (α → 0). Диссоциируют такие электролиты обратимо, т. е. наряду с процессом распада их молекул на ионы — диссоциацией — происходит процесс соединения ионов в молекулы — ассоциация.
$HNO_{3} = H^{+} + NO_{3}^{-}$
$HNO_{2} ⇄ H^{+} + NO_{2}^{-}$
Знак обратимости в уравнении диссоциации азотистой кислоты, так как это слабый электролит.Примените свои знания
5. Напишите уравнения электролитической диссоциации следующих веществ: бромида калия, иодоводородной кислоты, хлорида железа(III), сульфата натрия.
Ответ:
Уравнения электролитической диссоциации:
1) бромида калия: $KBr = K^{+} + Br^{-}$
2) иодоводородной кислоты: $HI = H^{+} + I^{-}$
3) хлорида железа(III): $FeCl_{3} = Fe^{3+} + 3Cl^{-}$
4) сульфата натрия: $Na_{2}SO_{4} = 2Na^{+} + SO_{4}^{2-}$6. В чём сходство и различие состава растворов хлорида калия и хлорида натрия? Назовите ионы, присутствующие в растворах этих веществ.
Ответ:
Хлорид натрия (NaCl) и хлорид калия (KCl) − соли, имеющие одинаковый анион − хлорид, но разный катион.
В хлориде натрия присутсвуют ионы $Na^{+}$ и $Cl^{-}$.
В хлориде калия присутсвуют ионы $K^{+}$ и $Cl^{-}$.7. Чему равна сумма коэффициентов перед формулами ионов в уравнениях электролитической диссоциации: а) нитрата лития; б) хлорида бария; в) нитрита кальция; г) сульфата цинка?
Ответ:
а) $LiNO_{3} = Li^{+} + NO_{3}^{-}$
Сумма коэффициентов = 2.
б) $BaCl_{2} = Ba^{2+} + 2Cl^{-}$
Сумма коэффициентов = 3.
в) $Ca(NO_{3})_{2} = Ca^{2+} + 2NO_{3}^{-}$
Сумма коэффициентов = 3.
г) $ZnSO_{4} = Zn^{2+} + SO_{4}^{2-}$
Сумма коэффициентов = 2.8. Среди перечисленных веществ укажите сильные и слабые электролиты: сероводородная кислота, азотистая кислота, гидроксид бария, гидрат аммиака, серная кислота, сульфат магния.
Ответ:
Сероводородная кислота − слабый электролит.
Азотистая кислота − слабый электролит.
Гидроксид бария − сильный электролит.
Гидрат аммиака − слабый электролит.
Серная кислота − сильный электролит.
Сульфат магния − сильный электролит.9. Определите степени окисления атомов в следующих кислотах: борная $H_{3}BO_{3}$, метафосфорная $(HPO_{3})_ {n}$, двухромовая $H_{2}Cr_{2}O_{7}$. Напишите уравнения ступенчатой диссоциации двухромовой кислоты, учитывая, что по первой ступени двухромовая кислота диссоциирует полностью, а по второй − частично.
Ответ:
$H_{3}^{+1}B^{+3}O^{-2}_{3}$, $(H^{+1}P^{+5}O^{-2}_{3})_{n}$, $H^{+1}_{2}Cr^{+6}_{2}O^{-2}_{7}$.
$H_{2}Cr_{2}O_{7} = H^{+} + HCr_{2}O_{7}^{-}$
$HCr_{2}O_{7}^{-} = H^{+} + Cr_{2}O_{7}^{2-}$10. В 1 л воды растворили 4,48 л аммиака (н. у.). Найдите массовую долю аммиака в полученном растворе.
Ответ:
Дано:
V ($H_{2}O$) = 1л
V ($NH_{3}$) = 4,48 л
Найти: ω − ?
Решение:
1 л $H_{2}O$ = 1000 г $H_{2}O$
ω = $\frac{m_{в-ва}}{m_{р-ра}}$ * 100%
$m_{в-ва}$ = M * n = M * $\frac{V}{Vm}$ = 17 г/моль* $\frac{4,48 л}{22,4 л/моль}$ = 3,4 г
$m_{р-ра}$ = $m_{в-ва}$ + m ($H_{2}O$) = 3,4 г + 1000 г = 1003,4 г
ω = $\frac{3,4 г }{1003,4 г }$ * 100% = 0,34 %
Ответ: ω = 0,34 %.11. Дайте названия солям, формулы которых: $Na_{2}SO_{3}$, $(NH_{4})_{2}S$, $KNO_{2}$, $CuSO_{4}$, $Cr(NO_{3})_{3}$, $Ca(HCO_{3})_{2}$, $NH_{4}HSO_{4}$. Напишите уравнения электролитической диссоциации каждой из этих солей
Ответ:
Сульфит натрия: $Na_{2}SO_{3} = 2Na^{+} + SO_{3}^{2-}$.
Сульфид аммония: $(NH_{4})_{2}S = 2NH_{4}^{+} + S^{2-}$.
Нитрит калия: $KNO_{2} = K^{+} + NO_{2}^{-}$.
Сульфат меди: $CuSO_{4} = Cu^{2+} + SO_{4}^{2-}$.
Нитрат хрома (III): $Cr(NO_{3})_{3} = Cr^{3+} + 3NO_{3}^{-}$.
Гидрокарбонат кальция: $Ca(HCO_{3})_{2} = Ca^{2+} + 2HCO_{3}^{-}$.
Гидросульфат аммония: $NH_{4}HSO_{4} = NH_{4}^{+} + HSO_{4}^{-}$.Выразите свое мнение
Предложите свою классификацию электролитов.
Ответ:
Электролиты можно разделить на сильные, средние и слабые. Чем значение степени диссоциации ближе к 100%, тем сильнее электролит.
§6
-
§6. Химические свойства кислот как электролитов
Вопрос в начале параграфа✓
Вспомните общее уравнение электролитической диссоциации кислот:
$H_{n}Acd = nH^{+} + Acd^{n–}$
В растворах кислот, особенно сильных, присутствуют два типа ионов: одинаковые для всех кислот − катионы водорода и индивидуальные для каждой кислоты − анионы кислотного остатка. Какие ионы, образующиеся при диссоциации кислот, обуславливают их общие свойства?Ответ:
Катионы водорода обуславливают их общие свойства.
Лабораторный опыт 14
Поместите в штатив две пробирки с 2 мл раствора серной кислоты, две − с 2 мл раствора азотной кислоты и две − с 2 мл соляной кислоты. В первую, третью и пятую пробирки добавьте с помощью пипетки 2−3 капли раствора лакмуса, в остальные − метилового оранжевого. Как изменилась окраска индикаторов? Почему для эксперимента не был предложен раствор фенолфталеина?
Ответ:
Лакмус, метиловый оранжевый в кислой среде окрашиваются в красный цвет, фенолфталеин остаётся бесцветным, поэтому он не был предложен.
Лабораторный опыт 15
Налейте в три пробирки по 2 мл раствора гидроксида натрия и добавьте к ним по 2−3 капли фенолфталеина. Что наблюдаете? Затем по каплям приливайте в эти пробирки кислоты: в первую − раствор серной кислоты, во вторую − раствор азотной кислоты, в третью − соляную кислоту до тех пор, пока растворы не обесцветятся. О чём свидетельствует исчезновение окраски индикатора? Потрогайте дно пробирок и сделайте вывод о тепловом эффекте реакции.
Ответ:
При добавлении фенолфталеина к гидроксиду натрия раствор окрашивается в малиновый цвет.
Исчезновение окраски индикатора свидетельствует о том, что гидроксид натрия полностью прореагировал с кислотой. Дно пробирки стало теплым, так как реакция нейтрализации является экзотермической.Лабораторный опыт 16
Получите осадок гидроксида меди(II): к 2 мл раствора сульфата меди(II) прилейте 1 мл раствора щёлочи. Распределите полученный осадок по трём пробиркам. В первую прилейте соляную кислоту (т. е. раствор, содержащий ионы $H^{+} и C^{–}$), во вторую − раствор серной кислоты (т. е. раствор, содержащий ионы $H^{+} и SO_{4}^{2–}$), в третью − раствор азотной кислоты (т.е. раствор, содержащий ионы $H^{+} и NO_{3}^{–}$). Что наблюдаете? Запишите соответствующие уравнения реакций.
Ответ:
$CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
$Cu(OH)_{2} + 2HCl = CuCl_{2} + 2H_{2}O$
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$Cu(OH)_{2} + 2HNO_{3} = Cu(NO_{3})_{2} + 2H_{2}O$
Нерастворимое основание реагирует с кислотами.Лабораторный опыт 17
В три сухие пробирки поместите немного порошка оксида меди(II) и прилейте: в первую − соляную кислоту, во вторую − раствор серной кислоты, в третью − раствор азотной. Используя держатель для пробирок, нагрейте каждую пробирку в пламени спиртовки. Что наблюдаете? Запишите соответствующие уравнения реакций.
Ответ:
1) $CuO + 2HCl = CuCl_{2} + H_{2}O$
2) $CuO + H_{2}SO_{4} = CuSO_{4} + H_{2}O$
3) $CuO + 2HNO_{3} = Cu(NO_{3})_{2} + H_{2}O$
Оксид меди(II) растворяется в кислотах.Лабораторный опыт 18
Поместите в две пробирки по 1−2 гранулы цинка. Затем прилейте: в первую пробирку 2 мл соляной кислоты, а во вторую пробирку 2 мл раствора серной кислоты. Что наблюдаете? Запишите соответствующие уравнения реакций.
Ответ:
1) $Zn + 2HCl = ZnCl_{2} + H_{2}↑$
В первую пробирку поместили 1−2 гранулы цинка и прилили 2 мл соляной кислоты. Гранулы цинка растворяются в соляной кислоте с выделением бесцветного газа − водорода.
2) $Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
Во вторую пробирку поместили 1−2 гранулы цинка и прилили 2 мл раствора серной кислоты. Гранулы цинка растворяются в серной кислоте с выделением пузырьков газа − водорода.Вопрос (стр.38)?
Запишите молекулярные уравнения реакций: а) между цинком и соляной кислотой; б) между цинком и серной кислотой.
Ответ:
Молекулярные уравнения реакций:
а) между цинком и соляной кислотой: $Zn + 2HCl = ZnCl_{2} + H_{2}$
б) между цинком и серной кислотой: $Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}$Лабораторный опыт 19
Поместите в пробирку кусочек меди. Прилейте 2−3 мл соляной кислоты. Что наблюдаете?
Ответ:
Напишем уравнение реакции: $Cu + 2HCl = CuCl_{2} + H_{2}$.
Наблюдаем выделение пузырьков газа − водорода.Лабораторный опыт 20
Поместите в пробирку кусочек свинца и прилейте 2−3 мл раствора серной кислоты. Что наблюдаете?
Ответ:
Напишем уравнение реакции: $Pb + H_{2}SO_{4} = PbSO_{4} + H_{2}$.
Наблюдаем выделение пузырьков газа − водорода.Лабораторный опыт 21
В три пробирки налейте по 2 мл раствора карбоната натрия. Затем осторожно добавьте в каждую пробирку по 2−3 капли кислот: в первую пробирку − соляную кислоту, во вторую − раствор серной кислоты, в третью − раствор азотной кислоты. Что наблюдаете? Запишите соответствующие уравнения реакций.
Ответ:
1) $Na_{2}CO_{3} + 2HCl = 2NaCl + CO_{2} + H_{2}O$
В первую пробирку налили 2 мл раствора карбоната натрия. Затем осторожно добавили 2−3 капли соляной кислоты.
2) $Na_{2}CO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + CO_{2} + H_{2}O$
В первую пробирку налили 2 мл раствора карбоната натрия. Затем осторожно добавили 2−3 капли серной кислоты.
3) $Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + CO_{2} + H_{2}O$
В первую пробирку налили 2 мл раствора карбоната натрия. Затем осторожно добавили 2−3 капли азотной кислоты.
Карбонат натрия в реакция с кислотами образует угольную кислоту (нестабильная) за счет карбонат−иона. Угольная кислота распадается на углекислый газ и воду.Вопрос (стр.40)?
Запишите три молекулярных уравнения, соответствующих этому ионному уравнению.
Ответ:
Три молекулярных уравнения, соответствующих этому ионному уравнению:
$2H^{+} + CO_{3}^{2-} = H_{2}O + CO_{2}$↑
1) $Na_{2}CO_{3} + 2HCl = 2NaCl + CO_{2} + H_{2}O$
2) $Na_{2}CO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + CO_{2} + H_{2}O$
3) $Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + CO_{2} + H_{2}O$Лабораторный опыт 22
В три пробирки налейте по 2 мл раствора силиката натрия. Затем добавляйте по каплям: в первую пробирку соляную кислоту, во вторую − раствор серной кислоты, в третью − раствор азотной кислоты. Что наблюдаете? Запишите соответствующие уравнения реакций.
Ответ:
1) В пробирку налили 2 мл раствора силиката натрия. Затем добавили по каплям соляную кислоту:
$Na_{2}SiO_{3} + 2HCl = 2NaCl + H_{2}SiO_{3}↓$
2) В пробирку налили 2 мл раствора силиката натрия. Затем добавили по каплям раствор серной кислоты:
$Na_{2}SiO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}SiO_{3}↓$
3) В пробирку налили 2 мл раствора силиката натрия. Затем добавили по каплям раствор азотной кислоты:
$Na_{2}SiO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}SiO_{3}↓$
За счет содержания силикат−иона силикат натрия в реакциях с кислотами образует осадок: кремниевую кислоту $H_{2}SiO_{3}$.Вопрос (стр.40)?
Запишите молекулярные уравнения проделанных реакций, соответствующих приведённому выше ионному уравнению.
Ответ:
Молекулярные уравнения проделанных реакций, соответствующих приведённому ионному уравнению:
$2H^{+} + SiO_{3}^{2-} = H_{2}SiO_{3}$↓
1) $Na_{2}SiO_{3} + 2HCl = 2NaCl + H_{2}SiO_{3}$
2) $Na_{2}SiO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + H_{2}SiO_{3}$
3) $Na_{2}SiO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}SiO_{3}$Лабораторный опыт 23
В пробирку прилейте 2 мл соляной кислоты и добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Запишите соответствующее уравнение реакции.
Ответ:
В пробирку налили 2 мл соляной кислоты и добавили с помощью пипетки несколько капель раствора нитрата серебра:
$HCl + AgNO_{3} = AgCl + HNO_{3}$
Наблюдаем образование белого творожистого осадка.Вопрос (стр.41)?
Запишите аналогичные уравнения для растворимых солей стронция и свинца.
Ответ:
Уравнения для растворимых солей стронция и свинца:
1) $SrCl_{2} + H_{2}SO_{4} = SrSO_{4} + 2HCl$
2) $Pb(NO_{3})_{2} + H_{2}SO_{4} = PbSO_{4} + 2HNO_{3}$Проверьте свои знания
1. Какие электролиты называют кислотами? Какие признаки лежат в основе их классификации? Приведите примеры кислот каждого типа. Охарактеризуйте серную и фосфорную кислоты по всем указанным вами признакам.
Ответ:
Кислоты − электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты делятся:
1) на одноосновные ($HCl, HNO_{3}$), двухосновные ($H_{2}SO_{4}, H_{2}CO_{3}$) и трехосновные ($H_{3}PO_{4}$) − по числу атомов водорода;
2) на кислородсодержащие ($H_{2}SO_{4}$) и бескислородные (HCl) − по наличию кислорода;
3) на растворимые ($HNO_{3}$) и нерастворимые ($H_{2}SiO_{3}$) − по растворимости в воде;
4) на сильные ($HNO_{3}, H_{2}SO_{4}$) и слабыe ($H_{2}SiO_{3}, CH_{3}COOH$) − по степени диссоциации.
Серная кислота $H_{2}SO_{4}$: двухосновная, кислородсодержащая, растворимая, сильная.
Фосфорная кислота $H_{3}PO_{4}$: трехосновная, кислородсодержащая, растворимая, средней силы.2. Назовите общие химические свойства кислот. Перечислите условия протекания реакций между растворами кислот и металлами.
Ответ:
Химические свойства кислот:
1) Обладают кислым вкусом.
2) Растворимые в воде кислоты изменяют окраску индикаторов.
3) Кислоты реагируют с основаниями с образованием соли и воды.
4) Кислоты реагируют с оксидами металлов с образованием соли и воды.
5) Кислоты взаимодействуют с металлами с образованием соли и водорода.
Из сильных кислот по−особому взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации. Эти реакции вы будете изучать в нашем курсе позднее. Следовательно, из всех сильных кислот взаимодействие с металлами с образованием соли и водорода характерно для соляной и разбавленной серной кислот. Будучи сильными электролитами, эти вещества в растворе существуют не в виде молекул, а в виде ионов.3. Сформулируйте правило Бертолле, т.е. перечислите условия протекания реакций между растворами электролитов.
Ответ:
Правило Бертолле: реакция между растворами электролитов возможна только в том случае, если в результате реакции образуется газ, осадок или слабый электролит (например, вода).
Примените свои знания
4. Запишите уравнения реакций (в молекулярной и ионной формах), характеризующих свойства: а) серной кислоты; б) соляной кислоты.
Ответ:
а) Уравнения реакций (в молекулярной и ионной формах), характеризующие свойства серной кислоты:
$H_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2H_{2}O$
$2H^{+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + 2H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
$H_{2}SO_{4} + CuO = CuSO_{4} + H_{2}O$
$2H^{+} + SO_{4}^{2-} + CuO = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$2H^{+} + CuO = Cu^{2+} + H_{2}O$
$3H_{2}SO_{4} + 2Fe = Fe_{2}(SO_{4})_{3} + 3H_{2}$
$6H^{+} +3SO_{4}^{2-} + 2Fe = 2Fe^{3+} + 3SO_{4}^{2-} + 3H_{2}$
$6H^{+} + 2Fe = 2Fe^{3+} + 3H_{2}$
б) Уравнения реакций (в молекулярной и ионной формах), характеризующие свойства соляной кислоты:
$HCl + KOH = KCl + H_{2}O$
$H^{+} + Cl^{-} + K^{+} + OH^{-} = K^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
$2HCl + FeO = FeCl_{2} + H_{2}O$
$2H^{+} + 2Cl^{-} + FeO = Fe^{2+} + 2Cl^{-} + H_{2}O$
$2H^{+} + FeO = Fe^{2+} + H_{2}O$
$6HCl + 2Al = 2AlCl_{3} + 3H_{2}$
$6H^{+} + 6Cl^{-} + 2Al = 2Al^{3+} + 6Cl^{-} + 3H_{2}$
$6H^{+} + 2Al = 2Al^{3+} + 3H_{2}$5. Запишите в молекулярной и ионной формах уравнения реакций между:
а) азотной кислотой и оксидом кальция;
б) азотной кислотой и гидроксидом кальция;
в) азотной кислотой и карбонатом кальция.Ответ:
а) $2HNO_{3} + CaO = Ca(NO_{3})_{2} + H_{2}O$
$2H^{+} + 2NO_{3}^{-} + CaO = Ca^{2+} + 2NO_{3}^{-} + H_{2}O$
$2H^{+} + CaO = Ca^{2+} + H_{2}O$
б) $2HNO_{3} + Ca(OH)_{2} = Ca(NO_{3})_{2} + 2H_{2}O$
$2H^{+} + 2NO_{3}^{-} + Ca^{2+} + 2OH^{-} = Ca^{2+} + 2NO_{3}^{-} + H_{2}O$
$2H^{+} + 2OH^{-} = H_{2}O$
в) $2HNO_{3} + CaCO_{3} = Ca(NO_{3})_{2} + CO_{2} + H_{2}O$
$2H^{+} + 2NO_{3}^{-} + CaCO_{3} = Ca^{2+} + 2NO_{3}^{-} + CO_{2} + H_{2}O$
$2H^{+} + CaCO_{3} = Ca^{2+} + CO_{2} + H_{2}O$6. С какими из перечисленных веществ реагирует соляная кислота: азот, железо, оксид кальция, серная кислота, гидроксид алюминия, сульфат натрия, нитрат серебра(I)? Напишите уравнения возможных реакций в молекулярной и ионной формах.
Ответ:
Соляная кислота реагирует с железом, оксидом кальция, гидроксидом алюминия, нитратом серебра.
1) С железом:
$2HCl + Fe = FeCl_{2} + H_{2}$
$2H^{+} + 2Cl^{-} + Fe = Fe^{2+} + 2Cl^{-} + H_{2}$
$2H^{+} + Fe = Fe^{2+} + H_{2}$
2) С оксидом кальция:
$2HCl + CaO = CaCl_{2} + H_{2}O$
$2H^{+} + 2Cl^{-} + CaO = Ca^{2+} + 2Cl^{-} + H_{2}O$
$2H^{+} + CaO = Ca^{2+} + H_{2}O$
3) С гидроксидом алюминия:
$3HCl + Al(OH)_{3} = AlCl_{3} + 3H_{2}O$
$3H^{+} + 3Cl^{-} + Al(OH)_{3} = Al^{3+} + 3Cl^{-} + 3H_{2}O$
$3H^{+} + Al(OH)_{3} = Al^{3+} + 3H_{2}O$
4) С нитратом серебра:
$HCl + AgNO_{3} = AgCl + HNO_{3}$
$H^{+} + Cl^{-} + Ag^{+} + NO_{3}^{-} = AgCl + H^{+} + NO_{3}^{-}$
$Cl^{-} + Ag^{+} = AgCl$7. Найдите массу 10 %−ной соляной кислоты, необходимой для нейтрализации 160 г 5 %−ного раствора гидроксида натрия.
Ответ:
Дано:
ω (HCl) = 10%
$m_{р-ра}$ (NaOH) = 160 г
ω (NaOH) = 5%
Найти:
$m_{р-ра}$ (HCl) − ?
Решение:
$HCl + NaOH = NaCl + H_{2}O$
$m_{р-ра}$ (HCl) = $m_{в-ва}$ : ω
$m_{в-ва}$ (HCl) = M * n
n (HCl) = n (NaOH)
n (NaOH) = $m_{р-ра}$ (NaOH) * ω : M (NaOH)
n (NaOH) = 160 г * 0,05 : 40 г/моль = 0,2 моль
n (HCl) = 0,2 моль
$m_{в-ва}$ (HCl) = 36,5 г/моль * 0,2 моль = 7,3 г
$m_{р-ра}$ (HCl) = 7,3 г : 0,1 = 73 г
Ответ: $m_{р-ра}$ (HCl) = 73 г.8. Какая масса мрамора, содержащего 96 % карбоната кальция, потребуется для получения 89,6 л углекислого газа (н. у.) при взаимодействии его с азотной кислотой? Сколько граммов 20 %−ного раствора кислоты потребуется для этой реакции?
Ответ:
Дано:
ω ($CaCO_{3}$) = 96%
V ($CO_{2}$) = 89,2 л
ω ($HNO_{3}$) = 20%
Найти:
m (мрамора) − ?
$m_{р-ра}$ ($HNO_{3}$) − ?
Решение:
$CaCO_{3} + 2HNO_{3} = Ca(NO_{3})_{2} + CO_{2} + H_{2}O$
m (мрамора) = m ($CaCO_{3}$) : ω ($CaCO_{3}$)
m ($CaCO_{3}$) = M * n
n ($CaCO_{3}$) = n ($CO_{2}$)
n ($CO_{2}$) = $V : V_{m}$ = 89,6 л : 22,4 л/моль = 4 моль
n ($CaCO_{3}$) = 4 моль
m ($CaCO_{3}$) = 100 г/моль * 4 моль = 400 г
m (мрамора) = 400 г : 0,96 = 417 г
$m_{р-ра}$ ($HNO_{3}$) = $m_{в-ва}$ : ω
n ($HNO_{3}$) = 2 * 4 моль = 8 моль
$m_{в-ва}$ = M * n = 63 г/моль * 8 моль = 504 г
$m_{р-ра}$ ($HNO_{3}$) = 504 г : 0,2 = 2520 г
Ответ: m (мрамора) = 417 г; $m_{р-ра}$ ($HNO_{3}$) = 2520 г.Используйте дополнительную информацию
Подготовьте сообщение об областях применения серной кислоты.
Ответ:
Серная кислота − одна из самых сильных кислот. Она реагирует с большинством металлов, растворяет минералы, обугливает древесину, бумагу и ткани. При попадании кислоты на кожу возникают сильные химические ожоги. Серная кислота прекрасно растворяется в воде с выделением большого количества теплоты. Если наливать воду в концентрированную кислоту, за счёт выделяющейся теплоты вода закипает и разбрызгивает жидкость. Это очень опасно! Поэтому, приготавливая раствор, серную кислоту тонкой струйкой вливают в воду (а не наоборот!) при постоянном перемешивании.
Серная кислота применяется:
1) для получения других кислот;
2) для производства минеральных удобрений;
3) для очистки нефтепродуктов;
4) в свинцовых аккумуляторах;
5) в производстве моющих средств, красителей, лекарств. §7
-
§7. Химические свойства оснований как электролитов
Вопрос в начале параграфа✓
Вспомните общее уравнение электролитической диссоциации оснований:
$M(OH)_{n} = M^{n+} + nOH^{–}$
В растворах щелочей присутствуют два типа ионов: общие для всех оснований гидроксид−анионы и индивидуальные для каждого основания катионы конкретных металлов. Какие ионы, образующиеся при диссоциации оснований, обусловливают их общие свойства?Ответ:
Гидроксид−анионы, образующиеся при диссоциации оснований, обусловливают их общие свойства.
Лабораторный опыт 24
В три пробирки налейте по 2 мл раствора гидроксида натрия. В каждую пробирку добавьте по 2−3 капли растворов индикаторов: в первую − фенолфталеина, во вторую − лакмуса, в третью − метилового оранжевого. Как изменилась окраска индикаторов?
Ответ:
$NaOH = Na^{+} + OH^{-}$
В три пробирки налили по 2 мл раствора гидроксида натрия. В каждую пробирку добавьте по 2−3 капли растворов индикаторов: в первую − фенолфталеина, во вторую − лакмуса, в третью − метилового оранжевого.
В первой пробирке будет малиновая окраска, во второй − синяя, в третьей − желтая.Вопрос (стр.42)?
Приведите по два молекулярных уравнения, соответствующие приведённым сокращённым ионным уравнениям реакций.
$OH^{–} + H^{+} = H_{2}O$
$M(OH)_{n} + nH^{+} = Mn_{+} + nH_{2}O$Ответ:
$OH^{–} + H^{+} = H_{2}O$:
1) $HCl + KOH = KCl + H_{2}O$
2) $H_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2H_{2}O$
$M(OH)_{n} + nH^{+} = Mn_{+} + nH_{2}O$:
1) $Al(OH)_{3} + 3HCl = AlCl_{3} + 3H_{2}O$
2) $Zn(OH)_{2} + H_{2}SO_{4} = ZnSO_{4} + 2H_{2}O$Лабораторный опыт 25
Откройте пробки двух небольших пластиковых бутылочек из−под минеральной воды, заполненных углекислым газом, а затем в одну из них прилейте 10 мл раствора гидроксида натрия, а в другую − 10 мл раствора гидроксида калия. Вновь закройте бутылки пробками и встряхните. Что наблюдаете?
Ответ:
Открыли пробки двух небольших пластиковых бутылочек из−под минеральной воды, заполненных углекислым газом, а затем в одну из них прилили 10 мл раствора гидроксида натрия, а в другую − 10 мл раствора гидроксида калия. Вновь закрыли бутылки пробками и встряхнули.
Напишем уравнения реакций:
1) $CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
2) $CO_{2} + 2KOH = K_{2}CO_{3} + H_{2}O$
Наблюдаем исчезновение углекислого газа, так как он вступает в реакцию с щелочами с образованияем солей и воды.Лабораторный опыт 26
В две пробирки налейте по 2 мл растворов солей аммония — хлорида $NH_{4}Cl$ и нитрата $NH_{4}NO_{3}$. Затем добавьте в каждую по 1 мл раствора щёлочи — гидроксида натрия. Подогрейте содержимое каждой пробирки в пламени спиртовки с помощью держателя для пробирок. Осторожно понюхайте продукт взаимодействия. Что ощущаете? Поднесите к отверстию пробирки влажную универсальную индикаторную бумагу. Что наблюдаете?
Ответ:
$NH_{4}Cl + NaOH = NaCl + NH_{3} + H_{2}O$
$NH_{4}NO_{3} + NaOH = NaNO_{3} + NH_{3} + H_{2}O$
Ощущаем выделение газа с резким запахом.
С помощью лакмусовой бумажки выяснили, что раствор имеет слабощелочную среду, так как бумага окрасилась в синий цвет.Вопросы (стр.44)?
1. Запишите молекулярное уравнение, соответствующее приведённому сокращённому ионному уравнению.
$Ba^{2+} + SO_{4}^{2−} = BaSO_{4}$↓Ответ:
Молекулярное уравнение, соответствующее приведённому сокращённому ионному уравнению:
$Ba(OH)_{2} + H_{2}SO_{4} = BaSO_{4} + 2H_{2}O$2. Запишите два молекулярных уравнения, соответствующие приведённому сокращённому ионному уравнению.
$Cu^{2+} + 2OH^{–} = Cu(OH)_{2}$↓Ответ:
Два молекулярных уравнения, соответствующие приведённому сокращённому ионному уравнению:
1) $CuCl_{2} + 2NaOH = Cu(OH)_{2} + 2NaCl$
2) $CuSO_{4} + 2KOH = Cu(OH)_{2} + K_{2}SO_{4}$Лабораторный опыт 27
Повторите уже знакомый вам эксперимент. В пробирку налейте 2−3 мл раствора сульфата меди (II) − медного купороса − и прилейте 1−2 мл раствора щёлочи. Что наблюдаете? Содержимое пробирки сохраните для проведения следующего опыта.
Ответ:
Напишем уравнение реакции:
$CuSO_{4} + 2NaOH = Cu(OH)_{2} ↓ + Na_{2}SO_{4}$
Наблюдаем образование осадка синего цвета − гидроксида меди.Лабораторный опыт 28
Закрепите в пробиркодержателе пробирку с полученным в предыдущем опыте синим осадком. Осторожно нагревайте её в пламени спиртовки (не до кипения). Что наблюдаете?
Ответ:
Напишем уравнение реакции: $Cu(OH)_{2} = CuO + H_{2}O$
Наблюдаем исчезновение синего осадка и образование черного вещества − оксида меди.Проверьте свои знания
1. Какие химические свойства характерны для щелочей? Какие — для нерастворимых оснований? Какие химические свойства характерны для обеих групп оснований?
Ответ:
Для щелочей характерны реакции взаимодействия:
1) с солями;
2) с оксидами неметаллов.
Для нерастворимых оснований характерны реакции: разложения.
И щелочи, и нерастворимые основания реагируют с кислотами.2. Какие свойства оснований обусловлены гидроксид−анионами, а какие — катионами металла или аммония?
Ответ:
Свойства оснований, обусловленные гидроксид−анионами:
1) изменение окраски индикаторов;
2) взаимодействие с кислотами.
Свойства оснований, обусловленные катионами металла или аммония: растворимость.3. Перечислите условия протекания реакций между растворами щелочей и солей.
Ответ:
Растворимые в воде основания реагируют с солями. Такие реакции также протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или вода.
Примените свои знания
4. Напишите ионные и молекулярные уравнения реакций, протекающих при взаимодействии:
а) раствора гидроксида натрия и оксида азота (V);
б) раствора гидроксида хрома (II) и соляной кислоты;
в) растворов сульфата аммония и гидроксида натрия.Ответ:
а) Ионные и молекулярные уравнения реакций, протекающие при взаимодействии раствора гидроксида натрия и оксида азота (V):
$2NaOH + N_{2}O_{5} = 2NaNO_{3} + H_{2}O$
$2Na^{+} + 2OH^{-} + N_{2}O_{5} = 2Na^{+} + 2NO_{3}^{-} + H_{2}O$
$2OH^{-} + N_{2}O_{5} = 2NO_{3}^{-} + H_{2}O$
б) Ионные и молекулярные уравнения реакций, протекающие при взаимодействии раствора гидроксида хрома (II) и соляной кислоты:
$Cr(OH)_{2} + 2HCl = CrCl_{2} + 2H_{2}O$
$Cr(OH)_{2} + 2H^{+} + 2Cl^{-} = Cr^{2+} + 2Cl^{-} + 2H_{2}O$
$Cr(OH)_{2} + 2H^{+} = Cr^{2+} + 2H_{2}O$
в) Ионные и молекулярные уравнения реакций, протекающие при взаимодействии растворов сульфата аммония и гидроксида натрия:
$(NH_{4})_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2NH_{3} + 2H_{2}O$
$2NH_{4}^{+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + 2NH_{3} + 2H_{2}O$
$NH_{4}^{+} + OH^{-} = NH_{3} + H_{2}O$5. Напишите по одному молекулярному уравнению реакций, которым соответствуют сокращённые ионные уравнения:
а) $Al^{3+} + 3OH^{–} = Al(OH)_{3}$↓
б) $CO_{2} + 2OH^{–} = CO_{3}^{2-} + H_{2}O$
в) $2H^{+} + Cu(OH)_{2} = Cu^{2+} + 2H_{2}O$Ответ:
а) Ионное уравнение $Al^{3+} + 3OH^{–} = Al(OH)_ {3}$↓ соответствует молекулярному уравнению реакции:
$AlCl_{3} + 3NaOH = 3NaCl + Al(OH)_{3}$
б) Ионное уравнение $CO_{2} + 2OH^{–} = CO_{3}^{2-} + H_{2}O$ соответствует молекулярному уравнению реакции:
$CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
в) Ионное уравнение $2H^{+} + Cu(OH)_{2} = Cu^{2+} + 2H_{2}O$ соответствует молекулярному уравнению реакции:
$2HCl + Cu(OH)_{2} = CuCl_{2} + 2H_{2}O$6. Найдите массу 20%−ной соляной кислоты, необходимой для реакции со 160 г 25%−ного раствора гидроксида натрия.
Ответ:
Дано:
ω ($HCl$) = 20%
$m_{р-ра}$ (NaOH) = 160 г
ω (NaOH) = 25%
Найти:
m (HCl) − ?
Решение:
$HCl + NaOH = NaCl + H_{2}O$
m (HCl) = M * n : ω
n (HCl) = n (NaOH)
n (NaOH) = $m_{р-ра}$ (NaOH) * ω (NaOH) : M = 160 г * 0,25 : 40 г/моль = 1 моль
n (HCl) = n (NaOH) = 1 моль
m (HCl) = 36,5 г/моль * 1 моль : 0,2 = 182,5 г
Ответ: m (HCl) = 182,5 г.7. Какой объём аммиака (н. у.) образуется при взаимодействии 535 мг 20%−ного раствора хлорида аммония с избытком раствора гидроксида калия? Какая масса 40%−ного раствора щёлочи потребуется для проведения этой реакции?
Ответ:
Дано:
$m_{р-ра}$ ($NH_{4}Cl$) = 535 мг
ω = 20%
ω (KOH) = 40%
Найти:
V ($NH_{3}$) − ?
$m_{р-ра}$ (KOH) − ?
Решение:
$NH_{4}Cl + KOH = KCl + NH_{3} + H_{2}O$
V ($NH_{3}$) = $V_{m}$ * n
n ($NH_{3}$) = n ($NH_{4}Cl$)
n ($NH_{4}Cl$) = $m_{р-ра}$ ($NH_{4}Cl$) * ω : M = 535 мг * 0,2 : 53,5 г/моль = 2 ммоль
n ($NH_{3}$) = 2 ммоль
V ($NH_{3}$) = 22,4 л/моль * 2 ммоль = 44,8 мл
$m_{р-ра}$ (KOH) = M * n : ω (KOH) = 56 г/моль * 2 ммоль : 0,4 = 280 мг
Ответ: V ($NH_{3}$) = 44,8 мл; $m_{р-ра}$ (KOH) = 280 мг.Используйте дополнительную информацию
Подготовьте сообщение об областях применения и свойствах едких щелочей.
Ответ:
Гидроксид натрия – неорганическое вещество белого цвета. Обладает высокой гигроскопичностью. На воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии. Раствор едкого натра мылок на ощупь.
Гидроксид натрия получают электролизом раствора хлорида натрия:
2NaCl + $2H_{2}$O = 2NaOH + $H_{2}$ + $Cl_{2}$
Также гидроксид натрия можно получить при взаимодействии натрия, оксида натрия, гидрида натрия или пероксида натрия с водой:
2Na + $2H_{2}$O = 2NaOH + $H_{2}$
2$Na_{2}$O + $H_{2}$O = 2NaOH
2$Na_{2}$ $O_{2}$ + $H_{2}$O = 2NaOH + $H_{2}O_{2}$
К химическим свойствам щелочи можно отнести взаимодействие с кислотными оксидами, кислотами и солями:
2NaOH + $CO_{2}$ = $Na_{2}CO_{3}$ + $H_{2}$O
NaOH + HCl = NaCl + $H_{2}$O
2NaOH + $CuCl_{2}$ = 2NaCl + $Cu(OH)_{2}$
Гидроксид натрия используется во многих отраслях промышленности: в производстве целлюлозы и бумаги, текстиля, питьевой воды, мыла и моющих средств, а также в качестве очистителя сточных вод. §8
-
§8. Химические свойства солей как электролитов
Вопрос в начале параграфа✓
В отличие от свойств кислот и оснований свойства солей зависят как от катиона металла, так и от аниона кислотного остатка. С какими свойствами солей вы познакомились при изучении свойств кислот и щелочей?
Ответ:
Соли реагируют с кислотами и щелочами, если в продуктах реакции есть осадок или газ.
Лабораторный опыт 29
Поместите в пробирку небольшой кусочек мрамора и прилейте к нему 2−3 мл раствора азотной кислоты. Что наблюдаете? Как можно распознать выделяющийся газ?
Ответ:
Напишем уравнение реакции:
$CaCO_{3} + 2HNO_{3} = Ca(NO_{3})_{2} + CO_{2} + H_{2}O$
Наблюдаем выделение газа − $CO_{2}$.
Углекислый газ можно распознать по помутнению известковой воды:
$CO_{2} + Ca(OH)_{2} = CaCO_{3} + H_{2}O$Лабораторный опыт 30
Налейте в пробирку 2 мл раствора сульфата железа (III), а затем добавьте в неё 3 мл раствора гидроксида натрия. Что наблюдаете?
Ответ:
Напишем уравнение реакции:
$Fe_{2}(SO_{4})_{3} + 6NaOH = 2Fe(OH)_{3} + 3Na_{2}SO_{4}$
Наблюдаем выпадение осадка рыжего цвета − гидроксида железа (III).Вопросы (стр.47)??
1. Запишите молекулярное уравнение реакции между сульфатом магния и фосфатом щелочного металла.
Ответ:
Молекулярное уравнение реакции между сульфатом магния и фосфатом щелочного металла:
$3MgSO_{4} + 2Na_{3}PO_{4} = Mg_{3}(PO_{4})_{2} + 3Na_{2}SO_{4}$2. Запишите молекулярное уравнение реакции между сульфатом меди (II) и цинком.
Ответ:
Молекулярное уравнение реакции между сульфатом меди (II) и цинком:
$CuSO_{4} + Zn = ZnSO_{4} + Cu$Лабораторный опыт 31
Поместите в пробирку канцелярскую скрепку. Прилейте в пробирку раствор сульфата меди (II) так, чтобы скрепка полностью находилась в растворе. Через некоторое время вы сможете отметить признак протекающей реакции. Какие изменения вы наблюдаете?
Ответ:
Поместили в пробирку канцелярскую скрепку. Прилили в пробирку раствор сульфата меди (II) так, чтобы скрепка полностью находилась в растворе.
Уравнение реакции:
$Fe + CuSO_{4} = FeSO_{4} + Cu↓$
Мы наблюдаем образование красного осадка − меди и растворение скрепки.Проверьте свои знания
1. Какие электролиты называют солями?
Ответ:
Соли − это сложные вещества, состоящие из катиона металла и кислотного остатка.
2. Охарактеризуйте химические свойства средних солей.
Ответ:
Химические свойства средних солей:
1) Соли и кислоты взаимодействуют, если образуется осадок или газ.
2) Растворы солей и щелочей взаимодействуют, если образуется осадок или газ.
3) Взаимодействие растворов одних солей с растворами других солей.
4) Взаимодействие растворов солей с металлами определяется положением металла в электрохимическом ряду напряжений металлов и подчиняется уже знакомым вам правилам (напомним их):
• металл, вступающий в реакцию с раствором соли, должен располагаться в электрохимическом ряду напряжений левее металла, входящего в состав соли;
• как исходная соль, так и соль, образующаяся в результате реакции, должны быть растворимыми;
• так как щелочные и щелочноземельные металлы взаимодействуют с водой, то в растворах солей они реагируют в первую очередь именно с ней, а потому для подобных реакций их не используют.3. Как диссоциируют кислые соли? Запишите уравнения диссоциации сульфата и гидросульфата калия и уравнение реакции превращения кислой соли в среднюю.
Ответ:
Кислые соли диссоциируют на катион металла и анион кислотного остатка.
Уравнение диссоциации сульфата калия:
$K_{2}SO_{4} = 2K^{+} + SO_{4}^{2-}$
Уравнение диссоциации гидросульфата калия:
$KHSO_{4} = K^{+} + HSO_{4}^{-}$
Уравнение реакции превращения кислой соли в среднюю:
$KHSO_{4} + KOH = K_{2}SO_{4} + H_{2}O$Примените свои знания
4. Запишите ионные и молекулярные уравнения получения сульфата магния с использованием соединений разных классов (не менее пяти способов).
Ответ:
1) Ионное и молекулярные уравнения получения сульфата магния с помощью оксида магния и оксида серы (VI):
$MgO + SO_{3} = MgSO_{4}$
$MgO + SO_{3} = Mg^{2+} + SO^{2-}_{4}$
2) Ионное и молекулярные уравнения получения сульфата магния с помощью оксида магния и серной кислоты:
$MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O$
$MgO + 2H^{+} + SO_{4}^{2-} = Mg^{2+} + SO_{4}^{2-} + H_{2}O$
$MgO + 2H^{+} = Mg^{2+} + H_{2}O$
3) Ионное и молекулярные уравнения получения сульфата магния с помощью магния и серной кислоты:
$Mg + H_{2}SO_{4} = MgSO_{4} + H_{2}$
$Mg + H_{2}^{+} + SO_{4}^{2-} = Mg^{2+} + SO^{2-}_{4} + H_{2}$
$Mg + H_{2}^{+} = Mg^{2+} + H_{2}$
4) Ионное и молекулярные уравнения получения сульфата магния с помощью магния и сульфата меди (II):
$Mg + CuSO_{4} = MgSO_{4} + Cu$
$Mg + Cu^{2+} + SO^{2-}_{4} = Mg^{2+} + SO^{2-}_{4} + Cu$
$Mg + Cu^{2+} = Mg^{2+} + Cu$
5) Ионное и молекулярные уравнения получения сульфата магния с помощью карбоната магния и серной кислоты:
$MgCO_{3} + H_{2}SO_{4} = MgSO_{4} + CO_{2} + H_{2}O$
$Mg^{2+} + CO^{2-}_{3} + 2H^{+} + SO^{2-}_{4} = Mg^{2+} + SO^{2-}_{4} + CO_{2} + H_{2}O$
$CO^{2-}_{3} + 2H^{+} = CO_{2} + H_{2}O$5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $P → P_{2}O_{5} → H_{3}PO_{4} → Ca_{3}(PO_{4})_{2}$
б) $Zn → ZnCl_{2} → Zn(OH)_{2} → ZnO → ZnSO_{4} → Zn(NO_{3})_{2}$
в) $Na_{2}O → NaOH → NaHCO_{3} → Na_{2}CO_{3} → Na_{2}SO_{4}$
Реакции с участием электролитов запишите также и в ионном виде.Ответ:
а) $P → P_{2}O_{5} → H_{3}PO_{4} → Ca_{3}(PO_{4})_{2}$
$4P + 5O_{2} = 2P_{2}O_{5}$
$P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
$2H_{3}PO_{4} + 3CaO = Ca_{3}(PO_{4})_{2} + 3H_{2}O$
б) $Zn → ZnCl_{2} → Zn(OH)_{2} → ZnO → ZnSO_{4} → Zn(NO_{3})_{2}$
$Zn + Cl_{2} = ZnCl_{2}$
$ZnCl_{2} + 2NaOH = Zn(OH)_{2} + 2NaCl$
$Zn^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} = Zn(OH)_{2} + 2Na^{+} + 2Cl^{-}$
$Zn^{2} + 2OH^{-} = Zn(OH)_{2}$
$Zn(OH)_{2} = ZnO + H_{2}O$
$ZnO + H_{2}SO_{4} = ZnSO_{4} + H_{2}O$
$ZnSO_{4} + Ba(NO_{3})_{2} = BaSO_{4} + Zn(NO_{3})_{2}$
$Zn^{2+} + SO_{4}^{2-} + Ba^{2+} + 2NO_{3}^{-} = BaSO_{4} + Zn^{2+} + 2NO_{3}^{-}$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}$
в) $Na_{2}O → NaOH → NaHCO_{3} → Na_{2}CO_{3} → Na_{2}SO_{4}$
$Na_{2}O + H_{2}O = 2NaOH$
$NaOH + CO_{2} = NaHCO_{3}$
$Na^{+} + OH^{-} + CO_{2} = Na^{+} + HCO_{3}^{-}$
$OH^{-} + CO_{2} = HCO_{3}^{-}$
$NaHCO_{3} + NaOH = Na_{2}CO_{3} + H_{2}O$
$Na^{+} + HCO_{3}^{-} + Na^{+} + OH^{-} = 2Na^{+} + CO_{3}^{2-} + H_{2}O$
$HCO_{3}^{-} + OH^{-} = CO_{3}^{2-} + H_{2}O$
$Na_{2}CO_{3} + CaSO_{4} = Na_{2}SO_{4} + CaCO_{3}$
$2Na^{+} + CO_{3}^{2-} + Ca^{2+} + SO_{4}^{2-} = 2Na^{+} + SO_{4}^{2-} + CaCO_{3}$
$Ca^{2+} + CO_{3}^{2-} = CaCO_{3}$6. Сульфат бария используют в качестве контрастного вещества при рентгеноскопии желудочно−кишечного тракта, в качестве наполнителя при изготовлении бумаги и резины, как пигмент белой краски. Какая масса 20 %−ных растворов сульфата натрия и хлорида бария потребуется для получения 93,2 кг сульфата бария?
Ответ:
Дано:
ω ($Na_{2}SO_{4}$) = 20%
ω ($BaCl_{2}$) = 20%
m ($BaSO_{4}$) = 93,2 кг
Найти:
$m_{р-ра}$ $(Na_{2}SO_{4})$ − ?
$m_{р-ра}$ $(BaCl_{2})$ − ?
Решение:
$Na_{2}SO_{4} + BaCl_{2} = BaSO_{4} + 2NaCl$
n ($BaSO_{4}$) = m : M = 93200 : 233 = 400 моль
n ($Na_{2}SO_{4}$) = n ($BaCl_{2}$) = n ($BaSO_{4}$) = 400 моль
m ($Na_{2}SO_{4}$) = n * M = 400 * 142 = 56800 г
$m_{р-ра}$ ($Na_{2}SO_{4}$) = m ($Na_{2}SO_{4}$) * 100% : ω ($Na_{2}SO_{4}$) = 284000 г = 284 кг
m ($BaCl_{2}$) = n * M = 400 * 208 = 83200 г
$m_{р-ра}$ ($BaCl_{2}$) = m * 100% : ω = 416000 г = 416 кг
Ответ: $m_{р-ра}$ ($Na_{2}SO_{4}$) = 284 кг; $m_{р-ра}$ ($BaCl_{2}$) = 416 кг.7. Железную пластинку погрузили в раствор сульфата меди (II), в результате чего её масса увеличилась на 1,3 г. Рассчитайте массу меди, выделившейся на пластинке.
Ответ:
Дано:
m = 1,3 г
Найти:
m (Cu) − ?
Решение:
$Fe + CuSO_{4} = FeSO_{4} + Cu$
Масса пластинки уменьшилась за счет растворения железа, но увеличилась за счет выделения меди:
m (Cu) − m (Fe) = 1,3 г
n (Cu) * M (Cu) − n (Fe) * M (Fe) = 1,3
n (Cu) = n (Fe)
n (M (Cu) − M (Fe)) = 1,3
n = 1,3 : ((M (Cu) − M (Fe)) = 1,3 : (64 − 56) = 0,1625 моль
m (Cu) = n * M = 0,1625 * 64 = 10,4 г
Ответ: m (Cu) = 10,4 г.Используйте дополнительную информацию
Подготовьте сообщение об областях применения и свойствах одной из солей: средней (хлорид натрия, карбонат кальция, фосфат кальция), кислой (гидрокарбонат натрия или кальция), основной (малахит). Аргументируйте свой выбор соли.
Ответ:
Области применения и свойства гидрокабоната натрия
В настоящее время сода (гидрокарбонат натрия) является ценным сырьем для стекольной, мыловаренной, текстильной, пищевой и других отраслей промышленности. Сода − это первое вещество, которое было получено искусственным путем. Ее производство дало толчок развитию целого ряда отраслей химической промышленности (получению серной кислоты, хлора, некоторых неорганических солей, минеральных удобрений и т. д.).
Сода представляет собой белую, легко растворимую соль. В своем составе она содержит воду, которая испаряется при нагревании или выветривании на воздухе. Такая, полностью потерявшая воду сода называется кальцинированной и является основным сырьем для производства других содовых продуктов. §9
-
§9. Гидролиз солей
Вопрос в начале параграфа✓
Проанализируйте этимологию слова «гидролиз». Какое определение можно дать процессу гидролиза?
Ответ:
Этимология названия процесса гидролиза (от греч. hydor — вода, lysis — разложение), а также анализ состава его участников (и вода, и соли — сложные вещества) позволяют сформулировать следующее определение.
Гидролизом называют реакции обменного взаимодействия веществ с водой, приводящие к их разложению.Вопросы (стр.50)??
1. Почему фенолфталеин не изменил окраску в растворе хлорида натрия?
Ответ:
Фенолфталеин не изменил окраску в растворе хлорида натрия, потому что хлорид натрия имеет нейтральную среду, а фенолфталеин не меняет свою окраску в нейтральной среде.
2. Какая реакция среды будет у раствора соли, образованной слабым основанием и сильной кислотой?
Ответ:
среда у раствора соли, образованной слабым основанием и сильной кислотой, будет кислая.
Вопрос (стр.51)?
Почему в таблице растворимости против формул некоторых солей стоит прочерк, означающий, что данная соль не существует в растворе?
Ответ:
В таблице растворимости против формул некоторых солей стоит прочерк, означающий, что данная соль не существует в растворе, потому что это ещё один случай гидролиза солей. Соли, образованные слабым основанием и слабой кислотой, подвергаются гидролизу как по катиону, так и по аниону.
Проверьте свои знания
1. Что называют гидролизом? Какие варианты гидролиза вы знаете?
Ответ:
Гидролизом называют реакции обменного взаимодействия веществ с водой, приводящие к их разложению.
Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону.
Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону.2. Запишите формулы некоторых солей, которым в таблице растворимости соответствуют прочерки, и уравнения реакций их гидролиза.
Ответ:
Формулы некоторых солей, которым в таблице растворимости соответствуют прочерки:
$BaS$ − сульфид бария
$CaS$ − сульфид кальция
$MgS$ − сульфид магния
$NiCO_{3}$ − карбонат никеля
$Al_{2}S_{3}$ − сульфид алюминия
$Cr_{2}S_{3}$ − сульфид хрома (III)
Уравнения реакций гидролиза:
$Al_{2}S_{3} + 6H_{2}O = 2Al(OH)_{3}↓ + 3H_{2}S↑$
$Cr_{2}S_{3} + 6H_{2}O = 2Cr(OH)_{3} + 3H_{2}S$3. Только ли кислота и основание могут в результате обмена образовать соль?
Ответ:
Реакции гидролиза (реакции с водой) могут также образовывать соль.
$Na_{2}CO_{3} + H_{2}O = NaHCO_{3} + NaOH$Примените свои знания
4. Запишите уравнения гидролиза следующих солей, укажите тип гидролиза и среду образовавшегося раствора: $Cu(NO_{3})_{2}, FeSO_{4}, ZnCl_{2}, K_{2}S, Na_{2}SiO_{3}, NH_{4}Cl, Al(NO_{3})_{3}$
Ответ:
1) $Cu(NO_{3})_{2} + H_{2}O = CuOHNO_{3} + HNO_{3}$ − гидролиз по катиону; среда кислая
2) $2FeSO_{4} + 2H_{2}O = (FeOH)_{2}SO_{4} + H_{2}SO_{4}$ − гидролиз по катиону; среда кислая
3) $ZnCl_{2} + H_{2}O = ZnOHCl + HCl$ − гидролиз по катиону; среда кислая
4) $K_{2}S + H_{2}O = KHS + KOH$ − гидролиз по аниону; среда щелочная
5) $Na_{2}SiO_{3} + H_{2}O = NaHSiO_{3} + NaOH$ − гидролиз по аниону; среда щелочная
6) $NH_{4}Cl + H_{2}O = NH_{3} * H_{2}O + HCl$ − гидролиз по катиону; среда кислая
7) $Al(NO_{3})_{3} + H_{2}O = AlOH(NO_{3})_{2} + HNO_{3}$ − гидролиз по катиону; среда кислая5. Допишите левые части уравнений реакций:
а) … = $LiHSiO_{3} + LiOH$
б) … = $MgOHBr + HBr$
в) … → $2Cr(OH)_{3} + 3H_{2}S$Ответ:
а) … = $LiHSiO_{3} + LiOH$
$Li_{2}SiO_{3} + H_{2}O = LiHSiO_{3} + LiOH$
б) … = $MgOHBr + HBr$
$MgBr_{2} + H_{2}O = MgOHBr + HBr$
в) … → $2Cr(OH)_{3} + 3H_{2}S$
$Cr_{2}S_{3} + 6H_{2}O → 2Cr(OH)_{3} + 3H_{2}S$6. Смешали растворы карбоната натрия и сульфата алюминия. При этом выделился газ и выпал осадок (объясните почему). Напишите уравнение реакции.
Ответ:
Напишем уравнение реакции:
$3Na_{2}CO_{3} + Al_{2}(SO_{4})_{3} + 3H_{2}O = 3Na_{2}SO_{4} + 2Al(OH)_{3}↓ + 3CO_{2}↑$
В данной реакции протекает двойной гидролиз (и по катиону, и по аниону).Практическая работа 1
Вариант 1
1. Докажите опытным путём состав:
а) серной кислоты;
б) хлорида железа(III).Ответ:
а) $BaCl_{2} + H_{2}SO_{4} = BaSO_{4} + 2HCl$
При взаимодействии серной кислоты с хлоридом бария образуется осадок белого цвета − сульфат бария. Качественной реакцией на сульфат−ион являются реакции с солями бария.
б) $FeCl_{3} + 3NaOH = Fe(OH)_{3} + 3NaCl$
При взаимодействии хлорида железа (III) со щелочью образуется осадок бурого цвета − гидроксид железа (III). Качественной реакцией на ионы железа являются реакции с щелочами.2. Испытайте растворы хлорида калия, карбоната калия и хлорида цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
Ответ:
1) Хлорид калия образован сильным основанием и сильной кислотой поэтому гидролизу не подвергается.
2) $K_{2}CO_{3} + H_{2}O = KOH + KHCO_{3}$
$CO_{3}^{2-} + H_{2}O = OH^{-} + HCO_{3}^{-}$
Карбонат калия гидролизуется по аниону, имеет щелочную среду. Поэтому можно использовать фенолфталеин.
3) $ZnCl_{2} + H_{2}O = ZnOHCl + HCl$
$Zn^{2+} + H_{2}O = ZnOH^{+} + H^{+}$
Хлорид цинка гидролизуется по катиону, имеет кислую среду. Поэтому можно использовать лакмус.3. Практически осуществите следующие превращения:
$CuSO_{4} → Cu(OH)_{2} → CuO → CuCl_{2} → Cu$
Оформите отчёт о наблюдениях и условиях проведения реакций. Запишите уравнения реакций с участием электролитов в молекулярной и ионной формах. Реакции с участием простых веществ рассмотрите как окислительно−восстановительные.Ответ:
$CuSO_{4} → Cu(OH)_{2} → CuO → CuCl_{2} → Cu$
1) $CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
$Cu^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = Cu(OH)_{2} + 2Na^{+} + SO_{4}^{2-}$
$Cu^{2+} + 2OH^{-} = Cu(OH)_ {2}$
2) $Cu(OH)_{2} = CuO + H_{2}O$
3) $CuO + 2HCl = CuCl_{2} + H_{2}O$
$CuO + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
4) $CuCl_{2} + Fe = FeCl_{2} + Cu$
$Cu^{2+} + 2Cl^{-} + Fe = Fe^{2+} + 2Cl^{-} + Cu$
$Cu^{2+} + Fe = Fe^{2+} + Cu$
$CuCl_{2}$ − окислитель
Fe − восстановительВариант 2
1. Докажите опытным путём состав:
а) гидроксида кальция;
б) сульфата аммония.Ответ:
а) $Ca(OH)_{2} + Na_{2}CO_{3} = CaCO_{3}↓ + 2NaOH$
При взаимодействии гидроксида кальция и карбоната образуется осадок белого цвета. Качественной реакцией на ион кальция являются карбонаты.
б) $(NH_{4})_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2NH_{3}↑ + 2H_{2}O$
При взаимодействии сульфата аммония и щелочи образуется газ − аммиак. Качественной реакцией на ион аммония являются −OH ионы.2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
Ответ:
1) Нитрат натрия образован сильным основанием и сильной кислотой, поэтому не подвергается гидролизу.
2) $Na_{2}CO_{3} + H_{2}O = NaOH + NaHCO_{3}$
Карбонат натрия гидролизуется по аниону, имеет щелочную среду. Поэтому можно использовать фенолфталеин.
3) $Zn(NO_{3})_{2} + H_{2}O = ZnOHNO_{3} + HNO_{3}$
Нитрат цинка гидролизуется по катиону, имеет кислую среду. Поэтому можно использовать лакмус.3. Практически осуществите следующие превращения:
$Fe → FeSO_{4} → Fe(OH)_{2} → FeCl_{2} → Fe(NO_{3})_{2}$
Оформите отчёт о наблюдениях и условиях проведения реакций. Запишите их уравнения для реакций с участием электролитов в молекулярной и ионной формах. Реакции с участием простых веществ рассмотрите как окислительно−восстановительные.Ответ:
$Fe → FeSO_{4} → Fe(OH)_{2} → FeCl_{2} → Fe(NO_{3})_{2}$
1) $Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}$ − окислительно−восстановительная реакция
$Fe + 2H^{+} + SO_{4}^{2-} = Fe^{2+} + SO_{4}^{2-} + H_{2}$
$Fe + 2H^{+} = Fe^{2+} + H_{2}$
2) $FeSO_{4} + 2NaOH = Fe(OH)_{2} + Na_{2}SO_{4}$
$Fe^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = Fe(OH)_{2} + 2Na^{+} + SO_{4}^{2-}$
$Fe^{2+} + 2OH^{-} = Fe(OH)_{2}$
3) $Fe(OH)_{2} + 2HCl = FeCl_{2} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + 2Cl^{-} = Fe^{2+} + 2Cl^{-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} = Fe^{2+} + 2H_{2}O$
4) $FeCl_{2} + 2AgNO_{3} = 2AgCl + Fe(NO_{3})_{2}$
$Fe^{2+} + 2Cl^{-} + 2Ag^{+} + 2NO_{3}^{-} = 2AgCl + Fe^{2+} + 2NO_{3}^{-}$ §10
-
$Ag^{+} + Cl^{-} = AgCl$ГЛАВА III. Неметаллы и их соединения
§10. Общая характеристика неметалловВопрос в начале параграфа✓
Неметаллы − это химические антонимы металлов. Какими характерными особенностями строения и свойств обладают неметаллы?
Ответ:
Атомы большинства неметаллов содержат четыре−семь электронов на внешнем электронном слое (энергетическом уровне). Для завершения электронной оболочки до устойчивого октета неметаллам проще присоединить один−четыре электрона (возникает ионная или ковалентная полярная связь) или обобществить их с атомами этого же или другого неметалла (возникает ковалентная неполярная и полярная связь), чем отдать четыре−семь валентных электронов другому атому.
Физические свойства неметаллов настолько разнообразны, что объединяет их, пожалуй, только одно: они не похожи на металлы.Проверьте свои знания
1. Чем различается строение атомов металлов и неметаллов? Укажите положение элементов−неметаллов в периодической системе Д. И. Менделеева.
Ответ:
Атомы большинства неметаллов содержат четыре−семь электронов на внешнем электронном слое (энергетическом уровне). Для завершения электронной оболочки до устойчивого октета неметаллам проще присоединить один−четыре электрона (возникает ионная или ковалентная полярная связь) или обобществить их с атомами этого же или другого неметалла (возникает ковалентная неполярная и полярная связь), чем отдать четыре−семь валентных электронов другому атому. По сравнению с атомами металлов атомы неметаллов той же группы имеют меньший радиус атома.
Таким образом, атомы неметаллов характеризуются большим числом электронов на внешнем энергетическом уровне или небольшим радиусом атома по сравнению с металлами той же группы.2. Какие типы кристаллических решёток вы знаете? Какие из них характерны для простых веществ — неметаллов? Приведите примеры неметаллов с различным типом кристаллической решётки, укажите различия в физических свойствах этих веществ.
Ответ:
Существуют ионная, молекулярная, атомная и металлическая кристаллические решетки.
Для простых веществ неметаллов характерна молекулярная кристаллическая решетка (сера, кислород, бром) или атомная кристаллическая решетка (алмаз, кремний).
Свойства веществ с молекулярной кристаллической решеткой: непрочные, летучие, легкоплавкие.
Свойства веществ с атомной кристаллической решеткой: очень твердые, очень тугоплавкие, прочные, нелетучие.3. Чем физические свойства неметаллов отличаются от физических свойств металлов? Охарактеризуйте физические свойства простых веществ кислорода, азота и водорода.
Ответ:
Физические свойства неметаллов настолько разнообразны, что объединяет их, пожалуй, только одно: они не похожи на металлы.
Какие же физические свойства отличают неметаллы от металлов? Приведём лишь некоторые из них.
1) Низкая электропроводность. Большинство неметаллов − диэлектрики, т.е. они практически не проводят электрический ток. Однако это правило не обходится без исключений. Графит, одна из аллотропных модификаций углерода, благодаря особому строению кристаллической решётки хорошо проводит электрический ток. Кремний относится к полупроводникам. Необычную электропроводность проявляет селен: при освещении он проводит электрический ток в тысячу раз лучше, чем в темноте. Учёные предложили многочисленные области применения этого свойства: селеновые фотоэлементы, вырабатывающие электрический ток при освещении; автоматические датчики, включающие уличное освещение при наступлении сумерек; фотоэкспонометры в фотоаппаратах, регистрирующие освещённость объекта съёмки. Селен входит в состав светочувствительного слоя, которым покрыты рабочие барабаны аппаратов для ксерокопирования.
2) Цвет и отсутствие металлического блеска. Неметаллы отличаются разнообразием окраски. Фтор имеет светло−жёлтую окраску, хлор − жёлто−зелёную, бром − буро−коричневую, иод − чёрно−фиолетовую, кристаллическая сера − лимонно−жёлтую. Аллотропные модификации фосфора так и называют по цвету вещества: белый, красный, чёрный фосфор. А вот металлическим блеском из неметаллов могут «похвастаться» только графит, кристаллический кремний и иод.
Кислород: бесцветный газ, тяжелее воздуха.
Азот: бесцветный газ
Водород: очень легкий бесцветный газПримените свои знания
4. В ядре атома химического элемента содержится 76 нейтронов, что на 24 единицы больше числа протонов. Что это за элемент?
Ответ:
Так как количество протонов численно равно порядковому номеру, найдем порядковы номер: 76 − 24 = 52
Порядковый номер 52 имеет теллур (Te).5. Запишите уравнения реакций между следующими веществами: а) бромом и сероводородом; б) углеродом и оксидом цинка; в) кислородом и сульфидом меди(II).
Ответ:
а) Уравнение реакции между бромом и сероводородом:
$Br_{2} + H_{2}S = 2HBr + S$
б) Уравнение реакции между углеродом и оксидом цинка:
$C + ZnO = Zn + CO$
в) Уравнение реакции между кислородом и сульфидом меди(II):
$3O_{2} + 2CuS = 2CuO + 2SO_{2}$6. Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим превращениям:
а) $NH_{3} + O_{2} → N_{2} + H_{2}O$
б) $NaOH + Br_{2} → NaBr + NaBrO_{3} + H_{2}O$
в) $Na_{2}SO_{3} + Cl_{2} + H_{2}O → Na_{2}SO_{4} + HCl$
Определите окислители и восстановители.Ответ:
а) $NH_{3} + O_{2} → N_{2} + H_{2}O$
$4N^{-3}H_{3} + 3O^{0}_{2} → 2N^{0}_{2} + 6H_{2}O^{-2}$
$2N^{-3} - 6e = N^{0}_{2}$ − восстановитель
$O^{0}_{2} + 4e = 2O^{-2}$ − окислитель
б) $NaOH + Br_{2} → NaBr + NaBrO_{3} + H_{2}O$
$6NaOH + 3Br^{0}_{2} → 5NaBr^{-1} + NaBr^{+5}O_{3} + 3H_{2}O$
$Br_{2} + 2e = 2Br^{-1}$ − окислитель
$Br_{2} - 10e = 2Br^{+5}$ − восстановитель
в) $Na_{2}SO_{3} + Cl_{2} + H_{2}O → Na_{2}SO_{4} + HCl$
$Na_{2}S^{+4}O_{3} + Cl^{0}_{2} + H_{2}O → Na_{2}S^{+6}O_{4} + 2HCl^{-1}$
$S^{+4} - 2e = S^{+6}$ − восстановитель
$Cl_{2} + 2e = 2Cl^{-1}$ − окислитель7. Какой объём углекислого газа образуется при сжигании 800 л метана $CH_{4}$ (н. у.), содержащего 5 % примесей (по объёму)?
Ответ:
Дано:
V ($CH_{4}$) = 800 л
ω (примесей) = 5%
Найти:
V ($CO_{2}$) − ?
Решение:
$CH_{4} + 2O_{2} = CO_{2} + 2H_{2}O$
ω (чист.в.) = 100% − 95% = 5%
$V_{чист}$ ($CH_{4}$) = V ($CH_{4}$) * ω (чист.в.) = 800 л * 0,95 = 760 л
n ($CH_{4}$) = V : $V_{m}$ = 760 л : 22,4 л/моль = 33,9 моль
n ($CO_{2}$) = n ($CH_{4}$) = 33,9 моль
V ($CO_{2}$) = n * $V_{m}$ = 33,9 моль * 22,4 л/моль = 760 л
Ответ: V ($CO_{2}$) = 760 л8. Серу массой 0,8 г сожгли, полученный газ растворили в 100 г раствора гидроксида натрия с массовой долей щёлочи 4%. Рассчитайте массовые доли веществ в полученном растворе.
Ответ:
Дано:
m (S) = 0,8 г
m (NaOH) = 100 г
ω = 4%
Найти:
ω ($Na_{2}SO_{3}$) − ?
ω (NaOH) − ?
Решение:
$S + O_{2} = SO_{2}$
$SO_{2} + 2NaOH = Na_{2}SO_{3} + H_{2}O$
n ($SO_{2}$) = n (S)
n (S) = m : M = 0,8 г : 32 г/моль = 0,025 моль
n ($SO_{2}$) = 0,025 моль
n (NaOH) = m * ω : M = 100 г * 0,04 : 40 г/моль = 0,1 моль
Следовательно, щелочь в избытке.
n ($Na_{2}SO_{3}$) = n ($SO_{2}$) = 0,025 моль
m ($Na_{2}SO_{3}$) = 0,025 моль * 126 г/моль = 3,15 г
m ($SO_{2}$) = 0,025 моль * 64 г/моль = 1,6 г
$m_{р-ра}$ = 100 г + 1,6 г = 101,6 г
ω ($Na_{2}SO_{3}$) = $\frac{3,15 г}{101,6 г}$ * 100% = 3%
$m_{ост}$ (NaOH) = M * (n(NaOH) − n($SO_{2}$) = 40 г/моль * 0,05 моль = 2 г
ω (NaOH) = $\frac{2 г}{101,6 г }$ * 100% = 2%
Ответ: ω ($Na_{2}SO_{3}$) = 3%; ω (NaOH) = 2%.Используйте дополнительную информацию
Подготовьте сообщение по теме «Из истории создания спичек».
Ответ:
Из истории создания спичек
Первые спички самозажигающегося типа — изобретение химика из Франции по фамилии Шансель. Ему в 1805 году удалось создать спички, которые по сравнению с нынешними были далеко не совершенны.
Изобретение француза выглядело как тонкие палочки из дерева, на одном из концов которых размещалась воспламеняющаяся головка. В ее состав входила бертолетова соль с серой. Приспособления оказались крайне дорогостоящими, вдобавок еще и опасными — серная кислота при воспламенении создавала брызги, вызывающие ожоги.
Позже были придуманы фосфорные спички. У них проявился весомый недостаток — вещество известно ядовитостью.
Замену белому фосфору было найти нелегко. Это смог сделать шведский химик Густав Эрик Паш, который в 1844 году понял одну простую вещь: если спичка загорается при механическом контакте серы и фосфора, достаточно нанести его на шершавую поверхность, о которую чиркают! §11
-
§11. Общая характеристика элементов VIIA-группы - галогенов
Вопрос в начале параграфа✓
В чём сходство и различия строения атомов галогенов? Как особенности строения атомов галогенов отражаются на их свойствах?
Ответ:
На внешнем энергетическом уровне атомов галогенов расположено семь электронов, следовательно, до получения восьмиэлектронного слоя им недостаёт только одного электрона. По этой причине галогены — сильные окислители; присоединяя недостающий электрон, их атомы приобретают степень окисления –1. С увеличением радиуса атомов от фтора к астату уменьшается электроотрицательность галогенов и, следовательно, их окислительная способность. Семь электронов на внешнем энергетическом уровне атомов галогенов позволяют предположить, что максимальная степень окисления галогенов в соединениях равна +7, в частности, в высших оксидах $Г_{2}О_{7}$, где Г — общий символ для галогенов. Этот вывод будет справедлив лишь отчасти. Дело в том, что фтор — самый электроотрицательный химический элемент и положительных степеней окисления не проявляет.
Проверьте свои знания
1. Дайте общую характеристику галогенов на основании их положения в периодической системе химических элементов Д. И. Менделеева.
Ответ:
На внешнем энергетическом уровне атомов галогенов расположено семь электронов, следовательно, до получения восьмиэлектронного слоя им недостаёт только одного электрона. По этой причине галогены — сильные окислители; присоединяя недостающий электрон, их атомы приобретают степень окисления –1. С увеличением радиуса атомов от фтора к астату уменьшается электроотрицательность галогенов и, следовательно, их окислительная способность. Семь электронов на внешнем энергетическом уровне атомов галогенов позволяют предположить, что максимальная степень окисления галогенов в соединениях равна +7.
2. Расскажите о нахождении галогенов в природе. Какова роль этих элементов в жизнедеятельности организмов?
Ответ:
• Галогены в природе встречаются только в виде соединений. Наиболее известный из них − флюорит, или плавиковый шпат, $CaF_{2}$.
• Некоторые бурые водоросли, например ламинария (морская капуста), накапливают значительное количество йода. Отсюда и польза их употребления в пищу, и использование в качестве сырья для получения этого галогена.3. Охарактеризуйте физические свойства галогенов. Как изменяется цвет и плотность галогенов в ряду $F_{2} — Cl_{2} — Br_{2} — I_{2}$?
Ответ:
При обычных условиях светло−жёлтый фтор и жёлто−зелёный хлор − газы, бром − буровато−коричневая жидкость, а йод − твёрдое чёрно−серое вещество с металлическим блеском. От фтора к йоду плотность и насыщенность окраски простых веществ увеличивается.
4. Определите вид химической связи и тип кристаллической решётки в следующих веществах: иод, хлорид калия, бромоводород.
Ответ:
Йод − ковалентная неполярная связь, молекулярная решетка.
Хлорид калия − ионная связь, ионная решетка.
Бромоводород − ковалентная полярная связь, молекулярная решетка.5. Охарактеризуйте химические свойства галогенов.
Ответ:
Химические свойства:
1) Галогены взаимодействуют с металлами с образованием солей — галогенидов.
2) Одна из важнейших реакций галогенов — их взаимодействие с водородом.
3) Усиление окислительной способности галогенов от иода к фтору проявляется в реакциях их взаимного замещения. Бром, как более активный неметалл и более сильный окислитель, способен вытеснять иод из раствора иодидов.
4) Галогены, как и некоторые другие неметаллы, способны реагировать с растворами щелочей. Важно запомнить, что состав продуктов реакции зависит от температуры.Примените свои знания
6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $NaCl → HCl → FeCl_{2} → FeCl_{3} → AgCl$
б) $KBr → Br_{2} → ZnBr_{2} → HBr → Br_{2} → NaBrO_{3}$
Для реакций, протекающих в растворах, запишите ионные уравнения. В уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.Ответ:
а) $NaCl → HCl → FeCl_{2} → FeCl_{3} → AgCl$
$NaCl + H_{2}SO_{4} = NaHSO_{4} + HCl$
$Na^{+} + Cl^{-} + 2H^{+} + SO^{2-}_{4} = Na^{+} + HSO^{-}_{4} + H^{+} + Cl^{-}$
$H^{+} + SO^{2-}_{4} = HSO^{-}_{4}$
$Fe(OH)_{2} + 2HCl = FeCl_{2} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} + Cl^{-} = Fe^{2+} + 2Cl^{-} + 2H_{2}O$
$Fe(OH)_{2} + 2H^{+} = Fe^{2+} + Cl^{-} + 2H_{2}O$
$2FeCl_{2} + Cl_{2} = 2FeCl_{3}$
$Fe^{+2} - 1e = Fe^{+3}$ − восстановитель
$Cl_{2} + 2e = 2Cl^{-}$ − окислитель
$FeCl_{3} + 3AgNO_{3} = 3AgCl + Fe(NO_{3})_{3}$
$Fe^{3+} + 3Cl^{-} + 3Ag^{+} + 3NO_{3}^{-} = 3AgCl + Fe^{3+} + 3NO_{3}^{-}$
$Cl^{-} + Ag^{+} = AgCl$
б) $KBr → Br_{2} → ZnBr_{2} → HBr → Br_{2} → NaBrO_{3}$
$2KBr + Cl_{2} = 2KCl + Br_{2}$
$2Br^{-} - 2e = Br_{2}$ − востановитель
$Cl_{2} + 2e = 2Cl^{-}$ − окислитель
$Zn + Br_{2} = ZnBr_{2}$
$Zn^{0} - 2e = Zn^{+2}$ − восстановитель
$Br_{2} + 2e = 2Br^{-}$ − окислитель
$ZnBr_{2} + H_{2}O = ZnOHBr + HBr$
$Zn^{2+} + 2Br^{-} + H_{2}O = ZnOH^{+} + Br^{-} + H^{+} + Br^{-}$
$Zn^{2+} + H_{2}O = ZnOH^{+} + H^{+}$
$H_{2} + Br_{2} = 2HBr$
$H_{2}^{0} - 2e = 2H^{+}$ − окислитель
$Br_{2} + 2e = 2Br^{-}$ − восстановитель
$4HBr + O_{2} = 2Br_{2} + 2H_{2}O$
$2Br^{-} - 2e = Br_{2}$ − востановитель
$O_{2}^{0} + 4e = 2O^{-2}$ − окислитель
$Br_{2} + 6NaOH = 5NaBr + NaBrO_{3} + 3H_{2}O$
$Br_{2} + 2e = 2Br^{-}$ − окислитель
$Br_{2} -10e = 2Br^{+5}$ − восстановитель7. Какой объём хлора (н. у.) можно получить из 100 мл 25 %−ной соляной кислоты (ρ = 1,12 г / мл) в результате реакций с двумя окислителями − перманганатом калия и оксидом марганца (IV)? Совпали ли полученные значения?
Ответ:
Дано:
V(HCl) = 100 мл
ω = 25%
ρ = 1,12 г / мл
1) $KMnO_{4}$
2) $MnO_{2}$
Найти:
V ($Cl_{2}$) − ?
Решение:
1) $2KMnO_{4} + 16HCl = 2KCl + 2MnCl_{2} + 5Cl_{2} + 8H_{2}O$
n($Cl_{2}$) = $\frac{5}{16}$ * n(HCl)
n(HCl) = V * ρ * ω : M = 100 мл * 1,12 г/мл * 0,25 : 36,5 = 0,77 моль
n($Cl_{2}$) = $\frac{5}{16}$ * 0,77 моль = 0,24 моль
V($Cl_{2}$) = $V_{m}$ * n = 22,4 л/моль * 0,24 моль = 5,4 л
2) $MnO_{2} + 4HCl = MnCl_{2} + Cl_{2} + 2H_{2}O$
n($Cl_{2}$) = $\frac{1}{4}$ * n(HCl)
n(HCl) = V * ρ * ω : M = 100 мл * 1,12 г/мл * 0,25 : 36,5 = 0,77 моль
n($Cl_{2}$) = $\frac{1}{4}$ * 0,77 моль = 0,19 моль
V($Cl_{2}$) = $V_{m}$ * n = 22,4 л/моль * 0,19 моль = 4,3 л
Ответ: при реакции с перманганатом калия − V($Cl_{2}$) = 5,4 л, при реакции с оксидом марганца (IV) − V($Cl_{2}$) = 4,3 л; полученные значения не совпали.8. Какую массу йода можно получить из 30 г иодида натрия действием избытка хлорной воды, если выход продукта реакции составляет 65 %?
Ответ:
Дано:
m (NaI) = 30 г
η = 65%
Найти: m ($I_{2}$) − ?
Решение:
$2NaI + Cl_{2} = NaCl + I_{2}$
n (NaI) = m : M = 30 г : 150 г /моль = 0,2 моль
n ($I_{2}$) = 0,5 * n (NaI) = 0,5 * 0,2 моль = 0,1 моль
n ($I_{2}$) (практ.) = 0,1 моль * 0,65 = 0,065 моль
m ($I_{2}$) = n * M = 0,065 моль * 254 г/моль = 16,5 г
Ответ: m ($I_{2}$) = 16,5 г.Используйте дополнительную информацию
Подготовьте сообщение об истории открытия, свойствах и применении одного из галогенов. Аргументируйте свой выбор галогена.
Ответ:
История открытия, свойства и приименение хлора
Хлор — элемент 17−й группы периодической таблицы химических элементов, третьего периода, с атомным номером 17.
Соединение с хлором — газообразный хлороводород — было впервые получено Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
$4HCl + MnO_{2} = Cl_{2} + MnCl_{2} + 2H_{2}O$
Хлор вступает в реакции как с металлами, так и с неметаллами, например:
$Na + Cl = NaCl$
$H_{2} + Cl_{2} = 2HCl$
Чаще всего хлор используют при производстве различного вида пластикатов, поливинилхлорида и синтетического каучука. §12
-
§12. Соединения галогенов
Вопрос в начале параграфа✓
При смешивании растворов хлорида натрия и серной кислоты не наблюдается признаков химической реакции. Однако если взять для реакции концентрированную серную кислоту и твёрдый хлорид натрия, то нетрудно заметить выделение газа с резким запахом, особенно если реакция проводится при нагревании. Почему? Как условия реакции влияют на её протекание?
Ответ:
$NaCl + H_{2}SO_{4} = NaHSO_{4} + HCl↑$ − в данной реакции выделяется газ.
При смешивании растворов хлорида натрия и серной кислоты выделение газа не происходит, поэтому реакция не идет.Лабораторный опыт 32
Возьмите три пробирки. В первую налейте 2 мл раствора хлорида натрия, во вторую − 2 мл раствора бромида натрия, и в третью − 2 мл раствора иодида натрия. В каждую пробирку добавьте по 3−4 капли раствора нитрата серебра. Что наблюдаете? Можно ли по цвету осадка определить, какой из галогенид−ионов находится в пробирке?
Ответ:
1) В первую пробирку налили 2 мл раствора хлорида натрия. Добавили 3−4 капли раствора нитрата серебра.
$NaCl + AgNO_{3} = AgCl + NaNO_{3}$
Наблюдаем выделение осадка белого цвета.
2) Во вторую пробирку налили 2 мл раствора бромида натрия. Добавили 3−4 капли раствора нитрата серебра.
$NaBr + AgNO_{3} = AgBr + NaNO_{3}$
Наблюдаем выделение осадка светло−желтого цвета.
3) В третью пробирку налили 2 мл раствора иодида натрия. Добавили 3−4 капли раствора нитрата серебра.
$NaI + AgNO_{3} = AgI + NaNO_{3}$
Наблюдаем выделение осадка желтого цвета.
Таким образом, по цвету осадка можно определить, какой из галогенид−ионов находится в пробирке.Проверьте свои знания
1. Как получают галогеноводороды в промышленности и лаборатории? Как изменяется скорость реакции синтеза галогеноводородов в зависимости от природы галогена?
Ответ:
Галогеноводороды − летучие водородные соединения.
Галогеноводороды в лаборатории обычно получают воздействием концентрированной серной кислотой на галогениды щелочных металлов:
$CaF_{2} + H_{2}SO_{4} = CaSO_{4} + 2HF$
$2NaCl + H_{2}SO_{4} = Na_{2}SO_{4} + 2HCl$
Для получения галогеноводородов в промышленности обычно используют прямой синтез из простых веществ:
$H_{2} + F_{2} = 2HF$
$H_{2} + Cl_{2} = 2HCl$
Чем более электроотрицателен галоген, тем более активно идёт реакция с водородом, так, например, реакция фтора с водородом протекает со взрывом, а реакция йода с водородом идет только при нагревании и является обратимой.2. Каков состав высших оксидов галогенов и какими свойствами они обладают? Можно ли получить эти оксиды синтезом?
Ответ:
Состав высших оксидов галогенов $Г_{2}O_{7}$. Высшие оксиды галогенов обладают кислотными свойствами.
Оксиды галогенов нельзя получить синтезом кислорода и галогенов, потому что они являются неустойчивыми соединениями и сильными окислителями.3. С помощью какого реактива можно распознать галогенид−ионы? Какой ион является исключением? Как его распознают?
Ответ:
Соли галогеноводородных кислот − галогениды представляют собой твёрдые кристаллические вещества, большинство из которых хорошо растворимо в воде. К немногочисленным исключениям из этого правила относятся хлорид, бромид и иодид серебра. На этом свойстве основано обнаружение галогенид−анионов в растворе. Соляная кислота и её соли − хлориды при добавлении раствора нитрата серебра образуют белый творожистый осадок хлорида серебра. Ионное уравнение реакции имеет вид:
$Ag^{+} + Cl^{–} = AgCl↓$
При добавлении того же реагента к раствору, содержащему бромид−анионы, образуется светло−жёлтый осадок бромида серебра :
$Ag^{+} + Br^{-} = AgBr↓$
Иодид серебра окрашен ещё интенсивнее, это осадок жёлтого цвета:
$Ag^{+} + I^{–} = AgI↓$
Таким образом, с помощью одного реагента (раствора нитрата серебра) можно провести качественные реакции на хлорид−, бромид− или иодид−анионы. А вот фторид серебра растворим в воде, поэтому фторид−анион обнаруживают с помощью другого реагента − растворимой соли кальция (выпадает белый осадок):
$Ca^{2+} + 2F^{–} = CaF_{2}↓$Примените свои знания
4. Составьте схему образования химической связи для молекул галогеноводородов. Как меняется полярность связи и прочность молекулы галогеноводородов от HF к HI?
Ответ:
Схема образования химической связи для молекул галогеноводородов:
Полярность связи и прочность молекулы от HF к HI уменьшается, потому что электроотрицательность галогенов в этом ряду уменьшается.5. Дайте сравнительную характеристику галогеноводородных кислот. Укажите черты сходства и различия. Сравнение химических свойств проиллюстрируйте уравнениями химических реакций в молекулярной и ионной формах.
Ответ:
Галогеноводородные кислоты обладают всеми свойствами сильных неорганических кислот, которые хорошо знакомы. Они реагируют с металлами, стоящими до водорода в электрохимическом ряду напряжений, основными и амфотерными оксидами, основаниями и амфотерными гидроксидами, солями.
$2HCl + Zn = ZnCl_{2} + H_{2}$
$2HBr + Zn = ZnBr_{2} + H_{2}$
$2HCl + MgO = MgCl_{2} + H_{2}O$
$2HBr + ZnO = ZnBr_{2} + H_{2}O$
$HCl + NaOH = NaCl + H_{2}O$
$2HBr + Zn(OH)_{2} = ZnBr_{2} + 2H_{2}O$
Плавиковая кислота обладает необычным свойством: она способна реагировать с оксидом кремния(IV):
$4HF + SiO_{2} = SiF_{4} + 2H_{2}O$6. В четырёх пробирках без этикеток находятся растворы фторида, хлорида, бромида и иодида натрия. Как с помощью одного реактива распознать эти вещества? Напишите уравнения соответствующих реакций.
Ответ:
Эти соли можно распознать с помощью нитрата серебра:
$AgNO_{3} + 2NaF = AgF + NaNO_{3}$ − видимых изменений нет
$AgNO_{3} + NaCl = AgCl + NaNO_{3}$ − образование белого осадка
$AgNO_{3} + NaBr = AgBr + NaNO_{3}$ − образование светло−желтого осадка
$AgNO_{3} + NaI = AgI + NaNO_{3}$ − образование желтого осадка
Таким образом, если в пробирке видимых изменений нет, то там находится раствор фторида натрия, если белый осадок − хлорид натрия, если светло−желтый осадок − бромид натрия, если желтый осадок − йодид натрия.7. Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим превращениям:
а) $Fe_{2}(SO_{4})_{3} + KI → FeSO_{4} + I_{2} + K_{2}SO_{4}$
б) $NaBr + Cl_{2} → NaCl + Br_{2}$
в) $KBr + MnO_{2} + H_{2}SO_{4} → Br_{2} + K_{2}SO_{4} + MnSO_{4} + H_{2}O$
Укажите окислители и восстановители.Ответ:
а) $Fe_{2}(SO_{4})_{3} + 2KI = 2FeSO_{4} + I_{2} + K_{2}SO_{4}$
$Fe^{+3} + 1ē ⟶ Fe^{+2}$ − окислитель
$2I^{-} - 2ē ⟶ I_{2}^{0}$ − восстановитель
б) $2NaBr + Cl_{2} = 2NaCl + Br_{2}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$2Br^{-} - 2ē ⟶ Br_{2}^{0}$ − восстановитель
в) $2KBr + MnO_{2} + 2H_{2}SO_{4} = Br_{2} + K_{2}SO_{4} + MnSO_{4} + 2H_{2}O$
$Mn^{+4} + 2ē ⟶ Mn^{+2}$ − окислитель
$2Br^{-} - 2ē ⟶ Br_{2}^{0}$ − восстановитель8. При обработке 5,30 г смеси хлорида натрия и карбоната натрия избытком соляной кислоты выделилось 784 мл газа (н. у.). Рассчитайте массовые доли компонентов в смеси.
Ответ:
Дано:
m (смеси) = 5,30 г
V ($CO_{2}$) = 784 мл = 0,784 л
Найти:
ω (NaCl) − ?
ω ($Na_{2}CO_{3}$) − ?
Решение:
$Na_{2}CO_{3} + 2HCl = 2NaCl + H_{2}O + CO_{2}$
n ($CO_{2}$) = V : $V_{m}$ = 0,784 л : 22,4 л/моль = 0,035 моль
n ($Na_{2}CO_{3}$) = n ($CO_{2}$) = 0,035 моль
m ($Na_{2}CO_{3}$) = n * M = 0,035 моль * 106 г/моль = 3,71 г
ω ($Na_{2}CO_{3}$) = $\frac{m}{m (смеси)}$ * 100% = 70%
ω (NaCl) = 100% − 70% = 30%
Ответ: ω ($Na_{2}CO_{3}$) = 70%; ω (NaCl) = 30%.9. Молярная масса бромида одновалентного металла на 31 % больше, чем молярная масса хлорида этого металла. Что это за металл?
Ответ:
Дано:
M (бромида) на 31% > M (хлорида)
Найти:
Металл − ?
Решение:
Если молярная масса бромида одновалентного металла на 31% больше, чем молярная масса хлорида этого металла, тогда:
M (MeBr) = 1,31 * M (MeCl)
M (Me) + M (Br) = 1,31 * M (Me) + M (Cl)
M (Me) + 80 = 1,31 * (M (Me) + 35,5)
M (Me) − 1,31 * M (Me) = 46,5 − 80
0,31 * M (Me) = 33,5
M (Me) = 108, следовательно, металл − серебро (Ag).
Ответ: Серебро − Ag.Используйте дополнительную информацию
1. Объём производства соляной кислоты в России составляет 1 млн т в год. Сравните эти данные с объёмом производства соляной кислоты в трёх−четырёх других странах. Результат представьте в виде диаграммы в координатах: объём производства (млн т) — страна.
Ответ:
Объем производства в разных странах:
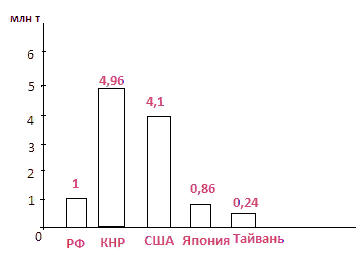
2. Подготовьте сообщение об областях применения одного из следующих веществ: а) хлорида калия; б) фторида натрия; в) бромида калия; г) хлорида кальция.
Ответ:
Фторид натрия − это неорганическое соединение с формулой NaF.
Применение фтористого натрия не ограничивается какой−либо определенной сферой промышленности. Использование химического вещества распространяется на производство лекарственных препаратов и зубной пасты. Фторид натрия в зубной пасте и препаратах используется для лечения и профилактики болезней костных тканей.
Также эту соль используют для получения алюминия в металлургии, где вещество используется для очистки металлов и создания антикоррозийного покрытия для деталей.
Фторид натрия применяют для обработки древесины, где фтористый натрий используется, как антисептик и консервант для дерева.
В сельском хозяйстве вещество используется для борьбы с вредными насекомыми.
А также фторид натрия применяют:
1) для обогащения воды фтором;
2) при производстве стеклянных и керамических изделий, эмали, огнеупоров, флюсов;
3) в лабораторных исследованиях, при которых вещество применяется в качестве реактива;
4) в фармакологии, где вещество применяется для тестирования лекарственных препаратов;
5) в биохимической отрасли, в которой фтористый натрий используется для консервации тканевых образцов;
6) при очищении газов от фторидов урана.Практическая работа 2
1. В три пробирки налейте по 1−2 мл разбавленной соляной кислоты. В первую пробирку добавьте 1−2 капли раствора лакмуса, во вторую − 1−2 капли раствора метилового оранжевого, в третью − 1−2 капли раствора фенолфталеина. Что наблюдаете? Объясните результаты.
Ответ:
$HCl = H^{+} + Cl^{-}$ − кислая среда
1) В пробирку налили 1−2 мл разбавленной соляной кислоты, добавили 1−2 капли раствора лакмуса. Лакмус в кислой среде приобретает красную окраску.
2) В пробирку налили 1−2 мл разбавленной соляной кислоты, добавили 1−2 капли раствора метилового оранжевого. Метиловый оранжевый в кислой среде приобретает розовую окраску.
3) В пробирку налили 1−2 мл разбавленной соляной кислоты, добавили 1−2 капли раствора фенолфталеина. Фенолфталеин в кислой среде приобретает бесцветную окраску.2. В первую и вторую пробирки из первого опыта добавляйте по каплям гидроксид натрия до тех пор, пока лакмус не станет фиолетовым, метиловый оранжевый — оранжевым. Сделайте вывод и напишите уравнение реакции в молекулярной и ионной формах.
Ответ:
$HCl + NaOH = NaCl + H_{2}O$
$H^{+} + Cl^{-} + Na^{+} + OH^{-} = Na^{+} + Cl^{-} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
1) В пробирку налили 1−2 мл разбавленной соляной кислоты, добавили 1−2 капли раствора лакмуса. Лакмус в кислой среде приобрел красную окраску. В пробирку добавляем по каплям гидроксид натрия до тех пор, пока лакмус не станет фиолетовым.
2) В пробирку налили 1−2 мл разбавленной соляной кислоты, добавили 1−2 капли раствора метилового оранжевого. Метиловый оранжевый в кислой среде приобретает розовую окраску. В пробирку добавляем по каплям гидроксид натрия до тех пор, пока метиловый оранжевый не станет оранжевым.
Вывод: Щелочь нейтрализует кислоту, то есть протекает реакция нейтрализации (реакция между щелочью и кислотой).3. В две пробирки налейте по 1—2 мл соляной кислоты. В одну поместите гранулу цинка, а в другую — кусочек медной проволоки (или стружки). Что наблюдаете? Объясните результаты. Напишите уравнение реакции в молекулярной и ионной формах и рассмотрите окислительно−восстановительные процессы.
Ответ:
1) В пробирку наливаем 1−2 мл соляной кислоты и добавляем гранулу цинка. Наблюдаем растворение металла и выделение газа − водорода.
$2HCl + Zn = ZnCl_{2} + H_{2}$
$2H^{+} + 2Cl^{-} + Zn = Zn^{2+} + 2Cl^{-} + H_{2}$
$2H^{+} + Zn = Zn^{2+} + H_{2}$
2) В пробирку наливаем 1−2 мл соляной кислоты и добавляем кусочек медной проволоки.
Реакция между кислотой и медью не пойдет, так как медь − металл, который после водорода в ряду активности металлов.
$HCl + Cu$ ≠4. В две пробирки налейте по 1—2 мл соляной кислоты. В первую добавьте на кончике шпателя оксид цинка. Во вторую опустите кусочек карбоната кальция (мела или мрамора). Объясните результаты наблюдений. Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
1) В пробирку нальем 1−2 мл соляной кислоты, добавим на кончике шпателя оксид цинка. Амфотерный оксид реагирует с кислотой, наблюдаем растворение твердого реагента − оксида цинка.
$2HCl + ZnO = ZnCl_{2} + H_{2}O$
$2H^{+} + 2Cl^{+} + ZnO = Zn^{2+} + 2Cl^{-} + H_{2}O$
$2H^{+} + ZnO = Zn^{2+} + H_{2}O$
2) В пробирку нальем 1−2 мл соляной кислоты, добавим кусочек карбоната кальция. В результате реакции выделяется газ − углекислый газ.
$2HCl + CaCO_{3} = CaCl_{2} + H_{2}O + CO_{2}$
$2H^{+} + 2Cl^{-} + CaCO_{3} = Ca^{2+} + 2Cl^{-} + H_{2}O + CO_{2}$
$2H^{+} + CaCO_{3} = Ca^{2+} + H_{2}O + CO_{2}$5. В пробирку налейте 1−2 мл раствора сульфата меди (II), добавьте 1−2 мл раствора гидроксида натрия. К полученному осадку добавляйте по каплям соляную кислоту до полного растворения осадка. Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
1) В пробирку налили 1−2 мл раствора сульфата меди (II), добавили 1−2 мл раствора гидроксида натрия. Образовался осадок − гидроксид меди (II).
$CuSO_{4} + 2NaOH = Cu(OH)_{2}↓ + Na_{2}SO_{4}$
$Cu^{2+} + SO^{2-}_{4} + 2Na^{+} + 2OH^{-} = Cu(OH)_{2} + 2Na^{+} + SO^{2-}_{4}$
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}$
2) К полученному осадку добавили по каплям соляную кислоту до полного растворения осадка. Образовался раствор голубого цвета.
$Cu(OH)_{2} + 2HCl = CuCl_{2} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + 2Cl^{-} = Cu^{2+} + 2Cl^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$6. В одну пробирку налейте 1−2 мл разбавленной соляной кислоты, в другую − 1−2 мл раствора хлорида натрия. В обе пробирки добавьте несколько капель раствора нитрата серебра. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
1) В пробирку налили 1−2 мл разбавленной соляной кислоты, добавили несколько капель раствора нитрата серебра. Наблюдаем образование белого творожистого осадка − хлорида серебра.
$HCl + AgNO_{3} = AgCl ↓ + HNO_{3}$
$H^{+} + Cl^{-} + Ag^{+} + NO^{-}_{3} = AgCl + H^{+} + NO^{-}_{3}$
$Cl^{-} + Ag^{+} = AgCl$
2) В пробирку налили 1−2 мл раствора хлорида натрия, добавили несколько капель раствора нитрата серебра. Наблюдаем образование белого творожистого осадка − хлорида серебра.
$NaCl + AgNO_{3} = AgCl ↓ + NaNO_{3}$
$Na^{+} + Cl^{-} + Ag^{+} + NO^{-}_{3} = AgCl + Na^{+} + NO^{-}_{3}$
$Cl^{-} + Ag^{+} = AgCl$ §13
-
§13. Халькогены. Сера
Вопрос в начале параграфа✓
Сера — типичный представитель халькогенов. Будучи неметаллом, сера способна проявлять как окислительные, так и восстановительные свойства. Какие химические свойства серы подтверждают этот вывод?
Ответ:
Принимая эти электроны от другого атома, сера проявляет окислительные свойства и приобретает минимальную степень окисления –2. Сера способна проявлять и восстановительные свойства, приобретая в результате отдачи электронов положительные степени окисления: +2 (встречается редко), +4 и максимально возможную +6.
Проверьте свои знания
1. Дайте сравнительную характеристику элементов VIA−группы на основании их положения в периодической системе Д. И. Менделеева.
Ответ:
Элементы VIА−подгруппы − халькогены − кислород, сера, селен, теллур. На внешнем энергетическом уровне они имеют 6 электронов.
От кислорода к теллуру атомный радиус увеличивается, окислительные свойства ослабевают, восстановительные − усиливаются.
Кислород проявляет степени окисления 0 и −2, сера −2, 0, +2, +4, +6, селен −2, +4, +6, теллур −2, +2, +4, +6.2. Дайте характеристику элемента серы на основании его положения в периодической системе Д. И. Менделеева.
Ответ:
Сера имеет 16 электронов. Сера − типичный неметалл. Для завершения внешнего энергетического уровня (до устойчивой 8−электронной конфигурации) сера присоединяет 2 электрона, проявляя окислительные свойства (степень окисления −2).
Сера может проявлять восстановительные свойства, приобретая степени окисления +2, +4 и +6.3. Расскажите о нахождении серы в природе. Как добывают самородную серу? Назовите формулы серосодержащих минералов.
Ответ:
Сера в природе встречается в свободном состоянии, а также в форме сульфидов и сульфатов. Важнейшие сульфиды − это минералы ZnS − сфалерит (цинковая обманка), PbS − галенит (свинцовый блеск), HgS − киноварь и $FeS_{2}$ − железный колчедан, или пирит. Наиболее известные сульфаты − это минералы $CaSO_{4}$ * $2H_{2}O$ − гипс, $2CaSO_{4}$ * $H_{2}O$ − алебастр, или полуводный гипс, а также $Na_{2}SO_{4}$ * $10H_{2}O$ − глауберова соль, или мирабилит.
Самородная сера встречается в жерлах потухших вулканов, поэтому наши предки считали её составной частью подземного мира. Из−за способности гореть, распространяя белый удушливый дым, серу отождествляли с тёмными силами.4. Охарактеризуйте аллотропные модификации серы, физические и химические свойства кристаллической серы. Ответ проиллюстрируйте уравнениями химических реакций.
Ответ:
Сера образует несколько простых веществ, способных превращаться одно в другое, т.е. для неё характерно явление аллотропии. Молекулы кристаллической серы состоят из восьми атомов, образующих замкнутое кольцо − цикл. Это твёрдые хрупкие блестящие кристаллы лимонно−жёлтого цвета, нерастворимые в воде. Если кристаллическую серу расплавить и резко охладить, вылив в холодную воду, образуется аморфная аллотропная форма этого вещества − пластическая сера. Она представляет собой тягучую массу коричневого цвета, напоминающую по консистенции жевательную резинку. Пластическая сера образована длинными цепочками атомов, связанных друг с другом.
Химические свойства
Окислительные свойства сера проявляет в отношении металлов, водорода и других менее электроотрицательных неметаллов.
1) Сера взаимодействует с большинством металлов, образуя соли − сульфиды:
$Fe + S = FeS_{2}$
2) Окислительные свойства сера проявляет и в реакции с водородом, которая протекает при нагревании:
$H_{2} + S = H_{2}S$
3) Восстановительные свойства сера проявляет в реакциях с простыми и сложными веществами. Перечень элементов, электроотрицательность которых выше, чем у серы, невелик: фтор, кислород, азот, хлор, бром.
$S + 3F_{2} = SF_{6}$Примените свои знания
5. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $H_{2}O_{2} → O_{2} → SO_{2} → SO_{3} → H_{2}SO_{4} → MgSO_{4}$
б) $KMnO_{4} → O_{2} → Li_{2}O → Li_{2}S → SO_{2}$
в) $S → ZnS → H_{2}S → SO_{2} → SO_{3} → H_{2}SO_{4} → FeSO_{4} → BaSO_{4}$
Укажите тип каждой реакции по числу и составу реагентов и образующихся веществ. Для реакций ионного обмена запишите также ионные уравнения реакций. Для окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.Ответ:
а) $H_{2}O_{2} → O_{2} → SO_{2} → SO_{3} → H_{2}SO_{4} → MgSO_{4}$
$2H_{2}O_{2} = 2H_{2}O + O_{2}$ − реакция разложения
$O^{-} + 1ē ⟶ O^{-2}$ − окислитель
$2O^{-} - 2ē ⟶ O_{2}^{0}$ − восстановитель
$O_{2} + S ⟶ SO_{2}$ − реакция соединения
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель
$2SO_{2} + O_{2} ⇄ 2SO_{3}$ − реакция соединения
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{+4} - 2ē ⟶ S^{+6}$ − восстановитель
$SO_{3} + H_{2}O ⟶ H_{2}SO_{4}$ − реакция соединения
$H_{2}SO_{4} + Mg(OH)_{2} ⟶ MgSO_{4} + 2H_{2}O$ − реакция обмена
$2H^{+} + SO_{4}^{2-} + Mg(OH)_{2} ⟶ Mg^{2+} + SO_{4}^{2-} + 2H_{2}O$
$2H^{+} + Mg(OH)_{2} ⟶ Mg^{2+} + 2H_{2}O$
б) $KMnO_{4} → O_{2} → Li_{2}O → Li_{2}S → SO_{2}$
$2KMnO_{4} = K_{2}MnO_{4} + MnO_{2} + O_{2}$ − реакция разложения
$Mn^{+7} +1ē ⟶ Mn^{+6}$ − окислитель
$O^{-2} - 4ē ⟶ O_{2}^{0}$ − восстановитель
$O_{2} + 4Li ⟶ 2Li_{2}O$ − реакция соединения
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Li^{0} - 1ē ⟶ Li^{+}$ − восстановитель
$Li_{2}O + H_{2}S ⟶ Li_{2}S + H_{2}O$ − реакция обмена
$2Li_{2}S + 3O_{2} ⟶ 2Li_{2}O + 2SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{-2} - 6ē ⟶ S^{+4}$ − восстановитель
в) $S → ZnS → H_{2}S → SO_{2} → SO_{3} → H_{2}SO_{4} → FeSO_{4} → BaSO_{4}$
$Zn + S = ZnS$ − реакция соединения
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
$S^{0} + 2ē ⟶ S{-2}$ − окислитель
$ZnS + 2HCl ⟶ ZnCl_{2} + H_{2}S$ − реакция обмена
$ZnS + 2H^{+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + H_{2}S$
$ZnS + 2H^{+} ⟶ Zn^{2+} + H_{2}S$
$2H_{2}S + 3O_{2} ⟶ 2SO_{2} + 2H_{2}O$
$S^{-2} - 6ē ⟶ S^{+4}$ − восстановитель
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$2SO_{2} + O_{2} ⟶ 2SO_{3}$ − реакция соединения
$S^{+4} - 2ē ⟶ S^{+6}$ − восстановитель
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$SO_{3} + H_{2}O ⟶ H_{2}SO_{4}$ − реакция соединения
$H_{2}SO_{4} + FeO ⟶ FeSO_{4} + H_{2}O$ − реакция обмена
$2H^{+} + SO^{2-}_{4} + FeO ⟶ Fe^{2+} + SO^{2-}_{4} + H_{2}O$
$2H^{+} + FeO ⟶ Fe^{2+} + H_{2}O$
$FeSO_{4} + BaCl_{2} ⟶ BaSO_{4} + FeCl_{2}$ − реакция обмена
$Fe^{2+} + SO^{2-}_{4} + Ba^{2+} + 2Cl^{-} ⟶ BaSO_{4} + Fe^{2+} + 2Cl^{-}$
$SO^{2-}_{4} + Ba^{2+} ⟶ BaSO_{4}$6. При взаимодействии 3,08 г металла с избытком серы получили 4,2 г сульфида этого металла в степени окисления +2. Какой металл был взят в реакцию?
Ответ:
Дано:
m (Me) = 3,08 г
m (сульфида) = 4,2 г
Найти: металл − ?
Решение:
n (Me) = n (сульфида)
n (Me) = m : M = 3,08 г : x
n (сульфида) = m : M = 4,2 г : (x + 32)
3,08 : x = 4,2 : (x + 32)
x = 88
Металл − стронций (Sr).
Ответ: в реакцию был взят стронций (Sr).7. Продукт взаимодействия 0,46 г натрия и 0,85 г серы обработали 35 мл воды, полученную смесь профильтровали. Какое вещество оказалось в растворе и какова его массовая доля?
Ответ:
Дано:
m (Na) = 0,46 г
m (S) = 0,85 г
V ($H_{2}O$) = 35 мл
Найти: вещество − ?
Решение:
n (Na) = m : M = 0,46 г : 23 г/моль = 0,02 моль − недостаток
n (S) = m : M = 0,85 г : 32 г/моль = 0,026 моль − избыток
$2Na + S = Na_{2}S$
n ($Na_{2}S$) = n (Na) : 2 = 0,01 моль
m ($Na_{2}S$) = n * M = 0,01 моль * 78 г/моль = 0,78 г
m ($H_{2}O$) = 35 г, так как 1 мл воды = 1 г воды
m (раствора) = 35 г + 0,78 г = 35,78 г
ω ($Na_{2}S$) = m ($Na_{2}S$) : m (раствора) * 100% = 0,78 г : 35,78 г * 100% = 2,2%
Ответ: В растворе оказался сульфид натрия, его массовая доля = 2,2%.Используйте дополнительную информацию
1. Используя дополнительные источники информации, расскажите о происхождении названий и истории открытия халькогенов.
Ответ:
К элементам VI главной подгруппы периодической системы элементов Д.И.Менделеева относятся кислород (O), сера (S), селен (Se), теллур (Te) и полоний (Ро). Групповое название этих элементов − халькогены (термин "халькоген" происходит от греческих слов "chalkos" − медь и "genos" − рожденный ), то есть "рождающие медные руды", обусловлено тем, что в природе они встречаются чаще всего в форме соединений меди (сульфидов, оксидов, селенидов и т.д.).
Элементы этой подгруппы − неметаллы (кроме полония Po) Химические свойства простых веществ сходны.
Селен Se − от слова "Селена" − Луна. Серое кристаллическое или красное порошкообразное вещество, по свойствам похож на серу: при горении образует оксид $SeO_{2}$ и далее − селенистую $H_{2}SeO_{3}$ и селеновую $H_{2}SeO_{4}$ кислоты. Селен имеет значительное биологическое значение: от содержания его в сетчатке глаза зависит острота зрения. Так, у орлов селена в сетчатке в 100 раз больше, чем у человека. В больших дозах селен и его соединения ядовиты.2. «Химической энциклопедией» можно назвать роман Жюля Верна «Таинственный остров». Найдите в романе отрывок, в котором упоминается производство одного из соединений серы.
Ответ:
"При получении серной кислоты промышленным путем требуются различные дорогостоящие аппараты. Строится специально предназначенное для них здание, приобретаются специальные приборы, платиновые тигли, камеры, в которых происходит преобразование, изнутри покрываются свинцом, который не поддается разрушительному действию кислот. У инженера не было ничего подобного, но он знал, что в некоторых местах, в частности в Богемии, серную кислоту изготовляют более простым способом, причем она получается даже более концентрированной. Таким именно простым способом получается дымящаяся серная кислота, известная под названием нордгаузенской, или олеума. Для того чтобы получить серную кислоту, Смит должен был провести еще одну операцию: подвергнуть действию высокой температуры в герметически закрытом сосуде кристаллы сернокислого железа, или железного купороса, чтобы серная кислота выделилась в виде паров. Сгустившись, эти пары превратятся в серную кислоту. Для прокаливания сернокислого железа и понадобились огнеупорные тигли, в которые положили кристаллы, затем герметически закупорили крышками и поставили в печь, где поддерживалась очень высокая температура, для перегонки. Операция и на этот раз удалась, и 20 мая, через двенадцать дней после начала работ, инженер имел уже довольно большое количество серной кислоты, которую он рассчитывал применять довольно часто".
§14
-
§14. Сероводород и сульфиды
Вопрос в начале параграфа✓
В сероводороде и сульфидах сера имеет минимальную степень окисления –2, следовательно, эти соединения проявляют в химических реакциях только восстановительные свойства. В какие реакции вступает сероводород и сульфиды?
Ответ:
Сероводород и сульфиды вступают в реакции окисления:
$2H_{2}S + 3O_{2} = 2SO_{2} + 2H_{2}O$
$2ZnS + 3O_{2} = 2SO_{2} + 2ZnO$Лабораторный опыт 33
В пробирку с 2 мл раствора сульфида натрия добавьте 2 мл соляной кислоты. Осторожно понюхайте содержимое пробирки. Что ощущаете? О чём свидетельствует появившийся запах? Немедленно поместите пробирку в вытяжной шкаф.
Ответ:
$Na_{2}S + 2HCl = 2NaCl + H_{2}S$
В пробирку с 2 мл раствора сульфида натрия добавили 2 мл соляной кислоты. Осторожно понюхали содержимое пробирки.
В результате реакции выделяется газ с запахом тухлых яиц − сероводород. Появившийся запах свидетельствует о том, что реакция между сульфидом натрия и соляной кислотой идет.Проверьте свои знания
1. Составьте схему образования химической связи в молекуле сероводорода.
Ответ:
Схема образования химической связи в молекуле сероводорода:

2. Охарактеризуйте физические и химические свойства сероводорода.
Ответ:
Сероводород очень ядовит! Вдыхание воздуха с небольшим его содержанием вызывает головокружение, головную боль, тошноту. Острое отравление человека наступает при концентрациях 0,2—0,3 мг / л, концентрация выше 1 мг / л — смертельна.
Сероводородная кислота реагирует со щелочами, образуя соли — сульфиды:
$H_{2}S + 2NaOH = Na_{2}S + H_{2}O$
Восстановительные свойства сероводород сохраняет и в водном растворе. При действии на сероводородную кислоту окислителей, например раствора брома в воде (бромной воды), образуется сера, выпадающая в осадок:
$H_{2}S + Br_{2} = S↓ + 2HBr$
Более сильные окислители способны окислять сероводород до оксида серы (IV) и даже до серной кислоты:
$H_{2}S + 3H_{2}SO_{4} = 4SO_{2}↑ + 4H_{2}O$
$H_{2}S + 8HNO_{3} = H_{2}SO_{4} + 8NO_{2}↑ + 4H_{2}O$3. Запишите сокращённые ионные уравнения качественных реакций на сульфид−ион и сульфат−ион.
Ответ:
Качественная реакция на сульфид−ион:
$Pb^{2+} + S^{2–} = PbS↓$
Качественная реакция на сульфат−ион:
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}$Примените свои знания
4. Напишите молекулярные и ионные уравнения реакций сероводородной кислоты с хлорной водой, гидроксидом лития, нитратом свинца (II), оксидом серы (IV). В уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
Ответ:
1) Реакция сероводородной кислоты с хлорной водой:
$H_{2}S + Cl_{2} ⟶ S↓ + 2HCl$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$S^{-2} - 2ē ⟶ S^{0}$ − восстановитель
2) Реакция сероводородной кислоты с гидроксидом лития:
$H_{2}S + 2LiOH ⟶ Li_{2}S + 2H_{2}O$
$H_{2}S + 2Li^{+} + 2OH^{-} ⟶ 2Li^{+} + S^{2-} + 2H_{2}O$
$H_{2}S + 2OH^{-} ⟶ S^{2-} + 2H_{2}O$
3) Реакция сероводородной кислоты с нитратом свинца (II):
$H_{2}S + Pb(NO_{3})_{2} ⟶ 2HNO_{3} + PbS↓$
$H_{2}S + Pb^{2+} + 2NO_{3}^{-} ⟶ 2H^{+} + 2NO_{3}^{-} + PbS↓$
$H_{2}S + Pb^{2+} ⟶ 2H^{+} + PbS↓$
4) Реакция сероводородной кислоты с оксидом серы (IV):
$2H_{2}S + SO_{2} ⟶ 3S + 2H_{2}O$
$S^{+4} + 4ē ⟶ S^{0}$ − окислитель
$S^{-2} - 2ē ⟶ S^{0}$ − восстановитель5. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: $ZnS → H_{2}S → S → FeS → SO_{2}$
Для окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.Ответ:
$ZnS + 2HCl ⟶ ZnCl_{2} + H_{2}S↑$
$ZnS + 2H^{+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + H_{2}S↑$
$ZnS + 2H^{+} ⟶ Zn^{2+} + H_{2}S↑$
$2H_{2}S + SO_{2} ⟶ 3S↓ + 2H_{2}O$
$S^{+4} + 4ē ⟶ S^{0}$ − окислитель
$S^{-}2 - 2ē ⟶ S^{0}$ − восстановитель
$S + Fe ⟶ FeS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
$2FeS + 3O_{2} ⟶ 2FeO + 2SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ окислитель
$S^{-2} - 6ē ⟶ S^{+4}$ восстановитель6. Напишите по одному молекулярному уравнению реакции, соответствующему каждому из следующих ионных уравнений:
а) $H_{2}S + OH^{-} = HS^{-} + H_{2}O$
б) $H_{2}S + 2OH^{-} = S^{2-} + 2H_{2}O$
в) $HS^{-} + OH^{-} = S^{2-} + H_{2}O$
г) $S^{2-} + Cu^{2+} = CuS↓$Ответ:
а) Молекулярное уравнение реакции, соответствующее следующему ионному уравнению $H_{2}S + OH^{-} = HS^{-} + H_{2}O$:
$H_{2}S + NaOH = NaHS + H_{2}O$
б) Молекулярное уравнение реакции, соответствующее следующему ионному уравнению $H_{2}S + 2OH^{-} = S^{2-} + 2H_{2}O$:
$H_{2}S + 2NaOH = Na_{2}S + 2H_{2}O$
в) Молекулярное уравнение реакции, соответствующее следующему ионному уравнению $HS^{-} + OH^{-} = S^{2-} + H_{2}O$:
$KHS + KOH = K_{2}S + H_{2}O$
г) Молекулярное уравнение реакции, соответствующее следующему ионному уравнению $S^{2-} + Cu^{2+} = CuS↓$:
$K_{2}S + CuSO_{4} = K_{2}SO_{4} + CuS↓$7. В химической реакции, протекающей по уравнению
$2H_{2}S + Cl_{2} = 2S + 2HCl$,
концентрация газообразного хлора за 3 мин уменьшилась с 0,063 моль/л до 0,027 моль/л. Рассчитайте скорость химической реакции в данный промежуток времени.Ответ:
Дано:
t = 3 мин
$C_{1}$ = 0,063 моль/л
$C_{2}$ = 0,027 моль/л
Найти:
V − ?
Решение:
t = 3 мин = 180 с
V = $\frac{C_{1} - C_{2}}{t}$ = $\frac{0,063 - 0,027}{180}$ = 0,0002 $\frac{моль}{л\;* \;с}$ = 0,2 $\frac{ммоль}{л\;* \;с}$
Ответ: V = 0,2 $\frac{ммоль}{л\;*\;с}$.8. В состав белой краски (свинцовых белил), нередко использовавшейся ранее для написания икон, входил сульфат свинца (II). Спустя длительное время белая краска таких икон чернела из−за взаимодействия сульфата свинца с сероводородом. Образующийся сульфид свинца (II) − соль чёрного цвета. Для восстановления белых тонов икону обрабатывали раствором пероксида водорода, при этом сульфид свинца (II) вновь окислялся до сульфата свинца (II). Составьте уравнение этой реакции, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
Ответ:
$PbS + 4H_{2}O_{2} ⟶ PbSO_{4} + 4H_{2}O$
$2O^{-1} + 2ē ⟶ 2O^{-2}$ − окислитель
$S^{-2} - 8ē ⟶ S^{+6}$ − восстановительИспользуйте дополнительную информацию
Подготовьте сообщение о нахождении в природе, свойствах, областях применения и получении сероводорода.
Ответ:
Сероводород очень ядовит! Вдыхание воздуха с небольшим его содержанием вызывает головокружение, головную боль, тошноту. Острое отравление человека наступает при концентрациях 0,2−0,3 мг / л, концентрация выше 1 мг/л − смертельна. При отравлении сероводородом пострадавшего необходимо немедленно вынести на свежий воздух. Однако в небольших концентрациях сероводород полезен. Так, сероводородные ванны используют в медицине для лечения заболеваний кожи, опорно−двигательного аппарата, сердечно−сосудистой системы и др.
В природе сероводород содержится в попутных газах нефтяных месторождений, в природном и вулканическом газах. Он может содержаться в подземных водах, выходящих на поверхность в виде минеральных источников. Сероводород образуется также при разложении белковых веществ, поэтому его запах ассоциируется с запахом тухлых яиц.В промышленности сероводород образуется в качестве побочного продукта при переработке нефти, природного газа, каменного угля. Выбрасывать в атмосферу его нельзя из−за высокой токсичности. Очищают промышленные выбросы от сероводорода, окисляя его до серы.
В качестве окислителя используют оксид серы (IV):
$2H_{2}S + SО_{2} = 3S↓ + 2H_{2}O$
Если в качестве окислителя используют кислород воздуха, то воздух берут в недостаточном количестве:
$2H_{2}S + О_{2} = 2S↓ + 2H_{2}O$
В избытке же кислорода сероводород горит с образованием оксида серы (IV) и водяных паров:
$2H_{2}S + 3О_{2} = 2SО_{2} + 2H_{2}O$
В указанных процессах сероводород проявляет сильные восстановительные свойства. В лабораторных условиях сероводород получают реакцией обмена между сульфидом металла (чаще всего сульфидом железа (II)) и разбавленной серной кислотой:
$FeS + H_{2}SО_{4} = H_{2}S↑ + FeSO_{4}$
Сероводород малорастворим в воде, его раствор называют сероводородной кислотой. §15
-
§15. Кислородные соединения серы
Вопрос в начале параграфа✓
В соединениях с кислородом сера проявляет степени окисления +4 и +6. Какими свойствами характеризуются эти соединения? Какие из этих веществ проявляют только окислительные свойства, а какие − и окислительные, и восстановительные?
Ответ:
Оксид серы (IV) и оксид серы (VI) проявляют кислотные свойства, но у оксида серы (VI) они более выражены.
• Взаимодействуют с водой, при этом с оксидом серы (IV) образуется слабая сернистая кислота, а с оксидом серы (VI) – сильная серная кислота:
$SO_{2} + H_{2}O ⇄ H_{2}SO_{3}$
$SO_{3} + H_{2}O ⟶ H_{2}SO_{4}$
• Взаимодействуют с основными оксидами:
$SO_{2} + Na_{2}O ⟶ Na_{2}SO_{3}$
• Взаимодействуют с щелочами:
$SO_{2} + 2NaOH ⟶ Na_{2}SO_{3} + H_{2}O$
Оксид серы (IV) и оксид серы (VI) проявляют окислительные свойства:
$SO_{2} + 2H_{2}S ⟶ 3S + 2H_{2}O$
$2SO_{3} ⇄ 2SO_{2} + O_{2}$
Оксид серы (IV) проявляет восстановительные свойства.Лабораторный опыт 34
В одну пробирку налейте 2 мл раствора сульфата натрия, в другую − 2 мл раствора серной кислоты. Затем прилейте в каждую пробирку по 1 мл раствора хлорида бария. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций.
Ответ:
1) В пробирку налили 2 мл раствора сульфата натрия, затем прилили 1 мл раствора хлорида бария.
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4} ↓$
$2Na^{+} + SO^{2-}_{4} + Ba^{2+} + 2Cl^{-} = 2Na^{+} + 2Cl^{-} + BaSO_{4}$
$SO^{2-}_{4} + Ba^{2+} = BaSO_{4}$
2) В пробирку налили 2 мл раствора серной кислоты, затем прилили 1 мл раствора хлорида бария.
$H_{2}SO_{4} + BaCl_{2} = 2HCl + BaSO_{4} ↓$
$2H^{+} + SO^{2-}_{4} + Ba^{2+} + 2Cl^{-} = 2H^{+} + 2Cl^{-} + BaSO_{4}$
$SO^{2-}_{4} + Ba^{2+} = BaSO_{4}$
В обоих пробирках наблюдаем образование осадка белого цвета − сульфата бария.Проверьте свои знания
1. Дайте сравнительную характеристику оксидов серы в степенях окисления +4 и +6. Свой ответ проиллюстрируйте уравнениями химических реакций в молекулярной и ионной формах.
Ответ:
Оксид серы (IV) и оксид серы (VI) проявляют кислотные свойства, но у оксида серы (VI) они более выражены.
• Взаимодействуют с водой, при этом с оксидом серы (IV) образуется слабая сернистая кислота, а с оксидом серы (VI) – сильная серная кислота:
$SO_{2} + H_{2}O ⇄ H_{2}SO_{3}$
$SO_{3} + H_{2}O ⟶ H_{2}SO_{4}$
• Взаимодействуют с основными оксидами:
$SO_{2} + Na_{2}O ⟶ Na_{2}SO_{3}$
• Взаимодействуют с щелочами:
$SO_{2} + 2NaOH ⟶ Na_{2}SO_{3} + H_{2}O$
Оксид серы (IV) и оксид серы (VI) проявляют окислительные свойства.
$SO_{2} + 2H_{2}S ⟶ 3S + 2H_{2}O$
$2SO_{3} ⇄ 2SO_{2} + O_{2}$
Оксид серы (IV) проявляет восстановительные свойства.2. Дайте характеристику сернистой кислоты и её солей. Как распознать сульфит−ион?
Ответ:
Сернистая кислота $H_{2}SO_{3}$ − неорганическая кислота средней силы, которая существует только в разбавленных водных растворах. При попытке выделить эту кислоту в чистом виде или при незначительном нагревании раствора происходит разложение вещества, т.е. реакция, обратная образованию кислоты из оксида серы (IV) и воды:
$H_{2}SO_{3} = SO_{2}↑ + H_{2}O$
Сернистая кислота, как и соответствующий ей оксид серы (IV), проявляет сильные восстановительные свойства и также применяется для отбеливания различных материалов.
Соли сернистой кислоты − сульфиты. Большинство солей сернистой кислоты малорастворимо или нерастворимо в воде. Исключения составляют растворимые сульфиты щелочных металлов и аммония. При действии на сульфиты сильных кислот в результате реакции ионного обмена образуется сернистая кислота, которая при незначительном нагревании распадается на воду и сернистый газ. Эту реакцию используют для лабораторного получения оксида серы (IV).
Благодаря наличию атомов серы в степени окисления +4 сульфиты металлов проявляют сильные восстановительные свойства.
При взаимодействии с катионами бария сульфит−ионы образуют белый кристаллический осадок сульфита бария $BaSO_{3}$:
$BaCl_{2} + Na_{2}SO_{3} = BaSO_{3} + 2NaCl$
$Ba^{2+} + SO_{3}^{2–} = BaSO_{3}$
Это качественная реакция на сульфит−ионы.3. Дайте характеристику серной кислоты и её солей. Как распознать сульфат−ион?
Ответ:
Серная кислота хорошо растворяется в воде. Напомним, что при разбавлении серную кислоту приливают в воду, а не наоборот. Такой порядок смешивания веществ обусловлен тем, что при растворении серной кислоты в воде выделяется большое количество теплоты и порция воды, добавленная в кислоту, может закипеть, разбрызгивая едкую жидкость. В разбавленном водном растворе серная кислота − сильный электролит. Такой раствор проявляет все свойства кислот, обусловленные присутствием катионов водорода. Свойства концентрированной серной кислоты значительно отличаются от свойств разбавленной. Концентрированная серная кислота − сильное водоотнимающее средство. Она обугливает бумагу, ткани, древесину, оставляет на коже глубокие, долго не заживающие ожоги.
Соли серной кислоты − сульфаты. В противоположность сульфитам большинство солей серной кислоты (за исключением сульфатов щелочноземельных металлов и свинца) растворимо в воде. Сульфаты склонны к образованию кристаллогидратов. Качественной реакцией на сульфат−ион служит взаимодействие с раствором хлорида или нитрата бария:
$Ba^{2+} + SO_{4}^{2−} = BaSO_{4}↓$4. Почему свойства разбавленной и концентрированной серной кислоты различаются?
Ответ:
В разбавленном водном растворе серная кислота − сильный электролит. Такой раствор проявляет все свойства кислот, обусловленные присутствием катионов водорода. Свойства концентрированной серной кислоты значительно отличаются от свойств разбавленной. Во−первых, концентрированная серная кислота − сильное водоотнимающее средство. Она обугливает бумагу, ткани, древесину, оставляет на коже глубокие, долго не заживающие ожоги. Во−вторых, концентрированная серная кислота − сильный окислитель. Она способна взаимодействовать с металлами, стоящими в электрохимическом ряду напряжений как до, так и после водорода. В таких реакциях серная кислота является окислителем за счёт атомов серы в высшей степени окисления +6, поэтому в результате взаимодействия образуются продукты восстановления серы.
5. Какое правило должно соблюдаться при разбавлении серной кислоты?
Ответ:
При разбавлении серную кислоту приливают в воду, а не наоборот. Такой порядок смешивания веществ обусловлен тем, что при растворении серной кислоты в воде выделяется большое количество теплоты и порция воды, добавленная в кислоту, может закипеть, разбрызгивая едкую жидкость.
Примените свои знания
6. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $S → SO_{2} → SO_{3} → Na_{2}SO_{4} → BaSO_{4}$
б) $H_{2}SO_{4} → SO_{2} → K_{2}SO_{3} → MgSO_{3} → SO_{2}$
Для реакций, протекающих в растворах, запишите ионные уравнения, а в уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.Ответ:
а) $S → SO_{2} → SO_{3} → Na_{2}SO_{4} → BaSO_{4}$
$S + O_{2} = SO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель
$2SO_{2} + O_{2} = 2SO_{3}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$S^{+4} - 2ē ⟶ S^{+6}$ − восстановитель
$SO_{3} + 2NaOH = Na_{2}SO_{4} + H_{2}O$
$SO_{3} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + H_{2}O$
$SO_{3} + 2OH^{-} ⟶ SO_{4}^{2-} + H_{2}O$
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}↓$
б) $H_{2}SO_{4} → SO_{2} → K_{2}SO_{3} → MgSO_{3} → SO_{2}$
$Cu + 2H_{2}SO_{4} = CuSO_{4} + SO_{2}↑ + 2H_{2}O$
$S^{+6} + 2ē ⟶ S^{+4}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель
$SO_{2} + 2KOH = K_{2}SO_{3} + H_{2}O$
$SO_{2} + 2K^{+} + 2OH^{-} ⟶ 2K^{+} + SO_{3}^{2-} + H_{2}O$
$SO_{2} + 2OH^{-} ⟶ SO_{3}^{2-} + H_{2}O$
$K_{2}SO_{3} + MgCl_{2} = 2KCl + MgSO_{3}$
$2K^{+} + SO_{3}^{2-} + Mg^{2+} + 2Cl^{-} ⟶ 2K^{+} + 2Cl^{-} + MgSO_{3}$
$Mg^{2+} + SO_{3}^{2-} ⟶ MgSO_{3}$
$MgSO_{3} = MgO + SO_{2}↑$7. Массовые доли химических элементов в соли составляют: калий — 49,4 %, сера — 20,2 %, кислород — 30,4 %. Определите формулу соли, назовите её.
Ответ:
Дано:
ω (K) = 49,4%
ω (S) = 20,2%
ω (O) = 30,4%
Найти: формула − ?
Решение:
x : y : z = ω (K) : ω (S) : ω (O) = 0,494 : 0,202 : 0,304 = 2 : 1 : 3
Следовательно, формула соединения − $K_{2}SO_{3}$ − сульфит калия.
Ответ: $K_{2}SO_{3}$ − сульфит калия.8. В 1960 г 5 %−ного раствора серной кислоты растворили 2,24 л аммиака (н. у.). Рассчитайте массовую долю соли в полученном растворе.
Ответ:
Дано:
m ($H_{2}SO_{4}$) = 1960 г
ω = 5%
V ($NH_{3}$) = 2,24 л
Найти: ω ($NH_{4}HSO_{4}$) − ?
Решение:
$H_{2}SO_{4} + NH_{3} = NH_{4}HSO_{4}$
m ($H_{2}SO_{4}$) = 1960 г * 0,05 = 98 г
n ($H_{2}SO_{4}$) = m : M = 98 г : 98 г/моль = 1 моль
n ($NH_{3}$) = V : $V_{m}$ = 2,24 л : 22,4 л/моль = 0,1 моль
Следоватлеьно, серная кислота в избытке.
n ($NH_{4}HSO_{4}$) = n ($NH_{3}$) = 0,1 моль
m ($NH_{4}HSO_{4}$) = n * M = 0,1 моль * 115 г/моль = 11,5 г
ω ($NH_{4}HSO_{4}$) = m ($NH_{4}HSO_{4}$) : $m_{(р-ра)}$ * 100%
m ($NH_{3}$) = n * M = 0,1 моль * 17 г/моль = 1,7 г
m (р−ра) = m ($H_{2}SO_{4}$) + m ($NH_{4}HSO_{4}$) = 1960 г + 1,7 г = 1961,7 г
ω ($NH_{4}HSO_{4}$) = 11,5 г : 1961,7 г * 100% = 0,57%
Ответ: ω ($NH_{4}HSO_{4}$) = 0,57%.9. Железную пластинку погрузили в раствор сульфата меди (II). Через некоторое время масса пластинки увеличилась на 0,4 г. Вычислите массу меди, выделившейся на пластинке.
Ответ:
Дано:
m = 0,4 г
Найти:
m (Cu) − ?
Решение:
$CuSO_{4} + Fe = FeSO_{4} + Cu$
n = n (Fe) = n (Cu)
$m_{2} = m_{1} + m (Cu) - m (Fe)$
$m_{2} = m_{1}$ + n * (M (Cu) − M (Fe))
$m_{1}$ + n * (64 − 56) − $m_{1}$ = 0,4
8 * n = 0,4
n = 0,05 моль
m (Cu) = M * n = 64 г/моль * 0,05 моль = 3,2 г
Ответ: m (Cu) = 3,2 г.10. Массовая доля воды в кристаллогидрате сульфата железа (II), который называют железным купоросом, составляет 45,3%. Выведите формулу кристаллогидрата.
Ответ:
Дано:
ω ($H_{2}O$) = 45,3%
Найти:
Формула − ?
Решение:
m ($FeSO_{4}$) : m ($H_{2}O$) = ($A_{r}$ ($FeSO_{4}$)) : (x * $A_{r} (H_{2}O$))
(100 − 45,3) : 45,3 = 152 : (18 * x)
x = $\frac{152\;*\;45,3}{18\;*\;(100\;-\;45,3)}$
x = 7
Формула кристаллогидрата : $FeSO_{4}$ * $7H_{2}O$.
Ответ: $FeSO_{4}$ * $7H_{2}O$.11. В трёх пробирках без этикеток находятся растворы сульфида, сульфита и сульфата калия. Как с помощью одного реактива распознать эти вещества? Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
Распознать растворы сульфида, сульфита и сульфата калия можно с помощью соляной кислоты.
• С сульфидом калия будет выделяться газ имеющий запах тухлых яиц:
$K_{2}S + 2HCl ⟶ 2KCl + H_{2}S↑$
$2K^{+} + S^{2-} + 2H^{+} + 2Cl^{-} ⟶ 2K^{+} + 2Cl^{-} + H_{2}S↑$
$2H^{+} + S^{2-} ⟶ H_{2}S↑$
• С сульфитом калия будет выделяться газ имеющий резкий запах:
$K_{2}SO_{3} + 2HCl ⟶ 2KCl + H_{2}O + SO_{2}↑$
$2K^{+} + SO_{3}^{2-} + 2H^{+} + 2Cl^{-} ⟶ 2K^{+} + 2Cl^{-} + H_{2}O + SO_{2}↑$
$2H^{+} + SO_{3}^{2-} ⟶ H_{2}O + SO_{2}↑$
• С сульфатом калия изменений не будет, так как реакция не идет:
$K_{2}SO_{4} + HCl$ ≠12. Разделите лист бумаги пополам вертикальной линией. Напишите уравнения восьми реакций, характеризующих химические свойства серной кислоты, так, чтобы левая часть равенства оказалась на левой половине листа, знак равенства — на черте, а правая часть уравнения — на правой половине листа. Разрежьте лист по линии, две половинки отдайте двум своим одноклассникам. Их задача — восстановить недостающие половины уравнений реакций. Проверьте их работу, поставьте свою отметку. Допишите уравнения реакций по половинкам листов, полученных от двух других одноклассников.
Ответ:
1) $H_{2}SO_{4} + Zn$ = $ZnSO_{4} + H_{2}$
2) $H_{2}SO_{4} + CuO$ = $CuSO_{4} + H_{2}O$
3) $H_{2}SO_{4} + 2NaOH$ = $Na_{2}SO_{4} + 2H_{2}O$
4) $H_{2}SO_{4} + CaO$ = $CaSO_{4} + H_{2}O$
5) $H_{2}SO_{4} + Na_{2}CO_{3}$ = $Na_{2}SO_{4} + CO_{2} + H_{2}O$
6) $H_{2}SO_{4} + BaCl_{2}$ = $BaSO_{4} + 2HCl$
7) $H_{2}SO_{4} + Mg$ = $MgSO_{4} + H_{2}$
8) $H_{2}SO_{4} + 2KOH$ = $K_{2}SO_{4} + 2H_{2}O$Практическая работа 3
1. В три пробирки налейте по 1−2 мл разбавленной серной кислоты. В первую пробирку добавьте 1−2 капли раствора лакмуса, во вторую − 1−2 капли раствора метилового оранжевого, в третью − 1−2 капли раствора фенолфталеина. Что наблюдаете? Объясните результаты.
Ответ:
$H_{2}SO_{4} = H^{+} + SO_{4}^{2-}$ − кислая среда
1) В пробирку налили 1−2 мл разбавленной серной кислоты, добавили 1−2 капли раствора лакмуса. Лакмус в кислой среде приобретает красную окраску.
2) В пробирку налили 1−2 мл разбавленной серной кислоты, добавили 1−2 капли раствора метилового оранжевого. Метиловый оранжевый в кислой среде приобретает розовую окраску.
3) В пробирку налили 1−2 мл разбавленной серной кислоты, добавили 1−2 капли раствора фенолфталеина. Фенолфталеин в кислой среде приобретает бесцветную окраску.2. В первую и вторую пробирки из первого опыта добавляйте по каплям гидроксид натрия до тех пор, пока лакмус не станет фиолетовым, метиловый оранжевый − оранжевым. Сделайте вывод и напишите уравнение реакции в молекулярной и ионной формах.
Ответ:
$H_{2}SO_{4} + 2NaOH = Na_{2}SO_{4} + 2H_{2}O$
$H^{+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} = 2Na^{+} + SO_{4}^{2-} + 2H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
1) В первую пробирку наливали 1−2 мл разбавленной серной кислоты, добавили 1−2 капли раствора лакмуса. Лакмус в кислой среде приобрел красную окраску.
В пробирку добавляем по каплям гидроксид натрия до тех пор, пока лакмус не станет фиолетовым.
2) Во вторую пробирку наливали 1−2 мл разбавленной серной кислоты, добавили 1−2 капли раствора метилового оранжевого. Метиловый оранжевый в кислой среде приобрел розовую окраску.
В пробирку добавляем по каплям гидроксид натрия до тех пор, пока метиловый оранжевый не станет оранжевым.
Щелочь нейтрализует кислоту, то есть протекает реакция нейтрализации (реакция между щелочью и кислотой).3. В две пробирки налейте по 1—2 мл раствора серной кислоты. В одну поместите гранулу цинка, а в другую — кусочек медной проволоки (или стружки). Что наблюдаете? Объясните результаты. Напишите уравнение реакции в молекулярной и ионной формах. Рассмотрите окислительно−восстановительные процессы.
Ответ:
1) В пробирку наливаем 1−2 мл серной кислоты и добавляем гранулу цинка. Наблюдаем растворение металла и выделение газа − водорода.
$H_{2}SO_{4} + Zn = ZnSO_{4} + H_{2}$
$2H^{+} + SO_{4}^{2-} + Zn = Zn^{2+} + SO_{4}^{2-} + H_{2}$
$2H^{+} + Zn = Zn^{2+} + H_{2}$
2) В пробирку наливаем 1−2 мл серной кислоты и добавляем кусочек медной проволоки.
Реакция между кислотой и медью не пойдет, так как медь − металл после водорода в ряду активности металлов.
$H_{2}SO_{4} + Cu$ ≠4. В две пробирки налейте по 1−2 мл раствора серной кислоты. В первую добавьте на кончике шпателя оксид меди (II), во вторую − на кончике шпателя порошок карбоната натрия (техническую соду). Объясните результаты. Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
1) В пробирку нальем 1−2 мл серной кислоты, добавим на кончике шпателя оксид меди. Оксид реагирует с кислотой, наблюдаем растворение твердого реагента − оксида меди:
$H_{2}SO_{4} + CuO = CuSO_{4} + H_{2}O$
$2H^{+} + SO_{4}^{2-} + CuO = Cu^{2+} + SO_{4}^{2-} + H_{2}O$
$2H^{+} + CuO = Cu^{2+} + H_{2}O$
2) В пробирку нальем 1−2 мл серной кислоты, добавим кусочек карбоната натрия. В результате реакции выделяется газ − углекислый газ:
$H_{2}SO_{4} + Na_{2}CO_{3} = Na_{2}SO_{4} + H_{2}O + CO_{2}$
$2H^{+} + SO_{4}^{2-} + 2Na^{+} + CO^{2-}_{3} = 2Na^{+} + SO_{4}^{2-} + H_{2}O + CO_{2}$
$2H^{+} + CO^{2-}_{3} = H_{2}O + CO_{2}$5. В пробирку налейте 1−2 мл раствора сульфата меди (II), добавьте 1−2 мл раствора гидроксида натрия. К полученному осадку добавляйте по каплям серную кислоту до полного растворения осадка. Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
1) В пробирку налили 1−2 мл раствора сульфата меди (II), добавили 1−2 мл раствора гидроксида натрия. Образовался осадок − гидроксид меди (II).
$CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
$Cu^{2+} + SO^{2-}_{4} + 2Na^{+} + 2OH^{-} = Cu(OH)_{2} + 2Na^{+} + SO^{2-}_{4}$
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}$
2) К полученному осадку добавили по каплям серную кислоту до полного растворения осадка. Образовался раствор голубого цвета.
$Cu(OH)_{2} + H_{2}SO_{4} = CuSO_{4} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + SO_{4}^{2-} = Cu^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$6. В одну пробирку налейте 1−2 мл раствора серной кислоты, в другую − 1−2 мл раствора сульфата натрия. В обе пробирки добавьте несколько капель раствора хлорида бария. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Ответ:
1) В пробирку налили 1−2 мл серной кислоты, добавили несколько капель раствора хлорида бария. Наблюдаем образование белого осадка − сульфата бария.
$H_{2}SO_{4} + BaCl_{2} = BaSO_{4}↓ + 2HCl$
$2H^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = BaSO_{4} + 2H^{+} + 2Cl^{-}$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}$
2) В пробирку налили 1−2 мл сульфата натрия, добавили несколько капель раствора хлорида бария. Наблюдаем образование белого осадка − сульфата бария.
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} = BaSO_{4} + Na^{+} + 2Cl^{-}$
$Ba^{2+} + SO_{4}^{2-} = BaSO_{4}$ §16
-
§16. Общая характеристика элементов VA-группы. Азот
Вопрос в начале параграфа✓
Шотландский учёный Даниель Резерфорд в 1772 г. проводил эксперименты по сжиганию под стеклянным колпаком древесного угля, серы и фосфора. Продукты горения поглощались раствором щёлочи. Резерфорд установил, что остающаяся после эксперимента часть воздуха — это газ, в котором свеча не горит, а мышь гибнет. О каком газе идёт речь?
Ответ:
Газ, в котором свеча не горит, а мышь гибнет − азот ($N_{2}$).
Проверьте свои знания
1. Дайте общую характеристику элементов VА−группы на основании их положения в периодической системе Д. И. Менделеева. Укажите закономерности изменения радиуса атома, электроотрицательности, неметаллических свойств с ростом атомного номера элемента.
Ответ:
На внешнем энергетическом уровне атомов элементов VА−группы располагается пять электронов, т.е. до завершения электронной оболочки атомов до устойчивого октета не хватает трёх электронов. Азот и фосфор − неметаллы, а висмут − это уже металл. Наиболее электроотрицательный элемент группы − азот; его значение электроотрицательности уступает только значению электроотрицательности фтора и кислорода. Высшая степень окисления атомов элементов VА−группы равна +5. Кроме того, все эти элементы, кроме висмута, проявляют минимальную степень окисления –3. Соответственно формула высших оксидов азота и его электронных аналогов $Э_{2}O_{5}$, формула летучих водородных соединений $ЭH_{3}$, где Э − элемент.
Атомный радиус увеличивается от азота к висмуту.
В ряду N – Sb неметаллические свойства ослабевают, а металлические усиливаются.2. В чём причины малой химической активности простого вещества азота?
Ответ:
Химическая связь в молекуле азота − ковалентная неполярная. При образовании химической связи два атома азота образуют три общие электронные пары. Таким образом, связь в молекуле азота тройная, т.е. образована тремя общими электронными парами, что и обусловливает её высокую прочность.
Примените свои знания
3. Используя знания по биологии, охарактеризуйте биологическую роль азота. Нарисуйте схему круговорота азота в природе.
Ответ:
Основная функция и способность азота – образовывать пептидные связи и формировать все разнообразие белков, а также участвовать в составе множества биологически активных гетероциклов. Азот необходим всем живым организмам для синтеза азотсодержащих строительных блоков − аминокислот, из которых образуются белки и нуклеиновые кислоты.
Физиологическая роль азота в организме ассоциируется, прежде всего, с белками и аминокислотами, их метаболизмом, участием в жизненно−важных процессах и влиянием на эти процессы. Аминокислоты являются исходными соединениями при биосинтезе гормонов, витаминов, медиаторов, пигментов, пуриновых и пиримидиновых оснований и т.д.
Схема круговорота азота в природе:
4. Какой объём газообразного азота может быть получен из 1000 $м^{3}$ воздуха (н. у.), если потери в процессе фракционной перегонки сжиженного воздуха составляют 15%? Объёмная доля азота в воздухе составляет 78%.
Ответ:
Дано:
V (воздух) = 1000 $м^{3}$
Потери = 15%
ω ($N_{2}$) = 78%
Найти:
V ($N_{2}$) − ?
Решение:
$V_{т}$ ($N_{2}$) = V (воздух) * ω ($N_{2}$) = 1000 $м^{3}$ * 0,78 = 780 $м^{3}$
100% − 15% = 85% − выход
$V_{п}$ ($N_{2}$) = 780 $м^{3}$ * 0,85 = 663 $м^{3}$
Ответ: $V_{п}$ ($N_{2}$) = 663 $м^{3}$Выразите свое мнение
В Большой советской энциклопедии издания 1952 г. (т. 1, с. 452, статья «Азот») написано: «Азот в сложении с капитализмом — это война, разрушение, смерть. Азот в сложении с социализмом — это высокий урожай, высокая производительность труда, высокий материальный и культурный уровень трудящихся». Как вы думаете, актуальна ли подобная точка зрения в наше время?
Ответ:
Данная точка зрения не является актуальной: независимо от политического режима азот может применяться как для мирных целей, так и для военных.
Используйте дополнительную информацию
Подготовьте сообщение об азотных удобрениях.
Ответ:
Азотные удобрения
Азотные удобрения применяются для обогащения любой почвы минеральными соединениями, вне зависимости от ее состава и показателей pH. Единственное отличие состоит в том, что необходимо учитывать количество вносимых удобрений для разных земляных составов. Так, для более бедных песчаных потребуется большее количество и частота применения, а на черноземах его расход будет намного меньше.
Промышленное производство различных видов азотных удобрений основано главным образом на образовании синтетического аммиака из молекулярного азота и водорода. Азот получают пропусканием воздуха через генератор с горящим коксом, а источником водорода служат природный газ, нефтяные и коксовые газы. Из смеси $N_{2}$ и $H_{2}$ (в отношении 1: 3) при высокой температуре и давлении в присутствии катализаторов получают аммиак: $N_{2} + 3H_{2} = 2NH_{3}$ §17
-
§17. Аммиак. Соли аммония
Вопрос в начале параграфа✓
Соединения, содержащие азот в самой восстановленной форме, т.е. в минимальной степени окисления –3, могут проявлять только восстановительные свойства. Какие реакции характерны для таких соединений?
Ответ:
Реакции, характерные для соединений азота:
1) Аммиак горит в чистом кислороде, при этом образуется азот и водяные пары:
$4NH_{3} + 3O_{2} = 2N_{2} + 6H_{2}O$
2) Если проводить данную реакцию в присутствии катализатора (платина, оксид хрома (III)), то протекает более глубокое окисление аммиака − с образованием оксида азота(II):
$4NH_{3} + 5O_{2} = 4NO + 6H_{2}O$
3) Восстановительные свойства аммиака проявляются и в реакции с некоторыми оксидами металлов:
$2NH_{3} + 3CuO = N_{2} + 3Cu + 3H_{2}O$
4) Как газообразный аммиак, так и водный раствор этого вещества, реагируют с кислотами, образуя соли аммония:
$NH_{3} + HCl = NH_{4}Cl$Лабораторный опыт 35
Соберите прибор для получения газа и проверьте его на герметичность. В пробирку прибора поместите смесь кристаллических хлорида аммония и щёлочи. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки поднимите вверх и наденьте на него сухую пробирку. Под тягой прогрейте пробирку со смесью, а затем нагревайте её в том месте, где находятся реагенты. Что ощущаете? Через минуту снимите пробирку с аммиаком и, не переворачивая, опустите отверстием в кристаллизатор с водой. Что наблюдаете? Закройте отверстие пробирки пальцем под водой, переверните её с полученным раствором, уберите палец и добавьте в раствор несколько капель раствора фенолфталеина. Что наблюдаете? Запишите уравнения реакции получения аммиака. Какой способ вы использовали для его собирания?
Ответ:
После нагревания смеси хлорида аммония и щёлочи в пламени спиртовки, ощущается резкий запах аммиака:
$NH_{4}Cl + NaOH ⟶ NaCl + H_{2}O + NH_{3}↑$
При опускании пробирки с аммиаком в воду, наблюдается втягивание воды в пробирку.
При добавлении раствора фенолфталеина к раствору аммиака наблюдается изменение окраски индикатора, он приобретает малиновый цвет из−за присутствия в растворе гидроксид−анионов:
$NH_{3} + H_{2}O ⇄ NH_{4}OH$
$NH_{4}OH ⇄ NH_{4}{+} + OH^{-}$
Аммиак собирали методом вытеснения воздуха, так как аммиак легче воздуха.Лабораторный опыт 36
В пробирку налейте 2 мл раствора хлорида аммония и добавьте 2 мл раствора гидроксида натрия. Нагревайте пробирку. Поднесите к отверстию пробирки влажную лакмусовую бумагу. Что наблюдаете? О чём свидетельствует изменение окраски индикаторной бумаги?
Ответ:
В пробирку налили 2 мл раствора хлорида аммония и добавили 2 мл раствора гидроксида натрия. Нагрели пробирку.
$NH_{4}Cl + NaOH = NaCl + NH_{3} + H_{2}O$
Выделившийся аммиак окрашивает влажную лакмусовую бумажку в синий цвет, это связано с тем, что раствор аммиака имеет щелочную реакцию среды, из−за присутствия гидроксид−анионов ($OH^{-}$).Проверьте свои знания
1. Составьте схему образования химической связи в молекуле аммиака.
Ответ:
Схема образования химической связи в молекуле аммиака:
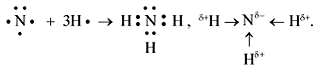
2. Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Ответ:
Аммиак − бесцветный газ с резким характерным запахом, легче воздуха, хорошо растворяется в воде. Такой раствор используют в медицине и в быту (аммиачная вода), а 10%−ный раствор аммиака в воде называется нашатырным спиртом.
Химические свойства:
1) В воде образует гидрат и слабо диссоциирует с образованием щелочной среды.
2) Горит в кислороде.
3) Окисляется в присутствии катализатора.
4) Восстанавливает металлы из оксидов.
5) Реагирует с кислотами с образованием солей аммония.
Аммиак — исходное вещество для получения азотной кислоты и солей аммония. Аммиак также используют в качестве хладагента в промышленных холодильных установках. Он легко сжижается при повышении давления, а испарение сопровождается поглощением теплоты, в результате чего и происходит охлаждение.3. Почему аммиак в окислительно−восстановительных реакциях проявляет свойства восстановителя?
Ответ:
Аммиак в окислительно−восстановительных реакциях проявляет свойства восстановителя, так как в молекуле аммиака азот находится в низшей степени окисления (−3).
4. В чём состоит донорно−акцепторный механизм образования ковалентной связи? Какой ещё механизм образования ковалентной связи вам известен? Подтвердите свои рассуждения рассмотрением строения катиона аммония.
Ответ:
Образование катиона аммония происходит в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару (её называют неподелённой электронной парой), и катионом водорода, который переходит к аммиаку от молекул кислоты. Атом азота называют донором электронов, а атом водорода — акцептором. Существует ещё обменный механизм образования ковалентной связи.
Строение катиона аммония: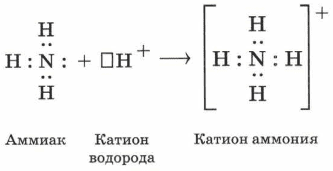
5. Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
Ответ:
Сокращённое ионное уравнение качественной реакции на катион аммония:
$NH_{4}^{+} + OH^{-} ⟶ NH_{3}↑ + H_{2}O$Примените свои знания
6. Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой. Какая из этих реакций является окислительно−восстановительной?
Ответ:
Уравнение реакции получения нитрида натрия:
$6Na + N_{2} ⟶ 2Na_{3}N$ − окислительно−восстановительная реакция
Уравнение взаимодействия нитрида натрия с водой:
$Na_{3}N + 3H_{2}O ⟶ 3NaOH + NH_{3}↑$7. С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди (II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
Ответ:
Аммиак реагирует с азотной кислотой, кислородом, водой и оксидом меди(II), но не будет реагировать с гидроксидом натрия, хлоридом калия, железом и сульфатом аммония.
$NH_{3} + HNO_{3} = NH_{4}NO_{3}$
$4NH_{3} + 3O_{2} = 2N_{2} + 6H_{2}O$
$NH_{3} + H_{2}O = NH_{4}OH$
$2NH_{3} + 3CuO = N_{2} + 3Cu + 3H_{2}O$8. В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
Распознать хлорид аммония можно с помощью щелочи:
$NH_{4}Cl + NaOH ⟶ NaCl + H_{2}O + NH_{3}$
Хлорид натрия со щелочью реагировать не будет:
NaCl + NaOH ≠ реакция не идёт9. В 150 мл воды растворили 67,2 л аммиака (н. у.). Рассчитайте массовую долю аммиака в полученном растворе.
Ответ:
Дано:
V ($H_{2}O$) = 150 мл
V ($NH_{3}$) = 67,2 л
Найти:
ω ($NH_{3}$) − ?
Решение:
n ($NH_{3}$) = V : $V_{m}$ = 67,2 л : 22,4 л/моль = 3 моль
m ($NH_{3}$) = n * M = 3 моль * 17 г/моль = 51 г
m ($H_{2}O$) = 150 г
m (р−ра) = m ($H_{2}O$) + m ($NH_{3}$) = 150 г + 51 г = 201 г
ω ($NH_{3}$) = m ($NH_{3}$) : $m_{(р-ра)}$ * 100% = 51 г : 201 г * 100% = 25%
Ответ: ω ($NH_{3}$) = 25%.Выразите свое мнение
Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония. Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения?
Ответ:
Зеленый цвет − массовые доли кислорода.
Синий цвет − массовые доли металла/водорода.
Красный цвет − массовые доли азота.
Фиолетовый цвет − массовая доля серы.
Нитрат аммония $NH_{4}NO_{3}$:
M = 14 + 4 + 14 + 16 * 3 = 80
ω (H) = $\frac{4 * Ar(H)}{Mr(NH_{4}NO_{3})}$ * 100% = $\frac{4}{80}$ * 100% = 5%
ω (N) = $\frac{2 * Ar(N)}{Mr(NH_{4}NO_{3})}$ * 100% = $\frac{28}{80}$ * 100% = 35%
ω (O) = $\frac{3 * Ar(O)}{Mr(NH_{4}NO_{3})}$ * 100% = $\frac{48}{80}$ * 100% = 60%
Нитрат кальция $Ca(NO_{3})_ {2}$:
M = 40 + (14 + 16 * 3) * 2 = 164
ω (Ca) = $\frac{Ar(Ca)}{Mr(Ca(NO_{3})_ {2})}$ * 100% = $\frac{40}{164}$ * 100% = 24,4%
ω (N) = $\frac{2 * Ar(N)}{Mr(Ca(NO_{3})_ {2})}$ * 100% = $\frac{28}{164}$ * 100% = 17,1%
ω (O) = $\frac{6 * Ar(O)}{Mr(Ca(NO_{3})_ {2})}$ * 100% = $\frac{96}{164}$ * 100% = 58,5%
Сульфат аммония $(NH_{4})_ {2}SO_{4}$:
M = (14 + 4) * 2 + 32 + 16 * 4 = 132
ω (H) = $\frac{8 * Ar (H)}{Mr ((NH_{4})_{2}SO_{4})}$ * 100% = $\frac{8}{132}$ * 100% = 6,1%
ω (N) = $\frac{2 * Ar (N)}{Mr ((NH_{4})_{2}SO_{4})}$ * 100% = $\frac{28}{132}$ * 100% = 21,2%
ω (O) = $\frac{4 * Ar (O)}{Mr ((NH_{4})_{2}SO_{4})}$ * 100% = $\frac{64}{132}$ * 100% = 48,5%
ω (S) = $\frac{Ar (O)}{Mr ((NH_{4})_{2}SO_{4})}$ * 100% = $\frac{32}{132}$ * 100% = 24,2%
Нитрат калия $KNO_{3}$:
M = 39 + 14 + 16 * 3 = 101
ω (K) = $\frac{Ar(K)}{Mr(KNO_{3})}$ * 100% = $\frac{39}{101}$ * 100% = 38,6%
ω (N) = $\frac{Ar(N)}{Mr(KNO_{3})}$ * 100% = $\frac{14}{101}$ * 100% = 13,9%
ω (O) = $\frac{3 * Ar(O)}{Mr(KNO_{3})}$ * 100% = $\frac{48}{101}$ * 100% = 47,5%
Наибольшее содержание азота наблюдаем в нитрате аммония, поэтому мы бы рекомендовали его использовать в качестве азотного удобрения.Используйте дополнительную информацию
Подготовьте сообщение по теме «Производство аммиака: от Габера до современности».
Ответ:
Производство аммиака: от Габера до современности
В 1903 г. Ф. Габер начал лабораторные опыты по синтезу аммиака.
Габер по совету Вальтера Нернста решил проверить возможность каталитического синтеза аммиака при высоком давлении. В качестве катализатора он использовал платиновую фольгу и высокодисперсные железо и марганец.
Ученый полагал, что при взаимодействии небольших количеств азотоводородной смеси технология получения аммиака могла бы быть экономически рентабельной при использовании высоких давлений и циркуляции газа над катализатором, а также если образующийся аммиак будет выходить из аппарата тоже под высоким давлением. Габер отмечал, что выходы аммиака зависят и от эффективности катализатора.
Сейчас для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
$NH_{4}Cl + NaOH → NH_{3}↑ + NaCl + H_{2}O$Практическая работа 4
Получение аммиака и его водного раствора
1) Закройте пробирку пробкой с газоотводной трубкой и проверьте прибор на герметичность.
2) На листке бумаги перемешайте приблизительно равные массы кристаллических хлорида аммония $NH_{4}Cl$ и гидроксида кальция $Ca(OH)_{2}$ (например, по два шпателя того и другого вещества).
3) Приготовленную смесь внесите в пробирку на $\frac{1}{5}$ её объёма.
4) Закрепите прибор в штативе с небольшим наклоном в сторону пробки так, чтобы отверстие пробирки было чуть ниже дна: это связано с тем, что образующиеся капли воды не должны стекать на дно, иначе пробирка может лопнуть.
5) Наденьте сухую пробирку − приёмник газа на газоотводную трубку, направленную вверх.
6) Зажгите спиртовку. Нагревайте пробирку со смесью в пламени спиртовки, соблюдая все правила.
7) Определите наличие аммиака в пробирке−приёмнике. Для этого кусочек универсальной индикаторной бумаги смочите водой и пинцетом поднесите к отверстию пробирки. Что наблюдаете? Запишите уравнение реакции.
8) Прекратите нагревание. Снимите пробирку с аммиаком с газоотводной трубки, не переворачивая её. Конец газоотводной трубки сразу же после снятия с неё пробирки−приёмника закройте кусочком мокрой ваты.
9) Немедленно закройте отверстие пробирки−приёмника пробкой с держателем и опустите пробирку в стакан с водой. Только под водой выньте пробку из отверстия пробирки с помощью держателя.
10) Слегка покачивая пробирку, растворите собранный газ в воде. Когда вода поднимется в пробирку, снова закройте отверстие пробирки пробкой с держателем и выньте пробирку из сосуда.
Изучение химических свойств водного раствора аммиака
1) Содержимое пробирки с полученным раствором аммиака разделите на две пробирки. В одну добавьте 2−3 капли фенолфталеина. Что наблюдаете?
2) В эту же пробирку прилейте раствор соляной кислоты (или азотной кислоты) до исчезновения окраски. Запишите уравнения реакции в молекулярной и ионной формах.
3) В другую пробирку прилейте 1−2 мл раствора хлорида алюминия. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
4) Снимите ватку с газоотводной трубки и снова нагрейте пробирку со смесью гидроксида кальция и хлорида аммония. Поднесите к отверстию газоотводной трубки палочку, смоченную соляной кислотой. Что наблюдаете? Запишите уравнение реакции. Разберите установку и приведите в порядок рабочее место. Оформите отчёт.Ответ:
Получение аммиака и его водного раствора
1) Закрыли пробирку пробкой с газоотводной трубкой и проверили прибор на герметичность.
2) На листке бумаги перемешали приблизительно равные массы кристаллических хлорида аммония $NH_{4}Cl$ и гидроксида кальция $Ca(OH)_ {2}$ (например, по два шпателя того и другого вещества).
3) Приготовленную смесь внесли в пробирку на $\frac{1}{5}$ её объёма.
4) Закрепили прибор в штативе с небольшим наклоном в сторону пробки так, чтобы отверстие пробирки было чуть ниже дна: это связано с тем, что образующиеся капли воды не должны стекать на дно, иначе пробирка может лопнуть.
5) Надели сухую пробирку − приёмник газа на газоотводную трубку, направленную вверх.
6) Зажгли спиртовку. Нагрели пробирку со смесью в пламени спиртовки, соблюдая все правила.
7) Определили наличие аммиака в пробирке−приёмнике. Для этого кусочек универсальной индикаторной бумаги смочили водой и пинцетом поднесли к отверстию пробирки.
В растворе аммиака фенолфталеин меняет окраску на малиновую.
$NH_{3} + H_{2}O = NH_{4}OH = NH_{4}^{+} + OH^{-}$
8) Прекратили нагревание. Сняли пробирку с аммиаком с газоотводной трубки, не переворачивая её. Конец газоотводной трубки сразу же после снятия с неё пробирки−приёмника закрыли кусочком мокрой ваты.
9) Немедленно закрыли отверстие пробирки−приёмника пробкой с держателем и опустили пробирку в стакан с водой. Только под водой вынули пробку из отверстия пробирки с помощью держателя.
10) Слегка покачивая пробирку, растворили собранный газ в воде. Когда вода поднимется в пробирку, снова закрыли отверстие пробирки пробкой с держателем и вынули пробирку из сосуда.
Изучение химических свойств водного раствора аммиака
1) Содержимое пробирки с полученным раствором аммиака разделили на две пробирки. В одну добавили 2−3 капли фенолфталеина.
В растворе аммиака фенолфталеин меняет окраску на малиновую.
$NH_{3} + H_{2}O = NH_{4}OH = NH_{4}^{+} + OH^{-}$
2) В эту же пробирку прилили раствор соляной кислоты (или азотной кислоты) до исчезновения окраски.
$NH_{3} + HCl = NH_{4}Cl$
$NH_{3} + H^{+} + Cl^{-} = NH_{4}^{+} + Cl^{-}$
$NH_{3} + H^{+} = NH_{4}^{+}$
3) В другую пробирку прилили 1−2 мл раствора хлорида алюминия.
$3NH_{3} * H_{2}O + AlCl_{3} = Al(OH)_{3} + 3NH_{4}Cl$
$3NH_{3} * H_{2}O + Al^{3+} + 3Cl^{-} = Al(OH)_{3} + 3NH_{4}^{+} + 3Cl^{-}$
$3NH_{3} * H_{2}O + Al^{3+} = Al(OH)_{3} + 3NH_{4}^{+}$
4) Сняли ватку с газоотводной трубки и снова нагрели пробирку со смесью гидроксида кальция и хлорида аммония. Поднесли к отверстию газоотводной трубки палочку, смоченную соляной кислотой.
$Ca(OH)_{2} + 2NH_{4}Cl = CaCl_{2} + 2NH_{3} + 2H_{2}O$
Разобрали установку и привели в порядок рабочее место. §18
-
§18. Кислородные соединения азота
Вопрос в начале параграфа✓
В соединениях с кислородом азот проявляет степени окисления +1, +2, +3, +4, +5. Какими свойствами характеризуются эти соединения? Какое из них проявляет только окислительные свойства, а какие — и окислительные, и восстановительные?
Ответ:
Только окислительные свойства проявляет оксид азота (V) − $N_{2}O_{5}$.
Только восстановительные свойства проявляет оксид азота (I) − $N_{2}O$.
Остальные оксиды проявляют и окислительные, и восстановительные свойства.Лабораторный опыт 37
В пробирку поместите немного (на кончике шпателя) оксида меди (II) и добавьте 2 мл раствора азотной кислоты. Нагревайте пробирку. Что наблюдаете? О чём свидетельствует изменение окраски раствора? В пробирку налейте 1 мл раствора гидроксида натрия и добавьте 2 капли раствора фенолфталеина. Добавляйте в пробирку раствор азотной кислоты. Что наблюдаете? Почему исчезла окраска индикатора? Получите гидроксид меди (II). Для этого к 1—2 мл раствора сульфата меди добавьте немного раствора гидроксида натрия. Прилейте в пробирку раствор азотной кислоты. Что наблюдаете? Почему растворился осадок гидроксида меди (II)? Запишите молекулярные и ионные уравнения реакций.
Ответ:
В пробирку поместили немного оксида меди (II) и добавили 2 мл раствора азотной кислоты. Нагрели пробирку.
$CuO + 2HNO_{3} = Cu(NO_{3})_{2} + H_{2}O$
$CuO + 2H^{+} + 2NO_{3}^{-} = Cu^{2+} + 2NO_{3}^{-} + H_{2}O$
$CuO + 2H^{+} = Cu^{2+} + H_{2}O$
Наблюдаем растворение оксида. Изменение окраски ратсвора свидетельствует о протекании реакции.
В пробирку налили 1 мл раствора гидроксида натрия и добавили 2 капли раствора фенолфталеина. Добавляли в пробирку раствор азотной кислоты.
$NaOH + HNO_{3} = NaNO_{3} + H_{2}O$
$Na^{+} + OH^{-} + H^{+} + NO^{-}_{3} = Na^{+} + NO^{-}_{3} + H_{2}O$
$H^{+} + OH^{-} = H_{2}O$
Наблюдаем появление малиновой окраски раствора после добавления фенолфталеина, а затем исчезновение окраски, так как кислота нейтрализует щелочь.
К 1−2 мл раствора сульфата меди добавили немного раствора гидроксида натрия.
$CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
$Cu^{2+} + SO^{2-}_{4} + 2Na^{+} + 2OH^{-} = Cu(OH)_{2} + 2Na^{+} + SO^{2-}_{4}$
$Cu^{2+} + 2OH^{-} = Cu(OH)_{2}$
Затем прилили в пробирку раствор азотной кислоты.
$Cu(OH)_{2} + 2HNO_{3} = Cu(NO_{3})_{2} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} + NO^{-}_{3} = Cu^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O$
Наблюдаем растворение осадка − гидроксида меди (II) − в азотной кислоте.Проверьте свои знания
1. Запишите формулы всех оксидов азота и дайте им названия. Разделите их на две группы. Какой критерий классификации вы использовали при этом?
Ответ:
Солеобразующие оксиды:
$N_{2}O_{3}$ – оксид азота (III)
$NO_{2}$ – оксид азота (IV)
$N_{2}O_{5}$ – оксид азота (V)
Несолеобразующие оксиды:
$N_{2}O$ – оксид азота (I)
NO – оксид азота (II)2. Сравните по свойствам две кислородсодержащие кислоты азота. Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
Азотистая кислота. В свободном состоянии получить эту кислоту не удаётся, так как она легко разлагается. В водном растворе азотистая кислота — слабый электролит, обратимо диссоциирует в соответствии с уравнением
$HNO_{2} = H^{+} + NO_{2}^{−}$
Поскольку атом азота в азотистой кислоте находится в промежуточной степени окисления +3, для неё характерна окислительно−восстановительная двойственность. В реакциях с сильными окислителями азотистая кислота окисляется до азотной, проявляя свойства восстановителя:
$2HNO_{2} + O_{2} = 2HNO_{3}$
Однако она проявляет и слабые окислительные свойства:
$2HNO_{2} + 2HI = I_{2} + 2NO + 2H_{2}O$
С основными оксидами и щелочами азотистая кислота образует соли — нитриты:
$HNO_{2} + NaOH = NaNO_{2} + H_{2}O$
Азотная кислота. Казалось бы, для получения азотной кислоты логично в качестве исходного вещества использовать атмосферный азот, источник которого практически неисчерпаем. Но вспомните, насколько химически инертно это вещество, с каким трудом и в каких жёстких условиях азот окисляется кислородом.
Азотная кислота представляет собой бесцветную жидкость, которая при хранении частично разлагается и приобретает бурый оттенок. Его придаёт кислоте один из продуктов реакции — оксид азота (IV): $4HNO_{3} = 4NO_{2} + O_{2} + 2H_{2}O$
Азотная кислота — сильный электролит, в водном растворе полностью диссоциирует с образованием катионов водорода и нитрат−анионов:
$HNO_{3} = H^{+} + NO_{3}^{-}$3. Какие особенности азотной кислоты следует учитывать при рассмотрении её реакций с металлами? Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
В реакциях с металлами и разбавленная, и концентрированная азотная кислота проявляют особенные свойства. Окислителем в таких реакциях является не катион водорода, как в других кислотах, а анион $NO_{3}^{−}$. Следовательно, и продуктом восстановления будет не водород, а соединения азота в более низких степенях окисления. Это зависит как от концентрации кислоты, так и от активности металла. Чем меньше массовая доля кислоты в растворе и выше активность металла, тем полнее протекает восстановление азота.
Например, при взаимодействии концентрированной азотной кислоты с медью (металлом малоактивным, стоящим после водорода в электрохимическом ряду напряжений), помимо соли металла и воды, образуется оксид азота (IV):
$Cu + 4HNO_{3} = Cu(NO_{3})_{2} + 2NO_{2} + 2H_{2}O$
Разбавленная азотная кислота реагирует с медью уже с образованием оксида азота(II):
$3Cu + 8HNO_{3} = 3Cu(NO_{3})_{2} + 2NO + 4H_{2}O$
Железо, алюминий и хром концентрированной азотной кислотой пассивируются, то есть не реагируют.4. Запишите уравнения реакций, с помощью которых получают азотную кислоту.
Ответ:
Уравнения реакций, с помощью которых получают азотную кислоту:
$4NH_{3} + 5O_{2} = 4NO + 6H_{2}O$
$2NO + O_{2} = 2NO_{2}$
$4NO_{2} + 2H_{2}O + O_{2} = 4HNO_{3}$Примените свои знания
5. Используя метод электронного баланса, составьте уравнения окислительно−восстановительных реакций, протекающих по схемам:
а) $NO_{2} + P → N_{2} + P_{2}O_{5}$
б) $I_{2} + HNO_{3} → HIO_{3} + NO_{2} + H_{2}O$
в) $FeCl_{2} + NaNO_{2} + HCl → FeCl_{3} + NaCl + NO + H_{2}O$
В каждой реакции укажите окислитель и восстановитель.Ответ:
а) $NO_{2} + P → N_{2} + P_{2}O_{5}$
$10NO_{2} + 8P = 5N_{2} + 4P_{2}O_{5}$
$2N^{+4} + 8ē ⟶ N_{2}^{0}$ − окислитель
$2P^{0} - 10ē ⟶ 2P^{+5}$ − восстановитель
б) $I_{2} + HNO_{3} → HIO_{3} + NO_{2} + H_{2}O$
$I_{2} + 10HNO_{3} = 2HIO_{3} + 10NO_{2} + 4H_{2}O$
$N^{+5} + 1ē ⟶ N^{+4}$ − окислитель
$I_{2}^{0} - 12ē ⟶ 2I^{+5}$ − восстановитель
в) $FeCl_{2} + NaNO_{2} + HCl → FeCl_{3} + NaCl + NO + H_{2}O$
$FeCl_{2} + NaNO_{2} + 2HCl = FeCl_{3} + NaCl + NO + H_{2}O$
$N^{+3} + 1ē ⟶ N^{+2}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель6. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $NH_{3} → N_{2} → NO → NO_{2} → HNO_{3} → NaNO_{3} → NaNO_{2}$
б) $KNO_{3} → HNO_{3} → Cu(NO_{3})_{2} → NO_{2} → N_{2}$.
Для реакций, протекающих в растворах, запишите ионные уравнения, а в уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.Ответ:
а) $NH_{3} → N_{2} → NO → NO_{2} → HNO_{3} → NaNO_{3} → NaNO_{2}$
1) $4NH_{3} + 3O_{2} ⟶ 2N_{2} + 6H_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$2N^{-3} - 6ē ⟶ N_{2}^{0}$ − восстановитель
2) $N_{2} + O_{2} ⟶ 2NO$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N_{2}^{0} - 4ē ⟶ 2N^{+2}$ − восстановитель
3) $2NO + O_{2} ⟶ 2NO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N^{+2} - 2ē ⟶ N^{+4}$ − восстановитель
4) $4NO_{2} + O_{2} + 2H_{2}O ⟶ 4HNO_{3}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$N^{+4} - 1ē ⟶ N^{+5}$ − восстановитель
5) $HNO_{3} + NaOH ⟶ NaNO_{3} + H_{2}O$
$H_{+} + NO_{3}^{-} + Na^{+} + OH^{-} ⟶ Na^{+} + NO_{3}^{-} + H^{2}O$
$H^{+} + OH^{-} ⟶ H_{2}O$
6) $2NaNO_{3} ⟶ 2NaNO_{2} + O_{2}$
$N^{+5} + 2ē ⟶ N^{+3}$ − окислитель
$2O^{-2} - 4ē ⟶ O_{2}^{0}$ − восстановитель
б) $KNO_{3} → HNO_{3} → Cu(NO_{3})_{2} → NO_{2} → N_{2}$
1) $2KNO_{3} + H_{2}SO_{4} ⟶ 2HNO_{3}↑ + K_{2}SO_{4}$
$2K^{+} + 2NO_{3}^{-} + 2H^{+} + SO_{4}^{2-} ⟶ 2HNO_{3}↑ + 2K^{+} + SO_{4}^{2-}$
$H^{+} + NO_{3}^{-} ⟶ HNO_{3}↑$
2) $2HNO_{3} + Cu(OH)_{2} ⟶ Cu(NO_{3})_{2} + 2H_{2}O$
$2H^{+} + 2NO_{3}^{-} + Cu(OH)_{2} ⟶ Cu^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$2H^{+} + Cu(OH)_{2} ⟶ Cu^{2+} + 2H_{2}O$
3) $2Cu(NO_{3})_{2} ⟶ 2CuO + 4NO_{2}↑ + O_{2}$
$N^{+5} + 1ē ⟶ N^{+4}$ − окислитель
$2O^{-2} - 4ē ⟶ O_{2}^{0}$ − восстановитель
4) $2NO_{2} + 2S ⟶ N_{2} + 2SO_{2}$
$2N^{+4} + 8ē ⟶ N_{2}^{0}$ − окислитель
$S^{0} - 4ē ⟶ S^{+4}$ − восстановитель7. При разложении 66,2 мг нитрата металла в степени окислении +2 образовалось 44,6 мг оксида этого металла. Установите формулу нитрата и напишите уравнение реакции разложения.
Ответ:
Дано:
$m_{1}$ = 66,2 мг
$m_{2}$ = 44,6 мг
Найти:
Формула − ?
Решение:
Пусть $A_{r}$ (Me) = x.
n ($Me(NO_{3})_ {2}$) = m : M = 0,662 : (x + 132)
n (MeO) = m : M = 0,446 : (x + 16)
n ($Me(NO_{3})_ {2}$) = n (MeO)
0,662 : (x + 124)= 0,446 : (x + 16)
x = 207
Атомную массу 207 имеет свинец − Pb.
$2Pb(NO_{3})_{2} = 2 PbO + 4NO_{2} + O_{2}$
Ответ: Нитрат свинца − $Pb(NO_{3})_{2}$.8. Для нейтрализации 25,0 мл раствора азотной кислоты (плотность 1,115 г / мл) потребовалось 31,9 мл 10 %−ного раствора гидроксида натрия (плотность 1,11 г / мл). Определите массовую долю кислоты в исходном растворе.
Ответ:
Дано:
V ($HNO_{3}$) = 25,0 мл
$ρ_{1}$ = 1,115 г/мл
V (NaOH) = 31,9 мл
ω = 10%
$ρ_{2}$ = 1,11 г/мл
Найти:
ω ($HNO_{3}$) − ?
Решение:
$NaOH + HNO_{3} = NaNO_{3} + H_{2}O$
m (р−ра NaOH) = V * ρ = 31,9 1,11 = 35,409 г
m (NaOH) = m(р−ра NaOH) * ω (NaOH) : 100% = 35,409 * 0,1 = 3,5409 г
n (NaOH) = m : M = 3,5409 : 40 = 0,088 моль
n ($HNO_{3}$) = n (NaOH) = 0,088 моль
m ($HNO_{3}$) = n * M = 0,088 * 63 = 5,58 г
m (р−ра $HNO_{3}$) = V * ρ = 25 * 1,115 = 27,88 г
ω ($HNO_{3}$) = m ($HNO_{3}$) : m (р−ра $HNO_{3}$) * 100% = 5,58 : 27,88 * 100% = 20%
Ответ: ω ($HNO_{3}$) = 20%.Используйте дополнительную информацию
1. К какой группе (кислотных или несолеобразующих) оксидов следует отнести оксид азота (IV)? Обоснуйте свою точку зрения.
Ответ:
Оксид азота (IV) следует отнести к кислотным оксидам, потому что он вступает в реакцию с водой и щелочами, а также имеет промежуточную степень окисления (+4) между двумя кислотными оксидами – оксидом азота (III) (+3) и оксидом азота (V) (+5).
2. Бурый дым, выходящий из труб некоторых химических предприятий, называют «лисий хвост». Какое вещество придаёт выбросам бурую окраску? Какие химические предприятия загрязняют атмосферу этим веществом?
Ответ:
Оксид азота (IV) придает выбросам бурую окраску.
Предприятия, которые загрязняют атмосферу этим веществом: металлургические комбинаты, заводы по производству азотной кислоты.3. Перед оккупацией Дании гитлеровскими войсками выдающийся физик Нильс Бор спас от конфискации свою золотую нобелевскую медаль, растворив её в «царской водке». После освобождения Европы в 1945 г. Бор выделил золото из раствора, и Нобелевский комитет отчеканил медаль заново. Напишите уравнение реакции взаимодействия золота с «царской водкой».
Ответ:
Царская водка − это смесь концентрированных азотной $HNO_{3}$ и соляной кислот HCl, взятых в соотношении 1 : 3 по объему.
Взаимодействие золота с «царской водкой»:
$Au + 4HCl + HNO_{3} → H[AuCl_{4}] + NO + 2H_{2}O$ §19
-
§19. Фосфор и его соединения
Вопрос в начале параграфа✓
Александр Евгеньевич Ферсман, русский геохимик и минералог, один из основоположников геохимии, «поэт камня», как его называл Алексей Толстой, утверждал, что фосфор является «элементом жизни и мысли». Почему?
Ответ:
Фосфор − биогенный элемент, он входит в состав всех живых организмов. Особенно много фосфора в плодах и семенах, в жировой ткани. Большое количество этого элемента содержится в головном мозге. Богатые фосфором продукты питания (например, рыба, яйца, молоко) полезны для умственной деятельности. Скелет человека и животных формируется главным образом за счёт соединений фосфора и кальция, вот почему в период роста организма в пище в достаточном количестве должны содержаться эти элементы.
Из курса биологии мы знаем, что в каждой клетке содержится соединение фосфора аденозинтрифосфорная кислота (АТФ). Она поставляет энергию для всех процессов, происходящих в клетке.Лабораторный опыт 38
В пробирку налейте 2 мл раствора фосфата натрия и добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Составьте молекулярное и ионное уравнение реакции.
Ответ:
В пробирку налили 2 мл раствора фосфата натрия и добавили с помощью пипетки несколько капель раствора нитрата серебра.
$Na_{3}PO_{4} + 3AgNO_{3} = Ag_{3}PO_{4} + 3NaNO_{3}$
$3Na^{+} + PO^{3-}_{4} + 3Ag^{+} + 3NO^{-}_{3} = Ag_{3}PO_{4} + 3Na^{+} + 3NO^{-}_{3}$
$3Ag^{+} + PO_{4}^{3-} = Ag_{3}PO_{4}$
Наблюдаем образование осадка белого цвета − фосфата серебра.Проверьте свои знания
1. Дайте характеристику фосфора на основании его положения в периодической системе Д. И. Менделеева.
Ответ:
Атомный номер фосфора − 15, следовательно, в ядре атома фосфора 15 протонов, а электронную оболочку составляют 15 электронов. Поскольку фосфор − элемент третьего периода, электроны в атоме располагаются на трёх энергетических уровнях.
Фосфор − типичный неметалл. Для завершения внешнего энергетического уровня до устойчивой восьмиэлектронной оболочки атому фосфора недостаёт трёх электронов. В отличие от атома азота, пять внешних электронов находятся на большем расстоянии от ядра атома и менее прочно с ним связаны. Следовательно, неметаллические свойства у фосфора выражены слабее, чем у азота. Тем не менее при образовании связей с атомами менее электроотрицательных элементов, в первую очередь металлов и водорода, атом фосфора принимает недостающие три электрона и приобретает минимальную степень окисления –3. Максимальная же степень окисления, которую фосфор проявляет в соединениях с более электроотрицательными элементами, определяется числом валентных электронов и равна +5.2. Сравните аллотропные модификации фосфора, т.е. найдите черты сходства и различия между ними.
Ответ:
Белый фосфор − воскоподобное вещество, легко режется ножом, плавится уже при температуре 44°С. В твёрдом состоянии имеет молекулярную кристаллическую решётку, а его молекулы состоят из четырёх атомов, расположенных в вершинах правильного тетраэдра. Именно поэтому формулу белого фосфора записывают так: $P_{4}$.
Белый фосфор очень реакционноспособен. При ограниченном доступе воздуха он окисляется кислородом, при этом наблюдается зеленоватое свечение. Это явление называют хемилюминесценцией. Во избежание окисления белый фосфор хранят под слоем воды, в которой он практически нерастворим. Белый фосфор чрезвычайно ядовит, самовоспламеняется на открытом воздухе, а также при контакте с кожей.
При нагревании без доступа воздуха белый фосфор превращается в другую аллотропную модификацию − красный фосфор. Это твёрдое вещество красно−бурого цвета. Красный фосфор менее активен, устойчив на воздухе, нетоксичен, не обладает способностью светиться на воздухе, но при поджигании легко загорается и горит ярким пламенем с выделением густого белого дыма.3. Охарактеризуйте получение, свойства и применение красного фосфора. Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
Красный фосфор получают при нагревании белого фосфора без доступа воздуха.
• Окислительные свойства фосфор проявляет по отношению к металлам. Продукты взаимодействия, в которых фосфор проявляет степень окисления −3, называются фосфиды. Например, при нагревании фосфора с металлическим кальцием образуются красно−коричневые кристаллы фосфида кальция:
$3Ca + 2P = Ca_{3}P_{2}$
• Восстановительные свойства фосфор проявляет по отношению к кислороду, галогенам, а также сложным веществам−окислителям. Например, в атмосфере хлора фосфор сгорает с образованием хлорида фосфора (V):
$2P + 5Cl_{2} = 2PCl_{5}$
• Концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
$P + 5HNO_{3} = H_{3}PO_{4} + 5NO_{2} + H_{2}O$
• Красный фосфор применяют в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также в качестве газопоглотителя в производстве ламп накаливания.Примените свои знания
4. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$P → Ca_{3}P_{2} → PH_{3} → P_{2}O_{5} → H_{3}PO_{4} → K_{3}PO_{4} → Ag_{3}PO_{4}$.
Для реакций, протекающих в растворах, запишите ионные уравнения. В уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.Ответ:
1) $3Ca + 2P = Ca_{3}P_{2}$
$P^{0} + 3ē ⟶ P^{-3}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
2) $Ca_{3}P_{2} + 6H_{2}O = 3Ca(OH)_{2} + 2PH_{3}↑$
3) $2PH_{3} + 4O_{2} = P_{2}O_{5} + 3H_{2}O$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$2P^{-3} - 16ē ⟶ 2P^{+5}$ − восстановитель
4) $P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
5) $H_{3}PO_{4} + 3KOH = K_{3}PO_{4} + 3H_{2}O$
$3H^{+} + PO_{4}^{3-} + 3K^{+} + 3OH^{-} ⟶ 3K^{+} + PO_{4}^{3-} + 3H_{2}O$
$H^{+} + OH^{-} ⟶ H_{2}O$
6) $3AgNO_{3} + K_{3}PO_{4} = 3KNO_{3} + Ag_{3}PO_{4}↓$
$3Ag^{+} + 3NO_{3}^{-} + 3K^{+} + PO_{4}^{3-} ⟶ 3K^{+} + 3NO_{3}^{-} + Ag_{3}PO_{4}↓$
$3Ag^{+} + PO_{4}^{3-} ⟶ Ag_{3}PO_{4}↓$5. Найдите массу 2 %−ного раствора фосфорной кислоты, необходимую для нейтрализации 30 г 8 %−ного раствора гидроксида натрия. Рассчитайте массу полученного фосфата.
Ответ:
Дано:
ω = 2%
m (NaOH) = 30 г
ω = 8%
Найти:
m ($Na_{3}PO_{4}$) − ?
m (раствора $H_{3}PO_{4}$) − ?
Решение:
$3NaOH + H_{3}PO_{4} = Na_{3}PO_{4} + 3H_{2}O$
m (NaOH) = m (раствора NaOH) * ω (NaOH) : 100% = 30 * 0,08 = 2,4 г
n (NaOH) = m : M = 2,4 : 40 = 0,06 моль
n ($H_{3}PO_{4}$) = n($Na_{3}PO_{4}$) = n (NaOH) : 3 = 0,06 : 3 = 0,02 моль
m ($Na_{3}PO_{4}$) = n * M = 0,02 * 164 = 3,28 г
m ($H_{3}PO_{4}$) = n * M = 0,02 * 98 = 1,96 г
m (раствора $H_{3}PO_{4}$) = m($H_{3}PO_{4}$) * 100% : ω (NaOH) = 1,96 * 100% : 2 = 98 г
Ответ: m ($Na_{3}PO_{4}$) = 3,28 г; m (раствора $H_{3}PO_{4}$) = 98 г.6. Один из способов получения фосфорной кислоты — окисление фосфора концентрированной азотной кислотой. Используя метод электронного баланса, составьте уравнение данной реакции, протекающей по схеме: $P + HNO_{3} + H_{2}O → H_{3}PO_{4} + NO↑$. Какая масса фосфорной кислоты образуется при окислении 17,2 г технического красного фосфора, содержащего 10 % примесей?
Ответ:
$3P + 5HNO_{3} + 2H_{2}O ⟶ 3H_{3}PO_{4} + 5NO↑$
$N^{+5} + 3ē ⟶ N^{+2}$ − окислитель
$P^{0} - 5ē ⟶ P^{+5}$ − восстановитель
Дано:
$m_{т}$ (P) = 17,2 г
ω (примесесй) = 10%
Найти:
m ($H_{3}PO_{4}$) − ?
Решение:
$3P + 5HNO_{3} + 2H_{2}O = 3H_{3}PO_{4} + 5NO$
ω (P) = 100% − 10% = 90%
m (P) = $m_{т}$ (P) * m (P) = 17,2 г * 0,9 = 15,48 г
n (P) = m : M = 15,48 г : 31 г/моль = 0,5 моль
n (P) = n ($H_{3}PO_{4}$) = 0,5 моль
m ($H_{3}PO_{4}$) = n * M = 0,5 * 98 = 49 г
Ответ: m ($H_{3}PO_{4}$) = 49 г.Выразите свое мнение
Сравните продукты реакции горения фосфина с продуктами горения и каталитического окисления аммиака. Как вы думаете, с чем связано различие?
Ответ:
$2PH_{3} + 4O_{2} = P_{2}O_{5} + 3H_{2}O$
При горении фосфина образуется оксид фосфора (V) и вода.
$4NH_{3} + 3O_{2} = 2N_{2} + 6H_{2}O$
При некаталитическом горении аммиака образуется азот и вода.
$NH_{3} + 4O_{2} = 4NO + 6H_{2}O$
При каталитическом горении аммиака образуется оксид азота (II) и вода.
Это связано с тем, что азот является более электроотрицательным элементом, чем фосфор.Используйте дополнительную информацию
Один из городов России расположен в следующей точке земного шара: 67°34'03'' с. ш., 33°23'36'' в. д. Как называется этот город? Какое отношение к изучаемой теме он имеет? Составьте краткую информационную справку об этом городе.
Ответ:
Этот город называется Апатиты.
Апатиты − город в Мурманской области России. Центр городского округа город Апатиты с подведомственной территорией, в который помимо него входят посёлок Тик−Губа и станция Хибины.
Расположен на Кольском полуострове, между озером Имандра и горным массивом Хибины на левом берегу реки Белая.
Город расположен на месте Хибинских месторождений апатитонефелиновых руд, чем и объясняется название города. Апатит − группа минералов класса фосфатов, основной компонент апатитовых руд, богатых фосфором. §20
-
§20. Общая характеристика элементов IVA-группы. Углерод
Вопрос в начале параграфа✓
Будучи неметаллом, углерод способен проявлять как окислительные, так и восстановительные свойства. Какие химические свойства углерода подтверждают этот вывод?
Ответ:
Восстановительные свойства углерод проявляет в реакциях со сложными веществами−окислителями. Например, концентрированная серная кислота взаимодействует с углеродом, при этом наблюдается бурное выделение углекислого и сернистого газов:
$C + 2H_{2}SO_{4} = CO_{2}↑ + 2SO_{2}↑ + 2H_{2}O$
Окислительные свойства. При нагревании углерод взаимодействует с металлами. Образующиеся вещества носят общее название карбиды. Спекание кокса с алюминием приводит к получению карбида алюминия:
$4Al + 3C = Al_{4}C_{3}$Проверьте свои знания
1. Дайте характеристику элемента углерода на основании его положения в периодической системе Д. И. Менделеева.
Ответ:
Элементы IVA−группы содержат на внешнем энергетическом уровне атомов четыре электрона. Для создания устойчивой электронной оболочки соответствующего благородного газа атомы этих элементов должны либо отдать четыре электрона, либо присоединить ровно столько же. Склонность элементов подгруппы углерода к отдаче или присоединению электронов определяется радиусом их атомов. Углерод и кремний, имеющие небольшие радиусы атомов, относятся к неметаллам. Олово и свинец, радиусы атомов которых больше, — элементы−металлы. Германий сочетает свойства элемента−металла и элемента−неметалла. Максимальная степень окисления атомов элементов IVA−группы +4, все они образуют высшие оксиды состава $ЭO_{2}$. Минимальную степень окисления –4 могут принимать только углерод и кремний.
2. Сравните свойства алмаза и графита.
Ответ:
Алмаз — прозрачное кристаллическое вещество, самое твёрдое из всех природных веществ. Он служит эталоном твёрдости по так называемой шкале Мооса и по десятибалльной системе оценивается высшим баллом 10. Такая твёрдость алмаза обусловлена особой структурой его атомной кристаллической решётки. В ней каждый атом углерода окружён четырьмя такими же атомами, расположенными в вершинах тетраэдра. Кристаллы алмаза обычно бесцветные, но иногда за счёт примесей приобретают синюю, голубую, красную или чёрную окраску. Они обладают очень сильным блеском благодаря высокой светопреломляющей и светоотражающей способности.
Графит — тёмно−серое, жирное на ощупь кристаллическое вещество с металлическим блеском. В отличие от алмаза, графит — очень мягкий, непрозрачный материал, хорошо проводит теплоту и электрический ток, тугоплавкий. Мягкость графита, его способность оставлять серый след на поверхностях других материалов обусловлены его слоистой структурой. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, прочно связаны в шестиугольники, а вот связи между слоями относительно слабые. Из графита изготавливают электроды, твёрдые смазки трущихся деталей, замедлители нейтронов в ядерных реакторах, стрежни для карандашей. Сходное с графитом строение имеют разновидности так называемого аморфного углерода — сажа и древесный уголь. Главное отличие аморфного углерода от графита состоит в том, что мельчайшие кристаллики в аморфном веществе расположены не упорядоченно, а хаотически. Сажу получают разложением при высокой температуре природного газа. Основная составляющая природного газа — метан разлагается на углерод и водород.3. Что представляет собой аморфный углерод? Какие виды такого углерода различают? Где их применяют?
Ответ:
Сходное с графитом строение имеют разновидности так называемого аморфного углерода − сажа и древесный уголь. Главное отличие аморфного углерода от графита состоит в том, что мельчайшие кристаллики в аморфном веществе расположены не упорядоченно, а хаотически.
Сажу получают разложением при высокой температуре природного газа. Основная составляющая природного газа − метан − разлагается на углерод и водород. Сажу используют в промышленности при изготовлении резины (именно поэтому автомобильные покрышки и многие другие резиновые изделия имеют чёрный цвет), она входит в состав чёрных красок, в том числе для принтеров, а также применяется для изготовления химических источников тока.
Древесный уголь получают и при нагревании кусочков древесины при высокой температуре без доступа воздуха. Его образование объясняется разложением сложных углеродсодержащих веществ древесины с удалением газообразных продуктов. В результате процесса разложения остаётся некое подобие углеродного каркаса, бывшего ранее растительными волокнами. Поэтому древесный уголь имеет пористую структуру, внутри он пронизан многочисленными полостями, каналами, пустотами. Благодаря этому древесный уголь обладает способностью поглощать газы и растворённые вещества. Такое свойство называют адсорбцией.4. Что такое адсорбция? Расскажите о применении этого явления (на примере активированного угля).
Ответ:
Древесный уголь обладает способностью поглощать газы и растворённые вещества. Такое свойство называют адсорбцией. Для увеличения адсорбционной способности древесного угля его обрабатывают водяным паром. Полученный таким образом уголь называют активированным. Активированный уголь используют для очистки сахарных сиропов в свеклосахарном производстве, в фильтрующих противогазах для поглощения отравляющих веществ, при пищевых отравлениях (в виде таблеток).
5. Охарактеризуйте химические свойства углерода. Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
Восстановительные свойства углерод проявляет в реакциях со сложными веществами−окислителями. Например, концентрированная серная кислота взаимодействует с углеродом, при этом наблюдается бурное выделение углекислого и сернистого газов:
$C + 2H_{2}SO_{4} = CO_{2}↑ + 2SO_{2}↑ + 2H_{2}O$
Окислительные свойства. При нагревании углерод взаимодействует с металлами. Образующиеся вещества носят общее название карбиды. Спекание кокса с алюминием приводит к получению карбида алюминия:
$4Al + 3C = Al_{4}C_{3}$
Углерод выступает в роли окислителя и при взаимодействии с неметаллами, имеющими меньшее значение электроотрицательности. Так, при прокаливании смеси углерода с кремнием получают карбид кремния, или карборунд:
$Si + C = SiC$
При взаимодействии с водородом углерод также проявляет окислительные свойства:
$C + 2H_{2} = CH_{4}$
Образующееся вещество называют метаном. Приведённое уравнение химической реакции лежит в основе промышленного процесса утилизации мелкой угольной пыли, образующейся в качестве отхода коксохимического производства.Примените свои знания
6. Используя метод электронного баланса, определите коэффициенты в схеме реакции:
$C + HNO_{3} → CO_{2} + NO_{2} + H_{2}O$
Укажите окислитель и восстановитель.Ответ:
$C + 4HNO_{3} = CO_{2} + 4NO_{2} + 2H_{2}O$
$N^{+5} + 1ē ⟶ N^{+4}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель7. Напишите уравнения реакций углерода с оксидом меди(II), серой, оксидом свинца(IV), магнием. Определите, какие свойства — окислительные или восстановительные — проявляет углерод в каждой из реакций.
Ответ:
Реакция углерода с оксидом меди(II):
$C + CuO = CO + Cu$ − восстановительные свойства
Реакция углерода с серой:
$C + 2S = CS_{2}$ − восстановительные свойства
Реакция углерода с оксидом свинца(IV):
$C + PbO_{2} = Pb + CO_{2}$ − восстановительные свойства
Реакция углерода с магнием:
$C + Mg = MgC_{2}$ − окислительные свойства8. Какая масса кокса (условно чистый углерод) потребуется для получения цинка из 216 т рудного концентрата, содержащего 75 % оксида цинка, если кокс необходимо взять в двукратном избытке?
Ответ:
Дано:
m (концентрата) = 216 т
ω (ZnO) = 75%
Найти:
m (C) − ?
Решение:
$C + ZnO = Zn + CO$
m (ZnO) = m (концентрата) * ω (ZnO) = 216 т * 0,75 = 162 т
n (ZnO) = m : M = 162 т : 81 г/моль = 2 Ммоль
Так как кокс необходимо взять в двукратном избытке, то $m_{т}$ (C) = 2 * 12 т = 24 т, где $m_{т}$ − масса технического вещества.
$m_{п}$ (C) = 2 * 24 т = 48 т, где $m_{п}$ − масса примесей.
Ответ: $m_{п}$ (C) = 48 т.Используйте дополнительную информацию
1. Первый в России алмаз был найден 5 июля 1829 г. на Урале в Пермской губернии на Крестовоздвиженском золотом прииске четырнадцатилетним крепостным Павлом Поповым. Прииск был расположен недалеко от посёлка Промысла Горнозаводского района Пермского края. Найдите это место на сервисе электронных карт (http://maps.google.com, http://wikimapia.org, http://maps.mail.ru или др.), распечатайте карту и спутниковую съёмку окрестностей посёлка Промысла, определите его географические координаты и расстояние до районного центра Горнозаводска и столицы края Перми.
Ответ:
Координаты поселка Промысел: 58.563655, 59.155041.
Расстояние до Горнозаводска: 52,5 км.
Расстояние до Перми: 182 км.2. Каким образом имя выдающегося русского химика Николая Дмитриевича Зелинского связано с химией углерода? Какое техническое изобретение было сделано им совместно с инженером Эдуардом Куммантом?
Ответ:
Николай Дмитриевич Зелинский искал универсальный фильтр. В то время использовали обычный древесный уголь очищенный этиловым спиртом, но он слишком быстро насыщался отравляющими газами. Для активации угля Н. Д. Зелинский пропитывал их водой, а затем прокаливал и томил без доступа воздуха. В начале июня 1915 года Зелинский на заседании Санитарно−технического отдела сделал сообщение о свойствах активированного угля.
На заседании присутствовал Эдуард Куммант, инженер−технолог резиновой фабрики. Под впечатлением выступления Зелинского он к 15 июня изготовил первую резиновую маску, к которой крепился фильтр с углём Зелинского.3. Подготовьте сообщение об одной из аллотропных модификаций углерода — фуллеренах, графите или углеродных нанотрубках.
Ответ:
Фуллерен – молекулярное соединение, принадлежащее к классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Уникальная структура фуллеренов обуславливает их уникальные физические и химические свойства.
Фуллерены названы таким образом по имени инженера и архитектора Ричарда Бакминстера Фуллера, который разработал и построил пространственную конструкцию, представляющую собой полусферу, собранную из тетраэдров. Данная конструкция принесла Фуллеру международное признание и известность. Сегодня по его разработкам разрабатываются и строятся купольные дома. §21
-
§21. Кислородные соединения углерода
Вопрос в начале параграфа✓
При образовании химических связей с кислородом углерод принимает положительные степени окисления: +4 и реже +2. Какие окислительно−восстановительные свойства характеризуют эти соединения? В каких реакциях углерод не изменяет свою степень окисления?
Ответ:
Восстановительные свойства углерод проявляет в реакциях со сложными веществами−окислителями. Например, концентрированная серная кислота взаимодействует с углеродом, при этом наблюдается бурное выделение углекислого и сернистого газов:
$C + 2H_{2}SO_{4} = CO_{2}↑ + 2SO_{2}↑ + 2H_{2}O$
Окислительные свойства. При нагревании углерод взаимодействует с металлами. Образующиеся вещества носят общее название карбиды. Спекание кокса с алюминием приводит к получению карбида алюминия:
$4Al + 3C = Al_{4}C_{3}$
Углерод выступает в роли окислителя и при взаимодействии с неметаллами, имеющими меньшее значение электроотрицательности. Так, при прокаливании смеси углерода с кремнием получают карбид кремния, или карборунд:
$Si + C = SiC$
При взаимодействии с водородом углерод также проявляет окислительные свойства:
$C + 2H_{2} = CH_{4}$
Образующееся вещество называют метаном. Приведённое уравнение химической реакции лежит в основе промышленного процесса утилизации мелкой угольной пыли, образующейся в качестве отхода коксохимического производства.
Углерод не изменяет свою степень окисления в составе сложных веществ, например:
$CO_{2} + Na_{2}O = Na_{2}CO_{3}$.Лабораторный опыт 39
Соберите прибор для получения газов. Поместите в прибор кусочек мрамора, прилейте 3−4 мл соляной кислоты. Закройте прибор пробкой с изогнутой газоотводной трубкой. Пропускайте углекислый газ через 3−4 мл воды с несколькими каплями лакмуса. Что наблюдаете? О чём свидетельствует изменение окраски индикатора? Осторожно нагревайте содержимое пробирки. Что наблюдаете? Почему окраска индикатора вновь изменилась? Сделайте вывод об устойчивости угольной кислоты.
Ответ:
Собрали прибор для получения газов. Поместили в прибор кусочек мрамора, прилили 3−4 мл соляной кислоты. Закрыли прибор пробкой с газоотводной трубкой.
$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$
Пропускали углекислый газ через 3 − 4 мл воды с несколькими каплями лакмуса. Наблюдаем окрашивание раствора в красный цвет.
При нагревании раствора угольной кислоты наблюдается окрашивание лакмуса в фиолетовый цвет, что свидетельствует о том, что среда стала нейтральной:
$H_{2}CO_{3} ⟶ CO_{2}↑ + H_{2}O$
Отсюда можно сделать вывод о том, что угольная кислота является слабой кислотой.Проверьте свои знания
1. Какие оксиды образует углерод? Какие группы оксидов они представляют?
Ответ:
Углерод горит на воздухе и в кислороде с образованием углекислого газа:
$C + O_{2} = CO_{2}$ − кислотный оксид.
Если кислорода недостаточно, образующийся углекислый газ реагирует с раскалённым углеродом, при этом образуется оксид углерода(II):
$CO_{2} + C = 2CO$ − несолеобразующий оксид.
Следовательно, углерод образует два оксида. Это бесцветные газы без запаха.2. Охарактеризуйте получение и свойства оксида углерода (II). Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
Оксид углерода (II) относят к несолеобразующим оксидам.
Поскольку степень окисления +2 для углерода является промежуточной и нехарактерной, оксид углерода(II) − сильный восстановитель. Приведём доказательства этого утверждения.
Во−первых, этот газ горит, т. е. взаимодействует с кислородом по уравнению:
$2CO + O_{2} = 2CO_{2}$
Во−вторых, оксид углерода (II) восстанавливает металлы из их оксидов, что используют в металлургических процессах. Так, при получении чугуна в доменной печи протекает одна из основных реакций восстановления железа:
$4CO + Fe_{3}O_{4} = 4CO_{2} + 3Fe$3. Охарактеризуйте получение, свойства и применение оксида углерода (IV). Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
Оксид углерода (IV) хорошо известен вам под названием углекислый газ. В промышленности оксид углерода (IV) получают разложением природных карбонатов кальция (мел, известняк) при высокой температуре:
$CaCO_{3} = CaO + CO_{2}↑$
В лабораторных условиях для получения углекислого газа на карбонат кальция (мрамор) действуют соляной кислотой:
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2}↑ + H_{2}O$
Оксид углерода (IV) не обладает восстановительными свойствами, а проявляет слабые окислительные свойства. В этом можно убедиться на примере реакции углекислого газа с углеродом. Он не поддерживает горения, и только магний горит в его атмосфере:
$CO_{2} + 2Mg = 2MgO + C$
Углекислый газ − типичный кислотный оксид, которому соответствует непрочная летучая угольная кислота. Он взаимодействует с основными оксидами и щелочами с образованием солей:
$Na_{2}O + CO_{2} = Na_{2}CO_{3}$
$Ca(OH)_{2} + CO_{2} = CaCO_{3}↓ + H_{2}O$Примените свои знания
4. Какой из газов − углекислый или угарный − тяжелее воздуха? Ответ подтвердите расчётом плотности обоих газов по воздуху.
Ответ:
$CO_{2}$ − углекислый газ
CO − угарный газ
M (воздуха) = 29 г/моль
M (CO) = 12 + 16 = 28 г/моль
D = 28 : 29 = 0,97 − отношение массы угарного газа к воздуху.
M ($CO_{2}$) = 12 + 32 = 44 г/моль
D = 44 : 29 = 1,52 − отношение массы углекислого газа к воздуху.
Следовательно, углекислый газ тяжелее воздуха.5. Вспомните, какое строение имеют молекулы $CO$ и $CO_{2}$. Нарисуйте в тетради схемы образования этих молекул.
Ответ:
Строение молекулы угарного газа:

Строение молекулы углекислого газа:
6. Запишите молекулярные уравнения реакций, соответствующие каждому из приведённых ионных уравнений:
а) $Ca^{2+} + CO_{3}^{2−} = CaCO3↓$
б) $CO_{2} + OH^{–} = HCO_{3}^{−}$
в) $CO_{2} + 2OH^{–} = CO_{3}^{2−} + H_{2}O$
г) $HCO_{3}^{–} + H^{+} = H_{2}O + CO_{2}↑$
д) $MgCO_{3} + 2H^{+} = Mg^{2+} + CO_{2}↑ + H_{2}O$
е) $CO_{3}^{2−} + 2H^{+} = CO_{2}↑ + H_{2}O$Ответ:
а) $Ca^{2+} + CO_{3}^{2−} = CaCO3↓$
Соответствующее молекулярное уравнение:
$CaCl_{2} + Na_{2}CO_{3} = 2NaCl + CaCO3↓$
б) $CO_{2} + OH^{–} = HCO_{3}^{−}$
Соответствующее молекулярное уравнение:
$CO_{2} + NaOH = NaHCO_{3}$
в) $CO_{2} + 2OH^{–} = CO_{3}^{2−} + H_{2}O$
Соответствующее молекулярное уравнение:
$CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
г) $HCO_{3}^{–} + H^{+} = H_{2}O + CO_{2}↑$
Соответствующее молекулярное уравнение:
$NaHCO_{3} + HCl = NaCl + H_{2}O + CO_{2}↑$
д) $MgCO_{3} + 2H^{+} = Mg^{2+} + CO_{2}↑ + H_{2}O$
Соответствующее молекулярное уравнение:
$MgCO_{3} + 2HCl = MgCl_{2} + CO_{2}↑ + H_{2}O$
е) $CO_{3}^{2−} + 2H^{+} = CO_{2}↑ + H_{2}O$
Соответствующее молекулярное уравнение:
$Na_{2}CO_{3} + 2HCl = NaCl + CO_{2}↑ + H_{2}O$7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $CO_{2} → CaCO_{3} → Ca(HCO_{3}) → CO_{2} → CO$
б) $C → CO_{2} → Na_{2}CO_{3} → BaCO_{3} → CO_{2}$
Для реакций обмена запишите ионные уравнения. В уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.Ответ:
а) $CO_{2} → CaCO_{3} → Ca(HCO_{3}) → CO_{2} → CO$
1) $CO_{2} + Ca(OH)_{2} = CaCO_{3}↓ + H_{2}O$
$CO_{2} + Ca^{2+} + 2OH^{-} ⟶ CaCO_{3}↓ + H_{2}O$
2) $CaCO_{3} + CO_{2} + H_{2}O = Ca(HCO_{3})_{2}$
$CaCO_{3} + CO_{2} + H_{2}O ⟶ Ca^{2+} + 2HCO_{3}^{-}$
3) $Ca(HCO_{3})_{2} + 2HCl = CaCl_{2} + 2H_{2}O + 2CO_{2}↑$
$Ca^{2+} + 2HCO_{3}^{-} + 2H^{+} + 2Cl^{-} ⟶ Ca^{2+} + 2Cl^{-} + 2H_{2}O + 2CO_{2}↑$
$H^{+} + HCO_{3}^{-} ⟶ H_{2}O + CO_{2}↑$
4) $CO_{2} + C = 2CO$
$C^{+4} + 2ē ⟶ C^{+2}$ − окислитель
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
б) $C → CO_{2} → Na_{2}CO_{3} → BaCO_{3} → CO_{2}$
1) $C + O_{2} = CO_{2}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$C^{0} - 4ē ⟶ C^{+4}$ − восстановитель
2) $CO_{2} + 2NaOH = Na_{2}CO_{3} + H_{2}O$
$CO_{2} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + CO_{3}^{2-} + H_{2}O$
$CO_{2} + 2OH^{-} ⟶ CO_{3}^{2-} + H_{2}O$
3) $BaCl_{2} + Na_{2}CO_{3} = 2NaCl + BaCO_{3}↓$
$Ba^{2+} + 2Cl^{-} + 2Na^{+} + CO_{3}^{2-} ⟶ 2Na^{+} + 2Cl^{-} + BaCO_{3}↓$
$Ba^{2+} + CO_{3}^{2-} ⟶ BaCO_{3}↓$
4) $BaCO_{3} = BaO + CO_{2}↑$8. Какую массу известняка, содержащего 92 % карбоната кальция, необходимо взять для прокаливания, чтобы получить 156,8 л углекислого газа (н. у.)?
Ответ:
Дано:
ω ($CaCO_{3}$) = 92%
V ($CO_{2}$) = 156,8 л
Найти:
$m (CaCO_{3})_ {практич.}$ − ?
Решение:
$CaCO_{3} = CaO + CO_{2}$
n ($CO_{2}$) = V : $V_{m}$ = 156,8 : 22,4 = 7 моль
n ($CaCO_{3}$) = n ($CO_{2}$) = 7 моль
m ($CaCO_{3}$) = n * M = 7 * 100 = 700 г
$m (CaCO_{3})_ {практич.}$ = 700 * 0,92 = 760,9 г
Ответ: $m (CaCO_{3})_ {практич.}$ = 760,9 гИспользуйте дополнительную информацию
В сказке В. Ф. Одоевского «Мороз Иванович» Мороз говорит Рукодельнице: «…ведь я знаю, есть такие неряхи, что печку истопить истопят, а трубу… закроют, да не вовремя, когда ещё не все угольки прогорели, а оттого в горнице угарно бывает, голова у людей болит, в глазах зелено; даже от угара умереть можно». От какого вещества «в горнице угарно бывает»? Откуда оно берётся? Подготовьте презентацию об угарном газе.
Ответ:
От угарного газа «в горнице угарно бывает». Оно образуется в результате реакции:
$2C + O_{2} = 2CO$.
Угарный газ − оксид углерода, о котором слишком часто приходится слышать, если речь идет об отравлении продуктами горения, несчастных случаях в промышленности или даже в быту. В силу особых ядовитых свойств этого соединения обычная домашняя газовая колонка может стать причиной гибели целой семьи.
Практическая работа 5
1) В две пробирки налейте по 20 капель дистиллированной воды и добавьте по 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесите примерно 20 капель раствора известковой воды. Установите пробирки в штатив. Туда же поместите и три пустые пробирки.
2) В прибор для получения газов внесите 2—3 небольших кусочка мрамора и закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустите в пробирку с водой, подкрашенной раствором лакмуса. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
3) Пропускайте выделяющийся оксид углерода (IV) через воду до тех пор, пока раствор лакмуса не приобретёт красную окраску. Объясните наблюдаемое и запишите уравнения реакции в молекулярной и ионной формах.
Сравните окраску раствора с окраской раствора в контрольной пробирке.
4) Промойте конец газоотводной трубки в стакане с водой. После этого конец газоотводной трубки перенесите в пробирку с известковой водой и пропускайте газ до помутнения раствора (рис. 49).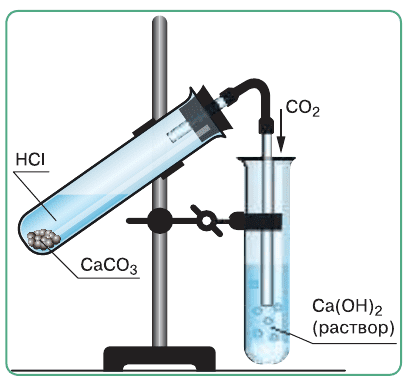
Рис. 49. Прибор для получения углекислого газа
5) Продолжайте пропускать газ через помутневший раствор. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
Примечание. Если скорость выделения газа замедлилась, то в пробирку с мрамором можно добавить немного соляной кислоты.
6) Промойте конец газоотводной трубки в стакане с водой. Перенесите газоотводную трубку в четвёртую пробирку, опустив её до дна пробирки. Соберите газ методом вытеснения воздуха (почему именно этим методом?).
7) Зажгите лучинку и внесите её в пробирку. Что наблюдаете? Объясните наблюдаемое.
8) В одну чистую пробирку налейте 2 мл раствора карбоната натрия, в другую — 2 мл раствора карбоната калия. Добавьте в каждую пробирку 1—2 мл раствора серной кислоты. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной формах. Разберите установку и приведите в порядок рабочее место. Оформите отчёт.Ответ:
1) В две пробирки налили по 20 капель дистиллированной воды и добавили по 3—4 капли раствора фиолетового лакмуса. В третью пробирку внесли примерно 20 капель раствора известковой воды. Установили пробирки в штатив. Туда же поместили и три пустые пробирки.
2) В прибор для получения газов внесли 2—3 небольших кусочка мрамора и закрепили прибор в лапке штатива. В воронку налили немного соляной кислоты, чтобы она покрывала кусочки мрамора. Газоотводную трубку прибора опустили в пробирку с водой, подкрашенной раствором лакмуса.
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2} + H_{2}O$
$CaCO_{3} + 2H^{+} + 2Cl^{-} = Ca^{2+} + 2Cl^{-} + CO_{2} + H_{2}O$
$CaCO_{3} + 2H^{+} = Ca^{2+} + CO_{2} + H_{2}O$
Наблюдаем выделение бесцветного газа − углекислого газа.
3) Пропускали выделяющийся оксид углерода (IV) через воду до тех пор, пока раствор лакмуса не приобрел красную окраску.
$CO_{2} + H_{2}O = H_{2}CO_{3} = H^{+} + HCO_{3}^{-} = 2H^{+} + CO_{3}^{2-}$
Наблюдаем образование раствора красного цвета.
4) Промыли конец газоотводной трубки в стакане с водой. После этого конец газоотводной трубки перенесли в пробирку с известковой водой и пропускали газ до помутнения раствора.
5) Продолжали пропускать газ через помутневший раствор.
$CO_{2} + CaCO_{3} + H_{2}O = Ca(HCO_{3})_{2}$
$CO_{2} + CaCO_{3} + H_{2}O = Ca^{2+} + 2HCO_{3}^{-}$
Примечание. Если скорость выделения газа замедлилась, то в пробирку с мрамором добавляли немного соляной кислоты.
6) Промыли конец газоотводной трубки в стакане с водой. Перенесли газоотводную трубку в четвёртую пробирку, опустив её до дна пробирки. Собрали газ методом вытеснения воздуха.
Так как углекислый газ тяжелее воздуха, то его собирают методом вытеснения воздуха.
7) Зажгли лучинку и внесли её в пробирку.
Лучинка гаснет, так как углекислый газ не поддерживает горение.
8) В одну чистую пробирку налили 2 мл раствора карбоната натрия, в другую — 2 мл раствора карбоната калия. Добавили в каждую пробирку 1—2 мл раствора серной кислоты.
При добавлении серной кислоты к карбонатам наблюдаем выделение пузырьков газа − углекислый газ.
$Na_{2}CO_{3} + H_{2}SO_{4} = Na_{2}SO_{4} + CO_{2} + H_{2}O$
$2Na^{+} + CO^{2-}_{3} + 2H^{+} + SO^{2-}_{4} = 2Na^{+} + SO^{2-}_{4} + CO_{2} + H_{2}O$
$CO^{2-}_{3} + 2H^{+} = CO_{2} + H_{2}O$
$K_{2}CO_{3} + H_{2}SO_{4} = K_{2}SO_{4} + CO_{2} + H_{2}O$
$2K^{+} + CO^{2-}_{3} + 2H^{+} + SO^{2-}_{4} = 2K^{+} + SO^{2-}_{4} + CO_{2} + H_{2}O$
$CO^{2-}_{3} + 2H^{+} = CO_{2} + H_{2}O$
Разобрали установку и привели в порядок рабочее место. §22
-
§22. Углеводороды
Вопрос в начале параграфа✓
В неорганической химии чаще используют понятие «степень окисления», чем понятие «валентность», а в органической химии − наоборот. Сравните эти понятия на примере веществ, о которых пойдёт речь в параграфе.
Ответ:
Понятие «валентность» применяют для соединений, образованных с помощью ковалентной связи. Валентность определяется только числом ковалентных связей без учета полярности образованных связей, поэтому валентность не имеет знака и приобретает значение от I до VIII.
Для соединений независимо от вида химической связи, применяется более универсальное понятие «степень окисления», это понятие условное для веществ образованных с помощью ковалентной связи. Степень окисления, в отличие от валентности, может иметь положительное, отрицательное и нулевое значение. Степень окисления в простых веществах равна нулю, а валентность имеет значение отличное от нуля.
Например, степень окисления атома углерода в ацетилене ($C_{2}H_{2}$) равна –1, а валентность — четырём.Проверьте свои знания
1. Что является предметом изучения органической химии?
Ответ:
Предметом изучения органической химии являются органические вещества.
2. Что такое химическое строение? Что обозначает валентный штрих в структурных формулах органических веществ?
Ответ:
Химическое строение – порядок соединения атомов в молекуле, их взаимное расположение в пространстве.
Валентным штрихом в структурных формулах органических веществ обозначают химическую связь.3. Какие органические вещества называют углеводородами? На какие группы их подразделяют?
Ответ:
Углеводороды − органические вещества, состоящие из атомов углерода и водорода.
По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.4. Дайте сравнительную характеристику метана и этана. Найдите черты сходства и различия в их строении.
Ответ:
В простейшем углеводороде − метане $CH_{4}$, как и во всех органических соединениях, атом углерода четырёхвалентен, а валентность атома водорода, как и в любых других веществах, равна единице. На рисунке 50 изображена объёмная модель молекулы метана. В таких моделях атомы разных элементов изображают в виде шариков разного размера и цвета. Атом углерода принято изображать чёрным шариком, водорода − белым, кислорода − красным и т.д.
Рис. 50. Модель молекулы метана
Рассмотрим химическое строение ещё одного углеводорода − этана ($C_{2}H_{6}$). Атомов углерода в молекуле этана два, они связаны одной общей электронной парой, т.е. одной ковалентной связью. Оставшиеся три электрона у каждого атома углерода расходуются на образование ковалентных связей с атомами водорода.
Рис. 51. Модель молекулы этана5. Дайте сравнительную характеристику этана, этилена и ацетилена. Найдите черты сходства и различия в их строении и свойствах.
Ответ:
Рассмотрим химическое строение этана. Атомов углерода в молекуле этана два, они связаны одной общей электронной парой, т.е. одной ковалентной связью. Оставшиеся три электрона у каждого атома углерода расходуются на образование ковалентных связей с атомами водорода.
Этилен − первый представитель углеводородов, которые называют непредельными или ненасыщенными, так как в них валентности атомов углерода не насыщены до предела атомами водорода. Отличительной чертой химического строения таких углеводородов является наличие в молекуле двойной углерод−углеродной связи C=C. К группе непредельных углеводородов, помимо этилена, относят ещё один углеводород − ацетилен.
Молекулярная формула ацетилена $C_{2}H_{2}$, и индексы в этой формуле нельзя сокращать. Степень окисления атома углерода в ацетилене равна −1, а валентность − четырём. Химическая связь между атомами углерода в ацетилене тройная, этот углеводород также относится к непредельным.Примените свои знания
6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: $C → Be_{2}C → CH_{4} → CO_{2} → CaCO_{3}$.
Ответ:
$C → Be_{2}C → CH_{4} → CO_{2} → CaCO_{3}$
1) $C + 2Be = Be_{2}C$
2) $Be_{2}C + 4HCl = 2BeCl_{2} + CH_{4}$
3) $CH_{4} + 2O_{2} = CO_{2} + 2H_{2}O$
4) $CaO + CO_{2} = CaCO_{3}$7. Рассчитайте степени окисления атомов углерода в метане, этане, этилене и ацетилене.
Ответ:
Метан: $C^{-4}H^{+1}_ {4}$
Степень оксиления углерода в метане равна −4.
Этан: $C^{-3}_ {2}H^{+1}_ {6}$
Степень оксиления углерода в этане равна −3.
Этилен: $C^{-2}_ {2}H^{+1}_ {4}$
Степень оксиления углерода в этилене равна −2.
Ацетилен: $C^{-1}_ {2}H^{+1}_{2}$
Степень оксиления углерода в ацетилене равна −1.8. При обработке 41,7 г технического карбида кальция избытком соляной кислоты выделилось 13,44 л ацетилена (н. у.). Рассчитайте массовую долю карбида кальция в техническом образце.
Ответ:
Дано:
m ($CaC_{2}$) = 41,7 г
V ($C_{2}H_{2}$) = 13,44 л
Найти:
ω ($CaC_{2}$) − ?
Решение:
$CaC_{2} + 2H_{2}O = Ca(OH)_{2} + C_{2}H_{2}$
n ($C_{2}H_{2}$) = V : $V_{m}$ = 13,4 л : 22,4 л/моль = 0,6 моль
n ($CaC_{2}$) = n ($C_{2}H_{2}$) = 0,6 моль
m ($CaC_{2}$) = n * M = 0,6 моль * 64 г/моль = 38,4 г
ω ($CaC_{2}$) = 38,4 г : 41,7 г * 100% = 92,1 %
Ответ: ω ($CaC_{2}$) = 92,1 %.Используйте дополнительную информацию
Подготовьте сообщение о жизни и деятельности великого русского химика Александра Михайловича Бутлерова.
Ответ:
Бутлеров Александр Михайлович (1828–1886) — русский учёный, химик, сделавший немало важных научных открытий. Вошёл в историю как основатель научной школы органической химии, создатель теории строения органических веществ.
Спустя 7 лет после начала обучения, в 1851 г. Александр Михайлович защитил в Казанском университете свою работу на звание магистра химии, посвященную окислению органических соединений. Через 3 года в Москве он защитил диссертацию на присуждение ему научной степени доктора химических наук, в которой он исследовал эфирные масла. В 1858 г. на Парижской конференции он обратил на себя внимание научной общественности своим выступлением об общем строении тел.
Самым значительным научным достижением А. М. Бутлерова является то, что он стал основоположником теории химического строения веществ («структурной теории»). Это учение, которое является основой современной органической химии, положило начало синтезу множества новых органических соединений. §23
-
§23. Кислородосодержащие органические соединения
Вопрос в начале параграфа✓
Кроме углерода и водорода, многие органические соединения содержат в составе своих молекул и атомы кислорода. Эти многочисленные соединения объединены в классы. Что представляют собой эти классы и каковы их важнейшие представители?
Ответ:
Спирты и карбоновые кислоты содержат атомы кислорода.
Представитель спиртов: этиловый спирт.
Представитель карбоновых кислот: уксусная кислота.Вопрос (стр.120)?
Попробуйте изобразить структурную формулу простейшего спирта, содержащего три гидроксильные группы. Каждая группа −OH должна быть связана со своим собственным атомом углерода. Помните, что атомы углерода в органических веществах четырёхвалентны.
Ответ:
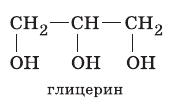
Модель молекулы глицерина:
Проверьте свои знания
1. Какие вещества называют спиртами? На какие группы делят этот класс органических соединений? Приведите примеры.
Ответ:
Спирты – органические соединения, содержащие одну или более гидроксильных групп (–OH), непосредственно связанных с насыщенным атомом углерода.
Спирты делятся на одноатомные и многоатомные.
Примеры одноатомных спиртов: метиловый спирт, этиловый спирт.
Примеры многоатомных спиртов: этиленгликоль, глицерин.2. Какие вещества называют карбоновыми кислотами? На какие группы делят этот класс органических соединений? Приведите примеры.
Ответ:
Карбоновые кислоты — органические вещества молекулы которых содержат карбоксильную группу (–COOH).
Классификация по строению углеводородного радикала:
1) Предельные карбоновые кислоты: карбоксильная группа COOH соединена с предельным радикалом.
2) Непредельные карбоновые кислоты: карбоксильная группа COOH соединена с непредельным радикалом.
3) Ароматические кислоты: карбоксильная группа COOH соединена с бензольным кольцом.Примените свои знания
3. Напишите уравнение реакции получения этилового спирта из этилена.
Ответ:
Уравнение реакции получения этилового спирта из этилена:
4. Охарактеризуйте области применения этанола, его физиологическое действие на организм человека.
Ответ:
Этанол $C_{2}H_{5}OH$ − продукт много−тоннажного химического производства. Он служит сырьём для получения многих органических веществ, его используют в медицине, пищевой промышленности, как компонент парфюмерных и косметических препаратов. В некоторых странах этиловый спирт (этанол) используют в качестве моторного топлива в смеси с бензином или даже в чистом виде.
Этиловый спирт обладает прекрасной растворяющей способностью. Он легко растворяет жиры и другие органические вещества, поэтому его используют как компонент растворителей для лаков, красок, эмалей, средств бытовой химии.
Этиловый спирт входит в состав алкогольных напитков. В малых дозах он может на некоторое время улучшать самочувствие человека, помогает расслабиться, справиться со стрессом. Тем не менее даже при разовом употреблении спиртного работа нервной системы нарушается, а приём больших доз этилового спирта может привести к смерти. Если же употребление спиртных напитков, даже слабоалкогольных, становится систематическим, у человека может развиться неизлечимое хроническое заболевание − алкоголизм. При этом в организме происходят необратимые изменения; больному требуется постоянное поступление в организм новых порций спирта. Погибают не только нервные клетки, но и клетки печени, нарушается работа сердца, снижается вероятность рождения здорового ребёнка.5. В чём заключается принципиальное отличие многоатомных спиртов от одноатомных?
Ответ:
В молекуле этилового спирта есть одна гидроксильная группа. Такие спирты называют одноатомными спиртами.
Молекула органического вещества может содержать не только одну, но и две и более гидроксильные группы. В этом случае спирты называют многоатомными спиртами.
Различить растворы многоатомных и одноатомных спиртов можно с помощью свежеосажденного гидроксида меди (II). В растворе многоатомного спирта будет наблюдаться растворение гидроксида меди (II) и окрашивание раствора в синий цвет. В растворе с одноатомным спиртом изменений наблюдаться не будет.6. Напишите, какие вещества вступили в реакции, если в результате получились следующие вещества:
а) … → $2CH_{3}COOK + CO_{2} + H_{2}O$
б) … → $(CH_{3}COO)_{2}Zn + H_{2}$
в) … → $2CH_{3}COONa + H_{2}O$
г) … → $(CH_{3}COO)_{2}Mg + 2H_{2}O$
Напишите уравнения полностью.Ответ:
а) При взаимодействии уксусной кислоты и карбоната кальция образуется ацетат калия, углекислый газ и вода:
$2CH_{3}COOH + K_{2}CO_{3}$ → $2CH_{3}COOK + CO_{2} + H_{2}O$
б) При взаимодействии уксусной кислоты и цинка образуется ацетат цинка, водород:
$2CH_{3}COOH + Zn$ → $(CH_{3}COO)_{2}Zn + H_{2}$
в) При взаимодействии уксусной кислоты и гидроксида натрия образуется ацетат натрия и вода:
$CH_{3}COOH + NaOH$ → $CH_{3}COONa + H_{2}O$
г) При взаимодействии уксусной кислоты и гидроксида магния образуется ацетат магния и вода:
$2CH_{3}COOH + Mg(OH)_ {2}$ → $(CH_{3}COO)_{2}Mg + 2H_{2}O$7. Какую массу воды нужно добавить к 40 г 70 %−ного раствора глицерина, чтобы получить 5 %−ный раствор?
Ответ:
Дано:
m (глицерина) = 40 г
ω = 70%
$ω_{1}$ = 5%
Найти:
m ($H_{2}O$) − ?
Решение:
$ω_{1}$ = $\frac{m(в-ва)}{m(р-ра)\;+\;m (H_{2}O)}$ * 100%
m (в−ва) = m (р−ра) * ω = 40 г * 0,7 = 28 г
0,05 = $\frac{28\;г }{40\;г\;+\;m(H_{2}O)}$
40 г + m ($H_{2}O$) = 560 г
m ($H_{2}O$) = 560 г − 40 г = 520 г
Ответ: m ($H_{2}O$) = 520 г.8. Смешали 90 г 10 %−ного раствора уксусной кислоты и 160 г 5 %−ного раствора гидроксида натрия. Рассчитайте массовые доли веществ в полученном растворе.
Ответ:
Дано:
m ($CH_{3}COOH$) = 90 г
ω = 10%
m (NaOH) = 160 г
ω = 5%
Найти:
ω ($CH_{3}COONa$) − ?
ω (NaOH) − ?
Решение:
$CH_{3}COOH + NaOH = CH_{3}COONa + H_{2}O$
m ($CH_{3}COOH$) = 90 * 0,1 = 9 г
n ($CH_{3}COOH$) = m : M = 9 : 60 = 0,15 моль − недостаток
m (NaOH) = 160 * 0,05 = 8 г
n (NaOH)= m : M = 8 : 40 = 0,2 моль − избыток
n ($CH_{3}COONa$)= 0,15 моль
m ($CH_{3}COONa$) = n * M= 82 * 0,15 = 12,3 г
n (NaOH) ост. = 0,2 − 0,15 = 0,05 моль
m (NaOH) ост. = n * M= 40 * 0,05 = 2 г
m (р−ра) = 90 + 160 = 250 г
ω ($CH_{3}COONa$) = 12,3 г : 250 г * 100% = 4,92%
ω (NaOH) = 2 г : 250 г * 100% = 0,8%
Ответ: ω ($CH_{3}COONa$) = 4,92%; ω (NaOH) = 0,8%.Используйте дополнительную информацию
Подготовьте сообщение по теме «Алкоголизм и его профилактика», используя возможности Интернета.
Ответ:
Алкоголизм и его профилактика
Лечение и профилактика алкоголизма − это комплекс мер, направленных на предупреждение возникновения заболевания, его терапию и предупреждение возможных срывов.
Основными целями профилактической работы являются:
1) предотвращение начала развития болезни;
2) подавление желания употреблять спиртные напитки тем лицам, которые прошли лечение пристрастия;
3) ограничительные меры.
Профилактика алкоголизма
Выделяют три этапа профилактики:
• Первичная профилактика направлена на предупреждение возникновения алкоголизма. Такие мероприятия обычно направлены на рассказ о пагубных действиях алкоголя.
• Вторичная профилактика направлена уже на лечение больных алкоголизмом. В эту программу входит работа с семьей больного, его встреча с бывшими алкоголиками, собеседование и социально−психологическая помощь.
• Третичная профилактика направлена на оказание помощи выздоравливающим от алкоголизма людям. В эту программу входит психологическая консультация и посещение общества анонимных алкоголиков. §24
-
§24. Кремний и его соединения
Вопрос в начале параграфа✓
Если углерод — главный элемент живой природы, то кремний — главный элемент неживой природы. Почему?
Ответ:
По содержанию в земной коре элемент кремний занимает второе место после кислорода. В свободном состоянии кремний в природе не встречается, самым распространённым соединением кремния считают его оксид, на долю которого в сочетании с оксидами металлов приходится 90 % массы литосферы.
Лабораторный опыт 40
Соберите прибор для получения газов. Получите углекислый газ взаимодействием мрамора с соляной кислотой. Пропускайте углекислый газ через раствор силиката натрия. Что наблюдаете? Сравните силу угольной и кремниевой кислот.
Ответ:
Собрали прибор для получения газов. Получили углекислый газ взаимодействием мрамора с соляной кислотой.
$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}$
Пропустили углекислый газ через раствор силиката натрия.
$CO_{2} + Na_{2}SiO_{3} = Na_{2}CO_{3} + SiO_{2}$
Наблюдаем выпадение белого осадка.
Угольная и кремниевая кислоты являются слабыми, но угольная кислота сильнее, чем кремниевая, т.к. угольная кислота вытесняет кремниевую из её соли.Проверьте свои знания
1. Запишите схему строения атома кремния и укажите степени окисления, характерные для этого элемента в соединениях. Приведите примеры формул соединений кремния.
Ответ:
Строение атома.
Поскольку кремний расположен в периодической системе элементов Д. И. Менделеева в третьем периоде, в IVА−группе, то схема строения его атома следующая: 2e, 8e, 4e.
Степени окисления, характерные для кремния в соединениях: −4, 0, +2, +4.
Примеры соединений кремния: $SiO_{2}, H_{2}SiO_{3}$.2. Охарактеризуйте способы получения, свойства и применение кристаллического кремния. Ответ подтвердите уравнениями соответствующих реакций.
Ответ:
В современных электронных приборах используется кремний очень высокой чистоты. Содержание примесей в кристалле не должно превышать 0,00000001%! Такой фантастически чистый кремний получают либо в результате очень сложного технологического процесса удаления примесей, либо разложением летучего водородного соединения кремния − силана:
$SiH_{4} = Si + 2H_{2}$
Окислительные свойства этот неметалл проявляет только по отношению к металлам. Реакции соединения протекают при очень высоких температурах и приводят к образованию силицидов. Например, расплавленный кальций реагирует с порошком кремния с образованием силицида кальция: $2Ca + Si = Ca_{2}Si$
Кремний не реагирует с водородом, но образует летучее водородное соединение. Силан получают действием воды или кислот на силициды активных металлов:
$Ca_{2}Si + 4HCl = 2CaCl_{2} + SiH_{4}↑$
Восстановительные свойства кремний проявляет при взаимодействии с неметаллами (галогенами, кислородом), а также с некоторыми сложными веществами. Из неметаллов при комнатной температуре кремний реагирует только со фтором:
$Si + 2F_{2} = SiF_{4}$Примените свои знания
3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$SiO_{2} → Si → Ca_{2}Si → SiH_{4} → SiO_{2} → K_{2}SiO_{3} → H_{2}SiO_{3} → SiO_{2}$.Ответ:
$SiO_{2} → Si → Ca_{2}Si → SiH_{4} → SiO_{2} → K_{2}SiO_{3} → H_{2}SiO_{3} → SiO_{2}$
$SiO_{2} + 2Mg = Si + 2MgO$
$Si + 2Ca = Ca_{2}Si$
$Ca_{2}Si + 4HCl = 2CaCl_{2} + SiH_{4}↑$
$SiH_{4} + 2O_{2} = SiO_{2} + 2H_{2}O$
$SiO_{2} + 2KOH = K_{2}SiO_{3} + H_{2}O$
$K_{2}SiO_{3} + 2HCl = 2KCl + H_{2}SiO_{3}↓$
$H_{2}SiO_{3} = H_{2}O + SiO_{2}$4. Почему щёлочи в лаборатории хранят не в стеклянных сосудах, а в полимерных упаковках?
Ответ:
Щёлочи в лаборатории хранят не в стеклянных сосудах, а в полимерных упаковках, потому что они медленно реагируют с основным компонентом стекла – оксидом кремния (IV):
$SiO_{2} + 2KOH = K_{2}SiO_{3} + H_{2}O$5. Какой объём водорода (н. у.) образуется при взаимодействии 96 г кремния, содержащего 5 % примесей, с избытком раствора гидроксида натрия? Какое количество вещества гидроксида натрия потребуется для реакции?
Ответ:
Дано:
m (Si) = 96 г
ω (примеси) = 5%
Найти:
V ($H_{2}$) − ?
n (NaOH) − ?
Решение:
$Si + 2NaOH + H_{2}O = Na_{2}SiO_{3} + 2H_{2}$
ω (Si)= 100% − 5% = 95%
m (Si) = 96 * 0,95 = 91,2 г
n (Si) = m : M = 91,2 г : 28 г/моль = 3,26 моль
n (NaOH) = 2 * n (Si) = 3,26 моль * 2 = 6,52 моль
n ($H_{2}$) = 2 * n (Si) = 3,26 моль * 2 = 6,52 моль
V ($H_{2}$) = n * $V_{m}$ = 6,52 моль * 22,4 л/моль = 146,1 л
Ответ: n (NaOH) = 6,52 моль; V ($H_{2}$) = 146,1 л.6. Охарактеризуйте области применения кремния и его соединений. Перечислите предметы быта, домашнего обихода, при изготовлении которых использован кремний и кремнийсодержащие вещества.
Ответ:
В современных электронных приборах используется кремний очень высокой чистоты. Содержание примесей в кристалле не должно превышать 0,00000001%! Такой фантастически чистый кремний получают либо в результате очень сложного технологического процесса удаления примесей, либо разложением летучего водородного соединения кремния − силана.
Предметы быта, домашнего обихода, при изготовлении которых использован кремний и кремнийсодержащие вещества: процессоры, микроконтроллеры, солнечные ячейки и батареи, цемент, стекло, датчики света.7. Выполните домашний эксперимент «Силикатный сад».
Реактивы и оборудование: соли — медный купорос, железный купорос (их можно приобрести в магазине товаров для сада и огорода), силикатный клей (1—2 тюбика), несколько баночек из бесцветного стекла (сколько солей возьмёте для опытов, столько нужно и баночек).
Ход работы. Разбавьте клей водой (1 : 1). Налейте раствор в баночки из бесцветного стекла. На донышки предварительно положите несколько крупных кристаллов одной из указанных солей. В течение нескольких дней наблюдайте за происходящими изменениями. Напишите отчёт о проделанной работе. Не забудьте про уравнения реакций!Ответ:
Разбавили клей водой (1 : 1). Налили раствор в баночки из бесцветного стекла. На донышки предварительно положили несколько крупных кристаллов одной из указанных солей. В течение нескольких дней наблюдали за происходящими изменениями.
Реакции с медным купоросом:
$CuSO_{4} + K_{2}SiO_{3} ⟶ K_{2}SO_{4} + CuSiO_{3}↓$
$CuSO_{4} + Na_{2}SiO_{3} ⟶ Na_{2}SO_{4} + CuSiO_{3}↓$
Реакции с железным купоросом:
$FeSO_{4} + K_{2}SiO_{3} ⟶ K_{2}SO_{4} + FeSiO_{3}↓$
$FeSO_{4} + Na_{2}SiO_{3} ⟶ Na_{2}SO_{4} + FeSiO_{3}↓$Выразите свое мнение
Как вы думаете, почему углерод называют главным элементом живой природы, а кремний — основным элементом неживой природы?
Ответ:
Углерод называют главным элементом живой природы, так как углерод является "скелетом" всех органических соединений.
Кремний является основным элементом неживой природы, так как основной компонент земной коры – оксид кремния (IV). §25
-
§25. Силикатная промышленность
Вопрос в начале параграфа✓
Секрет изготовления этого материала открыли китайские мастера в VI—VII вв. Он стал альтернативой камню, дереву, глине и отличался невероятной красотой и практичностью. Люди говорили, что изделия из этого материала белы, как снег, тонки, как бумага, и прочны, как металл. Секрет изготовления этого материала китайские мастера свято хранили почти тысячу лет. Того, кто дерзнул бы выдать этот секрет, ждала неминуемая смерть. О каком материале идёт речь? Какие изделия из него есть у вас дома?
Ответ:
Речь идет о фарфоре.
Из фарфора изготавливают:
1) посуду;
2) статуэтки;
3) элементы корпуса часов;
4) плафоны для ламп;
5) различные панно и другие предметы декора.Проверьте свои знания
1. Назовите основные виды продукции силикатной промышленности.
Ответ:
Основные виды продукции силикатной промышленности: стекло, цемент, кирпич, керамика, фарфор, фаянс.
2. Какие природные и химические материалы служат сырьём для производства цемента, стекла, керамики?
Ответ:
Сырьё для производства цемента:
известняк ($CaCO_{3}$), глина ($SiO_{2}, Al_{2}O_{3}$ и незначительное кол−во $Fe_{2}O_{3}$), гипс ($CaSO_{4} * 2H_{2}O$).
Сырьё для производства стекла:
сода ($Na_{2}CO_{3}$), известняк ($CaCO_{3}$), песок ($SiO_{2}$).
Сырьё для производства керамики:
глина ($SiO_{2}, Al_{2}O_{3}$ и незначительное кол−во $Fe_{2}O_{3}$).Примените свои знания
3. При прокаливании строительное связующее гипс, имеющее формулу $CaSO_{4} ⋅ 2H_{2}O$, превращается в алебастр состава $CaSO_{4} ⋅ 0,5H_{2}O$. При добавлении воды алебастр быстро твердеет, вновь превращаясь в гипс. Какая масса воды потребуется для превращения в гипс 14,5 кг алебастра?
Ответ:
Дано:
m ($CaSO_{4} ⋅ 0,5H_{2}O$) = 14,5 кг
Найти:
m ($H_{2}O$) − ?
Решение:
$CaSO_{4} * 0,5H_{2}O + 1,5 H_{2}O = CaSO_{4} * 2H_{2}O$
n ($CaSO_{4} * 0,5H_{2}O$) = m : M = 14500 : 145 = 100 моль
n ($H_{2}O$) = 1,5 * n ($CaSO_{4} * 0,5H_{2}O$) = 1500 моль
m ($H_{2}O$) = n * M = 1500 * 18 = 27000 г = 27 кг
Ответ: 27 кг.4. Найдите массу каждого из компонентов шихты (смеси), необходимых для получения 10 т оконного стекла согласно уравнению реакции
$Na_{2}CO_{3} + CaCO_{3} + 6SiO_{2} = Na_{2}O ⋅ CaO ⋅ 6SiO_{2} + 2CO_{2}↑$
Какой объём углекислого газа (н. у.) образуется при этом?Ответ:
Дано:
m (стекла) = 10 т
Найти:
m ($Na_{2}CO_{3}$) − ?
m ($CaCO_{3}$) − ?
m ($SiO_{2}$) − ?
V ($CO_{2}$) − ?
Решение:
$Na_{2}CO_{3} + CaCO_{3} + 6SiO_{2} = Na_{2}O * CaO * 6SiO_{2} + 2CO_{2}$
n ($Na_{2}O * CaO * 6SiO_{2}$) = m : M = 10000000 : 478 = 20921 моль
n ($Na_{2}CO_{3}$) = n ($Na_{2}O * CaO * 6SiO_{2}$) = 20921 моль
m ($Na_{2}CO_{3}$) = n * M = 20921 * 106 = 2217626 г = 2,22 т
n ($CaCO_{3}$) = n ($Na_{2}O * CaO * 6SiO_{2}$) = 20921 моль
m ($CaCO_{3}$) = n * M = 20921 * 100 = 2092100 г = 2,01 т
n ($SiO_{2}$) = 6 * n ($Na_{2}O * CaO * 6SiO_{2}$) = 6 * 20921 = 125526 моль
m ($SiO_{2}$) = n * M = 125526 * 60 = 7531560 г = 7,53 т
n ($CO_{2}$) = 2 * n ($Na_{2}O * CaO * 6SiO_{2}$) = 2 * 20921 = 41842 моль
V ($CO_{2}$) = n * Vm = 41842 * 22,4 = 937261 л = 937,3 $м^{3}$
Ответ: m ($Na_{2}CO_{3}$) = 2,22 т; m ($CaCO_{3}$) = 2,01 т; m ($SiO_{2}$) = 7,53 т; V ($CO_{2}$) = 937,3 $м^{3}$.Используйте дополнительную информацию
1. Прочтите стихотворение.
Покушав как−то травку,
Зашёл слон по делам
В фарфоровую лавку
И… повернулся там!
Мораль сей басни впереди,
Она острей булавки.
Коль ты есть слон, то не ходи
В фарфоровые лавки!
Что означает фраза «слон в посудной лавке», которая положена в основу этой мини−басни? Кто автор этого стихотворения?Ответ:
Басня «О слонах и фарфоре» принадлежит перу русского поэта и драматурга Н.Я.Агнивцева (1888−1932).
Выражение «слон в посудной лавке» означает неуклюжесть и неповоротливость.2. Подготовьте сообщение об истории фарфоровой промышленности в России.
Ответ:
Большинство исторических источников указывают на то, что родиной фарфора является Китай. Там мастера научились получать такое сырьё приблизительно в VI−VIII веке н.э. Они быстро поняли, насколько уникален этот материал, и решили держать в строжайшем секрете формулу его получения.
В Среднюю Азию изделия из фарфора проникли ориентировочно в IX веке, а уже через 7 веков технология и формулы этого уникального материала попали к японским мастерам. В Европу фарфор попал позже всех (в XIV он был завезён из Китая Марко Поло), но известно, что, например, в России первые фабрики, производившие изделия из такой керамики появились только в XVIII веке.
Русский фарфор, к слову, заслуживает отдельного упоминания в рамках этого рассказа. Изначально он больше походил на фаянс по своим техническим характеристикам. Во времена развития фарфоровой промышленности в Царской России существовало два направления производства: частные мануфактуры, а также выпуск фарфоровых изделий под началом царской семьи (это не первая подобная практика, такое существовало, например, и у Медичи). §26
-
§26. Получение неметаллов
Вопрос в начале параграфа✓
Как металлы, так и неметаллы встречаются в природе в свободном виде и в форме соединений. Какие промышленные способы применяют для получения неметаллов?
Ответ:
Промышленные способы получения неметаллов можно разделить на три группы:
1) выделение простых веществ из природных объектов;
2) восстановление неметаллов, входящих в состав минералов;
3) окисление природных соединений.Проверьте свои знания
1. В каком виде встречаются неметаллы в природе? Приведите примеры.
Ответ:
Часть неметаллов встречается в природе в виде соединений, в которых атомы неметаллов проявляют только положительные степени окисления. Это фосфор, кремний, германий, бор и некоторые другие.
Другая часть неметаллов представлена соединениями, в которых они проявляют отрицательные степени окисления.2. Что такое фракционная перегонка воздуха? На каких физических свойствах компонентов воздуха основан этот способ его разделения? Какие продукты получают в результате фракционной перегонки жидкого воздуха?
Ответ:
Сложной технической задачей является разделение смеси газов, которой является воздух, на отдельные компоненты. Эта задача решается фракционной перегонкой (ректификацией) жидкого воздуха, т. е. его разделением на отдельные фракции − компоненты, имеющие определённые температуры кипения. Ректификацию осуществляют в специальных аппаратах − ректификационных колоннах.
Фракционная перегонка воздуха – способ разделения атмосферных газов, основанный на различной температуре кипения компонентов воздуха.
В результате фракционной перегонки жидкого воздуха получают кислород, аргон и азот.3. Что называют электролизом? Какие неметаллы получают с помощью электролиза?
Ответ:
Реакцию разложения электролита под действием электрического тока называют электролизом.
Путём электролиза получают активные неметаллы: галогены, водород, кислород.Примените свои знания
4. Приведите примеры природных веществ, в которых неметаллы находятся в отрицательных, нулевой и положительных степенях окисления. Какие способы − физические или химические − лежат в основе получения каждого из этих неметаллов в чистом виде?
Ответ:
Нулевая степень окисления: кислород, азот, аргон.
Способ получения: физический (фракционная перегонка).
Положительная степень окисления: фосфориты.
Способ получения: химический.
Отрицательная степень окисления: хлорид натрия.
Способ получения: электрохимический (электролиз).5. Какие массы кислорода и азота можно получить из 2000 $м^{3}$ воздуха (н. у.), в котором объёмная доля кислорода составляет 21 %, а азота − 78 %?
Ответ:
Дано:
V (воздуха) = 2000 $м^{3}$
φ ($O_{2}$) = 21%
φ ($N_{2}$) = 78%
Найти:
m ($O_{2}$) − ?
m ($N_{2}$) − ?
Решение:
V ($O_{2}$) = 2000 * 0,21 = 420 $м^{3}$ = 420000 л
n ($O_{2}$) = V : $V_{m}$ = 420000 : 22,4 = 18750 моль
m ($O_{2}$) = n * M = 18750 * 32 = 600000 г = 600 кг
V ($N_{2}$) = 2000 * 0,78 = 1560 $м^{3}$ = 1560000 л
n ($N_{2}$) = V : $V_{m}$ = 1560000 : 22,4 = 69643 моль
m ($N_{2}$) = n * M = 69643 * 28 = 1950004 г = 1950 кг
Ответ: m ($O_{2}$) = 600 кг; m ($N_{2}$) = 1950 кг.6. Массовые доли элементов в минерале аурипигменте равны: мышьяк — 61 %, сера — 39 %. Определите формулу минерала.
Ответ:
Дано:
ω (As) = 61%
ω (S) = 39%
Найти:
формула − ?
Решение:
x − индекс мышьяка
y − индекс серы
x : y = (0,61 : M (As)) : (0,39 : M(S)) = 0,0081 : 0,0122 = 2 : 3
$As_{2}S_{3}$ − формула
Ответ: $As_{2}S_{3}$.7. Какую массу фосфора можно получить из 387,5 кг фосфорита, массовая доля фосфата кальция в котором составляет 80 %?
Ответ:
Дано:
m (фосфорита) = 387,5 кг
ω = 80%
Найти:
m (P) − ?
Решение:
$Ca_{3}(PO_{4})_{2} + 3SiO_{2} + 5C = 3CaSiO_{3} + 5CO +2P$
m ($Ca_{3}(PO_{4})_ {2}$) = 387,5 * 0,8 = 310 кг = 310000 г
n ($Ca_{3}(PO_{4})_ {2}$)= m : M = 310000 : 310 = 1000 моль
n (P) = 2 * n ($Ca_{3}(PO_{4})_{2}$) = 2000 моль
m (P) = n * M = 2000 * 31 = 62000 г = 62 кг
Ответ: m (P) = 62 кг.8. Одним из промышленных способов получения кремния является восстановление его из оксида металлическим магнием. Какую массу песка, содержащего 96 % оксида кремния (IV), и какую массу магния необходимо взять для получения 84 г кремния?
Ответ:
Дано:
ω ($SiO_{2}$) = 96%
m (Si) = 84 г
Найти:
m (Mg) − ?
m (песка) − ?
Решение:
$2Mg + SiO_{2} = 2MgO + Si$
n (Si) = m : M = 84 : 28 = 3 моль
n (Mg) = 2 * n (Si) = 6 моль
m (Mg) = n * M = 6 * 24 =144 г
n ($SiO_{2}$) = n (Si) = 3 моль
m ($SiO_{2}$) = n * M = 3 * 60 =180 г
m (песка) =180 * 100% : 96% = 187,5 г
Ответ: m (Mg) =144 г; m (песка) = 187,5 г.9. Разложением при высокой температуре природного газа, основным компонентом которого является метан $CH_{4}$, получают сразу два важных неметалла — углерод в виде сажи и водород. Какой объём метана необходимо подвергнуть разложению, чтобы выделившегося водорода хватило для восстановления 23,2 г оксида вольфрама (VI)?
Ответ:
Дано:
m ($WO_{3}$) = 23,2 г
Найти:
V ($CH_{4}$) − ?
Решение:
$3H_{2} + WO_{3} = 3H_{2}O + W$
n ($WO_{3}$) = m : M = 23,2 : 232 = 0,1 моль
n ($H_{2}$) = 3 * n ($WO_{3}$) = 0,3 моль
$CH_{4} = C + 2H_{2}$
n ($CH_{4}$) = n ($H_{2}$) : 2 = 0,15 моль
V ($CH_{4}$) = n * $V_{m}$ = 0,15 * 22,4 = 3,36 л
Ответ: V ($CH_{4}$) = 3,36 л.Используйте дополнительную информацию
1. Подготовьте сообщение о жизни и деятельности Х. Дэви.
Ответ:
Английский химик, физик, геолог, один из основателей электрохимии, поэт Хемфри Дэви родился в октябре 1778 года в Пензансе, в семье резчика по дереву. Уже в детстве Хемфри всех удивлял своими необычайными способностями. После смерти отца Дэви стал учеником аптекаря, начал заниматься химией. Будущий ученый составил внушительный план самообразования, которому упорно следовал. Свое первое открытие Хемфри Дэви сделал в 17 лет – он обнаружил, что трение двух брусков льда друг о друга вызывает их плавление и предположил, что теплота является особым видом движения.
Нельзя сказать что великий ученый обладал абсолютным здоровьем, так в 1826 году его поражает первый апоплексический удар. Через год он отправляется в Лондон с братом. На пути в Англию 29 мая 1829 года Дэви получает второй удар, от которого он и скончался в возрасте 50 лет.
Похоронен в Лондоне на месте упокоения знатных людей Англии. В его честь было названо здание Университета. Медаль за важные открытия в области химии наст название "медаль Дэви". Его именем был назван кратер на луне.2. Подготовьте сообщение об истории открытия фтора.
Ответ:
Плавиковую кислоту в конце XVIII столетия удалось синтезировать шведскому фармацевту Шееле, открывшему кислород. Спустя век Джордж Горн сумел выделить небольшое количество фтора, но вещество мгновенного взорвалось.
Взяв за основу открытия предшественников, Анри Муассан создал V−образное электролизное устройство из платины. Хотя делать аппарат нужно было из меди, поскольку недорогой металл уменьшает воздействие агрессивного вещества. Плавиковую кислоту французский химик соединил с кристаллами гидродифторида калия, и использовал смесь в качества электролита.
Муассан погрузил аппарат в хлористый этил и снизил температуру в устройстве до −23°С. Фтор собирался в медные трубки. Пробки из плавикового шпата, которыми изолировались электроды, предотвращали возникновение реакции токсического элемента с другими веществами.
После заявления химика о получении фтора, Академия наук направила ученых на проверку изобретения, но аппарат при них начал барахлить. Не привела к успеху вторая попытку запустить электролиз.
Лишь на третий раз Муассан понял причину неудачи. Добавив в устройство фтористый калий и пропустив ток, химик получил свободный элемент, который до 1886 г. не удалось выделить никому. §27
-
§27. Получение важнейших химических соединений неметаллов
Вопрос в начале параграфа✓
Вы познакомились с производством простых веществ — неметаллов. А как в промышленности получают важнейшие соединения неметаллов?
Ответ:
Любое химическое производство состоит из отдельных взаимосвязанных процессов — стадий, главными из которых являются:
1) подготовка сырья и подвод реагирующих веществ в зону реакции;
2) проведение химических реакций;
3) отвод продуктов и непрореагировавших веществ из зоны реакции.
Процессы промышленного получения химических соединений сложны и масштабны.Проверьте свои знания
1. Назовите основные стадии химического производства: а) серной кислоты; б) аммиака.
Ответ:
а) Получают серную кислоту так называемым контактным способом в три стадии:
1) Получение оксида серы (IV). В качестве сырья применяют серу, серный колчедан или сероводород.
2) Получение оксида серы (VI). Окисление оксида серы (IV) кислородом в присутствии катализатора.
3) Получение серной кислоты. Связывание образующегося оксида серы(VI) водой.
б) Синтез аммиака в колоннах синтеза высотой 20 м в присутствии порошкообразного железа с примесью оксидов алюминия и калия. Эти колонны сделаны из специальных сортов стали, так как синтез протекает при 450−500°С и высоком давлении (до 200 атмосфер и выше):
$N_{2} + 3H_{2} = 2NH_{3}$
При прохождении через колонну синтеза только 0,1% азотоводородной смеси превращается в аммиак. Поэтому выходящую смесь газов охлаждают, аммиак сжижают, а не вступившие в реакцию азот и водород снова направляют в колонну синтеза.2. Охарактеризуйте основные методы и принципы химической технологии: метод кипящего слоя, принципы теплообмена, циркуляции, противотока.
Ответ:
Чтобы увеличить скорость обжига, используют принцип противотока — сверху в печь подают измельчённый колчедан, а снизу — воздух, обогащённый кислородом. Воздух вдувается через множество трубок под давлением, которое отрегулировано так, чтобы частицы колчедана не распылялись и не слёживались. Частицы колчедана оказываются во взвешенном состоянии, создавая иллюзию кипящей жидкости, поэтому и возникло название метод кипящего слоя.
Между слоями катализатора располагают трубки теплообменника, по которым газообразный оксид серы (IV) подаётся в контактный аппарат. При этом одновременно происходит нагревание оксида серы (IV) и охлаждение до необходимой температуры продукта реакции на данной стадии — оксида серы (VI). Этот принцип — принцип теплообмена широко применяют на химическом производстве. Температура в контактном аппарате поддерживается на уровне 400 °С. Выходящие из контактного аппарата газы направляются в трубки теплообменника для дальнейшего охлаждения и передачи теплоты очищенному и осушенному сернистому газу. Степень превращения $SO_{2}$ в $SO_{3}$ на современных сернокислотных заводах достигает 98 %. Непрореагировавшие оксид серы (IV) и кислород отделяются от полученного оксида серы (VI) и возвращаются в контактный аппарат. Этот принцип химического производства называют циркуляцией.3. Напишите уравнения химических реакций, лежащих в основе получения серной кислоты из серы. Какая из реакций является обратимой? Как в химической технологии решается вопрос максимального использования непрореагировавших исходных веществ?
Ответ:
Уравнения химических реакций, лежащих в основе получения серной кислоты из серы:
1) $S + O_{2} = SO_{2}$
2) $2SO_{2} + O_{2} = 2SO_{3}$ − обратимая реакция
3) $SO_{3} + H_{2}O = H_{2}SO_{4}$
Принцип циркуляции позволяет максимально эффективно использовать непрореагировавшие вещества: после реакции непрореагировавший диоксид серы вновь возвращается в контактный аппарат.4. Напишите уравнение химической реакции, лежащей в основе производства аммиака. Дайте характеристику этой реакции по всем известным вам признакам классификации.
Ответ:
Уравнение химической реакции, лежащей в основе производства аммиака:
$N_{2} + 3H_{2} = 2NH_{3}$
Реакция соединения, обратимая, каталитическая, окислительно−восстановительная, экзотермическая.Примените свои знания
5. На серно−кислотном заводе из 1 т серного колчедана получают 360 кг 100 %−ной серной кислоты. Рассчитайте массовую долю выхода продукта реакции.
Ответ:
Дано:
m ($FeS_{2}$) = 1 т
m ($H_{2}SO_{4}$) = 360 кг
ω = 100%
Найти:
m ($H_{2}SO_{4}$) − ?
Решение:
$4FeS_{2} + 11O_{2} = 2Fe_{2}O_{3} + 8SO_{2}$
$2SO_{2} + O_{2} = 2SO_{3}$
$SO_{3} + H_{2}O = H_{2}SO_{4}$
n ($FeS_{2}$) = m : M = 1000 : 88 = 8,33 кмоль
n ($SO_{2}$) = n ($H_{2}SO_{4}$) = 2 * n ($FeS_{2}$) = 16,66 кмоль
m ($H_{2}SO_{4}$) = n * M = 16,66 * 98 = 1630 кг
ω = 360 : 1630 * 100% = 22,1%
Ответ: m ($H_{2}SO_{4}$) = 22,1%.6. Какое количество теплоты выделится при взаимодействии 500 л азота с 1200 л водорода (н. у.), если тепловой эффект реакции равен 46 кДж на 1 моль аммиака?
Ответ:
Дано:
V ($N_{2}$) = 500 л
V ($H_{2}$) = 1200 л
Q = 46 кДж на n ($N_{2}$) = 1 моль
Найти:
Q − ?
Решение:
$N_{2} + 3H_{2} = 2NH_{3}$
V ($NH_{3}$) = 2 * V ($N_{2}$) = 1000 л
V ($NH_{3}$) = 2 * V ($H_{2}$) : 3 = 800 л
По недостатку:
n ($N_{2}$) = V : $V_{m}$ = 800 : 22,4 = 35,71 моль
Q = 46кДж/моль * 35,71 моль = 1643 кДж = 1,64 МДж
Ответ: Q = 1,64 МДж.Используйте дополнительную информацию
Изучите диаграмму индекса химического производства в России в период с 1991 по 2011 г.
Что показывает данная диаграмма? Какие выводы о состоянии химической промышленности в России в этот период можно сделать? Используя свои знания по истории России, соотнесите максимумы и минимумы на диаграмме с историческими событиями, происходившими в стране и мире в соответствующие годы.
Ответ:
Диаграмма показывает индекс химического производства РФ в денежном выражении в данном году к аналогичному объему в предыдущем году.
После распада СССР промышленность страны переживала спад, и это коснулось химических отраслей (1991−1998 гг.).
С формированием рыночной экономики, объем химического производства начинает расти до 2007 года. В 2008 г. начинается мировой финансовый кризис, который вызывает спад в химической отрасли. §28
-
ГЛАВА IV. Металлы и их соединения
§28. Общая характеристика металловВопрос в начале параграфа✓
Из 118 элементов периодической системы Д. И. Менделеева более 90 − это металлы. Что общего в строении атомов металлов? Какие физические свойства металлов обусловлены особенностями металлической кристаллической решётки?
Ответ:
Атомы металлов на внешнем энергетическом уровне, как правило, содержат от одного до трёх электронов. Для элементов А−групп это валентные электроны. Напомним, что валентными называют те электроны, которые участвуют в образовании химических связей. При образовании химических связей атомы металлов отдают валентные электроны. Этот факт указывает на то, что эти электроны относительно слабо связаны с ядром.
Такие свойства как пластичность, теплопроводность, отражающая способность и электропроводность обусловлены особенностями металлической кристаллической решётки.Вопрос (стр.146)?
Почему химические формулы таких неметаллов, как азот, кислород, озон, белый фосфор (соответственно $N_{2}, O_{2}, O_{3}, P_{4}$), записывают с использованием индекса, а химические формулы простых веществ — металлов — только символом элемента?
Ответ:
Дело в том, что деление элементов на металлы и неметаллы достаточно условно. Целый ряд «пограничных» элементов (например, германий, олово) проявляют переходные свойства. Атомы металлов, вступая друг с другом в химические связи, образуют простые вещества, которые также принято называть металлами. Названия химических элементов−металлов и соответствующих им простых веществ одинаковы.
Проверьте свои знания
1. Каковы особенности строения атомов металлов? Как в периодической системе Д. И. Менделеева располагаются элементы−металлы?
Ответ:
Атомы металлов на внешнем энергетическом уровне, как правило, содержат от одного до трёх электронов. Для элементов А−групп это валентные электроны. Напомним, что валентными называют те электроны, которые участвуют в образовании химических связей. При образовании химических связей атомы металлов отдают валентные электроны. Этот факт указывает на то, что эти электроны относительно слабо связаны с ядром.
Строение атомов металлов определяет их положение в периодической системе химических элементов Д. И. Менделеева. Во−первых, среди элементов А−групп примерно половина — металлы. Поскольку атомы металлов характеризуются малым числом валентных электронов, а их число совпадает с номером группы элемента, «левый фланг» элементов А−групп (I—II группы) занят металлами.
Во−вторых, к металлам относятся все элементы Б−групп.2. Из приведённого перечня выпишите названия металлов, запишите символы этих элементов: олово, кадмий, мышьяк, иод, олово, теллур, барий, криптон, молибден, селен, ртуть, бериллий, бор.
Ответ:
Металлы:
Олово − Sn
Кадмий − Cd
Мышьяк − As
Йод − $I_{2}$
Олово − Sn
Теллур − Te
Барий − Ba
Криптон − Kr
Молибден − Mo
Селен − Se
Ртуть − Hg
Бериллий − Be
Бор − B3. Какую связь называют металлической? Как происходит её образование в простых веществах — металлах?
Ответ:
Особенности строения атомов металлов отражаются и на природе химических связей, которые они образуют друг с другом. Эту связь называют металлической связью.
У металлов в кристаллическом состоянии в узлах кристаллической решётки располагаются катионы металлов или атомы металлов, а скрепляют этот «каркас» электроны, свободно перемещающиеся по всему кристаллу.4. Как устроена кристаллическая решётка металлов?
Ответ:
В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы, и наоборот.
5. Какие физические свойства обусловлены общим для всех металлов типом кристаллической решётки? Назовите области применения металлов, основанные на указанных вами физических свойствах.
Ответ:
Физические свойства, обусловленные общим для всех металлов типом кристаллической решётки:
1. Электропроводность. Серебро и золото обладают самой хорошей электропроводностью, они применяются в производстве электроники. Медь и алюминий применяются для проводов ЛЭП.
2. Теплопроводность. Медь и алюминий обладают самой хорошей теплопроводностью, их используются для производства радиаторов и теплообменников.
3. Металлический блеск. Хром применяют для производства зеркал и декоративных покрытий.
4. Пластичность. Самый пластичный металл − золото, его применяют в ювелирном деле, для декоративных покрытий (сусальное золото). Из железа изготавливают листы, трубы, вытягивают проволоку и т. д.Примените свои знания
6. Сравните металлическую кристаллическую решётку с ионной, атомной и молекулярной кристаллическими решётками.
Ответ:
В металлической решетке узлы очень прочно связаны друг с другом, что придет металлам твердость и относительно высокие температуры плавления, но высокая подвижность электронного газа делает металлы пластичными, а также электро− и теплопроводными.
В молекулярной кристаллической решетке связи между молекулами гораздо слабее, чем между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры кипения и плавления, часто летучи и имеют запах.
Вещества с немолекулярным (атомным, ионным) строением, наоборот, характеризуются высокими температурами кипения и плавления, обычно они твердые нелетучие, без запаха.7. Определите атомные номера и названия элементов по следующим данным:
а) расположен в пятом периоде, IIА−группе;
б) имеет 23 электрона в электронной оболочке;
в) заряд ядра атома равен +29;
г) в ядре его изотопа $Э^{65}$ содержится 35 нейтронов;
д) электронная оболочка атома состоит из трёх электронных слоёв, на внешнем слое расположен один электрон.Ответ:
а) Стронций (атомный номер − 38) расположен в пятом периоде, IIА−группе.
б) Ванадий (атомный номер − 23) имеет 23 электрона в электронной оболочке.
в) Медь (атомный номер − 29) − заряд ядра атома равен +29.
г) Цинк (атомный номер − 30) − в ядре его изотопа $Э^{65}$ содержится 35 нейтронов.
д) Натрий (атомный номер − 11) − электронная оболочка атома состоит из трёх электронных слоёв, на внешнем слое расположен один электрон.8. Какие свойства металлов использованы в образных выражениях «железный характер», «свинцовый кулак», «золотой характер», «серебряный дождь», «медный волос»?
Ответ:
Выражение Свойство
Железный характер Твердость
Свинцовый кулак Плотность
Золотой характер Редкость
Серебряный дождь Металлический блеск
Медный волос ЦветИспользуйте дополнительную информацию
Подготовьте сообщение по одной из тем:
1) «Элементы−металлы в организме человека и их биологическая роль»;
2) «Металлы в технике».Ответ:
Элементы−металлы в организме человека и их биологическая роль
1) Кальций
Только представьте, 1 кг вашего веса забирает данный металл. Этот элемент является составляющим каждой клетки. Основная локализация − кости, но он участвует не только в формировании скелета.
2) Калий
Содержится в клетках, регулирует водный баланс в организме и нормализует ритм сердца. Калий влияет на работу многих клеток в организме, особенно нервных и мышечных.
3) Натрий
C калием отвечает за движение жидкости. Калий содержится внутри клетки, натрий − снаружи. Пара калий/натрий отвечает за повышение или снижение артериального давления.
4) Магний
Играет важнейшую роль в организме человека, однако всего 50 грамм, которые содержатся в сердечной мышце, головном мозге и костях, к сожалению, не способны восполнить постоянный расход при стрессах, физических нагрузках, во время беременности и в период активного роста.
5) Железо
Принимает участие во многих процессах нашего организма. Самый важный из них − передача кислорода в ткани и мышцы. §29
-
§29. Химические свойства металлов
Вопрос в начале параграфа✓
Особенности строения атомов металлов объясняют тот факт, что металлы проявляют только восстановительные свойства, т. е. отдают валентные электроны. Какие вещества выступают в этом случае в роли окислителей?
Ответ:
В этом случае в роли окислителей выступают неметаллы.
Вопрос (стр.150)?
В 1865 г. выдающийся русский химик Н. Н. Бекетов защитил докторскую диссертацию на тему «Исследования над явлениями вытеснения одних металлов другими». Проанализируйте фрагмент химического эксперимента, выполненного Бекетовым. Цинк способен вытеснять железо из растворов солей: $Zn + FeSO_{4} = ZnSO_{4} + Fe$. Проведение реакции в обратном направлении невозможно. В свою очередь, железо вытесняет медь из растворов солей меди: $Fe + CuSO_{4} = FeSO_{4} + Cu$. Как вы думаете, способна ли медь вытеснить цинк из раствора его соли? Расположите три металла в порядке уменьшения их активности.
Ответ:
Нет, медь не способна вытеснить цинк из раствора его соли.
Расположим три металла в порядке уменьшения их активности:
1. Zn
2. Fe
3. CuЛабораторный опыт 41
Налейте в пробирку 5 мл раствора сульфата меди (II). Погрузите в раствор железный гвоздь, привязанный на нитку. Через 2−3 минуты извлеките гвоздь из пробирки, потянув за нитку. Что наблюдаете? Сделайте выводы об относительной активности железа и меди.
Ответ:
Налили в пробирку 5 мл раствора сульфата меди (II). Погрузили в раствор железный гвоздь, привязанный на нитку. Через 2−3 минуты извлекли гвоздь из пробирки, потянув за нитку. Наблюдаем образования медного налета на гвозде.
Вывод: Таким образом, железо активнее меди.Проверьте свои знания
1. Общие химические свойства металлов — простых веществ можно обозначить одним химическим термином. Назовите его.
Ответ:
Все металлы являются восстановителями, то есть отдают электроны.
2. Перечислите общие химические свойства металлов. Подчеркните особенности взаимодействия металлов с растворами кислот и солей.
Ответ:
Рассмотрим общие химические свойства металлов:
1) Взаимодействие металлов с неметаллами.
2) Взаимодействие металлов с водой.
3) Взаимодействие металлов с кислотами.
С кислотами при комнатной температуре реагирует гораздо больше металлов, чем с водой. Определить, какие это металлы, поможет электрохимический ряд напряжений. В него, помимо металлов, помещён и водород. Металлы, стоящие в ряду напряжений до водорода, способны вытеснять его из растворов кислот.
4) Взаимодействие металлов с растворами солей.
Более активный металл способен реагировать с солью менее активного металла, вытесняя его из раствора. Для правильного написания уравнения подобных реакций вновь воспользуемся электрохимическим рядом напряжений металлов. Любой металл вытесняет из растворов солей все металлы, стоящие за ним правее, и, в свою очередь, может быть вытеснен расположенными левее.
5) Взаимодействие металлов с оксидами.3. Если металл проявляет различные степени окисления, то укажите факторы, от которых зависит состав продукта взаимодействия металлов с неметаллами и растворами кислот и солей. Приведите примеры.
Ответ:
Неметаллы, как правило, окисляют металлы до большей степени окисления.
Кислоты − сильные окислители. Если же кислота − не окислитель (соляная), то металл переходит в более низкую степень окисления.
Железо с хлором образует хлорид железа (III):
$2Fe + 3Cl_{2} = 2FeCl_{3}$
С хлороводородом − хлорид железа (II):
$Fe + 2HCl = FeCl_{2} + H_{2}↑$Примените свои знания
4. От чего зависит скорость протекания химического процесса? Расположите указанные металлы в порядке уменьшения скорости реакции с соляной кислотой: а) олово; б) железо; в) магний; г) цинк.
Ответ:
Скорость химической реакции зависит от различных факторов (температура, концентрация, степень измельчения вещества), в том числе от природы реагирующих веществ. Чем активнее металл, тем легче протекает реакция с его участием.
Металлы в порядке уменьшения скорости реакции с соляной кислотой:
в) магний;
г) цинк;
б) железо;
а) олово.
1 − в, 2 − г, 3 − б, 4 − а.5. Охарактеризуйте химические свойства следующих металлов: а) калия; б) цинка; в) меди. Запишите уравнения соответствующих химических реакций. Рассмотрите их с точки зрения теории электролитической диссоциации и процессов окисления — восстановления. В чём сходство и различия свойств перечисленных металлов?
Ответ:
а) Химические свойства калия:
1) Взаимодействие с неметаллами.
$2K + S ⟶ K_{2}S$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$K^{0} - 1ē ⟶ K^{+2}$ − восстановитель
2) Взаимодействие с водой.
$2K + 2H_{2}O ⟶ 2KOH + H_{2}↑$
$2H^{+1} + 2ē ⟶ H_{2}^{0}$ − окислитель
$K^{0} - 1ē ⟶ K^{+2}$ − восстановитель
3) Взаимодействие с кислотами.
$2K + 2HCl ⟶ 2KCl + H_{2}↑$
$2K + 2H^{+} + 2Cl^{-} ⟶ 2K^{+} + 2Cl^{-} + H_{2}↑$
$2K + 2H^{+} ⟶ 2K^{+} + H_{2}↑$
$2K + 2HCl ⟶ 2KCl + H_{2}↑$
$2H^{+1} + 2ē ⟶ H_{2}^{0}$ − окислитель
$K^{0} - 1ē ⟶ K^{+}$ − восстановитель
б) Химические свойства цинка:
1) Взаимодействие с неметаллами.
$Zn + S ⟶ ZnS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
2) Взаимодействие с водой.
Не реагирует с водой.
3) Взаимодействие с кислотами.
$Zn + 2HCl ⟶ ZnCl_{2} + H_{2}↑$
$Zn + 2H^{+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + H_{2}↑$
$Zn + 2H^{+} ⟶ Zn^{2+} + H_{2}↑$
$Zn + 2HCl ⟶ ZnCl_{2} + H_{2}↑$
$2H^{+1} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
4) Взаимодействие с растворами солей.
$Zn + CuCl_{2} ⟶ ZnCl_{2} + Cu$
$Zn + Cu^{2+} + 2Cl^{-} ⟶ Zn^{2+} + 2Cl^{-} + Cu$
$Zn + Cu^{2+} ⟶ Zn^{2+} + Cu$
$Zn + CuCl_{2} ⟶ ZnCl_{2} + Cu$
$Cu^{+2} + 2ē ⟶ Cu^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
5) Взаимодействие с оксидами.
$3Zn + Fe_{2}O_{3} ⟶ 3ZnO + 2Fe$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$Zn^{0} - 2ē ⟶ Zn^{+2}$ − восстановитель
в) Химические свойства меди:
1) Взаимодействие с неметаллами.
$Cu + S ⟶ CuS$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель
2) Взаимодействие с водой.
Не реагирует с водой.
3) Взаимодействие с кислотами.
Не реагирует с разбавленными кислотами.
4) Взаимодействие с растворами солей.
$Cu + 2AgNO_{3} ⟶ Cu(NO_{3})_{2} + Ag$
$Cu + 2Ag^{+} + 2NO_{3}^{-} ⟶ Cu^{2+} + 2NO_{3}^{-} + Ag$
$Cu + 2Ag^{+} ⟶ Cu^{2+} + Ag$
$Cu + 2AgNO_{3} ⟶ Cu(NO_{3})_{2} + Ag$
$Ag^{+} + 1ē ⟶ Ag^{0}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель
5) Взаимодействие с оксидами.
$Cu + Ag_{2}O ⟶ CuO + Ag$
$Ag^{+} + 1ē ⟶ Ag^{0}$ − окислитель
$Cu^{0} - 2ē ⟶ Cu^{+2}$ − восстановитель6. Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам:
а) $Ba + N_{2} → Ba_{3}N_{2}$
б) $Ca + H_{2}O → Ca(OH)_{2} + H_{2}$
в) $Al + HCl → AlCl_{3} + H_{2}$
г) $Sn + AgNO_{3} → Sn(NO_{3})_{2} + Ag$
Для каждой реакции определите окислитель и восстановитель.Ответ:
а) $3Ba + N_{2} = Ba_{3}N_{2}$
$N_{2}^{0} + 6ē ⟶ 2N^{-3}$ − окислитель
$Ba^{0} - 2ē ⟶ Ba^{+2}$ − восстановитель
б) $Ca + 2H_{2}O = Ca(OH)_{2} + H_{2}$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Ca^{0} - 2ē ⟶ Ca^{+2}$ − восстановитель
в) $2Al + 6HCl = AlCl_{3} + 3H_{2}↑$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Al^{0} - 3ē ⟶ Al^{+3}$ − восстановитель
г) $Sn + 2AgNO_{3} = Sn(NO_{3})_{2} + 2Ag$
$Ag^{+} + 1ē ⟶ Ag^{0}$ − окислитель
$Sn^{0} - 2ē ⟶ Sn^{+2}$ − восстановитель7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $CuO → Cu → Cu(NO_{3})_{2} → Cu(OH)_{2} → CuO → CuCl_{2}$
б) $NaCl → Na → NaOH → NaHSO_{4} → Na_{2}SO_{4} → BaSO_{4}$
в) $ZnS → ZnO → Zn → ZnSO_{4} → ZnCl_{2} → ZnCO_{3} → ZnO$
г) $MgCl_{2} → Mg → MgO → MgSO_{4} → Mg(OH)_{2} → Mg(NO_{3})_{2}$Ответ:
а) $CuO → Cu → Cu(NO_{3})_{2} → Cu(OH)_{2} → CuO → CuCl_{2}$
$CuO + H_{2} = Cu + H_{2}O$
$Cu + 2AgNO_{3} = Cu(NO_{3})_{2} + 2Ag$
$Cu(NO_{3})_{2} + 2KOH = 2KNO_{3} + Cu(OH)_{2}↓$
$Cu(OH)_{2} = CuO + H_{2}O$
$CuO + 2HCl = CuCl_{2} + H_{2}O$
б) $NaCl → Na → NaOH → NaHSO_{4} → Na_{2}SO_{4} → BaSO_{4}$
$2NaCl = 2Na + Cl_{2}↑$
$2Na + 2H_{2}O = 2NaOH + H_{2}↑$
$NaOH + H_{2}SO_{4} = NaHSO_{4} + H_{2}O$
$NaHSO_{4} + NaOH = Na_{2}SO_{4} + H_{2}O$
$Na_{2}SO_{4} + BaCl_{2} = 2NaCl + BaSO_{4}↓$
в) $ZnS → ZnO → Zn → ZnSO_{4} → ZnCl_{2} → ZnCO_{3} → ZnO$
$2ZnS + 3O_{2} = 2ZnO + 2SO_{2}$
$ZnO + H_{2} = Zn + H_{2}O$
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}↑$
$ZnSO_{4} + BaCl_{2} = ZnCl_{2} + BaSO_{4}↓$
$ZnCl_{2} + K_{2}CO_{3} = 2KCl + ZnCO_{3}↓$
$ZnCO_{3} = ZnO + CO_{2}$
г) $MgCl_{2} → Mg → MgO → MgSO_{4} → Mg(OH)_{2} → Mg(NO_{3})_{2}$
$MgCl_{2} + 2Na = 2NaCl + Mg$
$2Mg + O_{2} = 2MgO$
$MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O$
$MgSO_{4} + 2KOH = K_{2}SO_{4} + Mg(OH)_{2}↓$
$Mg(OH)_{2} + 2HNO_{3} = Mg(NO_{3})_{2} + 2H_{2}O$8. Запишите уравнения тех реакций, протекание которых возможно:
а) $Co + ZnCl_{2}$ →
б) $Ni + CuSO_{4}$ →
в) $Mg + HCl$ →
г) $Ag + HCl$ →
д) $Au + CuO$ →
е) $Zn + Hg(NO_{3})_{2}$ →Ответ:
Уравнения тех реакций, протекание которых возможно:
б) $Ni + CuSO_{4} = NiSO_{4} + Cu$
в) $Mg + 2HCl = MgCl_{2} + H_{2}↑$
е) $Zn + Hg(NO_{3})_{2} = Zn(NO_{3})_{2} + Hg$9. В 50 г воды растворили 2,74 г бария. Определите массовую долю гидроксида бария в полученном растворе.
Ответ:
Дано:
m ($H_{2}O$) = 50 г
m (Ba) = 2,74 г
Найти:
ω ($Ba(OH)_{2}$) − ?
Решение:
$Ba + 2H_{2}O = Ba(OH)_{2} +H_{2}$
n(Ba) = m : M = 2,74 : 137 = 0,02 моль
n(Ba) = n($Ba(OH)_{2}$) = n($H_{2}$) = 0,02 моль
m($Ba(OH)_{2}$) = n * M = 0,02 * 171 = 3,42 г
m($H_{2}$) = n * M = 0,02 * 2 = 0,04 г
m(раствора) = 50 + 2,74 − 0,04 = 52,7 г
ω ($Ba(OH)_{2}$) = m($Ba(OH)_{2}$) : m(раствора) = 3,42 : 52,7 * 100% = 6,5%
Ответ: ω ($Ba(OH)_{2}$) = 6,5%.10. Рассчитайте массу алюминия, который полностью прореагирует с 60,8 г оксида хрома (III). Какая масса хрома при этом получится?
Ответ:
Дано:
m ($Cr_{2}O_{3}$) = 60,8 г
Найти:
m (Cr) − ?
Решение:
$2Al + Cr_{2}O_{3} = Al_{2}O_{3} + 2Cr$
n($Cr_{2}O_{3}$) = m : M = 60,8 : 152 = 0,4 моль
n(Al) = n(Cr) = 2 * n($Cr_{2}O_{3}$) = 0,8 моль
m(Al) = n * M = 0,8 * 27 = 21,6 г
m(Cr) = n * M = 0,8 * 52 = 41,6 г
Ответ: m(Cr) = 41,6 г.11. Почему раствор сульфата меди (II) нельзя хранить в оцинкованном железном ведре?
Ответ:
Раствор сульфата меди (II) нельзя хранить в оцинкованном железном ведре, так как железо вступит в реакцию с солью:
$Fe + CuSO_{4} = FeSO_{4} + Cu$12. Медную пластинку погрузили в раствор нитрата серебра. Через некоторое время масса пластинки увеличилась на 1,52 г. Определите массу серебра, выделившегося на пластинке.
Ответ:
Дано:
m = 1,52 г
Найти:
m(Ag) − ?
Решение:
$Cu + 2AgNO_{3} = Cu(NO_{3})_{2} + 2Ag$
Масса пластинки уменьшилась за счет растворения меди, но увеличилась за счет выделения серебра:
m(Ag) − m(Cu) = 1,52 г
n(Ag) * M(Ag) − n(Cu) * M(Cu) = 1,52
n(Ag) = n(Cu) = n
n * (M(Ag) − M(Cu)) = 1,3
n = 1,3 : ((M(Ag) − M(Cu)) = 1,3 : (108 − 64) = 0,035 моль
m(Ag) = n * M = 0,14 * 65 = 2,24 г
Ответ: m(Ag) = 2,24 г.Используйте дополнительную информацию
Подготовьте сообщение об использовании металлов в пиротехнике или военном деле.
Ответ:
Начнем с бериллия. Его используют при сборке ядерных установок, техники ракетно−космического комплекса, средств коммуникации, а также для производства широкого спектра узлов и механизмов в авиастроении.
Титан постепенно становится практически незаменимым материалом для авиационной промышленности, постепенно вытесняя алюминий даже из самых, казалось бы, незыблемых мест. Сейчас из титана изготавливают двигатели для самолетов, лопатки компрессоров, которые устанавливаются на авиатехнические силовые установки, а также, в качестве эксперимента, некоторые КБ начинают применять титан для создания кожуха камер сгорания в авиационных двигателях.
В качестве топлива в составах для фейерверков используются различные металлы: железо и стали, алюминий, магний, титан и цирконий в порядке возрастания температуры горения и яркости пламени. Металлический цинк и медь могут использоваться в качестве топлива, которое горит “холодными” цветами, особенно в случае меди с донором хлора. §30
-
§30. Общая характеристика элементов IA-группы
Вопрос в начале параграфа✓
Элементы IА−группы периодической системы Д. И. Менделеева носят название щелочные металлы. Общее название предполагает совокупность общих свойств во всех формах существования элементов: атомов, простых веществ и соединений. Какие это свойства?
Ответ:
Щелочные металлы располагаются в IА−группе. У щелочных металлов на внешнем энергетическом уровне находятся по 1 электрону. Являются s−элементами, металлы.
Минимальная степень окисления 0, максимальна степень окисления +1.
Высшие оксиды: $Me_{2}O$.
Проявляют основные свойства: $Me_{2}O + 2HNO_{3} ⟶ 2MeNO_{3} + H_{2}O$
Высшие гидроксиды: MeOH.
Проявляют основные свойства: $2MeOH + 2HNO_{3} ⟶ 2MeHNO_{3} + 2H_{2}O$Проверьте свои знания
1. Дайте общую характеристику щелочных металлов на основании их положения в периодической системе химических элементов Д. И. Менделеева. Найдите сходство и различия в строении атомов щелочных металлов.
Ответ:
Атомы щелочных металлов содержат на внешнем энергетическом уровне по одному электрону. Восстановительные свойства возрастают от лития к цезию в связи с ростом радиусов атомов. Щелочные металлы как простые вещества. Щелочные металлы имеют металлическую кристаллическую решётку — это серебристо−белые мягкие вещества (легко режутся ножом) с характерным блеском на свежесрезанной поверхности. Все они лёгкие и легкоплавкие, причём, как правило, плотность этих металлов возрастает от лития к цезию, а температура плавления, наоборот, уменьшается. Щелочные металлы активно реагируют с составными частями воздуха, поэтому их хранят под слоем защитной жидкости: вазелинового масла (литий) или керосина (остальные металлы).
2. Как хранят щелочные металлы в лаборатории?
Ответ:
Щелочные металлы в лаборатории хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха.
3. Перечислите химические свойства щелочных металлов и раскройте зависимость скорости протекания реакций от природы щелочного металла.
Ответ:
Щелочные металлы взаимодействуют:
1) с неметаллами:
$2Na + Cl_{2} = 2NaCl$
2) с водой:
$2Na + 2H_{2}O = 2NaOH + H_{2}$
3) с кислотами:
$2K + 2HCl = 2KCl + H_{2}$
Скорость химической реакции возрастает от лития к цезию.Примените свои знания
1. Напишите молекулярные и ионные уравнения реакций: а) калия с водой; б) натрия с серой; в) оксида цезия с соляной кислотой; г) гидроксида лития с оксидом углерода (IV); д) оксида натрия с водой. В уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
Ответ:
а) $2K + H_{2}O ⟶ 2KOH + H_{2}↑$
$2H^{+1} + 2ē ⟶ H_{2}^{0}$ − окислитель
$K^{0} - 1ē ⟶ K^{+}$ − восстановитель
б) $2Na + S ⟶ Na_{2}S$
$S^{0} + 2ē ⟶ S^{-2}$ − окислитель
$Na^{0} - 1ē ⟶ Na^{+}$ − восстановитель
в) $Cs_{2}O + H_{2}O ⟶ 2CsOH$
$Cs_{2}O + H_{2}O ⟶ 2Cs^{+} + 2OH^{-}$
г) $2LiOH + CO_{2} ⟶ Li_{2}CO_{3} + H_{2}O$
$2Li^{+} + 2OH^{-} + CO_{2} ⟶ 2Li^{+} + CO_{3}^{2-} + H_{2}O$
$2OH^{-} + CO_{2} ⟶ CO_{3}^{2-} + H_{2}O$
д) $Na_{2}O + H_{2}O ⟶ 2NaOH$
$Na_{2}O + H_{2}O ⟶ 2Na^{+} + OH^{-}$2. В трёх склянках без этикеток находятся белые кристаллические порошки хлоридов калия, натрия и лития. Предложите способ распознавания этих веществ.
Ответ:
Распознать эти вещества можно с помощью внесения их в пламя горелки.
Ионы лития окрасят пламя в карминово−красный цвет, ионы натрия − в жёлтый цвет, а ионы калия − в розово−фиолетовый.3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $KOH → K → KCl → KNO_{3} → KNO_{2}$
б) $Li → Li_{2}O → LiOH → Li_{2}SO_{4} → LiCl$
в) $Na → NaOH → Na_{2}CO_{3} → NaNO_{3} → NaNO_{2}$Ответ:
а) $KOH → K → KCl → KNO_{3} → KNO_{2}$
$4KOH = 4K + O_{2} + 2H_{2}O$
$2K + 2HCl = 2KCl + H_{2}↑$
$KCl + AgNO_{3} = KNO_{3} + AgCl↓$
$2KNO_{3} = 2KNO_{2} + O_{2}↑$
б) $Li → Li_{2}O → LiOH → Li_{2}SO_{4} → LiCl$
$4Li + O_{2} = 2Li_{2}O$
$Li_{2}O + H_{2}O = 2LiOH$
$LiOH + H_{2}SO_{4} = Li_{2}SO_{4} + 2H_{2}O$
$Li_{2}SO_{4} + BaCl_{2} = 2LiCl + BaSO_{4}↓$
в) $Na → NaOH → Na_{2}CO_{3} → NaNO_{3} → NaNO_{2}$
$2Na + 2H_{2}O = 2NaOH + H_{2}↑$
$2NaOH + CO_{2} = Na_{2}CO_{3} + H_{2}O$
$Na_{2}CO_{3} + 2HNO_{3} = 2NaNO_{3} + H_{2}O + CO_{2}↑$
$2NaNO_{3} = 2NaNO_{2} + O_{2}↑$4. Вместо многоточий впишите в уравнения реакций формулы веществ:
а) $… + SO_{2} = Na_{2}SO_{3}$
б) $KOH + … = KNO_{3} + H_{2}O$
в) $… + … = 2LiCl + BaSO_{4}↓$
г) $2Na + 2H_{2}O = … + …$Ответ:
а) $Na_{2}O + SO_{2} = Na_{2}SO_{3}$
б) $KOH + HNO_{3} = KNO_{3} + H_{2}O$
в) $Li_{2}SO_{4} + BaCl_{2} = 2LiCl + BaSO_{4}↓$
г) $2Na + 2H_{2}O = 2NaOH + H_{2}↑$5. В тесто добавили половину чайной ложки (2,1 г) питьевой соды. Какой объём углекислого газа (н. у.) выделится при полном разложении этого вещества?
Ответ:
Дано:
m ($NaHCO_{3}$) = 2,1 г
Найти:
V ($CO_{2}$) − ?
Решение:
$2NaHCO_{3} = Na_{2}CO_{3} + CO_{2} + H_{2}O$
n ($NaHCO_{3}$) = m : M = 2,1 г : 84 г/моль = 0,025 моль
n ($CO_{2}$) = 0,5 * n ($NaHCO_{3}$) = 0,5 * 0,025 моль = 0,0125 моль
V ($CO_{2}$) = $V_{m}$ * n = 22,4 л/моль * 0,0125 моль = 0,28 л
Ответ: V ($CO_{2}$) = 0,28 л.Используйте дополнительную информацию
6. Подготовьте сообщение об истории открытия одного из щелочных металлов, его свойствах и применении.
Ответ:
В Древнем Египте щелочь имела название – «натрон», ее получали из озер или путем сжигания растений. Это же вещество, только с названием «нетер», было описано еще в Ветхом Завете. Она благополучно применялась в качестве моющего средства, сохранения мумий и прочих нужд.
Название «натрий» происходит от латинского слова natrium, которое было заимствовано из среднеегипетского языка, где оно означало среди прочего: «сода», «едкий натр».
Натрий − серебристо−белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 $г/см^{3}$ (при 19,7°C), температура плавления 97,86°C, температура кипения 883,15°C.
Металлический натрий широко используется как сильный восстановитель в препаративной химии и промышленности, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево−серных аккумуляторов. Его также применяют в выпускных клапанах двигателей грузовиков как жидкий теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов. §31
-
§31. Общая характеристика элементов IIA-группы
Вопрос в начале параграфа✓
К элементам IIА−группы периодической системы Д. И. Менделеева относят бериллий, магний и щелочноземельные металлы — кальций, стронций, барий, радий. Обладают ли щелочноземельные и щелочные металлы сходными свойствами?
Ответ:
Своё название щелочноземельные металлы получили потому, что их оксиды при растворении в воде образуют щёлочи. Также и щелочные металлы: $Na_{2}O + H_{2}O = 2NaOH$.
Лабораторный опыт 42
Немного порошка оксида кальция поместите в химический стакан и прилейте 20 мл воды. Тщательно перемешайте содержимое стакана стеклянной палочкой и дайте отстояться. Профильтруйте по 2 мл содержимого стакана в 2 пробирки. С помощью трубочки для коктейля через раствор первой пробирки продувайте выдыхаемый воздух. Что наблюдаете? С какой целью используют данную реакцию?
К раствору во второй пробирке добавьте 1−2 капли раствора фенолфталеина. Что наблюдаете? О чём свидетельствует появление окраски?Ответ:
Немного порошка оксида кальция поместили в химический стакан и прилили 20 мл воды. Тщательно перемешали содержимое стакана стеклянной палочкой и дали отстояться. Профильтровали по 2 мл содержимого стакана в 2 пробирки. С помощью трубочки для коктейля через раствор первой пробирки продували выдыхаемый воздух.
$CaO + H_{2}O = Ca(OH)_{2}$
$Ca(OH)_{2} + CO_{2} = CaCO_{3} + H_{2}O$
Наблюдаем образование осадка белого цвета − карбоната кальция.
Карбонат кальция, полученный таким способом, является основой зубных паст, косметических средств, его используют также в производстве бумаги высокого качества (мелованная бумага) и резины.
К раствору во второй пробирке добавили 1−2 капли раствора фенолфталеина. Наблюдаем образование раствора малинового цвета. Появление окраски свидетельствует о наличии щелочной среды.Проверьте свои знания
1. Сравните щелочные и щелочноземельные металлы. Укажите вид связи и тип кристаллической решётки в простых веществах, образованных этими металлами.
Ответ:
Для щелочных и щёлочноземельных металлов характерна металлическая связь и металлическая кристаллическая решетка, а отсюда и все типичные для металлов свойства: тепло− и электропроводность, пластичность, металлический блеск. Металлические свойства у щелочных металлов возрастают от лития к цезию, а у щёлочноземельных − от кальция к барию. Максимальная степень окисления щелочных металлов равна +1, а у щёлочноземельных +2.
Данные гидроксиды являются растворимыми основаниями – щёлочами, следовательно, взаимодействуют с кислотами, кислотными оксидами и солями.2. Перечислите общие химические свойства щелочноземельных металлов. Подчеркните особенности взаимодействия этих металлов с водой.
Ответ:
Активность щелочноземельных металлов (металлов IIА−группы) возрастает от бериллия к цезию. При взаимодействии с кислородом бериллий, магний, кальций и стронций образуют оксиды, а более активный барий − пероксид:
$2Ca + O_{2} = 2CaO$
$Ba + O_{2} = BaO_{2}$
Бериллий, магний и щелочноземельные металлы при нагревании реагируют и с другими активными неметаллами: галогенами, серой, азотом, образуя бинарные соединения − галогениды, сульфиды, нитриды:
$Be + Cl_{2} = BeCl_{2}$
$Mg + S = MgS$
$3Ca + N_{2} = Ca_{3}N_{2}$
Скорость взаимодействия металлов IIА−группы с водой также увеличивается от кальция к барию:
$Ca + 2H_{2}O = Ca(OH)_{2} + H_{2}↑$
Бериллий при комнатной температуре с водой не взаимодействует, магний реагирует медленно и только при нагревании. Большое количество кальция идёт на получение других металлов кальцийтермией − восстановлением металлов из их оксидов кальцием, например:
$TiO_{2} + 2Ca = Ti + 2CaO$
Бериллий, магний и стронций используют как компоненты сплавов.Примените свои знания
3. С помощью какой химической реакции можно доказать, что в состав природных соединений кальция — известняка, мрамора, кальцита — входит карбонат этого металла? Напишите уравнение реакции в молекулярной и ионной формах.
Ответ:
При пропускании углекислого газа через карбонат кальция происходит его растворение:
$CaCO_{3} + CO_{2} + H_{2}O ⟶ Ca(HCO_{3})_{2}$
$CaCO_{3} + CO_{2} + H_{2}O ⟶ Ca^{2+} + 2HCO_{3}^{-}$4. Охарактеризуйте свойства оксида кальция как основного оксида. Ответ подтвердите уравнениями химических реакций в молекулярной и ионной формах.
Ответ:
Свойства оксида кальция как основного оксида:
1) Оксиды щелочноземельных металлов реагируют с водой с образованием щелочей, например: $CaO + H_{2}O = Ca(OH)_{2}$
2) Их основные свойства проявляются также в реакциях с кислотными оксидами и кислотами, в результате которых образуются соли:
$CaO + CO_{2} = CaCO_{3}$
$CaO + 2HCl = CaCl_{2} + H_{2}O$
3) Оксиды щелочноземельных металлов получают разложением их карбонатов при нагревании, например при обжиге известняка: $CaCO_{3} = CaO + CO_{2}↑$5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $Ca → CaCl_{2} → CaCO_{3} → CaO → Ca(OH)_{2} → Ca(NO_{3})_{2} → CaF_{2}$
б) $BaCO_{3} → BaO → Ba(OH)_{2} → BaCl_{2} → Ba_{3}(PO_{4})_{2}$
Для реакций обмена запишите ионные уравнения.Ответ:
а) $Ca → CaCl_{2} → CaCO_{3} → CaO → Ca(OH)_{2} → Ca(NO_{3})_{2} → CaF_{2}$
1) $Ca + 2HCl = CaCl_{2} + H_{2}↑$
2) $CaCl_{2} + K_{2}CO_{3} = 2KCl + CaCO_{3}$ − реакция обмена
$Ca^{2+} + 2Cl^{-} + 2K^{+} + CO_{3}^{2-} ⟶ 2K^{+} + 2Cl^{-} + CaCO_{3}↓$
$Ca^{2+} + CO_{3}^{2-} ⟶ CaCO_{3}↓$
3) $CaCO_{3} = CaO + CO_{2}↑$
4) $CaO + H_{2}O = Ca(OH)_{2}$
5) $Ca(OH)_{2} + 2HNO_{3} = Ca(NO_{3})_{2} + 2H_{2}O$ − реакция обмена
$Ca^{2+} + 2OH^{-} + 2H^{+} + 2NO_{3}^{-} ⟶ Ca^{2+} + 2NO_{3}^{-} + 2H_{2}O$
$H^{+} + OH^{-} ⟶ H_{2}O$
6) $Ca(NO_{3})_{2} + 2NaF = 2NaNO_{3} + CaF_{2}↓$ − реакция обмена
$Ca^{2+} + 2NO_{3}^{-} + 2Na^{+} + 2F^{-} ⟶ 2Na^{+} + 2NO_{3}^{-} + CaF_{2}↓$
$Ca^{2+} + 2F^{-} ⟶ CaF_{2}↓$
б) $BaCO_{3} → BaO → Ba(OH)_{2} → BaCl_{2} → Ba_{3}(PO_{4})_{2}$
1) $BaCO_{3} = BaO + CO_{2}↑$
2) $BaO + H_{2}O = Ba(OH)_{2}$
3) $Ba(OH)_{2} + 2HCl = BaCl_{2} + 2H_{2}O$ − реакция обмена
$Ba^{2+} + 2OH^{-} + 2H^{+} + 2Cl^{-} ⟶ Ba^{2+} + 2Cl^{-} + 2H_{2}O$
$H^{+} + OH^{-} ⟶ H_{2}O$
4) $3BaCl_{2} + 2Na_{3}PO_{4} = 6NaCl + Ba_{3}(PO_{4})_{2}↓$ − реакция обмена
$3Ba^{2+} + 6Cl^{-} + 6Na^{+} + 2PO_{4}^{3-} ⟶ 6Na^{+} + 6Cl^{-} + Ba_{3}(PO_{4})_{2}↓$
$3Ba^{2+} + 2PO_{4}^{3-} ⟶ Ba_{3}(PO_{4})_{2}↓$6. При обработке 9,8 г смеси карбоната, гидроксида и сульфата кальция избытком соляной кислоты выделилось 0,896 л газа (н. у.) и осталось 2,1 г твёрдого остатка. Вычислите массовую долю компонентов в смеси.
Ответ:
Дано:
V($CO_{2}$) = 0,896 л
m(смеси) = 9,8 г
m($CaSO_{4}$) = 2,1 г
Найти:
ω($CaCO_{3}$)−?
ω($Ca(OH)_{2}$)−?
ω($CaSO_{4}$)−?
Решение:
n = V : $V_{m}$
n ($H_{2}O$) = 0,896 л : 22,4 л/моль = 0,04 моль
$CaCO_{3} + HCl = CaCl_{2} + CO_{2}↑ + 2H_{2}O$
$Ca(OH)_{2} + 2HCl = CaCl_{2} + 2H_{2}O$
$CaSO_{4} + HCl$ ≠
n ($CaCO_{3}$) = n ($CO_{2}$) = 0,04 моль
M ($CaCO_{3}$) = 100 г/моль
m($CaCO_{3}$) = n($CaCO_{3}$) * M($CaCO_{3}$) = 0,04 моль * 100 г/моль = 4 г
m($Ca(OH)_{2}$) = m(смеси) − m($CaCO_{3}$) − m($CaSO_{4}$) = 9,8 г − 4 г − 2,1 г = 3,7 г
ω($CaCO_{3}$) = (m($CaCO_{3}$) : m(смеси)) * 100% = (4 г : 9,8 г) * 100% = 40,8%
ω($Ca(OH)_{2}$) = (m($Ca(OH)_{2}$) : m(смеси)) * 100% = (3,7 г : 9,8 г) * 100% = 37,6%
ω($CaSО_{4}$) = (m($CaSО_{4}$) : m(смеси)) * 100% = (2,1 г : 9,8 г) * 100% = 21,4%
Ответ: ω($CaCO_{3}$) = 40,8%; ω($Ca(OH)_{2}$) = 37,6%; ω($CaSО_{4}$) = 21,4%.Используйте дополнительную информацию
1. Щелочные металлы получают электролизом расплавов их гидроксидов — щелочей. Для получения щелочноземельных металлов используют электролиз расплавов их солей. Как вы думаете, почему для этих целей не годятся гидроксиды щелочноземельных металлов? Напишите уравнение электролиза расплава хлорида кальция.
Ответ:
Для получения щёлочноземельных металлов с помощью электролиза не используют их гидроксиды, потому что при расплавлении и дальнейшем нагреве от пропускания электрического тока они разлагаются на оксид металла и воду.
Электролиз расплава хлорида кальция:
$CaCl_{2} ⟶ Ca + Cl_{2}↑$2. Подготовьте сообщение об истории открытия одного из щелочноземельных металлов, его свойствах и применении.
Ответ:
Магний — широко распространенный в природе металл, имеющий огромное биогенное значение для человека. Он является составной частью большого количества различных минералов, морской воды, гидротермальных вод.
Магний — металл серебристо−белого цвета. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния, которая разрушается при нагреве на воздухе до примерно 600°С. Плотность магния при 20°С — 1,737 $г/см^{3}$, температура плавления металла 651°С, температура кипения 1103°С.
В организме магний в основном содержится внутри клетки, где он действует как противоион для богатых энергией АТФ и нуклеиновых кислот. Магний является кофактором в более чем 300 ферментных системах, которые регулируют различные биохимические реакции, включая синтез белка, мышечную и нервную передачу, нервно−мышечную проводимость, передачу сигнала, участвуют в контроле уровней глюкозы крови и артериального давления. §32
-
§32. Жесткость воды и способы ее устранения
Вопрос в начале параграфа✓
В предыдущем параграфе упоминалась такая область применения стиральной соды, как умягчение воды. Какое значение имеет этот процесс в промышленности и в быту?
Ответ:
В жёсткой воде мясо и крупы плохо развариваются. Эти неприятности, которые приносит человеку жёсткая вода, далеко не исчерпывают их список. Загляните внутрь чайника или, когда в вашем доме или квартире проводится капитальный ремонт, в разрез трубы центрального отопления. Там мы увидим белый налет.
Проверьте свои знания
1. Какую воду называют жёсткой? Какова химическая природа жёсткости воды?
Ответ:
Воду называют жёсткой, если она содержит катионы кальция, магния и железа ($Ca^{2+}, Mg^{2+}, Fe^{3+}$).
Содержание этих ионов в воде обуславливают растворимые соединения кальция, магния и железа, например, соли (хлориды, нитраты, сульфаты).2. Какие виды жёсткости воды различают? Какова их химическая природа?
Ответ:
Жёсткость воды, обусловленную содержанием в ней гидрокарбонатов кальция и магния и устраняемую кипячением, называют временной жёсткостью.
Жёсткость воды, обусловленную содержанием в ней других соединений кальция и магния (хлоридов и сульфатов) и не устраняемую кипячением, называют постоянной жёсткостью.3. Как устраняют временную жёсткость воды, а как — постоянную?
Ответ:
И временная, и постоянная жёсткость воды легко устраняются добавлением карбоната натрия:
$CaCl_{2} + Na_{2}CO_{3} = CaCO_{3}↓ + 2NaCl$
$Ca^{2+} + CO_{3}^{2−} = CaCO_{3}↓$
Временную жесткость можно устранить кипячением воды.4. Какой вред человеку наносит жёсткая вода?
Ответ:
В жёсткой воде мыло не мылится. Дело в том, что мыла представляют собой натриевые (твёрдые) или калиевые (жидкие) соли жирных органических кислот, общую формулу которых можно условно записать как R−COONa или R−COOK. Как и все калиевые и натриевые соли, мыла растворимы в воде и диссоциируют.
В жёсткой воде мясо и крупы плохо развариваются. Эти неприятности, которые приносит человеку жёсткая вода, далеко не исчерпывают их список. Загляните внутрь чайника или, когда в вашем доме или квартире проводится капитальный ремонт, в разрез трубы центрального отопления.Примените свои знания
5. Почему при устранении временной жёсткости воды следует избегать добавления избытка известкового молока?
Ответ:
Избыток известкового молока только повысит содержание ионов кальция, которые и пытаются вывести из воды при борьбе с жесткостью.
6. Что такое минеральная вода? Предложите потребительскую классификацию минеральных вод.
Ответ:
Вода некоторых природных источников содержит катионы $K^{+}, Na^{+}, Ca^{2+} , Mg^{2+}$ и др., а также анионы $Cl^{–}, SO_{4}^{2−}, HCO_{3}^{−}$ и др., т. е. необходимые организму минеральные соли. Если содержание таких солей превышает 1 г/л, такие воды и их источники называют минеральными.
Наиболее богат минеральными источниками одноимённый район Кавказских Минеральных Вод. Например, наиболее известная и широко применяемая минеральная вода − кисловодский «Нарзан» − рекомендована как лечебносто−ловая сульфатно−гидрокарбонатная вода. Содержание солей в ней составляет 2−3 г/л.
В зависимости от преобладающих в минеральной воде ионов, можно классифицировать воды на сульфатно−гидрокарбонатные, гидрокарбонатные, кальциево−натриевые и т.д.; по общему содержанию солей (по мере возрастания) − на столовые, лечебно−столовые и лечебные.7. В образце жёсткой воды объёмом 1 л содержится 450 мг хлорида кальция. Какую массу кристаллической соды $Na_{2}CO_{3} * 10H_{2}O$ необходимо добавить к 250 л такой воды для устранения её постоянной жёсткости?
Ответ:
Дано:
1 л − 450 мг $CaCl_{2}$
V = 250 л
Найти:
m($Na_{2}CO_{3} * 10H_{2}O$) − ?
Решение:
1 л содержит 450 мг, значит 250 л содержит 250 * 450 = 112500 мг = 112,5 г
$CaCl_{2} + Na_{2}CO_{3} * 10H_{2}O = CaCO_{3} + 2NaCl + 10H_{2}O$
n($Na_{2}CO_{3} * 10H_{2}O$) = n($CaCl_{2}$) = m : M = 112,5 : 111 = 1,01 моль
m($Na_{2}CO_{3} * 10H_{2}O$) = n * M = 1,01 * 286 = 288,86 г
Ответ: m($Na_{2}CO_{3} * 10H_{2}O$) = 288,86 г.8. Какую массу соды (безводный карбонат натрия $Na_{2}CO_{3}$) необходимо добавить к 100 л природной воды, содержащей 610 мг / л катионов кальция, для её полного умягчения?
Ответ:
Дано:
V (природ.вода) = 100 л
C = 610 мг/л
Найти:
m($Na_{2}CO_{3}$) − ?
Решение:
$Ca^{2+} + Na_{2}CO_{3} = CaCO_{3} + 2Na^{+}$
m($Ca^{2+}$) = 610 мг/л * 100л = 61000 мг = 61 г
n($Na_{2}CO_{3}$) = n($Ca^{2+}$) = m : M = 61 : 40 = 1,525 моль
m($Na_{2}CO_{3}$) = n * M = 1,525 * 106 = 161,65 г
Ответ: m($Na_{2}CO_{3}$) = 161,65 г.Выразите свое мнение
Предложите свой проект по режиму экономии бытового потребления воды.
Ответ:
Способы экономии воды:
1) Отключать воду, когда она не нужна.
2) Стирать при полной загрузке стиральной машины.
3) Принимать душ, а не ванну.
4) Использовать минимум воды для мыться посуды.
5) Для чистки зубов поток воды не нужен – набирайте воду в стакан и используйте ее для полоскания щетки и зубов.Практическая работа 6
) Закройте пробирку пробкой с газоотводной трубкой и проверьте прибор на герметичность.
2) В прибор для получения газов внесите 2—3 небольших кусочка мрамора. Закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
3) Газоотводную трубку прибора опустите в пробирку с прозрачной известковой водой. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
4) Продолжайте пропускание углекислого газа до получения прозрачного раствора. Запишите уравнения реакции в молекулярной и ионной формах.Полученную жёсткую воду разделите на три пробирки.
5) К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете? Почему?
6) Вторую пробирку зажмите в пробиркодержателе и нагрейте на пламени спиртовки до кипения жидкости. Объясните наблюдаемое явление.
7) К содержимому третьей пробирки добавьте раствор соды. Что наблюдаете?
8) В пробирку прилейте 1—2 мл раствора хлорида кальция. Вставьте пробирку в пробиркодержатель и нагрейте содержимое пробирки. Наблюдаете ли вы какие−нибудь изменения, свидетельствующие о протекании химической реакции? Почему?
9) Установите пробирку в штатив и добавьте к содержимому 1—2 мл раствора карбоната натрия. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах. Оформите отчёт о работе.Ответ:
1) Закрыли пробирку пробкой с газоотводной трубкой и проверили прибор на герметичность.
2) В прибор для получения газов внесли 2—3 небольших кусочка мрамора. Закрепили прибор в лапке штатива. В воронку налили немного соляной кислоты, чтобы она покрывала кусочки мрамора.
$2HCl + CaCO_{3} = CaCl_{2} + CO_{2} + H_{2}O$
Наблюдаем выделение газа − углекислого газа.
3) Газоотводную трубку прибора опустили в пробирку с прозрачной известковой водой.
$CO_{2} + Ca(OH)_{2} = CaCO_{3} + H_{2}O$
Наблюдаем образование осадка белого цвета − карбоната кальция.
4) Продолжали пропускание углекислого газа до получения прозрачного раствора.
$CaCO_{3} + H_{2}O + CO_{2} ⟶ Ca(HCO_{3})_{2}$
$CaCO_{3} + H_{2}O + CO_{2} ⟶ Ca^{2+} + 2HCO_{3}^{-}$
Полученную жёсткую воду разделили на три пробирки.
5) К содержимому первой пробирки добавили немного раствора мыла, закрыли её пробкой и сильно встряхните.
$2C_{17}H_{35}COONa + Ca(HCO_{3})_{2} ⟶ (C_{17}H_{35}COO)_{2}Ca↓ + 2NaHCO_{3}$
Наблюдаем образование белого жирного осадка.
6) Вторую пробирку зажали в пробиркодержателе и нагрели на пламени спиртовки до кипения жидкости.
При кипячении второй пробирки с жесткой водой, наблюдается появление белого осадка, в следствии термического разложения карбоната кальция, и образования нерастворимого карбоната кальция:
$Ca(HCO_{3})_{2} = CaCO_{3} + H_{2}O + CO_{2}↑$
7) К содержимому третьей пробирки добавили раствор соды.
При добавлении раствора стиральной соды в третью пробирку с жесткой водой, наблюдается появление белого осадка, в следствии образования нерастворимого карбоната кальция:
$Ca(HCO_{3})_{2} + Na_{2}CO_{3} = CaCO_{3}↓ + 2NaHCO_{3}$
8) В пробирку прилили 1—2 мл раствора хлорида кальция. Вставили пробирку в пробиркодержатель и нагрели содержимое пробирки.
При нагревании хлорида кальция видимых признаков реакции нет, так как реакция не протекает.
$CaCl_{2}$ ≠
9) Установили пробирку в штатив и добавили к содержимому 1—2 мл раствора карбоната натрия.
$CaCl_{2} + Na_{2}CO_{3} = 2NaCl + CaCO_{3}$
Наблюдаем образование осадка белого цвета − карбоната кальция. §33
-
§33. Алюминий и его соединения
Вопрос в начале параграфа✓
Для алюминия характерно редкое сочетание ценных свойств: лёгкости, пластичности, блеска, хорошей электро− и теплопроводности, коррозионной стойкости, нетоксичности. В каких областях производства используют эти свойства алюминия?
Ответ:
Алюминий используют для изготовления проводов линий электропередачи, алюминиевых труб для нефтяной промышленности. Если поверхность алюминия отполировать, она становится блестящей. Это свойство металла используют для производства зеркал, прожекторов, мощных отражателей. Пластичность и нетоксичность алюминия лежат в основе его использования в производстве различных упаковочных материалов для пищевых продуктов.
Большая часть производимого алюминия идёт на получение сплавов. Благодаря лёгкости и прочности их широко используют в авиационной и космической промышленности.Проверьте свои знания
1. Запишите схему распределения электронов по энергетическим уровням в атоме алюминия.
Ответ:
Схема распределения электронов по энергетическим уровням в атоме алюминия:
1 энергетический уровень: 2 электрона
2 энергетический уровень: 8 электрона
3 энергетический уровень: 3 электрона2. Охарактеризуйте физические свойства алюминия и области применения этого металла.
Ответ:
Внешне алюминий походит на серебро, он примерно в 3 раза легче железа и меди. Алюминий − это очень пластичный металл: можно прокатать его в тонкую фольгу, сделать из него тончайшие украшения, придать ему нужную форму. Вот только прочность чистого алюминия невелика, но его сплавы с другими металлами заметно прочнее. Уже созданы сплавы алюминия с прочностью, в 10 раз превышающей прочность стали.
Алюминий используют для изготовления проводов линий электропередачи, алюминиевых труб для нефтяной промышленности. Если поверхность алюминия отполировать, она становится блестящей. Это свойство металла используют для производства зеркал, прожекторов, мощных отражателей. Пластичность и нетоксичность алюминия лежат в основе его использования в производстве различных упаковочных материалов для пищевых продуктов.
Большая часть производимого алюминия идёт на получение сплавов. Благодаря лёгкости и прочности их широко используют в авиационной и космической промышленности.3. Перечислите химические свойства алюминия. Подчеркните особенности его взаимодействия с серной и азотной кислотами. Запишите соответствующие уравнения реакций.
Ответ:
На воздухе алюминий устойчив, поскольку его поверхность покрывается тонкой и очень прочной оксидной плёнкой, которая защищает его от взаимодействия с компонентами воздуха и водой:
$4Al + 3O_{2} = 2Al_{2}O_{3}$
Если оксидную плёнку удалить механически или с помощью кислоты, алюминий способен медленно реагировать с водой:
$2Al + 6H_{2}O = 2Al(OH)_{3} + 3H_{2}↑$
Помимо кислорода, алюминий реагирует с большинством неметаллов, образуя бинарные соединения:
$2Al + 3Cl_{2} = 2AlCl_{3}$
Алюминий легко реагирует с кислотами − соляной и разбавленной серной:
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑$
$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}$
Однако с концентрированными серной, азотной и фосфорной кислотами алюминий при комнатной температуре не взаимодействует. Дело здесь также в образовании плотной защитной оксидной плёнки на поверхности металла.
Алюминий способен вытеснять менее активные металлы не только из растворов солей, но и из оксидов:
$2Al + 3CuCl_{2} = 2AlCl_{3} + 3Cu$
$2Al + Fe_{2}O_{3} = Al_{2}O_{3} + 2Fe$
Укажем ещё одно необычное свойство алюминия − он реагирует со щелочами с образованием комплексных солей и выделением водорода:
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}↑$Примените свои знания
4. Рассчитайте площадь алюминиевой фольги толщиной 0,01 мм, которую можно изготовить из 1 моль этого металла, если плотность алюминия равна 2,7 г / $см^{3}$.
Ответ:
Дано:
d = 0,01 мм
n = 1 моль
ρ = 2,7 г / $см^{3}$
Найти:
S − ?
Решение:
m(Al)= n * M = 1 * 27 = 27 г
V(Al) = 27 : 2,7 = 10 $см^{3}$ = 10000 $мм^{3}$
S(Al) = V : h = 10000 : 0,01 = 1000000 $мм^{2}$ = 10000 $см^{2}$
Ответ: S = 10000 $см^{2}$.5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $Al → Al_{2}(SO_{4})_{3} → Al(OH)_{3} → Al_{2}O_{3} → Al(NO_{3})_ {3}$
б) $Al → AlCl_{3} → Na[Al(OH)_ {4}] → Al(OH)_{3} → Al_{2}(SO_{4})_{3}$
Для реакций, протекающих в растворах, запишите ионные уравнения. В уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.Ответ:
а) $Al → Al_{2}(SO_{4})_{3} → Al(OH)_{3} → Al_{2}O_{3} → Al(NO_{3})_{3}$
1) $2Al + 3H_{2}SO_{4} ⟶ Al_{2}(SO_{4})_{3} + 3H_{2}↑$
$2H^{+1} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Al^{0} - 3ē ⟶ Al^{+3}$ − восстановитель
2) $Al_{2}(SO_{4})_{3} + 6NaOH ⟶ 3Na_{2}SO_{4} + 2Al(OH)_{3}↓$
$2Al^{3+} + 3SO_{4}^{2-} + 6Na^{+} + 6OH^{-} ⟶ 6Na^{+} + 3SO_{4}^{2-} + 2Al(OH)_ {3}↓$
$Al^{3+} + 3OH^{-} ⟶ Al(OH)_{3}$
3) $2Al(OH)_{3} ⟶ Al_{2}O_{3} + 3H_{2}O$
4) $Al_{2}O_{3} + 6HNO_{3} ⟶ 2Al(NO_{3})_{3} + 3H_{2}O$
$Al_{2}O_{3} + 6H^{+} + 6NO_{3}^{-} ⟶ 2Al^{3+} + 6NO_{3}^{-} + 3H_{2}O$
$Al_{2}O_{3} + 6H^{+} ⟶ 2Al^{3+} + 3H_{2}O$
б) $Al → AlCl_{3} → Na[Al(OH)_ {4}] → Al(OH)_{3} → Al_{2}(SO_{4})_{3}$
1) $2Al + 6HCl ⟶ 2AlCl_{3} + 3H_{2}↑$
$2H^{+1} + 2ē ⟶ H_{2}0$ − окислитель
$Al^{0} - 3ē ⟶ Al^{+3}$ − восстановитель
2) $AlCl_{3} + 4NaOH ⟶ 3NaCl + Na[Al(OH)_{4}]$
$Al^{3+} + 3Cl^{-} + 4Na^{+} + 4OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Na^{+} + [Al(OH)_{4}]^{-}$
$Al^{3+} + 4OH^{-} ⟶ [Al(OH)_{4}]^{-}$
3) $2Na[Al(OH)_{4}] + CO_{2} ⟶ Na_{2}CO_{3} + H_{2}O + 2Al(OH)_{3}↓$
$2Na^{+} + 2[Al(OH)_{4}]^{-} + CO_{2} ⟶ 2Na^{+} + CO_{3}^{2-} + H_{2}O + 2Al(OH)_{3}↓$
$2[Al(OH)_{4}]^{-} + CO_{2} ⟶ CO_{3}^{2-} + H_{2}O + 2Al(OH)_{3}↓$
4) $2Al(OH)_{3} + 3H_{2}SO_{4} ⟶ Al_{2}(SO_{4})_{3} + 6H_{2}O$
$2Al(OH)_{3} + 6H^{+} + 3SO_{4}^{2-} ⟶ 2Al^{3+} + 3SO_{4}^{2-} + 6H_{2}O$
$Al(OH)_{3} + 3H^{+} ⟶ Al^{3+} + 3H_{2}O$6. Используя метод электронного баланса, составьте уравнение реакции, соответствующее следующей схеме:
$Al + HNO_{3} → Al(NO_{3})_{3} + N_{2}O + H_{2}O$
Укажите окислитель и восстановитель.Ответ:
$8Al + 30HNO_{3} = 8Al(NO_{3})_{3} + 3N_{2}O + 15H_{2}O$
$Al^{0} - 3e = Al^{+3}$ − восстановитель
$N^{+5} + 4e = N^{+1}$ − окислитель7. Почему при добавлении к концентрированному раствору щёлочи небольшого количества раствора сульфата алюминия не выпадает осадок гидроксида алюминия? Каким должен быть порядок приливания реагентов для получения осадка гидроксида? Запишите молекулярные и ионные уравнения реакций раствора сульфата алюминия с избытком раствора гидроксида натрия.
Ответ:
При добавлении к концентрированному раствору щёлочи небольшого количества раствора сульфата алюминия не выпадает осадок гидроксида алюминия, потому что в результате реакции образуется растворимая комплексная соль:
$8NaOH + Al_{2}(SO_{4})_{3} ⟶ 3Na_{2}SO_{4} + 2Na[Al(OH)_{4}]$
$8Na^{+} + 8OH^{-} + 2Al^{3+} + 3SO_{4}^{2-} ⟶ 6Na^{+} + 3SO_{4}^{2-} + 2Na^{+} + 2[Al(OH)_{4}]^{-} Al^{3+} + 4OH^{-} ⟶ [Al(OH)_{4}]^{-}$
Для получения гидроксида алюминия щелочь добавляют в раствор сульфата алюминия, а не наоборот.Используйте дополнительную информацию
1. Подготовьте сообщение об истории открытия алюминия, его свойствах и применении.
Ответ:
Алюминий сразу после его открытия привлёк химиков своей красотой и лёгкостью. Внешне он походит на серебро, примерно в 3 раза легче железа и меди. Алюминий очень пластичный металл: можно прокатать его в тонкую фольгу, сделать из него тончайшие украшения, придать ему нужную форму. Вот только прочность чистого алюминия невелика, но его сплавы с другими металлами заметно прочнее. Уже созданы сплавы алюминия с прочностью, в 10 раз превышающей прочность стали. Каждый держал в руках изделия из этого серебристо−белого, лёгкого, сравнительно мягкого металла, будь то посуда, электропровод, проволока или фольга. Такое широкое использование алюминия и его сплавов объясняется сочетанием практических полезных свойств: высокой электропроводности, теплопроводности, пластичности, устойчивости к воздействию влаги и воздуха, нетоксичности, лёгкости механической обработки и главное − малой плотности. Сейчас ежегодно в мире получают около 60 млн т алюминия.
Химические свойства
На воздухе алюминий устойчив, поскольку его поверхность покрывается тонкой и очень прочной оксидной плёнкой, которая защищает его от взаимодействия с компонентами воздуха и водой:
$4Al + 3O_{2} = 2Al_{2}O_{3}$
Если оксидную плёнку удалить механически или с помощью кислоты, алюминий способен медленно реагировать с водой:
$2Al + 6H_{2}O = 2Al(OH)_{3} + 3H_{2}↑$
Помимо кислорода, алюминий реагирует с большинством неметаллов, образуя бинарные соединения:
$2Al + 3Cl_{2} = 2AlCl_{3}$
Алюминий легко реагирует с кислотами − соляной и разбавленной серной:
$2Al + 6HCl = 2AlCl_{3} + 3H_{2}↑$
$2Al + 3H_{2}SO_{4} = Al_{2}(SO_{4})_{3} + 3H_{2}$
Однако с концентрированными серной, азотной и фосфорной кислотами алюминий при комнатной температуре не взаимодействует. Дело здесь также в образовании плотной защитной оксидной плёнки на поверхности металла.
Алюминий способен вытеснять менее активные металлы не только из растворов солей, но и из оксидов:
$2Al + 3CuCl_{2} = 2AlCl_{3} + 3Cu$
$2Al + Fe_{2}O_{3} = Al_{2}O_{3} + 2Fe$
Укажем ещё одно необычное свойство алюминия − он реагирует со щелочами с образованием комплексных солей и выделением водорода:
$2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}↑$
Применение
Алюминий используют для изготовления проводов линий электропередачи, алюминиевых труб для нефтяной промышленности. Если поверхность алюминия отполировать, она становится блестящей. Это свойство металла используют для производства зеркал, прожекторов, мощных отражателей. Пластичность и нетоксичность алюминия лежат в основе его использования в производстве различных упаковочных материалов для пищевых продуктов. Вспомните хотя бы алюминиевую фольгу для обёртки шоколада или приготовления пищи, алюминиевые банки для прохладительных напитков, крышки пластиковых баночек с йогуртом.2. Какую роль играет сульфат алюминия в процессе очистки воды на водоочистительных станциях?
Ответ:
Для того, чтобы потребители использовали для технических целей или без вреда здоровью употребляли питьевую воду, проводится трудоемкая работа по ее подготовке соответствующими предприятиями.
Сначала проводится осветление воды; после этого выполняется ее умягчение; из жидкости удаляются соли и устраняются газы.
Осветление воды – ключевой этап.
Качественно выполнить его помогает именно сульфат алюминия. Процедура состоит их нескольких последовательных процессов − коагуляции, образования осадка и фильтрования. Во время коагуляции происходит объединение мельчайших частиц, загрязняющих жидкость, в один сгусток. Образование таких хлопьевидных соединений, которые называются флокулы, является характерным при использовании сульфат алюминия, после чего происходит их отстаивание и создается доступный для фильтрации осадок. §34
-
§34. Железо и его соединения
Вопрос в начале параграфа✓
Железо неразрывно связано с историей человечества. Алхимики использовали для обозначения железа символ управляющей им, по их мнению, планеты — Марса. Как вы думаете, почему?
Ответ:
Алхимическое обозначение железа связано с богом войны — Марсом. Железо и его сплавы до сих пор являются основой военной и космической техники.
Лабораторный опыт 43
В одну пробирку налейте 2 мл раствора сульфата железа(II), в другую — такой же объём раствора хлорида железа (III). В каждую пробирку добавьте по 1 мл раствора гидроксида натрия. Что наблюдаете? Каков цвет образующихся осадков?
Ответ:
В одну пробирку налили 2 мл раствора сульфата железа(II), в другую — такой же объём раствора хлорида железа (III).
В каждую пробирку добавили по 1 мл раствора гидроксида натрия.
1) $FeSO_{4} + 2NaOH = Fe(OH)_{2} + Na_{2}SO_{4}$
Наблюдаем образование зеленоватого осадка − гидроксида железа (II).
2) $FeCl_{3} + 3NaOH = 3Fe(OH)_{3} + 3NaCl$
Наблюдаем образование рыжего осадка − гидроксида железа (III).Лабораторный опыт 44
В одну пробирку налейте 2 мл раствора сульфата железа (II), в другую − такой же объём раствора хлорида железа (III). В первую пробирку добавьте 3−4 капли раствора красной кровяной соли, во вторую − 3−4 капли раствора жёлтой кровяной соли. Что наблюдаете? Сравните цвет образующихся осадков.
Ответ:
В одну пробирку налили 2 мл раствора сульфата железа (II), в другую − такой же объём раствора хлорида железа (III). В первую пробирку добавили 3−4 капли раствора красной кровяной соли, во вторую − 3−4 капли раствора жёлтой кровяной соли.
1) $FeSO_{4} + 2K_{3}[Fe(CN)_{6}] ⟶ 3K_{2}SO_{4} + Fe_{3}[Fe(CN)_{6}]_{2}↓$
Наблюдаем образование темно−синего осадка − $Fe_{3}[Fe(CN)_{6}]_{2}↓$.
2) $FeCl_{3} + 3K_{4}[Fe(CN)_{6}] ⟶ 12KCl + Fe_{4}[Fe(CN)_{6}]_{3}↓$
Наблюдаем образование темно−синего осадка − $Fe_{4}[Fe(CN)_{6}]_{3}↓$.Проверьте свои знания
1. Расскажите о нахождении железа в природе.
Ответ:
Железо − один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы. На Земле большая часть железа сосредоточена в ядре. Но и в земной коре на долю этого элемента приходится более 4 % массы, и это второе место среди металлов (после алюминия) и четвёртое среди всех химических элементов. Среди железных руд, т.е. горных пород, из которых можно добывать железо в промышленных масштабах, наибольшее значение имеют красный железняк (гематит) $Fe_{2}O_{3}$, магнитный железняк (магнетит) $Fe_{3}O_{4}$, бурый железняк (лимонит) $Fe_{2}O_{3} * 2H_{2}O$. В природе также широко распространён пирит (серный, или железный, колчедан) $FeS_{2}$, однако он не относится к железным рудам, а служит сырьём для получения серной кислоты. По запасам железных руд Россия занимает первое место в мире.
2. Не производя расчётов, укажите, в какой из руд — красном, буром, магнитном железняке или пирите — массовая доля железа наибольшая.
Ответ:
Напишем формулы веществ:
Красный железняк − $Fe_{2}O_{3}$
Бурый железняк − $Fe_{2}O_{3} * 2H_{2}O$
Магнитный железняк − $Fe_{3}O_{4}$
Железо тяжелее и кислорода, и водорода, поэтому вклад его атомов в массу молекулы будет решающим. Больше всего атомов железа в магнитном железняке, поэтому его содержание в этом минерале − наибольшее.3. Перечислите химические свойства железа. Подчеркните особенности его взаимодействия с растворами кислот и солей, а также с неметаллами.
Ответ:
Как и все металлы, простое вещество железо в любых химических реакциях проявляет восстановительные свойства. В зависимости от природы второго участника реакции − окислителя, в продуктах реакции железо может иметь степень окисления +2 или +3. Например, при взаимодействии железа с серой образуется сульфид железа(II):
$Fe + S = FeS$
Более сильный окислитель − хлор окисляет железо до степени окисления +3.
$2Fe + 3Cl_{2} = 2FeCl_{3}$
В этом отношении интересна реакция железа с кислородом. При высокой температуре порошок железа сгорает с образованием необычного оксида, который называют железной окалиной, а состав отражают формулой $Fe_{3}O_{4}$:
$3Fe + 2O_{2} = Fe_{3}O_{4}$
Что же необычного в этом оксиде? Если рассчитать степень окисления железа в этом веществе, то получится дробное число +8/3. Дело в том, что в данном оксиде степени окисления трёх атомов железа различны: у двух +3, у одного +2. Поэтому химическое название железной окалины − оксид железа(II, III). Подобные оксиды называют смешанными оксидами. Формулу оксида железа(II, III) можно записать по−другому: $FeO * Fe_{2}O_{3}$.
При высокой температуре раскалённое железо реагирует с перегретым водяным паром.
При этом также образуется оксид железа(II, III) и водород:
$3Fe + 4H_{2}O = Fe_{3}O_{4} + 4H_{2}↑$
На протекании этой реакции основан железо−паровой способ получения водорода.
Поскольку железо в электрохимическом ряду напряжений металлов стоит левее водорода, оно способно восстанавливать катионы водорода из растворов кислот:
$Fe + 2HCl = FeCl_{2} + H_{2}$
А вот концентрированные серная и азотная кислоты пассивируют железо и при комнатной температуре с ним не взаимодействуют. Фосфорная кислота также не реагирует с железом, поскольку при контакте этих веществ поверхность металла покрывается тонкой плёнкой нерастворимого фосфата железа, что предохраняет его от дальнейшего взаимодействия. В соответствии с положением в электрохимическом ряду напряжений железо может вытеснять металлы, стоящие правее его, из водных растворов их солей, например:
$Fe + CuSO_{4} = FeSO_{4} + Cu$Примените свои знания
4. Составьте уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
а) $FeO → Fe → FeCl_{3} → Fe(OH)_{3} → Fe_{2}O_{3} → Fe_{2}(SO_{4})_{3} → FeCl_{3}$
б) $Fe → FeCl_{2} → Fe(OH)_{2} → FeO → FeSO_{4} → FeCl_{2}$
Для реакций, протекающих в растворах, запишите ионные уравнения. В двух уравнениях окислительно−восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.Ответ:
а) $FeO → Fe → FeCl_{3} → Fe(OH)_{3} → Fe_{2}O_{3} → Fe_{2}(SO_{4})_{3} → FeCl_{3}$
1) $FeO + CO ⟶ Fe + CO_{2}$
$Fe^{+2} + 2ē ⟶ Fe^{0}$ − окислитель
$C^{+2} - 2ē ⟶ C^{+4}$ − восстановитель
2) $2Fe + 3Cl_{2} ⟶ 2FeCl_{3}$
$Cl_{2}^{0} + 2ē ⟶ 2Cl^{-}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+3}$ − восстановитель
3) $FeCl_{3} + 3NaOH ⟶ 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}$↓
4) $2Fe(OH)_{3} ⟶ Fe_{2}O_{3} + 3H_{2}O$
5) $Fe_{2}O_{3} + 3H_{2}SO_{4} ⟶ Fe_{2}(SO_{4})_{3} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} + 3SO_{4}^{2-} ⟶ 2Fe^{3+} + 3SO_{4}^{2-} + 3H_{2}O$
$Fe_{2}O_{3} + 6H^{+} ⟶ 2Fe^{3+} + 3H_{2}O$
6) $Fe_{2}(SO_{4})_{3} + 3BaCl_{2} ⟶ 2FeCl_{3} + 3BaSO_{4}↓$
$2Fe^{3+} + 3SO_{4}^{2-} + 3Ba^{2+} + 6Cl^{-} ⟶ 2Fe^{3+} + 6Cl^{-} + 3BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$
б) $Fe → FeCl_{2} → Fe(OH)_{2} → FeO → FeSO_{4} → FeCl_{2}$
1) $Fe + 2HCl ⟶ FeCl_{2} + H_{2}$
$2H^{+} + 2ē ⟶ H_{2}^{0}$ − окислитель
$Fe^{0} - 2ē ⟶ Fe^{+2}$ − восстановитель
2) $FeCl_{2} + 2NaOH ⟶ 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
3) $Fe(OH)_{2} ⟶ FeO + H_{2}O$
4) $FeO + H_{2}SO_{4} ⟶ FeSO_{4} + H_{2}O$
$FeO + 2H^{+} + SO_{4}^{2-} ⟶ Fe^{2+} + SO_{4}^{2-} + H_{2}O$
$FeO + 2H^{+} ⟶ Fe^{2+} + H_{2}O$
5) $FeSO_{4} + BaCl_{2} ⟶ FeCl_{2} + BaSO_{4}↓$
$Fe^{2+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ Fe^{2+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$5. Используя метод электронного баланса, составьте уравнения окислительно−восстановительных реакций, соответствующих схемам:
а) $Fe(OH)_{2} + O_{2} + H_{2}O → Fe(OH)_{3}$
б) $Fe + Br_{2} → FeBr_{3}$
в) $FeSO_{4} + KMnO_{4} + H_{2}SO_{4} → Fe_{2}(SO_{4})_{3} + K_{2}SO_{4} + MnSO_{4} + H_{2}O$
Укажите окислитель и восстановитель.Ответ:
а) $Fe(OH)_{2} + O_{2} + H_{2}O → Fe(OH)_{3}$
$4Fe(OH)_{2} + O_{2} + 2H_{2}O = 4Fe(OH)_{3}$
$O_{2}^{0} + 4ē ⟶ 2O^{-2}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель
б) $Fe + Br_{2} → FeBr_{3}$
$2Fe + 3Br_{2} = 2FeBr_{3}$
$Br_{2}^{0} + 2ē ⟶ 2Br^{-}$ − окислитель
$Fe^{0} - 3ē ⟶ Fe^{+2}$ − восстановитель
в) $FeSO_{4} + KMnO_{4} + H_{2}SO_{4} → Fe_{2}(SO_{4})_{3} + K_{2}SO_{4} + MnSO_{4} + H_{2}O$
$10FeSO_{4} + 2KMnO_{4} + 8H_{2}SO_{4} = 5Fe_{2}(SO_{4})_{3} + K_{2}SO_{4} + 2MnSO_{4} + 8H_{2}O$
$Mn^{+7} + 5ē ⟶ Mn^{+2}$ − окислитель
$Fe^{+2} - 1ē ⟶ Fe^{+3}$ − восстановитель6. Напишите по два молекулярных уравнения, соответствующих каждому ионному уравнению:
а) $Fe^{2+} + 2OH^{–} = Fe(OH)_{2}↓$
б) $Fe_{2}O_{3} + 6H^{+} = 2Fe^{3+} + 6H_{2}O$
в) $2Fe^{3+} + 2I^{–} = 2Fe^{2+} + I_{2}$Ответ:
а) $Fe^{2+} + 2OH^{–} = Fe(OH)_ {2}↓$
Молекулярные уравнения, которые соответствуют данному ионному уравнению:
$FeCl_{2} + 2NaOH = 2NaCl + Fe(OH)_{2}↓$
$Fe(NO_{3})_{2} + 2KOH = 2KNO_{3} + Fe(OH)_{2}$
б) $Fe_{2}O_{3} + 6H^{+} = 2Fe^{3+} + 6H_{2}O$
Молекулярные уравнения, которые соответствуют данному ионному уравнению:
$Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 6H_{2}O$
$Fe_{2}O_{3} + 3H_{2}SO_{4} + Fe_{2}(SO_{4})_{3} + 3H_{2}O$
в) $2Fe^{3+} + 2I^{–} = 2Fe^{2+} + I_{2}$
Молекулярные уравнения, которые соответствуют данному ионному уравнению:
$2FeCl_{3} + 2KI = 2FeCl_{2} + 2KCl + I_{2}$
$Fe_{2}(SO_{4})_{3} + 2NaI = 2FeSO_{4} + Na_{2}SO_{4} + I_{2}$7. Железный купорос $FeSO_{4} * 7H_{2}O$ широко используют как фунгицид — средство для борьбы с грибковыми заболеваниями растений. Какую массу железного купороса можно получить из 2,8 кг железных опилок и необходимого количества разбавленной серной кислоты?
Ответ:
Дано:
m (Fe) = 2,8 кг
Найти:
m ($FeSO_{4} * 7H_{2}O$) − ?
Решение:
$Fe + H_{2}SO_{4} + 7H_{2}O = FeSO_{4} * 7H_{2}O + H_{2}$
n ($FeSO_{4} * 7H_{2}O$) = n (Fe) = m : M = 2800 : 56 = 50 моль
m ($FeSO_{4} * 7H_{2}O$) = n * M = 50 * 278 = 13900 г = 13,9 кг
Ответ: m ($FeSO_{4} * 7H_{2}O$) = 13,9 кг.8. Один из учащихся написал формулу двойной соли железа и аммония как $NH_{4}Fe(SO_{4})_{2} * 12H_{2}O$, а другой — как $(NH_{4})_{2}Fe(SO_{4})_{2} * 6H_{2}O$. Кто из них прав? Докажите ваше утверждение.
Ответ:
Прав тот, кто написал формулу $NH_{4}Fe(SO_{4})_{2} * 12H_{2}O$, в данной форме на 2 сульфат−аниона приходится 1 катион железа (III) и 1 катион аммония.
9. На трёх карточках опишите свойства различных металлов, не называя эти металлы. Раздайте карточки своим одноклассникам, получите от них три аналогичные карточки с описанием. К следующему уроку постарайтесь определить, описания каких металлов вам достались. Можно ли по полученному вами тексту сделать однозначный вывод?
Ответ:
1) Химический элемент первой группы, третьего периода периодической системы Менделеева, с атомным номером 11. Как простое вещество представляет собой мягкий щелочной металл серебристо−белого цвета. На внешнем энергетическом уровне натрий имеет один электрон, который он легко отдаёт. (Натрий)
2) Элемент второй группы (по старой классификации − главной подгруппы второй группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. (Магний)
3) Элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество − пластичный переходный металл золотисто−розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком. (Медь)Практическая работа 7
Опыт 1
Опыт 1. Осуществление цепочки превращений
Проведите химические реакции, с помощью которых можно осуществить следующие превращения:
$MgO → MgCl_{2} → Mg(OH)_{2} → MgSO_{4} → MgCO_{3}$
Все опыты проводите в одной пробирке, добавляя по каплям следующий реагент до прекращения признаков протекания реакции.
Напишите уравнения реакций в молекулярной и ионной формах.Ответ:
$MgO → MgCl_{2} → Mg(OH)_{2} → MgSO_{4} → MgCO_{3}$
1) $MgO + 2HCl ⟶ MgCl_{2} + H_{2}O$
$MgO + 2H^{+} + 2Cl^{-} ⟶ Mg^{2+} + 2Cl^{-} + H_{2}O$
$MgO + 2H^{+} ⟶ Mg^{2+} + H_{2}O$
2) $MgCl_{2} + 2NaOH ⟶ 2NaCl + Mg(OH)_{2}↓$
$Mg^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Mg(OH)_{2}↓$
$Mg^{2+} + 2OH^{-} ⟶ Mg(OH)_{2}↓$
3) $Mg(OH)_{2} + H_{2}SO_{4} ⟶ MgSO_{4} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} + SO_{4}^{2-} ⟶ Mg^{2+} + SO_{4}^{2-} + 2H_{2}O$
$Mg(OH)_{2} + 2H^{+} ⟶ Mg^{2+} + 2H_{2}O$
4) $MgSO_{4} + Na_{2}CO_{3} ⟶ Na_{2}SO_{4} + MgCO_{3}↓$
$Mg^{2+} + SO_{4}^{2-} + 2Na^{+} + CO_{3}^{2-} ⟶ 2Na^{+} + SO_{4}^{2-} + MgCO_{3}↓$
$Mg^{2+} + CO_{3}^{2-} ⟶ MgCO_{3}↓$Опыт 2
Опыт 2. Получение соединений металлов и изучение их свойств
Используя предложенные вам реактивы, получите хлорид железа(II). Докажите наличие иона $Fe^{2+}$ в полученном растворе.
Используя в качестве окислителя пероксид водорода, получите из хлорида железа (II) хлорид железа (III). Докажите наличие иона $Fe^{3+}$ в полученном растворе.
Переведите ион $Fe^{3+}$ в осадок в виде гидроксида железа(III).
Напишите уравнения всех реакций в молекулярной и ионной формах.Ответ:
При добавлении щелочи к хлориду железа (II) докажем наличие иона $Fe^{2+}$ в полученном растворе, так как образуется осадок темно−зеленого цвета:
$FeCl_{2} + 2NaOH ⟶ 2NaCl + Fe(OH)_{2}↓$
$Fe^{2+} + 2Cl^{-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + 2Cl^{-} + Fe(OH)_{2}↓$
$Fe^{2+} + 2OH^{-} ⟶ Fe(OH)_{2}↓$
Получим из хлорида железа (II) хлорид железа (III), используя в качестве окислителя пероксид водорода:
$2FeCl_{2} + 2HCl + H_{2}O_{2} ⟶ 2FeCl_{3} + 2H_{2}O$
$2Fe^{3+} + 4Cl^{-} + 2H^{+} + 2Cl^{-} + H_{2}O_{2} ⟶ 2Fe^{3+} + 6Cl^{-} + 2H_{2}O$
$2Fe^{3+} + 2H^{+} + H_{2}O_{2} ⟶ 2Fe^{3+} + 2H_{2}O$
При добавлении щелочи к хлориду железа (III) образуется осадок рыжего цвета: $FeCl_{3} + 3NaOH ⟶ 3NaCl + Fe(OH)_{3}↓$
$Fe^{3+} + 3Cl^{-} + 3Na^{+} + 3OH^{-} ⟶ 3Na^{+} + 3Cl^{-} + Fe(OH)_{3}↓$
$Fe^{3+} + 3OH^{-} ⟶ Fe(OH)_{3}↓$Опыт 3
Опыт 3. Распознавание соединений металлов
В четырёх пронумерованных пробирках без этикеток находятся кристаллические соли: сульфат магния, сульфат цинка, сульфат натрия, карбонат кальция. С помощью предложенных вам реактивов распознайте каждую соль. Напишите уравнения проведённых реакций в молекулярной и ионной формах.Ответ:
Для распознавания солей нужно добавить раствор гидроксида натрия.
В пробирках с сульфатом магния и сульфатом цинка образуются осадки:
$MgSO_{4} + 2NaOH ⟶ Na_{2}SO_{4} + Mg(OH)_{2}↓$
$Mg^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + Mg(OH)_{2}↓$
$Mg^{2+} + 2OH^{-} ⟶ Mg(OH)_{2}↓$
$ZnSO_{4} + 2NaOH ⟶ Na_{2}SO_{4} + Zn(OH)_{2}↓$
$Zn^{2+} + SO_{4}^{2-} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + SO_{4}^{2-} + Zn(OH)_{2}↓$
$Zn^{2+} + 2OH^{-} ⟶ Zn(OH)_{2}↓$
Но при избытке раствора гидроксида натрия гидроксид цинка ратсорится:
$Zn(OH)_{2} + 2NaOH ⟶ Na_{2}[Zn(OH)_{4}]$
$Zn(OH)_{2} + 2Na^{+} + 2OH^{-} ⟶ 2Na^{+} + [Zn(OH)_{4}]^{-}$
$Zn(OH)_{2} + 2OH^{-} ⟶ [Zn(OH)_ {4}]^{-}$
В две пробирки с нераспознанным веществами добавим соляную кислоту, в пробирке с карбонатом кальция будет наблюдаться выделение газа:
$CaCO_{3} + 2HCl ⟶ CaCl_{2} + H_{2}O + CO_{2}↑$
$CaCO_{3} + 2H^{+} + 2Cl^{-} ⟶ Ca^{2+} + 2Cl^{-} + H_{2}O + CO_{2}↑$
$CaCO_{3} + 2H{+} ⟶ Ca^{2+} + H_{2}O + CO_{2}↑$
В пробирку с сульфатом натрия добавим хлорид бария, образуется белый осадок:
$Na_{2}SO_{4} + BaCl_{2} ⟶ 2NaCl + BaSO_{4}↓$
$2Na^{+} + SO_{4}^{2-} + Ba^{2+} + 2Cl^{-} ⟶ 2Na^{+} + 2Cl^{-} + BaSO_{4}↓$
$Ba^{2+} + SO_{4}^{2-} ⟶ BaSO_{4}↓$ §35
-
§35. Коррозия металлов и способы защиты от нее
Вопрос в начале параграфа✓
Ежегодно около четверти металлургических предприятий мира работают на восполнение потерь от коррозии. Что такое коррозия и как уменьшить потери от неё?
Ответ:
Коррозия − это разрушение металла или сплава в результате взаимодействия с окружающей средой.
Способы защиты металлов от коррозии:
1) Нанесение защитных покрытий на поверхность металлического изделия.
2) Добавка легирующих элементов.
3) Изменение состава поверхностного слоя металлического изделия.
4) Использование ингибиторов.
5) Протекторная защита.Проверьте свои знания
1. Что такое коррозия? Какие виды коррозии различают?
Ответ:
Коррозия − это разрушение металла или сплава в результате взаимодействия с окружающей средой.
Различают химическую и электрохимическую коррозию.
Химическая коррозия металлов − это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.2. Проиллюстрируйте химическую коррозию на примере процессов, протекающих с литием на воздухе, сопроводив их соответствующими уравнениями реакций.
Ответ:
1) При взаимодействии лития с кислородом образуется оксид лития:
$4Li + O_{2} = 2Li_{2}O$
2) При взаимодействии лития с водой образуется щелочь и водород:
$2Li + 2H_{2}O = 2LiOH + H_{2}$3. Перечислите способы защиты от коррозии.
Ответ:
Способы защиты металлов от коррозии:
1) Нанесение защитных покрытий на поверхность металлического изделия.
2) Добавка легирующих элементов.
3) Изменение состава поверхностного слоя металлического изделия.
4) Использование ингибиторов.
5) Протекторная защита.Примените свои знания
4. Медь на воздухе покрывается налётом тёмного цвета, представляющим собой тонкую плёнку оксида меди (II). Напишите уравнение соответствующей реакции. Предложите способ химической очистки поверхности меди от оксидной плёнки без повреждения металла.
Ответ:
$2Cu + O_{2} = 2CuO$
Способ химической очистки поверхности меди от оксидной плёнки:
$CuO + 2HCl = CuCl_{2} + H_{2}O$
$Cu + HCl$ ≠5. Бронзовые скульптуры под действием кислорода воздуха, углекислого газа и влаги покрываются патиной − зеленоватым налётом, состоящим главным образом из вещества с формулой $(CuOH)_{2}CO_{3}$. К какому классу соединений относится это вещество? Дайте ему название. Напишите уравнение реакции этого соединения с раствором серной кислоты.
Ответ:
$(CuOH)_{2}CO_{3}$ – осно́вная соль.
$(CuOH)_{2}CO_{3} + 2H_{2}SO_{4} = 2CuSO_{4} + 3H_{2}O + CO_{2}↑$6. В состав преобразователей ржавчины, которые превращают рыхлый гидроксид железа (III) в тонкую прочную плёнку фосфата железа(III), входит фосфорная кислота. Напишите уравнение реакции, протекающей при обработке ржавой поверхности фосфорной кислотой. Является ли данная реакция окислительно−восстановительной?
Ответ:
$Fe(OH)_{3} + H_{3}PO_{4} ⟶ FePO_{4} + 3H_{2}O$
Данная реакция не является окислительно−восстановительной.7. В начале XX в. из порта Нью−Йорка вышла в открытый океан красавица яхта. Её владелец, американский миллионер, изготовил корпус яхты из очень дорогого в то время алюминия, листы которого скреплялись медными заклёпками. Это было очень красиво: сверкающий серебристый корабль, усеянный золотистыми головками заклёпок! Однако через несколько месяцев обшивка корпуса начала расходиться, и яхта пошла ко дну. Почему? Напишите соответствующие уравнения реакций.
Ответ:
Обшивка корпуса начала расходиться из−за электрохимической коррозии алюминия. При контакте с медью в водной среде алюминий, как более активный металл, постепенно корродирует, превращаясь в ионы $Al^{3+}$:
$Al^{0} - 3ē ⟶ Al^{3+}$8. Для защиты от коррозии тонкого железного листа (жести) его покрывают тонким слоем металлического цинка. Каким образом цинковое покрытие предохраняет железо от коррозии? Рассмотрите электрохимические процессы, протекающие на поверхности обоих металлов.
Ответ:
При контакте железа с металлическим цинком в агрессивной среде разрушается в первую очередь более активный металл – цинк:
$Zn^{0} - 2ē ⟶ Zn^{2+}$
Высвободившиеся электроны попадают на поверхность менее активного металла – железа, на котором происходит процесс восстановления веществ, вызывающих коррозию:
$O_{2} + 2H_{2}O + 4ē ⟶ 4OH^{-}$.
В результате окисления цинка образуется гидроксид этого металла:
$Zn^{2+} + 2OH^{-} ⟶ Zn(OH)_{2}↓$.9. Выполните домашний эксперимент «Изучение коррозии железных гвоздей».
Реактивы и оборудование: растворы аммиака (нашатырный спирт), хлорида натрия (поваренная соль), уксусной кислоты (столовый уксус), карбоната или гидрокарбоната натрия (стиральная или питьевая сода), вода; пять гвоздей, пять прозрачных пузырьков (например, из−под лекарств); любой самодельный индикатор
Ход работы
1) Возьмите пять пузырьков и опустите в каждый по чистому блестящему гвоздю. Аккуратно! Не разбейте донышки пузырьков!
2) Налейте в каждый пузырёк раствор одного из реагентов так, чтобы он полностью покрыл гвоздь.
3) С помощью любого индикатора определите среду каждого раствора. Оставьте гвозди в растворах до следующего дня. Проследите за тем, какие изменения обнаружились при этом.
4) Напишите отчёт о проделанной работе, ответив на следующие вопросы:
• В каких растворах наблюдались, а в каких не наблюдались признаки коррозии?
• Удалось ли вам установить какие−либо закономерности при проведении опыта? Каковы они? Как можно объяснить эти закономерности?
• Заметили ли вы разницу в том, как протекает коррозия на поверхности, шляпке, остром кончике гвоздя?Ответ:
Изучение коррозии железных гвоздей
1) Взяли пять пузырьков и опустили в каждый по чистому блестящему гвоздю.
2) Налили в каждый пузырёк раствор одного из реагентов так, чтобы он полностью покрыл гвоздь.
3) С помощью любого индикатора определили среду каждого раствора. Оставили гвозди в растворах до следующего дня. Проследили за тем, какие изменения обнаружились при этом.Реагент Среда Признаки коррозии
Нашатырный спирт щелочная −
Поваренная соль нейтральная есть
Уксус кислая есть
Питьевая сода щелочная −
Вода нейтральная есть
Присутствие в среде солей и кислот способствует коррозии. В щелочной среде коррозия, наоборот, замедлена.
При этом, в местах, где выше плотность контакта гвоздя с агрессивной средой наблюдается больше следов коррозии. §36
-
§36. Металлы в природе. Понятие о металургии
Вопрос в начале параграфа✓
Некоторые металлы встречаются в природе в самородном состоянии, большинство же — в виде различных соединений. Тем не менее и те и другие получают посредством физических и химических процессов, которые в совокупности называют металлургией. Что представляет собой эта отрасль науки и производства?
Ответ:
Отрасль науки и промышленности, которая занимается получением металлов и сплавов, называют металлургией (от греч. metallon — рудник и ergon — работа).
Проверьте свои знания
1. Какие металлы называют благородными? Чем обусловлена возможность их существования в природе в свободном состоянии?
Ответ:
Благородными металлами называют золото, серебро, платину, а также ближайших «соседей» платины по группе — палладий, иридий, родий, рутений, осмий.
В чём же состоит их «благородство»? Во−первых, изделия из этих металлов выглядят красиво. Во−вторых, поразительна их химическая стойкость: на них не действуют растворы кислот и щелочей, да и концентрированные кислоты растворяют не всякий благородный металл; благородные металлы также не корродируют, не разрушаются на воздухе.2. Что такое металлургия? Какие способы получения металлов из природного сырья вы знаете? Сравните разные виды металлургии.
Ответ:
Отрасль науки и промышленности, которая занимается получением металлов и сплавов, называют металлургией (от греч. metallon — рудник и ergon — работа).
В зависимости от того, каким способом восстанавливают металл, существует несколько видов металлургического производства.
1) Пирометаллургия.
Этот термин произошёл от греческого слова pyros — огонь. Для получения металла руду нагревают с подходящим восстановителем: углеродом (коксом), водородом или более активным металлом.
2) Гидрометаллургия.
Само название этого вида металлургии указывает на то, что получение металла ведут из раствора (от греч. hydor — вода). Поэтому природное соединение металла предварительно переводят в раствор действием подходящего реагента.
3) Электрометаллургия.
Активные металлы из их природных соединений очень трудно восстановить с помощью химических веществ. Катионы щелочных, щелочноземельных металлов или алюминия с большим трудом принимают недостающие электроны.Примените свои знания
3. Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам:
а) $Cu_{2}O + C → Cu + CO$
б) $Fe_{2}O_{3} + CO → Fe + CO_{2}$
в) $V_{2}O_{5} + Al → Al_{2}O_{3} + V$Ответ:
а) $Cu_{2}O + C = 2Cu + CO$
$Cu^{+1} + 1ē ⟶ Cu^{0}$ − окислитель
$C^{0} - 2ē ⟶ C^{+2}$ − восстановитель
б) $Fe_{2}O_{3} + 3CO = 2Fe + 3CO_{2}$
$Fe^{+3} + 3ē ⟶ Fe^{0}$ − окислитель
$C^{+2} - 2ē ⟶ C^{+4}$ − восстановитель
в) $3V_{2}O_{5} + 10Al = 5Al_{2}O_{3} + 6V$
$V^{+5} + 5ē ⟶ V^{0}$ − окислитель
$Al^{0} - 3ē ⟶ Al^{+3}$ − восстановитель4. Напишите уравнения электролиза расплавов:
а) хлорида калия;
б) бромида натрия;
в) хлорида магния.Ответ:
а) Уравнение электролиза расплава хлорида калия:
$2KCl ⟶ 2K + Cl_{2}↑$
б) Уравнение электролиза расплава бромида натрия:
$NaBr ⟶ 2Na + Br_{2}↑$
в) Уравнение электролиза расплава хлорида магния:
$MgCl_{2} ⟶ Mg + Cl_{2}↑$5. Какой из железосодержащих минералов предпочтительнее использовать для получения железа с точки зрения содержания в руде нужного элемента: пирит $FeS_{2}$, лимонит $Fe_{2}O_{3} * 2H_{2}O$, магнетит $Fe_{3}O_{4}$, гематит $Fe_{2}O_{3}$? Ответ обоснуйте, рассчитав массовую долю железа в указанных соединениях.
Ответ:
Дано:
$FeS_{2}$
$Fe_{2}O_{3} * 2H_{2}O$
$Fe_{3}O_{4}$
$Fe_{2}O_{3}$
Найти:
$ω_{1}$ (Fe) − ?
$ω_{2}$ (Fe) − ?
$ω_{3}$ (Fe) − ?
$ω_{4}$ (Fe) − ?
Решение:
ω = $\frac{n\;*\;Ar}{Mr}$ * 100%
$ω_{1}$ (Fe) = $\frac{1\;*\;56}{120}$ * 100% = 47%
$ω_{2}$ (Fe) = $\frac{2\;*\;56}{196}$ * 100% = 57%
$ω_{3}$ (Fe) = $\frac{3\;*\;56}{232}$ * 100% = 72%
$ω_{4}$ (Fe) = $\frac{2\;*\;56}{160}$ * 100% = 70%
Ответ: для получения железа предпочтительнее использовать магнетит, в нем содержится 72% железа.6. Массовая доля сульфида цинка в руде сфалерит составляет 42 %. Рассчитайте, какую массу цинка можно получить из 1 т такой руды.
Ответ:
Дано:
ω ($ZnS$) = 42%
m = 1 т
Найти:
m (Zn) − ?
Решение:
m = 1 т = 1000 кг
m (ZnS) = m * ω ($ZnS$) = 1000 кг * 0,42 = 420 кг
ω (Zn) = $\frac{1 * 65}{97}$ * 100% = 67%
m (Zn) = m (ZnS) * ω (Zn) = 420 кг * 0,67 = 281 кг
Ответ: m (Zn) = 281 кг.7. В состав минерала халькопирита входят медь (массовая доля 34,78 %), железо (массовая доля 30,44 %) и сера (массовая доля 34,78 %). Определите формулу минерала.
Ответ:
Дано:
ω (Cu) = 34,78%
ω (Fe) = 30,44%
ω (S) = 34,78%
Найти:
формула − ?
Решение:
n (Cu) = 0,3478 : 64 = 0,0054
n (Fe) = 0,3044 : 56 = 0,0054
n (S) = 0,3478 : 32 = 0,0109
x : y : z = n (Cu) : n (Fe) : n (S) = 0,0054 : 0,0054 : 0,0109 = 1 : 1 : 2
Таким образом, молекулярная формула − $CuFeS_{2}$.
Ответ: $CuFeS_{2}$.8. Массовая доля оксида алюминия в образце боксита составляет 81,6 %. Какую массу алюминия можно получить из 1 т этого сырья, если производственные потери металла составляют 6 %?
Ответ:
Дано:
ω (Al) = 81,6%
m (сырья) = 1 т
ω (потери) = 6%
Найти:
m (Al) практич. − ?
Решение:
m ($Al_{2}O_{3}$) = 1т * 0,816 = 0,816 т = 816000 г
$Al_{2}O_{3}$ −> 2Al
n (Al) = 2 * n ($Al_{2}O_{3}$) = m : M = 2 * 816000 : 102 = 16000 моль
m (Al) = n * M = 16000 * 27 = 432000 г = 0,432 т
ω (Al) = 100% − 6% = 94%
m (Al) практич. = 0,432 * 0,94 = 0,406 т
Ответ: m (Al) практич. = 0,406 т.9. Какие массы хрома и никеля потребуются для получения нержавеющей стали из 200 кг железа, если содержание в конечном сплаве никеля составляет 8 %, а хрома — 10 %?
Ответ:
Дано:
m (Fe) = 200 кг
ω (Ni) = 8%
ω (Cr) = 10%
Найти:
m (Cr) − ?
m (Ni) − ?
Решение:
ω (Fe) = 100% − 10% − 8% = 82%
m (сплава) = 200000 : 0,82 = 243902 г
m (Ni) = 243902 * 0,08 = 19512 г = 19,51 кг
m (Cr) = 243902 * 0,1 = 24390,1 г = 24,39 кг
Ответ: m (Ni) = 19,51 кг; m (Cr) = 24,39 кг.Используйте дополнительную информацию
Есть ли в вашем регионе металлургическое производство? Если есть, то подготовьте сообщение о нём и о его продукции.
Ответ:
Производство чугуна и стали
Для выплавки чугуна в доменных печах используют железные руды, топливо, флюсы.
Руды: Железные руды содержат 55 − 60% железа в различных соединениях (оксидов, гидроксидов, карбонатов и др.), а также пустую породу.
Марганцевые руды применяют для выплавки сплава железа с марганцем – ферромарганца, а также передельный чугунов. Хромовые руды используют для производства феррохрома, металлического хрома и огнеупорных материалов – хромомагнезитов. Комплексные руды используют для выплавки природно−легированных чугунов. Это железомарганцевые руды, хромоникелевые руды, железованадиевые руды.
Топливо: кокс – для получения необходимой температуры и создавать условия для восстановления железо из руды; в целях экономии часть кокса заменяют природным газом, мазутом, пылевидным топливом. §37
-
ГЛАВА V. Химия и окружающая среда
§37. Химический состав планеты Земля
Вопрос в начале параграфа✓
Все живые и неживые объекты природы состоят из одних и тех же 90 химических элементов. Как устроена планета Земля с точки зрения химии?
Ответ:
Наша планета Земля весом миллиард триллионов тонн состоит из самых разных веществ. А эти вещества, в свою очередь, построены из 90 различных химических элементов. Именно столько элементов обнаружено на нашей планете. Остальные элементы периодической системы ни на Земле, ни в космосе не встречаются, они получены искусственно.
Лабораторный опыт 45
Рассмотрите при помощи увеличительного стекла или лупы кусочек гранита. Хорошо заметно его неоднородное строение. Красноватые или сероватые зёрна — это полевой шпат, полупрозрачные — кварц, блестящие чешуйчатые зёрнышки — слюда.
Ответ:
Рассмотрели при помощи увеличительного стекла или лупы кусочек гранита. Хорошо заметно его неоднородное строение. Красноватые или сероватые зёрна — это полевой шпат, полупрозрачные — кварц, блестящие чешуйчатые зёрнышки — слюда.
Проверьте свои знания
1. Каково строение нашей планеты? Какие химические элементы преобладают в каждой из оболочек Земли?
Ответ:
Наша планета Земля весом миллиард триллионов тонн состоит из самых разных веществ. А эти вещества, в свою очередь, построены из 90 различных химических элементов. Именно столько элементов обнаружено на нашей планете. Остальные элементы периодической системы ни на Земле, ни в космосе не встречаются, они получены искусственно.
Ядро окружено мантией, состоящей из веществ, образованных в основном алюминием, кремнием и кислородом.
Из магматических горных пород состоит наружная оболочка планеты − земная кора.
Литосфера − оболочка Земли, образованная земной корой и прилегающими к ней слоями мантии. Литосфера на 82% состоит из кислорода, кремния и алюминия.
Водную оболочку планеты называют гидросферой. Она отличается разнообразием содержащихся в ней веществ и элементов.
Атмосфера, воздушная оболочка Земли представлена в основном неметаллами − азотом, кислородом, благородными газами.2. Что такое минералы, осадочные породы? Приведите названия пяти минералов из коллекции Минералогического музея им. А. Е. Ферсмана. Для выполнения задания воспользуйтесь сайтом музея: www.fmm.ru.
Ответ:
Горные породы состоят из минералов. Минералы, в отличие от горных пород, − это однородные по составу и свойствам природные тела, которые образуются в результате процессов, протекающих в земной коре.
Горные породы представляют собой сочетание нескольких различных веществ. В этом легко убедиться, рассматривая горную породу при небольшом увеличении с помощью лупы.
Примеры минералов:
• альмандин $Fe_{3}Al_{2}(SiO_{4})_ {3}$,
• ильменит $(TiFe)O_{3}$,
• кордиерит $Mg_{2}Al_{3}(AlSi_{5}O_{18})$,
• перовскит $(CaTi)O_{3}$,
• пейнит $CaZrBAl_{9}O_{18}$.3. Охарактеризуйте химический состав гидросферы. Соединения каких химических элементов, помимо кислорода и водорода, преобладают в Мировом океане?
Ответ:
Главная составная часть гидросферы — Мировой океан. В морской и океанической воде растворено много веществ, причём в ней можно обнаружить практически все известные в природе химические элементы, даже золото. Средняя солёность Мирового океана составляет около 35 г солей в 1 л воды (чуть больше столовой ложки на литр). Если бы вода всех морей и океанов внезапно испарилась, на дне образовался бы слой веществ толщиной 50 м. Большая его часть (примерно 78 %) приходилась бы на хлорид натрия, который и придаёт морской воде солёный вкус. А горьковатый привкус — результат присутствия соединений магния.
4. Расскажите о составе атмосферного воздуха.
Ответ:
Атмосфера, воздушная оболочка Земли, представлена исключительно элементами−неметаллами, а соединения металлов могут содержаться в ней лишь как случайные компоненты, обусловленные загрязнением воздуха промышленными отходами и некоторыми другими веществами (пыль, микроорганизмы, пыльца растений и т. п.). Азот, кислород, благородные газы относят к постоянным компонентам атмосферного воздуха, их содержание колеблется у поверхности Земли очень незначительно. Азот присутствует в воздухе главным образом в виде простого вещества $N_{2}$. Аналогично кислород представлен в атмосфере преимущественно простыми веществами: кислородом $O_{2}$, а в верхних слоях атмосферы — озоном $O_{3}$. Кислород в атмосфере входит также в состав некоторых переменных составных частей воздуха, например оксидов: углекислого ($CO_{2}$) и угарного (CO) газов, оксидов азота и серы.
Примените свои знания
5. Один из самых солёных водоёмов на планете — Мёртвое море. Для того чтобы приготовить аналог его вод, нужно в 1 л чистой воды растворить 490 г соли. Рассчитайте массовую долю солей в Мёртвом море.
Ответ:
Дано:
1 л воды − 490 г соли
Найти:
ω (солей) − ?
Решение:
1 л воды = 1000 г воды
ω (солей) = 490 г : (490 г + 1000 г) * 100% = 32,89%
Ответ: ω (солей) = 32,89%.6. Массовые доли элементов в минерале криолите составляют: калий — 58,2 %, алюминий — 13,4 %, фтор — 28,4 %. Определите формулу минерала.
Ответ:
Дано:
ω (K) = 58,2%
ω (Al) = 13,4%
ω (F) = 28,4%
Найти:
формула − ?
Решение:
n (K) = 0,582 : 39 = 0,015
n (Al) = 0,134 : 27 = 0,005
n (F) = 0,284 : 19 = 0,015
x : y : z = n (K) : n (Al) : n (F) = 0,015 : 0,005 : 0,015 = 3 : 1 : 3
$K_{3}AlF_{3}$ − такого минерала не существует.
Ответ: $K_{3}AlF_{3}$.Выразите свое мнение
Одна из глобальных проблем человечества — нехватка пресной воды. При этом, например, в прибрежных странах Африки солёных вод предостаточно. Какие способы опреснения морской воды вы можете предложить?
Ответ:
Способы опреснения морской воды:
1) Дистилляция: воду отгоняют, примеси при этом не испаряются.
2) Вымораживание.
3) Ионный обмен: используются мембраны, задерживающие ионы солей, растворенных в воде.
4) Электродиализ.
5) Осмос − односторонняя диффузия растворителя через полупроницаемую мембрану в более концентрированный раствор. §38
-
§38. Охрана окружающей среды от химического загрязнения
Вопрос в начале параграфа✓
Химическое производство — основа жизни современного общества. Однако оно далеко не безопасно для окружающей среды, в которой живёт человечество. Какие наиболее известные глобальные экологические проблемы требуют незамедлительного решения?
Ответ:
Следствием химического загрязнения окружающей среды являются такие экологические проблемы, как нарушение биогеохимических круговоротов химических элементов, потепление климата, кислотные дожди и др. Деятельность человека в первую очередь влияет на круговороты углерода, кислорода, азота, фосфора и серы.
Проверьте свои знания
1. Как образуются кислотные осадки? Какой вред окружающей среде, промышленным и сельскохозяйственным предприятиям они наносят? Как влияют кислотные осадки на здоровье человека?
Ответ:
Поступающие в атмосферу выбросы металлургических и других предприятий, а также выхлопные газы автомобилей служат причиной выпадения кислотных дождей.
Кислотные дожди, точнее, осадки — дождь или снег, pH которых < 5,6, образуются в результате химических реакций между содержащимися в атмосфере водяными парами и кислотными оксидами.
Кислотные осадки переводят нерастворимые соли тяжёлых металлов в растворимые, которые усваиваются растениями, а потом попадают в организм животных и человека. Такие соединения также представляют угрозу для здоровья. Кроме того, в результате кислотных осадков гибнут леса и луга, разрушаются скульптуры, памятники архитектуры, металлические конструкции и т. д.2. Что представляет собой парниковый эффект? Почему его так называют? К каким последствиям приводит парниковый эффект?
Ответ:
Так, сжигание ископаемого топлива и переработка полезных ископаемых вводят в биосферу углерод и другие химические элементы, которые были ранее выведены из круговорота. В атмосфере повышается содержание так называемых парниковых газов — углекислого газа, паров воды, метана и др. Как следствие, усиливается парниковый эффект — свойство атмосферы пропускать световую энергию Солнца, но задерживать тепловое излучение Земли.
3. Почему озоновый слой называют также озоновым щитом планеты? Что такое озоновые дыры? Каковы причины их возникновения?
Ответ:
С химическим загрязнением атмосферы, возможно, связана и проблема уменьшения озонового слоя планеты, который располагается в стратосфере на высоте 20—25 км и защищает всё живое от губительного ультрафиолетового излучения Солнца. Явление локального уменьшения концентрации озона в озоновом слое Земли получило название озоновой дыры.
Появление озоновых дыр — разрушение озона в стратосфере — вызывается как природными, так и антропогенными факторами (запусками сверхзвуковых самолётов и ракет, выбросами автомобилей и промышленных предприятий, поступлением в атмосферу фреонов из холодильных установок).4. Почему охрана Мирового океана является глобальной проблемой?
Ответ:
Более 70 % поверхности Земли приходится на Мировой океан, который необходим для существования человеческой цивилизации. Он выполняет роль гигантского отстойника для захоронения токсичных отходов деятельности человека. Однако способность к самоочищению у вод многих внутренних морей уже исчерпана, а у Мирового океана близка к пределу. Отсюда следует, что охрана атмосферы, гидросферы и литосферы является условием существования человечества.
5. Какие международные соглашения регулируют систему мер по охране окружающей среды от химического загрязнения?
Ответ:
В 1997 г. в Киото, Япония, был принят международный документ — Киотский протокол, который обязывает развитые страны и страны с переходной экономикой сократить или стабилизировать выбросы парниковых газов.
Документом, устанавливающим межгосударственные меры по охране озонового слоя планеты, является принятая в 1985 г. Венская конвенция, которая была дополнена в 1987 г. Монреальским протоколом. Этот протокол содержит список самых опасных веществ, разрушающих озоновый слой.Примените свои знания
6. Составьте уравнения реакций образования кислотных дождей.
Ответ:
Кислотные дожди, точнее, осадки — дождь или снег, pH которых < 5,6, образуются в результате химических реакций между содержащимися в атмосфере водяными парами и кислотными оксидами:
$SO_{2} + NO_{2} = SO_{3} + NO$
$NO + O_{2} = 2NO_{2}$
$SO_{3} + H_{2}O = H_{2}SO_{4}$
$2NO_{2} + H_{2}O = HNO_{3} + HNO_{2}$7. Предложите уравнения реакций, в результате которых разрушаются памятники архитектуры.
Ответ:
Уравнения реакций, в результате которых разрушаются памятники архитектуры:
$CaCO_{3} + 2HNO_{3} ⟶ Ca(NO_{3})_{2} + H_{2}O + CO_{2}↑$
$CaCO_{3} + H_{2}SO_{4} ⟶ CaSO_{4} + H_{2}O + CO_{2}↑$
$CaSO_{4} + H_{2}SO_{4} ⟶ Ca(HSO_{4})_{2}$Используйте дополнительную информацию
1. Подготовьте сообщение о наиболее крупных экологических катастрофах последнего десятилетия, вызванных химическим загрязнением.
Ответ:
Наиболее крупные экологические катастрофы последнего десятилетия, вызванные химическим загрязнением:
1) Утечка нефтепродуктов из танкера «Престиж»
В ноябре 2002 года проходя через Бискайский залив, танкер попал возле берегов Галисии в сильный шторм, в результате чего получил трещину длиной 35 м, из которой стало вытекать около тысячи тонн мазута в сутки.
Испанские береговые службы не позволили грязному судну зайти в ближайший порт, поэтому его попытались отбуксировать в Португалию, но и там был получен аналогичный отказ. В конце концов, неприкаянный танкер отбуксировали в Атлантику. 19 ноября он затонул окончательно, расколовшись на две части, которые погрузились на дно на глубину порядка 3700 м. Поскольку устранить поломку и откачать нефтепродукты было невозможно, то в океан попало свыше 70 000 кубометров нефти. На поверхности вдоль береговой линии образовалось пятно длиной более тысячи километров, это нанесло местной фауне и флоре колоссальный ущерб.
2) Крушение танкера «Эксон Валдез»
23 марта 1989 года из терминала в аляскинском порту Валдиз отплыл полностью загруженный нефтью танкер «Эксон Валдез», который направлялся в калифорнийский порт Лонг−Бич.
В океан в результате катастрофы вылилось 40 000 кубометров нефти, а экологи считают, что значительно больше. Загрязнению подверглись 2400 км береговой линии, что сделало эту аварию одной из самых значительных экологических катастроф в мире.2. Одно из направлений «зелёной химии», развиваемое в России, — синтез новых материалов, очистка химических веществ с использованием сверхкритических жидкостей. Чаще всего используют сверхкритический оксид углерода (IV). При каких условиях оксид углерода(IV) становится сверхкритическим? Где уже используют сверхкритический оксид углерода(IV)? Ответы на вопросы можно найти на сайте www.greenchemistry.ru.
Ответ:
Одно из направлений «зеленой» химии, развиваемое в России, − синтез новых материалов, очистка химических веществ с использованием сверхкритических жидкостей. Чаще всего используют сверхкритический диоксид углерода, реже – воду, аммиак, пропан, азот и ксенон. Диоксид углерода и вода – дружественные природе и недорогие реагенты, поэтому их использование, безусловно, отвечает целям и задачам «зеленой» химии. И главное достоинство сверхкритических жидкостей: после использования давление в реакторе сбрасывается, и они возвращаются в атмосферу Земли. При этом отпадает необходимость в использовании вредных органических растворителей в больших количествах, ведь после реакции требуется обычно тщательная отмывка готового продукта.
Вблизи критической точки на фазовой диаграмме свойства веществ радикально меняются. Вода и $CO_{2}$ становятся эффективными растворителями. Поскольку сверхкритический диоксид углерода инертен, в нем можно проводить синтез органических веществ, в том числе комплексов металлов, полимеризацию, с его помощью можно экстрагировать необходимые вещества, например, извлекать из растворов соли тяжелых металлов. Более того, возможна экстракция и из твердых веществ. Так, в Радиевом институте (г.Санкт−Петербург) разработаны научные основы извлечения трансурановых элементов из радиоактивно загрязненных земель Чернобыльской зоны. Что касается полимеризации, сверхкритический $CO_{2}$ лучше растворяет фторированные углеводороды. Фирма «Дюпон» выбрала технологию с применением этого растворителя для производства фторсодержащих полимеров. Синтез других полимеров можно проводить в присутствии перфторуглеродов. Они позволяют предотвратить выпадение в осадок целевого полимера, например, полиакрилата, за счет того, что растущая молекула полимера удерживается в растворе окружающими ее перфторированными группами, примерно так, как молекулы поверхностно−активных веществ удерживают в растворе частицы жира и грязи при стирке. Кстати, в Японии сверхкритический $CO_{2}$ уже активно используют в прачечных−химчистках. В других отраслях промышленности сверхкритический СО2 тоже активно используется, но преимущественно как агент для экстракции. В качестве растворителя в химических реакциях он применяется в считанном количестве промышленных процессов. К числу пионеров можно отнести ученых Ноттингемского университета в Великобритании, которые совместно с фирмой Thomas Swan & Co. Ltd. сумели быстро масштабировать до 1000 т/год процесс селективного гидрирования изофорона в триметилциклогексанон в присутствии палладиевого катализатора, причем реактор сконструирован таким образом, что переход к другому процессу происходит относительно легко.
Работы по использованию сверхкритического $CO_{2}$ активно ведутся в России в МГУ им.М.В.Ломоносова, в Институте элементоорганических соединений РАН в лаборатории А.Р.Хохлова, и в других исследовательских лабораториях.
Использование воды вблизи критической точки сложнее и обходится дороже, чем диоксида углерода, поскольку критические температура и давления в этом случае существенно выше (374°С, 220 атм.). Однако получаемые результаты могут быть очень интересными, т.к. вода приобретает свойства чрезвычайно сильного растворителя.
Необходимо учитывать затраты энергии при переводе вещества в сверхкритическое состояние. Экологическая выгода от использования сверкритических флюидов должна превосходить тот ущерб, который может быть нанесен природе в результате выработки дополнительных количеств энергии. §39
-
ГЛАВА IV. Обобщение знаний по химии за курс основной школы. Подготовка к ОГЭ
§39. ВеществаПримените свои знания
1. Распределение электронов по энергетическим уровням 2, 8, 6 имеет атом элемента:
1) кислорода
2) кремния
3) серы
4) аргонаОтвет:
Распределение электронов по энергетическим уровням 2, 8, 6 имеет атом элемента:
1) кислорода: 2е, 6е.
2) кремния: 2е, 8е, 4е.
((3))серы
4) аргона: 2е, 8е, 8е.
Ответ: 3).2. Атомы химических элементов углерода и кремния имеют одинаковое число
1) электронов на внешнем электронном слое
2) протонов в ядре
3) заполненных электронных слоёв
4) нейтроновОтвет:
Атомы химических элементов углерода и кремния имеют одинаковое число электронов на внешнем электронном слое.
Атомы химических элементов углерода и кремния имеют одинаковое число
((1)) электронов на внешнем электронном слое
2) протонов в ядре
3) заполненных электронных слоёв
4) нейтронов
Ответ: 1).3. Химические элементы расположены в порядке уменьшения их атомного радиуса в ряду
1) S → O → N
2) Mg → Ca → Ba
3) Al → Si → P
4) Li → Na → KОтвет:
Химические элементы расположены в порядке уменьшения их атомного радиуса в ряду
1) S → O → N
2) Mg → Ca → Ba
((3)) Al → Si → P
4) Li → Na → K
Ответ: 3).4. Свойства оксидов изменяются от основных к кислотным в ряду
1) $Na_{2}O → Al_{2}O_{3} → SO_{3}$
2) $SiO_{2} → P_{2}O_{5} → MgO$
3) $K_{2}O → CaO → ZnO$
4) $SO_{2} → CO_{2} → P_{2}O_{5}$Ответ:
Свойства оксидов изменяются от основных к кислотным в ряду
((1)) $Na_{2}O → Al_{2}O_{3} → SO_{3}$
2) $SiO_{2} → P_{2}O_{5} → MgO$
3) $K_{2}O → CaO → ZnO$
4) $SO_{2} → CO_{2} → P_{2}O_{5}$
Ответ: 1).5. В молекуле хлора химическая связь
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) металлическаяОтвет:
В молекуле хлора химическая связь ковалентная неполярная.
В молекуле хлора химическая связь
((1)) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) металлическая
Ответ: 1).6. Из указанных веществ ионная связь присутствует в
1) аммиаке
2) хлороводороде
3) меди
4) оксиде натрияОтвет:
Из указанных веществ ионная связь присутствует в оксиде натрия.
Из указанных веществ ионная связь присутствует в
1) аммиаке
2) хлороводороде
3) меди
((4)) оксиде натрия
Ответ: 4).7. Высшие степени окисления свинца и серы соответственно равны
1) +4 и +6
2) +4 и +8
3) +2 и +6
4) +2 и +4Ответ:
Высшие степени окисления свинца и серы соответственно равны +4 и +6.
Высшие степени окисления свинца и серы соответственно равны
((1)) +4 и +6
2) +4 и +8
3) +2 и +6
4) +2 и +4
Ответ: 1).8. Такую же степень окисления, как и в аммиаке, азот имеет в соединении
1) $NaNO_{3}$
2) $NH_{4}Cl$
3) $N_{2}O_{3}$
4) $HNO_{2}$Ответ:
Такую же степень окисления, как и в аммиаке, азот имеет в соединении $N^{-3}H_{4}Cl$.
Такую же степень окисления, как и в аммиаке, азот имеет в соединении
1) $NaN^{+5}O_{3}$
((2)) $N^{-3}H_{4}Cl$
3) $N^{+3}_{2}O_{3}$
4) $HN^{+3}O_{2}$
Ответ: 2).9. Кислотным оксидом и основанием соответственно являются
1) MgO, KOH
2) $SO_{2}$, NaCl
3) $Ba(OH)_{2}, P_{2}O_{5}$
4) $CO_{2}$, NaOHОтвет:
Кислотным оксидом и основанием соответственно являются $CO_{2}$, NaOH.
Кислотным оксидом и основанием соответственно являются
1) MgO, KOH
2) $SO_{2}$, NaCl
3) $Ba(OH)_{2}, P_{2}O_{5}$
((4)) $CO_{2}$, NaOH
Ответ: 4).10. Гидроксиду кальция соответствует формула
1) $CaSO_{4}$
2) $Ca(OH)_{2}$
3) CaO
4) $CaCO_{3}$Ответ:
Гидроксиду кальция соответствует формула $Ca(OH)_ {2}$.
Гидроксиду кальция соответствует формула
1) $CaSO_{4}$
((2)) $Ca(OH)_{2}$
3) CaO
4) $CaCO_{3}$
Ответ: 2).
$CaSO_{4}$ − сульфат кальция
CaO − оксид кальция
$CaCO_{3}$ − карбонат кальция11. Выберите верные утверждения.
В ряду химических элементов O → S → Se
1) увеличивается число электронных слоёв в атомах
2) уменьшается число протонов в ядрах атомов
3) ослабевают неметаллические свойства
4) увеличивается число валентных электронов
5) уменьшается радиус атомаОтвет:
В ряду химических элементов O → S → Se
((1)) увеличивается число электронных слоёв в атомах
2) уменьшается число протонов в ядрах атомов
((3)) ослабевают неметаллические свойства
4) увеличивается число валентных электронов
5) уменьшается радиус атома
Ответ: 1, 3.12. Химические элементы расположены в порядке усиления восстановительных свойств в рядах
1) Li → Be → B
2) Fe → Mg → Na
3) K → Na → Li
4) C → B → Be
5) Ca → Mg → BeОтвет:
Химические элементы расположены в порядке усиления восстановительных свойств в рядах
1) Li → Be → B
((2)) Fe → Mg → Na
3) K → Na → Li
4) C → B → Be
5) Ca → Mg → Be
Ответ: 2).§40. Химические реакции
Проверьте свои знания
1. К химическим явлениям относят процесс
1) превращения воды в пар
2) превращения негашёной извести в гашёную
3) образования инея на деревьях
4) кристаллизации расплава алюминияОтвет:
К химическим явлениям относят процесс превращения негашёной извести в гашёную.
К химическим явлениям относят процесс
1) превращения воды в пар
2) превращения негашёной извести в гашёную
3) образования инея на деревьях
4) кристаллизации расплава алюминия
Ответ: 2).2. Общая масса всех веществ, участвующих в химической реакции,
1) увеличивается
2) уменьшается
3) может как увеличиваться, так и уменьшаться
4) не изменяетсяОтвет:
Общая масса всех веществ, участвующих в химической реакции, не изменяется.
Общая масса всех веществ, участвующих в химической реакции,
1) увеличивается
2) уменьшается
3) может как увеличиваться, так и уменьшаться
4) не изменяется
Ответ: 4).3. Взаимодействие оксида железа(III) с соляной кислотой относят к реакциям
1) соединения
2) разложения
3) обмена
4) замещенияОтвет:
Взаимодействие оксида железа(III) с соляной кислотой относят к реакциям обмена.
Взаимодействие оксида железа(III) с соляной кислотой относят к реакциям
1) соединения
2) разложения
3) обмена
4) замещения
Ответ: 3).4. К растворимым в воде электролитам относят
1) карбонат натрия
2) гидроксид меди(II)
3) хлорид серебра
4) сульфат барияОтвет:
К растворимым в воде электролитам относят карбонат натрия.
К растворимым в воде электролитам относят
1) карбонат натрия
2) гидроксид меди(II)
3) хлорид серебра
4) сульфат бария
Ответ: 1).5. С образованием гидроксид−ионов в водном растворе диссоциируют
1) кислоты
2) щёлочи
3) оксиды
4) средние солиОтвет:
Ответ: 2) щёлочи
6. Наибольшее число ионов образуется в растворе при полной диссоциации 1 моль
1) $NH_{4}Cl$
2) $H_{2}SO_{4}$
3) $AlCl_{3}$
4) $NaNO_{3}$Ответ:
Наибольшее число ионов образуется в растворе при полной диссоциации 1 моль
1) $NH_{4}Cl$
2) $H_{2}SO_{4}$
3) $AlCl_{3}$
4) $NaNO_{3}$
Ответ: 4).7. Сокращённому ионному уравнению $Cu^{2+} + 2OH^{–} = Cu(OH)_{2}↓$ соответствует взаимодействие между
1) растворами сульфата меди(II) и гидроксида натрия
2) оксидом меди(II) и раствором гидроксида калия
3) раствором хлорида меди(II) и гидратом аммиака
4) медью и гидроксидом натрияОтвет:
Сокращённому ионному уравнению $Cu^{2+} + 2OH^{–} = Cu(OH)_ {2}↓$ соответствует взаимодействие между растворами сульфата меди(II) и гидроксида натрия:
$CuSO_{4} + 2NaOH = Cu(OH)_{2} + Na_{2}SO_{4}$
Сокращённому ионному уравнению $Cu^{2+} + 2OH^{–} = Cu(OH)_ {2}↓$ соответствует взаимодействие между
1) растворами сульфата меди(II) и гидроксида натрия
2) оксидом меди(II) и раствором гидроксида калия
3) раствором хлорида меди(II) и гидратом аммиака
4) медью и гидроксидом натрия
Ответ: 1).8. В водном растворе не могут одновременно существовать ионы
1) $Na^{+}$ и $SO_{4}^{2−}$
2) $H^{+}$ и $CO_{3}^{2−}$
3) $Ag^{+}$ и $NO_{3}^{−}$
4) $K^{+}$ и $OH^{–}$Ответ:
В водном растворе не могут одновременно существовать ионы $H^{+}$ и $CO_{3}^{2−}$. Так как в растворе происходит связывание ионов с образованием углекислого газа $CO_{2}$ и воды $H_{2}O$.
В водном растворе не могут одновременно существовать ионы
1) $Na^{+}$ и $SO_{4}^{2−}$
2) $H^{+}$ и $CO_{3}^{2−}$
3) $Ag^{+}$ и $NO_{3}^{−}$
4) $K^{+}$ и $OH^{–}$
Ответ: 2).9. Установите соответствие между схемой превращения и изменением степени окисления азота в ней.
СХЕМА ПРЕВРАЩЕНИЯ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА
А) $NO_{2} + O_{2} + H_{2}O → HNO_{3}$ 1) $N^{+2} → N^{+3}$
Б) $NO + O_{2} → NO_{2}$ 2) $N^{+4} → N^{+5}$
В) $NaNO_{3} → NaNO_{2} + O_{2}$ 3) $N^{+5} → N^{+3}$
4) $N^{+4} → N^{+2}$
5) $N^{+2} → N^{+4}$
Решение
А Б В
2 5 3Примените свои знания
10. Сумма коэффициентов в уравнении окислительно−восстановительной реакции, схема которой
$Cu + HNO_{3} → Cu(NO_{3})_{2} + NO + H_{2}O$, равна
1) 16
2) 18
3) 20
4) 22Ответ:
Сумма коэффициентов в уравнении окислительно−восстановительной реакции, схема которой
$Cu + HNO_{3} → Cu(NO_{3})_{2} + NO + H_{2}O$, равна 20:
$3Cu + 8HNO_{3} = 3Cu(NO_{3})_{2} + 2NO + 4H_{2}O$
Сумма коэффициентов в уравнении окислительно−восстановительной реакции, схема которой
$Cu + HNO_{3} → Cu(NO_{3})_{2} + NO + H_{2}O$, равна
1) 16
2) 18
3) 20
4) 22
Ответ: 3).§41. Основы неорганической химии
Проверьте свои знания
1. И магний, и медь взаимодействуют с
1) раствором нитрата свинца(II)
2) разбавленной серной кислотой
3) хлором
4) раствором гидроксида калияОтвет:
И магний, и медь взаимодействуют с хлором.
И магний, и медь взаимодействуют с
1) раствором нитрата свинца(II)
2) разбавленной серной кислотой
3) хлором
4) раствором гидроксида калия
Ответ: 3).2. Химическая реакция возможна между
1) оксидом фосфора(V) и раствором гидроксида натрия
2) оксидом меди(II) и водой
3) растворами хлорида натрия и сульфата калия
4) гидроксидом железа(III) и магниемОтвет:
Химическая реакция возможна между оксидом фосфора(V) и раствором гидроксида натрия.
Химическая реакция возможна между
1) оксидом фосфора(V) и раствором гидроксида натрия
2) оксидом меди(II) и водой
3) растворами хлорида натрия и сульфата калия
4) гидроксидом железа(III) и магнием
Ответ: 1).3. Сульфат меди(II) в растворе не реагирует с
1) железом
2) гидроксидом натрия
3) хлоридом бария
4) нитратом цинкаОтвет:
Сульфат меди(II) в растворе не реагирует с нитратом цинка.
Сульфат меди(II) в растворе не реагирует с
1) железом
2) гидроксидом натрия
3) хлоридом бария
4) нитратом цинка
Ответ: 4).4. И гидроксид калия, и серная кислота могут взаимодействовать с
1) алюминием
2) хлором
3) оксидом магния
4) нитратом барияОтвет:
И гидроксид калия, и серная кислота могут взаимодействовать с алюминием.
И гидроксид калия, и серная кислота могут взаимодействовать с
1) алюминием
2) хлором
3) оксидом магния
4) нитратом бария
Ответ: 1).5. С оксидом натрия реагирует каждое из двух веществ:
1) кислород и вода
2) оксид углерода(IV) и оксид бария
3) калий и азотная кислота
4) вода и оксид фосфора(V)Ответ:
С оксидом натрия реагирует каждое из двух веществ: вода и оксид фосфора(V).
С оксидом натрия реагирует каждое из двух веществ:
1) кислород и вода
2) оксид углерода(IV) и оксид бария
3) калий и азотная кислота
4) вода и оксид фосфора(V)
Ответ: 4).6. Разбавленная серная кислота не взаимодействует с
1) оксидом кремния
2) магнием
3) оксидом алюминия
4) карбонатом калияОтвет:
Разбавленная серная кислота не взаимодействует с оксидом кремния.
Разбавленная серная кислота не взаимодействует с
1) оксидом кремния
2) магнием
3) оксидом алюминия
4) карбонатом калия
Ответ: 1).7. С гидроксидом натрия взаимодействует вещество, формула которого
1) $Cr(NO_{3})_{3}$
2) $NH_{3}$
3) CaO
4) $O_{2}$Ответ:
С гидроксидом натрия взаимодействует вещество, формула которого
1) $Cr(NO_{3})_{3}$
2) $NH_{3}$
3) CaO
4) $O_{2}$
Ответ: 1).8. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) $Na_{2}SO_{3} + HCl$ → 1) $Na_{2}SO_{4}$
Б) $H_{2}S + NaOH$ → 2) $NaCl + H_{2}SO_{4}$
B) $Na_{2}SO_{3} + O_{2}$ → 3) $NaCl + SO_{2} + H_{2}O$
4) $Na_{2}SO_{3} + H_{2}O$
5) $Na_{2}S + H_{2}O$
Решение
А Б В
3 5 1Примените свои знания
9. Дана схема превращений:
$P → P_{2}O_{5} → H_{3}PO_{4} → Na_{3}PO_{4} → Ag_{3}PO_{4}$
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для последнего превращения составьте сокращённое ионное уравнение.Ответ:
$P → P_{2}O_{5} → H_{3}PO_{4} → Na_{3}PO_{4} → Ag_{3}PO_{4}$
$4P + 5O_{2} = 2P_{2}O_{5}$
$P_{2}O_{5} + 3H_{2}O = 2H_{3}PO_{4}$
$H_{3}PO_{4} + 3NaOH = Na_{3}PO_{4} + 3H_{2}O$
$Na_{3}PO_{4} + 3AgNO_{3} = 3NaCl + Ag_{3}PO_{4}↓$
$3Ag^{+} + PO_{4}^{3-} ⟶ Ag_{3}PO_{4}↓$10. Дана схема превращений:
$Na_{2}CO_{3}$ $\overset{+HCl}{→}$ $X_{1}$ → $CaCO_{3}$ → $\overset{+HNO_{3}}{→}$ $X_{2}$
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение.Ответ:
$Na_{2}CO_{3} + 2HCl ⟶ 2NaCl + H_{2}O + CO_{2}↑$
$2H^{+} + CO_{3}^{2-} ⟶ H_{2}O + CO_{2}↑$
$CO_{2} + Ca(OH)_{2} ⟶ CaCO_{3}↓ + H_{2}O$
$CaCO_{3} + 2HNO_{3} ⟶ Ca(NO_{3})_{2} + H_{2}O + CO_{2}↑$


