 В 7 классе школьники начинают изучать такой школьный предмет как химию. Предмет очень важный в плане его применения в нашей жизни, в плане его применения в промышленности, в плане его применения понимания происходящих процессов реакций веществ. Так вот, не смотря на всю свою важность, предмет этот более теоретический, чем практический. Да, мы видимо вещи вокруг нас, понимаем что многие из них созданы путем в том числе и каких-то химических реакций, можем понаблюдать за этими реакциями, за самыми простыми. Однако это только лишь визуальная верхушка айсберга не дающая нам представления о том, что и с чем реагирует. Это совсем не так как скажем в физике, мы видимо падение тела, его отскок, наблюдаем за нагревом и все в таком роде. Делая заключение о происходящих процессах из явного действия. Здесь же, в химии, нет смысла делать заключения без знаний теоретических основ и тех химических элементов, который участвуют в реакции. Важны и условия и массы и объемы и активность вещества, все это порой неуловимо на глаз, и все реакции показательны лишь тогда, когда есть понимание как они пойдут на самом деле на бумаге.
В 7 классе школьники начинают изучать такой школьный предмет как химию. Предмет очень важный в плане его применения в нашей жизни, в плане его применения в промышленности, в плане его применения понимания происходящих процессов реакций веществ. Так вот, не смотря на всю свою важность, предмет этот более теоретический, чем практический. Да, мы видимо вещи вокруг нас, понимаем что многие из них созданы путем в том числе и каких-то химических реакций, можем понаблюдать за этими реакциями, за самыми простыми. Однако это только лишь визуальная верхушка айсберга не дающая нам представления о том, что и с чем реагирует. Это совсем не так как скажем в физике, мы видимо падение тела, его отскок, наблюдаем за нагревом и все в таком роде. Делая заключение о происходящих процессах из явного действия. Здесь же, в химии, нет смысла делать заключения без знаний теоретических основ и тех химических элементов, который участвуют в реакции. Важны и условия и массы и объемы и активность вещества, все это порой неуловимо на глаз, и все реакции показательны лишь тогда, когда есть понимание как они пойдут на самом деле на бумаге.
Так вот, нас будет интересовать вступление в химию, первые задачи, первые темы, первые домашние задания по этому предмету. Речь пойдет о ГДЗ для учебника химии для 7 класса автора Еремина. И вот далее как раз об этих ответах...
Для того, чтобы посмотреть нужные вам страницы и параграфы с ответами, кликаем по вкладкам...
ГДЗ по химии для учебника за 7 класс, автор Еремин
...кликнув по вкладкам перед вами откроются ответы (ГДЗ).
Из чего состоит мир: вопросы и задания. Номер №1
-
Из чего состоит мир: вопросы и задания. Номер №1
Какие науки называют естественными?
Ответ
К естественным наукам относятся:
1) Физика
2) Биология
3) География
4) Химия 2
-
Номер №2
Что является предметом изучения химии?
Ответ
Предмет изучения химии − вещества и их превращения. А если подробнее, то Химия − наука, изучающая вещества, также их состав и строение, их свойства, зависящие от состава и строения, их превращения, ведущие к изменению состава − химические реакции, а также законы и закономерности, которым эти превращения подчиняются.
3
-
Номер №3
Как в домашних условиях можно измерить объём пластикового ведра?
Ответ
Наиболее простой способ измерить вместительность ведра — постепенно заполнять его водой, объем которой измеряется сразу или после. Для этого можно заполнять емкость водой из литровых банок, подсчитывая их количество, либо же поступить в обратном порядке: заполнить тару, а затем выливать воду, подсчитывая ее количество литровыми банками.
4
-
Номер №4
Изобразите различные уровни организации материи на примере воды.
Ответ

Мы можем изучать объекты неживой природы визуально (на макроуровне) либо на уровне отдельных атомов или молекул.
Капля воды может рассматриваться как на макроуровне, так и на микроуровне. в свободное время. Номер №1
-
Из чего состоит мир: в свободное время. Номер №1
Проведем опыт. Возьмите пустой стакан и опустите его вверх дном в таз, заполненный водой. Почему вода не заходит в стакан? Какое вещество находится в стакане?
Ответ
На воду действует давление воздуха. Опуская стакан в таз с водой, давление воздуха вытесняет воду и не даёт заполнить ей стакан. Несмотря на это небольшое количество воды всё−таки попадает в стакан. В итоге в стакане находится воздух и вода.
§1. вопросы перед параграфом. Номер №1
-
§1. вопросы перед параграфом. Номер №1
Из чего состоят все вещества?
Ответ
Все вещества состоят из отдельных мельчайших частиц − атомов и молекул, которые представляют собой объединение из нескольких одинаковых или различных атомов.
страница 10
-
(стр.10). Номер №1
Найдите латинские названия химических элементов водород, углерод и кислород. Что они означают? Что означают названия этих элементов на русском языке?
Ответ
1) Водород (лат. Hydrogenium− от др.−греч. — "вода" и — "рождаю") — "порождающий воду".
2) Углерод (лат. Carboneum− от латинского "carbo "— уголь ) − "рождающий уголь".
3) Кислород (лат. Oxygenium − от греч. "окис" – "кислый" и "геннао" – "рождаю") — "рождающий кислоты". 13
-
(стр.13). Номер №1
Проанализируйте химическую формулу метана. Каких атомов в нём больше и во сколько раз? Сколько процентов от общего числа атомов составляют атомы углерода, а сколько — атомы водорода?
Ответ
$CH_{4}$
1) В молекуле метана атомов водорода в четыре раза больше, чем атомов углерода.
2) Атом углерода составляет 20% от общего числа атомов, атомы водорода составляют 80% от общего числа атомов. 15
-
(стр.15). Номер №1
Как вы думаете, кто из изображённых на картине персонажей является магистром (главным алхимиком), а кто — его помощниками?
 Рис. 7. Ян ван дер Страт. Лаборатория алхимика. 1570 г.
Рис. 7. Ян ван дер Страт. Лаборатория алхимика. 1570 г.Ответ
Главным алхимиком является мужчина в очках и в шляпе, остальные персонажи картины − помощники.
(стр.15). Номер №2
Сколько химических элементов было открыто в XX в.?
Ответ
В XX веке был открыт 31 элемент.
18
-
(стр.18). Номер №1
Вспомните из курса биологии, какие вещества участвуют в фотосинтезе; какие вещества при этом образуются.
Ответ
В фотосинтезе участвуют углекислый газ ($CO_{2}$) и вода ($H_{2}O$), при этом образуются глюкоза ($C_{6}H_{12}O_{6}$) и кислород ($O_{2}$).
§1. проблемный вопрос. Номер №1
-
§1. проблемный вопрос. Номер №1
Как в мире появились вещества?
Ответ
Водород первым из элементов появился во Вселенной. Это произошло в первые мгновения после Большого взрыва, около 14 млрд лет назад.
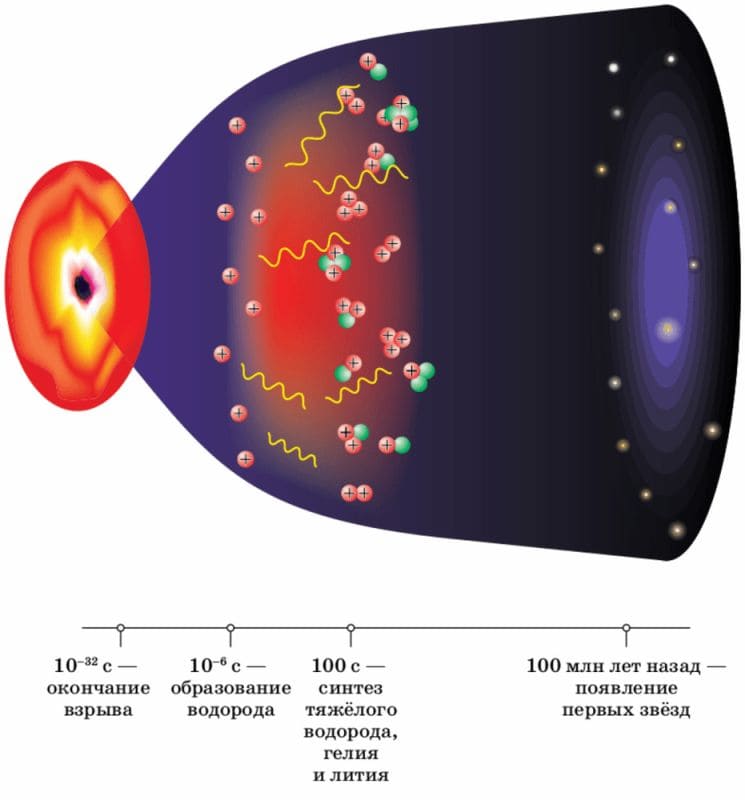
Рис. 4. Образование первых элементов в результате Большого взрыва
Впоследствии в результате ядерных реакций, происходящих внутри звёзд, а также при взрыве или слиянии звёзд образовались все остальные, более тяжёлые элементы, которые и сейчас существуют в природе.
§1. вопросы и задания. Номер №1
-
§1. вопросы и задания. Номер №1
Сколько химических элементов получено искусственным путём?
Ответ
Из известных 118 химических элементов в природе существует около 90, а остальные 28 получены искусственно, с помощью ядерных реакций.
2
-
Номер №2
Как вы думаете, атомы какого химического элемента образовались во Вселенной после водорода?
Ответ
После водорода ( H ) во Вселенной появились атомы гелия ( He ). Они образовались в результате первичного нуклеосинтеза, после Большого взрыва.
3
-
Номер №3
Почему сложных веществ намного больше, чем простых?
Ответ
Потому что атомы химических элементов соединяются между собой в самых разнообразных сочетаниях и количественных соотношениях. Таких сочетаний образуется значительно больше из атомов различных химических элементов, чем из атомов одного химического элемента. Поэтому сложных веществ намного больше, чем простых.
4
-
Номер №4
Приведите примеры веществ, в состав которых входят три элемента.
Ответ
1) Карбонат натрия ($NaCO_{3}$)
2) Карбонат кальция ($CaCO_{3}$)
3) Серная кислота ($H_{2}SO_{4}$)
4) Глюкоза($C_{6}H_{12}O_{6}$)
5) Сахароза ($C_{12}H_{22}O_{11}$)
6) Гидроксид натрия ($NaOH$)
7) Нитрат калия ($KNO_{3}$). 5
-
Номер №5
Азот образует с кислородом несколько газообразных веществ. В одном из них атомов азота в два раза больше, чем атомов кислорода, а в другом − наоборот. Составьте химические формулы этих веществ.
Ответ
1) $N_{2}O$ − оксид азота (I) или веселящий газ
2) $NO_{2}$ − оксид азота (IV) 6
-
Номер №6
В некотором количестве метана содержится 1000 атомов водорода. Чему равно число атомов углерода?
Ответ
Молекула метана состоит из 1 атома углерода и 4 атомов водорода, следовательно, атомов углерода будет в 4 раза меньше, чем атомов водорода, то есть 1000 : 4 = 250.
Ответ: 250 атомов углерода. 7
-
Номер №7
Прочитайте формулы: $N_{2}$ ,$NO_{2}$ ,$C_{2}H_{6}$, $CaCl_{2}$, $NaOH$, $NaHCO_{3}$, $HCN$, $SO_{2}$, $C_{6}H_{6}$.
Ответ
$N_{2}$ ― эн−два
$NO_{2}$ ― эн−о−два
$C_{2}H_{6}$ ― цэ−два−аш−шесть
$CaCl_{2}$ ― кальций−хлор−два
NaOH ― натрий−о−аш
$NaHCO_{3}$ ― натрий−аш−цэ−о−три
$HCN$ ― аш−цэ−эн
$SO_{2}$ ― эс−о−два
$C_{6}H_{6}$ ― цэ−шесть−аш−шесть 8
-
Номер №8
В каком из веществ, перечисленных в таблице 1, наибольший процент атомов кислорода.
Ответ
Наибольший процент атомов кислорода в карбонате кальция ($CO_{3}$) = 60%
Хлорид натрия (NaCl), метан ($CH_{4}$), аммиак ($NH_{3}$), сероводород ($H_{2}S$) не содержат атомов кислорода.
1) Вода ($H_{2}O$) − 33%
2) Карбонат натрия ($NaCO_{3}$) − 50%
3) Карбонат кальция ($CO_{3}$) − 60%
4) Серная кислота ($H_{2}SO_{4}$) − 57%
5) Глюкоза($C_{6}H_{12}O_{6}$) − 25%
6) Сахароза ($C_{12}H_{22}O_{11}$) − 24% §1. в свободное время. Номер №1
-
§1. в свободное время. Номер №1
Проведём опыт. Возьмите кусочек мела и опустите его в столовый уксус. Что наблюдаете? Один из продуктов взаимодействия мела с уксусом — углекислый газ. Что произошло с атомами углерода в этой реакции?
Ответ
1) В ходе опыта мы видим выделение пузырьков газа (углекислый газ).
2) Атомы углерода, входящие в состав мела ($CaCO_{3}$), переходят в состав молекул углекислого газа ($CO_{2}$). §2. вопросы перед параграфом. Номер №1
-
§2. вопросы перед параграфом. Номер №1
Каких атомов больше всего во Вселенной?
Ответ
В нашей галактике Млечный путь (рис.10) доля атомов водорода составляет 92,3% от общего числа числа атомов, на втором месте находится гелий − 7,5 %

Рис. 10 Спиральная галактика − Млечный путь
В Солнечной системе доля атомов водорода немного меньше, чем в галактике − 91%, а доля атомов гелия выше − 8,9%.
Два этих "космических" элемента − Водород и гелий − и составляют основную массу нашей Вселенной. 2
-
Номер №2
В каких веществах эти атомы есть на Земле?
Ответ
Водород (H) есть в:
1) воде ($H_{2}O$)
2) органических соединениях (например: глюкоза − $C_{6}H_{12}O_{6}$)
3) кислотах (например: серная кислота − $H_{2}SO_{4}$)
Гелий (He) − это инертный газ, который не вступает в реакцию с другими веществами. Его можно найти только в чистом виде. 3
-
Номер №3
Какие элементы есть и на Солнце, и в живых организмах?
Ответ
И на Солнце, и в живых организмах есть:
1) водород ( H )
2) кислород ( O )
3) кальций ( Ca )
4) углерод ( C )
5) железо ( Fe ) §2. проблемный вопрос. Номер №1
-
§2. проблемный вопрос. Номер №1
Как узнали состав Вселенной; земной коры?
Ответ
Состав Вселенной и земной коры узнали с помощью гамма−спектроскопии.
Планеты и астероиды начинают излучать в гамме под воздействием бомбардировки более массивных частиц: высокоэнергетичных протонов, альфа− бета− лучей и нейтронов. Заряженные частицы ударяют в поверхностный грунт и тот начинает излучать в гамме. И, что характерно, каждый химический элемент излучает в своем диапазоне. То есть, нам достаточно провести гамма−спектрометром над поверхностью, чтобы понять из чего она состоит. §2. вопросы и задания. Номер №1
-
§2. вопросы и задания. Номер №1
Назовите самый распространённый элемент:
а) во Вселенной
б) на Земле
в) в человеческом организме.Ответ
а) Водород (H)
б) Кислород (O)
в) Водород (H) 2
-
Номер №2
Почему в Солнечной системе содержание гелия выше, чем во Вселенной в целом?
Ответ
На Солнце в результате ядерной реакции атомы водорода непрерывно превращаются в атомы гелия.
3
-
Номер №3
Атомов какого элемента больше всего:
а) в ядре Земли
б) в земной коре?Ответ
а) В ядре Земли больше всего атомов железа (Fe).
б) В земной коре больше всего атомов кислорода (O). 4
-
Номер №4
Химическая формула одного из минералов, входящих в состав мантии Земли, $Mg_{2}SiO_{4}$. Во сколько раз число атомов кислорода в этом минерале превышает число атомов: а) магния; б) кремния?
Ответ
а) Количество атомов кислорода в данном минерале превышает число атомов магния в 2 раза.
б) Количество атомов кислорода в данном минерале превышает число атомов кремния в 4 раза. 5
-
Номер №5
Шпинель — минерал, входящий в состав земной коры. Шпинель состоит из магния, алюминия и кислорода. Атомов магния в 2 раза меньше, чем атомов алюминия, а последних — в 2 раза меньше, чем атомов кислорода. Напишите химическую формулу шпинели.
Ответ
Химическая формула шпинели − $MgAl_{2}O_{4}$
6
-
Номер №6
Используя свои знания по биологии, назовите по одному веществу в человеческом организме, в состав которых входят атомы элементов C, N, P, S, Fe.
Ответ
C ― гликоген
N ― глицин
P ― гидроксиапатит
S ― кератин
Fe ― гемоглобин 7
-
Номер №7
Используя приведённый ниже перечень, заполните таблицу, описывающую содержание элементов в организме человека.
"Элементы жизни" Макроэлементы Микроэлементы Отсутствует в организме
Элементы: H, He, C, N, O, Na, Mg, Si, P, S, K, Zn, I.
Ответ
"Элементы жизни" Макроэлементы Микроэлементы Отсутствует в организме
H, C, N, O Na, Mg, P, S, K Si, Zn, I He §3. вопросы перед параграфом. Номер №1
-
§3. вопросы перед параграфом. Номер №1
Что такое радиоактивность?
Ответ
Радиоактивность − самопроизвольное превращение атомов одного элемента в атомы других элементов, сопровождающееся испусканием частиц или излучением высокой энергии.
2
-
Номер №2
Какие элементы бывают радиоактивными?
Ответ
Радиоактивными бывают неустойчивые элементы. Элементы, начиная с 83−го, рано или поздно распадаются, испуская различные частицы и превращаясь в другие элементы.
страница 29
-
(стр.29). Номер №1
Можно ли с помощью радиоуглеродного метода надёжно измерить возраст:
а) египетской мумии
б) мамонта
в) древнего человека — неандертальца?Ответ
Радиоуглеродный метод (радиоуглеродное датирование) — разновидность метода радиоизотопного датирования, применяемый для определения возраста органических останков путём измерения содержания в материале радиоактивного изотопа углерода −14 (см. рисунок 1) по отношению к стабильным изотопам углерода.
Углерод−14 – радиоактивный изотоп углерода, в ядре которого вмещается 6 протонов и 8 нейтронов.
С помощью данного метода можно надёжно измерить возраст египетской мумии, мамонта и неандертальцев (которые жили не более 60 тысяч лет назад), так как последние особи данных существ жили менее 60 тысяч лет назад.
рис.1 31
-
(стр.31). Номер №1
Какие элементы образуются при распаде урана под действием медленных нейтронов? Во сколько раз увеличивается число нейтронов при каждом распаде?
Ответ
При распаде урана под действием медленных нейтронов образуются Криптон и Барий. При каждом распаде число нейтронов увеличивается в три раза.
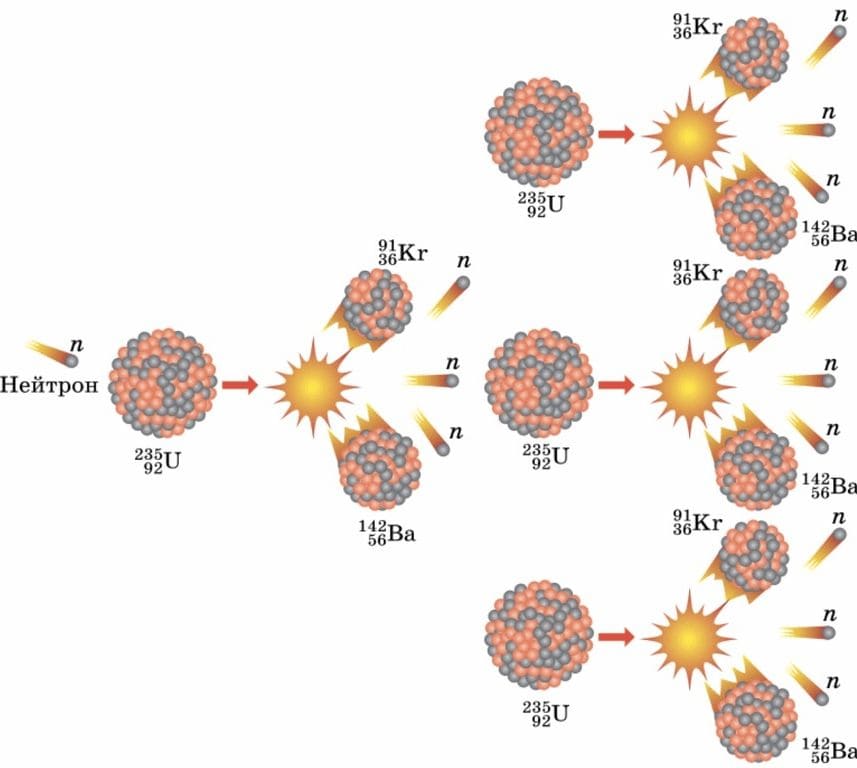
§3. проблемный вопрос. Номер №1
-
§3. проблемный вопрос. Номер №1
Полезны или нет неустойчивые атомы?
Ответ
Неустойчивые атомы полезны при правильном использовании. Например, если их используют в производстве атомной энергии.
вопросы и задания. Номер №1
-
вопросы и задания. Номер №1
Укажите радиоактивные и устойчивые элементы в следующем перечне: гелий, кислород, натрий, хлор, технеций, свинец, торий, менделевий, дубний, московий.
Ответ
Радиоактивные элементы Устойчивые элементы
технеций, торий, менделевий, дубний, московий гелий, кислород, натрий, хлор, свинец 2
-
Номер №2
Чем отличаются друг от друга радиоактивные атомы разных элементов?
Ответ
Друг от друга радиоактивные атомы разных элементов отличаются скоростью распада.
3
-
Номер №3
Чем различаются изотопы одного и того же элемента?
Ответ
Изотопы одного и того же элемента различаются массой (числом нейтронов и, следовательно, массовым числом).
4
-
Номер №4
Есть ли радиоактивные изотопы у кислорода?
Ответ
У кислорода есть радиоактивнвый изотоп. Это кислород−19, которого в природе не существует, однако он может быть получен искусственно.
5
-
Номер №5
Приведите примеры радиоактивных изотопов, существующих в природе.
Ответ
Примеры радиоактивных изотопов, существующих в природе:
1) углерод−14
2) торий−232
3) уран−235 6
-
Номер №6
Назовите три основные, на ваш взгляд, области применения радиоактивных атомов.
Ответ
1) медицина (рентген−аппараты, лечение рака)
2) энергетика (производство э/э на АЭС)
3) наука (получение других изотопов, исследование структуры веществ). 7
-
Номер №7
Почему атомную энергию считают неисчерпаемой?
Ответ
Запасов уранового топлива хватит на много тысяч лет, также их можно возобновлять с помощью реакторов.
8
-
Номер №8
Можно ли назвать атомную энергию возобновляемой?
Ответ
Можно, если она вырабатывается с помощью реакторов на быстрых нейтронах, поскольку такие реакторы позволяют превращать отработавшее ядерное топливо в новое топливо для АЭС, образуя замкнутый цикл использования ядерного топлива.
§4. вопросы перед параграфом. Номер №1
-
§4. вопросы перед параграфом. Номер №1
Какие частицы считаются элементарными?
Ответ
Элементарные частицы − собирательный термин, относящийся к микрообъектам, которые на данный момент на практике невозможно расщепить на составные части.
2
-
Номер №2
Какие элементарные частицы входят в состав атомов?
Ответ
Во всех атомах есть три типа элементарных частиц:
1) электроны (e) − имеют отрицательный заряд, равный –1
2) протоны (p) − имеют положительны заряд, равный +1
3) нейтроны (n) − заряда не имеют, это электронейтральные частицы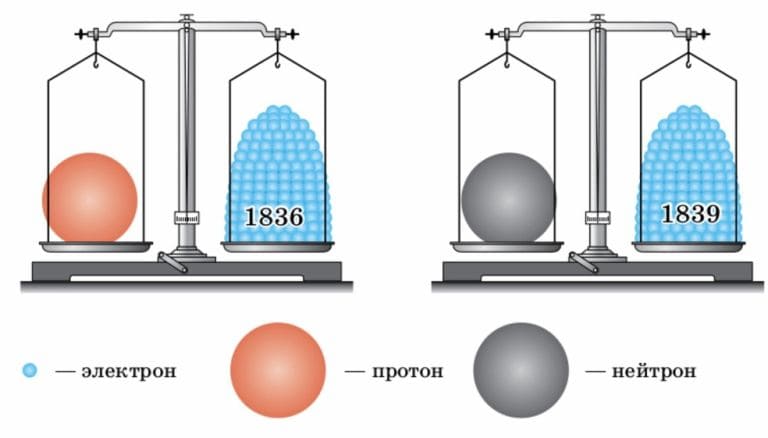
Рис. 20 Строение атома углерода
Массы протона и нейтрона почти одинаковы и намного, почти в 2000 раз, превышают массу электрона.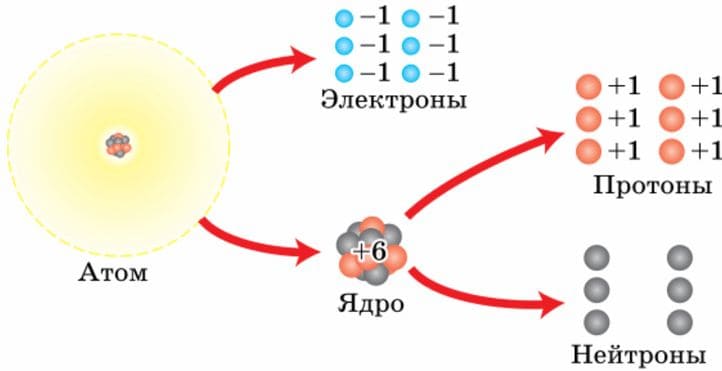
Рис. 21 Условное изображение строения атомов §4. проблемный вопрос. Номер №1
-
§4. проблемный вопрос. Номер №1
Как доказать, что атом − не элементарная частица, а в атоме есть ядро.
Ответ
Доказать, что атом − не элементарная частица, помогли физики. Открытие радиоактивности и существования неустойчивых атомов подтвердило идею о сложном строении атома: если некоторые атомы распадаются, то они уже не могут считаться элементарными частицами. Значит, атом состоит из более простых частиц.
Мы знаем, что во всех атомах есть три типа элементарных частиц: электроны (e), протоны (p) и нейтроны (n). Каждая частица характеризуется электрическим зарядом и массой.
Протоны и нейтроны образуют ядро, которое находится в центре атома. §4. вопросы и задания. Номер №1
-
§4. вопросы и задания. Номер №1
Если представить атом размером с Луну (диаметр 3500 км), то каким будет радиус его ядра.
Ответ
Дано:
D (атома) = 3500 км = 3500000 м
Найти:
R (ядра) − ?
Ответ:
Т.к. ядро атома примерно в 100 тыс. раз меньше размера атома, то есть $\frac{D (атома)}{D (ядра)}$ = 100000, следовательно,
D (ядра) = $\frac{D (атома)}{100000}$ = $\frac{3500000 м}{100000}$ = 35 м
R (ядра) = $\frac{D (ядра)}{2}$ = $\frac{35 м}{2}$ = 17,5 м
Ответ: R (ядра) = 17,5 м 2
-
Номер №2
Если бы ядро атома имело радиус, равный толщине волоса (0,08 мм), то каким был размер атома?
Ответ
Дано:
R (ядра) = 0,08 мм
Найти:
D (атома) − ?Ответ:
Т.к. ядро атома примерно в 100 тыс. раз меньше размера атома, то есть $\frac{D(атома)}{D (ядра)}$ = 100000, следовательно,
D (ядра) = R (ядра) * 2 = 0,16 мм
D (атома)= D (ядра) * 2 = 0,16 * 100000 = 16000 мм = 16 м
Ответ: D (атома) = 16 м 3
-
Номер №3
Чему равно массовое число самого лёгкого атома?
Ответ
Самый лёгкий атом у водорода (H), его массовое число равно 1.
4
-
Номер №4
Назовите атом, строение которого изображено на рисунке 23, определите его массовое число, заряд ядра и число нейтронов.
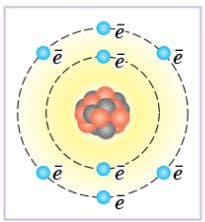 Рис.23. Условное изображение строения атома
Рис.23. Условное изображение строения атомаОтвет
1) Количество электронов равно 8, а число электронов = порядковому номеру элемента, значит это элемент с порядковым №8, т.е. это кислород (O).
2) Массовое число A = 16.
3) Заряд ядра +8.
4) Число нейтронов:
A (массовое число) − Z (количество протонов) = 16 − 8 = 8 нейтронов. 5
-
Номер №5
Назовите элементы, атомы которых содержат:
а) 2 ē;
б) 10 ē;
в) 18 ē;
г) 36 ē;
д) 54 ē;
е) 86 ē.Ответ
а) 2 ē − Гелий (порядковый №2)
б) 10 ē − Неон (порядковый №10)
в) 18 ē − Аргон (порядковый №18)
г) 36 ē − Криптон (порядковый №36)
д) 54 ē − Ксенон (порядковый №54)
е) 86 ē − Радон (порядковый №86)
Число электронов = число протонов = порядковый номер элемента. §5. вопросы перед параграфом. Номер №1
-
§5. вопросы перед параграфом. Номер №1
Одинаковы ли атомы одного и того же химического элемента?
Ответ
У одного и того же химического элемента атомы разные, но с одинаковым зарядом ядра.
Водород − первый элемент Периодической системы химических элементов Д. И. Менделеева. Его порядковый номер 1 означает, что заряд ядра атома водорода Z= +1, ядро содержит один протон, а вокруг ядра движется один электрон. Число нейтронов и массовое число у изотопов водорода различаются. Самый лёгкий и самый распространённый изотоп водорода − протий вообще не содержит нейтронов, его ядро состоит из одного протона. В ядре атома дейтерия содержатся один протон и один нейтрон, атомы дейтерия в два раза тяжелее атомов протия. Самый тяжёлый изотоп водорода − тритий. В его ядре три частицы − один протон и два нейтрона. Независимо от массы атомы всех изотопов водорода содержат по одному электрону и не имеют электрического заряда (табл. 3).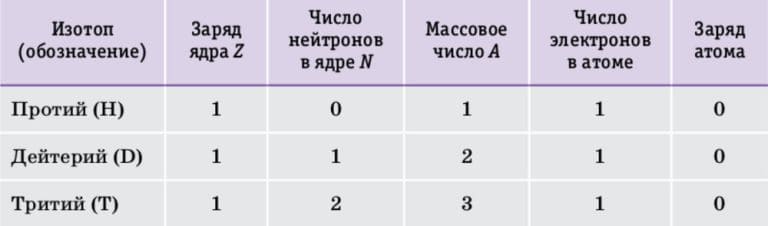
Таблица 3. Сравнительный состав изотопов водорода 2
-
Номер №2
В чём различие атомов одного и того же химического элемента?
Ответ
Атомы одного и того же химического вещества различаются атомной массой.
§5. проблемный вопрос. Номер №1
-
§5. проблемный вопрос. Номер №1
Изотопы отличаются друг от друга массой. Различаются ли они химическими свойствами?
Ответ
Химические свойства определяются строением внешнего электронного уровня. У изотопов его строение абсолютно одинаково, поэтому и свойства одинаковы.
§5. вопросы и задания. Номер №1
-
§5. вопросы и задания. Номер №1
Что общего у изотопов одного и того же элемента и чем они различаются?
Ответ
Сходства: заряд ядра атома, число протонов, число электронов.
Различия: число нейтронов и, соответственно, массовое число (или масса). 2
-
Номер №2
Запишите в символьном виде обозначения изотопов:
1) гелий−4
2) азот−14
3) фтор−19
4) хлор−35Ответ
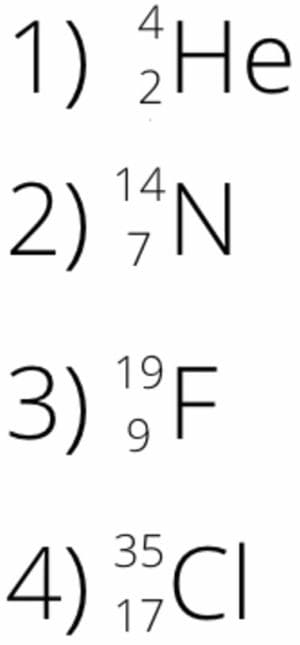
3
-
Номер №3
Используя рисунок 24, опишите строение атома углерода−13.
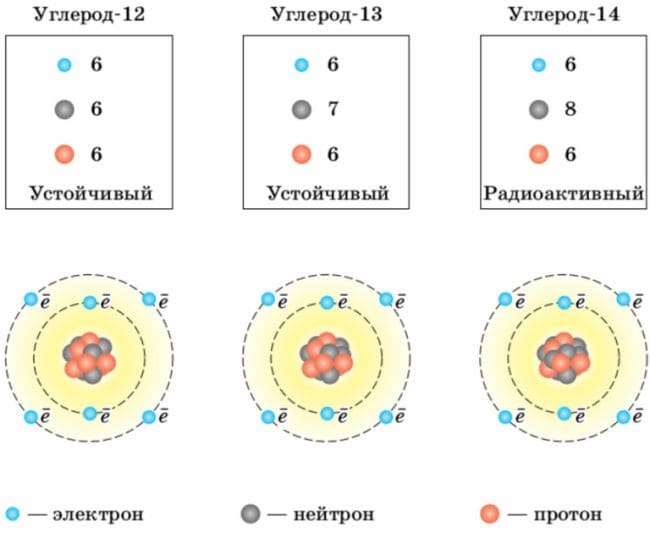 Рис.24. Строение изотопов углерода
Рис.24. Строение изотопов углеродаОтвет
Атом углерода−13 состоит из ядра, в состав которого входят 6 протонов и 7 нейтронов, вокруг которого находятся 6 электронов (2 электрона на внутренней оболочке и 4 на внешней).
4
-
Номер №4
Для трёх изотопов углерода составьте таблицу, аналогичную таблице 3.
Таблица 3. Сравнительный состав изотопов водорода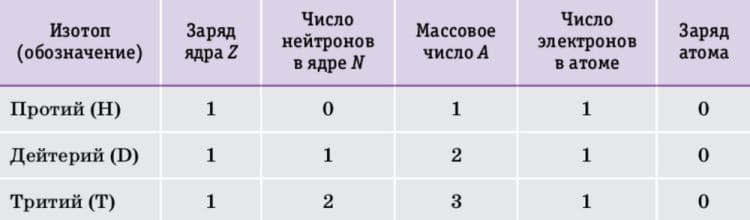 Ответ
ОтветИзотоп (обозначение) Заряд ядра, Z Число нейтронов в ядре, N Массовое число, A Число электронов в атоме Заряд атома
Углерод − 12 6 12 − 6 = 6 12 6 0
Углерод − 13 6 13 − 6 = 7 13 6 0
Углерод − 14 6 14 − 6 = 8 14 6 0 5
-
Номер №5
В составе какого из изотопов гелия ( Z = 2 ) столько же нейтронов, сколько в составе дейтерия? Назовите и запишите его полное обозначение, указав массовое число
Ответ
В составе Гелий−3 столько же нейтронов, сколько в составе дейтерия.
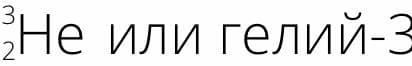
Ядро дейтерия содержит один нейтрон ( N = 1 ) и один протон ( Z = 1 ), следовательно, ядро изотопа гелия будет содержать 2 протона ( Z = 2 ) и 1 нейтрон ( N = 1 ), поэтому его массовое число равно А = Z + N= 2 + 1 = 3 6
-
Номер №6
В каких из перечисленных атомов число протонов, нейтронов и электронов одинаково: кислород−16, фтор−19, натрий−23, магний−24, фосфор−31, сера−32?
Ответ
Число протонов, нейтронов и электронов одинаково в Кислороде−16, Магние−24 и Сере−32
Изотоп Массовое число, A Число протонов, Z Число нейтронов, N Число электронов
Кислород−16 16 8 16 − 8 = 8 8
Фтор−19 19 9 19 − 9 = 10 9
Натрий−23 23 11 23 − 11 = 12 11
Магний−24 24 12 24 − 12 = 12 12
Фосфор−31 31 15 31 − 15 = 16 15
Сера−32 32 16 32 − 16 = 16 16 7
-
Номер №7
Атом хлора содержит нейтронов на три больше, чем протонов. Назовите этот изотоп, запишите его полное обозначение.
Ответ
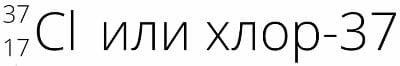
Атом хлора содержит 17 протонов ( Z = 17 ) (равно его порядковому номеру), поэтому изотоп будет содержать 20 нейтронов ( N = 17 + 3 = 20 ), а его массовое число равно A = Z + N = 17 + 20 = 37 §6. вопросы перед параграфом. Номер №1
-
§6. вопросы перед параграфом. Номер №1
Что открыл Д.И. Менделеев?
Ответ
Дмитрий Менделеев в 1869 году открыл периодический закон химических элементов, на основе которого им была построена таблица.
§6. проблемный вопрос. Номер №1
-
§6. проблемный вопрос. Номер №1
Как Менделеев смог открыть Периодический закон, не зная строения атома? Что ему помогло?
Ответ
Менделееву в открытии Периодического закона помогло наблюдение и сравнение свойств известных химических элементов. Он расставил элементы в порядке возрастания их атомных масс, выделил повторяющиеся свойства и получил группы и периоды известной нам таблицы химических элементов.
§6. вопросы и задания. Номер №1
-
§6. вопросы и задания. Номер №1
Какие учёные исследовали явление периодичности до Менделеева?
Ответ
Иоганн Вольфганг Дёберейнер. В 1829 году немецкий химик предпринял первую значимую попытку систематизации элементов: некоторые сходные по своим свойствам элементы объединил по три в группы, которые назвал триадами.
Леопольд Гмелин. В 1843 году опубликовал таблицу, в которой химически сходные элементы были расставлены по группам в порядке возрастания эквивалентных весов, элементы составляли триады, а также тетрады и пентады.
Макс фон Петтенкофер и Жан Дюма. В 1850−х годах они предложили «дифференциальные системы», направленные на выявление общих закономерностей в изменении атомного веса элементов.
Юлиус Лотар Мейер. В 1864 году опубликовал таблицу, содержавшую 28 элементов, размещённые в шесть столбцов согласно их валентностям, намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах сходных элементов. В 1870 году опубликовал ещё одну работу, содержавшую новую таблицу и график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид. 2
-
Номер №2
Какие предсказания Менделеева подтвердились в XIX веке?
Ответ
В XIX веке были открыты элементы, свойства которых предсказал Менделеев, называя их экаалюминием (то есть «похож на алюминий») и экакремнием (то есть «похож на кремний») ― это галлий (открыл Поль Лекок де Буабодран в1875 году) и германий (открыл Клеменс Винклер в 1886 году).
3
-
Номер №3
Чем ещё, кроме Периодического закона, известен Д.И. Менделеев? Подготовьте сообщение о его достижениях и заслугах.
Ответ
В 1854—1856 годах исследовал явления изоморфизма, раскрывающие отношения между кристаллической формой и химическим составом соединений, а также зависимость свойств элементов от величины их атомных объёмов, а в 1860 году открыл критическую температуру.
В 1859 году сконструировал прибор для определения плотности жидкости.
В 1865−1887 годах создал гидратную теорию растворов, развил идеи о существовании соединений переменного состава.
В 1874 году открыл общее уравнение состояния идеального газа.
В 1890−1892 годах совместно с И.М. Чельцовым принимал участие в разработке бездымного пороха.
Автор ряда работ по метрологии. Создал точную теорию весов, разработал наилучшие конструкции коромысла и арретира, предложил точнейшие приёмы взвешивания. §7. вопросы перед параграфом. Номер №1
-
§7. вопросы перед параграфом. Номер №1
Какую информацию можно найти в Периодической системе?
Ответ
Из Переодической системы можно узнать:
1) Название элемента − фтор
2) Химический символ − F
3) Порядковый номер −19
4) Заряд ядра − +9
5) Число электронов в атоме − 9
6) Атомную массу − 18,9984 страница 46
-
(стр.46). Номер №1
Найдите закономерности в изменении атомных номеров в главной и побочной подгруппах.
Ответ
В главных подгруппах разница между атомными номерами составляет:
8, 8, 18, 18, 32 ( Атомные массы: $Li$−3; $Na$−11; $K$−19; $Rb$−37; $Cs$−55; $Fr$−87)
В побочных подгруппах разница между атомными номерами составляет:
18, 32, 32 ( Атомные массы: $Cu$−29; $Ag$−47; $Au$−79; $Rg$−111) §7. проблемный вопрос. Номер №1
-
§7. проблемный вопрос. Номер №1
Есть ли границы у периодической системы?
Ответ
Чётких границ у периодической системы на данный момент времени нет, так как учёные до сих пор работают над созданием новых элементов.
Самый последний элемент, который был открыт, − это Оганессий (Og) в 2015 году. 118−ый элемент, которому сначала было присвоено временное название "унуктоний" был в дальнейшем назван в честь академика наук Юрия Цолаковича Оганесяна за его исследования трансактиновидных элементов. §7. вопросы и задания. Номер №1
-
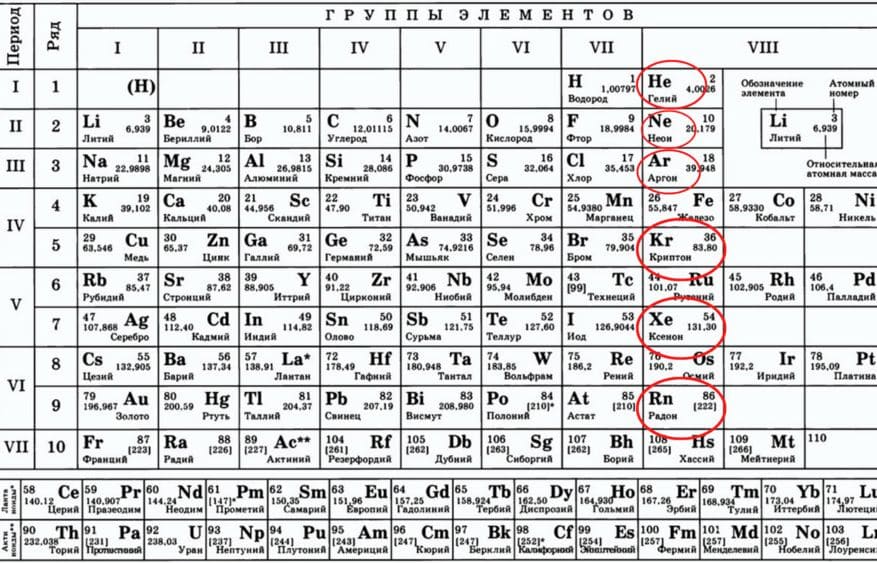
§7. вопросы и задания. Номер №1
Найдите в периодической таблице благородные газы.
Ответ
Благородные газы − гелий, неон, аргон, криптон, ксенон, радон − располагаются в главной подгруппе VIII группы.
2
-
Номер №2
Перечислите все галогены в периодической таблице. Какой группе и какой подгруппе они принадлежат?
Ответ
Галогены: фтор, хлор, бром, йод, астат. Все эти элементы находятся в главной подгруппе VII группы.
3
-
Номер №3
Используя периодическую таблицу, дайте характеристику восьмого элемента Периодической системы.
Ответ
Кислород
1) располагается во втором периоде, в главной подгруппе VI группы
2) имеет порядковый номер 8
3) заряд ядра атома +8
4) число протонов в ядре атома − 8
5) число электронов − 8
6) атомная масса − 15,9994 а.е.м. 4
-
Номер №4
Опишите элемент, который находится в третьем периоде и III группе.
Ответ
Алюминий
1) порядковый номер − 13
2) заряд ядра атома +13
3) число протонов в ядре атома − 13
4) число электронов − 13
5) атомная масса − 26,9815 а.е.м. 5
-
Номер №5
По аналогии с I группой определите, какие элементы входят в состав главной и побочной подгрупп II группы.
Ответ
Элементы II группы главной подгруппы: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.
Элементы II группы побочной подгруппы: цинк Zn, кадмий Cd, ртуть Hg, коперниций Cn. 6
-
Номер №6
Найдите в периодической таблице:
а) элемент, атомная масса которого примерно равна порядковому номеру;
б) три элемента, относительные атомные массы которых в 2 раза больше их порядкового номера;
в) два элемента, названные в честь великих учёных – химиков или физиков;
г) два элемента, названные в честь небесных тел;
д) два элемента, названные в честь стран;
е) элемент, названный в честь мифологического персонажа;
ж) пять элементов, названия которых связаны с Россией.Ответ
а) Водород H
Ar(H)=1, порядковый номер водорода 1.
б) Гелий He, углерод C, кислород O, сера S
Ar(He) = 4, 4 : 2 = 2, порядковый номер гелия − 2
Ar(C) = 12, 12 : 2 = 6, порядковый номер углерода − 6
Ar(O) = 16, 16 : 2 = 8, порядковый номер кислорода − 8
Ar(S) = 32, 32 : 2 = 16, порядковый номер серы − 16
в) Менделевий Md, эйнштейний Es
г) Уран U, нептуний Np
д) Германий Ge, франций Fr
е) Прометий Pm (в честь титана Прометея), ванадий V (в честь древнескандинавской богини красоты Ванадис)
ж) Рутений Ru (Ruthenia — латинское название Руси), дубний Db ( в честь российского центра по исследованиям в области ядерной физики, наукограда Дубны) , московий Mc, флеровий Fl (Флеровий назван в честь Лаборатории ядерных реакций имени Флерова), оганессон Og (в честь академика Юрия Оганесяна). 7
-
Номер №7
Составьте из обозначений химических элементов слова на английском языке: а) Moscow; б) carbon; в) water.
Ответ
а) Moscow: Mo (Молибден) − S (Сера) − Co (Кобальт) − W (Вольфрам)
б) carbon: C (Углерод) − Ar (Аргон) − B (Бор) − O (Кислород) − N (Азот)
в) water: W (Вольфрам) − At (Астат) − Er (Эрбий) 8
-
Номер №8
Как вы думаете, появится ли когда−нибудь в периодической таблице восьмой период? Приведите свои соображения.
Ответ
В периодической таблице может появиться восьмой период, если будет синтезирован изотоп с достаточно стабильным ядром и в достаточном количестве.
§8. вопросы перед параграфом. Номер №1
-
§8. вопросы перед параграфом. Номер №1
Что такое молекула?
Ответ
Молекула − устойчивая частица, состоящая из двух и более связанных между собой атомов.
2
-
Номер №2
Чем молекулы отличаются от атомов?
Ответ
Атом является элементарной частицей вещества. Он имеет свою массу и размер и отвечает за свойства этого вещества, как химического элемента. Именно строением атома обуславливаются химические свойства вещества. Атомы не встречаются в свободном состоянии.
Молекула – это то, из чего состоит вещество. В состав молекул могут входить два и более атомов, которые между собой связаны межатомными связями. страница 50
-
(стр.50). Номер №1
Все ли вещества молекулярного строения обладают запахом? Приведите примеры веществ, имеющих запах.
Ответ
Не все вещества молекулярного строения имеют запах.
Вещества молекулярного строения, у которых нет запаха: $CO_{2}$ (углекислый газ), CO (угарный газ), $H_{2}O$ (вода)
Вещества молекулярного строения, у которых есть запах: нефть, уксус, спирт. 53
-
(стр.53). Номер №1
Определите химические формулы молекул, модели которых приведены на рисунке 34.
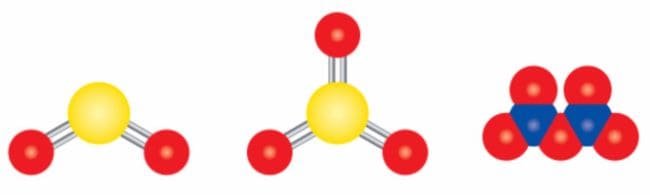 Рис. 34. Модели некоторых молекул
Рис. 34. Модели некоторых молекулОтвет
1) $SO_{2}$
2) $SO_{3}$
3) $P_{2}O_{5}$ §8. проблемный вопрос. Номер №1
-
§8. проблемный вопрос. Номер №1
Почему некоторые атомы объединяются в молекулы? Почему не все вещества состоят из молекул?
Ответ
1) Атомы объединяются в молекулы благодаря химическим связям. Причем участвуют в образовании этих связей электроны, находящиеся во внешнем слое этих атомов.
2) Атомы могут соединяться друг с другом и другим способом. Так, в кристаллах алмаза, графита, песка все атомы соединены в единое целое, и молекулу выделить в них невозможно.
В некоторых сложных веществах атомы превращаются в заряженные частицы − ионы − и тоже молекул не образуют. Противоположно заряженные ионы притягиваются друг к другу и образуют твёрдое тугоплавкое вещество. Такое строение имеют поваренная соль, мел, питьевая сода, медный купорос, щёлочь. §8. вопросы и задания. Номер №1
-
§8. вопросы и задания. Номер №1
Определите, какие из приведённых веществ состоят из молекул: азот, сернистый газ, стекло, фарфор, ванилин, мел, перекись водорода, железо, известняк. По каким признакам вы это определили?
Ответ
Из молекул состоит : азот, сернистый газ, ванилин, перекись водорода.
Все газы и почти все жидкости состоят из молекул. Такие вещества часто летучи и имеют запах.
Азот при обычных условиях газ, сернистый газ и ванилин имеют запах, перекись водорода является жидкостью. 2
-
Номер №2
Приведите по два примера веществ молекулярного строения, состоящих из одного, двух и трёх элементов.
Ответ
Вещества состоящие из одного элемента: $O_{3}$ (озон), $I_{2}$ (йод).
Вещества состоящие из двух элементов: $NH_{3}$ (аммиак), $CH_{4}$ (метан).
Вещества состоящие из трёх элементов: $C_{2}H_{4}O_{2}$ (уксусная кислота), $C_{3}H_{8}O_{3}$ (глицерин). 3
-
Номер №3
Из веществ, приведённых в задании 1, выберите газы; жидкости; твёрдые вещества. Составьте и заполните таблицу.
Газы Жидкости Твёрдые вещества
ОтветГазы Жидкости Твёрдые вещества
азот, сернистый газ перекись водорода стекло, фарфор, ванилин, мел, железо, известняк 4
-
Номер №4
Найдите массу (в а.е.м.) всех молекул веществ, перечисленных в таблице 4.
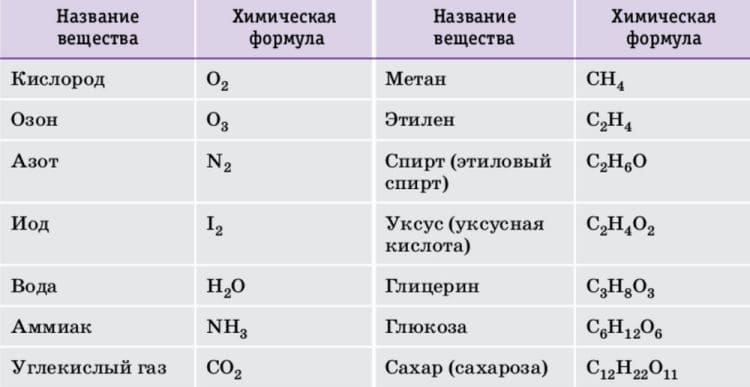 Таблица 4. Примеры веществ молекулярного строения.
Таблица 4. Примеры веществ молекулярного строения.Ответ
1) Масса кислорода: m ($O_{2}$) = 2 * m (O) = 2 * 16 а.е.м. = 32 а.е.м.
2) Масса озона: m ($O_{3}$) = 3 * m (O) = 3 * 16 а.е.м. = 48 а.е.м.
3) Масса азота: m ($N_{2}$) = 2 * m (N) = 2 * 14 а.е.м. = 28 а.е.м.
4) Масса иода: m ($I_{2}$) = 2 * m (I) = 2 * 127 а.е.м. = 254 а.е.м.
5) Масса воды: m ($H_{2}O$) = 2 * m (H)+m (O) = 2 * 1 а.е.м. + 16 а.е.м. = 18 а.е.м.
6) Масса аммиака: m ($NH_{3}$) = m (N)+3 * m (H) = 14 а.е.м. + 3 * 1 а.е.м.= 17 а.е.м.
7) Масса углекислого газа: m ($CO_{2}$) = m (C)+2 * m ($O$) = 12 а.е.м. + 2 * 16 а.е.м.= 44 а. е. м.
8) Масса метана: m ($CH_{4}$) = m (C)+4 * m (H) = 12 а.е.м. + 4 * 1 а.е.м.= 16 а.е.м.
9) Масса этилена: m ($C_{2}H_{4}$) = 2 * m (C)+4 * m (H) = 2 * 12 а.е.м. + 4 * 1 а.е.м.= 28 а.е.м.
10) Масса спирта (этилового): m ($C_{2}H_{6}O$) = 2 * m (C) + 6 * m (H)+m (O) = 2 * 12 а.е.м. + 6 * 1 а.е.м. + 16 а.е.м. = 46 а.е.м.
11) Масса уксуса (уксусной кислоты): m ($C_{2}H_{4}O_{2}$) = 2 * m (C) + 4 * m (H) + 2 * m (O) = 2 * 12 а.е.м. + 4 * 1 а.е.м. + 2 * 16 а.е.м. = 60 а.е.м.
12) Масса глицерина: m ($C_{3}H_{8}O_{3}$) = 3 * m (C) + 8 * m (H) + 3 * m (O) = 3 * 12 а.е.м. + 8 * 1 а.е.м. + 3 * 16 а.е.м. = 92 а.е.м.
13) Масса глюкозы: m ($C_{6}H_{12}O_{6}$) = 6 * m (C)+12 * m (H) + 6 * m (O) = 6 * 12 а.е.м. + 12 * 1 а.е.м. + 6 * 16 а.е.м. = 180 а.е.м.
14) Масса сахара (сахарозы): m ($C_{12}H_{22}O_{11}$) = 12 * m (C) + 22 * m (H) + 11 * m (O) = 12 * 12 а.е.м. + 22 * 1 а.е.м. + 11 * 16 = 342 а.е.м. 5
-
Номер №5
Определите формулы веществ, молекулярные модели которых изображены на рисунке 38.
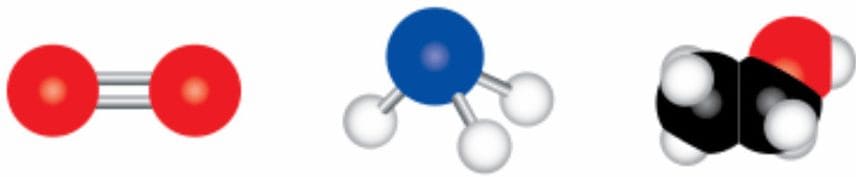 Рис. 38. Модели некоторых молекул
Рис. 38. Модели некоторых молекулОтвет
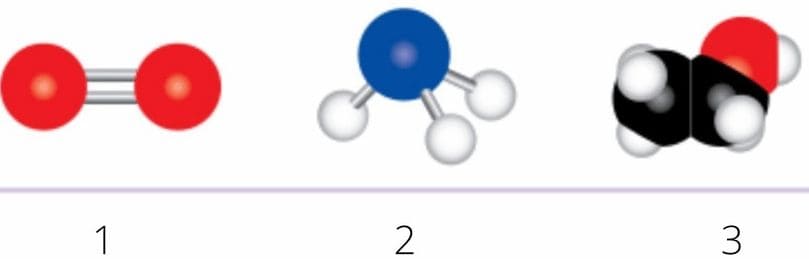
1) $O_{2}$ (кислород)
2) $NH_{3}$ (аммиак)
3) $C_{2}H_{5}OH$ (этанол) 6
-
Номер №6
При гниении мяса белки́, входящие в его состав, разлагаются. При этом выделяется газ с неприятным запахом, молекула которого состоит из атомов серы и водорода. Всего в молекуле три атома. Массовое соотношение серы к водороду − 16:1. Найдите формулу газа.
Ответ
Дано:
В молекуле три атома
m (H) = y
m (S) = x
x : y = 16 : 1
Найти:
Формулу $H_{y}S_{x}$Ответ:
n (x) = $\frac{m}{M}$ = $\frac{16}{32}$ = 0,5
n (y) = $\frac{m}{M}$ = $\frac{1}{1}$ = 1
$H_{1}S_{0,5}$ => $H_{2}S$
Ответ: формула газа $H_{2}S$ (сероводород). 7
-
Номер №7
Молекула вещества, входящего в состав природного газа, состоит из атомов углерода и водорода. Всего в молекуле 8 атомов. Общая масса атомов углерода в 4 раза превосходит общую массу атомов водорода. Определите формулу вещества.
Ответ
Дано:
Всего 8 атомов
m(C) : m(H) = 4 : 1Ответ:
n (C) = $\frac{m}{M}$=$\frac{4}{12}$ = 0,333
n (H) = $\frac{m}{M}$ = $\frac{1}{1}$ = 1
n (C) : n (H) = 0,333 : 1 => $CH_{3}$
Так как в молекуле 8 атомов, мы увеличиваем число атомов углерода и водорода в простейшей формуле в два раза и получаем $C_{2}H_{6}$
Ответ: $C_{2}H_{6}$ §9. вопросы перед параграфом. Номер №1
-
§9. вопросы перед параграфом. Номер №1
Как устроены газы, жидкости и твёрдые вещества?
Ответ
Твердые тела в обычных условиях сохраняют и объем, и форму.
Газы не имеют формы, занимают весь предоставленный им объем, легко сжимаются и расширяются.
Жидкости сохраняют свой объем, а не занимают весь объем сосуда, принимают форму сосуда, в которой находятся, обладают текучестью, очень плохо сжимаются. 2
-
Номер №2
Чем они различаются по строению?
Ответ
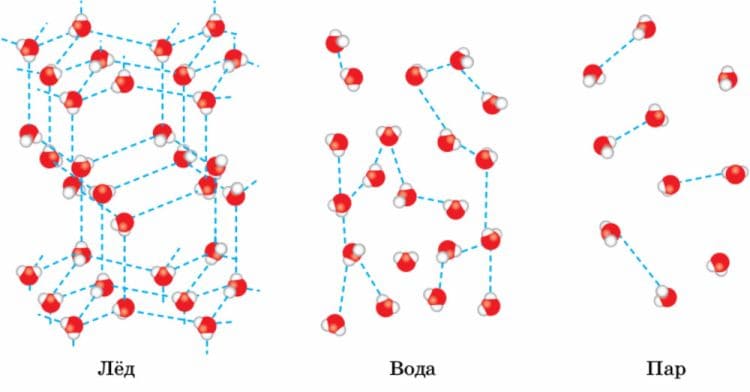
В газах расстояние между молекулами намного больше размеров самих молекул. В среднем расстояния между молекулами газов в десятки раз больше размеров самих молекул. На таких расстояниях молекулы очень слабо притягиваются друг к другу. По этой причине газы не имеют собственной формы и постоянного объема.
Промежутки между молекулами жидкостей малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. На таких расстояниях притяжение молекул друг к другу уже значительно. Поэтому молекулы жидкости не расходятся на большие расстояния и жидкость в обычных условиях сохраняет свой объем. Однако притяжение молекул жидкости еще не настолько велико, чтобы жидкость сохраняла свою форму
Твердые тела в обычных условиях сохраняют и объем, и форму. Это объясняется тем, что притяжение между их частицами еще больше, чем у жидкостей, так как молекулы находятся очень близко друг к другу. страница 59
-
(стр.59). Номер №1
Приведите свои примеры плавления и кристаллизации веществ в окружающем мире.
Ответ
Примеры плавления:
1) Плавление свечи.
2) Плавление пластика под действием температуры.
3) Плавление масла на сковородке.
4) Плавление стекла.
Примеры кристаллизации:
1) Кристаллизация соли в море.
2) Кристаллизация сахара в чае.
3) Кристаллизация сахара в варенье. §9. проблемный вопрос. Номер №1
-
§9. проблемный вопрос. Номер №1
Все ли вещества имеют три агрегатных состояния?
Ответ
Нет, не все вещества имеют три агрегатных состояния.
Например:
Для сахара известны только два агрегатных состояния: твёрдое и жидкое.
При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует. §9. вопросы и задания. Номер №1
-
§9. вопросы и задания. Номер №1
В каких агрегатных состояниях вещество имеет:
а) собственный объём;
б) форму?Ответ
Вещество имеет:
а) собственный объём: в твёрдом и жидком агрегатных состояниях.
б) форму: в твёрдом агрегатном состоянии. 2
-
Номер №2
Какое вещество на Земле существует во всех трёх агрегатных состояниях?
Ответ
Вода ― в условиях нашей планеты одновременно находится в виде твердого вещества (лёд), жидком и газообразном состоянии (водяной пар).
3
-
Номер №3
Приведите примеры явлений испарения, сублимации, кристаллизации и конденсации, которые можно наблюдать в природе.
Ответ
Явления испарения в природе: высыхание лужи, пересыхание рек.
Явления сублимации в природе: исчезновение изморози в морозную погоду, бельё после стирки можно высушить и на морозе.
Явления кристаллизации в природе: образование льда, образование снежинок.
Явления конденсации в природе: образование облаков, образование тумана. 4
-
Номер №4
На рисунке 48 изображено строение одного и того же вещества в трёх агрегатных состояниях. Какие агрегатные состояния обозначены буквами а, б и в?
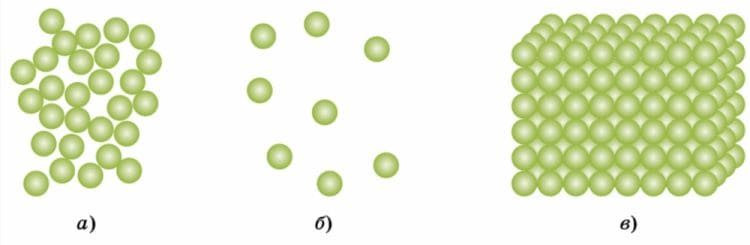 Рис. 48. Агрегатное состояние вещества
Рис. 48. Агрегатное состояние веществаОтвет
Агрегатные состояния:
а) Жидкость
б) Газ
в) Твёрдое вещество 5
-
Номер №5
В термометрах для измерения температуры на улице используют ртуть или подкрашенный спирт. Используя данные текста параграфа, определите, какой из них (или оба) можно использовать: а) в тропиках; б) в Арктике. Объясните.
Ответ
а) В тропиках можно использовать оба термометра, т.к. температуры кипения ртути и спирта выше максимальной температуры воздуха в тропиках.
б) В Арктике можно использовать только спиртовой термометр, т.к. температура замерзания спирта (−115°C), в отличие от ртути (−39°C), ниже минимальной температуры воздуха в Арктике. 6
-
Номер №6
Воздух на 99% состоит из двух газов − азота (температура кипения −196°С) и кислорода (температура кипения −183°С). Опишите, что будет происходить при охлаждении воздуха от комнатной температуры до температуры: а) −180°С; б) −190°С; в) −200°С.
Ответ
а) При охлаждении воздуха от комнатной температуры до температуры −180°C воздух в газообразном состоянии, будет уменьшаться в объёме.
б) При охлаждении воздуха от комнатной температуры до температуры −190°C кислород превратится в жидкость, а азот будет иметь газообразное состояние.
в) При охлаждении воздуха от комнатной температуры до температуры −200°C весь воздух превратится в жидкость. 7
-
Номер №7
Найдите данные о температуре и давлении на поверхности Венеры и Марса. В каких агрегатных состояниях может находиться вода на этих планетах?
Ответ
Средняя температура на Марсе значительно ниже, чем на Земле: −63°C. Поскольку атмосфера Марса сильно разрежена, она плохо сглаживает суточные колебания температуры поверхности.
На Марсе вода находится в газообразном и в твёрдом состояниях
Атмосфера Венеры намного плотнее и горячее атмосферы Земли: её температура на среднем уровне поверхности составляет около 467°C.
На Венере вода находится в газообразном состоянии 8
-
Номер №8
Почему переход между агрегатными состояниями вещества считают физическим, а не химическим явлением?
Ответ
Переход между агрегатными состояниями вещества считают физическим явлением, потому что не изменяется состав вещества и не образуются новые вещества с новыми физическими свойствами.
§10. вопросы перед параграфом. Номер №1
-
§10. вопросы перед параграфом. Номер №1
Что такое кристалл?
Ответ
Кристалл − структура, в которой составляющие ее частицы расположены в строго определённом порядке − периодически повторяющимися рядами, сетками, каркасами.

§10. в свободное время. Номер №1
-
§10. в свободное время. Номер №1
Рассмотрите через увеличительное стекло кристаллы поваренной соли и сахарного песка. Какую форму они имеют? Зарисуйте несколько кристаллов наиболее правильной формы в тетрадь. Найдите среди кристаллов сростки.
Ответ
Кристаллы поваренной соли и сахара имеют кубическую форму.
Кристалл поваренной соли:
Кристаллы сахара:
Сростки кристаллов соли:
§10. проблемный вопрос. Номер №1
-
§10. проблемный вопрос. Номер №1
Снежинки − это кристаллы льда. Почему не бывает двух одинаковых снежинок?
Ответ
В жидком и газообразном состоянии молекулы воды свободно двигаются мимо друг друга, не образуя прочных межмолекулярных связей. Когда температура падает − молекулы теряют кинетическую энергию, их движение становится замедленным, и между молекулами формируются связи. Форма и конфигурация электронного облака вокруг атомов в молекулах воды такова, что при охлаждении они выстраиваются в правильные шестиугольники. С этой фигуры начинается каждая снежинка.
Дальше ростом кристалла управляет только случай. В зависимости от влажности, давления и других условий, сопровождающих рост снежинок, новые слои молекул накладываются друг на друга, образуя замысловатую форму снежинки.
§10. вопросы и задания. Номер №1
-
§10. вопросы и задания. Номер №1
Какие тела называют кристаллами? Приведите примеры.
Ответ
Кристаллы − это тела, которые имеют кристаллическую решётку.
Примеры: поваренная соль, алмаз, кварц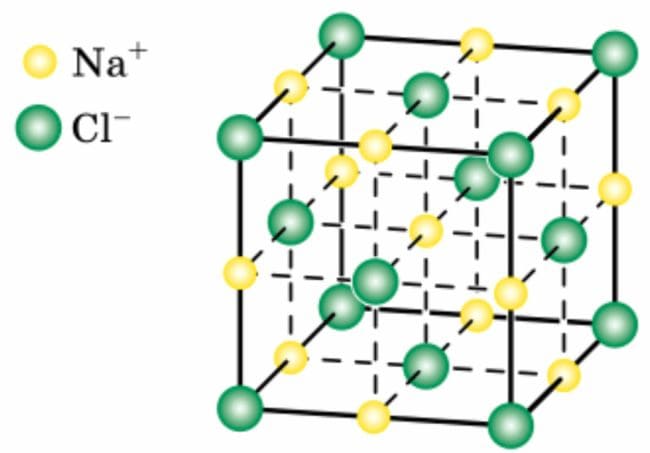
Рис. 49. Кристаллическая решётка поваренной соли 2
-
Номер №2
Найдите в интернете фотографии кристаллов медного купороса, калийной селитры, алюмокалиевых квасцов. Сравните их.
Ответ
Кристалл медного купороса:

Кристалл калийной селитры:
Кристалл алюмокалиевых квасцов:
Данные кристаллы различаются по цвету (кристалл медного купороса − синий, кристаллы калийной селитры − белые, кристаллы алюмокалиевых квасцов − прозрачные, бесцветные), по форме (у медного купороса кристаллы в форме призмы, у калийной селитры кристаллы в форме ромба, у алюмокалиевых квасцов кристаллы в форме октаэдра) и по размеру (у медного купороса − крупные кристаллы, у калийной селитры и алюмокалиевых квасцов − мелкие кристаллы). 3
-
Номер №3
Какие известные вам продукты питания состоят из отдельных кристаллов?
Ответ
Продукты питания, которые состоят из отдельных кристаллов:
1) Соль.
2) Сахар.
3) Пищевая сода.
4) Кристаллиеский желатин. 4
-
Номер №4
Речной песок тоже состоит из кристаллов вещества, называемого кварцем. Песок добывают не только в реках, но и в карьерах. Если в две литровые банки положить речной и карьерный песок равной массы, то окажется, что карьерный песок занимает меньший объём. Выскажите предположение, чем это может быть вызвано.
Ответ
Карьерный песок, в отличие от речного, содержит больше примесей, которые заполняют пустоты между песчинками, поэтому при одинаковой массе он занимает меньший объём.
§11. вопросы перед параграфом. Номер №1
-
§11. вопросы перед параграфом. Номер №1
Как классифицируют вещества по составу?
Ответ
Схема. Классификация веществ
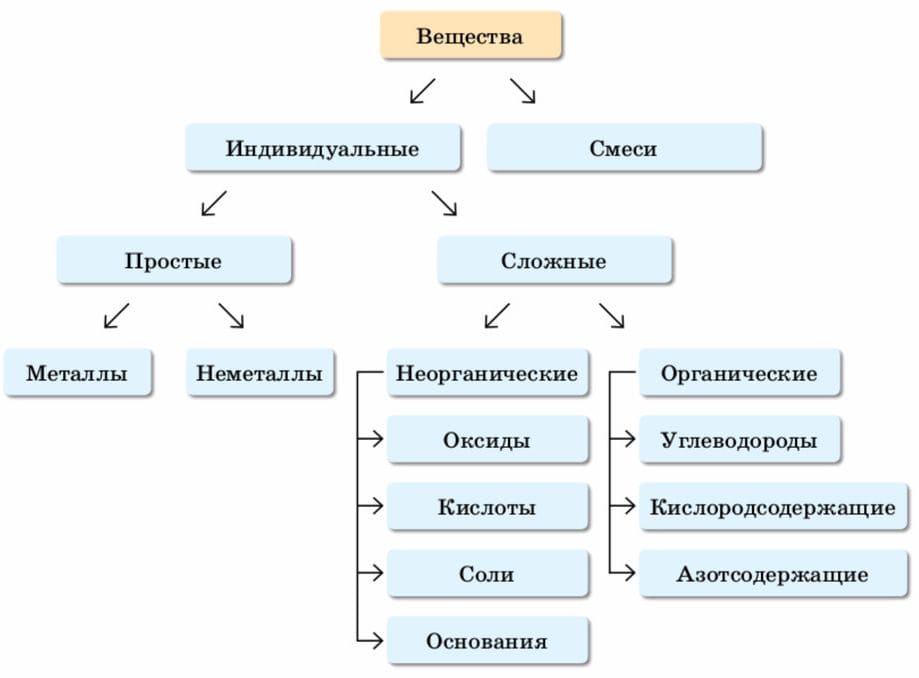
Вещества по составу делят на индивидуальные (чистые) и смеси.
Индивидуальное вещество имеет постоянный состав и характеризуется единственной химической формулой.
В состав смеси входит не менее двух веществ, причём состав смеси может быть переменным. 2
-
Номер №2
Каковы основные классы неорганических веществ?
Ответ
Основные классы неорганических веществ:
1/) Оксиды.
2) Кислоты.
3) Соли.
4) Основания. страница 72
-
(стр.72). Номер №1
Проведём опыт. Налейте в стакан или чашку столовый уксус и опустите туда мел. Что наблюдаете? Растворился ли мел полностью? Можно ли на основании опыта решить, является школьный мел чистым веществом или смесью?
Ответ
Ход работы:
В стакан налили немного уксуса. Мы положили туда мелок. Уксус сильно забурлил. Затем от мела начали откалываться небольшие кусочки. Мел состоит из известняка, который при взаимодействии с кислотой разрушается и выделяется углекислый газ, что мы и увидели при проведении опыта. При взаимодействии уксуса с мелом в ходе реакции выпал осадок.
Вывод: Мел, который продаётся в магазинах не является чистым веществом, так как весь известняк ($CaCO_{3}$) растворился в уксусной кислоте, а сульфат кальция ($CaSO_{4}$) выпал в осадок.(стр.72). Номер №1
Какие ещё из известных вам веществ представляют собой смеси?
Ответ
Смеси:
1) Молоко.
2) Гранит.
3) Бензин.
4) Помада. 75
-
(стр.75). Номер №1
Раздел «Занимательные опыты». Для знакомства со способами получения оксидов выполните опыты 2 и 3 (с. 178, 179).
Ответ
Опыт 2. Горение магния.
Возьмите пинцетом кусок магниевой стружки так, чтобы основная часть стружки торчала наружу. Опыт проводите на чистом столе над металлическим противнем с песком. Рядом с противнем на столе поместите подставку под горючее, на неё положите одну таблетку сухого топлива и подожгите её спичкой. Внесите в верхнюю часть пламени магниевую ленту. Как только она загорится, расположите руку с держателем над противнем. Когда лента сгорит и держатель остынет, рассмотрите белый порошок, образовавшийся при горении магния. Это жжёная магнезия − оксид магния MgO. Её добавляют в состав некоторых кремов и мазей. Опыт эффектно наблюдать в темноте. Попробуйте провести его вечером на открытом воздухе.

Опыт 3. Окисление меди.
Возьмите пинцетом медную фольгу и внесите её в пламя спиртовки. В отличие от магния, медь не горит на воздухе, а медленно окисляется, покрываясь чёрным налётом оксида меди. Это говорит о том, что медь − малоактивный металл. Есть и ещё менее активные металлы, такие как золото и серебро. Они кислородом воздуха вообще не окисляются. Медную фольгу, покрытую оксидом меди, оставьте для следующего опыта, поместив её в чашку Петри.

(стр.75). Номер №1
Какие элементы имеют несколько оксидов? Приведите примеры.
Ответ
1) Сера: $SO_{2}$ (оксид серы IV) и $SO_{3}$ (оксид серы VI)
2) Железо: $FeO$ (оксид железа II) и $Fe_{2}O_{3}$ (оксид железа III)
3) Хром: $Cr_{2}O_{3}$ (оксид хрома III), $CrO_{3}$ (оксид хрома VI) и $CrO$ (оксид хрома II)
4) Углерод: $CO$ (угарный газ, оксид углерода II) и $CO_{2}$ (углекислый газ, оксид углерода IV)
5) Азот: $NO$ (оксид азота II), $NO_{2}$ (оксид азота IV) и $N_{2}O_{5}$ (оксид азота V) 76
-
(стр.76). Номер №1
Используя информационные ресурсы, назовите кислоты, которые присутствуют в организме человека.
Ответ
В организме человека присутствуют:
1) Аскорбиновая кислота − витамин.
2) Фолиевая кислота − витамин.
3) Оротовая кислота − витамин.
4) Никотиновая кислота − витамин.
5) Соляная кислота − находится в желудке.
6) Молочная кислота − образуется в мышцах.(стр.76). Номер №1
Многие органические кислоты имеют названия, связанные с источником их получения. Найдите в литературе и запишите формулы следующих кислот: муравьиная, щавелевая, уксусная, молочная, лимонная, яблочная, винная. Как называются соли этих кислот?
Ответ
1) Муравьиная кислота − HCOOH
Формиаты − соли муравьиной кислоты.
2) Щавелевая кислота − HOOC−COOH
Оксалаты − соли щавелевой кислоты.
3) Уксусная кислота − $CH_{3}COOH$
Ацетаты − соли уксусной кислоты.
4) Молочная кислота − $C_{3}H_{6}O_{3}$
Лактаты − соли молочной кислоты.
5) Лимонная кислота − $C_{6}H_{8}O_{7}$
Цитраты − соли лимонной кислоты.
6) Яблочная кислота − $C_{4}H_{6}O_{5}$
Малаты − соли яблочной кислоты.
7) Винная кислота − $C_{4}H_{6}O_{6}$
Тартраты − соли винной кислоты. 77
-
(стр.77). Номер №1
Раздел «Занимательные опыты». Взаимодействие кислот с металлами изучается в опыте 4 (с. 179).
Ответ
Опыт 4. Растворяем металлы в кислотах.
В четыре пробирки поместите кусочек магниевой стружки, гранулу цинка, порошок железа, медную фольгу. В каждую пробирку прилейте по 1 мл соляной кислоты. В каких пробирках происходит выделение газа? Расположите пробирки в штативе так, чтобы скорость выделения газа уменьшалась слева направо. Чем сильнее выделяется газ, тем активнее металл. Газ, который образуется, − водород. Символ водорода вместе с символами металлов помещают в ряд активности металлов. Чем активнее металл, тем левее в ряду расположен символ. Данный металл способен вытеснить все металлы, стоящие в ряду активности правее него, из растворов их солей. Водород вытесняют из кислот лишь металлы, расположенные левее водорода. На основании опыта составьте ряд активности, включив в него четыре взятых вами металла и водород.
Выделение газа происходит во всех пробирка, кроме пробирки с медной фольгой.
Ряд активности на основании опыта:
Mg − Zn − Fe − H − Cu 78
-
(стр.78). Номер №1
Получение известковой воды.
Проведём опыт. Купите в аптеке растворы хлорида кальция и нашатырный спирт. Налейте раствор хлорида кальция в стакан и добавляйте к нему по каплям нашатырный спирт, пока не образуется белая взвесь. Дайте взвеси отстояться. Затем аккуратно слейте прозрачный раствор в другой стакан и нагрейте до кипения. Этот раствор и есть известковая вода. С другим способом получения известковой воды можно познакомиться в разделе «Занимательные опыты» (опыт 1, с. 177)Ответ

Опыт 1. Приготовление известковой воды.
Для растворения твёрдых веществ будем использовать дистиллированную воду. Такая вода, в отличие от водопроводной, не содержит растворённых солей. Чтобы отмерить необходимое количество воды, надо внимательно смотреть на деления, отмеченные на стакане. Известковой водой называют раствор гашёной извести. Научное название этого соединения − гидроксид кальция $Ca(OH)_{2}$. Поместите два шпателя порошка этого вещества в стакан. Прилейте в стакан 50 мл дистиллированной воды (по делениям на стакане) и хорошо перемешайте стеклянной палочкой. Получился раствор, по внешнему виду похожий на молоко. Его так и называют − известковое молоко. Напоминаем, что пробовать на вкус известковое молоко, как и другие вещества, категорически запрещено! Раствор стал похожим на молоко из−за того, что содержит муть − мелкие частички нерастворившегося гидроксида кальция. Их отделяют, пропуская раствор через фильтр. Способ изготовления фильтра описан в § 14. Воронку с фильтром помещают в стакан. Теперь всё готово к фильтрованию. Для отделения мути используем приготовленный фильтр. С помощью стеклянной палочки прильём мутный раствор на фильтр. Не нужно пытаться сразу перелить на фильтр весь раствор из стакана. Лучше подождать, пока уровень жидкости в воронке понизится, после этого вновь долить в воронку мутный раствор. Обратите внимание, что из воронки капает на дно стакана прозрачный раствор. Его надо сразу же после фильтрования перенести в пустую склянку, приклеив к ней этикетку «Известковая вода».Номер №2
Раздел «Занимательные опыты». Для знакомства со способами получения и химическими свойствами щелочей выполните опыты 9−11 (с. 181 − 182).
Ответ
Опыт 9. «Розовое молоко».
В пробирку внесём один шпатель порошка гидроксида кальция, добавим 2 мл воды и перемешаем. Получится белая жидкость, похожая на молоко. Добавим в него одну−две капли фенолфталеина − «молоко» станет розовым. Сохраните этот раствор для следующего опыта.
Опыт 10. «Розовое молоко» опять становится прозрачным.
Возьмите пробирку с «розовым молоком», оставшуюся после проведения опыта 9. Внесите в неё 1 мл раствора уксусной кислоты и перемешайте. Что произошло с «молоком»? Оно стало бесцветным и прозрачным. А как нам вернуть раствору розовый цвет? Попробуйте догадаться сами и проверьте свои догадки экспериментально.
Чтобы вернуть окраску раствора ("молока") в розовый необходимо к нему прилить еще известковой воды.
Опыт 11. Известковая вода мутнеет.
Налейте в пробирку 2 мл известковой воды (её мы приготовили в опыте 1), опустите в пробирку соломинку для коктейля или стеклянную трубку и ртом выдувайте воздух (не перепутайте − воздух надо выдувать, а не втягивать, как это происходит, когда вы пьёте коктейль). Как только известковая вода помутнеет, прекратите дуть. Образующаяся муть − это осадок карбоната кальция (мела). Дождитесь, когда осадок опустится на дно и отделится от раствора. Затем с помощью стеклянной палочки аккуратно отберите жидкость над осадком и перенесите её в другую пробирку. Определите рН этой жидкости, пользуясь универсальным индикатором. Какую реакцию среды имеет раствор?
Раствор показывает реакцию щелочной среды.
К осадку прилейте несколько капель соляной кислоты. Выделяющиеся пузыри − это углекислый газ. §11. проблемный вопрос. Номер №1
-
§11. проблемный вопрос. Номер №1
Какие признаки, кроме строения и состава, могут быть положены в основу классификации химических веществ?
Ответ
В основе классификации химический веществ могут быть положены их свойства.
Например: металлы и неметаллы; кислотные, основные и амфотерные оксиды. §11. вопросы и задания. Номер №1
-
§11. вопросы и задания. Номер №1
Назовите хотя бы одно индивидуальное вещество в окружающем мире. Какова его формула?
Ответ
Индивидуальные вещества в окружающем мире:
1) Карбонат натрия (мел) − $CaCO_{3}$.
2) Хлорид натрия (соль) − NaCl.
3) Гелий − He. 2
-
Номер №2
Почему простых веществ известно в несколько раз больше, чем химических элементов?
Ответ
Многие химические элементы образуют не одно, а несколько простых веществ.
Примеры: Химический элемент кислород образует два простых вещества: кислород и озон, а химический элемент углерод − несколько простых веществ: алмаз, графит, фуллерен. 3
-
Номер №3
Почему сложных веществ известно во много раз больше, чем простых?
Ответ
Атомы химических элементов соединяются между собой в самых разнообразных сочетаниях и количественных соотношениях. Очевидно, что таких сочетаний образуется значительно больше из атомов различных химических элементов сложного вещества, чем из атомов одного химического элемента простого вещества.
4
-
Номер №4
Оксидами каких элементов являются: вода, ржавчина, углекислый газ, глинозём, магнитный железняк, негашёная известь?
Ответ
Вода является оксидом водорода, ржавчина − это оксид железа, углекислый газ − оксид углерода, глинозём − оксид алюминия, магнитный железняк − оксид железа, негашёная известь − оксид кальция.
5
-
Номер №5
Приведите примеры кислот, используемых в быту. Какие из них относятся к органическим, а какие — к неорганическим?
Ответ
Уксусная кислота, лимонная кислота, щавелевая кислота, аскорбиновая кислота, ацетилсалициловая кислота − органические кислоты.
Фосфорная кислота, борная кислота − неорганические кислоты. 6
-
Номер №6
Как вы думаете, можно ли считать воду кислотой? Попадает ли она под определение кислот?
Ответ
Кислоты − это сложные вещества, состоящие из атомов водорода, которые могут замещаться на атомы металла, и кислотных остатков.
Но ведь и вода содержит атомы водорода, которые могут замещаться атомами металла:
2$H_{2}O$ + 2Na = 2NaOH + $H_{2}$
Значит, воду можно отнести к кислотам, так как она подходит под определение. Но вот другое определение кислот (более точное):
кислотой является водородсодержащее соединение, водный раствор которого обладает следующими свойствами: проводит электрический ток, при реакции с металлическим цинком выделяет водород, окрашивает лакмус в красный цвет, имеет кислый вкус.
Вода под это определение не подходит. 7
-
Номер №7
Определите по названиям, какие из перечисленных веществ относятся к солям: сульфат магния (английская соль), оксид железа (III), гидрокарбонат натрия (питьевая сода), лимонная кислота, глюконат кальция.
Ответ
К солям относятся: сульфат магния, гидрокарбонат натрия, глюконат кальция.
Оксид железа (III) − относится к оксидам.
Лимонная кислота − относится к кислотам. 8
-
Номер №8
Выясните из курса биологии, какие соли входят в состав организма человека.
Ответ
В состав организма человека входят хлорид натрия и фосфат кальция.
§12. вопросы перед параграфом. Номер №1
-
§12. вопросы перед параграфом. Номер №1
Чем отличаются химические явления от физических?
Ответ
Химические явления в отличие от физических явлений сопровождаются изменением состава вещества и изменением его химической формулы.
2
-
Номер №2
Каковы признаки химических реакций?
Ответ
Признаки химических реакций:
1. Изменение цвета.
2. Образование осадка и выделение газа из раствора.
3. Выделение или поглощение тепла.
4. Появление запаха и света. 3
-
Номер №3
Что такое уравнение реакции?
Ответ
Химическая реакция − превращение одних веществ (реагентов) в другие (продукты), происходящее при определённых условиях.
Уравнение химической реакции − это условная запись химической реакции с помощью формул и символов. страница 81
-
(стр.81). Номер №1
Какие реакции в природе происходят: а) при нагревании; б) под действием света; в) в растворе?
Ответ
а) При нагревании: реакции горения, окисления и разложения.
Пример: появление железной окалины на железном гвозде в результате его нагревания; разложение перманганата калия при нагревании.
б) Под действием света: фотосинтез в растениях.
в) В растворе: обменные процессы.
Пример: гашение пищевой соды уксусом. 83
-
(стр.83). Номер №1
Проведём опыт. Растворите в воде несколько кристалликов марганцовки (перманганата калия $KMnO_{4}$), хорошо перемешайте. Будьте аккуратны! Полученный раствор тёмно−фиолетового цвета разлейте по пяти пробиркам и добавьте в каждую различные вещества: уксусную кислоту, лимонную кислоту, щавелевую кислоту, перекись водорода, соду. В каких случаях цвет раствора изменился?
Ответ
В результате реакций раствор поменяет свой цвет при взаимодействии $KMnO_{4}$ с уксусной кислотой, лимонной кислотой, щавелевой кислотой и содой. Цвет растворов будет коричневым.
Перекись водорода взаимодействует с пермаганатом калия только в кислой среде (среда данного раствора − нейтральная). Так как вещества не взаимодействуют, то и цвет раствора не изменится. 84
-
(стр.84). Номер №1
Раздел «Занимательные опыты». Выполните опыт 10 (с. 181).
Какой признак свидетельствует о протекании химической реакции?Ответ
Опыт 10. «Розовое молоко» опять становится прозрачным.
Возьмите пробирку с «розовым молоком», оставшуюся после проведения опыта 9. Внесите в неё 1 мл раствора уксусной кислоты и перемешайте. Что произошло с «молоком»? Оно стало бесцветным и прозрачным. А как нам вернуть раствору розовый цвет? Попробуйте догадаться сами и проверьте свои догадки экспериментально.
Чтобы вернуть окраску раствора («молока») в розовый необходимо к нему прилить еще известковой воды.
О протекании химической реакции свидетельствует изменение окраски раствора. §12. проблемный вопрос. Номер №1
-
§12. проблемный вопрос. Номер №1
Почему происходят химические реакции?
Ответ
Химические реакции – превращение одних веществ в другие. В этом процессе разрываются одни связи и формируются другие, а также перераспределяются ядра и электроны. Исходным реагентам энергетически выгодно превратиться в продукты реакции. Реакции идут самопроизвольно либо при обычных условиях, либо при нагревании или изменении давления, если в обычных условиях они термодинамически невозможны.
§12. вопросы и задания. Номер №1
-
§12. вопросы и задания. Номер №1
Рассмотрите явления, изображённые на рисунке 61. В каком случае произошла химическая реакция?

Рис. 61. Различные физические и химические явления и природные процессыОтвет
Химическая реакция происходит на картинке под буквой "в". На фотографии изображен процесс горения древесины, в ходе горения образуются новые вещества (углекислый газ − $CO_{2}$ и вода − $H_{2}O$).
2
-
Номер №2
При откупоривании бутылки с газированной водой выделяется газ. Происходит ли при этом химическая реакция?
Ответ
Нет, химическая реакция при этом не происходит.
При открывании бутылки не происходит превращения одних веществ в другие, а выделяется газ, который находился там под давлением. 3
-
Номер №3
Составьте химические уравнения по схемам реакций, приведённым в тексте параграфа.
Ответ
1) При взаимодействии этилового спирта и кислорода образуется углекислый газ и вода:
$C_{2}H_{6}O$ + 3$O_{2}$ = 2$CO_{2}$ + 3$H_{2}O$
2) При взаимодействии карбоната натрия и хлорида кальция образуется карбонат кальция и хлорид натрия:
$Na_{2}CO_{3}$ + $CaCl_{2}$ = $CaCO_{3}$ + 2$NaCl$
3) При взаимодействии карбоната натрия и щавеливой кислоты (гликольальдегида) образуется углекислый газ, ацетат натрия и вода:
$Na_{2}CO_{3}$ + 2$C_{2}H_{4}O_{2}$ = $CO_{2}$ + 2$C_{2}H_{3}O_{2}Na$ + $H_{2}O$ 4
-
Номер №4
Расставьте коэффициенты в схемах химических реакций.
а) $H_{2}$ + $O_{2}$ → $H_{2}O$
б) $CH_{4}$ + $O_{2}$ → $CO_{2}$ + $H_{2}O$
в) $KOH$ + $HCl$ →$KCl$ + $H_{2}O$
г) $Al$ + $O_{2}$ → $Al_{2}O_{3}$Ответ
а) 2$H_{2}$ + $O_{2}$ = 2$H_{2}O$
б) $CH_{4}$ + 2$O_{2}$ = $CO_{2}$ + 2$H_{2}O$
в) $KOH$ + $HCl$ = $KCl$ + $H_{2}O$
г) 4$Al$ + 3$O_{2}$ = 2$Al_{2}O_{3}$ 5
-
Номер №5
Приведите пример химического явления из повседневной жизни, сопровождающегося изменением цвета.
Ответ
Химические явления, сопровождающиеся изменением цвета: подгорание пищи, выгорание цвета одежды на солнце, пожелтение листьев осенью, ржавление металла, почернение серебряных изделий, обугливание сахара.
6
-
Номер №6
Какие из перечисленных ниже явлений относятся к химическим: а) горение свечи; б) измельчение кофейных зёрен; в) таяние снега; г) отбеливание тканей; д) отправка письма по электронной почте; е) появление ржавчины на металлических изделиях; ж) дыхание?
Ответ
К химическим явлениям относятся:
а) горение свечи;
г) отбеливание тканей;
е) появление ржавчины на металлических изделиях;
д) дыхание. 7
-
Номер №7
Составьте уравнения реакций, протекающих в опытах 2−5 из раздела «Занимательные опыты».
Ответ
Опыт 2. Горение магния
2$Mg$ + $O_{2}$ = 2$MgO$
Опыт 3. Окисление меди
2$Cu$ + $O_{2}$ = 2$CuO$
Опыт 4. Растворяем кислоты в металлах
$Mg$ + 2$HCl$ = $MgCl_{2}$ + $H_{2}$
$Zn$ + 2$HCl$ = $ZnCl_{2}$ + $H_{2}$
$Fe$ + 2$HCl$ = $FeCl_{2}$ + $H_{2}$
$Cu$ + $HCl$ = реакция не идёт
Опыт 5. Получаем кислород
2$H_{2}O_{2}$ = 2$H_{2}O$ + $O_{2}$ §13. вопросы перед параграфом. Номер №1
-
§13. вопросы перед параграфом. Номер №1
Как получить раствор из двух веществ?
Ответ
Для растворения понадобятся как минимум два вещества. Одно из них— растворитель. Второе вещество, которое мы переводим в раствор, может быть любым. Главное, чтобы при растворении оно не вступало с водой (или другим растворителем) в химическую реакцию. Иначе мы либо вообще не получим никакого раствора, либо получим раствор не исходного, а другого вещества. Для получения раствора необходимо внести порцию вещества в растворитель и перемешивать до тех пор, пока жидкость не станет прозрачной (рис. 64).

Рис. 64. Растворение вещества в воде 2
-
Номер №2
Что такое растворимость и от чего она зависит?
Ответ
Растворимость количественно выражается максимальной массой вещества, которую можно перевести в раствор, используя 100 г растворителя.
§13. проблемный вопрос. Номер №1
-
§13. проблемный вопрос. Номер №1
Почему одни вещества хорошо смешиваются друг с другом, а другие нет?
Ответ
Вещество лучше растворяется в жидкости, если оно обладает той же полярностью и сходными прочими характеристиками.
Всем известно, что масло и вода не смешиваются: если мы добавим каплю масла в стакан с водой, с этой каплей ничего не произойдет, она не растворится. С другой стороны, если в воду капнуть этанол (спирт) капля сразу исчезнет, потому что она растворилась. Такое поведение веществ объясняют эмпирическим правилом «подобное растворяется в подобном».
Дело в том, что вода — полярная молекула. Электроны в молекуле воды большую часть времени проводят около кислорода, и, хотя суммарный электрический заряд всей молекулы равен нулю, молекула воды со стороны водорода становится положительно заряженной. Молекула этанола также полярная, и поэтому между молекулами воды и этанола могут образовываться водородные связи.
С другой стороны, масло состоит из неполярных молекул, поэтому между ними и молекулами воды нет связей. Масло не «подобно» воде и не растворяется в ней. §13. вопросы и задания. Номер №1
-
§13. вопросы и задания. Номер №1
Приведите примеры веществ, растворимых и нерастворимых в воде.
Ответ
Растворимые в воде вещества: поваренная соль (хлорид натрия), сахар, калийная селитра (нитрат калия), лимонная кислота, этанол (этиловый спирт).
Нерастворимые в воде вещества: оксид алюминия, мел (карбонат кальция), подсолнечное масло. 2
-
Номер №2Как изменяется растворимость большинства твёрдых веществ при нагревании? Что произойдёт, если насыщенный при 70°С раствор калийной селитры охладить до комнатной температуры?
Ответ
При нагревании растворимость большинства твёрдых веществ увеличивается.
Если насыщенный при 70°С раствор калийной селитры охладить до комнатной температуры, то образуется осадок и раствор станет мутным. 3
-
Номер №3
Глядя на рисунок 68, определите, какой из растворов медного купороса имеет наибольшую концентрацию.

Рис. 68. Растворы медного купороса разной концентрацииОтвет
Наибольшую концентрацию медного купороса имеет раствор под буквой в), так как у него самый насыщенный цвет.
4
-
Номер №4
Какую массу калийной селитры и какой объём воды нужно взять для приготовления 300г 4%−го раствора?
Ответ
Дано:
w($KNO_{3}$) = 4%
m(раствора) = 300 г
p($H_{2}O$) = 1$\frac{г}{мл}$ (плотность воды является постоянной величиной)
Найти::
m($KNO_{3}$) − ?
V($H_{2}O$) − ?Ответ:
1. Вычисляем массу калийной селитры:
m($KNO_{3}$) = $\frac{m(раствора)\; * \;w(KNO_{3})}{100}$ = $\frac{300\;*\;4%}{100}$ = 12 г
2. Рассчитываем массу воды:
m($H_{2}O$) = m(раствора) − m($KNO_{3}$) = 300 г – 12 г = 288 г
V($H_{2}O$) = $\frac{m(H_{2}O)}{p(H_{2}O)}$ = $\frac{288}{1}$ = 288 мл
Ответ: m($KNO_{3}$) = 12 г, V($H_{2}O$) = 288 мл. 5
-
Номер №5
Растворимость калийной селитры в воде при комнатной температуре равна 31,6 г в 100 г воды. Определите массовую долю селитры в насыщенном растворе.
Ответ
Дано:
m($H_{2}O$)=100 г
m($KNO_{3}$)=31,6 г
Найти:
$w$($KNO_{3}$) − ?Ответ:
1. Рассчитываем массу раствора:
m(раствора) = m($KNO_{3}$) + m($H_{2}O$) = 31,6 г + 100 г = 131,6 г
2. Вычисляем массовую долю калийной селитры в растворе:
$w$($KNO_{3}$) = $\frac{m(KNO_{3})}{m(раствора)}$100% = $\frac{31,6 г}{131,6 г}$100% = 24%
Ответ: $w$($KNO_{3}$) = 24% 6
-
Номер №6
В каком объёмном соотношении нужно смешать уксусную кислоту и воду для получения 9%−го раствора?
Ответ
Дано:
$w$($CH_{3}COOH$) = 9%
$p$($H_{2}O$) = 1$\frac{г}{мл}$
$p$($CH_{3}COOH$) = 1,05 $\frac{г}{мл}$
Найти:
V($CH_{3}COOH$) : V($H_{2}O$)−?Ответ:
Допустим, что масса раствора 100 г.
1. Вычисляем массу уксусной кислоты:
m($CH_{3}COOH$) = $\frac{m(раствора)\;* \;w(CH_{3}COOH)}{100}$ = $\frac{100\;*\;9}{100}$ = 9 г
2. Рассчитываем массу воды в растворе:
m($H_{2}O$) = m(раствора) − m($CH_{3}COOH$) = 100 г − 9 г = 91 г
3. Вычисляем объёмы уксусной кислоты и воды:
V($CH_{3}COOH$) = $\frac{m(CH_{3}COOH)}{p(CH_{3}COOH)}$ = $\frac{9}{1,05}$ = 8,57 мл
V($H_{2}O$) = $\frac{m(H_{2}O)}{p(H_{2}O)}$ = $\frac{91}{1}$ = 91 мл
4. Определяем соотношение объёмом:
V($CH_{3}COOH$) : V($H_{2}O$) = 8,57мл : 91мл = 1мл : 10,6мл
Ответ: Для получения 9%−го раствора нужно смешать 1мл уксусной кислоты и 10,6 мл воды. 7
-
Номер №7
Пользуясь кривой растворимости (см. рис. 67), предложите способ очистки сахарного песка от случайно попавшей в него поваренной соли.
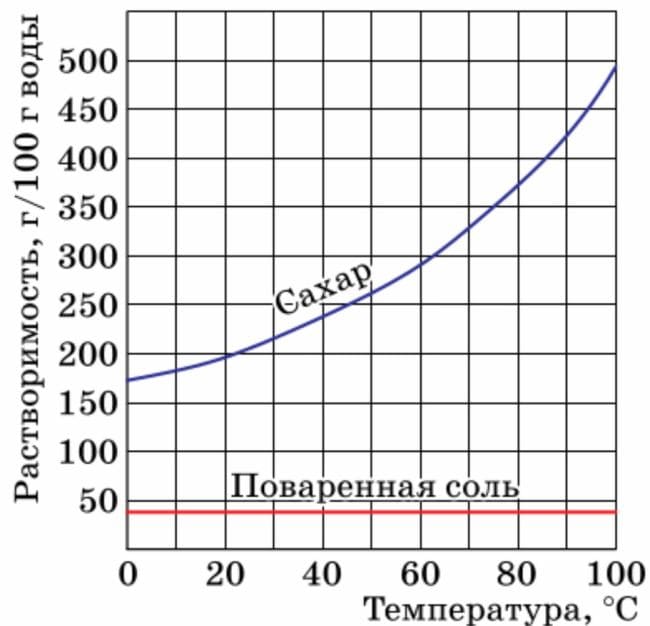
Рис. 67. Кривые растворимости сахара (сахарозы) и поваренной солиОтвет
1. Растворим эту смесь в воде.
2. Кристаллизацией раствора получим кристаллы соли (воду выпаривают лишь частично, а затем раствор оставляют открытым в течение длительного времени или охлаждают, вода медленно испаряется, и растворённое вещество выделяется в виде крупных кристаллов).
3. Фильтрованием получаем кристаллики соли.
4. Выпариванием фильтрата (раствора, прошедшего через фильтр) получаем сахарный песок. §14. вопросы перед параграфом. Номер №1
-
§14. вопросы перед параграфом. Номер №1
Какие вещества можно разделять фильтрованием?
Ответ
Фильтрование позволяет отделить твердое вещество от жидкости или газа.
2
-
Номер №2
Как правильно отделить осадок от раствора?
Ответ
Для отделения осадка от раствора необходимо процедить раствор через фильтр. Частицы твёрдого вещества (осадок) застрянут в фильтре, а раствор просочится через фильтр.
§14. проблемный вопрос. Номер №1
-
§14. проблемный вопрос. Номер №1
Для чего отделяют вещества друг от друга? Всегда ли это необходимо?
Ответ
Вещества отделяют друг от друга для того, чтобы получить чистое вещество. Фильтрование позволяет отделить осадок от раствора. С помощью фильтрования можно очистить воду от нерастворимых в ней примесей, например, от песка, глины, мела.
Отделять вещества друг от друга нужно не всегда, ведь иногда нам нужно использовать смеси. §14. вопросы и задания. Номер №1
-
§14. вопросы и задания. Номер №1
Что называют фильтрованием?
Ответ
Фильтрование — процесс разделения смеси жидкости (или газа) и твёрдых веществ при помощи пористых перегородок материалов (фильтров).
2
-
Номер №2
Из каких материалов изготавливают фильтры?
Ответ
Фильтры изготавливают из фильтровальной бумаги, ткани, активированного угля и пористых полимеров.
В лаборатории фильтрование осуществляют с помощью бумажных фильтров, изготовленных из пористой фильтровальной бумаги. К фильтрованию часто прибегают не только в лабораториях, но и в промышленности.
В промышленности используют не только бумажные или тканевые фильтры, но и выполненные из пористых полимерных материалов, пористого стекла, асбеста.
В воздушных фильтрах бумагу или ткань заменяют на активированный уголь, который тоже имеет пористую структуру. В нём много мелких сквозных каналов, на внутренней поверхности которых оседают частички пыли.
В современном автомобиле установлено сразу несколько фильтров. Один из них обеспечивает фильтрацию от пыли и грязи поступающего в двигатель воздуха. Масляный фильтр очищает моторное масло от продуктов нагара. Отдельный фильтр очищает воздух, который поступает в салон машины. Все фильтры по мере загрязнения требуют замены.
Процесс фильтрования постоянно происходит и в природе. Фильтрами в этом случае выступают слои земли, через которые проходит вода. 3
-
Номер №3
Расскажите об использовании фильтров в вашей квартире.
Ответ
Примеры домашних фильтров:
1) Сито ― для просеивания муки.
2) Фильтр водопроводной воды ― для очистки воды от частичек ржавчины.
3) Воздушный фильтр ― для очистки воздуха от частичек пыли. 4
-
Номер №4
Можно ли с помощью фильтра очистить: а) чай от растворённого в нём сахара; б) чай от плавающих в нём чаинок?
Ответ
а) Фильтр не поможет очистить чай от растворённого в нём сахара, так как растворенные молекулы сахара пройдут через фильтр вместе с раствором (чаем).
б) С помощью фильтра можно очистить чай от плавающих в нём чаинок. 5
-
Номер №5
Смесь поваренной соли и медной стружки массой 50 г размешали в 1 л воды и профильтровали. На фильтре осела стружка массой 10 г. Найдите массовую долю соли в фильтрате.
Ответ
Дано:
m (смеси) = 50г
V ($H_{2}O$) = 1л
m ($Cu$) = 10г
Найти:
$w$ ($NaCl$) = ?Ответ:
1. Рассчитываем массу поваренной соли в смеси:
m ($NaCl$) = m (смеси) − m ($Cu$) = 50 г − 10 г = 40 г
2. Рассчитываем массу воды:
m ($H_{2}O$) = V ($H_{2}O$) * ρ ($H_{2}O$) = 1000 мл * 1$\frac{г}{мл}$ = 1000 г
3. Рассчитываем массу раствора:
m (раствора) = m ($NaCl$)+m ($H_{2}O$) = 40 г + 1000 г = 1040 г
4. Вычисляем массовую долю поваренной соли в растворе:
$ω$($NaCl$) = $\frac{m(NaCl)}{m(раствора)}$ = $\frac{40 г}{1040 г}$ * 100% = 3,8%
Ответ: $w$ ($NaCl$) = 3,8% §15. вопросы перед параграфом. Номер №1
-
§15. вопросы перед параграфом. Номер №1
Какие существуют способы нагревания веществ?
Ответ
Нагревать вещества можно с помощью:
1) Горячей воды.
2) Печей (в современном мире существуют газовые, электрические и печи на дровах).
3) Солнечных лучей.
4) Спиртовки.
5) Газовой горелки.
6) Свечки. 2
-
Номер №2
Для чего используют нагревание?
Ответ
Нагревание использую для увеличения скорости реакции, а также для изменения агрегатного состояния веществ (переход воды в пар при кипении или таяние льда).
§15. проблемный вопрос. Номер №1
-
§15. проблемный вопрос. Номер №1
Вы узнали о способах нагревания. А как охлаждают вещества?
Ответ
Вещества охлаждают с помощью:
1. Холодной воды.
2. Сухого льда.
3. Холодильной камеры. §15. вопросы и задания. Номер №1
-
§15. вопросы и задания. Номер №1
Объясните, почему для протекания многих превращений требуется нагревание.
Ответ
Это объясняется тем, что нагревание приводит к увеличению скорости движения молекул или колебания атомов в кристаллах, что увеличивает число соударений молекул реагирующих веществ, то есть скорость соприкосновения веществ.
2
-
Номер №2
Какие нагревательные приборы, используемые в лабораториях, вы знаете?
Ответ
В лаборатории используют: спиртовки, электрические плитки, муфельные печи и газовые горелки.
3
-
Номер №3
Как можно осуществлять контроль температуры?
Ответ
Осуществлять контроль температуры можно с помощью термометра, температурных датчиков.
4
-
Номер №4
Какая часть пламени является наиболее горячей?
Ответ
Наиболее высокая температура − в верхней части пламени и по его бокам.

5
-
Номер №5
Подумайте, почему сырые дрова не дают такого жаркого огня, как сухие.
Ответ
Сырые дрова, в отличие от сухих, не дают такого жаркого огня, так как часть энергии горения тратится на нагревание и на испарение воды.
§16. вопросы перед параграфом. Номер №1
-
§16. вопросы перед параграфом. Номер №1
Какие смеси разделяют выпариванием?
Ответ
Выпариванием разделяют однородные смеси − растворы.
2
-
Номер №2
Когда из раствора выделяются кристаллы?
Ответ
Кристаллы выделяются при охлаждении раствора.
§16. проблемный вопрос. Номер №1
-
§16. проблемный вопрос. Номер №1
Образование кристаллов из раствора − физическое или химическое явление?
Ответ
Образование кристаллов из раствора − это физическое явление, так как новых веществ при этом не образуется.
§16. вопросы и задания. Номер №1
-
§16. вопросы и задания. Номер №1
Какую операцию называют выпариванием? Как её осуществляют?
Ответ
Выпаривание − процесс испарения растворителя из раствора. Выпаривание происходит при нагревании раствора до температуры кипения.
2
-
Номер №2
Расскажите, как можно вырастить в домашних условиях крупные кристаллы поваренной соли.
Ответ
Для получения крупных кристаллов поваренной соли в домашних условиях в раствор соли опускают хлопчатобумажную нить. Воду выпаривают лишь частично, а затем раствор оставляют открытым в течение длительного времени. Вода медленно испаряется, и поварённая соль выделяется на нити в виде крупных кристаллов.
3
-
Номер №3
Как можно превратить мелкие кристаллы калийной селитры в крупные?
Ответ
Растворите в стакане с горячей (почти кипящей) водой две ложечки калийной селитры, дождитесь полного растворения кристаллов. Вытрите стакан снаружи сухой тряпкой, поставьте его на электроплитку и вновь нагрейте. Перемешивайте раствор стеклянной палочкой. Выключите плитку. Не снимая стакан с плитки, дайте ему постепенно охладиться до комнатной температуры. Кристаллы будут крупными, если раствор охлаждать постепенно, перед этим выпарив половину воды.
4
-
Номер №4
При выпаривании 120г раствора поваренной соли получили 6г твёрдого остатка. Определите массовую долю соли в исходном растворе.
Ответ
Дано:
m(раствора) = 120 г
m(NaCl) = 6 г
Найти:
w(NaCl) = ?Ответ:
Вычисляем массовую долю поваренной соли в растворе:
w(NaCl) = $\frac{m(NaCl)}{m(раствора)}$ * 100% = $\frac{6г}{120г}$ * 100% = 5%
Ответ: w(NaCl) = 5% 5
-
Номер №5
В каком случае удастся получить больше твёрдого остатка: при выпаривании 230г 7%−го раствора поваренной соли или 150г 10%−го раствора калийной селитры?
Ответ
Дано:
w (NaCl) = 7%
m(р−ра NaCl) = 230 г
w ($KNO_{3}$) = 10%
m(р−ра $KNO_{3}$) = 150 г
Найти:
m(NaCl) − ?
m($KNO_{3}$) − ?Ответ:
Вычисляем массы поваренной соли и калийной селитры:
m(NaCl) = $\frac{m(р-ра NaCl) * w(NaCl)}{100}$ = $\frac{230 * 7}{100}$ = 16,1 г
m($KNO_{3}$) = $\frac{m(р-ра KNO_{3}) * w(KNO_{3})}{100}$ = $\frac{150 * 10}{100}$ = 15 г
m($KNO_{3}$) < m($NaCl$)
Ответ: Твёрдого остатка получится больше при выпаривании поваренной соли NaCl. 6
-
Номер №6
Используя данные о растворимости поваренной соли из приложения (с.190), определите, можно ли растворить при комнатной температуре две столовые ложки поваренной соли в 1л воды. Одна столовая ложка без горки вмещает 25г соли.
Ответ
Приложение. Растворимость некоторых солей в воде (г безводной соли и 100 г воды)
Дано:
V($H_{2}O$) = 1л
m ($NaCl$) = 25г 2= 50 г*Ответ:**
По таблице растворимости в 100 мл воды при комнатной температуре можно растворить не более 35,9 г поваренной соли NaCl, или, другими словами, в 1 л − 359 г.
Две столовые ложки поваренной соли имеют массу 25 г * 2=50 г, а 50 г<359 г, следовательно, их можно растворить в 1 литре воды.
Ответ: Да, в 1л воды можно растворить две столовые ложки поваренной соли. §17. вопросы перед параграфом. Номер №1
-
§17. вопросы перед параграфом. Номер №1
Из чего состоит воздух?
Ответ
Воздух − это смесь газов.
В его состав входят:
1. Азот ($N_{2}$)
2. Кислород ($O_{2}$)
3. Инертный газ Аргон (Ar)
4. Углекислый газ ($CO_{2}$)
5. Инертный газ Неон (Ne)
6. Инертный газ Гелий (He)
Рис.81. Состав сухого воздуха 2
-
Номер №2
Как разделить воздух на отдельные вещества?
Ответ
Для разделения воздуха на отдельные вещества его сначала сжижают путём повышения давления и понижения температуры. Затем, полученную жидкость разделяют на отдельные газы (фракции) при помощи фракционной перегонки.
Температура кипения жидкого кислорода −182,98 °C.
Температура кипения жидкого аргона −185,9°C.
Температура кипения жидкого азота −195,8°C.
Эта разность температур кипения и позволяет разделить смесь. 3
-
Номер №3
Чем воздух по свойствам отличается от чистого кислорода?
Ответ
1. Чистым кислородом нельзя дышать в течение долгого времени.
2. Воздух − это смесь газов, кислород − это чистое вещество.
3. При чистом кислороде реакция горения будет происходить более бурно.
4. Чистый кислород окисляет вещества быстрее, чем воздух. 4
-
Номер №4
Как в атмосфере появился кислород?
Ответ
Кислород начал появляться в атмосфере в результате фотосинтеза, осуществляемого в Мировом океане бактериями и синезелёными водорослями. Поглощая солнечный свет, они превращали углекислый газ в органические вещества. В качестве побочного продукта этой реакции образовывался молекулярный кислород, который из−за плохой растворимости в воде выделялся в атмосферу.
страница 109
-
(стр.109). Номер №1
Раздел «Занимательные опыты».
Подробнее познакомиться с получением одного из оксидов нам поможет опыт 2 (с.178).Ответ
Опыт 2. Горение магния
Возьмите пинцетом кусок магниевой стружки так, чтобы основная часть стружки торчала наружу. Опыт проводите на чистом столе над металлическим противнем с песком. Рядом с противнем на столе поместите подставку под горючее, на неё положите одну таблетку сухого топлива и подожгите её спичкой. Внесите в верхнюю часть пламени магниевую ленту. Как только она загорится, расположите руку с держателем над противнем. Когда лента сгорит и держатель остынет, рассмотрите белый порошок, образовавшийся при горении магния. Это жжёная магнезия — оксид магния MgO. Её добавляют в состав не которых кремов и мазей. Опыт эффектно наблюдать в темноте. Попробуйте провести его вечером на открытом воздухе.
111
-
(стр.111). Номер №1
Раздел «Занимательные опыты».
Для получения кислорода и изучения его свойств выполните опыт 5 (с.179−180).Ответ
Опыт 5. Получаем кислород
Познакомимся со свойствами ещё одного неметалла — кислорода. Кислород входит в состав воздуха — в нём его 21% по объёму. Мы получим чистый кислород. Для этого используем перекись водорода. Это вещество способно разлагаться на воду и кислород. Перекись водорода при хранении разлагается постепенно, поэтому хранят её в темноте. Аптечная 3%−я перекись поступает в продажу в склянках из коричневого стекла. Для ускорения разложения перекиси используем оксид марганца. В химический стакан налейте примерно 5 мл перекиси. На кончике шпателя внесём в стакан с перекисью оксид марганца. Перекись вспенивается. Это выделяется кислород. Убедиться, что выделившийся газ — кислород, можно с помощью тлеющей лучинки. Для этого зажгите лучинку и, когда она разгорится, потушите её, но не полностью, а так, чтобы на её конце остался тлеющий уголёк. Внесите тлеющую лучинку в стакан с перекисью, опустив её как можно ниже, но не касаясь раствора (иначе лучинка погаснет). Лучинка вспыхнет. Это свидетельствует о том, что при разложении перекиси выделяется кислород.
113
-
(стр.113). Номер №1
В определённые периоды истории Земли концентрация кислорода в воздухе превышала ныне существующую. Такая атмосфера была химически очень активной, поэтому на Земле часто происходили лесные пожары. Определите по графику (см. рис. 84), сколько миллионов лет назад содержание кислорода в атмосфере превышало 30%.
Рис. 84. Изменение содержания кислорода в атмосфере за время существования ЗемлиОтвет
Содержание кислорода в атмосфере превышало 30% примерно 300 миллионов лет назад.
§17. проблемный вопрос. Номер №1
-
§17. проблемный вопрос. Номер №1
Есть ли атмосфера у Солнца? А у других планет Солнечной системы?
Ответ
У Солнца есть атмосфера, которую принято разделять на фотосферу, хромосферу и корону. Также у всех планет Солнечной системы есть атмосфера, кроме Меркурия.
§17. вопросы и задания. Номер №1
-
§17. вопросы и задания. Номер №1
Плотность воды равна 1 кг/л. Во сколько раз воздух легче воды?
Ответ
Дано:
p ($H_{2}O$) = 1 кг/л = 1000 г/л
p(воздуха) = 1,29 г/л
Найти:
$\frac{p(H_{2}O)}{p(воздуха)}$ − ?
Ответ:
$\frac{p(H_{2}O)}{p(воздуха)}$ = $\frac{1000}{1,29}$ = 775 раз
Ответ: Плотность воды в 775 раз больше плотности воздуха. 2
-
Номер №2
Чему равна объёмная доля кислорода в воздухе?
Ответ
Объёмная доля кислорода в воздухе равна 21%.
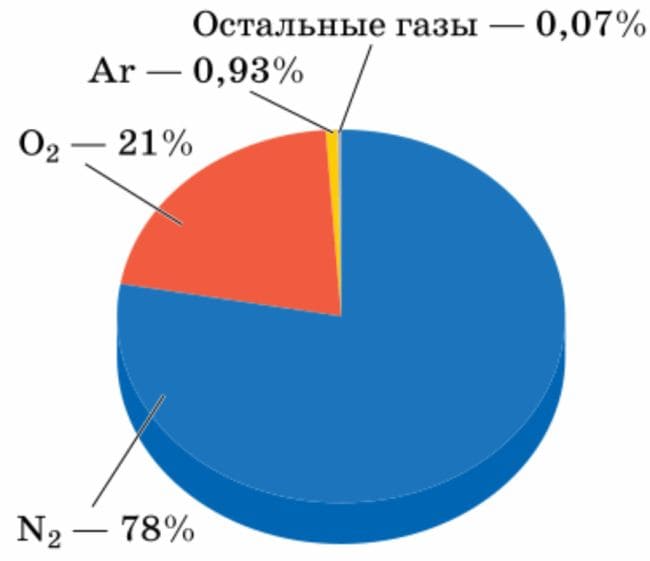
Рис.81. Состав сухого воздуха 3
-
Номер №3
Сколько миллилитров углекислого газа содержится в одном кубометре воздуха?
Ответ
Дано:
V(возд.) = $1м^3$ = $10^6$ мл
w ($CO_{2}$) = 0,04%
Найти:
V($CO_{2}$) − ?Ответ:
V($CO_{2}$) = $\frac{w(CO_{2})*V(возд.)}{100}$ = $\frac{0,04 * 106 мл}{100}$ = 400 мл
Ответ: V ($CO_{2}$) = 400 мл 4
-
Номер №4
Составьте уравнение окисления глюкозы в организме.
Ответ
Окисление глюкозы − это взаимодействие глюкозы и кислорода. В ходе реакции выделяется углекислый газ и вода.
$C_{6}H_{12}O_{6}$ + 6$O_{2}$ = 6$CO_{2}$ + 6$H_{2}O$ 5
-
Номер №5
Взаимодействуя с аммиаком, кислород превращает его в азот и воду. Составьте уравнение этой реакции.
Ответ
Формула аммиака: $NH_{3}$.
4$NH_{3}$+3$O_{2}$ = 2$N_{2}$+6$H_{2}O$ 6
-
Номер №6
Различия в каком свойстве позволяют разделить воздух на азот и кислород?
Ответ
Разделение основано на различии температур кипения сжиженного азота (–196°С) и кислорода (–183°С). Если сжижать воздух, а затем дать ему испариться, то в газообразную фазу будет переходить более низкокипящий компонент (азот), и пары обогатятся им, а жидкость – кислородом.
7
-
Номер №7
В каких областях промышленности применяют кислород?
Ответ
Кислород применяют в ракетостроении (в качестве топлива), в медицине, в металлургии, при сварке.
8
-
Номер №8
При разложении перекиси водорода $H_{2}O_{2}$ образуются кислород $O_{2}$ и вода $H_{2}O$. Составьте уравнение этой реакции.
Ответ
2$H_{2}O_{2}$ = $O_{2}$+2$H_{2}O$
9
-
Номер №9
Какие газы являются наиболее токсичными для организма? Откуда они берутся в атмосфере?
Ответ
Для организма наиболее токсичными газами являются сероводород ($H_{2}S$), сернистый газ $SO_{2}$ и хлор ($Cl_{2}$), которые попадают в воздух в результате деятельности химических, нефтехимических и металлургических производств. Очень ядовитым газом также является озон ($O_{3}$), который может образовываться из кислорода в загрязнённой атмосфере мегаполисов в яркий солнечный день.
страница 114
-
(стр.114). Номер №1
В XVIII в. были открыты и изучены многие газообразные вещества. Их часто называли «воздухом», добавляя прилагательное, характеризующее новый газ. Используя информационные ресурсы, объясните, что такое «горючий воздух», «огненный воздух», «связанный воздух», «морской кислотный воздух», «щелочной воздух».
Ответ
Горючий воздух − это первое название водорода ($H_{2}$).
Огненный воздух − это первое название кислорода ($O_{2}$).
Связанный воздух − это первое название углекислого газа ($CO_{2}$).
Морской кислотный воздух − это первое название хлористого водорода ($HCl$).
Щелочной воздух − это первое название аммиака ($NH_{3}$). §18. вопросы перед параграфом. Номер №1
-
§18. вопросы перед параграфом. Номер №1
Какими необычными свойствами обладает вода?
Ответ
Вода обладает целым рядом необычных свойств, которые объясняются её строением. Наличие водородных связей объясняет многие необычные свойства воды:
1. высокую теплоёмкость, благодаря которой вода используется в качестве теплоносителя;
2. большую теплоту испарения, которая помогает воде поддерживать тепловой баланс организма;
3. очень высокое поверхностное натяжение, уступающее только ртути;
4. аномально высокую температуру кипения, поэтому в земных условиях больше всего жидкой воды;
5. вода является отличным растворителем. 2
-
Номер №2
Где в организме больше всего воды?
Ответ
Больше всего воды в глазах (95%), крови (90%) и мозге (80%).
3
-
Номер №3
Какой воды больше всего на Земле?
Ответ
На Земле больше всего солёной воды (97,5%).
(стр.118). Номер №1
-
(стр.118). Номер №1
Предложите способ уменьшения бытового расхода воды без особого ущерба для комфорта.
Ответ
Способы уменьшения бытового расхода воды без особого ущерба для комфорта:
1. Принятие душа вместо традиционной ванны позволяет снизить потребление воды в 2−3 раза.
2. Если заткнуть слив мойки пробкой, набрать определенное количество воды, залить моющее средство и мыть посуду, как в тазу, то потребление воды уменьшется во много раз.
3. Мытье овощей и фруктов в миске, таким образом можно очистить их более эффективно и экономно.
4. Не стоит запускать стиральную / посудомоечную машину, если она не полностью заполнена.
5. Уменьшение силы напора.
6. Обнаружение и ремонт протекающих труб. 121
-
(стр.121). Номер №1
Приведите примеры веществ: неограниченно смешивающихся с водой; хорошо растворимых в воде; очень плохо растворимых в воде; гидрофобных.
Ответ
Вещества, неограниченно смешивающиеся с водой: перекись водорода, этиловый спирт, серная кислота.
Вещества, хорошо растворимые в воде: аммиак ($NH_{3}$), хлороводород(HCl), многие соли (NaCl − хлорид натрия, $K_{2}CO_{3}$ − карбонат калия), органические вещества, содержащие кислород ($C_{6}H_{12}O_{6}$ − глюкоза, $C_{12}H_{22}O_{11}$ − сахароза).
Вещества, плохо растворимые в воде: кислород ($O_{2}$), азот ($N_{2}$), гидроксид кальция ($Ca(OH)_{2}$), эфиры ($CH_{3}OCH_{3}$ − диметиловый эфир).
Гидрофобные вещества: жиры, липиды, нуклеиновые кислоты.(стр.122). Номер №1
Используя пластилин и спички, соберите модель молекулы воды, представив атомы кислорода и водорода шариками разного цвета, а связи — спичками. Учтите, что атом кислорода больше атома водорода примерно в два раза.
Ответ
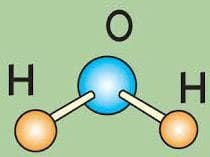
§18. проблемный вопрос. Номер №1
-
§18. проблемный вопрос. Номер №1
Почему вода играет уникальную роль в жизни человека?
Ответ
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов.
§18. вопросы и задания. Номер №1
-
§18. вопросы и задания. Номер №1
Какой воды на Земле больше всего — твёрдой, жидкой или газообразной?
Ответ
На Земле больше всего жидкой воды (96,5%).
2
-
Номер №2
Какое из агрегатных состояний воды: а) самое тяжёлое; б) самое лёгкое?
Ответ
а) Самое тяжёлое − жидкое состояние воды.
б) Самое лёгкое − газообразное состояние воды. 3
-
Номер №3
В чём разница между пресной и дистиллированной водой?
Ответ
Пресная вода, в отличие от дистиллированной, содержит растворённые в ней соли (менее 0,1%).
4
-
Номер №4
Как вы думаете, полезно ли пить дистиллированную воду?
Ответ
В больших количествах дистиллированная вода вредна для здоровья, так как организм человека приспособлен к потреблению воды с растворёнными в ней солями.
5
-
Номер №5
Какую геометрическую форму имеет молекула воды?
Ответ
Молекула воды имеет форму равнобедренного треугольника.
6
-
Номер №6
Сколько процентов водорода содержит вода: а) по массе; б) по числу атомов?
Ответ
а) по массе:
Дано:
m (H) = 1 а.е.м.
m (O) = 16 а.е.м.
Найти:
$w$ (H) = ?
Ответ:
m ($H_{2}O$) = 2 * m (H) + m (O) = 2 * 1 + 16 = 18 а.е.м.
$w$ (H) = $\frac{2*1}{18}$ = 0,111, или 11,1%
Ответ: $w$ (H) = 11,1%б) по числу атомов:
Дано:
Молекула воды $H_{2}O$ состоит из 2 атомов водорода и 1 атома кислорода, всего атомов − 3.
Найти:
Количество процентов водорода по числу атомов = ?
Ответ:
w (H) = $\frac{2}{3}$ * 100% = 66,7%
Ответ: Вода содержит 66,7% водорода по числу атомов. 7
-
Номер №7
В каком агрегатном состоянии между молекулами воды больше всего водородных связей?
Ответ
Водородных связей между молекулами воды больше всего в твёрдом агрегатном состоянии.
8
-
Номер №8
Чтобы перевести вещество из жидкого состояния в газообразное, нужно разорвать все связи между молекулами, а для этого — затратить энергию в виде теплоты. Используя этот факт, объясните, почему у воды очень высокая теплота испарения.
Ответ
Потому что на разрушение водородных связей между молекулами нужна дополнительная энергия (дополнительный нагрев). Из−за водородных связей вода имеет аномально высокую температуру кипения, поэтому в земных условиях больше всего жидкой воды.
9
-
Номер №9
Как вы думаете, почему жизнь появилась в жидкой воде, а не в твёрдой?
Ответ
Жизнь появилась в жидкой воде, а не в твёрдой, потому что она является хорошим растворителем различных веществ, а также вода является хорошей средой для переноса этих самых веществ.
страница 122
-
(стр.122). Номер №1
Самостоятельно сфотографируйте несколько снежинок. Чем они различаются и что у них общего?
Ответ
Сходства снежинок:
1. Они всегда имеют 6 лучей и образуют форму шестигранника.
2. Состоят из замороженной воды.
3. Имеют сердцевину.
4. Все остроконечны.
5. Имеют узор.
Различие снежинок − узор всегда у всех снежинок разный.
(стр.122). Номер №1
В названиях некоторых растворов имеется слово «вода». Используя информационные ресурсы, дайте определения понятий: «известковая вода», «бромная вода», «жавелевая вода», «аммиачная вода», «туалетная вода».
Ответ
Известковая вода − прозрачный бесцветный раствор гидроксида кальция ($Ca(OH)_{2}$).
Бромная вода − водный раствор брома ($Br_{2}$) жёлто−оранжевого цвета.
Жавелевая вода − водный раствор гипохлорита натрия ($NaClO$), имеет отбеливающие свойства.
Аммиачная вода − азотное удобрение, раствор аммиака в воде ($NH_{4}OH$).
Туалетная вода − парфюмерное средство в виде водно−спиртового раствора, в котором не менее 4 % (по массе) душистых веществ. §19. вопросы перед параграфом. Номер №1
-
§19. вопросы перед параграфом. Номер №1
Каковы свойства углекислого газа?
Ответ
Физические свойства:
Углекислый газ — бесцветный, он не имеет запаха, но обладает кисловатым вкусом. Углекислый газ примерно в 1,5 раза тяжелее воздуха. Углекислый газ умеренно растворим в воде — примерно 1:1 по объёму при температуре 25°С. Однако эту растворимость можно заметно увеличить при повышении давления.
Химические свойства:
С химической точки зрения углекислый газ — довольно инертное и безопасное вещество. Он является продуктом горения и сам горения не поддерживает. 2
-
Номер №2
Как в природе образуется $CO_{2}$ и во что он превращается?
Ответ
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
3
-
Номер №3
Опасен ли углекислый газ для человека?
Ответ
Углекислый газ сам по себе не ядовит, однако, так как он не поддерживает дыхания, находиться в атмосфере с повышенным его содержанием небезопасно (табл. 8). При длительном нахождении в помещении необходимо время от времени его проветривать. Однако все неприятные явления, вызванные избыточным содержанием $CO_{2}$, обратимы и исчезают на свежем воздухе.
Таблица 8. Допустимое время нахождения в атмосфере с повышенным содержанием углекислого газа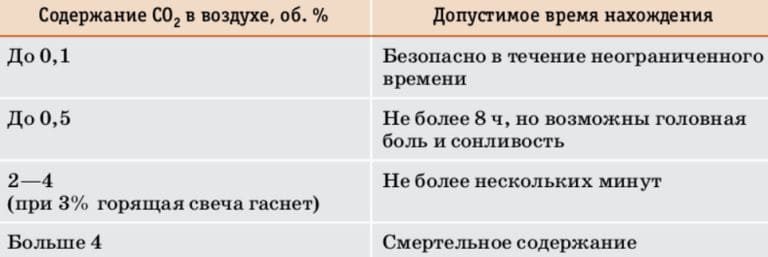
страница 123
-
(стр.123). Номер №1
Формула этилена − $C_{2}H_{4}$. Напишите уравнение горения этого газа в кислороде.
Ответ
При горении этилена в кислороде выделяется углекислый газ и вода:
$C_{2}H_{4}$ + 3$O_{2}$= 2$CO_{2}$ + 2$H_{2}O$ 124
-
(стр.124). Номер №1
Проведём опыт. Приобрести «сухой лёд» можно у продавцов мороженого или заказать с доставкой по интернету. Для опытов нужно небольшое количество вещества.
1. Поместите немного «сухого льда» внутрь воздушного шарика и завяжите шарик. Наблюдайте за изменением объёма. Можете измерить, при каком исходном количестве льда шарик лопнет.Ответ
Со временем объём шарика увеличится, так как будет выделятся углекислый газ, который будет наполнять шар. Если поместить в шарик слишком много «сухого льда», то он лопнет.
Номер №2
Проведём опыт. Приобрести «сухой лёд» можно у продавцов мороженого или заказать с доставкой по интернету. Для опытов нужно небольшое количество вещества.
2. Опустите кусок «сухого льда» в горячую воду, содержащую мыльный раствор. Опишите происходящие изменения.Ответ
Когда вы бросаете кусочек «сухого льда» в миску с мыльной водой, то выделяется газ. Тонкий слой мыльной пленки, натянутой по краю чаши, задерживает выделяющийся газ, создавая большой мыльный пузырь.
125
-
(стр.125). Номер №1
Раздел «Занимательные опыты». Со свойствами углекислого газа можно познакомиться в опыте 7 (с.180−181).
Ответ
Опыт 7. Изучаем газировку
Для опыта вам потребуется бутылка с газированной водой и с такой же водой, но без газа. Определите кислотность среды и сделайте вывод, как углекислый газ влияет на величину pH. Углекислый газ $CO_{2}$ − кислотный оксид, при взаимодействии с водой он образует слабую угольную кислоту. Налейте газированную воду в пробирку и прокипятите. Растворимость газов уменьшается при нагревании. При кипячении угольная кислота разложится, а углекислый газ улетит. Как изменится при этом pH раствора? Сделайте предположение и подкрепите его экспериментально.
Газированная вода имела кислотную среду, а вода без газа была с щелочной средой. После кипичения pH газированной воды увеличилось. 130
-
(стр.130). Номер №1
Раздел «Занимательные опыты». Со свойствами известковой воды вы можете познакомиться, проделав опыты 11−14 (с.181−182).
Ответ
Опыт 11. Известковая вода мутнеет
Налейте в пробирку 2 мл известковой воды (её мы приготовили в опыте 1), опустите в пробирку соломинку для коктейля или стеклянную трубку и ртом выдувайте воздух (не перепутайте − воздух надо выдувать, а не втягивать, как это происходит, когда вы пьёте коктейль). Как только известковая вода помутнеет, прекратите дуть. Образующаяся муть − это осадок карбоната кальция (мела). Дождитесь, когда осадок опустится на дно и отделится от раствора. Затем с помощью стеклянной палочки аккуратно отберите жидкость над осадком и перенесите её в другую пробирку. Определите pH этой жидкости, пользуясь универсальным индикатором. Какую реакцию среды имеет раствор? Данный раствор имеет нейтральную среду.
К осадку прилейте несколько капель соляной кислоты. Выделяющиеся пузыри − это углекислый газ.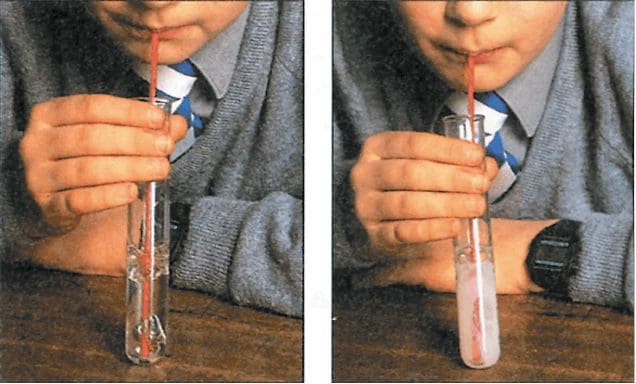
Опыт 12. Известковая вода сначала мутнеет, а потом становится прозрачной
Повторите начало предыдущего опыта. Налейте в пробирку 2 мл известковой воды (её мы приготовили в опыте 1), опустите в пробирку соломинку для коктейля или стеклянную трубку и ртом выдувайте воздух (не перепутайте − воздух надо выдувать, а не втягивать, как это про исходит, когда вы пьёте коктейль). Однако, когда известковая вода помутнеет, упорно продолжайте дуть. Через некоторое время муть растворится. Мел взаимодействует с избытком углекислого газа и водой с образованием другой соли − гидрокарбоната кальция. Полученный раствор гидрокарбоната кальция используйте для следующего опыта.
Опыт 13. Муть появляется снова и не исчезает
Поместите пробирку с раствором гидрокарбоната кальция в держатель и нагрейте её на пламени. Что наблюдаете?
При нагревании гидрокарбоната натрия выделяется водяной пар, углекислый газ и карбонат кальция.
$Ca(HCO_{3})_{2}$ = $CaCO_{3}$ + $H_{2}O$ + $CO_{2}$
Образующийся осадок − это мел (карбонат кальция).
Опыт 14. Опять выпадает мел
Повторите опыт 12, а к полученному прозрачному раствору добавьте известковую воду. Вы получите осадок мела уже при комнатной температуре. §19. проблемный вопрос. Номер №1
-
§19. проблемный вопрос. Номер №1
Является ли повышенное содержание углекислого газа в атмосфере угрозой для человечества; проблемой?
Ответ
Сам по себе углекислый газ не вреден для окружающей среды. Наоборот, он является одним из главных элементов процесса жизнедеятельности растений. Они поглощают $CO_{2}$, перерабатывают его и выделяют в атмосферу кислород. Но если диоксида углерода становится слишком много, он начинает играть роль тепловой изоляции для планеты. Излучение Солнца свободно проходит через атмосферу, но вот обратно, в космос, уходит тем меньше тепловой энергии, чем больше парниковых газов в газовой оболочке Земли. Поверхность планеты начинает нагреваться. Тают льды, изменяются климат и видовой состав флоры и фауны.
Природа будет развиваться, эволюционировать и дальше, изменение климата − проблема, прежде всего, для человечества, которое тысячи лет живет в относительно комфортных условиях. Если уровень Мирового океана значительно изменится, начнутся катастрофы, проблемы будут не у отдельно взятых людей, а у целых государств. §19. вопросы и задания. Номер №1
-
§19. вопросы и задания. Номер №1
Горение древесины можно упрощённо описать схемой: $C_{6}H_{10}O_{5}$ + $O_{2}$ → $CO_{2}$ + $H_{2}O$. Расставьте коэффициенты и запишите уравнение реакции.
Ответ
При горении древесины образуется углекислый газ и вода:
$C_{6}H_{10}O_{5}$ + 6$O_{2}$ = 6$CO_{2}$ + 5$H_{2}O$ 2
-
Номер №2
Составьте уравнение реакции сгорания глюкозы $C_{6}H_{12}O_{6}$ до углекислого газа и воды. Сравните с уравнением реакции сгорания древесины. Чем различаются эти уравнения и что в них общего?
Ответ
Сгорание глюкозы:
$C_{6}H_{12}O_{6}$ + 6$O_{2}$ = 6$CO_{2}$ + 6$H_{2}O$
Сгорание древесины:
$C_{6}H_{10}O_{5}$ + 6$O_{2}$ = 6$CO_{2}$ + 5$H_{2}O$
Уравнения различаются числом молекул воды: при сгорании 1 молекулы древесины образуется 5 молекул воды, а при сгорании 1 молекулы глюкозы − 6 молекул воды.
Общее в них то, что в результате реакции образуется углекислый газ и вода, причем в обоих случаях на 1 молекулу веществ расходуется 6 молекул кислорода и образуется 6 молекул углекислого газа. 3
-
Номер №3
Сколько весит молекула $CO_{2}$?
Ответ
Дано:
m (C) = 12 а.е.м.
m (O) = 16 а.е.м.
Найти:
m ($CO_{2}$) = ?Ответ:
m($CO_{2}$)= m (C) +2 * m(O) = 12 а.е.м. + 2 * 16 а.е.м. = 44 а.е.м.
Ответ: m ($CO_{2}$) = 44 а.е.м. 4
-
Номер №4
Как вы думаете, почему на экзамены и олимпиады не разрешают приносить газированную воду?
Ответ
При открытии бутылки с газированной водой выделяющийся углекислый газ увлекает за собой воду, которая может залить бланки.
5
-
Номер №5
Отличается ли по вкусу газированная питьевая вода от негазированной?
Ответ
Отличается, т.к. газированная питьевая вода на вкус немного кислая из−за того, что в ее растворе образуется неустойчивая угольная кислота:
$H_{2}O$ + $CO_{2}$ = $H_{2}CO_{3}$ 6
-
Номер №6
Сколько литров углекислого газа содержится в $1м^3$ воздуха?
Ответ
Дано:
V(возд.) = $1м^3$ =1000 л
w($CO_{2}$) = 0,04%
Найти:
V($CO_{2}$) − ?Ответ:
V($CO_{2}$) = $\frac{w(CO_{2})\;* \;V(возд.)}{100}$ = $\frac{0,04\;*\;1000}{100}$ = 0,4 л
Ответ: V($CO_{2}$) = 0,4 л. 7
-
Номер №7
Какие парниковые газы, кроме $CO_{2}$, вы знаете? Если не знаете, найдите информацию в сети Интернет.
Ответ
Парниковый газ − это газ, который поглощает и излучает лучистую энергию в тепловом инфракрасном диапазоне, вызывая парниковый эффект.
Основными парниковыми газами в атмосфере Земли являются водяной пар ($H_{2}O$), углекислый газ ($CO_{2}$), метан ($CH_{4}$), закись азота ($N_{2}O$) и озон ($O_{3}$). 8
-
Номер №8
Назовите основную область применения углекислого газа.
Ответ
Углекислый газ является продуктом горения и сам горения не поддерживает. Именно поэтому его широко используют при тушении пожаров. Будучи тяжелее воздуха, $CO_{2}$ оседает на горящей поверхности и перекрывает доступ кислорода к ней. Горючие жидкости и электрические приборы нужно тушить только пеной с углекислым газом!

9
-
Номер №9
Каково безопасное содержание $CO_{2}$ в воздухе?
Ответ
Безопасное содержание $CO_{2}$ в воздухе − до 0,1% по объёму.
Таблица 8. Допустимое время нахождения в атмосфере с повышенным содержанием углекислого газа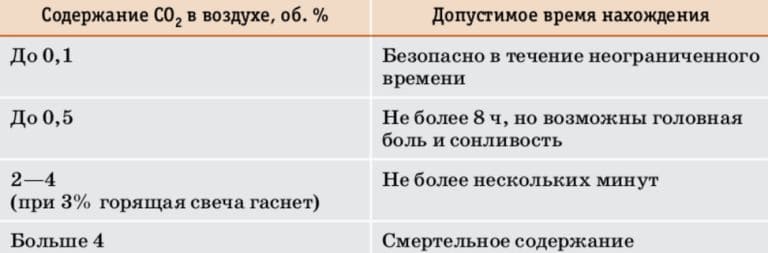
10
-
Номер №10
Назовите по два процесса, приводящих к выделению $CO_{2}$ в атмосферу и к его удалению из неё.
Ответ
Горение и дыхание ― процессы, приводящие к выделению $CO_{2}$ в атмосферу. Одна часть углекислого газа из атмосферы поглощается растениями и водорослями, превращаясь в процессе фотосинтеза в кислород, а другая часть ― растворяется в Мировом океане.
11
-
Номер №11
Какие из перечисленных ниже свойств соответствуют углекислому газу при обычных условиях?
1) легче воздуха
2) не поддерживает дыхания
3) не поддерживает горения
4) ядовит
5) нерастворим в водеОтвет
При обычных условиях углекислый газ:
2) не поддерживает дыхания
3) не поддерживает горения 12
-
Номер №12
Придумайте свои эксперименты с «сухим льдом».
Ответ
Эксперимент №1.
1. Поместите в банку обычную свечку и подожгите.
2. Насыпьте по краям небольшое количество «сухого льда» – через пару секунд газ заполнит банку, и свечка потухнет.
3. Попытайтесь поджечь свечу заново – это невозможно, так как углекислый газ не горит, а кислорода в банке больше нет.
Эксперимент №2
1. Положите в глубокую и широкую кастрюлю кусочек «сухого льда» и подождите, пока она наполнится газом.
2. Надуйте обычные мыльные пузыри и пускайте их в кастрюлю – пузырики будут красиво, словно живые, парить и танцевать над газом.
Эксперимент №3
1. Приготовьте небольшую пластиковую бутылку с крышкой.
2. Положите в нее немного «сухого льда» и слегка полейте его горячей водой.
3. Проткните бутылку недалеко от крышки и плотно вставьте пластмассовую трубочку.
4. Подготовьте в небольшой емкости густой мыльный раствор.
5. Смочите конец трубки мылом – надуется белый пузырик, который можно брать в руки, если надеть на них шерстяные варежки. §20. вопросы перед параграфом. Номер №1
-
§20. вопросы перед параграфом. Номер №1
Сколько соли нужно человеку?
Ответ
По рекомендациям Всемирной организации здравоохранения (ВОЗ) ежедневное употребление соли для взрослого человека не должно превышать 5 г.
2
-
Номер №2
Как добывают соль?
Ответ
Для добывания каменной соли в земле роют шахты, откуда её извлекают большими кусками.
Для добычи поваренной соли на берегу моря устраивается ряд неглубоких бассейнов, которые сообщаются друг с другом. В результате испарения воды из бассейнов морская соль начинает кристаллизоваться. Её выгребают и складывают в кучи для просушки. Такую соль называют садочной или бассейновой.
Соль, полученную из растворов выпариванием, называют выварочной.
В жаркое время года с поверхности соляных озёр испаряется настолько много воды, что соль сама собой начинает кристаллизоваться на дне водоёма. Её просто выгребают со дна и складывают на берегу для просушки. Такую соль называют самосадочной. страница 134
-
(стр.134). Номер №1
Проведём опыт. Приготовьте насыщенный раствор поваренной соли. Для этого поместите пять столовых ложек соли в пол−литровую банку и наполните её на 2/3 объёма дистиллированной водой. Содержимое банки интенсивно перемешайте, пока бо́льшая часть соли не растворится. Если при перемешивании растворилась вся соль, добавьте в раствор ещё порцию соли и вновь перемешайте. Дайте нерастворившейся соли осесть на дно. Слейте раствор с кристаллами соли в сухую банку. Итак, мы получили насыщенный раствор. Найдите в пачке соли крупный кристаллик и аккуратно поместите его на дно сосуда с насыщенным раствором. Теперь надо ждать. Оставьте сосуд на столе и каждый день наблюдайте за ростом кристалла. Время от времени переворачивайте его пинцетом, чтобы грани росли равномерно. Удаляйте другие кристаллы, если они появляются на дне и стенках сосуда. Опыт по выращиванию кристаллов можно видоизменить. Возьмите хлопчатобумажную нить, один конец которой привяжите к середине карандаша (обмотайте карандаш). Другой конец опустите в насыщенный раствор поваренной соли. Карандаш положите сверху на края сосуда. Через некоторое время конец нити, опущенный в раствор соли, покроется кристаллами (рис.101).
 Рис. 101. Выращивание кристаллов на нити
Рис. 101. Выращивание кристаллов на нити
Для выращивания кристаллов идеально подходит белая синельная проволока, покрытая со всех сторон (как маленький ёршик) мягким ворсом. Сделайте из такой проволоки снежинку и поместите её в насыщенный раствор соли. Со временем ворсинки синельной проволоки покроются блестящими кристаллами поваренной соли (рис. 102). Рис. 102. Выращивание кристаллов на синельной проволоке
Рис. 102. Выращивание кристаллов на синельной проволокеОтвет
Приготовьте насыщенный раствор поваренной соли. Для этого поместите пять столовых ложек соли в пол−литровую банку и наполните её на 2/3 объёма дистиллированной водой. Содержимое банки интенсивно перемешайте, пока бо́льшая часть соли не растворится. Если при перемешивании растворилась вся соль, добавьте в раствор ещё порцию соли и вновь перемешайте. Дайте нерастворившейся соли осесть на дно. Слейте раствор с кристаллами соли в сухую банку. Итак, мы получили насыщенный раствор. Найдите в пачке соли крупный кристаллик и аккуратно поместите его на дно сосуда с насыщенным раствором. Теперь надо ждать. Оставьте сосуд на столе и каждый день наблюдайте за ростом кристалла. Время от времени переворачивайте его пинцетом, чтобы грани росли равномерно. Удаляйте другие кристаллы, если они появляются на дне и стенках сосуда. Опыт по выращиванию кристаллов можно видоизменить. Возьмите хлопчатобумажную нить, один конец которой привяжите к середине карандаша (обмотайте карандаш). Другой конец опустите в насыщенный раствор поваренной соли. Карандаш положите сверху на края сосуда. Через некоторое время конец нити, опущенный в раствор соли, покроется кристаллами (рис.101). Для выращивания кристаллов идеально подходит белая синельная проволока, покрытая со всех сторон (как маленький ёршик) мягким ворсом. Сделайте из такой проволоки снежинку и поместите её в насыщенный раствор соли. Со временем ворсинки синельной проволоки покроются блестящими кристаллами поваренной соли (рис. 102).
§20. проблемный вопрос. Номер №1
-
§20. проблемный вопрос. Номер №1
Какую роль играет хлорид натрия в организме?
Ответ
Хлористый натрий является незаменимым веществом для правильного функционирования человеческого организма. Поваренная соль является основополагающим строительным элементом нашего организма так же, как и вода. Она участвует во многих биохимических процессах в организме. Соль не производится нашим организмом и поступает извне.
Недостаток соли в организме имеет пагубные последствия: прекращается обновление клеток и ограничивается их рост, что впоследствии может привести к гибели клеток. Соленый вкус активизирует слюновыделение, что особенно важно для переваривания пищи. Помимо слюны натрий и хлор присутствуют также в поджелудочном соке, желчи и участвуют в пищеварении на разных уровнях. Натрий способствует усвоению углеводов, а хлор, в форме соляной кислоты, ускоряет переваривание белков. Кроме, того хлористый натрий поддерживает энергетический обмен внутри клеток. Соль регулирует циркуляцию жидкостей в организме, ответственна за разжижение крови и лимфы, а также выведения углекислого газа. Большое значение имеет соль в регулировке кровяного давления, повышение которого часто ставят именно соли в вину. §20. вопросы и задания. Номер №1
-
§20. вопросы и задания. Номер №1
Опишите физические свойства поваренной соли.
Ответ
Поваренная соль − это белый тугоплавкий порошок, хорошо растворимый в воде. При комнатной температуре в 100 г воды растворяется 35,9 г поваренной соли. Растворимость этого вещества незначительно меняется с ростом температуры (см. рис. 67). Так, при 80°C в 100 г воды удастся растворить лишь немногим бо́льшую массу соли − 38,1 г.
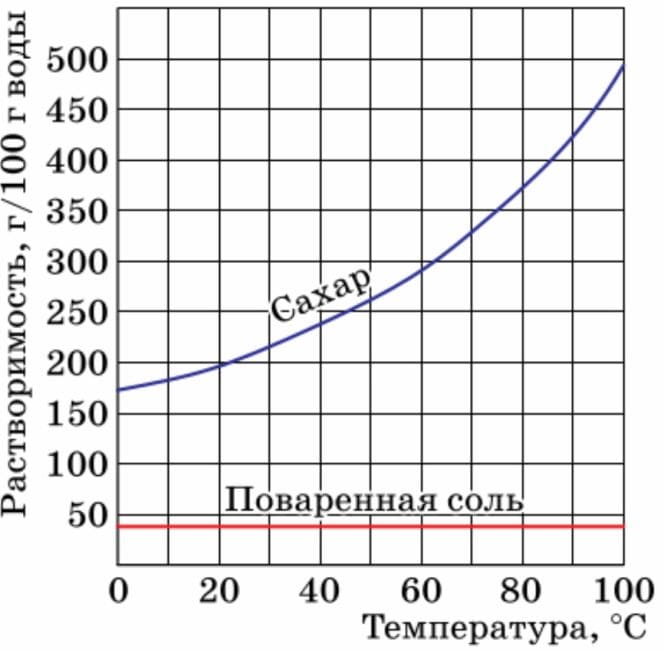
Рис. 67. Кривые растворимости сахара (сахарозы) и поваренной соли 2
-
Номер №2
Можно ли поставить букет в вазу из галита и налить в неё воду?
Ответ
Нельзя, потому что галит (каменная соль) растворим в воде.
3
-
Номер №3
Какую соль называют каменной, садочной, самосадочной, выварочной, йодированной?
Ответ
Каменной солью называют минерал галит, который образовался при высыхании древних морей и соляных озер.
Садочной солью называют соль, полученную в результате испарения морской воды из неглубоких бассейнов.
Самосадочной солью называют соль, добытую со дна соляных озёр, которая образуется в результате испарения воды в жаркое время года.
Выварочной солью называют соль, полученную из растворов выпариванием.
Йодированной солью называют соль, обогащённую соединениями йода. 4
-
Номер №4
На упаковке поваренной соли написано «Соль поваренная пищевая, экстра, выварочная, иодированная» (рис. 103). Что это означает?
 Рис. 103. Упаковка поваренной соли
Рис. 103. Упаковка поваренной солиОтвет
Слово "поваренная" указывает на состав соли (хлорид натрия), "пищевая" — пригодна для употребления в пищу, "экстра" — имеет высокую степень очистки от посторонних примесей, "выварочная" — получена способом выпаривания из соляных растворов, "йодированная" — обогащена соединениями йода.
5
-
Номер №5
Какую форму имеют кристаллы поваренной соли?
Ответ
Кристаллы поваренной соли имеют кубическую форму:

6
-
Номер №6
При засолке огурцов рекомендуют добавлять на 1 л воды одну столовую ложку поваренной соли (25 г). Определите массовую долю соли в огуречном рассоле.
Ответ
Дано:
V($H_{2}O$) = 1 л = 1000 мл
m(NaCl) = 25 г
p($H_{2}O$) = 1 $\frac{г}{мл}$
Найти:
w (NaCl) = ?Ответ:
1. Рассчитываем массу воды:
m($H_{2}O$) = V($H_{2}O$) * p($H_{2}O$) = 1000 мл * 1$\frac{г}{мл}$ = 1000 г
2. Рассчитываем массу раствора:
m(раствора) = m(NaCl) +m($H_{2}O$) = 25 г + 1000 г = 1025 г
3. Вычисляем массовую долю поваренной соли в растворе:
w (NaCl) = $\frac{m(NaCl)}{m(раствора)}$ = $\frac{25}{1025}$ = 0,0244, или 2,44%
Ответ: w(NaCl) = 2,44% §21. вопросы перед параграфом. Номер №1
-
§21. вопросы перед параграфом. Номер №1
Что такое углеводы?
Ответ
Углеводы — это природные органические соединения, состоящие из молекул углерода и воды, которые синтезируются в растениях под влиянием солнечной энергии.
2
-
Номер №2
Какова роль глюкозы в организме?
Ответ
Глюкоза − основной источник энергии почти у всех живых организмов − животных, растений, бактерий. В этом заключается её исключительная биологическая роль. В организме человека глюкоза является основным источником энергии для мозга.
3
-
Номер №3
Что называют брожением?
Ответ
Брожение − это разложение глюкозы на различные органические вещества более простого строения, например, молочную кислоту, этиловый спирт, уксусную кислоту под действием ферментов, содержащихся в микроорганизмах.
4
-
Номер №4
Что получают из глюкозы в пищевой промышленности?
Ответ
Брожение глюкозы используют для производства кисломолочных продуктов (кефира, простокваши, сметаны, творога и др.), вина, пива, уксуса. Выделяющийся при брожении газ придаёт пористость тесту при выпечке хлеба. Применяют реакцию брожения и в домашней кулинарии для приготовления квашеной капусты, солёных огурцов и грибов.
§21. проблемный вопрос. Номер №1
-
§21. проблемный вопрос. Номер №1
Какие вещества, кроме глюкозы, дают энергию организму?
Ответ
Жиры дают намного больше энергии, чем глюкоза. Однако окисление жиров — значительно более медленный процесс, который происходит только при недостаточном питании, когда организму приходится потреблять свои резервы.
§21. вопросы и задания. Номер №1
-
§21. вопросы и задания. Номер №1
Можно ли формулу глюкозы сократить в 6 раз и записать как $CH_{2}O$?
Ответ
Нельзя, потому что формула глюкозы тогда будет содержать совсем другой количественный состав атомов.
2
-
Номер №2
Сколько весит молекула глюкозы?
Ответ
Дано:
m(C) = 12 а.е.м.
m(H) = 1 а.е.м.
m(O) = 16 а.е.м.
Найти:
m($C_{6}H_{12}O_{6}$) = ?Ответ:
m($C_{6}H_{12}O_{6}$) = 6 * m(C) + 12 * m(H) + 6 * m(O) = 6 * 12 а.е.м. + 12 * 1 а.е.м. + 6 * 16 а.е.м. = 180 а. е. м.
Ответ: m($C_{6}H_{12}O_{6}$) = 180 а.е.м. 3
-
Номер №3
Средняя суточная потребность семиклассника в энергии составляет 12 МДж. На сколько минут ему хватит энергии, полученной при полном окислении 1 г глюкозы? Сколько глюкозы надо окислить, чтобы полученной энергии хватило на один урок?
Ответ
Дано:
$Q_{потреб.}$ = 12 $\frac{МДж}{сут.}$
$Q$($C_{6}H_{12}O_{6})$ = 16 $\frac{кДж}{г}$
$m_{1}$($C_{6}H_{12}O_{6}$) = 1 г
$t_{1}$ = 45 мин.
Найти:
$t_{2}$ = ?
$m_{2}$ = ?Ответ:
$Q_{потреб.}$ = 12 $\frac{МДж}{сут.}$ = $\frac{12000кДж}{1440 мин.}$ = 8,33 $\frac{кДж}{мин.}$
$t_{2}$ = $\frac{m_{1}(C_{6}H_{12}O_{6})\;* \;Q(C_{6}H_{12}O_{6})}{Q_{потреб.}}$=$\frac{1\;* \;16 }{8,33}$ = 1,92 мин
$m_{2}$ ($C_{6}H_{12}O_{6}$) = $\frac{t_{1}\;* \;Q_{потреб}}{Q(C_{6}H_{12}O_{6})}$ = $\frac{45\;*\;8,33}{16}$ = 23,4 г
Ответ: $t_{2}$ = 1,92 мин., $m_{1}$($C_{6}H_{12}O_{6}$) = 23,4 г. 4
-
Номер №4
На что можно потратить 16 кДж энергии? Предложите свой пример.
Ответ
Из курса физики мы знаем, что потенциальная энергия тела (в джоулях) в поле тяготения Земли вблизи поверхности вычисляется по формуле E = mgh, где m − масса тела (в килограммах), g − гравитационная постоянная (в $\frac{м}{с^2}$), а h − высота (в метрах).
Из этого следует, что 16 = x * 10 * y.
Значит, 16 кДж энергии мы можем потратить на поднятие предмета массой 1,6 кг на 1 метр или на поднятие предмета массой 0,4 кг на 4 метра.
Для удобства необходимо брать множители кратные 16.
E = mgh
Если энергия E = 16 кДж, а гравитационная постоянная равна 10 $\frac{м}{с^2}$, то произведение (умножение) массы тела и высоты должно быть в 10 раз меньше, чем энергия (16 кДж):
1,6 кг * 1м * 10 $\frac{м}{с^2}$ = 16 Кдж
0,4 кг * 4м * 10 $\frac{м}{с^2}$ = 16 Кдж 5
-
Номер №5
При производстве кисломолочных продуктов глюкозу превращают в молочную кислоту $C_{3}H_{6}O_{3}$. Других продуктов при этом не образуется. Составьте уравнение этой реакции.
Ответ
Реакция происходит под влиянием ферментов, которые являются катализаторами.
$C_{6}H_{12}O_{6}$ = 2$C_{3}H_{6}O_{3}$ 6
-
Номер №6
Плотность крови равна 1,05 г/мл. Каково нормальное содержание глюкозы в крови в процентах (по массе)?
Ответ
Дано:
p (крови) = 1,05 $\frac{г}{мл}$
Норма глюкозы в крови = 3,5 − 5,5 $\frac{ммоль}{л}$
Найти:
Нормальное содержание глюкозы в крови в процентах = ?
Ответ:
Пусть V(крови) = 1 л, тогда
m (крови) = p * V = 1,05 * 1000 = 1050 г
$n_{1}$($C_{6}H_{12}O_{6}$) = 3,5 * 1,000 = 3,500 ммоль
$n_{2}$ ($C_{6}H_{12}O_{6}$) = 5,5 * 1,000 = 5,500 ммоль
M ($C_{6}H_{12}O_{6}$) = 6 * 12 + 12 * 1 + 6 * 16 = 180 $\frac{г}{моль}$
$m_{1}$ ($C_{6}H_{12}O_{6}$) = n * M = 3,5 * 180 = 630 мг
$m_{2}$ ($C_{6}H_{12}O_{6}$) = n * M = 5,5 * 180 = 990 мг
$w_{1}$ = $\frac{m(вещества)}{m(раствора)}$ * 100% = $\frac{630}{1050}$ * 100% = 0,06%
$w_{2}$ = $\frac{m(вещества)}{m(раствора)}$ * 100% = $\frac{990}{1050}$ * 100% = 0,094%
Ответ: нормальное содержание глюкозы в крови в процентах от 0,06% до 0,094%. 7
-
Номер №7
Чем отличаются реакция брожения и реакция горения глюкозы?
Ответ
Реакция брожения глюкозы: $C_{6}H_{12}O_{6}$ = 2$C_{2}H_{5}OH$ + 2$CO_{2}$
Реакция горения глюкозы: $C_{6}H_{12}O_{6}$ + 6$O_{2}$ = 6$CO_{2}$ + 6$H_{2}O$
Реакция брожения глюкозы, в отличие от реакции горения глюкозы, протекает без присутствия кислорода и вместо воды образуется этиловый спирт. §22. вопросы перед параграфом. Номер №1
-
§22. вопросы перед параграфом. Номер №1
Чем отличаются минералы от горных пород?
Ответ
Минералы − это индивидуальные вещества, а горные породы являются природными смесями.
2
-
Номер №2
Могут ли разные минералы иметь одинаковую формулу?
Ответ
Не могут, так как каждый минерал имеет определённый состав, который выражают химической формулой.
3
-
Номер №3
Глина − это горная порода или минерал?
Ответ
Глина − это мелкозернистая осадочная порода, пылевидная в сухом состоянии, но становящаяся пластичной при увлажнении.

Рис. 109. Глина: а − белая; б − красная 4
-
Номер №4
К каким классам веществ обычно принадлежат минералы?
Ответ
Обычно минералы относят к оксидам и солям.
5
-
Номер №5
Вода − это минерал или нет?
Ответ
Вода является минералом в твёрдом агрегатном состоянии (в форме льда).
Лед это минерал, когда он образуется естественным путем, но он уже не будет считаться минералом, если для его получения были приложены человеческие усилия.
Снежинка, падающая из тучи будет считаться минералом, потому что она естественным путем образуется в атмосфере Земли. Однако, кубик льда, сделанный в холодильнике, не будет считаться минералом, так как он был произведен действиями людей. страница 141
-
(стр.141). Номер №1
Какие минералы и горные породы вы знаете из курса географии?
Ответ
Из курса географии мы знаем:
1. Минералы: поваренная соль, мел, доломит, галька, гипс и каменная соль.
2. Горные породы: гранит, габбро, олинивит, базальт, пикрит, пемза, нефть, известняк, уголь, щебень, песок, глина, гравий, галька, мрамор. 145
-
(стр.145). Номер №1
Проведём опыт.
Поместим в пустую склянку стеклянную воронку, отверстие в которой закроем ватным тампоном. Насыплем в воронку песок и нальём воду. Вода проходит сквозь песок. Значит, песок пропускает сквозь себя воду, которая просачивается между отдельными песчинками. Теперь размешаем в воде немного глины. Вода станет мутной. Мутную воду выльем в воронку с песком. Проходя сквозь песок, вода становится прозрачной − очищается. Вся муть оседает на песке. Насыпанный в стакан с водой чистый песок не делает воду мутной, так как тяжёлые песчинки сразу опускаются на дно. Обычно песок содержит в своём составе небольшое количество глины. Такой песок делает воду мутной.Ответ
Поместим в пустую склянку стеклянную воронку, отверстие в которой закроем ватным тампоном. Насыплем в воронку песок и нальём воду. Вода проходит сквозь песок. Значит, песок пропускает сквозь себя воду, которая просачивается между отдельными песчинками. Теперь размешаем в воде немного глины. Вода станет мутной. Мутную воду выльем в воронку с песком. Проходя сквозь песок, вода становится прозрачной − очищается. Вся муть оседает на песке. Насыпанный в стакан с водой чистый песок не делает воду мутной, так как тяжёлые песчинки сразу опускаются на дно. Обычно песок содержит в своём составе небольшое количество глины. Такой песок делает воду мутной.

§22. проблемный вопрос. Номер №1
-
§22. проблемный вопрос. Номер №1
Как образуются минералы в природе?
Ответ
Минералы – это природные тела естественного происхождения. Они образуются в результате разнообразных физико−химических процессов на поверхности или в недрах Земли. Все минералы находятся в данный момент или некогда находились в кристаллическом состоянии.
§22. вопросы и задания. Номер №1
-
§22. вопросы и задания. Номер №1
Назовите по одному примеру минералов − простых веществ: металлов и неметаллов.
Ответ
Металл: золото (Au), марганец (Mn).
Неметалл: сера (S), алмаз и графит (C − являются аллотропными формами углерода). 2
-
Номер №2
Какие вы знаете минералы, принадлежащие к классу оксидов?
Ответ
Минералы, принадлежащие к классу оксидов:
1. Гематит ($Fe_{2}O_{3}$).
2. Куприт ($Cu_{2}O$).
3. Корунд ($Al_{2}O_{3}$).
4. Кварц ($SiO_{2}$).
5. Пиролюзит ($MnO_{2}$).
6. Касситерит ($SnO_{2}$). 3
-
Номер №3
Перечислите важнейшие типы горных пород. Приведите примеры.
Ответ
Магматические (гранит, базальт), осадочные (известняк, мел, фосфориты, глины, каменный уголь, горючие сланцы), метаморфические (кварцит, гнейс, глинистые сланцы).
4
-
Номер №4
Предложите способ очистки песка от содержащейся в нём примеси глины.
Ответ
Способ отстаивания.
Смесь помещаем в воду и встряхиваем, а потом оставляем на время. Постепенно песок оседает на дно, а примеси глины равномерно распределяются в толще воды. С осевшего на дно осадка аккуратно, по стеклянной палочке сливаем жидкость. 5
-
Номер №5
Как экспериментально доказать, что при действии кислот на известняк образуется углекислый газ?
Ответ
Следует поместить известняк в пробирку и добавить немного кислоты (например: серная $H_{2}SO_{4}$, соляная кислота ($HCl$)) а выделяющийся газ пропустить через пробирку с известковой водой. Помутнение прозрачного известкового раствора свидетельствует о наличии углекислого газа.
6
-
Номер №6
В какую историческую эпоху выполнена скульптура, представленная на рисунке 114? Что она изображает?
 Рис. 114. Скульптура из мрамора
Рис. 114. Скульптура из мрамораОтвет
Данная скульптура была выполнена в Средние века в Греции. На скульптуре изображена древнегреческая богиня Артемида и олень.
§23. вопросы перед параграфом. Номер №1
-
§23. вопросы перед параграфом. Номер №1
Что образуется при сжигании горючих органических веществ?
Ответ
При сжигании горючих органических веществ образуется вода ($H_{2}O$) и углекислый газ ($CO_{2}$).
2
-
Номер №2
Какие вещества получают из природного газа, нефти, угля?
Ответ
Природный газ − не только топливо, но и важнейшее химическое сырьё, из которого получают водород, а также некоторые важные органические вещества.
Сырую нефть подвергают переработке. При первичной переработке с помощью перегонки нефть разделяют на фракции − смеси веществ, обладающих близкими температурами кипения. Так, в числе других получают бензиновую фракцию, содержащую углеводороды, которые кипят в интервале от 100 до 140°С. Более высококипящие фракции подвергают вторичной обработке − крекингу. Крекинг приводит к разрушению длинных молекул углеводородов и к образованию из них молекул, входящих в состав бензина. Твёрдый остаток от перегонки нефти − мазут − используют для производства асфальта.
Каменный уголь не только используют как топливо, но и перерабатывают с целью получения многих ценных веществ. Для этого его нагревают в печах без доступа воздуха. Такой процесс называют коксованием, так как в результате образуется большое количество твёрдого остатка − кокса. 3
-
Номер №3
Как образовались нефть и каменный уголь?
Ответ
Нефть образовалась в толще осадочных пород в результате разложения останков живых организмов без доступа воздуха.
Бурый и каменный уголь залегает в земной коре большими пластами между слоями глины, песка, известняка. Уголь образовался из древовидных папоротников, которые росли на Земле миллионы лет назад. Они произрастали на болотистой, покрытой водой почве и поэтому, погибнув, падали прямо в воду. Так на дне болот скапливалось большое количество деревьев. Сверху их заносило глиной и песком. Погребённые на дне болот и озёр деревья без доступа воздуха не могли гнить, но разлагались, превращаясь в уголь. Сверху на них давили слои земли. Уголь слёживался, становился плотнее. Чем дольше лежал уголь в земле, тем выше его качество. §23. проблемный вопрос. Номер №1
-
§23. проблемный вопрос. Номер №1
Почему при сжигании органических веществ всегда выделяется теплота? Что полезнее − сжигать горючие вещества или перерабатывать их?
Ответ
Горючее, имеющее в своем составе водород, при сгорании образует воду в газообразном состоянии, которая, охлаждаясь, будет конденсироваться. Так как в процессе конденсации паров тепло выделяется, то общее количество теплоты, полученное при сгорании вещества, будет больше на эту величину. При этом количество теплоты, выделяющееся при конденсации паров, равно количеству теплоты, затраченному на парообразование.
Полезнее будет перерабатывать горючие вещества, так как в этом случае не будет выделяться так много парниковых газов, которые вредят экологии Земли. §23. вопросы и задания. Номер №1
-
§23. вопросы и задания. Номер №1
Перечислите важнейшие горючие полезные ископаемые. Какое из них преимущественно используют без дополнительной переработки?
Ответ
Важнейшие горючие полезные ископаемые: природный газ, сланцевый газ, нефть, бурый уголь, каменный уголь, торф.
Без дополнительной переработки используют: природный газ. 2
-
Номер №2
Какие полезные вещества получают при переработке нефти? Где их применяют?
Ответ
Полезные вещества, которые получают при переработке нефти Где и как их используют
Бензин Топливо, растворитель
Дизельное топливо Топливо
Авиационное топливо Топливо, растворитель
Горючий нефтяной газ Топливо в химической промышленности
Мазут Топливо 3
-
Номер №3
Какое расстояние может проехать автомобиль, заправленный бензином, полученным из 1 барреля нефти, если средний расход топлива составляет 7 л бензина на 100 км пути?
Ответ
Дано:
V (бензина) = 7л
S = 100 км
1 баррель нефти = 85 л
Найти:
S (пройденное автомобилем) = ?Ответ:
При переработке из 1 барреля нефти получают 85 л бензина.
7 л − 100 км
85 л − x км
x = $\frac{85\; * \;100}{7}$ = 1214 км
Ответ: автомобиль может проехать 1214 км. 4
-
Номер №4
На поверхности воды разлилась нефть объёмом 1 л. Какую площадь займёт нефтяное пятно, если толщина нефтяной плёнки составляет 25 нм (1 нм = $10^{-9}$ м)?
Ответ
Дано:
V = 1 л
h = 25 нм
Найти: S = ?Ответ:
V = 1 л = 0,001 $м^3$
h = 25 нм = 25 * 10$^{-9}$ м = 25 * $0,1^9$
S = $\frac{V}{h}$ = $\frac{0,001м^3}{25\; * \;0,1^9}$ = 40000 $м^2$
Ответ: S = 40000 $м^2$ 5
-
Номер №5
Что называют антрацитом; бурым углём? Для чего их применяют?
Ответ
Антрацит ― горная порода, которая содержит от 95% углерода, залегает на больших глубинах (около 6 км), имеет характерный блеск и повышенную твердость. Антрацит применяют в качестве топлива в энергетике и в быту, в чёрной и цветной металлургии, а также для производства адсорбентов.

Бурый уголь ― горная порода, которая содержит менее 75% углерода, залегает на наименьших глубинах, имеет характерную чёрно−бурую окраску, низкую плотность и рыхлую структуру, содержит летучие вещества, влагу, а также неорганические примеси. Бурый уголь используется как энергетическое и коммунально−бытовое топливо.
§24. вопросы перед параграфом. Номер №1
-
§24. вопросы перед параграфом. Номер №1
Чем металлы отличаются от неметаллов?
Ответ
Все металлы наделены металлическим блеском, они превосходные проводники электрического тока и тепла. Большинство из них пластичны, при физическом воздействии металлы легко меняют форму. Неметаллы, наоборот, плохие проводники тепла и электрического тока.
2
-
Номер №2
Что такое сплавы?
Ответ
Сплавы − это вещества, состоящие из двух и более металлов, которые получаются с помощью плавления простых элементов.
3
-
Номер №3
Как получают металлы из руд?
Ответ
Пирометаллургия − это восстановление металлов из их руд при высоких температурах с помощью восстановителей. В процессах пирометаллургии используются различные восстановители:
• неметаллические − кокс, оксид углерода (II), водород;
• металлические − алюминий, магний, кальций и другие металлы.
Если в качестве восстановителя применяют алюминий, то процесс восстановления называют алюминотермией. страница 157
-
(стр.157). Номер №1
Сравните цвет латуни и бронзы с цветом металлов, которые входят в их состав.
Ответ

Рис. 125. Латунь (а) и бронза (б)
Латунь − это медно−цинковый сплав.
Латунь, в отличие от розово−красной меди, имеет золотистый или желтоватый цвет.
Бронза, как правило, состоит из меди и олова.
Бронза по сравнению с медью кажется тёмно−коричневой.
Медь
Цинк:
Олово:
§24. проблемный вопрос. Номер №1
-
§24. проблемный вопрос. Номер №1
Какие металлы сильнее всего изменили жизнь человека?
Ответ
Сильнее всего жизнь человека изменили:
1. Медь. Обрабатывая медь с 7 по 3 тысячелетие до н.э, человек заметил, что изготовить из нее наконечник для стрелы гораздо легче, чем из камня, да и тупятся медные наконечники медленнее, чем каменные. Более того, заточить затупившийся медный наконечник намного проще и быстрее. Её начали использовать для изготовления орудий труда, производства монет, украшений и т.д.
Однако, в древности медь не вытеснила полностью каменные орудия труда. Только когда человек научился плавить медь и впоследствии открыл для себя бронзу, − металл полностью заменил камень.
2. Олово. На основе олова и меди получали бронзу (один из наидревнейших сплавов, полученных человеком). Все, необходимое для быта человека, в древности изготавливалось из этого сплава. Археологи обнаружили оружие (кинжалы, топоры, наконечники стрел, мечи), мебель и предметы интерьера (зеркала), а также посуду (кувшины, вазы, тарелки). Кроме того, из бронзы изготавливали монеты и всевозможные украшения. Около V−IV веков до нашей эры античные скульпторы Греции научились отливать крупные бронзовые статуи, кстати, эта технология актуальна и сегодня. В Средние века бронза использовалась для производства пушек и артиллерийских снарядов.
3. Алюминий. На рубеже XIX и XX веков алюминий стал применяться в самых разных сферах и дал толчок для развития целых отраслей.
В 1891 году по заказу Альфреда Нобеля в Швейцарии создается первый пассажирский катер Le Migron с алюминиевым корпусом. А через три года шотландская судостроительная верфь Yarrow & Co представила изготовленную из алюминия 58−метровую торпедную лодку. Этот катер назывался «Сокол», был сделан для военно−морского флота Российской империи и развивал рекордную для того времени скорость в 32 узла.
В 1894 году американская железнодорожная компания New York, New Haven, and Hartford Railroad, принадлежавшая тогда банкиру Джону Пирпонту Моргану (J.P. Morgan), начала выпускать специальные легкие пассажирские вагоны, сидения которых были выполнены из алюминия. А всего через 5 лет на выставке в Берлине Карл Бенц представил первый спортивный автомобиль с алюминиевым корпусом.
Но настоящую революцию алюминий совершил в авиации, за что навсегда заслужил свое второе имя – «крылатый металл». В этот период изобретатели и авиаторы во всем мире работали над созданием управляемых летательных аппаратов – самолетов.
4. Железо. Благодаря железу на смену первобытно−общинному племенному строю пришло зарождение классового общества и формирование государств, налаживание новых торговых связей. Именно в раннем железном веке формируется самый известный торговый маршрут − Великий шелковый путь.
Несмотря на то, что технология получения железа более сложная и трудоемкая, чем в случае с бронзой, железный век уверенно сменил предшествующий ему бронзовый. Все потому, что железо было более широко распространено в природе. За период бронзового века многие металлические предметы стали перерабатывать в оружие. Именно нехватка олова для отливки бронзы заставила древних металлургов искать альтернативу.
Задолго до промышленной революции большинство людей в раннем железном веке разводили домашний скот и занимались сельским хозяйством. Центром жизни была деревня, где общины обрабатывали землю и вручную изготовляли предметы первой необходимости.
Производство железных инструментов помогло сделать ведение сельского хозяйства более простым и эффективным. Крестьяне смогли обрабатывать более твердые почвы, что позволило выводить новые сорта и высаживать новые культуры. Это же касалось и животноводства. Благодаря более эффективному способу ведения хозяйства освобождалось и время.
Больше времени означало, что теперь люди могли заниматься не только хозяйством, но и продать или обменивать то, что вырастили. Некоторые семьи начали создавать свои пекарни, мастерские по пошиву одежды и кузни. Развитие кузнечного дела в свою очередь стимулировало развитие таких ремесел как обработка кожи, дерева и кости. В этот период процветает торговля. §24. вопросы и задания. Номер №1
-
§24. вопросы и задания. Номер №1
Какими общими свойствами обладают металлы?
Ответ
Общие свойства металлов:
• металлический блеск,
• ковкость,
• пластичность,
• хорошо проводят теплоту,
• хорошо проводят электричество. 2
-
Номер №2
Найдите металлы, перечисленные в параграфе, в периодической таблице.
Ответ
$Fe$ (железо), $Cu$ (медь), $Al$ (алюминий), $Zn$ (цинк), $Sn$ (олово), $Pb$ (свинец), $Ag$ (серебро), $Au$ (золото), $Pt$ (платина), $Hg$ (ртуть).
3
-
Номер №3
Какие сплавы вы знаете?
Ответ
Сплавы:
Бронза − сплав меди с оловом.
Латунь − сплав меди с цинком.
Силумин − сплав алюминия с кремнием.
Дуралюмин − сплав алюминия с магнием, марганцем и кремнием.
Чугун − сплав железа с углеродом.
Сталь − сплав железа с углеродом. 4
-
Номер №4
Как металл добывают из руды? Расскажите на примерах из параграфа.
Ответ
1. Цинк добывают из цинковой обманки $ZnS$.
При нагревании на воздухе цинковая обманка превращается в оксид цинка (ZnO):
2$ZnS$ + 3$O_{2}$ = 2$ZnO$ + 2$SO_{2}$ ,
который смешивают с коксом и нагревают (образуется цинк и выделяется углекислый газ):
2$ZnO$ + $C$ = 2$Zn$ + $CO_{2}$
2. Железо добывают из руды (оксида железа).
Сперва руду смешивают с коксом и нагревают для получения чугуна (сплава железа с углеродом):
2$Fe_{2}O_{3}$ + 3$C$ = 4$Fe$ + 3$CO_{2}$,
а потом для получения железа уменьшают содержание в сплаве углерода, продувая через расплавленный чугун воздух, обогащённый кислородом (при этом «лишний» углерод выгорает). 5
-
Номер №5
Приведите пример из жизни, иллюстрирующий пластичность металлов.
Ответ
Алюминиевой фольгой заворачивают предмет любой формы и она не рвётся.
Медная проволока в шнуре питания для пылесоса многократно меняет форму, и не образуются разрывы проволоки. 6
-
Номер №6
Составьте рассказ о жизни и деятельности учёного, изображённого на рисунке 126.
 Рис. 126. Бронзовая статуя, покрытая патиной
Рис. 126. Бронзовая статуя, покрытая патинойОтвет
На фотографии статуя Михаила Васильевича Ломоносова (1711–1765 гг.) – великого русского ученого, химика, физика, художника, историка, поэта и писателя, труды которого стали известны во всем мире. Прославился в таких областях знаний, как: астрономия, геология, приборостроение, география и многие другие.
Ранние годы
Родился Михаил Ломоносов 8 (19) ноября 1711 года в деревне Мишанинская (Архангельская губерния, сейчас − село Ломоносово) в зажиточной семье. С ранних лет он любил выходить с отцом в море. Эти плавания оказали влияние на формирование представлений юного Ломоносова о красоте природы, закалили его характер.
Грамоте и чтению Ломоносову удалось обучиться еще в детстве. В возрасте 14 лет Михаил уже умел грамотно писать. Узнав, что отец хочет его женить, в 19 лет решает бежать в Москву.
Учеба и трудовая деятельность
Движимый стремлением к знаниям, он пешком приходит в Москву (1731 г.), где поступает в Славяно−греко−латинскую академию. Там жизнь Ломоносова очень трудна и бедна. Однако благодаря упорству ему удается за 5 лет пройти весь 12−летний курс обучения.
В числе лучших студентов в 1736 году отправляется учиться в Германию, где изучает технические и естественные науки, а также иностранные языки и литературу. Начал собирать свою библиотеку, в которую вошли как античные авторы, так и современники.
Для тех времен биография Михаила Ломоносова была весьма насыщенной. Он изучает множество наук, ставит опыты, выступает с лекциями. Даже при такой занятости у Ломоносова остается время на сочинение стихотворений.
В 1741 году Михаил Васильевич возвращается на родину.
В 1742 году Ломоносов был назначен адъюнктом физики в Петербургской академии наук, а через 3 года стал профессором химии.
Смерть и наследие
Вклад Ломоносова в такие науки, как физика, химия, география, астрономия, минералогия, почвоведение, геология, картография, геодезия, метеорология очень велики. Литературное творчество Ломоносова содержит произведения на разных языках. Это «История Российская», трагедии «Тамара и Селим», «Демофонт» и многие стихотворения Ломоносова.
В 1754 году он разработал проект Московского университета, названный позже в его честь университетом Ломоносова. Кроме того, краткая биография Ломоносова знаменательна открытием закона сохранения материи, написанием работ по теории цвета, построением множества оптических приборов.
Большой вклад Ломоносов внес также в историю. Ученый создал «Краткий российский летописец с родословием», где описал главные события истории России с 862 по 1725 год. Это издание облегчило работу с историческими документами и стало очень популярно среди читателей.
Смерть настигла Михаила Ломоносова в возрасте 54 лет. Умер великий ученый от воспаления легких 4 (15) апреля 1765 года и был похоронен на Лазаревском кладбище в Санкт−Петербурге. §25. вопросы перед параграфом. Номер №1
-
§25. вопросы перед параграфом. Номер №1
Из чего состоит стекло?
Ответ
Кварцевое стекло состоит из чистого оксида кремния ($SiO_{2}$).
Силикатное стекло состоит из оксидов металлов и оксида кремния (например: $Na_{2}O$ * $CaO$ * 6$SiO_{2}$ − формула оконного стекла. Знак умножения в химической формуле означает, как ни странно, просто сумму.). 2
-
Номер №2
Из чего получают стекло?
Ответ
Стекло получают при взаимодействии оксида кремния, соды и известняка. В ходе реакции также выделяется углекислый газ.
6$SiO_{2}$ + $Na_{2}CO_{3}$ + $CaCO_{3}$ = $Na_{2}O$ * $CaO$ * 6$SiO_{2}$ + 2$CO_{2}$ 3
-
Номер №3
Почему одни стёкла не имеют цвета, а другие окрашены?
Ответ
Цветные стёкла получают, вводя в шихту или в стекломассу специальные красящие добавки. В их роли выступают соли или оксиды различных металлов. Сильнее всего окрашивает стекло оксид кобальта CoO, который придаёт ему яркий синий цвет. Если красителя добавить много, то стекло будет казаться чёрным. Используя различные красители и комбинируя их, готовя шихту разных составов, удаётся получить стекло самых разнообразных оттенков.

Рис. 133. Окраска стёкол ионами металлов 4
-
Номер №4
Где применяют стёкла?
Ответ
В настоящее время стёкла находят широкое применение в строительстве, архитектуре, быту. Линзы очков, фотоаппаратов и телескопов изготавливают из особого оптического стекла. Посуда из стекла, дешёвая и гигиеничная, прочно вошла в наш быт. Лабораторная посуда, в которой мы проводим опыты, тоже по большей части стеклянная.
§25. проблемный вопрос. Номер №1
-
§25. проблемный вопрос. Номер №1
Какие свойства делают стекло удобным материалом для создания произведений искусства?
Ответ
Важнейшие свойства стекла, обусловливающие его применение, — высокая прозрачность для лучей света, значительная механическая прочность, стойкость к воздействию химических реагентов наряду с низкой теплопроводностью и большая цветовая палитра.
§25. вопросы и задания. Номер №1
-
§25. вопросы и задания. Номер №1
Что называют стеклом?
Ответ
Стёкла − это аморфные тела, образующиеся при охлаждении высоковязких расплавов.
2
-
Номер №2
Расскажите о производстве стекла.
Ответ
Сырьём для производства стекла является шихта, состоящая из кварца ($SiO_{2}$), соды ($Na_{2}CO_{3}$) и известняка ($CaCO_{3}$). Её тщательно измельчают, перемешивают и подают в печь. Процесс производства стекла принято называть варкой, т.к. образуется расплав, из которого выделяется множество пузырьков газа − это углекислый газ, который образуется при разложении карбонатов:
6$SiO_{2}$ + $Na_{2}CO_{3}$ + $CaCO_{3}$ $\overset{t}{=}$ $Na_{2}O$ * $CaO$ * 6$SiO_{2}$ + 2$CO_{2}$ 3
-
Номер №3
Назовите изделия из стекла, с которыми вы встречаетесь в быту.
Ответ
Окна, витрины, стеклянные стаканы, стеклянный графин, стеклянные бусы, банки, бутылки.
4
-
Номер №4
Приведите примеры, доказывающие, что при нагревании стекло обладает пластичностью.
Ответ
Если нагреть стеклянную палочку на кончике пламени спиртовки, а потом согнуть её, то при остывании палочка сохранит согнутую форму. Стеклодувы надувают комочек расплавленного стекла как резиновый шарик.
5
-
Номер №5
Какие ионы придают стеклу окраску?
Ответ
Ионы меди ($Cu^{2+}$) придают стеклу синюю окраску.
Ионы хрома ($Cr^{3+}$) − зелёную.
Ионы марганца ($Mn^{3+}$) − фиолетовую.
Ионы кобальта ($Co^{2+}$) − ярко−синюю.
Ионы железа ($Fe^{3+}$ и серы $S^{2-}$) − янтарную.
Ионы железа ($Fe^{2+}$ и $Fe^{3+}$) − зелёную.
Ионы эрбия ($Er^{3+}$) − розовую.
Ионы неодима ($Nd^{3+}$) − лиловую.
Рис. 133. Окраска стёкол ионами металлов 6
-
Номер №6
Как отличить цветное стекло от кристалла?
Ответ
При ударе кристаллические тела раскалываются, образуя плоские сколы, соответствующие плоскостям спайности. Стёкла раскалываются с образованием изогнутых поверхностей, напоминающих раковины.
§26. вопросы перед параграфом. Номер №1
-
§26. вопросы перед параграфом. Номер №1
Что такое керамика?
Ответ
Керамика − это изделия из глины (или глинистых веществ) с минеральными добавками или без них, полученные путем формования и последующего обжига.
2
-
Номер №2
Керамика − минерал или искусственный материал?
Ответ
Керамика является первым искусственным материалом, полученным человеком.
3
-
Номер №3
Как получают керамику из природных веществ?
Ответ
В быту и в технике наиболее широкое распространение получила керамика белого или серого цвета, которая обжигается при высокой температуре. Для её изготовления используют белую глину и кварцевый песок. В качестве специальной добавки (плавня) используют полевой шпат. Все эти компоненты не окрашены, поэтому и керамика получается белая. В отличие от стекла, керамика состоит из отдельных зёрен, разделённых порами. В порах находятся газы. Чем выше температура обжига керамики, тем ниже её пористость. Добавка плавней также уменьшает количество пор, так как образующееся из плавней стекло заполняет всё пространство между зёрнами.
4
-
Номер №4
Что делают из керамических материалов?
Ответ
В зависимости от назначения различают керамические изделия промышленно−строительные, технические, хозяйственно−бытовые и художественно−декоративные.
К промышленно−строительной и технической керамике относят кирпич, черепицу, печные изразцы, облицовочные и половые плитки и др.
В состав хозяйственно−бытовой и художественно−декоративной керамики включают гончарную посуду, а также посуду и художественно−декоративные изделия из фарфора, фаянса и майолики. страница 169
-
(стр.169). Номер №1
Рассмотрите посуду, имеющуюся у вас дома. Найдите, какие предметы выполнены из стекла, а какие из фарфора и фаянса. Помните, что молочное стекло по цвету может напоминать фарфор.
Ответ
Стекло: банки, графин, кружки, салатник.
Фарфор: чайный сервиз (чашки, блюдца), заварной чайник.
Фаянс: тарелки, кружки. §26. проблемный вопрос. Номер №1
-
§26. проблемный вопрос. Номер №1
Какие известные произведения искусства выполнены из фарфора?
Ответ
Из фарфора сделано очень много статуэток, ваз, тарелок (расписанных художниками), чайных сервизов.

Ваза для фруктов с лепными бутонами роз по тулову. XIX в.
Мейсенская фарфоровая мануфактура
Фарфор, рельеф, лепка, надглазурная роспись, позолота
Вазочка. 1800−1810
Франция, предместье Сен−Дени, фабрика Шольхер.
Фарфор, надглазурная роспись, позолота §26. вопросы и задания. Номер №1
-
§26. вопросы и задания. Номер №1
Что называют керамикой? Приведите примеры керамических изделий.
Ответ
Керамика − материалы, изготавливаемые из глин или их смесей.
Из керамики делают посуду, изоляторы для открытых проводов, статуэтки. 2
-
Номер №2
Сравните фарфор и фаянс по составу, технологии производства, свойствам изделий.
Ответ
Фарфор Фаянс
Состав Получают из каолина (белой глины), полевого шпата и кварца. Получают из каолина, полевого шпата и кварца, с меньшим составом плавней.
Технологии производства Используют минимум два обжига – сначала при более низкой температуре (меньше 1000°C), а затем при более высокой – между которыми изделие покрывают глазурью. Для росписи используют специальные керамические краски, которые выдерживают сильное нагревание. Обжигают при более низкой температуре, что позволяет использовать для декорирования более легкоплавкие глазури.
Свойства изделий Звонкий твёрдый черепок, который в тонком слое просвечивает, бедное разнообразие цветов. Меньше пористый, более лёгкий, менее плотный и менее твёрдый, большое разнообразие цветов. 3
-
Номер №3
Что общего и в чём различие между стеклом и керамикой?
Ответ
Общее: стекло и керамика хрупкие материалы, содержат в своём составе кварц.
Различие: стекло прозрачное и монолитное, а керамика непрозрачная и пористая. §27. вопросы перед параграфом. Номер №1
-
§27. вопросы перед параграфом. Номер №1
Что такое полимеры?
Ответ
Полимер − это вещество, которое состоит из большого числа молекул. Эти молекулы связаны между собой в звенья. Молекулы полимеров очень длинные, причём, в отличие от молекул других веществ, они состоят из отдельных фрагментов, которые повторяются сотни тысяч раз.
2
-
Номер №2
Какими общими свойствами они обладают?
Ответ
Общие свойства полимеров: маленькая плотность, высокая прочность и эластичность, газо− и водонепроницаемость, низкая теплопроводность, высокая химическая стойкость, легкость механической обработки, способность склеиваться и свариваться, низкая теплостойкость, низкая твердость, высокое тепловое расширение, повышенная ползучесть, относительно быстрое старение, горючесть.
3
-
Номер №3
В чём недостатки полимерных материалов?
Ответ
Недостатки полимерных материалов:
1. Любой вид полимеров изменяет форму в большей или меньшей степени, при повышении температуры и нагрузки. Текучесть обусловлена малой жесткостью и пластичностью основы.
2. Небольшой диапазон рабочих температур пластика требует избирательного применения материалов.
3. Низкая теплопроводность полимеров в конструкциях зданий и сооружений плюс, а в промышленных деталях плохой отвод тепла ограничивает применение пластика.
4. Старение – свойство всех пластмасс. Они разрушаются от воздействия климатических и производственных факторов. Как следствие, возникает вопрос утилизации отходов. Состав теряет технологические свойства, но не разлагается, как натуральные материалы.
5. Полимеры в закрытом помещении, выделяют летучие компоненты. Наибольший вред приносят строительные материалы для внутренней отделки. Все полимеры опасны при пожаре. Даже не поддерживая горения, составы выделяют токсины, приводящие к отравлению дымом. страница 173
-
(стр.173). Номер №1
Изучите маркировку на изделиях из пластика, которыми вы пользуетесь в быту, и, пользуясь рисунком 140, сделайте вывод, из каких полимерных материалов они сделаны.
Ответ
Большинство изделий (бутылки, контейнеры, баночки для таблеток, упаковки от уходовой косметики и т.д.) сделаны из полиэтилентерефталата (01) и полиэтилена низкой плотности (04), так же встречаются полиэтилен выской плотности (02), полипропилен (05) и прочие виды пластика (07).

Рис.140. Маркировка пластиков §27. проблемный вопрос. Номер №1
-
§27. проблемный вопрос. Номер №1Металлы и полимеры − самые необходимые для человечества материалы. Сравните их между собой: какие у них есть преимущества и недостатки.
Ответ
Металлы Полимеры
Преимущества 1. Прочность и надежность. Из−за своих физических свойств он способен выдерживать большие нагрузки. Поэтому его применяют при создании различных конструкций, оборудования и машин. 2. Универсальность. С металлом можно совершать множество операций и придавать ему различную форму за очень короткое время при минимуме усилий. 3. Цена. Еще одно достоинство металла. Этот материал стоит гораздо меньше других, что позволяет закупать больший объем продукции. 4. Сочетание с другими материалами. Металл в этом плане уникален. Его можно совмещать почти с чем угодно и при этом получаются великолепные изделия высокого качества. 1. Неограниченная сырьевая база для их производства, постоянно пополняемая за счет синтеза новых полимеров с заранее заданными свойствами. 2. Невысокая полимероемкость, т.е. невысокий расход смол на единицу готовой продукции; простота переработки полимерных материалов в изделия любого (даже весьма сложного) профиля с образованием минимума отходов;способность полимеров образовывать тонкие прочные пленки; широкие технологические возможности получения материалов и изделий с заданными характеристиками, отвечающими функциональным, эксплуатационным, эстетическим и экономическим требованиям. 3. Ценный комплекс свойств: сочетание легкости и прочности, водо−, паро− и газонепроницаемость, химическая стойкость, электроизоляционные и диэлектрические свойства, эластичность, неподверженность коррозии и др.; способность принимать любую окраску и фактуру.
Недостатки 1. Склонность к коррозии. На большей части металлов может появиться ржавчина. Обычно она возникает со временем. При этом металл теряет свою прочность. Становится хрупким и ненадежным. 2. Дополнительные затраты. Они возникают в связи с тем, что металл требует покрытия специальными материалами. Это крайне необходимо. Ведь большая часть металлов склонна к коррозии и без дополнительной обработки их срок службы ограничен. 3. Вес. Металл является крайне тяжелым материалом. Поднять его довольно трудно. Иногда задействуется даже специальное оборудование, что может стать большим недостатком. 1. Любой вид полимеров изменяет форму в большей или меньшей степени при повышении температуры и нагрузки. 2. Текучесть обусловлена малой жесткостью и пластичностью основы. 3. Небольшой диапазон рабочих температур пластика требует избирательного применения материалов. 4. Низкая теплопроводность полимеров в конструкциях зданий и сооружений плюс, а в промышленных деталях плохой отвод тепла ограничивает применение пластика. 5. Старение – свойство всех пластмасс. Они разрушаются от воздействия климатических и производственных факторов. Как следствие, возникает вопрос утилизации отходов. Состав теряет технологические свойства, но не разлагается, как натуральные материалы. 6. Полимеры в закрытом помещении, выделяют летучие компоненты. Наибольший вред приносят строительные материалы для внутренней отделки. Все полимеры опасны при пожаре. Даже не поддерживая горения, составы выделяют токсины, приводящие к отравлению дымом. §27. вопросы и задания. Номер №1
-
§27. вопросы и задания. Номер №1
Какие вещества называют полимерами? Приведите примеры.
Ответ
Полимеры – длинные молекулы состоящие из повторяющихся фрагментов – мономеров.
Примеры: полиэтилен, полипропилен, тефлон. 2
-
Номер №2
Что такое эластомеры? Какое свойство материала называют эластичностью?
Ответ
Эластомеры – это материалы, которые обладают эластичностью – легко изменяют свою форму под внешним воздействием, а когда это воздействие прекращается, возвращаются к прежним размерам.
3
-
Номер №3
Приведите примеры природных волокон.
Ответ
К природным волокнам относятся: хлопок, пенька, лён, шерсть, натуральный шёлк.
4
-
Номер №4
Какие пластики вы знаете?
Ответ
Из пластиков делают мебель, упаковочные материалы, органические стёкла. Помимо уже упомянутого полиэтилена, в быту широко распространены изделия из полипропилена. Они более прочные, чем полиэтиленовые. Из полипропилена делают садовую мебель, упаковки для продуктов, коробки, ящики. Для остекления теплиц, крытых навесов в последние годы используют поликарбонаты. Посуду с антипригарным покрытием делают из политетрафторэтилена, который кратко называют тефлоном. Пластиковые бутылки изготавливают из полиэтилентерефталата.
5
-
Номер №5
Найдите в интернете информацию о свойствах полиэтилена, полипропилена, полиэтилентерефталата.
Ответ
Полиэтилен и полипропилен
Физические свойства. Полиэтилен значительно легче воды, его плотность примерно 0,92 г/$см^{3}$. Он эластичен, в тонком слое бесцветный, прозрачный, на ошупь несколько жирный, напоминающий парафин. Если кусочек полиэтилена нагреть, то уже при температуре 110°C он становится мягким и легко изменяет форму. При охлаждении полиэтилен затвердевает и сохраняет приданную ему форму. При очень сильном нагревании полиэтилен разлагается. Полипропилен (отдельные его виды) отличается от полиэтилена более высокой температурой плавления (плавится при температуре 160−180°С) и большей механической прочностью.
Химические свойства.
Полиэтилен и полипропилен обладают свойствами предельных углеводородов. При обычных условиях эти полимеры не реагируют ни с серной кислотой, ни со щелочами. Концентрированная азотная кислота разрушает полиэтилен, особенно при нагревании. Они не обесцвечивают бромную воду и раствор перманганата калия даже при нагревании.
Тефлон (политетрафторэтилен)
Прочное и химически очень стойкое вещество. Тефлон по химической устойчивости превосходит все металлы, даже золото и платину. Он выдерживает температуру до 260°C, не горит и является отличным диэлектриком. В быту очень популярна посуда с покрытием из тефлона – пища в такой посуде не пригорает. 6
-
Номер №6
Предыдущее
Объясните, с какой целью осуществляется раздельный сбор отходов из стекла, пластика, бумаги (см. рис. 141).
Рис. 141. Контейнер для раздельного сбора мусораОтвет
Раздельный сбор отходов осуществляется с целью сократить общее загрязнение окружающей среды, в том числе сократить площадь мусорных полигонов.


